Educação
|
|
| Solubilidade e reatividade de gases Reactivity and solubility of gases |
|
Luciana Almeida Silva; Luiz Souza Carvalho; Wilson Araújo Lopes; Pedro Afonso de Paula Pereira; Jailson B. de Andrade*
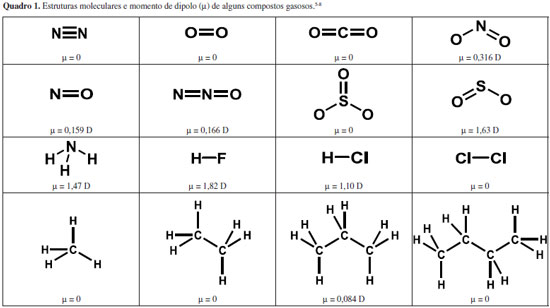
Instituto de Química, Universidade Federal da Bahia, 40170-115 Salvador - BA, Brasil Recebido em 17/10/2016 *e-mail: jailsondeandrade@gmail.com This paper deals with the solubility and reactivity of gases, especially in water, covering the main aspects that influence the dissolution process, namely polarizability of atoms or molecules in gas phase and their ability to react with the solvent. The discussion highlights the importance of solubility of gases in several biological processes, such as respiration and photosynthesis, hydrogen storage and industrial processes, as the production of carbonated beverages. The discussion also addresses the importance of gas solubility in atmospheric chemistry and aquatic environments. INTRODUÇAO Há cerca de dois bilhoes de anos alguns organismos passaram a realizar fotossíntese, o que desencadeou uma grande evoluçao dos seres vivos. A crescente concentraçao de gases oxidantes como oxigênio e ozônio na baixa troposfera obrigou os organismos a se refugiarem na água.1,2 Com o aumento progressivo da pressao parcial na atmosfera, o oxigênio foi lentamente sendo dissolvido na água e desta forma os organismos foram aos poucos se adaptando ao novo ambiente, até que nos últimos 500 milhoes de anos saíram da água para povoar a superfície da Terra envolta por uma tênue camada de gases. Os gases que compoem a atmosfera mantêm as condiçoes ideais na superfície do planeta para a criaçao e manutençao da vida como, por exemplo, o oxigênio, vital para os seres aeróbios, o dióxido de carbono, usado na fotossíntese e o nitrogênio, convertido pelas bactérias fixadoras de nitrogênio e utilizado pelas plantas, sendo essencial na construçao de biomoléculas; além de atuar como um escudo protetor contra radiaçao cósmica de alta energia.1,3 Muitos desses processos ocorrem em meio aquoso e sao dependentes da capacidade de dissoluçao desses gases em água. Os gases sao definidos como um conjunto de moléculas ou átomos, muito separados entre si, em movimento permanente e aleatório, com trajetórias pouco influenciadas por forças interatômicas ou intermoleculares. O comportamento de cada gás pode ser descrito por uma equaçao que estabelece a relaçao entre as quatro variáveis que definem seu estado, volume (V), quantidade de matéria (n), temperatura (T) e pressao (p), p = f(T, V, n).4 Nas condiçoes de temperatura e pressao ordinárias (25 oC e 1 atm), o estado gasoso predomina quando as forças interatômicas ou intermoleculares inexistem (gases perfeitos) ou sao de baixa intensidade, a exemplo das forças de dispersao de London, que sao interaçoes resultantes de formaçao de dipolos instantâneos, típicas entre moléculas apolares. No entanto, vale ressaltar que o estado gasoso nao é exclusivo de moléculas apolares (Quadro 1). Há diversos tipos de gases constituídos por moléculas polares, nas condiçoes ordinárias de temperatura e pressao, como sao os casos do dióxido de enxofre, dos haletos de hidrogênio e da amônia, cujas interaçoes do tipo dipolo-dipolo, ou até mesmo ligaçoes hidrogênio, nao sao suficientemente intensas para levá-los à forma condensada.
As interaçoes intermoleculares fracas também irao limitar a solubilidade de gases em fases de dispersao líquidas ou sólidas. Por outro lado, quando a fase de dispersao é um gás, a formaçao da mistura independe de interaçoes intermoleculares e os gases serao miscíveis em qualquer proporçao.
SOLUBILIDADE DE GASES Solubilidade em água Quando a fase de dispersao, ou solvente, é um líquido, a solubilidade do gás é governada pela lei de Henry, proposta em 1801 pelo químico inglês William Henry, a qual pode ser escrita como na equaçao 1  em que sG é a solubilidade do gás, kH a constante de Henry e pG a pressao parcial do gás. A constante de Henry, kH, depende da natureza do gás, do solvente e da temperatura. A Tabela 1 lista os valores de kH de alguns gases.
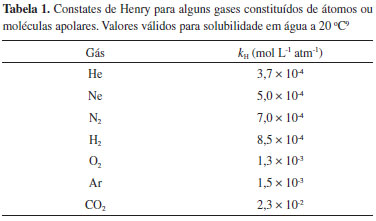
Os valores de kH mostrados na Tabela 1 sao referentes a soluçoes formadas por gases constituídos de átomos isolados, caso dos gases nobres, ou por moléculas apolares dispersos em um solvente polar, a água, a uma dada temperatura. Fixando-se dois parâmetros, como temperatura e tipo de solvente, é possível perceber que a magnitude do valor de kH é dependente da intensidade das forças que atuam entre átomos ou moléculas do gás e moléculas do líquido, sendo que predominam as interaçoes do tipo dipolo permanente-dipolo induzido. A intensidade destas interaçoes dependerá da polarizabilidade das moléculas ou átomos que compoem o gás. A polarizabilidade de uma espécie química é uma grandeza física que indica a facilidade com que a sua densidade eletrônica pode ser distorcida, formando uma distribuiçao assimétrica, os dipolos instantâneos ou induzidos.9-11 No caso dos gases nobres, por exemplo, a solubilidade em água é muito baixa, tornando-se maior à medida que aumenta a populaçao de elétrons no átomo, o que permite maior polarizabilidade (Tabela 2).
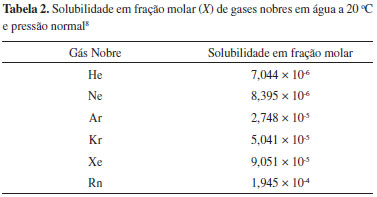
A baixa solubilidade do gás hélio em água é usada, por exemplo, para reduzir riscos em mergulhos profundos. Os cilindros de ar comprimido que usam nitrogênio para fazer o balanço de oxigênio nao sao adequados para este fim. A molécula de nitrogênio possui nuvem eletrônica compacta, pouco suscetível à polarizaçao, visto que grande parte dos elétrons de valência está comprometida com a ligaçao entre os dois átomos (Quadro 1). Como consequência, as interaçoes dipolo permanente-dipolo induzido sao de baixa intensidade e o gás nitrogênio terá baixa solubilidade em água (2,33 mL/100 g de água a 0 oC e 1,42 mL/100 g de água a 40 oC).8,13 A baixa solubilidade do nitrogênio em água implica também em baixa solubilidade no sangue. Entretanto, esta aumenta à medida que aumenta a pressao, como previsto pela lei de Henry. Em grandes profundidades, por conta da elevada pressao, o nitrogênio torna-se perigosamente mais solúvel no sangue, solubilidade esta que se reduz drasticamente ao subir para a superfície. Na descompressao, a degasagem provoca a formaçao de inúmeras bolhas no sangue, em um processo conhecido como embolia, que pode bloquear ou romper vasos capilares muito finos, impedindo que o oxigênio chegue aos tecidos, o que pode ser fatal! Quando o hélio é usado no balanço de oxigênio em cilindros para mergulho, o risco é reduzido visto que sua solubilidade no plasma é menor e o tamanho reduzido do átomo de hélio permite que atravesse a membrana celular sem causar danos. A mistura contendo hélio também evita o fenômeno conhecido como narcose por nitrogênio, que consiste no desenvolvimento de euforia, falsa sensaçao de segurança e aparente estado de embriaguez em mergulhos que atingem pressoes superiores a 4 atmosferas quando ar comprimido é usado. Apesar de quimicamente inerte, o nitrogênio submetido a elevadas pressoes torna-se lipossolúvel e interfere na transmissao de impulsos nervosos.14,15 Hidrocarbonetos alifáticos, os alcanos de C1 a C4 sao gases no estado padrao e também apresentam baixa solubilidade em água. As interaçoes nesse caso também serao do tipo dipolo permanente-dipolo induzido, visto que tratam-se de moléculas apolares ou com momento de dipolo muito baixo (Quadro 1). O metano é o menor dos hidrocarbonetos, apresentando nuvem eletrônica compacta, pouco suscetível à polarizaçao, resultando na menor solubilidade em água dentro desta série. O etano, com dois átomos de carbono é mais polarizável que o metano, o que facilita as interaçoes dipolo permanente-dipolo induzido com a água, tornando-o mais solúvel. Porém, à medida que aumenta a cadeia, o hidrocarboneto torna-se mais hidrofóbico, visto que o dipolo induzido pela água será menos intenso em funçao da menor polarizabilidade da molécula; como consequência, há uma reduçao de solubilidade do etano ao butano (Figura 1).
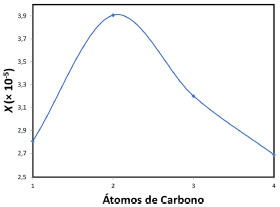 Figura 1. Solubilidade em fraçao molar (X) de alcanos alifáticos de cadeia curta (C1 a C4) em água a 20oC. Dados de solubilidade extraídos da ref. 8
Solubilidade e reaçoes químicas Moléculas Apolares CO2 é uma molécula linear apolar, com densidade eletrônica que permite polarizaçao (Quadro 1). Aliado a isso, dióxido de carbono atua como um ácido fraco de Lewis que reage com água para produzir diferentes espécies em soluçao (equaçoes 2-4). Essas características lhe garantem elevada solubilidade em água (90,1 mL/100 g de H2O a 20 oC).8 A espécie predominante em soluçao irá depender do pH do meio e das respectivas constantes de equilíbrio. 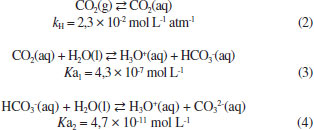 Assim como o CO2, muitos gases têm a solubilidade aumentada em água em funçao de intensas interaçoes intermoleculares que resultam em reaçoes químicas. Por exemplo, os halogênios que se encontram na forma de gás no estado padrao, casos do F2 e Cl2, sao constituídos de moléculas apolares, mas apresentam elevada solubilidade em água como consequência do elevado poder oxidante, especialmente do flúor (Eo = 2,87 V). Em soluçao aquosa, flúor é totalmente reduzido a fluoreto ao oxidar a água (equaçao 5), enquanto que o cloro sofre desproporcionamento, resultando em cloreto e hipoclorito (equaçao 6). A solubilidade do cloro é de 247 mL/100 g de água a 20 oC,13 porém, no equilíbrio estao presentes Cl2 hidratado e HClO, espécies denominadas de cloro ativo, além do cloreto. O cloro ativo é definido como a quantidade de cloro em soluçao capaz de liberar Cl2 quando em meio ácido.16 Para manter o elevado teor de cloro ativo em águas sanitárias, por exemplo, as soluçoes sao preparadas em meio básico, com valores de pH que podem variar entre 11,5 - 13,5. 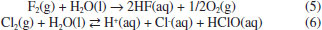 Moléculas Polares Os haletos de hidrogênio (HF, HCl, HBr e HI) sao polares e interagem via forças intermoleculares do tipo dipolo-dipolo mas, mesmo assim, encontram-se na forma gasosa no estado padrao, à temperatura ambiente, inclusive o HF, que interage via ligaçoes hidrogênio (p.e. 19,9 oC). Esses ácidos se dissociam quase que completamente em água, à exceçao do HF, formando misturas azeotrópicas em todos os casos. As interaçoes predominantes nas soluçoes aquosas serao do tipo íon-dipolo, em razao da dissociaçao dos ácidos. Apesar do HF se dissociar apenas parcialmente, consequência da alta energia de dissociaçao e da estrutura polimérica, a elevada solubilidade é garantida pelas fortes ligaçoes hidrogênio com a água. O HF é comercializado em soluçao aquosa com concentraçoes que variam de 47 - 51%. Os óxidos de enxofre, SO2 e SO3, em fase gasosa sao considerados importantes poluentes atmosféricos. O SO2 tem estrutura angular e, portanto, polar, com momento de dipolo igual a 1,63 D, enquanto que o SO3 gasoso ocorre com estrutura trigonal plana, com momento de dipolo nulo, ou seja, a molécula é apolar (Quadro 1). Apesar das diferenças estruturais, ambos interagem fortemente com a água, resultando em alta solubilidade acompanhada de reaçoes químicas. As duas moléculas atuarao como receptoras de elétrons, sendo, entao, ácidos de Lewis. Os átomos de oxigênio ligados ao enxofre deslocam densidade eletrônica, o que contribui para aumentar sua eletrodeficiência. Desta forma, o trióxido de enxofre, com maior número de átomos de oxigênio, é um ácido mais forte que o dióxido de enxofre e reage imediatamente com água para formar ácido sulfúrico (equaçao 7). 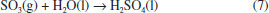 A polaridade e acidez moderada do dióxido de enxofre permitem boa solubilidade em água (22,8 g/100 g de água),8 visto que a dissoluçao é acompanhada de reaçoes químicas, cujas espécies predominantes em soluçao irao depender do pH do meio (equaçoes 8-10): 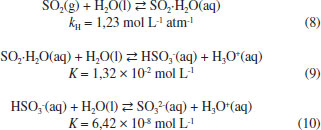 As transformaçoes de espécies oxigenadas de enxofre que ocorrem na troposfera envolvem os equilíbrios descritos pelas equaçoes 8-10. Uma vez formado ou emitido para a atmosfera, SO2 é oxidado, tanto na fase gasosa quanto na fase aquosa (chuva, neblina, nevoeiro), produzindo ácido sulfúrico (H2SO4) ou partículas neutralizadas sob forma de sulfato (Figura 2).
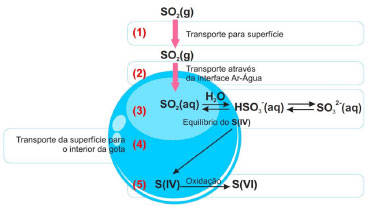 Figura 2. Conversao gás-partícula: esquema representativo da transferência de SO2(g) para a fase aquosa3
O transporte de gases através da interface ar/água em gotículas permite que reaçoes na atmosfera ocorram em meio aquoso, formando produtos com baixas pressoes de vapor, tais como os ânions nitrato, sulfato e de ácidos carboxílicos. Alguns produtos de reaçoes atmosféricas, a exemplo do ácido sulfúrico e compostos orgânicos altamente oxigenados, sao resultado da troca de matéria entre as fases gasosa e particulada. Essa troca inclui a nucleaçao e crescimento de partículas finas, a adsorçao de gases na superfície das partículas sólidas, a captaçao de água pelas partículas para formar soluçoes aquosas e a dissoluçao de traços de solutos gasosos nas gotículas.17 Esses processos sao responsáveis, por exemplo, por parte do transporte e remoçao de SO2 da fase gasosa na atmosfera, até a transformaçao final em sulfato na fase aquosa. Na faixa de pH correspondente à água na atmosfera (pH 2 a 6), a maior parte do SO2 dissolvido encontra-se na forma do íon bissulfito, HSO3-.3 A conversao das espécies de S(IV) a S(VI), catalisada por cátions metálicos em presença de agentes oxidantes, ocorre em soluçao aquosa resultante do fenômeno de conversao gás-partícula, caso contrário essa e outras reaçoes nao seriam possíveis na atmosfera. Outra possibilidade de conversao gás-partícula é a reaçao direta entre gases resultando em finas partículas sólidas dispersas no ar. Um exemplo é a reaçao de neutralizaçao de amônia com cloreto de hidrogênio em fase gasosa que resulta em finas partículas de cloreto de amônio dispersas no ar, formando uma névoa. Essa reaçao é usada em um experimento clássico que ilustra a velocidade de difusao de gases e sua dependência com a massa molar (Figura 3).18 A reaçao de formaçao de NH4Cl (anel branco) ocorre na parte do tubo mais próxima à extremidade onde o HCl é introduzido, indicando que este se difunde mais lentamente por ter maior massa molar.
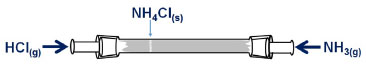 Figura 3. Experimento clássico que ilustra a lei de Graham
De acordo com Thomas Graham, a velocidade de difusao (v) de um gás é inversamente proporcional à raiz quadrada de sua massa molar (MM) e a razao entre suas velocidades de difusao pode ser dada pela equaçao (11):  Processos químicos e biológicos denominados de desnitrificaçao geram compostos reduzidos de nitrogênio sob a forma de gás a partir do nitrato (NO3-), que sao lançados na atmosfera (e.g. NO2, NO, N2O, N2; estruturas no Quadro 1). O N2, tratado anteriormente, apresenta baixa solubilidade em água em funçao da baixa polarizabilidade da nuvem eletrônica. Oxido nitroso, N2O, é pouco reativo e um poderoso gás de efeito estufa. Oxido nitroso e CO2 sao isoeletrônicos, com estrutura linear, porém N2O é assimétrico, com um dos átomos de nitrogênio ocupando a posiçao central, o que resulta em um momento de dipolo de 0,166 D. A solubilidade de N2O em água (65,6 mL/100 g de H2O a 20 oC)13 é inferior a do CO2 (90,1 mL/100 g de HO a 20 oC),8 que reage com água para formar bicarbonato. A baixa polaridade do óxido nitroso, no entanto, possibilita alta solubilidade em gorduras, tornando-o capaz de atravessar facilmente membranas celulares. Por ser lipossolúvel e apresentar efeito analgésico e sedativo, o óxido nitroso é usado na medicina e em procedimentos odontológicos para sedaçao consciente. A inalaçao do gás causa contraçoes involuntárias nos músculos da face, o que leva a pensar que o gás provoca risos, sendo assim chamado de gás hilariante. Já o dióxido de nitrogênio, NO2, apresenta estrutura angular, com momento de dipolo de 0,316 D, portanto, pouco polar. Dióxido de nitrogênio é um gás castanho muito reativo e desproporciona em água gerando ácido nítrico e óxido nítrico (equaçao 12). O óxido nítrico, NO, é um gás neutro e apresenta semelhança estrutural ao N2; porém, a molécula é assimétrica, resultando num pequeno momento de dipolo (0,159 D) e maior polarizabilidade. Como consequência, o NO é ligeiramente mais solúvel que o N2 em água (7,34 mL/100 g de H2O a 0 oC e 5,36 mL/100 g de H2O a 20 oC),8,13 mas é menos solúvel que o N2O em funçao do menor momento de dipolo e menor polarizabilidade do primeiro. A ampla utilizaçao de fertilizantes nitrogenados na agricultura tem contribuído para aumentar a quantidade dos óxidos de nitrogênio, NO e NO2, na atmosfera pelo processo de desnitrificaçao. Os óxidos de nitrogênio participam de uma série de reaçoes atmosféricas na formaçao do ozônio e na produçao de ácido nítrico, que contribui para o aumento da acidez da chuva. 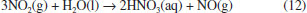 A amônia é um composto reduzido de nitrogênio e um gás no estado padrao. No ciclo do nitrogênio, é gerada no processo de fixaçao por reduçao biológica, realizada por cianobactérias. Industrialmente é produzida pelo processo Haber-Bosch, que combina H2 e N2 com auxílio de um catalisador, elevadas pressoes e temperaturas brandas (350 - 400 oC). A amônia é um gás muito solúvel em água (76,41 L/100 mL de água a 20 oC),13 com solubilidade que corresponde a mais de 700 volumes de NH3 para um volume de água.9 A amônia interage fortemente com a água, via ligaçoes hidrogênio, formando os íons amônio e hidróxido que encontram-se em equilíbrio (equaçao 13), produzindo misturas azeotrópicas com concentraçoes máximas de 28-32%. A soluçao é comercializada como hidróxido de amônio, tido como uma base fraca. 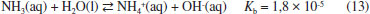 Solubilidade dos gases em meio aquoso e os processos biológicos Alguns processos biológicos, fundamentais para a constituiçao e manutençao da vida, sao governados pela participaçao de gases presentes na atmosfera e, em consequência, de sua solubilidade em fluidos biológicos. Dentre esses processos, cabe destacar dois deles, vistos a seguir. Respiraçao Oxigênio e dióxido de carbono sao gases importantes da atmosfera terrestre, responsáveis por 20,95% e 0,04% em volume, respectivamente, na composiçao do ar seco ao nível do mar. Embora os gases oxigênio e dióxido de carbono sejam constituídos por moléculas apolares, suas densidades eletrônicas sao mais suscetíveis à polarizaçao, especialmente o CO2, sendo, portanto, mais solúveis em água do que o nitrogênio, que é o componente majoritário da atmosfera terrestre, com 78,09% de seu volume total. Oxigênio e dióxido de carbono, dissolvidos em fluidos intra e extracelulares, desempenham funçoes vitais, como a respiraçao e a fotossíntese. Na respiraçao celular ocorre uma troca de gases, em que dióxido de carbono deixa a célula e oxigênio entra na célula. Oxigênio é necessário para converter a energia armazenada de moléculas orgânicas em ATP, enquanto que o metabolismo celular gera dióxido de carbono que deve ser removido da célula. Os organismos unicelulares realizam essa troca diretamente através da membrana celular, assim como animais simples que possuem formas que permitem essa troca através de suas superfícies corporais. Já os animais maiores desenvolveram diferentes sistemas para realizar a troca de gases e facilitar o transporte nas áreas onde ela ocorre. Nesses sistemas, os gases atravessam a membrana celular quando dissolvidos em uma soluçao aquosa, o que requer superfícies respiratórias úmidas. Diferentes sistemas de troca de gases foram desenvolvidos por animais aquáticos e terrestres. Por exemplo, as guelras sao muito eficientes para extrair o oxigênio da água, onde ele é apenas cerca de 1/20 da quantidade que está presente em um mesmo volume de ar. Por isso, esse sistema de troca foi desenvolvido por animais aquáticos (Figura 4).19
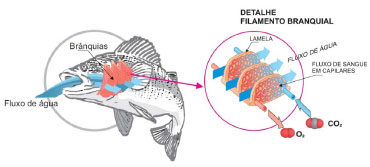 Figura 4. Sistema respiratório desenvolvido por animais aquáticos
Em funçao de restriçoes associadas à perda de água, os animais terrestres desenvolveram pulmoes mais eficientes. No sistema respiratório humano (Figura 5) o ar entra no corpo pelo nariz, onde é aquecido e filtrado, e vai para a cavidade nasal. Depois passa pela faringe, laringe e traquéia, atingindo os brônquios, que transportam o ar para dentro e fora dos pulmoes. As ramificaçoes dos brônquios em tubos cada vez mais finos sao chamadas de bronquíolos, com terminaçoes chamadas de alvéolos, que sao rodeados por capilares separados por uma fina parede (0,2 mm).
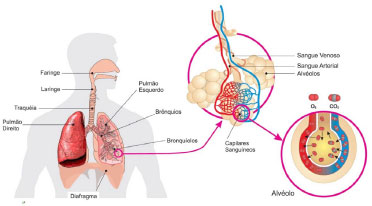 Figura 5. Sistema respiratório humano
O transporte dos gases dos alvéolos, com ar rico em oxigênio, para o interior dos capilares (sangue pobre em oxigênio) através da membrana, dá-se por diferença de pressoes parciais. Entretanto, a baixa solubilidade do oxigênio no sangue exige um transportador de O2 eficiente para atender às necessidades do corpo, funçao desempenhada pela hemoglobina (Hb). Enquanto que 1 L de plasma sanguíneo é capaz de dissolver 2,3 mL de O2 a 38 oC, temperatura média do sangue humano, a hemoglobina contida no mesmo volume de sangue é capaz de transportar 220 mL de O2.20 O oxigênio contido no sangue, dissolvido no plasma e, principalmente, na forma conjugada com a hemoglobina (oxi-hemoglobina), difunde-se para os tecidos e é transferido para a mioglobina, onde esse será armazenado para atender as demandas das células em diversas funçoes metabólicas. A perda de oxigênio e o ganho simultâneo de dióxido de carbono convertem o sangue arterial em venoso. O sangue venoso é coletado pelas veias, misturando-se no ventrículo direito e novamente circulado pelos pulmoes. A concentraçao de dióxido de carbono em células metabolicamente ativas é maior que no sangue, o que permite o seu transporte da célula para o sangue (Figura 6). O CO2 é cerca de 30 vezes mais solúvel em água que o oxigênio, consequência da maior polarizabilidade da sua nuvem eletrônica e da capacidade de combinar-se com a água para formar íons bicarbonato e íons H+. No entanto, essa reaçao é muito lenta para atender a necessidade de remoçao de CO2 diante de elevada atividade metabólica das células. A reaçao é, entao, catalisada pela enzima anidrase carbônica, que eleva em cerca de 107 a ordem de grandeza da constante cinética,21 o que permite maior eficiência no processo de remoçao de CO2, evitando o acúmulo desse gás no plasma que levaria à ruptura dos capilares pelo aumento excessivo da pressao interna.
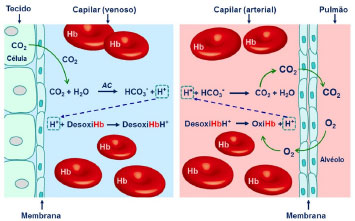 Figura 6. Processo de remoçao do dióxido de carbono do sangue. AC: anidrase carbônica
O processo de remoçao de CO2 é também auxiliado pela hemoglobina. Após transferir o oxigênio para a mioglobina, a desoxi-hemoglobina se combina com uma molécula de água, enquanto a sua parte protéica absorve H+, atuando como agente tamponante (Figura 6). No processo de troca de gases que ocorre através das membranas que separam os capilares dos alvéolos, a desoxi-hemoglobina se associa ao oxigênio e libera o H+, este se combina novamente com bicarbonato formando ácido carbônico, que é rapidamente decomposto em dióxido de carbono e água (Figura 6). Finalmente, o CO2 difunde-se para os alvéolos, onde sua pressao parcial é menor, fazendo o caminho de volta até a exalaçao do ar (Figura 6). Esse processo remove o dióxido de carbono do sangue, permitindo um fluxo contínuo da célula para os capilares. Desta forma, as concentraçoes médias de CO2 e íons bicarbonato no plasma sao mantidas em 1,2 mmol L-1 e 24 mmol L-1, respectivamente.20 Os equilíbrios envolvendo essas espécies (equaçoes 14 e 15) resultam em um sistema tampao que regula o pH do sangue, mantendo-o em ~7,4. O tampao bicarbonato freará variaçoes bruscas de pH, impedindo alteraçoes significativas do pH do sangue. 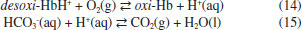 Desta forma, para que os indivíduos sejam saudáveis é preciso respirar ar limpo. Entretanto, a Organizaçao Mundial da Saúde (OMS)22 alertou, recentemente, no relatório global sobre zonas de perigo para poluiçao do ar que 92% da populaçao global respira ar inadequado. Cerca de 3 milhoes de mortes prematuras estao associadas à poluiçao externa do ar e a maioria das emissoes que poluem o ar, especialmente, NOx e SO2, sao de origem do setor energético, principalmente, da queima de combustíveis.23 As causas das mortes estao relacionadas a doenças que afetam os sistemas circulatório e respiratório, como doenças cardiovasculares, derrame, doença obstrutiva pulmonar crônica e câncer de pulmao. A World Energy Outlook23 faz uma projeçao alarmante de que o número de mortes prematuras em decorrência da poluiçao externa do ar deve aumentar para 4,5 milhoes em 2040 e quase 90% dessas mortes serao registradas em países de baixa e média renda, principalmente no sudeste da Asia e regioes ocidentais do Pacífico. O Brasil aparece nesse cenário com um aumento significativo de mortes comparado aos números de 2015. A estimativa é que passe das 22 mil mortes registradas em 2015 para 36 mil em 2040. Fotossíntese A fotossíntese envolve um sistema de troca de gases no sentido oposto ao da respiraçao e pode ser dividida em dois estágios sequenciais: as reaçoes dependentes da luz e as reaçoes independentes da luz, ou o ciclo de Calvin (Figura 7).24,25 A luz solar é absorvida pelos fotossistemas I e II (PS I e PS II), conhecidos como esquema Z, o que resulta na excitaçao de elétrons. Oxigênio é produzido pela oxidaçao da água no PS II e ATP e NADPH sao produzidos no PS I, armazenando a energia solar nas ligaçoes químicas. O oxigênio, pouco solúvel em meio aquoso, deixa o cloroplasto, local onde ocorre a fotossíntese, enquanto que ATP e NADPH fluem através das membranas para o estroma, cujo meio é aquoso, para fornecer a energia necessária na construçao de moléculas de carboidratos a partir da reduçao do CO2 atmosférico (ciclo de Calvin). A disponibilidade de CO2 no estroma irá depender da solubilidade do gás no fluido e será tanto maior quanto maior for a pressao parcial deste gás no ar atmosférico.
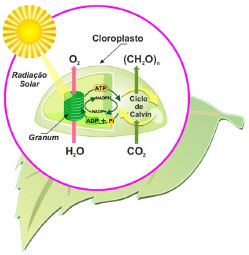 Figura 7. Estágios da fotossíntese: reaçoes dependentes da luz e reaçoes independentes da luz (ciclo de Calvin)
De uma forma geral, a reaçao global que sumariza a fotossíntese pode ser representada pela equaçao 16. 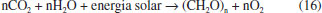 Os gases em ambientes aquáticos O ambiente aquático é fortemente dependente da solubilidade de oxigênio na água, sendo esse gás proveniente da dissoluçao do ar atmosférico e da fotossíntese de algas. Além da pressao parcial atmosférica, a solubilidade de oxigênio em corpos d'água será influenciada por fatores como salinidade e, principalmente, temperatura. Ao nível do mar, a solubilidade de O2 em água é de 6,0 mL L-1 a 25 °C.26 Em regioes temperadas, onde a temperatura é menor, a quantidade de oxigênio dissolvido é maior (10,1 mL L-1 a 0 oC e pressao atmosférica de 1 atm). Num clima muito frio, no entanto, o gelo, por ser menos denso, cobre a superfície da água, limitando a quantidade de oxigênio disponível. Nessas regioes, o fenômeno de recirculaçao das águas que ocorre no outono é fundamental para manter o ambiente aquático aerado. Em temperaturas próximas a 4 oC a água atinge sua densidade máxima. Nessas condiçoes, as águas superficiais se tornam mais densas que as águas mais profundas e assim se deslocam para o fundo, misturando as espécies dissolvidas, como oxigênio, num movimento vertical. Já em regioes tropicais, a quantidade de oxigênio dissolvido diminui por conta da elevaçao da temperatura (5,3 mL L-1 a 30 oC e pressao atmosférica de 1 atm); porém, isso nao significa inviabilidade da vida nesses ambientes, uma vez que os organismos aquáticos tropicais se adaptaram a essa condiçao ao longo da evoluçao. No entanto, o aquecimento de corpos d'água em decorrência de atividade humana ocorre em uma janela de tempo muito pequena, o que pode dificultar a adaptaçao dos seres vivos a essa nova condiçao, a exemplo do fenômeno de branqueamento de recifes de corais, consequência da perda dos simbiontes com o aumento da temperatura da água. Esses organismos sao responsáveis pela cor dos corais e importante fonte de alimento, uma vez que realizam fotossíntese.27 A acidificaçao dos oceanos, também causada pela atividade humana, é uma das consequências do aumento da concentraçao de CO2 atmosférico. Desde a era pré-industrial, estima-se que a concentraçao de CO2 na atmosfera aumentou cerca de 40%,28 passando de aproximadamente 280 ppmv (partes por milhao em volume) para 403 ppmv (novembro, 2016) de acordo com os dados da Divisao de Monitoramento Global ligado ao Departamento de Comércio dos Estados Unidos.29 A superfície dos oceanos absorve cerca de um terço do excesso de dióxido de carbono injetado na atmosfera pela açao humana, seja por queima de combustíveis fósseis ou por queimada de florestas, tendo como consequências a reduçao do pH e a diminuiçao da saturaçao de carbonato de cálcio nas águas superficiais. Desde os tempos pré-industriais, o pH médio das águas superficiais caiu cerca de 0,1 unidade, de aproximadamente 8,21 para 8,10, e a expectativa é que diminua mais 0,3-0,4 unidades de pH se as concentraçoes de CO2 atmosférico continuarem aumentando e atinjam os 800 ppmv, de acordo com projeçoes do IPCC (Intergovernmental Panel on Climate Change). As reaçoes na água do mar envolvendo o carbono inorgânico dissolvido sao reversíveis e próximas ao equilíbrio (equaçoes 2-4). Em pH 8,1, aproximadamente 90% do carbono inorgânico está na forma de bicarbonato, 9% na forma de carbonato e apenas 1% como CO2 dissolvido. A velocidade de formaçao e dissoluçao do carbonato de cálcio (equaçao 17) varia com o estado de saturaçao (Ω), definido como o produto iônico das concentraçoes dos íons cálcio e carbonato (equaçao 18). 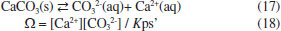 em que Kps' é o produto iônico aparente, que depende da temperatura, salinidade, pressao e a fase cristalina do mineral (aragonita ou calcita). A concentraçao de íons cálcio é proporcional à salinidade, enquanto que a concentraçao de íons carbonato pode ser calculada a partir de dados de carbono inorgânico dissolvido e alcalinidade. A formaçao de carapaça ou esqueleto em diversas espécies que habitam ambientes marinhos, geralmente ocorre quando Ω > 1, enquanto a dissoluçao do carbonato de cálcio ocorre quando Ω < 1.28 Os estados de saturaçao sao mais elevados em águas tropicais rasas e quentes e mais baixos em regioes de alta latitude, em águas frias e profundas, o que reflete o aumento da solubilidade do CaCO3 com a diminuiçao da temperatura e aumento da pressao. Desta forma, a capacidade do oceano em absorver CO2 atmosférico causa impacto direto no ambiente marinho. Os gases na indústria de alimentos: gaseificaçao de bebidas O processo artificial de gaseificaçao, que realça o paladar e confere frescor à bebida, é chamado de carbonataçao. Sua açao refrescante está associada à solubilidade de CO2 na água, que diminui com o aumento da temperatura. Como as bebidas gaseificadas sao tomadas geladas, há um aumento da temperatura no trajeto que vai da boca ao estômago. Esse aumento de temperatura associado ao meio ácido estomacal favorece a eliminaçao do CO2 e a sensaçao de frescor resulta da expansao desse gás, que é um processo endotérmico.4,30 O processo de carbonataçao é, geralmente, dividido em duas etapas. A primeira consiste na mistura do gás à água, com resfriamento a temperaturas que variam de 4 a 8 oC para aumentar sua solubilidade. A depender da bebida, outros ingredientes sao misturados, como o xarope em refrigerantes. No final do processo, no envasamento, mais CO2 é adicionado com a finalidade de aumentar a pressao parcial do gás e com isso sua solubilidade no meio aquoso. A depender do material da garrafa, a pressao de CO2 pode ser maior ou menor; por exemplo, as garrafas PET têm maior porosidade que as de vidro, o que vai requerer um maior conteúdo de CO2 para compensar perdas por permeaçao do gás através dos poros. Já as águas gaseificadas naturalmente sao consequência do aquecimento subterrâneo em aquíferos próximos a regioes onde ocorrem vulcoes ou onde a camada de magma está próxima da superfície. O intenso calor decompoe depósitos calcários contidos na água, liberando dióxido de carbono. Um exemplo é a famosa água mineral natural Perrier, proveniente da localidade de Vergéze na França, que é reforçada com CO2 na fonte por uma corrente de gás de origem vulcânica, que resulta em efervescência e características singulares. Por outro lado, as cervejas e os espumantes sao bebidas gaseificadas naturalmente pelo processo de fermentaçao. A cerveja para consumo é composta por 2 a 6% de etanol, 0,35 a 0,50% de dióxido de carbono, 90 a 95% de água e 2 a 6% de extrato residual. O processo de fabricaçao da cerveja envolve quatro etapas: brassagem; fermentaçao e maturaçao; filtraçao; e envasamento. Na fermentaçao, as leveduras consomem os carboidratos fermentáveis, produzindo etanol e CO2, como produtos principais, e ésteres, ácidos e álcoois superiores como produtos secundários. Após a fermentaçao, a cerveja é enviada para tanques maturadores e mantida por períodos variáveis a temperaturas abaixo de 0 oC, o que contribui para a preservaçao do CO2. No acabamento e envasamento, recebe estabilizantes que mantêm a espuma e antioxidantes para prevenir a influência negativa do O2. Para reter o aroma, recomenda-se tomar a cerveja com colarinho de dois a três dedos de espuma.31 O vinho é um produto natural resultante de diversas reaçoes bioquímicas que se iniciam durante a maturaçao e colheita da uva, sao estimuladas durante a fermentaçao e continuam após o engarrafamento.32 Os principais produtos voláteis resultantes das interaçoes microbianas sao o etanol e CO2, que nao contribuem significativamente para o aroma, ao contrário de ácidos orgânicos, alcoóis superiores, compostos carbonílicos, sulfurados e nitrogenados, lactonas e fenóis voláteis, que constituem o maior grupo de compostos formadores do "bouquet fermentativo".33 Na elaboraçao de vinhos espumantes, o vinho base, com elevada acidez e menor teor alcoólico, passa pelo processo de segunda fermentaçao, realizada em ambiente fechado, preservando o CO2 produzido naturalmente. Esse processo resulta na formaçao lenta de CO2 dentro da garrafa que, quando aberta, produz minúsculas bolhas de gás que transportam aromas e frescor ao nariz e à boca, características essenciais de bons espumantes. Outro aspecto importante na produçao de vinhos é a adiçao de compostos à base de oxoânions de enxofre (Na2S2O5 ou K2S2O5- metabissulfito de sódio ou potássio e/ou NaHSO3 ou KHSO3 - bissulfito de sódio ou potássio) para solucionar os problemas de oxidaçao e interferências microbianas indesejadas durante a fermentaçao. O SO2 liberado na dissoluçao desses compostos controla as reaçoes de oxidaçao e atua também inibindo o crescimento de leveduras nativas e bactérias através da reduçao da atividade específica da ATPase.34,35 A espécie de enxofre predominante no meio aquoso é fortemente dependente do pH (equaçao 19). Em um processo típico de elaboraçao de vinhos a faixa de pH é de 3-4, sendo o bissulfito a espécie predominate.36 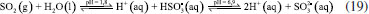 Os compostos carbonílicos presentes no vinho reagem com o bissulfito, levando à formaçao de ácidos alquilsulfônicos,36 num mecanismo semelhante ao que ocorre em reaçoes na atmosfera envolvendo SO2 e formaldeído, que resulta na formaçao de um aduto formaldeído-bissulfito (ácido hidroximetanosulfônico).37 O acetaldeído também reage rapidamente com o bissulfito, formando o ácido α-hidroxietanossulfônico, nao volátil, que diminui a percepçao olfativa indesejável do acetaldeído presente no vinho.36 Solubilidade de gases em sólidos A solubilidade dos gases em sólidos está diretamente relacionada a um tema que desperta grande interesse atualmente, desde que poderá alterar significativamente a matriz de combustíveis utilizados na frota veicular. Um dos grandes desafios atualmente para a consolidaçao da economia de hidrogênio é o desenvolvimento de tecnologias capazes de armazenar esse combustível de forma segura e acessível. O hidrogênio pode ser armazenado nas formas gasosa, líquida ou sólida: 1) como gás, comprimido em tanques altamente pressurizados; 2) como líquido, em tanques criogênicos e 3) como sólido, em hidretos metálicos ou materiais nanoestruturados.38 O hidrogênio tem baixa densidade volumétrica de armazenamento e mesmo sob elevadas pressoes o sistema de armazenamento requererá grandes volumes. Na forma de líquido, há aumento da densidade volumétrica de armazenamento, mas o sistema requer resfriamento a 20 K. Por essas razoes, os sistemas de armazenamento de hidrogênio na forma de gás e líquido sao pouco atrativos para aplicaçoes em veículos. As tecnologias alternativas de armazenamento de hidrogênio no estado sólido, por adsorçao em materiais nanoestruturados ou por formaçao de hidretos metálicos, têm despertado grande interesse em grupos de pesquisa ao redor do mundo. No primeiro caso, o hidrogênio é adsorvido ao material nanoestruturado pelos processos de quimissorçao ou fisissorçao e permanece na sua forma física original. Neste caso, é possível adsorver hidrogênio à temperatura ambiente, mas a quantidade adsorvida será proporcional à pressao aplicada. Já o segundo caso, trata-se de um sistema de armazenamento químico em que o hidrogênio é absorvido sob pressoes moderadas e baixas temperaturas. Certos metais, especialmente elementos dos blocos d e f, compostos intermetálicos ou ligas, têm habilidade de absorver hidrogênio para formar sólidos metal-hidrogênio reversíveis. A capacidade de absorver quantidades variáveis de hidrogênio resulta na formaçao de compostos nao estequiométricos e muitas vezes denominados de soluçoes sólidas. Desta forma, por absorçao a baixas pressoes, o hidrogênio pode ser potencialmente armazenado em hidretos metálicos com alta densidade volumétrica, uma alternativa mais segura comparada aos outros métodos. Para que seja considerado eficiente no armazenamento de hidrogênio por absorçao o material deve apresentar baixas temperaturas de absorçao/dessorçao, elevadas velocidades de hidrogenaçao/desidrogenaçao, boa reversibilidade e alta densidade volumétrica de armazenamento de hidrogênio.38-43 Os materiais mais estudados para este fim sao compostos intermetálicos do tipo AB5, AB2, AB, A2B, etc., em que A representa um elemento metálico com elevada afinidade por hidrogênio (geralmente, um elemento do início das séries de transiçao, d1 a d4, ou um lantanídio, com tendência a formar hidretos metálicos), enquanto B é um elemento metálico com fraca afinidade por hidrogênio (geralmente, um metal do final das séries de transiçao, d5 a d10, localizados na regiao da Tabela Periódica conhecida como lacuna de hidretos, a exceçao de cobre, zinco e paládio). Esta combinaçao permite que o hidrogênio seja absorvido reversivelmente. A capacidade dos compostos intermetálicos de absorver hidrogênio é dada pela razao H/M (hidrogênio/metal). A estabilidade do hidreto formado é determinada pela pressao de equilíbrio do hidrogênio molecular a uma dada temperatura e as propriedades termodinâmicas dos hidretos sao, geralmente, descritas por isotermas pressao-composiçao.39,40 A Figura 8 ilustra uma isoterma pressao-composiçao típica para absorçao/dessorçao de H2 em compostos intermetálicos, com destaque para três situaçoes: (1) H/M < 0,1, trata-se de uma soluçao sólida monofásica de hidreto que apresenta baixo conteúdo de hidrogênio, chamada fase α; (2) 0,1 < H/M < 0,8, há coexistência de duas fases, a fase saturada α que se transforma na fase β, com maior conteúdo de hidrogênio. Nesta situaçao, a pressao de equilíbrio do hidrogênio gasoso é mantida constante com o aumento da razao H/M, tendo-se um plateau de pressao, cujo comprimento determina a quantidade de H2 que pode ser armazenada reversivelmente com pequenas variaçoes de pressao. Deste modo, a formaçao e decomposiçao dos hidretos ocorrem no plateau de pressao, que é caracterizado pelo fenômeno de histerese, no qual a pressao de equilíbrio de hidrogênio durante o processo de absorçao é ligeiramente maior que a de dessorçao para compensar a energia necessária para expansao de rede; e (3) H/M > 0,8, a fase α é totalmente convertida a fase β, o sistema volta a ser monofásico e a pressao de hidrogênio aumenta abruptamente com o aumento da razao H/M.
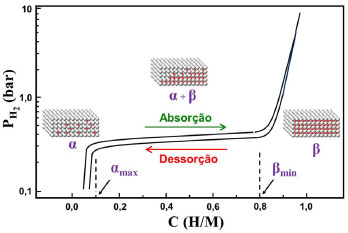 Figura 8. Estágios da fotossíntese: reaçoes dependentes da luz e reaçoes independentes da luz (ciclo de Calvin)
Alguns desses materiais sao adequados para aplicaçoes nao-automotivas como dispositivos móveis, fontes de energia estacionárias e tecnologias aeroespaciais, a exemplo das baterias de Ni/MH recarregáveis, constituídas por ligas intermetálicas do tipo AB5, AB2 e AB, que atuam como eletrodo negativo nestas baterias. As ligas derivadas de LaNi5 sao as mais utilizadas,43 porém, a capacidade gravimétrica de armazenamento de hidrogênio em LaNi5H6.5, por exemplo, é menor que 2% (m/m), inviabilizando o uso em veículos automotivos. Por outro lado, há um grande esforço internacional no sentido de identificar hidretos metálicos adequados a aplicaçoes automotivas e que tenham baixo custo, capaz de viabilizar o uso. O Departamento de Energia dos Estados Unidos (DOE) projetou para o ano de 2017 valores ideais de capacidade de armazenamento de hidrogênio de sistemas para uso em veículos equipados com células a combustível.38,41,44 O objetivo é desenvolver sistemas de armazenamento de hidrogênio com capacidade gravimétrica de 5,5% (kg H2/kg) e uma capacidade volumétrica de 4% (kg H2/L), operando na faixa de temperatura de -40 a 60 oC e pressao de 5 a 12 bar.44 A Tabela 3 apresenta alguns compostos intermetálicos já avaliados e compara suas capacidades gravimétricas de armazenamento com a do paládio, conhecido como "esponja de hidrogênio".
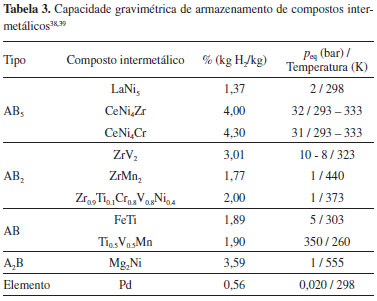
As ligas que alcançaram maiores capacidades gravimétricas de armazenamento ainda requerem altas pressoes e elevadas temperaturas. Deste modo, apesar da grande concentraçao de esforços, até o presente momento, o desenvolvimento de sistemas com capacidade gravimétrica de armazenamento de hidrogênio projetada pelo DOE ainda é considerado um desafio. Além dos hidretos metálicos, compostos como hidroboratos, MBH4 e M(BH4)2 (em que M é Li, Na, Mg ou Ca) e alanatos, MAlH4 (em que M é Na, Li ou K), também sao alvos de investigaçao.38,39
CONCLUSOES Diversos processos biológicos, industriais e que ocorrem na atmosfera e em corpos d'água dependem da capacidade de dissoluçao de gases em água e podem ser usados para abordar o fenômeno da solubilidade. A solubilidade de gases em água depende majoritariamente da polarizabilidade de átomos ou moléculas que os constituem e de sua capacidade em reagir com o solvente. Quando a polarizabilidade for alta e a dissoluçao for acompanhada de reaçao, as constantes de Henry serao elevadas e outros equilíbrios estarao envolvidos, além do processo de solvataçao. Por outro lado, a solubilidade de gases em sólidos é importante no desenvolvimento de tecnologias eficientes de armazenamento de hidrogênio que viabilizará o uso de células a combustível tanto em dispositivos estacionários quanto na frota veicular, contribuindo para a substituiçao da atual matriz energética. Variáveis importantes que devem ser consideradas na avaliaçao da solubilidade de gases, seja em meio de dispersao líquido ou sólido, sao a temperatura e a pressao. O aumento da pressao contribuirá sempre de forma positiva para a solubilidade de gases em meio de dispersao líquido ou sólida, porém, o aumento da temperatura exercerá efeitos contrários a depender da fase de dispersao. No caso de solvente líquido, o aumento da temperatura reduz a solubilidade dos gases devido à reduçao da intensidade das forças intermoleculares. Já o efeito do aumento de temperatura é positivo para a solubilidade de gases em fase de dispersao sólida pelo processo de absorçao, visto que envolve quebra e formaçao de ligaçoes químicas. Finalmente, cabe destacar que este artigo vem fechar um ciclo de discussao que aborda o tema solubilidade, e que teve seu início em 2004. O primeiro registrava em seu título uma provocaçao à discussao: "Por que todos os nitratos sao solúveis?";45 essa provocaçao foi mantida no segundo, que trazia a indagaçao "Sulfetos: Por que nem todos sao insolúveis?".46 A solubilidade dos compostos orgânicos também foi tratada, no artigo: "Solubilidade de substâncias orgânicas",47 o qual este sucede. Assim, com esta série de discussao espera-se abranger as fases condensadas e gasosa da matéria, bem como envolver espécies químicas de naturezas distintas, contribuindo para uma melhor compreensao desse importante fenômeno.
AGRADECIMENTOS Ao CNPq e FAPESB pelas bolsas e financiamentos e aos três revisores de Química Nova pelos excelentes comentários e sugestoes que contribuíram substancialmente para a melhoria do manuscrito.
REFERENCIAS 1. Mészáros, E.; Atmospheric Chemistry: Fundamental Aspects, 1981, Elsevier Scientific Publishing Company: Amsterdam, 1981. 2. Jardim, W. F.; QNEsc, Cadernos temáticos 2001, 5, 5. 3. Martins, C. R.; Pereira, P. A. P.; Lopes, W. A.; de Andrade, J. B.; QNESc, Cadernos temáticos 2003, 5, 28. 4. Atkins, P.; de Paula, J. B.; Atkins Físico-Química, Vol. 1, 7ª Ed., Livros Técnicos e Científicos Ed. S.A.: Rio de Janeiro, 2004. 5. http://qnint.sbq.org.br/novo/. Acessada em fevereiro de 2017. 6. Werner, H-J.; Rosmus, P. J. Chem. Phys. 1980, 73, 2319. 7. Lide Jr., D. R. J. Phys. Chem. 1960, 33, 1514. 8. Haynes, W. M. In Handbook of Chemistry and Physics; Haynes, W. M., Lide, D. R., Bruno, T. J., eds.; 95th ed., CRC Press, Inc: New York, 2014-2015. 9. Atkins, P.; Jones L.; Chemistry: Molecules, Matter, and Changes, Ed. Freeman: New York, 1997. 10. Lee, J. D.; Química Inorgânica nao tao concisa, Traduçao da 5ª ed. inglesa, Ed. Edgard Blücher: Sao Paulo, 1999. 11. Rocha, W. R.; QNEsc, Cadernos temáticos 2001, 4, 31. 12. Greenwood, N. N.; Earnshaw, A.; Chemistry of the Elements; 2nd ed., Butterworth Heinemann: Oxford, 1997. 13. http://gestis-en.itrust.de. Acessada em fevereiro de 2017. 14. Grover, A. C.; Grover, D. H.; J. Emerg. Med. 2014, 46, 225. 15. Hobbs, M.; Kneller, W.; Physiol. Behav. 2015, 144, 46. 16. Rezende, W.; Lopes, F. S.; Rodrigues, A. S.; Gutz, I. G. R.; QNEsc 2008, 30, 66. 17. Brasseur, G. P.; Orlando, J. J.; Tyndall, G. S.; Atmospheric Chemistry and Global Change, Oxford: New York, 1999. 18. Hawkes, S. J.; J. Chem. Educ. 1993, 70, 836. 19. Purves, W. K.; Orians, G. H.; Heller, H. C. R.; Life: The Science of Biology, 4th ed., Sinauer Associates Inc: Sunderland, 1994. 20. Chemello, E.; Naeq - Núcleo de Apoio ao Ensino de Química, Textos Interativos - "O equilíbrio ácido-base no sangue"; http://www.quimica.net/emiliano/equilibrio_acido_base_sangue.html. Acessada em fevereiro de 2017. 21. Kaim, W.; Schwederski, B.; Bioinorganic Chemistry: Inorganic Elements in the Chemistry of Life. An Introduction and Guide, John Wiley & Sons: Hoboken, 1996. 22. http://www.who.int/mediacentre/news/releases/2016/air-pollution-rising/en/. Acessada em fevereiro de 2017. 23. Energy and Air Pollution 2016 - World Energy Outlook Special Report. http://www.worldenergyoutlook.org/. Acessada em fevereiro de 2017. 24. Kluge, R. A.; Tezotto-Uliana, J. V.; da Silva, P. P. M.; Rev. Virtual Quim. 2015, 7, 56. 25. Fridlyand, L. E.; Scheibe, R.; BioSystems 1999, 51, 79. 26. Fiorucci, A. R.; Benedetti-Filho, E.; QNESc 2005, 22, 10. 27. Kavousi, J.; Reimer, J. D.; Tanaka, Y. Nakamura, T.; Mar. Environ. Res. 2015, 109, 9. 28. Doney, S. C.; Fabry, V. J.; Feely, R. A.; Kleypas, J. A.; Annu. Rev. Mar. Sci. 2009, 1, 169. 29. http://www.esrl.noaa.gov/gmd/ccgg/trends/. Acessada em fevereiro de 2017. 30. Lima, A. C. S.; Afonso, J. C.; QNESc 2009, 31, 210. 31. Rosa, N. A.; Afonso, J. C.; QNESc 2015, 37, 2, 98. 32. Romano, P.; Fiore, C.; Paraggio, M.; Caruso, M.; Capece, A.; Int. J. Food Microbiol. 2003, 86, 169. 33. Flanzy, C.; Enologia: Fundamentos Científicos y Tecnológicos, 1ª ed., Mundi Prensa & A. Madrid Vicente Ediciones: Madrid, 2000. 34. Carreté, R.; Vidal, M. T.; Bordons, A.; Constanti, M.; FEMS Microbiol. Lett. 2002, 211, 155. 35. Azevêdo, L. C.; Reis, M. M.; Silva, L. A.; de Andrade, J. B.; Quim. Nova 2007, 30, 1968. 36. Azevêdo, L. C.; Reis, M. M.; Motta, L. F.; da Rocha, G. O.; Silva, L. A.; de Andrade, J. B.; J. Agric. Food Chem. 2007, 55, 8670. 37. de Andrade, M. V. A. S.; Pinheiro, H. L. C.; Pereira, P. A. P.; de Andrade, J. B.; Quim. Nova 2002, 25, 1117. 38. Rusman, N. A. A.; Dahari, M.; Int. J. Hydrogen Energy 2016, 41, 12108. 39. Schlapbach, L.; Züttel, A.; Nature 2001, 414, 353. 40. Cuevas. F.; Joubert, J.-M., Latroche, M.; Percheron-Guégan, A.; Appl. Phys. A: Mater. Sci. Process. 2001, 72, 225. 41. Ahluwalia, R. K.; Peng, J.-K.; Hua, T. Q. Int. J. Hydrogen Energy 2014, 39, 1487. 42. Tan, Semra; Shen, Yang; Sahin, E. O.; Noréus, D.; Ozturkb, T. Int. J. Hydrogen Energy 2016, 41, 9948. 43. Falahati, H.; Barz, D. P. J. Int. J. Hydrogen Energy 2013, 38, 8838. 44. http://energy.gov/sites/prod/files/2014/03/f12/targets_onboard_hydro_storage.pdf. Acessada em fevereiro de 2017. 45. Silva, L. A.; Martins, C. R.; de Andrade, J. B.; Quim. Nova 2004, 27, 1016. 46. Martins, C. R.; Silva, L. A.; de Andrade, J. B.; Quim. Nova 2010, 33, 2283. 47. Martins, C. R.; Lopes, W. A.; de Andrade, J. B.; Quim. Nova 2013, 36, 1248. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access