Artigo
|
|
| Novos híbridos baseados em oxihidróxido de ferro(III) e nanopartículas de ouro (AuNPs/FeOOH) como catalisadores para a redução de poluentes orgânicos ambientais New hybrids based on iron (III) oxyhydroxide and gold nanoparticles (AuNPs / FeOOH) as catalysts for the reduction of organic environmental pollutants |
|
Camila Kauany da Silva Azevedo1; Eduardo Arizono dos Reis1; José Carlos Germino2; Jéferson Aparecido Moreto3; Ailton José Terezo1; Fernando Júnior Quites1,*,#
1. Departamento de Química, Instituto de Ciências Exatas e da Terra, Universidade Federal de Mato Grosso, 78060-900 Cuiabá - MT, Brasil Recebido em 24/10/2016 *e-mail: fquitesquim@gmail.com A new δ-FeOOH supported nano-Au catalyst was prepared by a facile method using HAuCl4 as the gold source and NaBH4 as the reducing agent. The samples (denoted as AuNPs/FeOOH) were characterized by means of X-ray diffraction (XRD), UV-vis and infrared spectroscopies and scanning electron microscope (SEM). The obtained characterization data confirmed the formation of Au nanoparticles on the δ-FeOOH matrix surface. SEM observations showed that Au nanoparticles have a spherical morphology and good dispersion with a narrow size distribution on the surface of iron (III) oxyhydroxide. The catalyst exhibits significantly high catalytic activity for hydrogenation of 4-nitrophenol (4-NP) to 4-aminophenol (4-AP) at room temperature. The high performance obtained can be attributed to the specific characteristics of the nanostructure of the catalyst of nano-Au deposited on the external surface of δ-FeOOH, including plenty of oxygen-containing groups of δ-FeOOH for anchoring AuNPs. Moreover, the catalytic activity increased when the AuNPs content in the δ-FeOOH support. The AuNPs-based δ-FeOOH hybrids are interesting catalysts for hydrogenation of nitrophenols to aminophenols. INTRODUÇAO Compostos nitrofenólicos estao entre os poluentes mais encontrados em efluentes industriais e agrícolas.1 Estes compostos possuem elevada toxicidade, mesmo em níveis residuais, além de elevada solubilidade e estabilidade em meio aquoso.2 Entre os compostos nitrofenólicos, o 4-nitrofenol (4-NP) é considerado um poluente prioritário devido ao seu potencial genotóxico e carcinogênico aos seres humanos tornando importante sua conversao a compostos que possuem menor toxicidade.3 A reduçao do 4-NP gera como produto o 4-aminofenol (4-AP), que comparado ao primeiro possui menor potencial tóxico e maior biodegradabilidade, além de ser um importante intermediário na indústria química.4,5 Materiais híbridos baseados em suportes inorgânicos e nanopartículas metálicas2,3,5 (NPs) sao compostos que possuem diversas aplicaçoes, entre elas, a utilizaçao como catalisadores para a degradaçao e ou reduçao de poluentes orgânicos ambientais como o 4-NP. Esses materiais podem apresentar combinaçoes de propriedades únicas que nao sao encontradas em compósitos convencionais.5,6 Além de obter resultados catalíticos melhorados, é possível também conseguir novas funcionalidades devido aos efeitos sinérgicos entre os seus diferentes componentes.7 Neste sentido, semicondutores oxihidróxidos de ferro (III) (FeOOH) tem atraído interesse na sua utilizaçao como precursor para a produçao de óxidos de ferro e como suportes para aplicaçoes em catálise.8 Os polimorfos do FeOOH sao geralmente cristalinos e ocorrem em diferentes estruturas cristalográficas incluindo a goethita (α-FeOOH), akaganeíta (β-FeOOH), lepidocrocita (γ-FeOOH) e a ferroxiíta (δ-FeOOH), que podem ser facilmente caracterizadas através da técnica de difraçao de raios X.8,9 O método de preparaçao dos oxihidróxidos de ferro (III) é muito sensível às condiçoes da síntese, na qual o tipo e a concentraçao do sal de ferro, o pH, a temperatura e o tempo de síntese (envelhecimento) sao fatores importantes.8 Entre as fases de oxihidróxido de ferro (III), a fase ferroxiíta (δ-FeOOH) tem atraído especial atençao devido a sua estabilidade química, comportamento ferromagnético e propriedade bioquímica associada aos íons Fe(III) e seus orbitais 3d.7,9-11 Este composto é um polimorfo metaestável do oxihidróxido de ferro (III) com uma estrutura baseada em um empacotamento hexagonal dos átomos de oxigênio com os íons Fe(III) ocupando metade dos interstícios octaédricos disponíveis, similar à rede da hematita (Fe2O3). A presença destes sítios octaédricos desigualmente ocupados induz uma magnetizaçao espontânea na estrutura do δ-FeOOH, com uma temperatura de Curie próxima a temperatura ambiente, possibilitando que este composto também seja empregado na medicina.7,9 Além disso, a banda de absorçao localizado na regiao próxima a 600 nm induz um comportamento semicondutor a este material, com energia de band gap em torno de 2,2 eV, o que possibilita a utilizaçao da luz solar como fonte de excitaçao para aplicaçoes em fotocatálise heterogênea empregando luz na regiao do visível.12,13 A síntese deste material nanoparticulado é fácil e de baixo custo, além disso, as nanopartículas podem ser facilmente dispersas em água, o que aumenta a sua eficiência catalítica.10,12 O δ-FeOOH tem sido utilizado também como fotocatalisador para a degradaçao de poluentes orgânicos ambientais.9,10,12,14 Entretanto, seu emprego é ainda limitado devido às elevadas taxas de recombinaçao do par elétron-buraco. Uma alternativa para minimizar este efeito é a formaçao de híbridos com nanopartículas de metais nobres como Ag, Au e Pt. Além de auxiliar a separaçao de cargas dos pares elétron-buraco, as nanopartículas metálicas também podem aumentar a atividade catalítica devido aos efeitos da banda de ressonância plasmônica de superfície.15 A utilizaçao do suporte inorgânico também evita a aglomeraçao das nanopartículas metálicas, já que no estado sólido as mesmas tendem a se aglomerar reduzindo a sua atividade catalítica.3,16 Entre as nanopartículas metálicas, as nanopartículas de ouro (AuNPs) têm atraído muito interesse devido às suas propriedades ópticas e eletrônicas que favorecem seu emprego em diversas áreas como na catálise, fabricaçao de sensores e aplicaçoes biomédicas.10 Neste sentido, Yue e colaboradores17 demostraram a síntese de nano-compósitos baseados em β-FeOOH (fase akaganeíta) e nanopartículas de ouro (AuNPs) para a detecçao de traços de melanina em soluçao aquosa. Neste estudo foi observado que as nanopartículas de ouro foram adsorvidas na superfície do suporte β-FeOOH devido às intensas interaçoes entre a hidroxilas superficiais do hospedeiro inorgânico com a superfície das AuNPs. Uma aplicaçao interessante para estudar a estabilidade e atividade catalítica de nanopartículas metálicas suportadas em óxidos inorgânicos é a reduçao catalítica de 4-nitrofenol a 4-aminofenol usando borohidreto de sódio (NaBH4) como agente redutor em soluçao aquosa.5,18,19 Esta reaçao é facilmente monitorada pela espectroscopia óptica de absorçao molecular na regiao do UV-vis. Embora este modelo de reaçao catalisada por nanopartículas metálicas seja muito bem entendido, ele representa uma necessidade real no mundo, uma vez que 4-NP é um poluente comum em efluentes aquosos, e seu produto reduzido, o 4-aminofenol (4-AP), é um precursor orgânico muito usado em diferentes reaçoes químicas. Esta reaçao demonstra a transformaçao de nitroaromáticos em anilinas funcionalizadas, as quais apresentam significante utilidade industrial. NPs de Au, Ag, Pt e Pd sao ativas cataliticamente para esta reaçao de reduçao de compostos nitrogenados orgânicos.5,14,19 Recentemente, Damasceno e colaboradores20 ocluíram nanopartículas de ouro e de paládio e suas nanoligas (AuPd) nos canais mesoporosos da sílica SBA-15. Estes materiais híbridos foram empregados como catalisadores para a reduçao de 4-NP a 4-AP na presença de NaBH4. De acordo com os estudos observados por estes autores, foi vista uma correlaçao entre a atividade catalítica e a quantidade de paládio inserida nas nanoligas de AuPd depositadas no suporte SBA-15, ou seja, a medida que o teor de NPs de paládio aumentou nas ligas (AuPd), a atividade catalítica dos híbridos AuPd/SBA-15 também foi aumentada. Estes resultados indicaram que a reduçao de 4-NP pode ser facilmente controlada através dos constituintes presentes na liga AuPd nos catalisadores AuPd/SBA-15. Ainda em relaçao às nanopartículas metálicas, elas também têm sido depositadas na superfície de materiais magnéticos (como por exemplo, Fe3O4 ou Fe2O3) para aplicaçoes catalíticas em diversas reaçoes orgânicas, como pode ser visto no excelente artigo de revisao publicado recentemente por Rossi e colaboradores.21 Uma estratégia muito empregada na literatura têm sido a preparaçao de caroços magnéticos revestidos superficialmente com sílica (SiO2).21,22 Como a superfície da sílica é facilmente funcionalizada, grupos funcionais podem ser ligados covalentemente em sua estrutura permitindo, em uma etapa posterior, a deposiçao de íons metálicos seguida por sua reduçao para a formaçao das NPs metálicas.21,22 Woo e Park23 depositaram AuNPs na superfície de microesferas de magnetita (Fe3O4) revestidas com sílica e polímeros orgânicos. A atividade catalítica das AuNPs nestes híbridos (Fe3O4@SiO2@Polímero@AuNPs) foi empregada para a reaçao de hidrogenaçao do 4-NP a 4-AP, na qual os catalisadores foram facilmente separados do meio reacional usando separaçao magnética. Fe3O4 revestida com SiO2 (Fe3O4@SiO2) foi também usada para a preparaçao de compostos híbridos contendo quitosona e nanopartículas de prata (AgNPs), como demostrado por Wang e colaboradores.24 As AgNPs mostraram atividade catalítica para a hidrogenaçao do 4-NP a 4-AP na presença de NaBH4, na qual, de acordo com estes autores, a reduçao total do 4-NP aconteceu em aproximadamente 3 min de reaçao. Walker e Zaleski25 também demostraram a preparaçao de híbridos multifuncionais feitos de Fe3O4@SiO2-M, em que M se refere às nanopartículas de ouro, prata e paládio para a reduçao catalítica de 4-nitrofenol. Baseando-se nestes estudos, pode-se concluir que o grande interesse nas fases de oxihidróxido de ferro (III) é que elas podem ser usadas como precursoras para a obtençao de óxidos de ferro quimicamente e termodinamicamente mais estáveis a temperaturas ambientes como, por exemplo, a hematita (Fe2O3).8,17,26 Outra vantagem associada ao uso destes materiais, em relaçao às fases dos óxidos de ferro, é que defeitos superficiais ou poros estruturais podem facilmente existir ou serem criados com maior facilidade na superfície do FeOOH, tornando-a mais reativa e atrativa para o confinamento de átomos, moléculas ou nanopartículas em sua superfície.17,26 Sendo assim, a facilidade da preparaçao sintética de híbridos baseados em NPs metálicas/FeOOH faz com que eles se tornem atraentes precursores para a preparaçao de óxidos de ferro (III) decorados com nanopartículas metálicas através de um simples tratamento térmico.17,29 Neste sentido, com a intençao em preparar catalisadores híbridos, é demonstrado neste estudo uma rotina simples e fácil para a preparaçao de oxihidróxido de ferro (III) (δ-FeOOH) decorado com nanoparticulas de ouro metálico (AuNPs) via um método de reduçao in situ em condiçoes brandas de síntese. Esta estratégia pode também ser aplicada a outras NPs como Ag e Pt, ou partículas bimetálicas (como exemplo, AgAu e AuPt). A intençao em depositar as AuNPs na superfície do δ-FeOOH é devido à banda ressonante plasmônica que as mesmas apresentam na regiao do visível e às suas propriedades catalíticas.16,27 Portanto, inicialmente os materiais híbridos AuNPs/FeOOH foram preparados e caracterizados estruturalmente e espectroscopicamente, e medidas de difraçao de raios X (DRX) e imagens de microscopia eletrônica de varredura (MEV), bem como medidas de absorçao na regiao do UV-vis e infravermelho demonstraram a formaçao das NPs de ouro e sua deposiçao na superfície do FeOOH. Em seguida, a atividade catalítica das NPs de Au nos híbridos (AuNPs/FeOOH) foi também avaliada usando a reduçao do 4-NP a 4-AP na presença de NaBH4 à temperatura ambiente.
PARTE EXPERIMENTAL Materiais Os materiais utilizados neste trabalho foram: sulfato ferroso amoniacal (Fe(SO4)(NH4).6H2O), hidróxido de sódio (NaOH), peróxido de hidrogênio (H2O2), ácido tetracloroaurato (III) (HAuCl4), borohidreto de sódio (NaBH4), 4-nitrofenol e água destilada. Síntese das nanopartículas de δ-FeOOH Inicialmente, foi preparada uma soluçao de sulfato ferroso amoniacal (Fe(SO4)(NH4).6H2O) (0,028 g mL-1). Em um banho de ultrassom, gotejaram-se nesta soluçao 100 mL de uma soluçao de hidróxido de sódio (2 mol L-1), produzindo um precipitado verde.9,12 Em seguida, foi adicionado rapidamente 2,5 mL de peróxido de hidrogênio (H2O2) 30% sob agitaçao constante. Imediatamente foi produzido um precipitado marrom avermelhado característico do δ-FeOOH, que foi separado por centrifugaçao, lavado com água destilada e álcool etílico e seco em temperatura ambiente em dessecador. O material obtido nesta etapa foi nomeado como FeOOH. Síntese dos nanohíbridos de AuNPs/FeOOH Os híbridos AuNPs/FeOOH foram sintetizados empregando diferentes quantidades de ouro. Em uma síntese típica: 300 mg de FeOOH foram dispersos em 20 mL de uma soluçao etanólica de HAuCl4. A suspensao foi mantida em agitaçao por cerca de 1 h. Em seguida, foram adicionados 5,0 mL de uma soluçao de NaBH4 (0,01 mol L-1) como agente redutor para reduzir os íons Au3+ à AuNPs na superfície do δ-FeOOH. Esta mistura ficou em agitaçao por cerca de 18 h em temperatura ambiente. Após este período, o sólido foi separado por centrifugaçao, lavado com água destilada e álcool etílico e seco à temperatura ambiente. Foram utilizadas diferentes concentraçoes da soluçao etanólica de HAuCl4: 2,5x10-3 mol L-3 para o híbrido AuNPs(1)/FeOOH e 5,0x10-3 mol L-1 para o híbrido AuNPs(2)/FeOOH. Caracterizaçao dos materiais A fim de se obter informaçoes sobre a estrutura cristalina dos materiais, foram realizadas medidas de difraçao de raios X (DRX) via método do pó depositando as amostras sólidas em porta amostra de vidro. Os difratogramas foram obtidos em um difratômetro modelo D8 Advance Bruker com fonte de radiaçao de cobre Cu (Kα = 1,5418 Å), com tensao de 40 kV e corrente de 40 mA. Os dados foram coletados na faixa de 20-70° 2θ em intervalo de 0,01° e velocidade de 4 ° min-1. Para analisar as propriedades ópticas dos materiais foram obtidos espectros de absorçao molecular na regiao do ultravioleta e do visível (UV-vis) no modo de refletância difusa. Os espectros UV-vis foram registrados em um espectrômetro modelo Cary 50 acoplado com uma esfera de integraçao usando BaSO4 como referência. A morfologia dos nanocompósitos foi estudada através das técnicas de microscopia eletrônica de varredura. Os espectros de absorçao na regiao do infravermelho com transformada de Fourier (FTIR) das amostras em KBr foram registrados na faixa de 4.000 a 400 cm-1 em um espectrômetro Nicolet 6700. As imagens de MEV foram obtidas usando um microscópio eletrônico de varredura de alta resoluçao modelo JEOL-2010. As amostras foram dispersas em isopropanol, sonicadas por 30 min e depositadas em um porta-amostra metálico. Avaliaçao da atividade catalítica A atividade catalítica das nanopartículas de ouro nos híbridos (AuNPs/FeOOH) foi realizada através da reaçao de reduçao do 4-NP na presença de NaBH4 em temperatura ambiente. Para isto, um excesso de NaBH4 (0,5 mL; 33,4 g L-1) foi adicionado a 10 mL de uma soluçao aquosa de 4-NP 0,21 g L-1 sob constante agitaçao. Após a mudança de coloraçao da soluçao, de amarelo claro a amarelo escuro, adicionaram-se 10 mg do catalisador. A conversao de 4-NP a 4-AP foi monitorada espectrofotometricamente através de medidas de absorçao molecular obtidas na faixa de 200-800 nm em um espectrofotômetro UV-vis modelo Varian Cary 50. Modelos cinéticos para a reduçao do 4-nitrofenol na presença dos catalisadores foram empregados para descrever o progresso da reaçao catalítica.3,5
RESULTADOS E DISCUSSOES Caracterizaçao estrutural e espectroscópica dos híbridos AuNPs/FeOOH As fases cristalinas do FeOOH e de seus híbridos (AuNPs/FeOOH) foram estudadas, primeiramente, pela técnica de difraçao de raios X. Através da técnica de DRX, as fases cristalinas do oxihidróxido de ferro (III) podem ser facilmente identificadas.28 Os difratogramas do FeOOH e do material após a deposiçao das nanopartículas de ouro estao apresentados na Figura 1. Para o suporte FeOOH é observado picos de difraçao a 2θ em 35 °; 40,5°; 54° e 63°, os quais podem ser atribuídos aos planos de difraçao (100), (101), (102) e (110) característicos da fase ferroxiíta (δ-FeOOH) do oxihidróxido de ferro (III) (JCPDS N° 13-0087).9,12 Ainda, de acordo com o perfil de DRX, os parâmetros de rede para o δ-FeOOH podem ser indexados a rede hexagonal (HC) com a = b = 2.95 Å e c = 4.43 Å (JCPDS N° 13-0087).7,9 Para o material híbrido AuNPs(2)/FeOOH podem ser vistos picos de difraçao a 2θ = 36°; 40,5°; 54° e 63°, correspondentes aos planos de difraçao da fase de δ-FeOOH, ao passo que novos picos de difraçao aparecem a 2θ = 38°, 44° e 64°, que podem ser indexados às reflexoes de Bragg (111), (200) e (220) (JCPDS N° 04-0784), respectivamente, relacionadas à fase cúbica de face centrada das nanopartículas de ouro depositadas na superfície do oxihidróxido de ferro (III).16 Usando a equaçao de Scherrer, o diâmetro médio estimado para as nanopartículas de ouro nesse material foi de 16 nm, consistente com o diâmetro médio observado pelas imagens de microscopia (veja discussao mais adiante). Estes resultados também indicaram que as AuNPs foram depositadas na superfície do δ-FeOOH e que as mesmas nao perturbam a estrutura cristalina do suporte inorgânico, como já observado também no trabalho recentemente publicado por Yue e colaboradores.17
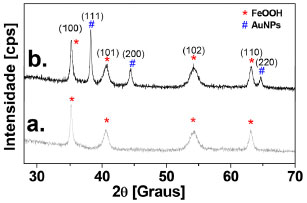 Figura 1. Difratogramas de raios X (a) do suporte δ-FeOOH e de seu híbrido (b) AuNPs(2)/FeOOH . Os símbolos (*) e (#) referem-se aos planos de difraçao das fases do δ-FeOOH e do ouro metálico, respectivamente
As imagens de MEV mostraram que o suporte δ-FeOOH foi sintetizado na forma de nanoplacas (Figura 2a), característico para materiais com a fase ferroxiíta (δ-FeOOH).29,30 Para o composto híbrido AuNPs(2)/FeOOH (Figura 2b-c), pode ser observada a presença de placas de δ-FeOOH decoradas com "pontos" esféricos superficiais atribuídos às AuNPs depositadas em sua superfície. A morfologia esférica das nanopartículas de ouro adsorvidas na superfície do δ-FeOOH foi também confirmada através da imagem MEV de alta resoluçao (veja Figura 2c). O espectro EDS-MEV e a distribuiçao atômica na superfície do híbrido AuNPs(2)/FeOOH mostrou que o mesmo possui em sua composiçao química ferro e ouro (veja Figura 1S no Material Suplementar).
 Figura 2. Imagens de microscopia eletrônica de varredura do suporte (a) δ‑FeOOH e do híbrido Au(2)/FeOOH em (b) baixa resoluçao (barra de escala: 500 nm) e (c) alta resoluçao (barra de escala: 200 nm)
As vibraçoes a curta distância dos materiais produzidos neste estudo foram investigadas usando a espectroscopia de absorçao na regiao do infravermelho. A Figura 3 mostra os espectros FTIR do δ-FeOOH e de seus híbridos. O espectro do δ-FeOOH (Figura 3a) exibiu uma banda, com alta intensidade relativa e alargada, na regiao de 3260 cm-1, devido aos modos de estiramento de moléculas de água fissiosorvidas em sua superfície. A banda a 3130 cm-1 pode ser atribuída à hidroxila superficial do FeOOH.8,31 Para os materiais híbridos (Figura 3b-c), a inserçao das nanopartículas de ouro promoveu a supressao da banda em 3130 cm-1 e, ao mesmo tempo, o surgimento de uma banda em 2900 cm-1 com intensificaçao da banda em 3260 cm-1. Estas bandas sao relacionadas ao estiramento (-OH), indicando a presença de moléculas de água adsorvidas na superfície dos híbridos.8,31,32 De acordo com Villalba e colaboradores,32 o alargamento desta banda pode ser também um indicativo de que nao há diferenciaçao entre as vibraçoes das hidroxilas superficiais (-OH livres) e das hidroxilas no material como um todo (material "bulk") (-OH com ligaçoes de hidrogênio intermolecular). Isto é uma possível evidência de que há uma interaçao entre as hidroxilas superficiais do δ-FeOOH e as NPs de ouro nos materiais híbridos. Ainda em relaçao ao espectro do δ-FeOOH puro, pode ser visto duas bandas a 1150 cm-1 e 890 cm-1 que correspondem às vibraçoes das ligaçoes Fe-O-OH.8,33 As bandas de transmitância na regiao de 500 a 780 cm-1 sao características das ligaçoes Fe-O.22,23 De acordo com a literatura,8,22,23 a banda próxima a 600 cm-1 é atribuída às vibraçoes de estiramento da ligaçao Fe-O de íons Fe(III) ocupando sítios tetraédricos; e a banda a 440 cm-1 pode ser afixada às vibraçoes de estiramento de Fe-O de íons Fe(III) ocupando os sítios octaédricos da rede. As bandas em 780 e 892 cm-1 (Figura 3a) podem ser afixadas aos modos de vibraçao da δ(OH) no plano e fora do plano do δ-FeOOH, respectivamente. Estas mesmas bandas discutidas acima estao deslocadas para mais alta energia nos materiais híbridos (Figura 3b-c). De acordo com Pedrosa e colaboradores,8 os deslocamentos nestas bandas podem ser devido a efeitos de cristalinidade, agregaçao das partículas e diferença na forma das mesmas que compoe a rede.
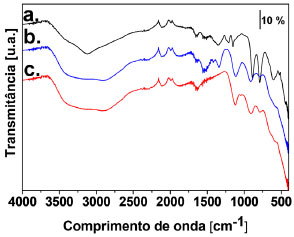 Figura 3. Espectros FTIR para o (a) δ-FeOOH e os seus híbridos (b) Au(1)/FeOOH e (c) Au(2)/FeOOH
Foram realizadas também medidas de espectroscopia de absorçao molecular na regiao do UV-Vis a fim de obter as características ópticas dos materiais. Tanto o δ-FeOOH quanto os híbridos (AuNPs/FeOOH) apresentaram uma banda de absorçao alargada na regiao de 350-750 nm, associada às transiçoes eletrônicas de campo ligante dos íons Fe(III) no FeOOH devido ao acoplamento de cátions Fe(III) adjacentes na estrutura deste oxihidróxido (Figura 4a).34 As bandas de absorçao na regiao de 290 a 400 nm podem ser atribuídas às transiçoes do tipo 6A1g → 4T1g (4P) e 6A1g → 4E (4D). A forte absorçao na regiao próxima a 530 nm pode ser associada às transiçoes do campo ligante 6A1g → 4Eg, 4A1g (4G). Bandas de transiçoes d-d (6A1 → 4T1) dos íons Fe(III) podem ser vistas na regiao de 800 - 1000 nm para o material FeOOH.32 Foi obtido também o espectro UV-vis dos híbridos AuNPs/FeOOH usando o suporte (FeOOH) como branco (Figura 4b). Nos espectros dos híbridos pode ser observada uma banda em torno de 560 nm que foi atribuída à banda de ressonância plasmônica das AuNPs com morfologia esférica.15,16,17,35 Portanto, estes resultados corroboram com as imagens MEV dos híbridos, indicando que as AuNPs com morfologia esférica foram depositadas na superfície do suporte inorgânico δ-FeOOH. Deve ser também enfatizado que os espectros da Figura 4b (após a subtraçao do suporte FeOOH) sao ligeiramente distintos das curvas da Figura 4a (usando BaSO4 como referência), o que pode ser devido à presença das AuNPs e/ou, também, aos efeitos de cristalinidade e tamanho das partículas nas diferentes amostras.8 Além disso, é importante salientar que estes compostos híbridos possuem grande capacidade de absorçao de luz na regiao do visível do espectro eletromagnético, sendo interessantes materiais para aplicaçoes em fotocatálise heterogênea ativada por luz solar natural.36
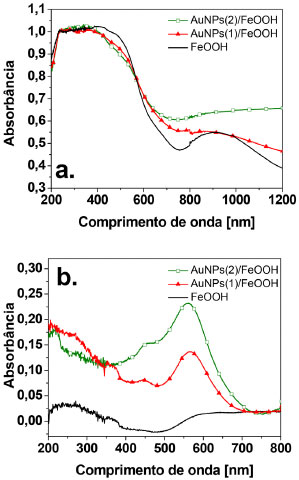 Figura 4. (a) e (b) Espectros de absorçao na regiao do UV-vis-NIR das amostras de δ-FeOOH e de seus híbridos AuNPs/FeOOH. O espectro da Figura 4b foi feito usando o FeOOH como branco
Reduçao catalítica do 4-nitrofenol pelos híbridos AuNPs/FeOOH A atividade das nanopartículas de ouro adsorvidas no δ-FeOOH foi investigada usando a reduçao do composto 4-NP a 4-AP na presença de NaBH4. A Figura 5a apresenta o espectro UV-vis da soluçao de 4-NP antes da adiçao do NaBH4, onde pode ser visto uma banda centrada a 317 nm associada às transiçoes eletrônicas π → π* do anel aromático do 4-nitrofenol. Após a adiçao de borohidreto de sódio, esta banda é deslocada para a regiao do vermelho em 400 nm devido à formaçao do complexo nitrofenolato.3,5, 8,18 Esta banda foi usada para monitorar a reduçao do 4-NP a 4-AP. Sem a adiçao do catalisador essa banda permanece inalterada por dias indicando que a reduçao do composto 4-NP nao é cineticamente favorável. Após a adiçao dos catalisadores AuNPs/FeOOH (Figura 5a-b), rapidamente esta banda é diminuída e, consequentemente, uma nova banda aparece em 298 nm indicando a formaçao do 4-aminofenol.3,5,18 Isto evidencia que as AuNPs nos híbridos estao atuando como catalisadores para a reduçao do 4-NP a 4-AP. A reduçao do 4-NP é completada em torno de 8 e 5 minutos para os catalisadores AuNPs(1)/FeOOH e AuNP(2)/FeOOH, respectivamente. Estes resultados mostraram que o aumento das AuNPs acelera a reduçao do composto nitrofenólico, como já observado nos trabalhos de Naik e colaboradores,37 que impregnaram NPs de prata nos canais de sílica mesoporosa do tipo SBA-15 para a reduçao de compostos nitrofenólicos. Nenhuma reduçao catalítica foi observada na presença apenas do suporte δ-FeOOH puro, indicando que a atividade catalítica pode ser atribuída exclusivamente as nanopartículas de ouro.3,20,24,25 Portanto, o uso do δ-FeOOH como suporte para a deposiçao de nanopartículas de ouro abre novas perspectivas para o emprego destes materiais como precursores para a produçao de híbridos multifuncionais baseados em óxidos de ferro (III) decorados com nanopartículas metálicas através do tratamento térmico dos catalisadores AuNPs/FeOOH.17,26
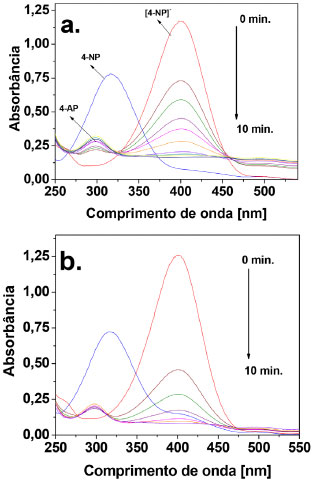 Figura 5 Espectro de absorçao UV-vis do 4-NP (curva azul) seguido da adiçao de NaBH4 e consequente formaçao do íon 4-nitrofenolato (curva vermelha). As demais medidas foram feitas em intervalos de 1 minuto para acompanhar a reduçao do 4-NP utilizando os catalisadores (a) AuNPs(1)/FeOOH e (b) AuNPs(2)/FeOOH. Na Figura, 4-NP refere-se à banda do 4-nitrofenol, 4-AP refere-se à banda do 4-aminofenol e [4-NP]- refere-se à banda do íon nitrofenolato
A cinética da reaçao pode ser facilmente obtida através dos espectros de absorçao UV-vis dependentes do tempo (Figura 6). Como a concentraçao de NaBH4 é muito alta comparada ao 4-NP, pode ser assumido que a reaçao segue uma cinética de pseudo-primeira ordem.3,5,18 A constante de reaçao de pseudo-primeira ordem (k) para esta reduçao pode ser fornecida pela equaçao abaixo: 
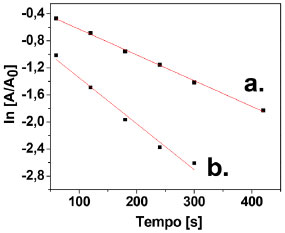 Figura 6. Gráficos da cinética de pseudo-primeira ordem para a reaçao de reduçao do 4-nitrofenol na presença dos catalisadores (a) AuNP(1)/FeOOH e (b) AuNPs(2)/FeOOH
em que At e A0 sao os valores das absorbâncias do 4-NP nos diferentes intervalos de tempos (t) e no início da reaçao (t0), respectivamente. O gráfico de ln(At/A0) versus tempo foi linear na presença dos catalisadores AuNPs/FeOOH (Figura 6), obtendo-se uma constante de velocidade (k) de 3,81 x 10-3 s-1 (R2 = 0,9979) e 6,79 x 10-3 s-1 (R2 = 0,9806) para os híbridos AuNPs(1)/FeOOH e AuNPs(2)/FeOOH, respectivamente. Estes resultados estao de acordo com o trabalho recentemente realizado por Walker e Zaleski,38 que encontraram uma constante de velocidade de 4,41 x 10-3 s-1 para a magnetita (Fe3O4) decorada com AuNPs. Também foi calculada a frequência de turnover (TOF) para a reaçao de reduçao do 4-NP utilizando os híbridos AuNPs/FeOOH como catalisadores. Os valores de TOF foram facilmente obtidos através da equaçao3 2.  Em que [C0] corresponde à concentraçao inicial de 4-nitrofenol em mols, [Ct] é referente à concentraçao de 4-nitrofenol no tempo t (t = 5 min de reaçao) e [Au] é a quantidade de AuNPs em mols no catalisador. TOF's de 44,9 e 29,9 h-1 foram obtidos para os catalisadores AuNPs(1)/FeOOH e AuNPs(2)/FeOOH, respectivamente. Estes valores de TOF indicaram que os catalisadores apresentam alta atividade catalítica para a reduçao do 4-NP a 4-AP devido à presença das AuNPs na superfície do FeOOH.3,5,37 Os resultados obtidos neste estudo estao de acordo com os estudos experimentais usando catalisadores híbridos (por exemplo: NPs de níquel suportadas em carbono39 e NPs de ouro adsorvidas em dendrímeros)40 para a reduçao catalítica de 4-NP apresentados na literatura.
CONCLUSOES Materiais híbridos baseados em nanopartículas de ouro e oxihidróxido de ferro (III) foram preparados e caracterizados neste estudo. As nanopartículas de ouro foram depositadas na superfície do δ-FeOOH como observado pelos dados de difraçao de raios X. Medidas de absorçao molecular UV-vis e imagens de microscopia eletrônica também corroboraram com os dados de DRX, indicando que as NPs de ouro possuem morfologia esférica e que elas estao adsorvidas na superfície do suporte inorgânico. Os híbridos AuNPs/FeOOH foram também empregados como catalisadores na hidrogenaçao catalítica do poluente orgânico ambiental 4-NP a 4-AP na presença de NaBH4 à temperatura ambiente. A atividade catalítica nos híbridos é aumentada com o aumento da quantidade de NPs de ouro nos catalisadores devido ao aumento da velocidade de reaçao. Nas condiçoes reacionais estudadas, a reduçao total do 4-NP ocorreu em torno de 4 min e 8 min para os catalisadores AuNPs(2)/FeOOH e AuNP(1)/FeOOH, respectivamente. Além disso, os materiais híbridos produzidos contendo as fases de FeOOH e nanopartículas metálicas podem ser interessantes precursores para a preparaçao de novas nanoestruturas de óxido de ferro decorados com NPs metálicas. Estes compostos podem também ser interessantes materiais para o uso em fotocatálise heterogênea ativada por luz solar devida à alta capacidade de absorçao de luz da fase δ-FeOOH na regiao do visível do espectro eletromagnético.
MATERIAL SUPLEMENTAR Figura 1S do Material Suplementar apresenta o espectro EDS‑MEV mostrando a distribuiçao de átomos na superfície do híbrido AuNPs(2)/FeOOH: (a) área selecionada e mapas de distribuiçao do (b) ferro (Fe-K), (d) ouro (Au-K) e (d) oxigênio (O-K); e (e) o espectro EDS-MEV.
AGRADECIMENTOS CKSA e EAR agradecem ao CNPq e à Capes pelas bolsas concedidas. Os autores também agradecem à Fundaçao de Amparo à Pesquisa ao Estado de Mato Grosso (FAPEMAT, Processo N°. 222535/2015), ao Estado de Minas Gerais (FAPEMIG), e ao CNPq pelo apoio financeiro que fomentou essa pesquisa.
REFERENCIAS 1. Chang, Y. C.; Chen, D. H.; J. Hazard. Mater. 2009, 165, 664. 2. Zheng, Y.; Shu, J.; Wang, Z.; Mater. Lett. 2015, 158, 339. 3. Quites, F. J.; Azevedo, C. K. S.; Alves, E. P. P.; Germino, J. C.; Vinhas, R. C. G.; Landers, R.; Terezo, A. J.; Atvars, T. D. Z.; J. Braz. Chem. Soc. 2017, 28, 106. 4. Borah, B. J.; Bharali, P.; J. Mol. Catal. A: Chem. 2014, 390, 29. 5. Zhao, P.; Fenga, X.; Huanga, D.; Yanga, G.; Astruc, D.; Coord. Chem. Rev. 2015, 287, 114. 6. Camargo, P. H.; Satyanarayana, K. G.; Wypych, F.; Mater. Res. 2009, 12, 1. 7. Chen, Y.; Zeng, D.; Zhang, K.; Lu, A.; Wang, L.; Peng, D. L.; Nanoscale 2014, 6. 8. Pedrosa. J.; Costa, B. F.; Portugal, A.; Duraes, L.; Mater. Chem. Phys. 2015, 163, 88. 9. Corrêa, S.; Lacerda, L. C. T.; Pires, M. S.; Rocha, M. V. J.; Nogueira, F. G. E.; da Silva, A. C.; Pereira, M. C.; de Brito, A. D. B.; da Cunha, E. F. F.; Ramalho, T. C.; J. Nanomaterials 2016, 2462135. 10. Lima, L. V. C.; Rodriguez, M.; Freitas, V. A. A.; Souza, T. E.; Machado, A. E. H.; Patrocínio, A. O. T.; Fabris, J. D., Oliveira, L. C. A.; Pereira, M. C.; Appl. Catal., B 2015, 165, 579. 11. Chen, P.; Xu, K.; Li, X.; Guo, Y.; Zhou, D.; Zhao, J.; Wu, X.; Wu, C.; Xie, Y.; Chem. Sci. 2014, 5, 2251. 12. Pereira, M. C.; Garcia, E. M.; Silva, A. C.; Lorençon, E.; Ardisson, J. D.; Murad, E.; Fabris, J. D.; Matencio, T.; Ramalho, T. C.; Rocha, M. V. J.; J. Mater. Chem. 2011, 21, 10280. 13. Silva, A. C.; Almeida, M. R.; Rodriguez, M.; Machado, A. R. T.; Oliveira, L. C. A.; Pereira, M. C.; J. Photochem. Photobiol. A: Chem. 2017, 332, 54. 14. Silva, M. F.; Pineda, E. A. G.; Bergamasco, R.; Quim. Nova 2015, 38, 393. 15. Liang, Y. N.; Li, Y.; Ang, C.; Shen, Y.; Chi, D.; Hu, X.; ACS Appl. Mater. Interfaces 2014, 6, 12406. 16. Massola, B. C. P.; Souza, N. M. P.; Stachack, F. F. F.; Oliveira, E. W. R. S.; Germino, J. C.; Terezo, A. J.; Quites, F. J.; Mater. Chem. Phys. 2015, 167, 152. 17. Yue, J.; Jiang, X.; Kaneti, Y. V.; Yu, A.; J. Colloid Interface Sci. 2012, 367, 204. 18. Tang, M.; Huang, G.; Li, X.; Pang, X.; Qiu, H.; Mater. Chem. Phys. 2015, 162, 31. 19. Silva, A. G. M.; Rodrigues, T. S.; Macedo, A.; Silva, R. T. P.; Camargo, P H. C.; Quim. Nova 2014, 37, 1716. 20. Damasceno, J. P. V.; Maroneze, C. M.; Strauss, M.; Sigoli, F. A.; Mazali, I. O.; New. J. Chem. 2016, 40, 6636. 21. Rossi, L. M.; Costa, N. J. S.; Silva, F. P.; Gonçalves, R. V.; Nanotechnology Rev. 2013, 2, 597. 22. Rossi, L. M.; Costa, N. J. S.; Silva, F. P.; Wojcieszak, R.; Green Chem. 2014, 16, 2906. 23. Woo, H.; Park, K. H.; Catal. Commun. 2014, 46, 133. 24. Wang, Z. Z.; Zhai1, S. R.; Zhai, B.; An, Q. D.; Li, S. W.; J. Sol-Gel Sci. Technol. 2015, 75, 680. 25. Walker, J. M.; Zaleski, J. M.; Nanoscale 2016, 8, 1535. 26. Guoa, X.; Liua, Q.; Wanga, L.; Huanga, H.; Yanga, D.; Cheng, M. L.; Mater. Sci. Eng. B 2012, 177, 321. 27. Bian, Z.; Tachikawa, T.; Zhang, P.; Fujitsuka, M.; Majima, T.; J. Am. Chem. Soc. 2014, 136, 458. 28. Wu, S.; Lu, J.; Ding, Z.; Li, N.; Fu, F.; Tang, B.; RSC Adv. 2016, 6, 82118. 29. Wang, Y-H.; Chen, K-C.; Int. J. Environ. Res. Public Health 2014, 11, 9325. 30. Marinho, J. Z.; Montes, R. H. O.; de Moura, A. P.; Longo, E.; Varela, J. A.; Munoz, R. A. A.; Lima, R. C.; Mater. Res. Bull. 2014, 49, 572. 31. Maiti, D.; Manju, U.; Velaga, S.; Devi, P. S.; Cryst. Growth Des. 2013, 13, 3637. 32. Villalba, J. C.; Constantino, V. R. L.; Anaissi, F. J.; J. Colloid Interface Sci. 2010, 349, 49. 33. Carlson, L.; Schwertmann, U.; Clay Minerals Soc. 1980, 28, 272. 34. Martin, T. P.; Merlin, R.; Huffman, D. R.; Cardona, M.; Solid State Commun. 1977, 22, 565. 35. Hamdy, M. S.; Micropor. Mesopor. Mater. 2016, 220, 81. 36. Oliveira, L. C. A.; Fabris, J. D.; Pereira, M. C.; Quim. Nova 2013, 36, 123. 37. Naik, B.; Hazra, S.; Prasad, V. S.; Ghosh, N. N.; Catal. Commun. 2011, 12, 1104. 38. Walker, J. M.; Zaleski, J. M.; Nanoscale, 2016, 8, 1535. 39. Xia, J.; He, G.; Zhang, L.; Sun, X.; Wang, X.; Appl. Catal. B: Environ. 2016, 180, 408. 40. Nemanashi, M.; Meijboom, R.; J. Colloid Interface Sci. 2013, 389, 260. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access





