Revisão
|
|
| Polimerossomos versus lipossomos: a evolução da "bala mágica" Polymersomes versus liposomes: the "magic bullet" evolution |
|
Alexsandra Conceiçao Apolinário; Juliana de Almeida Pachioni-Vasconcelos; Adalberto Pessoa Jr.; Carlota de Oliveira Rangel-Yagui*
Departamento de Tecnologia Bioquímico-Farmacêutica, Faculdade de Ciências Farmacêuticas, Universidade de São Paulo, Av. Prof. Lineu Prestes, 580 - Bloco 16, Cidade Universitária, 05508-000 São Paulo - SP, Brasil Recebido em 29/12/2016 *e-mail: corangel@usp.br Polymeric vesicles known as polymersomes are formed by the self-assemble of amphiphilic block copolymers and have structural organization similar to liposomes. However, polymersomes present higher physicochemical stability and structure versatility due to their polymeric nature. In this review we describe the main aspects related to the structure and applications of these systems for drug delivery. INTRODUÇAO As pesquisas com sistemas de liberaçao de fármacos e biofármacos a partir de nanoestruturas têm revolucionado as ciências farmacêuticas no mundo todo.1,2 Estes nanocarreadores (NC) têm propriedades peculiares relacionadas ao tamanho em escala nanométrica e área superficial aumentada, o que lhes confere potencial para modular características farmacocinéticas e farmacodinâmicas de fármacos. Portanto, sao capazes de melhorar a estabilidade in vitro e in vivo de fármacos, prolongar o tempo de circulaçao sanguínea e permitir a liberaçao controlada e direcionada.3,4 Devido às vantagens dos NC, a cada dia estudos descrevem novas possibilidades de aperfeiçoar ainda mais estes sistemas e percebe-se uma evoluçao constante no campo da nanotecnologia aplicada a produtos farmacêuticos, especialmente na oncologia. As pesquisas relatam NC amplamente usados como nanopartículas poliméricas, nanopartículas lipídicas sólidas, nanopartículas metálicas e lipossomos (LP), com diferentes abordagens referentes à composiçao, inovaçoes na técnica de produçao e alternativas para liberaçao sítio-dirigida, de modo que haja aprimoramento funcional do produto final.5-9 Um exemplo bastante atual de inovaçao em nanocarreadores sao as vesículas poliméricas, descritas inicialmente em 1981 por Kunitake e colaboradores10 e em 1995 estudadas com maior embasamento físico-químico por Zhang & Eisenberg.11 Posteriormente, essas vesículas foram denominadas polimerossomos (PL) por Discher e colaboradores,12 uma vez que apresentam organizaçao estrutural semelhante aos LP. PL podem ser conceituados como nanocarreadores supramoleculares poliméricos com estrutura vesicular. Enquanto LP sao vesículas de interior aquoso compostas por uma membrana lipídica, os PL, que também apresentam interior aquoso, sao compostos por uma membrana de copolímeros anfifílicos. Para compreender a importância dos PL, é válido reforçar que sao morfologicamente análogos aos LP, os quais estao entre os NC mais empregados no campo farmacêutico e foram relatados pioneiramente nos anos 60 por Bangham e seus colaboradores, que descreveram estruturas vesiculares organizadas em bicamadas originadas por fosfolipídeos em soluçoes aquosas.13 Após estudos iniciais com LPs, percebeu-se que estes nanocarreadores poderiam se encaixar no conceito proposto por Paul Ehrlich conhecido por "Bala Mágica" ou do inglês "Magic Bullet", conceito descrito em um artigo publicado pela Química Nova em 2002 intitulado"Lipossomas: a bala mágica acertou?".14 De acordo com Ehrlich, deveriam haver compostos, e aqui extrapolamos para nanoestruturas, capazes de atingir o alvo biológico sem causar danos ao organismo. Quase 30 anos após estes estudos preliminares, em 1995, a primeira formulaçao lipossomal, Doxilr, foi aprovada pela Food and Drug Administration (FDA) para o tratamento do sarcoma de Kaposi associado à Síndrome de Imunodeficiência Adquirida (SIDA). Atualmente, estima-se que 14 novos sistemas de LP foram aprovados e cerca de 21 encontram-se em ensaios clínicos.15 No entanto, a instabilidade físico-química é a principal desvantagem inerente a este NC devido à sua natureza lipídica, o que em geral nao ocorre com os PL em razao da estrutura polimérica, que é físico-quimicamente mais estável. Portanto, estes sistemas vêm sendo empregados recentemente em diversas abordagens de estudos para drug delivery.12,16 Os conceitos envolvendo os PL abrangem desde a compreensao da estrutura e propriedades dos copolímeros anfifílicos que constituem tais NC, passando pelos métodos de produçao e caracterizaçao das vesículas, bem como as principais aplicaçoes. Neste artigo, descrevemos os principais aspectos relacionados a estes tópicos. Cabe ressaltar que nao existe ainda na literatura artigos em língua portuguesa introduzindo o conceito de polimerossomos e suas potencialidades no campo farmacêutico. Além disso, consideramos importante a divulgaçao de temas na área de nanotecnologia farmacêutica assim como fizeram antes pesquisadores brasileiros, como por exemplo Schaffazick e colaboradores,17 ao detalharem os aspectos sobre a formaçao e caracterizaçao das nanopartículas, Oliveira e colaboradores18 em 2004, quando explanaram os principais aspectos da estrutura de microemulsoes e Durán e colaboradores,19 que descreveram didaticamente a tecnologia de produçao de nanocristais de fármacos.
LIPOSSOMOS VERSUS POLIMEROSSOMOS Diante da analogia entre LP e PL, surge o questionamento sobre as diferenças, vantagens e desvantagens de um em relaçao ao outro. A relevância dos LP (Figura 1) dentro da nanotecnologia é indiscutível, sao várias aplicaçoes na área farmacêutica que incluem desde liberaçao de ativos cosméticos até fármacos anticancerígenos.20,21 Porém, as pesquisas com PL vêm ganhando espaço nas nanociências, já que sao sistemas mais estáveis fisicoquimicamente e mais resistentes mecanicamente em relaçao às vesículas lipídicas em razao das propriedades químicas dos polímeros que os constituem.22
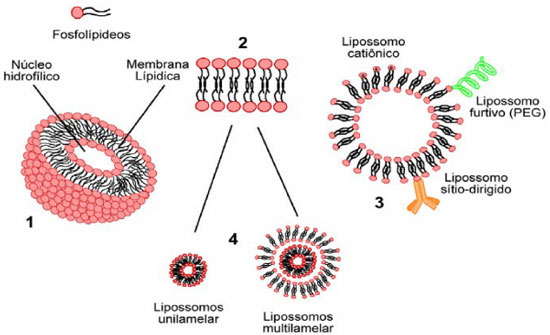 Figura 1. 1) Estrutura dos lipossomos constituídos por fosfolipídeos. 2) Bicamadas lipídicas. 3) Lipossomos com modificaçoes na superfície (peguilados, com carga e com anticorpos) 4) Tipos de lipossomos de acordo com o número de camadas
A composiçao dos LP consiste geralmente de fosfolipideos e esteróis; estes componentes, juntamente com o método de produçao, determinam as propriedades físicoquímicas destes NC.23 Algumas características dos LP como taxa de encapsulaçao, estabilidade da membrana e degradaçao sao difíceis de controlar e estes sistemas apresentam baixa versatilidade química.12 Uma outra desvantagem deste sistema diz respeito ao processo de esterilizaçao necessário às formulaçoes de uso intravenoso, que é limitado devido à susceptibilidade dos fosfolipídeos à degradaçao físico-química.24 A maior parte das pesquisas recentes com LP para drug delivery refere-se a sistemas compostos por vesículas unilamelares de 50-150 nm. Essa faixa de tamanho reflete um balanço entre eficiência de encapsulaçao (aumenta quanto maior o agregado formado), estabilidade dos LP (diminui para tamanhos superiores à faixa ótima de 80-200 nm) e habilidade em extravasar o sistema vascular (diminui com o aumento do tamanho). A espessura da membrana é de aproximadamente 4 nm. LP podem apresentar uma camada de polietielnoglicol (PEG) covalentemente ligada à superfície para evitar o reconhecimento pelos macrófagos. Nesses casos sao denominados de LP peguilados ou furtivos. Além de PEG, podem também apresentar em sua superfície ligantes com funçoes definidas, por exemplo para reconhecimento do alvo.25 A natureza lipídica torna os LP suscetíveis a processos de degradaçao como peroxidaçao lipídica, hidrólise, além da probabilidade de transiçao de fase (Tc), que é um importante parâmetro a ser avaliado para estes carreadores, já que se trata de um parâmetro que indica mudanças no estado físico da bicamada lipídica, que pode passar de uma conformaçao ordenada de gel para um estado desordenado líquido-cristalino em resposta à mudanças de temperatura.24 Esta propriedade influencia na permeabilidade, fusao, agregaçao e ligaçao à proteínas. A incorporaçao de alguns lipídeos fluidos na bicamada de lipossomos pode diminuir a Tc, aumentando sua fluidez.26 Para os PL, a instabilidade relacionada aos fenômenos de degradaçao físico-química ou mesmo mecânica diminui em razao das propriedades dos copolímeros anfifílicos que compoe estes NC. Copolímeros anfifílicos sao compostos de duas ou mais cadeias homopoliméricas distintas, covalentemente ligadas em um ou mais pontos de junçao que se auto-organizam em diferentes morfologias, incluindo micelas ou vesículas poliméricas, quando em contato com solventes, dependendo das condiçoes externas como temperatura, agitaçao e pH.27-29 Para aumentar a resistência de LPs ao trato gastrointestinal, por sua vez, eles podem ser modificados através da incorporaçao de sais biliares ou pelo desenvolvimento de LPs multilamelares.30 A estabilidade mecânica dos PL é determinada em razao da espessura da bicamada e, portanto, estes sistemas sao geralmente mais rígidos do que os LP. Os PL possuem membranas mais espessas (2-20 nm) do que os LP (3-5 nm), assim têm a vantagem de tenacidade superior e cinética de liberaçao mais lenta.29 A baixa massa molecular dos lipídeos confere fluidez na bicamada dos LP,31 enquanto que a espessura da membrana de PL pode ser controlada pela massa molecular dos copolímeros. Quanto maior a massa molecular dos copolímeros mais forte é a interaçao entre esses na bicamada formada, resultando em PL com membranas mais espessas e mais resistentes.29 Consequentemente, os PL apresentam elevada estabilidade mecânica, comportamento elástico e viscosidade de membrana elevada.31 As semelhanças entre LP e PL referem-se principalmente à morfologia vesicular, bem como aos métodos de produçao, especialmente o de hidrataçao do filme, que será discutido adiante. Ambas as estruturas sao baseadas em princípios termodinâmicos semelhantes, que implicam na formaçao espontânea de vesículas em razao das características anfifílicas dos componentes básicos (lipídeos ou copolímeros).32
COPOLIMEROS ANFIFILICOS Copolímeros anfifílicos (CA) sao análogos macromoleculares de tensoativos e lipídeos, os quais contêm duas ou mais sequências de homopolímeros quimicamente distintas quanto à polaridade e unidas por ligaçao covalente.33,34 As sequências de homopolímeros sao chamadas de blocos, por isso esses copolímeros sao denominados copolímeros dibloco (AB), tribloco (ABA) ou até multibloco, dependendo da quantidade de cadeias de homopolímeros. Assim, sao capazes formar estruturas versáteis que podem encapsular fármacos hidrofílicos e/ou hidrofóbicos. Mais de 20 morfologias já foram identificadas a partir da auto-agregaçao de CA, as quais sao termodinamicamente induzidas e/ou cineticamente controladas, destacando-se as micelas e vesículas, que serao discutidas no próximo tópico.35 Sao exemplos de copolímeros anfifílicos os copolímeros de poli(óxido de etileno)-poli(óxido de propileno)-poli(óxido de etileno), PEO-PPO-PEO; poli(óxido de etileno)-poli(ácido lático), PEO-PLA e poli(óxido de etileno)-policaprolactona (PEO-PCL). A auto-agregaçao dos copolímeros anfifílicos depende primordialmente de três parâmetros: a massa molecular média (Mw), a massa ou fraçao de volume de cada bloco (f) e a energia efetiva de interaçao entre as moléculas de copolímero.36 As propriedades físicas dos PL estao diretamente relacionadas à espessura da membrana, a qual por sua vez depende da massa molecular dos copolímeros; copolímeros anfifílicos de massa molecular mais elevada resultam em PL de membrana mais espessa, robusta e estável.37 A espessura da membrana dos PL implica diretamente nas seguintes propriedades destes sistemas: taxa de alongamento (Ka), área crítica de tensao (αc), tensao de lise (ζc) potencial de quebra (Vc), flexibilidade (Kb), difusibilidade lateral (D).29 CAs sintéticos podem apresentar considerável polidispersao, ou seja, podem conter cadeias de homopolímeros de comprimentos diferentes e, assim, a massa molecular nao apresenta um único valor. Os polímeros existem como uma distribuiçao de comprimentos de cadeia e massas moleculares. Nesse sentido, a Mw deve ser descrita como a soma da média das massas moleculares calculadas para todas as cadeias. Além da Mw, a massa molecular média em número, do inglês average molecular weight (Mn), e índice de polidispersao (PDI) devem ser analisados na escolha dos copolímeros.37 Os CAs podem ainda ser constituídos de um bloco flexível (coil) e outro rígido (rod), o qual possui capacidade limitada de esticar e se empacotar durante o processo de auto-organizaçao; esta conformaçao resulta da π-conjugaçao ao longo da cadeia do CA (Figura 2). Dessa maneira, sao classificados em copolímeros coil-coil ou rod-coil (Figura 2).38 CA do tipo rod-coil formam estruturas supramoleculares com dimensoes na escala nanométrica, que nao sao comuns em microfases formadas por copolímeros flexíveis como fases cristalinas termotrópica e liotrópicas.39 Na verdade, o bloco rod nao tem a mesma entropia conformacional do bloco coil, o que restringe a habilidade para esticar e se auto-organizar. Exemplos de copolímeros rod-coil sao estruturas de cadeia inflexível advindas de conjugaçao π (polímeros semicondutores), estruturas secundárias helicoidais (biomoléculas) ou grupos aromáticos; todos levam à adoçao de conformaçoes estendida e com cadeia rígida.40
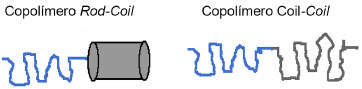 Figura 2. Copolímeros anfifílicos coil-coil e rod-coil. Blocos flexíveis repre sentados em linha e bloco rígido representado em cilindro. Blocos hidrofílicos representados em azul e blocos hidrofóbicos representados em cinza/preto
MECANISMOS DE FORMAÇAO DOS POLIMEROSSOMOS Os estudos envolvendo o processo de formaçao dos PL sao recentes. Em 1994 sugeriu-se a formaçao de estruturas vesiculares poliméricas e em 1995 foi descrita a formaçao de vesículas poliméricas a partir de CA.11,41 Desde 1999, Dennis Discher tem um sido um dos principais cientistas a estudar os PL. Além de ter descrito pela primeira vez as vesículas com tal nomenclatura, Discher também relatou diversas informaçoes sobre organizaçao conformacional, produçao e aplicaçao destas nanoestruturas. Dois mecanismos têm sido citados para explicar a formaçao dos PL: um baseado no crescimento de micelas em bicamadas que se auto-organizam em vesículas e outro também embasado no crescimento de micelas, entretanto, acrescentando o efeito de difusao de solvente para o interior das micelas e posteriormente a formaçao das vesículas.42 Desse modo, tem sido aceito que as micelas esféricas, que sao núcleos esféricos rodeados por uma corona polimérica, seriam os auto-agregados dos quais se formariam os demais tipos.35 A partir de 2005, um grupo liderado por Giuseppe Battaglia vem realizando amplos estudos na temática, nos quais descreve que CA em concentraçoes mais elevadas se auto-organizam em cristais líquidos liotrópicos e a transiçao da fase liotrópica para estruturas isotrópicas ocorre, por exemplo, com a passagem das lamelas em pilhas para estruturas fechadas (vesículas) com aumento da fase aquosa.43 Durante um período de tempo, o fenômeno de auto-agregaçao de moléculas anfifílicas foi ponto de discórdia entre cientistas da área físico-química, que aceitavam que forças físicas e a minimizaçao de energia livre no sistema levavam à agregaçao, e aqueles da área biológica, que consideravam que a geometria das moléculas resultaria no processo de auto-agregaçao.44 Atualmente, aceita-se que esse conjunto de proposiçoes se completam e explicam a auto-agregaçao. Como já mencionado, copolímeros anfifílicos se auto-agregam em meio aquoso dependendo da relaçao entre as massas moleculares dos blocos hidrofílico e hidrofóbico e da concentraçao de agregaçao crítica (CAC). Esse processo ocorre em razao do efeito hidrofóbico que demanda minimizaçao da energia livre das moléculas de água próximo à superfícies nao polares bem como da solvataçao das "cabeças hidrofílicas" do copolímero (forças de hidrataçao), podendo resultar em diversas morfologias. A quantidade crítica de água para o início da agregaçao depende dos seguintes fatores: (1) concentraçao de polímero, (2) temperatura, (3) composiçao de copolímero (estrutura química, proporçao e massa molecular de cada bloco de homopolímero) e (5) propriedades do solvente.42 A morfofologia resultante da auto agregaçao desses polímeros pode ser deduzida a partir do parâmetro crítico de empacotamento ou critical packing parameter (p) descrito na equaçao 1. Este conceito foi introduzido para moléculas anfifílicas em 1975 por Israellachvilli.45  em que: v é o volume da cadeia hidrofóbica, ao é a área da seçao transversal da cabeça polar do copolímero e lc é o comprimento da cadeia hidrofóbica. É importante ressaltar que na época de divulgaçao deste conceito nao havia conotaçoes para nanoestruturas do tipo PL.44 A Tabela 1 traz a classificaçao teórica dos sistemas formados de acordo com o valor de p.

Para copolímeros com porçao hidrofílica formada por PEG, pode-se ainda inferir o tipo de agregado formado a partir do parâmetro f (0 < f < 1), que representa a fraçao de volume hidrofílico do copolímero e o qual pode ser convertido em porcentagem, a partir dos valores de massa das fraçoes, usando o valor da densidade dos homopolímeros (Tabela 2).45 A Figura 3 apresenta uma ilustraçao destes dois parâmetros que interferem na geometria das nanoestruturas e estao intimamente ligados.

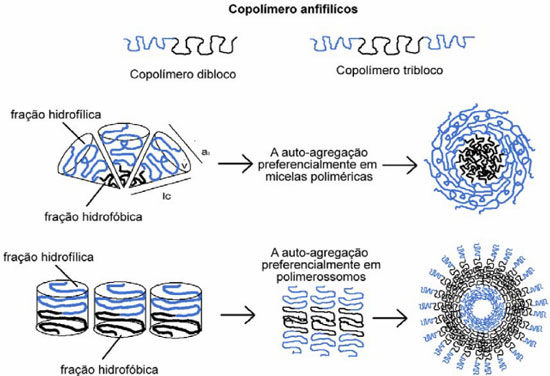 Figura 3. Representaçao esquemática da organizaçao geométrica de PL para um copolímero dibloco. De acordo com os tamanhos e proporçoes dos blocos hidrofílico e hidrofóbico, expressos matematicamente pela fraçao hidrofílica (f) ou pelo critical packing parameter (p), ocorre a agregaçao preferencialmente em micelas ou vesículas poliméricas (polimerossomos)
Do ponto de vista termodinâmico, a formaçao das micelas e vesículas é determinada pela energia livre do sistema, expressa pela equaçao 2:  em que ΔG, ΔH e ΔS sao, respectivamente, as variaçoes de energia livre de Gibbs, entalpia e entropia no processo de auto-agregaçao; T é a temperatura. A contribuiçao entálpica advém do balanço das interaçoes intra e inter moleculares entre o solvente e as moléculas de copolímero, incluindo interaçoes de van der Waals e ligaçoes de hidrogênio. O ganho entrópico advém da liberaçao das moléculas de água inicialmente estruturadas na vizinhança dos grupos hidrofóbicos do copolímero.46 Neste sentido, o parâmetro de segregaçao χN expressa o grau de segregaçao entre os segmentos hidrofílicos(a) e hidrofóbicos(b) do copolímero, χ refere-se a interaçao entre os diferentes blocos denominada de interaçao Flory-Huggins e N ao grau de polimerizaçao (N = Na + Nb). Um limite amplo de χN resulta em energia interfacial maior e menor perda da entropia, consequentemente, os segmentos estao altamente segregados. Na presença de um solvente seletivo para um dos blocos, a separaçao dos CA em uma microfase deve considerar também a interaçao de cada um dos seguimentos com tal solvente.42
MÉTODOS DE PREPARO Os principais métodos de preparo de PL incluem auto-agregaçao por simples dissoluçao, hidrataçao de um filme polimérico fino, troca de solvente ou co-solvente (solvent-switching) com precipitaçao do copolímero e dupla emulsificaçao com evaporaçao do solvente.47,48 A formaçao espontânea de PL é relatada por alguns autores em certas condiçoes, por exemplo, alguns copolímeros sao solúveis em determinadas faixas de pH.49 No entanto, no geral sao necessárias etapas que forneçam energia ao sistema.50 O método da hidrataçao do filme consiste na hidrataçao sob agitaçao vigorosa de um filme polimérico fino formado a partir da lenta evaporaçao de um solvente orgânico no qual o copolímero está dissolvido.51 Pode-se, ainda, empregar outras técnicas como agitaçao por ultrassom (sonicaçao), ciclo de resfriamento e aquecimento ou extrusao, visando reduzir o tamanho das vesículas e diminuir a polidispersao.52 A sonicaçao é feita em banho de ultrassom e a extrusao com os mesmos extrusores utilizados para LPs, com passagens sequenciais por membranas de policarbonato com poros de tamanho decrescente. A sonicaçao gera energia por meio do fenômeno da cavitaçao, que consiste na expansao e contraçao de bolhas de gás em um líquido exposto a ondas acústicas de pressao com (cavitaçao com colapso) ou sem (cavitaçao estável) ruptura das bolhas. A modificaçao de tamanho de vesículas poliméricas pode ser explicada pelo mesmo fenômeno descrito para vesículas lipídicas, o qual se sustenta no fato de que a oscilaçao das bolhas cria uma pressao local resultando na quebra das vesículas maiores em fragmentos que se reorganizam em vesículas menores.53 A extrusao também leva à diminuiçao de tamanho por promover a ruptura das vesículas quando forçadas através da membrana com tamanho de poro definido e reorganizaçao em PL com tamanho menor. Liu e colaboradores54 descreveram PL biodegradáveis formados a partir de copolímero tribloco de polietilenoglicol-β-policaprolactona-β-poli(2-dimetilaminoetilmetacrilato), obtidos pelo método de hidrataçao do filme. O copolímero foi dissolvido em clorofórmio e a remoçao do solvente foi feita lentamente com aplicaçao de vácuo por três a seis horas. A hidrataçao do filme foi feita com soluçao tampao contendo proteínas, seguida de sonicaçao por três minutos e agitaçao por 12 horas a 60 °C. De modo semelhante ao protocolo anterior, Ahmed e Discher45 elaboraram PL empregando copolímero de polietilenoglicol-poli(ácido láctico) (PEG-PLA) e polietilenoglicol-policaprolactona (PEG-PCL) para encapsular doxorrubicina. O método resultou em formaçao das vesículas com alto grau de polidispersao, uma vez que nao foram realizadas etapas de sonicaçao e extrusao. Algumas variáveis devem ser consideradas para aplicaçao deste método: volume da soluçao de hidrataçao, temperatura durante o processo de hidrataçao, velocidade e tempo de agitaçao. É relatado que hidrataçao sem agitaçao aumenta a polidispersao, resultando em ampla distribuiçao de tamanho das vesículas. A hidrataçao sob agitaçao vigorosa, por sua vez, reduz o tamanho das vesículas formadas.55 Apesar de amplamente descrito na literatura, esse método apresenta desvantagens como a tendência em formar sistemas polidispersos, a utilizaçao de longos períodos de tempo durante a hidrataçao para obtençao das vesículas, bem como a necessidade de métodos para diminuiçao do tamanho das vesículas, como por exemplo, extrusao da amostra final.56 O método da troca do solvente consiste em inicialmente dissolver os CA em um solvente orgânico e, em seguida, adicionar lentamente uma fase aquosa (ou injetar a fase orgânica em uma fase aquosa), levando à precipitaçao das vesículas. Por isso, pode ser denominado também de nanoprecipitaçao. Posteriormente é realizada e remoçao do solvente por técnicas de diálise ou evaporaçao.57 Este método foi empregado por Lee e colaboradores58 para elaboraçao de PL de PEG-PLA, o copolímero foi dissolvido em clorofórmio e adicionado em água com posterior agitaçao em vórtex. Em seguida, o solvente foi removido por agitaçao magnética. Marsden e colaboradores59 descreveram o preparo de PL seguindo a mesma técnica para diferentes copolímeros e empregando tetrahidrofurano (THF) como solvente. Neste trabalho, a evaporaçao do solvente ocorreu sob vácuo em evaporador rotativo. A técnica da dupla emulsificaçao é descrita como uma possibilidade para obtençao de PL menos polidispersos. Nesse método, sao formadas emulsoes do tipo água-em-óleo-em-água, sendo que os copolímeros dissolvidos na fase oleosa se auto-organizam em PL após evaporaçao da fase orgânica.60 Na obtençao de PL por dupla emulsificaçao podem ser usados dispositivos microfluídicos, os quais permitem a manipulaçao precisa de microfluxos em microcanais para gerar gotículas de emulsao uniformes com controle de tamanho das estruturas.61,62 Um método alternativo, a eletroporaçao, vem sendo utilizado para a encapsulaçao de biomoléculas em PL pré-formados. Esta consiste na aplicaçao de um campo elétrico que abre temporariamente poros nanométricos na membrana da vesícula permitindo a passagem das moléculas que se deseja encapsular. A abertura dos poros depende do tamanho das vesículas, voltagem aplicada, número, duraçao e frequência dos pulsos.63 Alguns trabalhos relatam sucesso no emprego desta técnica para encapsulaçao de biomoléculas como proteínas.64
PRINCIPAIS TÉCNICAS DE CARACTERIZAÇAO Uma extensa revisao recentemente publicada elencou dezessete técnicas para caracterizaçao de PL em meio aquoso, com intuito de descrever tamanho, lamelaridade, propriedades elásticas, carga, espessura da bicamada e polaridade. O mesmo trabalho divide as técnicas em cinco grupos: técnicas de espalhamento, métodos visuais, manipulaçao física e eletromagnética, ensaios de purificaçao e ferramentas de simulaçao.65 O tamanho fornecido pela técnica de espalhamento de luz dinâmico (do inglês dynamic light scattering, DLS) baseia-se no espalhamento da luz incidente a partir de um laser a uma intensidade induzida pelo movimento Browniano das partículas em soluçao, fornecendo o raio ou diâmetro hidrodinâmico a partir da equaçao de Stokes-Einstein, e assim deve ser correlacionado com análises microscópicas.66 Resultados de DLS podem sugerir agregaçao dos sistemas ou indicar mudanças nos tamanhos dos sistemas mediante alteraçoes de condiçoes experimentais.67,68  em que: Df é o coeficiente de difusao, kB é a constant de Boltzmann (1,38064852 x 10−23 J/K), T a temperatura, η a viscosidade do solvente e Rh é o raio hidrodinâmico. A microscopia eletrônica de varredura (MEV), a microscopia eletrônica de transmissao (MET) e a criomicroscopia de transmissao (Crio-MET) sao técnicas amplamente empregadas para visualizaçao dos PL, sendo que a primeira permite observar a forma e as outras duas sao mais precisas no que diz respeito à demonstraçao dos tipos de estruturas formadas permitindo avaliar a bicamada polimérica.57,66Já a microscopia confocal (MCF), uma vez que se trata de uma técnica de microscopia óptica, requer a produçao de vesículas grandes (micrométricas), do inglês, giant vesicles (sem técnicas de extrusao e sonicaçao). Nessa técnica sao empregados marcadores fluorescentes como nile red, isotiocianato de fluoresceína (acumulam-se na membrana) e rodamina-B (acumula-se no interior aquoso) para visualizaçao das vesículas.69,70 A microscopia de fluorescência também necessita de marcador fluorescente nas vesículas e permite estudar processos dinâmicos como difusao.66 A microscopia de força atômica (MFA) pode ser usada para avaliar características mecânicas da bicamada dos PL71 como fizeram Chen e coloaboradores que, por meio de MFA, avaliaram a rigidez de membranas de poliestireno-b-poli(ácido)acrílico.72 Assim como para outros NC, a taxa de encapsulaçao pode ser calculada diretamente nos sistemas após tratamentos que desagregam os PL ou indiretamente no sobrenadante após centrifugaçao dessas nanoestruturas. No primeiro caso sao empregados tensoativos ou solventes orgânicos que permitem a dissoluçao do polímero e, assim, liberaçao do fármaco encapsulado para quantificaçao direta.73 Já no segundo caso, quantifica-se o fármaco nao-encapsulado no sobrenadante e, por diferença, estima-se a porcentagem que foi encapsulada. A análise do potencial zeta (PZ) na maioria das vezes é comparativa para avaliaçao dos sistemas após encapsulaçao do fármaco.74 Como o valor de potencial zeta está relacionado com a carga do polímero, PL formados por copolímeros anfifílicos contendo polióxido de etileno como porçao polar apresentam valores de potencial zeta próximos a zero e a estabilizaçao dos PL ocorre por efeito estérico. Outra técnica que pode ser aplicada é o espalhamento de raio-X a baixo ângulo (do inglês, Small angle X-ray scattering, SAXS), técnica em que o espalhamento de raios-X é realizado em uma estreita faixa de ângulo (0,1-10°) que fornece informaçoes quanto à espessura e estrutura interna das vesículas.75
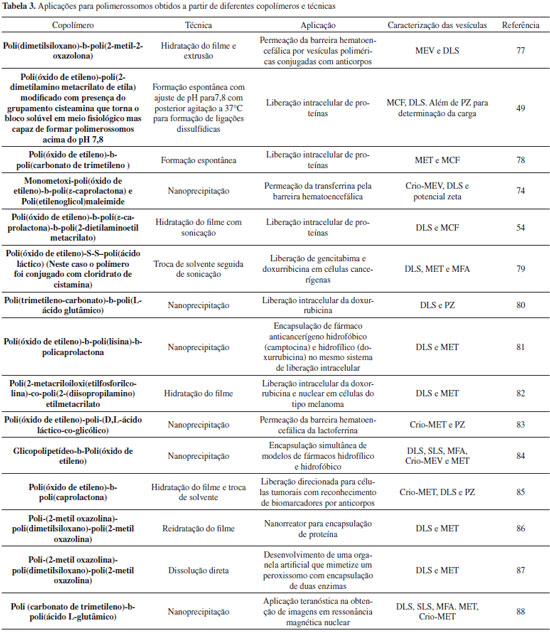
APLICAÇOES E INOVAÇOES As aplicaçoes dos PL em geral sao semelhantes às já conhecidas para os lipossomos.76 A Tabela 3 lista algumas aplicaçoes de diferentes sistemas de PL. Como já citado antes, a estrutura polimérica faz com que apresentem propriedades que os tornam menos susceptíveis a rápida degradaçao no organismo e menos imunogênicos.
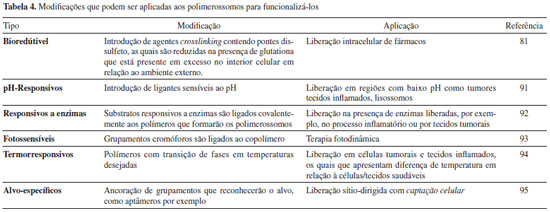
Inovaçoes na estrutura dos PL refletem uma evoluçao na ideia original destes NC como sistemas de armazenamento estável de um fármaco em razao da natureza polimérica da membrana e abrem vertentes para conceituá-los também como "sistemas inteligentes" de liberaçao de fármacos, especialmente em razao das dificuldades já relatadas para liberaçao.89 Assim, auto-agregados supramoleculares podem responder a estímulos externos (por exemplo, pH, temperatura, campos magnéticos, luz, processos redox).90 Na Tabela 4 sao apresentadas as modificaçoes mais comuns em PL de maneira a funcionalizá-los. Outra modificaçao pode ser na morfologia das vesículas, uma vez que a forma final dos PL é resultado de forças que controlam a membrana. Um exemplo de modificaçao morfológica refere-se ao desenvolvimento de sistemas tubulares com morfologia cilíndrica alongada, os quais penetrariam mais facilmente no ambiente intracelular. Para isto, fosfolipídeos e colesterol poderiam ser incorporados na composiçao dos PL.51
CONSIDERAÇOES FINAIS Desde que o conceito de "bala mágica" de Paul Ehrlich foi extrapolado para drug delivery com os lipossomos, descritos inicialmente nos anos 60, podemos dizer que esta ideia nao parou de evoluir, especialmente no campo da nanobiotecnologia. Atualmente, o conceito pode ser aplicado aos polimerossomos, nanoestruturas que reúnem todas as vantagens do sistema vesicular com núcleo aquoso e bicamada de caráter apolar característico dos lipossomos, mas apresentam vantagens de nanopartículas poliméricas, especialmente no que diz respeito à robustez. Desde a publicaçao inicial do termo polimerossomo e sua descriçao como nanocarreador no final dos anos 90 até hoje, o próprio conceito de auto-organizaçao ou self-assembly de compostos anfifílicos, que é a base teórica da formaçao destas vesículas, vem sendo expandido. Novos estudos vêm sendo realizados em relaçao à elaboraçao de polimerossomos, com foco nas características dos copolímeros como sensibilidade a certas faixas de temperatura e/ou pH que podem determinar a auto-agregaçao e variaçoes nas técnicas de produçao que permitem otimizar este processo. A variedade de copolímeros com diferentes características, capazes de direcionar fármacos para alvos específicos e controlar a velocidade de liberaçao e degradaçao, o aumento da meia vida dos fármacos encapsulados em razao da furtividade típica de certos materiais poliméricos, a possibilidade de terapia combinada com fármacos hidrofílicos no interior aquoso e fármacos hidrofóbicos na membrana, além de todas as outras vantagens de transportadores em escala nanométrica, tornam os polimerossomos uma abordagem atual e inteligente para drug delivery.
AGRADECIMENTOS Os autores agradecem ao CNPq, à CAPES e à FAPESP (processo 2013/08617-7 - Projeto temático e 2014/10456-4 - bolsa de doutorado para A. C. Apolinário).
REFERENCIAS 1. Dimer, F. A.; Friedrich, R. B.; Beck, R. C. R.; Pohlmann, A. R.; Quim Nova. 2015, 36, 1520. 2. Pachioni-Vasconcelos, J. D. A.; Lopes, A. M.; Apolinário, A. C.; Valenzuela-Oses, J. K.; Costa, J. S.R.; Nascimento, L. O.; Pessoa Jr., A.; Barbosa, L. R. S.; Rangel-Yagui, C. O.; Biomater Sci. 2016, 4, 205. 3. Wicki, A.; Witzigmann, D.; Balasubramanian, V.; Huwyler, J.; J. Controlled Release 2015, 200, 138. 4. Safari, J.; Zarnegar, Z.; J. Saudi Chem. Soc. 2014, 18, 85. 5. Alcalá-Alcalá, S.; Benítez-Cardoza, C. G.; Lima-Muñoz, E. J.; Piñón-Segundo, E.; Quintanar-Guerrero, D.; Int. J. Pharm. 2015, 489, 139. 6. Cheng, X.; Lee, R. J.; Adv. Drug Delivery Rev. 2016, 99, 129. 7. Ray, C.; Bhattacharya, D.; Sahu, S. K.; Dalton Trans. 2016, 45, 72963. 8. Li, X.; Anton, N.; Arpagaus, C.; Belleteix, F.; Vandamme, T. F.; J. Controlled Release 2010, 147, 304. 9. Otsuka, H.; Nagasaki, Y.; Kataoka, K.; Adv. Drug Delivery Rev. 2012, 64, 246. 10. Kunitake T, Nakashima N, Takarabe K, Nagai M, Tsuge A, Yanagi H.; J. Am. Chem. Soc. 1981, 28, 5945. 11. Zhang, L.; Eisenberg, A.; Science 1995, 268, 5218. 12. Discher, B. M.; Won, Y. Y; Ege, D. S.; Lee, J. C.; Bates, F. S.; Discher, D. E.; Hammer, D. A.; Science 1999, 284, 1143. 13. Bangham, D.; Standish, M. M.; Watkins, J. C.; J. Mol. Biol. 1965, 13, 238. 14. Santos, N. C.; Castanho, M. A. R. B.; Quim. Nova. 2002, 25, 1181. 15. Pasut, G.; Paolino, D.; Celia, C.; Mero, A.; Joseph, A. S.; Wolframd, J.; Cosco, D.; Schiavon. O.; Shen, H.; Fresta, M.; J. Controlled Release 2015, 199, 106. 16. Brinkhuis, R. P.; Rutjes, F. P. J. T.; van Hest, J. C. M.; Polym. Chem. 2011, 2, 1449. 17. Schaffazick, S. R.; Guterres, S. S.; Lucca F. L.; Pohlmann, A. R.; Quim Nova 2003, 26, 726. 18. Oliveira, A.G.; Scarpa, M. V.; Correa, M. A.; Rodrigues, C. L. F, Formariz, T. P.; Quim Nova 2004, 27, 131. 19. Durán, N.; Durán, M.; Tasic, L.; Marcato, P. D.; Quim Nova 2010, 33, 151. 20. Yoshizaki, Y.; Yuba, E.; Sakaguchi, N.; Koiwai, K.; Harada, A.; Kono, K.; Biomaterials 2014, 35, 8186. 21. Kim, S. J.; Kwon, S. S.; Jeon, S. H.; Yu, E. R; Park, S. N.; Int. J. Cosmet. Sci. 2014, 36, 553. 22. Messager, L.; Gaitzsch, J.; Chierico, L.; Battaglia, G.; Curr. Opin. Pharmacol. 2014, 18, 104. 23. Mosca, M.; Ceglie, A.; Ambrosone, L.; Chem. Phys. Lipids 2011, 164, 158. 24. Toh, M-R.; Chiu, G. N. C.; Asian J. Pharm. Sci. 2013, 8, 88. 25. Lasic, D. D.; Trends Biotechnol. 1998, 16, 307. 26. Maherani, B.; Arab-Tehrany, E.; Mozafari, M. R., Gaiani, C.; Linder, M.; Curr. Nanosci. 2011, 7, 436. 27. Onaca, O.; Enea, R.; Hughes, D. W.; Meier, W.; Macromol. Biosci. 2009, 9, 129. 28. Schacher, F. H.; Rupar, P.; Manners, I.; Angew. Chem. 2012, 51, 7898. 29. Chang, H.; Sheng, Y.; Tsao, H.; Soft Matter 2014,10,6373. 30. Zhang, X.; Qi, J.; Lu, Y.; He, W.; Li, X.; Wu, W.; Nanomedicine 2014, 10, 167. 31. Le Meins, J-F.; Sandre, O.; Lecommandoux, S.; EPJSFH 2011, 34, 1. 32. Discher, D. E.; Ortiz, V.; Srinivas, G.; Kleinb. M. L.; Kim, Y.; Christian, D.; Cai, S.; Photos, P.; Ahmed, F.; Prog. Polym. Sci. 2007, 32, 838. 33. Pawar, P. V.; Gohil, S. V.; Jain, J. P.; Kumar, N.; Polym. Chem. 2013, 4, 160. 34. Discher, D. E.; Eisenberg, A.; Science 2002, 297, 967. 35. Mai, Y.; Eisenberg, A.; Chem. Soc. Rev. 2012, 41, 5969. 36. Discher, D. E.; Ahmed, F.; Annu. Rev. Biomed. Eng. 2006, 8, 323. 37. Gentekos, D. T.; Dupuis, L. N.; Fors, B. P.; J. Am. Chem. Soc. 2016, 138, 1848. 38. Lin, Y.; Chang, H-Y.; Sheng, Y-J.; Tsao, H-K.; Soft Matter 2013, 9, 4802. 39. Lee, M.; Cho, B-K.; Zin, W-C.; Chem. Rev. 2001, 101, 3869. 40. Olsen, B. D.; Segalman, R.; Mater. Sci. Eng. 2008, 62, 37. 41. Honda, C.; Sakaki, K.; Nose, T.; Polymer 1994, 35, 5309. 42. Bleul, R.; Thiermann, R.; Maskos, M.; Macromolecules 2015, 48, 7396. 43. Battaglia, G.; Ryan, A. J.; Nat. Mater. 2005, 4, 869. 44. Israelachvili, J. N.; Mitchell, D. J.; Ninham, W. B.; . J. Chem. Soc., Faraday Trans. 1975, 72, 1525. 45. Ahmed, F.; Discher, D. E.; J. Controlled Release. 2004, 96, 37. 46. Hocine, S.; Li, M-H.; Soft Matter 2013, 9, 5839. 47. Liao, J., Wang, C.; Wang, Y.; Luo, F.; Qian. Z.; Curr. Pharm. Des. 2012, 18, 3432. 48. Shen, H.; Eisenberg, A.; J. Phys. Chem. B. 1999, 103, 9473. 49. Sun, H.; Meng, F.; Cheng, R.; Deng, C.; Zhong, Z.; Acta Biomater. 2014, 10, 2159. 50. Howse, J. R.; Jones, R. L.; Battaglia, G.; Ducker, R. E., Leggett, G. J.; Ryan, A. J.; Nat. Mater. 2009, 8, 507. 51. Robertson, J. D.; Yealland, G.; Avila-Olias, M.; Chierico, L.; Bandmann, O.; Renshaw S. A.; Giuseppe B.; ACS Nano 2014, 8, 4650. 52. Letchford, K.; Burt, H.; Eur. J. Pharm. Biopharm. 2007, 65, 259. 53. Richardson, E. S.; Pitt, W. G.; Woodbury, D. J.; Biophys J. 2007, 93, 4100. 54. Liu, G.; Ma, S.; Li, S.; Cheng, R.; Meng, F.; Liu, Haiyan, L.; Zhong, Z.; Biomaterials 2010, 31, 7575. 55. Photos, P. J.; Bacakova, L.; Discher, B.; Bates, F. S.; Discher, D. E.; J. Controlled Release 2003, 90, 323. 56. O'Neil, C. P.; Suzuki T.; Demurtas, D.; Finka, A.; Hubbell, J.; Langmuir 2009, 25, 9025. 57. Lee, J. S.; Feijen, J.; J. Controlled Release 2012, 161, 473. 58. Lee, Y.; Chang, J-B.; Kim, H. K.; Park, T. G.; Macromol. Res. 2006, 14, 359. 59. Marsden, H. R.; Gabrielli, L.; Kros, A.; Polym. Chem. 2010, 1,1512. 60. Shum, H. C.; Zhao, Y. J.; Kim, S. H.; Weitz, D.; Angew. Chem. 2011, 50, 1648. 61. Jang, W-S.; Park, S. C.; Kim, M.; Doh, J.; Lee, D.; Hammer, D.; Macromol. Rapid Commun. 2015, 36, 378. 62. Zhang, M.; Wang, W.; Xie, R.; Ju, X.; Liu, Z.; Jiang, L.; Chen, Q.; Chu, L.; Particuology 2015, 1, 14. 63. Bain, J.; Ruiz-Pérez, L.; Kennerley, A. J.; Muench, S. P.; Thompson, R.; Giuseppe B.; Staniland, S. S.; Sci. Rep. 2015, 5, 14311. 64. Wang, L.; Chierico, L.; Little, D.; Patikarnmonthon, N.; Yang, Z.; Azzouz, M.; Madsen, J.; Armes, S. P.; Battaglia, G.; Angew. Chem. 2012, 51, 11122. 65. Habel. J.; Ogbonna, A.; Larsen, N.; Cherré S.; Kynde, S.; Roi, S.; Koji, M.; Kinoshita, S.; Grethe, K.; Jensen, V.; Hansen, J. S.; Almdal, K.; Hèlix-Nielsen, C.; RSC Adv. 2015, 5, 79924. 66. Kita-Tokarczyk, K.; Grumelard, J.; Haefele, T.; Meier, W.; Polymer 2005, 46, 3540. 67. Smart, T. P.; Fernyhough, C.; Ryan, A. J.; Battaglia, G.; Macromol. Rapid Commun. 2008, 29, 1855. 68. Du, Y.; Chen W.; Zheng, M.; Meng, F.; Zhong, Z.; Biomaterials 2012, 29, 7291. 69. Liu, G.; Ma, S.; Li, S.; Liu, G.; Ma, S.; Li, S.; Cheng, R.; Meng, F.; Liu, H.; Zhong, Z.; Biomaterials 2010, 31, 7575. 70. Gaitzsch, J.; Appelhans, D.; Gräfe, D.; Schwille, P.; Voit, B.; Chem. Commun. (Cambridge, U. K.) 2011, 47, 3466. 71. Jaskiewicz, K.; Makowski, M.; Kappl, M.; Landfester, K.; Kroeger, A.; Langmuir 2012, 28, 12629. 72. Chen, Q.; Schönherr, H.; Vancso, G. J.; Soft Matter 2009, 5, 4944. 73. Wan, S.; He, D.; Yuan, Y.; Yan, Z.; Zhang, X.; Zhang, J.; Colloids Surf., B 2016, 143, 278. 74. Pang, Z.; Gao, H.; Yu, Y.; Chen, J.; Guo, L.; Ren, J.; Wen, Ziyi; Su, J.; Jiang, X.; Int. J. Pharm. 2011, 415, 1284. 75. Jiang, W.; Zhou, Y.; Yan, D.; Chem. Soc. Rev. 2015, 44, 3874. 76. Messager, L.; Gaitzsch, J.; Chierico, L.; Battaglia, G.; Curr. Opin. Pharmacol. 2014, 18, 104 77. Dieu, L-H.; Wu, D.; Palivan, C.G.; Balasubramanian, V.; Huwyler, J.; Eur. J. Pharm. Biopharm. 2014, 88, 316. 78. Li, S.; Meng, F.; Wang, Z.; Zhong, Y.; Zheng, M.; Liu, H.; Zhong, Z.; Eur. J. Pharm. Biopharm. 2012, 82, 103. 79. Nahire, R.; Haldar, M.K.; Paul, S.; Nahire, R.; Haldar, M.K.; Paul S.; Ambre, A. H.; Meghnani, V.; Layek, B.; Katti, K.S.; Gange K. N.; Singh, J.; Sarkar Kausik; Mallik, S.; Biomaterials 2014, 35, 6482. 80. Oliveira, H.; Pérez-Andrés, E.; Thevenot, J.; Sandre, O.; Berra, E.; Lecommandoux S.; J. Controlled Release 2013, 169, 165. 81. Thambi, T.; Deepagan, V. G.; Ko, H.; Lee, D. S.; Park, J. H.; J. Mater. Chem. 2012, 22, 22028. 82. Pegoraro, C.; Cecchin, D.; Gracia, L. S.; Warren, N.; Madsen, J.; Armes, S. P.; Lewis, A.; MacNeil, S.; Battaglia G.; Cancer Lett. 2013, 334, 328. 83. Yu, A.; Pang, Z.; Lu, W.; Yin, Q.; Gao, H.; Jiang, X; Pharm Res. 2012, 29, 83. 84. Das, S.; Sharma, D. K.; Chakrabarty, S.; Chowdhury, A.; Sem, G. S.; Langmuir 2015, 31, 3402. 85. Zou, T.; Dembele, F.; Beugnet, A.; Sengmanivong, L.; Trepout, S.; Marco, S.; Marco, A.; Li, M.; J. Biotechnol. 2015, 214, 147. 86. Dobrunz, D.; Toma, A. C.; Tanner, P.; Pfohl, T.; Palivan, C. G.; Langmuir 2012, 28, 15889. 87. Tanner, P.; Balasubramanian, V.; Palivan, C. G.; Nano Lett. 2013, 13, 2875. 88. Sanson, C.; Diou, O.; Thevenot, J.; Ibarboure, E.; Soum, A.; Brulet, A.; Miraux, S.; Thiaudiere, E.; Tan, S.; Brisson, A.; Dupuis, V.; Sandre, O.; Lecommandoux, S.; ACS Nano 2011, 5, 1122. 89. Dionzou, M.; Morère, A.; Roux, C.; Lonetti, B.; Marty, J. D.; Mingotaud, C.; Joseph, P.; Goudounèche, D.; Payré, B.; Léonetti, M.; Mingotaud, A. F.; Soft Matter 2016, 12, 2166. 90. Meng, F.; Zhong, Z.; Feijen, J.; Biomacromolecules 2009, 10, 197. 91. Chen, W.; Meng, F.; Cheng, R.; Zhong, Z.; J. Controlled Release 2010, 142, 40. 92. Feng, A.; Yuan, J.; Macromol. Rapid Commun. 2014, 35, 767. 93. Cabane, E.; Malinova, V.; Menon, S.; Palivan, C. G.; Meier, W.; Soft Matter 2011, 7, 9167. 94. Liu, F.; Kozlovskaya, V.; Medipelli, S.; Xue, B.; Ahmad, F.; Saeed, M.; Cropek, D.; Kharlampieva, E.; Chem. Mater. 2015, 27, 7945. 95. Li, X.; Zhu, X.; Qiu, L.; Acta Biomater. 2016, 35, 269. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access