Artigo
|
|
| Equilíbrio químico e cinética enzimática da interação de α-amilase com compostos fenólicos encontrados em cerveja Chemical equilibrium and enzymatic kinetics of α-amylase interaction with phenolic compounds found in beer |
|
George Augusto V. de Oliveira*; José Maurício Schneedorf Ferreira da Silva
Departamento de Bioquímica, Universidade Federal de Alfenas, 37130-000 Alfenas - MG, Brasil Recebido em 25/11/2016 *e-mail: george_veloso@yahoo.com.br α-amylase is a key enzyme in the production of beer due to the breakdown of starch into fermentable sugars. During the preparation of the brewing mash, the enzyme can be affected by polyphenols present in the mixture. Our aim was to evaluate the kinetics and equilibrium of the interaction of α-amylase with some polyphenols (chlorogenic, caffeic, ferulic acids and quercetin) present in beer in the usual range of mashing temperatures (40 - 80 °C), and to treat the results with integrated Michaelis-Menten and Stern-Volmer equations. The results showed a competitive inhibition model for all compounds with Ki values around 30 umol.L-1. The binding constants (Kb) revealed increasing values with temperature up to 323 K, corroborating the enzymatic data. Values for ΔH and ΔS revealed an entropy-driven association mechanism. Structure-activity relationships demonstrated a positive correlation between the biological activity of α-amylase and the polar nature descriptors of the polyphenols. Binding assays of the enzyme with chlorogenic acid at different pH and ionic strength support the structure-activity and thermodynamic data and suggest a plausible interaction of the carboxylate ion of the ligand with basic groups in the vicinity of the catalytic site of the enzyme. INTRODUÇAO As α-amilases estao entre as mais importantes enzimas industriais, amplamente utilizadas em indústrias na produçao de maltodextrinas, panificaçao, álcool, detergentes, têxteis e, em especial, para fabricaçao de cerveja.1 Segundo dados do SEBRAE (Serviço Brasileiro de Apoio às Micros e Pequenas Empresas) e SINDCERV (Sindicato Nacional das Indústrias de Cerveja), o Brasil é o 3° maior mercado consumidor de cerveja, com produçao de 13 bilhoes de litros e consumo de 14 bilhoes de litros, resultando em 62 litros per capita.2 Porém, ao mesmo tempo em que as maiores empresas cervejeiras do mundo estao inseridas nesse mercado, produzindo basicamente cervejas altamente populares como as American Lager, têm surgido como opçao as cervejas especiais, também conhecidas como artesanais ou Premium.3 A produçao da cerveja a partir do malte de cevada consiste em um exemplo complexo de enzimologia aplicada. Durante a preparaçao da cerveja, a açao enzimática que ocorre no preparo do mosto aquecido sob influência de diversos compostos pode levar a um produto final diversificado em propriedades organolépticas, em paralelo aos processos industriais de refinamento e controle de fermentaçao da cerveja. A açao enzimática nessa etapa promove a degradaçao do amido em açúcares fermentáveis. Interferências físicas (ex: alteraçoes de rampas de aquecimento, ordem na adiçao de produtos) ou químicas (inibiçao de enzimas degradantes) podem alterar a disponibilidade de açúcares fermentáveis e as características finais da cerveja.4 As enzimas α-amilase e β-amilase sao as principais responsáveis pela formaçao de açúcares fermentáveis durante a produçao de mosto. A α-amilase catalisa a hidrólise das ligaçoes α-1,4-glucano internas em polissacaridios contendo três ou mais unidades de D-glicose. Em contraste, a β-amilase atua sobre a ligaçao entre os últimos dois e três resíduos de glicose na cadeia de amido, liberando maltose.5 O mecanismo catalítico de α-amilases segue um padrao similar entre várias espécies,6 entre as quais α-amilase pancreática e salivar humana, de Aspergillus niger, Hordeum vulgare (cevada), e Aspergillus oryzae. Cada enzima possui um resíduo de glutamato (Glu) e dois resíduos de aspartato (Asp) necessários para a atividade, enquanto a maioria das enzimas da família também contêm dois resíduos de histidina (His) críticos para a estabilizaçao do estado de transiçao.6 A inibiçao da α-amilase pode ocorrer por fatores internos ou externos ao meio, tais como variaçoes da temperatura, variaçoes de pH, aumento da concentraçao de açúcares redutores (maltose e glucose) e interaçao com diversos compostos, entre outros.7-9 Componentes fenólicos sao adicionados à cerveja por lúpulo e malte. Eles exercem uma influência sobre vários atributos de qualidade da cerveja, tais como cor, sabor, adstringência e estabilidade coloidal da cerveja.10,11 Os polifenóis que ocorrem naturalmente na cerveja sao membros das proantocianidinas, oligômeros e polímeros de catequinas, epicatequina, e galocatequina; ou monômeros, como ácido cafeico, ácido ferúlico, ácido clorogênico e quercetina, os quatro últimos avaliados neste trabalho.12 A atividade de uma enzima pode ser determinada com base na velocidade de conversao do substrato em produto pela açao da enzima, o que pode ser obtido convencionalmente variando-se a concentraçao de substrato. Alternativamente, essa taxa de reaçao também pode ser obtida por integraçao da equaçao de Michaelis-Menten (Equaçao 1), permitindo a determinaçao dos parâmetros catalíticos a partir de um único ensaio, otimizando tempo, reagentes e substratos. Essa determinaçao se dá por ajuste nao linear de modelos cinéticos aos dados de uma curva progressiva de formaçao do produto ou de decaimento do substrato ao longo do tempo.13 Ajustes nao lineares possuem vantagens sobre o tratamento linear de dados de catálise enzimática (ex: Lineweaver-Burk, Eadie-Hofstee, entre outros.13 uma vez que nao há transformaçao das variáveis originais (t, St), nao se fere premissas de independências de variáveis para ajustes lineares (ex: Eadie-Hofstee), e tampouco produzem dispersoes assimétricas dos erros (ex: Lineweaver-Burk). 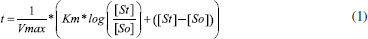 Onde t representa o tempo, Vmax representa a velocidade máxima da reaçao, Km é a constante de Michaelis-Menten para afinidade da enzima pelo substrato, [St] é a concentraçao do substrato e [So] é a concentraçao do substrato no tempo zero. Os inibidores reversíveis podem ser basicamente divididos em competitivos (Equaçao 2), incompetitivos (Equaçao 3) e nao-competitivos (Equaçao 4), representadas pelas equaçoes integradas que seguem.14 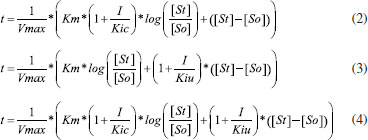 Tais equaçoes sao deduzidas a partir da Equaçao 1, onde o termo 1 + I Kic ou 1 + I Kiu representa a contribuiçao do efeito inibitório, Kic a constante de inibiçao competitiva e Kiu a constante de inibiçao incompetitiva. Determinaçao de parâmetros de interaçao de ligantes com proteínas por espectrofluorimetria A α-amilase apresenta intensidade de fluorescência decorrente de seus fluoróforos intrínsecos (triptofano, tirosina e fenilalanina). Na prática, o triptofano é o fluoróforo intrínseco dominante, e alteraçoes nos espectros de emissao do triptofano podem estar ligadas a transiçoes conformacionais, associaçao de subunidades, ligaçao ao substrato ou desnaturaçao. Essas interaçoes podem afetar o ambiente local na circunvizinhança do anel indol.15 A intensidade de fluorescência de uma proteína pode ser diminuída como resultado de uma ampla variedade de processos. Tais declínios na intensidade podem ser resultados de diferentes interaçoes moleculares entre a proteína e o ligante.16 Os mecanismos de extinçao da fluorescência podem ser avaliados pela relaçao de Stern-Volmer conforme a Equaçao 5, onde F0 e F representam as intensidades de fluorescência da proteína na ausência e na presença de ligante, respectivamente, [Q] a concentraçao do ligante, kq a constante da interaçao bimolecular, τ0 o tempo de vida do fluoróforo na ausência do ligante, e Ksv a constante de interaçao de Stern-Volmer.15 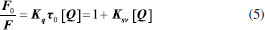 No caso das extinçoes serem puramente estáticas (formaçao de complexo) ou dinâmicas (colisional), a representaçao gráfica mostra-se linearmente dependente; entretanto, se a interaçao ocorrer de forma mista entre estática e dinâmica, o gráfico de Stern-Volmer mostra-se dependente exponencialmente.17 Em experimentos de interaçao ligante-proteína, o valor de Ksv é comumente considerado como a constante de interaçao do complexo (Kb).18,19 Diante do exposto, este trabalho avaliou as possíveis interaçoes moleculares e interferência inibitória de polifenóis usualmente presentes no mosto cervejeiro com α-amilase, e em temperaturas compatíveis com o processamento desse. Para tanto, foram realizados ensaios de inibiçao enzimática e equilíbrio químico de α-amilase com polifenóis em temperaturas de 25° a 60 °C, e os resultados relacionados à estrutura dos polifenóis e da enzima.
PARTE EXPERIMENTAL Materiais Todos os reagentes utilizados nesse trabalho foram de grau analítico. Foi empregado como substrato o amido solúvel (VETEC, Rio de Janeiro, RJ, Brasil), e como enzima α-amilase de Aspergillus oryzae (Sigma-Aldrich, St.Louis, MA, EUA). Os polifenóis escolhidos foram o ácido cafeico (Sigma-Aldrich, St.Louis, MA, EUA), ácido clorogênico (Sigma-Aldrich, St.Louis, MA, EUA), quercetina (Sigma-Aldrich, St. Louis, MA, EUA) e ácido ferúlico (Sigma-Aldrich, St. Louis, MA, EUA), todos de grau P.A. A pureza da enzima foi testada a partir do seu coeficiente de extinçao molar e perfil de absorçao molecular, esse também utilizado para que se verifique o grau de pureza dos polifenóis. Ensaio de inibiçao enzimática de α-amilase com compostos fenólicos A cinética enzimática da α-amilase foi testada na ausência e na presença dos polifenóis. Utilizamos o método modificado de amido-iodo como ensaio de referência. A soluçao de amido foi preparada em uma concentraçao de 20 mg mL-1 e diluída em uma proporçao de 1:1 com um tampao fosfato de potássio 0,04 mol L-1 pH 5,9. O reagente de revelaçao foi preparado por diluiçao em 100:1 da soluçao estoque de lugol (500 mg de iodo e 5,0 g de iodeto de potássio/100 mL de água). Uma alíquota de 1 mL de soluçao de amido foi adicionada a um tubo de ensaio contendo 0,5 mL de tampao fosfato de potássio 0,04 mol L-1 e incubado durante 10 min em banho-maria HMO128D (Hemoquímica, Minas Gerais, Brasil) (298 K, 313 K e 323 K), e a temperatura da soluçao foi aferida por um termômetro digital MT-600 (Minipa, Sao Paulo, Brasil). A enzima (30 µL a concentraçao de 1 mg mL-1) foi previamente incubada com uma alíquota do composto fenólico durante 10 minutos, sendo posteriormente adicionada na soluçao de substrato sob as condiçoes do ensaio. Após intervalos de 30 segundos, alíquotas de 50 µL foram retiradas do sistema tampao/amido/enzima/composto fenólico, seguindo-se a adiçao de 1 mL de reagente de interrupçao (HCl, 0,05 mol L-1). Após homogeneizaçao, adicionou-se 100 µL de soluçao de iodo. O decaimento do sinal do substrato foi monitorado em um espectrofotômetro Libra S22 UV/Vis (Biochrom LKB, St Albans, Reino Unido) em temperatura de 25 °C. A temperatura da soluçao foi aferida por um termômetro digital MT-600 (Minipa, Sao Paulo, Brasil). Espectrofluorimetria da interaçao de α-amilase com compostos fenólicos Os ensaios para obtençao de parâmetros termodinâmicos da interaçao da α-amilase com os polifenóis foram realizados em um fluorofotômetro CaryEclipse Spectro (Varian, Austrália) conectado a um banho de circulaçao de água modelo Q214-SC (Quimis, Sao Paulo, Brasil) com programaçao de rampas de temperatura controlada por microprocessador. Os dados coletados foram obtidos a temperaturas de soluçao constante de 293, 303, 313, 323 e 333 K. A temperatura da soluçao foi aferida por um termômetro digital MT-600. As amostras foram excitadas em 280 nm e a emissao de fluorescência, medida em 90 graus em relaçao ao feixe de excitaçao, foi registrada na faixa de 290-500 nm. Os dados obtidos foram corrigidos para o efeito interno segundo Van De Weert e Stella.19
RESULTADOS E DISCUSSAO Cinética de α-amilase na presença de compostos fenólicos As curvas progressivas de consumo de substrato por α-amilase na presença de ácido cafeico, ácido ferúlico, quercetina e ácido clorogênico em diferentes temperaturas estao ilustrados na Figura 1.
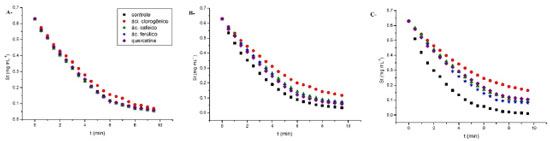 Figura 1. Inibiçao enzimática de compostos fenólicos a 2,8 x10-5 mol L-1 sobre α-amilase. A - 298 K, B - 313 K, Figura C - 323 K
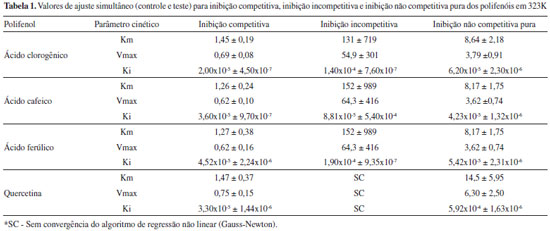
A inibiçao da enzima pelos polifenóis foi dependente da temperatura a um valor ótimo de 323 K, embora apenas o ácido clorogênico tenha sido capaz de inibir a enzima em 298 K. Ajustes nao lineares das equaçoes 2, 3 e 4 aos dados experimentais a 323 K foram realizados, e os resultados estao representados na Tabela 1.
Avaliou-se o melhor modelo comparando-se os resultados obtidos e o erro inerente a cada um, bem como a magnitude dos parâmetros cinéticos encontrados na ausência dos compostos fenólicos. Pelos dados da Tabela 1, pode-se verificar que o modelo de inibiçao competitiva foi o que melhor se ajustou aos dados. Uma sobreposiçao dos valores teóricos desse modelo aos dados está representada na Figura 2.
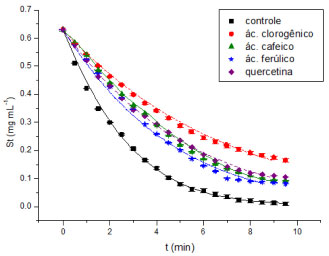 Figura 2. Ajuste nao linear dos dados de inibiçao dos compostos fenólicos (ácido clorogênico, ácido cafeico, ácido ferúlico e quercetina) sobre a catálise de amido por α-amilase em pH 5,9 a 323 K para determinaçao de valor do Kic
Efeito da temperatura Os dados cinéticos obtidos também podem ser representados por um decaimento exponencial de 1ª ordem, obtido pela lei de velocidade integradas, como dado pela Equaçao 6 a seguir.20  A partir da equaçao 6 realizou-se um ajuste exponencial de 1ª ordem aos dados experimentais a fim de se obter a constante de velocidade (k). A partir do valor de "k", pode-se analisar a dependência da velocidade de reaçao com a temperatura pela relaçao de Arrhenius.20  Em que k representa a constante de velocidade, A a constante pré-exponencial ou fator de frequência, Ea a energia de ativaçao, R a constante dos gases (8,314 J K-1 mol-1) e T a temperatura. Os resultados apresentados na Figura 3 reforçam a complexaçao com ácido clorogênico como a mais sensível à temperatura entre as testadas.
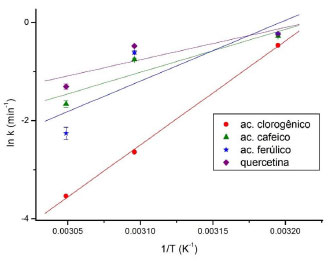 Figura 3. Dependência da constante de velocidade (k) da reaçao inibitória de polifenóis sobre a catálise do amido por α-amilase com a temperatura
Os valores para a energia de ativaçao (Ea) da reaçao para o sistema enzima-inibidor-substrato estao apresentados na Tabela 2.
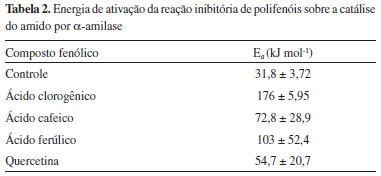
Esses resultados estao de acordo com os obtidos a partir da cinética de inibiçao realizada para os compostos fenólicos em 323 K, e apresentaram valores de energia de ativaçao para ácido clorogênico > ácido ferúlico > ácido cafeico > quercetina. O ácido clorogênico foi o que apresentou menor valor de Kic (Tabela 1), maior sensibilidade com a temperatura (Tabela 2) e maior inibiçao na temperatura ótima da enzima (323 K, Figura 2), antagonicamente aos valores apresentados para a quercetina. Isso pode ser justificado pela maior área de superfície apolar da quercetina, quando comparada à do ácido clorogênico, reduzindo sua interaçao, e/ou a presença do carboxilato desse, reforçando a mesma. De fato, é referido que a inibiçao de α-amilase, de modo geral, decorre da interaçao de grupos polares com o bolso catalítico relativamente pequeno da enzima.21 Interaçao de α-amilase com os compostos fenólicos por espectrofluorimetria A Figura 4 exibe os espectros de emissao de fluorescência da α-amilase na ausência e na presença dos compostos fenólicos, nos quais é observada uma forte banda de emissao de fluorescência em 334 nm apresentado pela α-amilase. Os ligantes nao apresentaram fluorescência intrínseca no comprimento de onda de excitaçao de 280 nm para a faixa espectral ensaiada. Essa emissao de fluorescência da enzima é devida à presença de seus resíduos aromáticos, em especial a 12 resíduos de triptofano presentes na estrutura da α-amilase (UniProtKB/Swiss-Prot - código P0C1B3).22 Especificamente, o domínio catalítico da enzima apresenta um resíduo de Trp-83 localizado no subsítio -3.21
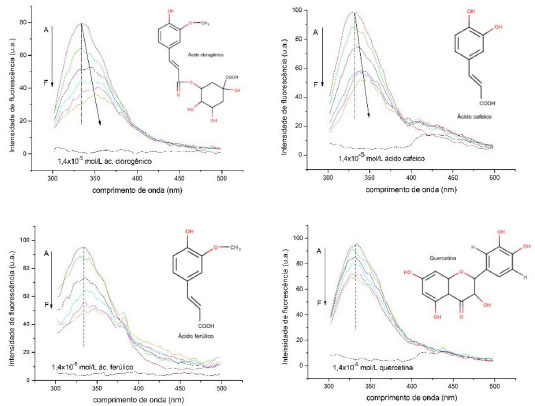 Figura 4. Espectro de emissao de fluorescência da α-amilase na ausência e presença de compostos fenólicos em várias concentraçoes, A-F: de 0 a 1,4x10-5 mol L-1 com incrementos de 2,8x10-6. (T=323 K e λex = 280 nm)
Em todos os espectrofluorogramas apresentados na Figura 4, a intensidade de fluorescência da α-amilase sofreu uma gradual diminuiçao com o aumento da concentraçao de ligante. A elevada diminuiçao da intensidade fluorescência sugere que ocorreu a formaçao de complexos entre eles,23 o que é corroborado pelos resultados de inibiçao da enzima. Nota-se que houve um deslocamento batocrômico (red shift) do espectro de fluorescência do complexo formado indicado pelas setas da figura 3 para a interaçao com ácido clorogênico e/ou ácido cafeico com a enzima. O red shift do comprimento de onda de emissao máxima de 334 para 348 nm da α-amilase na presença de ácido clorogênico e de 334 para 342 nm da α-amilase na presença de ácido cafeico, respectivamente, pode caracterizar um aumento da polaridade (ou uma diminuiçao da hidrofobicidade) na regiao vizinha ao sítio de triptofano, sugerindo uma transiçao conformacional na enzima.24 Contrariamente, nao foi verificado nenhum desvio para a interaçao de α-amilase na presença de ácido ferúlico ou quercetina. Embora seja especulativo, ambas as estruturas apresentam uma maior característica hidrofóbica (grupo metileno no ácido ferúlico e maior superfície apolar na quercetina) quando comparado aos demais testados, o que pode relacionar-se com uma menor energia de ligaçao com a enzima. O efeito da interaçao entre a α-amilase e os ligantes foi quantitativamente abordado pela equaçao 5 de Stern-Volmer, e está representado na Figura 5.
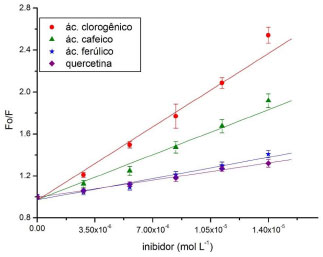 Figura 5. Gráfico de Stern-Volmer da interaçao de α-amilase com os polifenóis. T=323 K
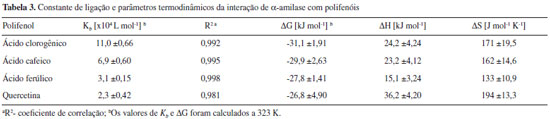
Esses resultados mostram uma tendência linear com a concentraçao dos polifenóis, sugerindo um comportamento estático (interaçao) ou dinâmico (colisional) para a extinçao observada. Embora essa distinçao possa ser apenas comprovada fluorimetricamente por determinaçao da constante de tempo de vida do fluoróforo (τ0) em diferentes temperaturas,15 o potencial inibitório dos polifenóis atesta o caráter estático do fenômeno. Utilizando dados obtidos para a constante de interaçao dos complexos (Kb) em diferentes temperaturas, os parâmetros termodinâmicos foram calculados a partir da equaçao 8 para energia de Gibbs (ΔG) e equaçao 9 de Van't Hoff para a variaçao da entalpia (ΔH) e variaçao da entropia (ΔS).16 Os dados estao representados na Tabela 3. 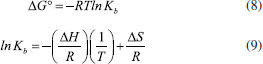
A energia de Gibbs dos complexos formados apoia uma maior interaçao para o ácido clorogênico, e menor interaçao para a quercetina, corroborando com os dados cinéticos apresentados. Valores positivos para ΔS podem indicar uma desordem parcial na estrutura do solvente, pela exclusao das moléculas de água próximas ao sítio de interaçao do complexo.25 Adicionalmente, valores positivos para ΔH e ΔS estao relacionados a interaçoes iônicas, plausíveis de ocorrer entre os carboxilatos do ácido clorogênico (pK~3,35), ácido cafeico (pK~4,37) e ácido ferúlico (pK~4,58) no pH 5,9 dos ensaios,26,27 com cadeias laterais de histidina, lisina e arginina na macromolécula. Isso sugere um mecanismo entropicamente dirigido da associaçao, contrapondo-se à contribuiçao entálpica relacionada à formaçao e quebra de ligaçoes de hidrogênio, às interaçoes de Van der Waals, e aos efeitos de protonaçao que podem acompanhar a associaçao.25 De fato, o domínio catalítico de α-amilase de Aspergillus oryzae exibe resíduos de aminoácidos básicos próximos ao subsítio de clivagem do substrato (-3 a +3).21 Complementarmente, isso poderia sugerir uma interaçao dos grupos aminados desses resíduos com íons carboxilatos de ácido clorogênico (menor valor de pKa), ácido ferúlico e cafeico (valores intermediários de pKa) e, em menor grau, com quercetina (valores de pKa elevados, 7,4 e 8,2, para os fenóis).28 Relaçao estrutura-atividade dos complexos A partir dos resultados de cinética e equilíbrio, que sugerem a magnitude do efeito biológico relacionado a determinadas propriedades dos ligantes, buscou-se analisar a relaçao da atividade biológica e formaçao dos complexos com alguns parâmetros reportados para os mesmos. Parâmetros como polarizabilidade, lipofilicidade, área total de superfície polar (TPSA) encontrados em base de dados dos compostos,29 foram contrastados com o parâmetro de atividade inibitória da catálise, IC50 (concentraçao do inibidor que fornece metade da inibiçao máxima), obtido a partir da Equaçao 10 para inibiçao competitiva, ao passo que valores de pKa encontrados na literatura foram contrastados com a constante de interaçao do complexo (Kb).30 Os resultados que apresentaram correlaçao significativa entre os descritores e os parâmetros biológicos avaliados (IC50 e Kb) estao apresentados na Figura 6. 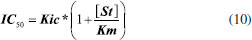
 Figura 6. Relaçao de parâmetros encontrados nos ensaios de cinética e equilíbrio (IC50 e Kb) com descritores reportados para os polifenóis
Com base nesses resultados pode-se afirmar que houve uma correlaçao positiva entre a atividade biológica (ligaçao e catálise) da α-amilase com os descritores de natureza polar dos polifenóis (reduçao com lipofilicidade, aumento com polarizabilidade, TPSA e pKa). Esses resultados também corroboram com um mecanismo plausível de interaçao do íon carboxilato dos polifenóis com o sítio ativo da enzima como já sugerido. A fim de se testar essa hipótese, procedeu-se a avaliaçao espectrofluorimétrica da interaçao de α-amilase em 323 K com o ácido clorogênico como modelo, variando-se pH (3,0 a 10,0) e força iônica (NaCl, 0 a 10%). Os resultados estao apresentados na Figura 7.
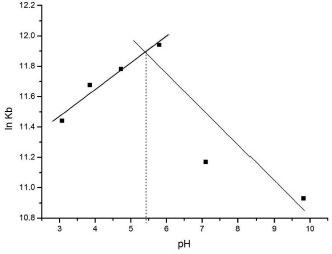 Figura 7. Interaçao de α-amilase com ácido clorogênico em 323 K sob variaçao de pH
A Figura 7 apresenta dois comportamentos lineares para a constante Kb em funçao do pH. Extrapolando-se linhas retas a partir desses resultados obtêm-se uma intersecçao a 5,5 no eixo das abscissas coincidente com a faixa de pKa para His livre (5,6 a 7,0),14 e reforçando-se a hipótese sugerida. De fato, a enzima possui três resíduos de His nos subsítios catalíticos, His 80, His 122 e His 210, todos envolvidos em ligaçoes de hidrogênio com o substrato em pH 7,5.21 No presente trabalho, os ensaios realizados em pH 5,9 sugerem a existência de uma populaçao mínima de espécies carregadas positivamente para esses resíduos. Complementarmente, a Figura 6 sugere que a ligaçao de maior estabilidade com a enzima (Kb) ocorreu para o ligante com maior intervalo entre o valor de pKa e o pH dos ensaios. Os resultados obtidos da titulaçao espectrofluorimétrica de ácido clorogênico sob variaçao de força iônica (Figura 8) mostraram uma relaçao inversa na qual a estabilidade do complexo reduz em funçao do teor salino.31 O gradiente negativo resultante do efeito da adiçao do sal neutro na interaçao ligante-proteína indica que os íons reagentes (ligante e proteína) exibem sinais contrários, reforçando a hipótese de estabilizaçao dos complexos por interaçao eletrostática do carboxilato do ácido clorogênico à proteína. Como a enzima apresenta um valor de ponto isoelétrico (pI) em torno de 4,5,32 o pH 5,9 utilizado nos ensaios implica que a mesma se apresentou na forma aniônica.33 De fato, utilizando-se uma calculadora virtual de propriedades físico-químicas para a sequência primária da enzima (Innovagen, http://www.pepcalc.com),22 foi contabilizado o valor de -14 para a rede de carga líquida da enzima no pH 5,9 do ensaio, e valor de pI de 4,15. Entretanto, sao encontrados em torno dos subsítios de catálise da enzima seis resíduos de aminoácidos básicos (Arg, Lys e His) e apenas dois resíduos ácidos (Asp),21 o que pode contribuir para a interaçao do carboxilato do ácido clorogênico, tendo em vista os valores de pK das cadeias laterais dos aminoácidos livres de 9,4 para Lys (ε-amino) e de 12,1 para Arg (grupo guanidínio).14 Esse dado também apoia a possibilidade de interaçao do ligante ionizado com aminas imidazólicas de resíduos de His nos subsítios catalíticos da enzima (His 80, His 122 e His 210).21
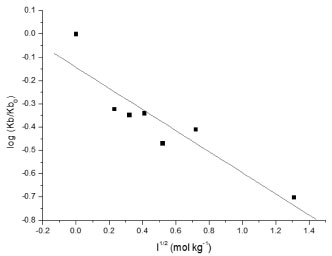 Figura 8. Interaçao de α-amilase com ácido clorogênico em 323 K sob variaçao de força iônica
CONCLUSAO Os polifenóis testados em diferentes temperaturas apresentaram potencial de inibiçao crescente frente a catálise da α-amilase até 323 K. O ácido clorogênico foi o que apresentou maior estabilidade na formaçao dos complexos, com menor valor de Kic, maior sensibilidade com a temperatura e maior inibiçao na temperatura ótima da enzima (323 K). A interaçao dos polifenóis com α-amilase revelou valores de Kb crescentes com a temperatura, e os parâmetros termodinâmicos ΔH e ΔS indicaram um mecanismo entropicamente dirigido para a associaçao. O estudo da relaçao estrutura-atividade demonstrou uma correlaçao positiva entre a atividade biológica da α-amilase (ligaçao e catálise) com os descritores de natureza polar dos polifenóis, sugerindo um mecanismo de estabilizaçao dos complexos por interaçao eletrostática entre o íon carboxilato dos ligantes com o sítio ativo da enzima, e que foi corroborado variando-se o pH e a força iônica nos ensaios. Como um todo, os resultados apresentados sugerem que o procedimento de mosturaçao para a elaboraçao de cerveja pode ser influenciado pela inibiçao de polifenois intrínsecos do malte nas faixas de temperatura empregadas no processo.
REFERENCIAS 1. Bakkialakshmi, S.; Shanthi, B.; Bhuvanapriya, T.; Spectrochim. Acta, Part A 2012, 90, 12. 2. http://www.sebraemercados.com.br/wp-content/uploads/2015/12/2014_05_20_RT_Mar_Agron_Cerveja_pdf.pdf, acessada em novembro 2016 3. https://sebrae.com.br/sites/PortalSebrae/artigos/microcervejarias-ganham-espaco-no-mercado-nacional,fbe9be300704e410VgnVCM1000003b74010aRCRD, acessada em abril de 2017. 4. Bamforth, C.; Brewing materials and processes: A practical approach to beer excellence, 1th ed., Academic Press: California, 2016. 5. Briggs, D. E.; Brookes, P. A.; Stevens, R.; Boulton, C. A.; Brewing: science and practice, 1th ed., CRC Press: New York, 2004. 6. MacGregor, E. A.; Janeček, Š.; Svensson, B.; Biochim. Biophys. Acta, Protein Struct. Mol. Enzymol. 2001, 1546, 1. 7. Gonçalves, R.; Mateus, N.; De Freitas, V.; Food Chem. 2011, 125, 665. 8. He, Q.; Lv, Y.; Yao, K.; Food Chem. 2007, 101, 1178. 9. Hill, G. A.; Macdonald, D. G.; Lang, X.; Biotechnol. Lett. 1997, 19, 1139. 10. Aron, P. M.; Shellhammer, T. H.; J. Inst. Brew. 2010, 116, 369. 11. Collin, S.; Jerkovic, V.; Bröhan, M.; Callemien, D.; Nat. Prod. 2013, 1, 2333. 12. Marova, I.; Parilova, K.; Friedl, Z.; Obruca, S.; Duronova, K.; Chromatographia 2011, 73, 83. 13. Bisswanger, H; Enzyme kinetics: principles and methods, 2th ed., John Wiley & Sons: Weinhein, 2008. 14. Marangoni, A. G.; Enzyme kinetics: a modern approach, 1th ed., John Wiley & Sons: New Jersey, 2003. 15. Valeur, B.; Berberan-Santos, M. N.; Molecular fluorescence: principles and applications, 2th ed., Wiley-VCH: Weinhein, 2012. 16. Gore, M. G.; Spectrophotometry and spectrofluorimetry: a practical approach, 2th ed., Oxford University Press: New York, 2000. 17. Trnková, L.; Bousova, I.; Kubicek, V.; Drsata, J.; Natural Science 2010, 2, 563. 18. Rashidipour, S.; Naeeminejad, S.; Chamani, J.; J. Biomol. Struct. Dyn. 2016, 34, 57. 19. Van de Weert, M.; Stella, L.; J. Mol. Struct. 2011, 998, 144. 20. Atkins, P.; De Paula, J.; Physical chemistry for the life sciences, 2th ed., Oxford University Press: USA, 2011. 21. Brzozowski, A. M.; Davies, G. J.; Biochemistry 1997, 36, 10837. 22. http://www.uniprot.org/uniprot/, acessada em outubro 2016. 23. Sun, L.; Chen, W.; Meng, Y.; Yang, X.; Yuan, L.; Guo, Y.; Food Chem. 2016, 208, 51. 24. Hu, Y. J.; Chen, C. H.; Zhou, S.; Bai, A. M.; Ou-Yang, Y.; Mol. Biol. Rep. 2012, 39, 2781. 25. Ross, P. D.; Subramanian, S.; Biochemistry 1987, 20, 3096. 26. Šeruga, M.; Tomac, I.; Int. J. Electrochem. Sci. 2014, 9, 6134. 27. Ozkorucuklu, S. P.; Beltrán, J. L.; Fonrodona, G.; Barrón, D.; Alsancak, G.; Barbosa, J.; J. Chem. Eng. Data 2009, 54, 807. 28. Rojas-Romo, C.; Serrano, N.; Ariño, C.; Arancibia, V.; Díaz-Cruz, J. M.; Esteban, M.; Talanta 2016, 155, 21. 29. https://pubchem.ncbi.nlm.nih.gov/compound/quercetin#section=Top, acessada em abril de 2017. 30. Cer, R. Z.; Mudunuri, U.; Stephens, R.; Lebeda, F. J.; Nucleic Acids Res. 2009, 37, 441. 31. Bunton, C. A.; Robinson, L. B.; J. Org. Chem. 1969, 34, 780. 32. Altikatoglu, M.; Tavukcuoglu, Ö.; Mustafaev, M.; Protein J. 2010, 29, 120. 33. Deshpande, S. S.; Cheryan, M.; J. Food Sci. 1984, 49, 516. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access