Artigo
|
|
| Perfil dos componentes voláteis produzidos pelo fungo fitopatógeno Albonectria Rigidiuscula em diferentes condições de cultivo Volatile components profile produced by the phytopathogenic fungus Albonectria Rigidiuscula in different conditions culture |
|
Francisco C. OliveiraI; Francisco G. BarbosaI,*; Jair MafezoliI; Maria da C. F. de OliveiraI; Francisco J. T. GonçalvesII; Francisco C. O. FreireII
IDepartamento de Química Orgânica e Inorgânica, Universidade Federal do Ceará, 60455-760 Fortaleza - CE, Brasil Recebido em 15/12/2016 *e-mail: fgerhar@gmail.com The VOCs produced by the Albonectria rigidiuscula fungus in different conditions were obtained by headspace-solid phase microextraction (HS-SPME) and analyzed by gas chromatography-mass spectrometry (GC-MS). Fourty-four VOCs were identified in different culture media and incubation periods. The highest production of VOCs occurred in solid rice medium and 14 days of incubation. The compounds 3-methylbutan-1-ol, 2-methylbutan-1-ol, γ-muurolene and nerolidol acetate were produced by A. rigidiuscula in all culture conditions. γ-Muurolene was identified as the major compound (40.78%, 26.24% and 27.04%) in PD medium and it was suggested as a chemical marker for this fungus. The use of multivariate data analysis (PCA) and (HCA) allowed the discrimination of the volatile chemical profiles according to the culture medium. INTRODUÇAO Albonectria rigidiuscula (Berk. & Br.) Ross. & Sam., sin. Calonectria rigidiuscula e Nectria rigidiuscula (Nectriaceae) é um fungo fitopatógeno que tem como anamorfo o fungo Fusarium decemcellulare.1 A espécie A. rigidiuscula é comum em países tropicais, sendo descrita também na China.2-4 No Brasil esta espécie é causadora da cancrose da pinha (Annona squamosa L.) e compromete o cultivo dessa cultura no cerrado de Goiás, Minas Gerais e Distrito Federal. Neste caso, a infecçao da planta é iniciada por conídios ou esporos do anamorfo F. decemcellulare ou por ascósporos de A. rigidiuscula. Após o estabelecimento da fitopatologia e formaçao do cancro, a resposta desencadeada pela planta infectada faz com que o anamorfo F. decemcellulare, em estágio envelhecido, passe a produzir a sua fase teleomorfa ou perfeita, transformando-se em A. rigidiuscula.5 O anamorfo F. decemcellulare também está relacionado com importantes fitopatologias, tais como morte de ponteiras, cancrose, galhas, podridao dos frutos, cancro-do-ramo e superbrotamento de plantas das famílias Anacardiaceae, Annonaceae, Sterculiaceae, Malvaceae, Apocynaceae, Euphorbiaceae, Meliaceae, Moraceae e Myrtaceae.5 Exemplo de dano causado na agricultura foi relatado por Qi et al., no qual durante os anos de 2009 e 2011 uma doença causada por F. decemcellulare comprometeu significativamente o cultivo de manga (Mangifera indica) na China.6 A partir do cultivo de A. rigidiuscula em meio fermentativo de arroz foram isolados quatro derivados de pirrolidinona com potencial citotóxico.3 Para o anamorfo F. decemcellulare foram identificados 10 pigmentos naftoquinônicos, sendo sua biossíntese influenciada diretamente pelas condiçoes de cultivo.7 Nao há relatos de estudos relacionados à produçao de compostos orgânicos voláteis (COVs) por A. rigidiuscula ou seu anamorfo. Em nosso grupo de pesquisa temos investigado a produçao de COVs como uma ferramenta auxiliar na discriminaçao de fungos da família Botryosphaeriaceae. Nos estudos sao combinadas técnicas de microextraçao em fase sólida por headspace (HS-SPME), análise por cromatografia gasosa acoplada à espectrometria de massas (CG-EM) e análise multivariada de dados (PCA e HCA).8 Sabendo-se que a produçao de COVs por espécies fúngicas ocorre através de mecanismos diversificados em funçao das diferentes fontes de carbono ou nitrogênio,9 neste trabalho, descreve-se a investigaçao do perfil de COVs produzidos pelo fungo fitopatógeno A. rigidiuscula cultivado em quatro meios de cultura diferentes e em três períodos de incubaçao; usando a HS-SPME como técnica de extraçao, a CG-EM como técnica de análise e a PCA/HCA como ferramenta quimiométrica para tratamento de dados.
EXPERIMENTAL Obtençao e identificaçao do fungo Uma cepa do fungo A. rigidiuscula foi isolada a partir de ramos de Psidium guajava com sintomas de seca descendente, coletada no bioma Caatinga, Crato-CE (S 07°13'38"; W 39°26'20"), Brasil e encontra-se depositada no laboratório de Fitopatologia da Embrapa Agroindústria Tropical - CNPAT sob a supervisao do Dr. Francisco das Chagas Oliveira Freire. A identificaçao do fungo se deu através de biologia molecular, com DNA extraído a partir do micélio de uma cepa, utilizando kit de isolamento UltraClean Microbial DNA da Mo-Bio laboratories. Fragmentos contendo o gene do RNA ribosomal 26S, grande subunidade D1 e D2 regiao (LSU) foram amplificados utilizando os primers LR0R (ACCCGCTGAACTTAAGC) e LR5 (TCCTGAGGGAAACTTCG). Fragmentos contendo o espaçador transcrito interno 1 e 2 e o gene 5.8.S (ITS) foram amplificados utilizando primers LS266 (GCATTCCCAAACAACTCGACTC) e V9G (TTACGTCCCTTTGTA). Fragmentos contendo o fragmento parcial do gene betatubulina (BT) foram amplificados utilizando primers BT2a (GGTAACCAAATCGGTGCTGCTTTC) e BT2b (ACCCTCAGTGTAGTGACCCTTGGC). Fragmentos contendo o fragmento parcial do gene de actina (ACT) foram amplificados utilizando primers ACT-512F (ATGTGCAAGGCCGGTTTCGC) e ACT-783R (TACGAGTCCTTCTGGCCCAT). Fragmentos contendo o Translocation Elongation Factor 1 alfa (TEF) foram amplificados utilizando primers EF1-728F (CATCGAGAAGTTCGAGAAGG) e EF2 (AACTTGCAGGCAATGTGG). Os fragmentos foram sequenciados com o kit de sequenciamento ABI Primr Big DyeTM Terminator v.3.0 ready Reaction Cycle. As amostras foram analisadas em analisador genético ABI PRISM 3700 Genetic Analyzer e os contigs foram montados utilizando as sequências de avanço e retrocesso com o programa SeqMan da LaserGene package. Uma análise multigênica foi realizada comparando as sequências no GenBank, on http://www.cbs.knaw.nl/ e na base de dados interna da CBS com as espécies mais recentes. Meios de cultura e materiais Caldo de batata dextrose (BD) foi adquirido da Himediar (Mumbai, India) e preparado de acordo com instruçoes do fabricante (24,0 g L-1, pH 5,1±0,2). O meio peptona foi obtido da Sigma-Aldrichr (St. Louis, USA). O meio semi-sólido batata dextrose agar (BDA) foi obtido da Himediar (Mumbai, India) e preparado de acordo com instruçoes do fabricante. O meio sólido foi preparado com arroz "Uncle Bens"r (10 g) adicionado em um frasco de vidro de 40 mL, juntamente com 8,4 mL de água destilada e autoclavado por 45 min a 15 lbs (121 ºC). Os vials de vidro (40 mL) com tampas de rosca e septos de PTFE/silicone e as fibras de polidimetilsiloxano (PDMS 100 µm) e polidimetilsiloxano/divinilbenzeno (PDMS/DVB 65 µm) foram obtidas da Sigma-Aldrichr (St. Louis, USA). As placas de Petri estéril descartáveis (90 x 15 mm) foram adquiridas da J. Prolabr (Sao José dos Pinhais, Brasil). A mistura de n-alcanos saturados C7-C30 foi obtida da Sigma-Aldrichr (St. Louis, USA). Cultivo do fungo e extraçao dos COVs A cepa de fungo foi inoculada em placas de Petri contendo meio BDA e incubada durante 7 dias a 25 ºC para assegurar que tinha a mesma idade. Um pellet (6 mm de diâmetro) da cepa foi transferido para frascos (40 mL) contendo 10 mL de BD, BDA, Peptona ou graos de arroz (10 g) e imediatamente selados com septos de PTFE/silicone e tampas roscadas. Após incubaçao durante 7, 14 e 21 dias a 25 ºC sob condiçoes estáticas, os frascos foram colocados em banho de etileno glicol a 60 ºC e os COVs foram extraídos por 10 min por HS-SPME utilizando uma fibra PDMS/DVB colocada acima (cerca de 1 cm) da superfície da cultura fúngica. Em seguida, a fibra foi removida e inserida na CG-EM a 250 ºC durante 4 min para a dessorçao dos COVs. Utilizou-se como controle (brancos) os frascos contendo apenas os meios de cultivo sem adiçao do fungo. Para a otimizaçao das condiçoes HS-SPME foi realizado um planejamento com duas variáveis quantitativas em dois níveis (temperatura: 50 e 60 ºC e tempo de extraçao: 10 e 20 min), em duplicata, e uma variável qualitativa (tipo de fibra: PDMS e PDMS/DVB). Foram realizados 24 experimentos, sendo 16 com o fungo e 8 controles. A análise estatística foi realizada utilizando-se o programa Quality Tools: Statistics in Quality Science.10 Análises de CG-EM As análises de CG-EM foram realizadas em um cromatógrafo a gás (Shimadzu, modelo QP-2010 Ultra), equipado com detector seletivo de massas, com auto injetor (Shimadzu, modelo AOC-20i), com coluna capilar de sílica fundida RTX-5MSr (Bellefonte, USA), (5% de dimetilsiloxisano), com dimensoes 30 m x 0,25 mm x 0,25 µm. A programaçao de temperatura do forno CG consistiu em 25 °C durante 2 min (período de dessorçao), 20 ºC/min, até 195 ºC, 10 ºC min-1 até 220 ºC, 20 ºC min-1 até 280 ºC. Os parâmetros instrumentais foram: temperatura do injetor de 250 ºC; modo de injeçao split de 1:5; vazao volumétrica da fase móvel de 1,7 mL min-1; temperatura do detector de 250 ºC. Os COVs produzidos por A. rigidiuscula sob diferentes condiçoes foram identificados pela comparaçao dos espectros de massa obtidos com os de bibliotecas espectrais de massa (Adams,11 Pherobase12 e NIST13), bem como dos índices de retençao calculados baseados na cromatografia gasosa com programaçao linear de temperatura14 com os da literatura.12,13 Os n-alcanos (C7-C30, Sigma-Aldrichr) foram utilizados como pontos de referência no cálculo dos índices de retençao linear. Análise multivariada de dados Os constituintes voláteis, extraídos por HS-SPME e identificados por CG-EM, foram submetidos a análises de PCA e HCA, utilizando o software livre R Project da R Foundation for Statistical Computingr.10 Os dados analisados correspondem às médias das injeçoes em triplicata e o arranjo matricial foi constituído por doze linhas (número de condiçoes de cultivo) e quarenta e quatro colunas (compostos identificados). Para o HCA utilizou-se a distância euclidiana como coeficiente de dissimilaridade e o agrupamento foi feito pelo método de associaçao média (Ward), com a opçao de truncamento automático para definir os conglomerados e obter o dendrograma.15
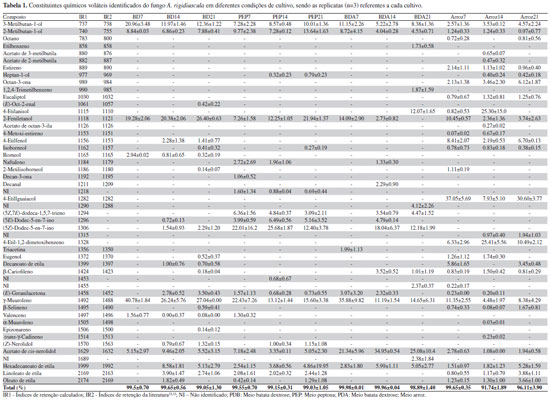
RESULTADOS E DISCUSSAO A extraçao de compostos voláteis por HS-SPME produzidos pelo fungo A. rigidiuscula em diferentes condiçoes de cultivo foi otimizada através de planejamento experimental 23, considerando-se temperatura (50 e 60 ° C), tempo de extraçao (10 e 20 min) e tipo de fibra (PDMS e PDMS/DVB) como variáveis. Como resultado, obteve-se o maior número de COVs detectados quando o experimento foi realizado a 60 ° C, 10 min e com a fibra PDMS/DVB. Conforme mostrado no gráfico de Pareto (Figura 1), a temperatura (A) foi a variável, que isoladamente apresentou maior influência na extraçao de COVs, mostrando que a otimizaçao das condiçoes de extraçao de VOCs por HS-SPME é necessária. De acordo com dados da literatura,8,16 a temperatura e o tempo afetam a eficiência de extraçao, alterando a cinética de transferência de massa dos compostos voláteis entre as diferentes fases do sistema, bem como a termodinâmica que descreve o equilíbrio de partiçao dos COVs.
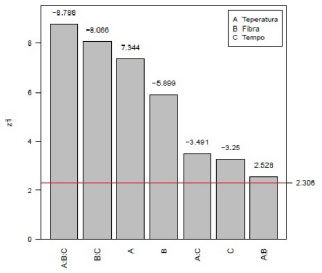 Figura 1. Gráfico de Pareto dos efeitos da temperatura (A), tipo de fibra (B) e tempo (C) na extraçao de COVs por HS-SPME do fungo A. rigidiuscula
Foram utilizados dois meios de cultivo líquidos, sendo um rico em carbono (BD sintético) e outro rico em carbono e nitrogênio (peptona sintético), um meio semi-sólido (BDA) e um meio sólido (arroz). Em todos os casos, A. rigidiuscula foi cultivado em três períodos distintos (7, 14 e 21 dias), sendo as extraçoes e análises de COVs realizadas no final de cada período. A condiçao que apresentou a maior produçao de COVs foi o cultivo de A. rigidiuscula em arroz durante 14 dias de incubaçao, sendo produzidos 32 compostos voláteis. No entanto, neste meio, houve uma diminuiçao na produçao destes compostos com 21 dias de incubaçao. O cultivo de A. rigidiuscula em BD com 7 dias de incubaçao apresentou a menor produçao de compostos voláteis, totalizando 7 COVs. Contudo, neste mesmo meio, houve um aumento crescente de COVs diretamente proporcional ao aumento do período de incubaçao, sendo observada a produçao máxima de 28 COVs em 21 dias de incubaçao. Para os meios peptona e BDA nao houve variaçoes significativas na produçao de COVs (Figura 2).
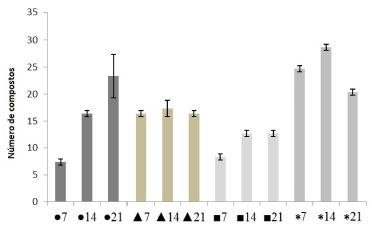 Figura 2. Produçao de COVs pelo fungo A. rigidiuscula em diferentes con diçoes: BD (● 7, 14 e 21 dias), peptona (▲ 7, 14 e 21 dias), BDA (■ 7, 14 e 21 dias) e arroz (* 7, 14 e 21 dias), sendo n=3
Utilizando-se as condiçoes otimizadas de extraçao por HS-SPME, após análise por CG-EM, foram identificados 44 COVs, os quais nao foram observados nos cultivos controles (Tabela 1). A maioria dos compostos identificados pertence às classes dos sesquiterpenos (7 nao oxigenados e 3 oxigenados) e monoterpenos (6 oxigenados). Além desses, foram identificados hidrocarbonetos de baixa massa molecular (4), hidrocarbonetos aromáticos (4), álcoois de baixa massa molecular (3), aldeídos (2), cetonas (2), ésteres de baixa e média massa molecular (5), compostos aromáticos oxigenados (5) e ésteres etílicos de ácidos graxos (3).
Os únicos compostos produzidos por A. rigidiuscula nos quatro meios de cultura e nos três períodos de incubaçao foram o 3-metilbutan-1-ol, 2-metilbutan-1-ol, γ-muuroleno e acetato de nerolidol. Embora em alguns casos esses compostos tenham sido detectados em pequenas quantidades, a prevalência em todas as condiçoes credenciam este grupo de COVs como possíveis marcadores para este fungo. Dentre estes compostos, o γ-muuroleno foi o majoritário e produzido, principalmente, no meio BD com teores significativos (40,78%; 26,24% e 27,04%) para 7, 14 e 21 dias de incubaçao, respectivamente. Alguns compostos foram específicos para um determinado meio de cultura. O octano, acetato de 3-metilbutan-1-ol, acetato de 2-metilbutan-1-ol, octan-3-ona, eucaliptol, acetato de octan-3-ol e α-muuroleno foram produzidos pelo fungo apenas em arroz. O composto decan-3-ona foi específico para o meio BD. Já os compostos etilbenzeno, 1,2,4-trimetilbenzeno, decanal e triacetina foram específicos para o meio de cultivo BDA. De acordo com a literatura, compostos microbianos podem ser produzidos de forma exclusiva por determinados microrganismos em condiçoes controladas.9,17 Comparaçao dos compostos identificados em A. rigidiuscula com banco de dados de compostos voláteis microbianos18 revelou que apenas dezesseis deles foram anteriormente descritos como compostos voláteis de fungos (3-metilbutan-1-ol, 2-metilbutan-1-ol, octano, etilbenzeno, acetato de 3-metilbutan-1-ol, acetato de 2-metilbutan-1-ol, 1,2,4-trimetilbenzeno, feniletanol, naftaleno, decanal, (E)-geranilacetona, γ-muuroleno, β-selineno, valenceno, epizonareno, α-muuroleno). Compostos como borneol, 2-metilisoborneol, decan-3-ona, isoborneol, 4-etilguaiacol, decanoato de etila e β-cariofileno foram relatados como COVs de origem bacteriana. Já a maior parte dos compostos identificados (21, ca. 48%) estao sendo relatados pela primeira vez como COVs fúngicos. A análise de componentes principais (PCA) e a análise de agrupamento hierárquico (HCA), utilizando o programa R,10 foram empregadas como técnicas estatísticas multivariadas para explicar as diferenças entre conjuntos das doze amostras (condiçoes de cultivo), sendo quatro meios de cultivo e três períodos de incubaçao do fungo A. rigidiuscula. Os dados submetidos à analise multivariada correspondem aos resultados cromatográficos (CG-EM) da média calculada das injeçoes em triplicata dos VOCs extraídos por HS-SPME. Para analisar e comparar os perfis de voláteis, todos os compostos identificados foram considerados. De acordo com a análise de PCA (Figura 3), a partir dos perfis de voláteis foi possível distinguir quase todas as condiçoes de cultivo, que explica em dois componentes principais 42,27% da variância total. A PCA só se mostrou ambígua na discriminaçao dos perfis voláteis do fungo cultivado em BD e BDA no período de sete dias. O dendrograma da análise de HCA (Figura 4) permite identificar um padrao de similaridade nos perfís de voláteis, conforme o meio de cultivo. Contudo, para os meios BD e BDA em sete dias de incubaçao essa distinçao nao se mostra satisfatória.
 Figura 3. PCA dos escores de 44 variáveis de doze amostras obtidas por HS-SPME e CG-EM do fungo A. rigidiuscula em diferentes condiçoes de cultivo
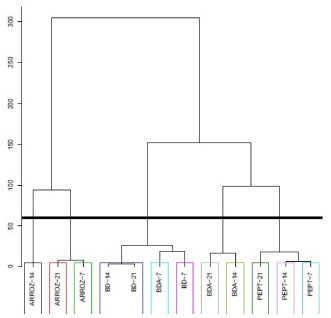 Figura 4. Dendrograma de HCA de doze amostras obtidas por HS-SPME e CG-EM do fungo A. rigidiuscula em diferentes condiçoes de cultivo
CONCLUSAO O perfil de compostos orgânicos voláteis de uma cepa do fungo A. rigidiuscula, em diferentes meios de cultivo e em diferentes períodos de incubaçao, foi investigada pela primeira vez, e quarenta e quatro compostos foram identificados. A utilizaçao da PCA e HCA permitiu a discriminaçao dos perfis químicos de voláteis de acordo com o meio de cultivo, principalmente para os meios Batata-Dextrose e Arroz. A maior produçao de COVs ocorreu no meio sólido Arroz com 14 dias de incubaçao. Alguns compostos foram identificados em todas as condiçoes de cultivo. Dentre estes, o γ-muuroleno, que é produzido majoritariamente no meio BD e apresenta potencial para ser utilizado como marcador químico volátil para o fungo A. rigidiuscula.
MATERIAL SUPLEMENTAR Figuras 1S-50S com espectros de massa dos COVs obtidos por CG-EM estao disponíveis em http://quimicanova.sbq.org.br, em arquivo pdf, com livre acesso.
AGRADECIMENTOS Os autores agradecem às agências brasileiras CNPq (484130/2012-9 e 405001/2013-4) e FUNCAP (004.01.00/10) pelo apoio financeiro, à Profa. Dra. Terezinha F. de Oliveira (Faculdade de Estatística, UFPA) pelas discussoes da análise multivariada e à CAPES pela bolsa de Francisco C. de Oliveira.
REFERENCIAS 1. Rossman, Y.; Samuels, J.; Rogerson, T.; Lowen, R.; Stud. Mycol. 1999, 42, 105. 2. Nong, Y.; Zhuang, Y.; Fungal Divers. 2005, 19, 95. 3. Li, J.; Liu, S.; Niu, S.; Zhuang, W.; Che, Y.; J. Nat. Prod. 2009, 72, 2184. 4. Lombard, L.; Bogale, M.; Montenegro, F.; Wingfield, D.; Wingfield, J.; Fungal Divers. 2008, 31, 73. 5. Junqueira, V.; Santiago, R.; Pinto, Q.; Chaves, C.; Embrapa Cerrados 2001, 16, 21. 6. Qi, X.; Pu, J.; Zhang, X.; Zhang, H.; Lu, Y.; Yu, F.; Zhang, Q.; Xie, X.; J. Phytopathol. 2013, 161, 735. 7. Medentsev, G.; Arinbasarova, A. Yu.; Akimenko, K.; Appl. Biochem. Microbiol. 2005, 41, 503. 8. Oliveira, C.; Barbosa, G.; Mafezoli, J.; Oliveira, F.; Camelo, M.; Longhinotti, E.; Lima, A.; Câmara, S.; Gonçalves, T.; Freire, O.; J. Braz. Chem. Soc. 2015, 26, 2189. 9. Bago, B.; Pfeffer, E.; Douds, D.; Brouillette, J.; Bécard, G.; Shachar-Hill, Y.; Plant Physiol. 1999, 121, 263. 10. R Development Core Team (2014); R: A language and environment for statistical computing; R Foundation for Statistical Computing, Vienna, Austria, available at http://www.R-project.org 11. Adams, P.; Identification of Essential Oil Components by Gas Chromatography/Mass Spectrometry, 4th ed., Carol Stream: Illinois, 2007. 12. http://www.pherobase.com/database/compound/compounds-index.php?isvalid=yes, accessed in May 2017. 13. http://webbook.nist.gov/chemistry/, accessed in May 2017. 14. Dool, H.; Kratz, D.; J. Chromatogr. 1963, 11, 463. 15. Jr, F.; Anderson, E.; Tatham, L.; Black, W. C. Análise Multivariada de Dados. 5a ed., Bookman: Porto Alegre, 2005. 16. Valente, P.; Augustos, F.; Quim. Nova 2000, 23, 523; Dórea, S.; Gaujac, A.; Navickiene, S.; Scientia Plena 2008, 4, 1. 17. Polizzi, V.; Adams, A.; Malysheva, V.; Saeger, S.; Peteghem, V.; Moretti, A.; Picco, M.; Kimpe, N. Sci Total Environ. 2012, 414, 277. 18. Lemfack, C.; Nickel, J.; Dunkel, M.; Preissner, R.; Piechulla, B.; Nucleic Acids Res. 2014, 42, 744. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access