Artigo
|
|
| Estudo mecanístico das reações fenton e cupro-fenton por análise voltamétrica in situ Mechanistic study of the fenton and cupro-fenton reactions by voltammetric analysis in situ |
|
Leidi C. Friedrich1,2,*; Carmem Lúcia P. S. Zanta3; Amilcar Machulek Jr.4; Frank H. Quina2
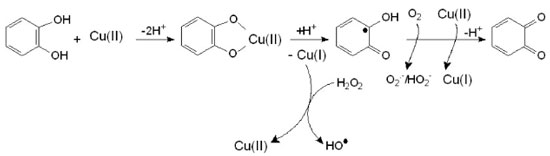
1. Departamento de Engenharias e Exatas, Universidade Federal do Paraná, Setor Palotina, 85950-000 Palotina - PR, Brasil Recebido em 21/12/2016 *e-mail: leidif@ufpr.br Although the classical Fenton process exhibits a high initial rate of the organic compounds degradation, this process is not complete due to the formation of refractory compounds which resist the attack of the hydroxyl radicals. In the presence of Cu(II), the degradation is slower, but results in a greater reduction of TOC (total organic carbon) measurements of net mineralization at the end of the reaction (t=120min). The addition of Cu(II) ions to classical Fenton reaction conditions (Fe(II) plus H2O2 at pH 3) is shown to accelerate the degradation of organic compounds. This synergic effect causes an approximately 15% additional reduction of the TOC. Voltammetric studies confirm the catalytic role of catechol in the presence of Fe(III)/Fe(II) and Cu(II)/Cu(I). Addition of aliphatic acids to the reaction medium, did not interfere with the cupro-Fenton reaction, but had an inhibitory effect on the classical Fenton reaction, consistent with the following order of interaction with the ion Fe(III): Oxalic Acid (OA) >> Formic Acid (FA) ~ Acetic acid (AA). INTRODUÇAO As águas residuais de diferentes indústrias químicas, como a produçao de resinas, agroquímicos e petroquímicos, a fabricaçao de papel e a fundiçao de ferro podem conter altas concentraçoes de fenol e seus derivados, que sao tóxicos e muitas vezes refratários.1-3 Várias abordagens estao sendo estudadas para minimizar o impacto do descarte desses efluentes. Entre as soluçoes propostas para este problema ambiental, os processos de oxidativos avançados (POAs), que se baseiam na geraçao do radical hidroxila como agente oxidante, sao particularmente atrativos como alternativa aos tratamentos físico-químicos ou biológicos convencionais.4-9 A reaçao de Fenton é um POA que consiste numa reaçao redox, na qual o Fe(II) é oxidado a Fe(III) por peróxido de hidrogênio, H2O2, o qual é por sua vez reduzido ao íon hidroxila e ao radical hidroxila, de acordo com a Equaçao (1):10 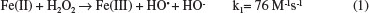 A eficiência da reaçao de Fenton é limitada à presença de compostos que reagem com o ferro, reduzindo a concentraçao dos catalisadores (íons de ferro livre) da soluçao, inibindo ou até mesmo parando completamente a reaçao de Fenton. Nesse caso a utilizaçao de cobre como catalisador pode ser uma alternativa para o tratamento de efluentes que contenham capturadores de ferro. O cobre está envolvido em processos biológicos de transferência de elétrons. Além disso, é um micronutriente essencial para o crescimento de fungos e funciona como um ativador de metal em várias enzimas fúngicas (por exemplo, oxidases) e na síntese de pigmentos.11 O cobre, como o ferro, pode sofrer reaçoes de tipo Fenton com H2O2 para produzir radicais hidroxila. Esta reaçao de cupro-Fenton12 tem sido usada para estudar a degradaçao de vários compostos de interesse tais como antraquinonas sintéticas, azoquinonas13 e azocorantes.14 O cobre também pode desempenhar um papel na biodegradaçao da podridao-branca da ligno-celulose. Embora modelos tenham sido propostos usando ferro como o metal de transiçao modelo para fungos de podridao parda,15 o cobre pode trabalhar nestes mecanismos igualmente bem. Segundo Xu e Goodell, a interaçao do ácido 2,3-dihidroxibenzóico (2,3-DHBA) com cobre, Cu(II), mostrou que Cu(II) pode oxidar o 2,3-DHBA em sua forma de semiquinona sob condiçoes ácidas, semelhante à reaçao de oxidaçao pelo Fe(III).16 Um estudo voltamétrico cíclico do sistema Cu(II), 2,3-DHBA e H2O2 mostrou que Cu(II) também pode reagir com derivados de dihidroxibenzeno a baixo pH para gerar radicais HO•, como no mecanismo de ciclo redox proposto por Liu et al.,17 mostrado no Esquema 1.
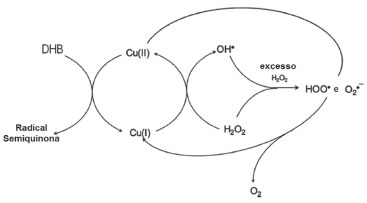 Esquema 1. Sistema redox de Cu(II) + dihidroxibenzeno (DHB) + H2O217
A atividade oxidante dos íons Fe(III) e Cu(II) foi avaliada para vários compostos fenólicos, principalmente derivados do catecol. O catecol é oxidado por Cu(II), gerando uma semiquinona que é subsequentemente oxidada para formar uma quinona. O oxigênio molecular (O2) também pode atuar como aceitador de elétrons, sendo reduzido pelo radical semiquinona ao superóxido/hidroperóxido, O2-/HO2, que pode ser convertido em H2O2. O mecanismo proposto por Aguiar et al.18 para a reduçao de Fe(III) ou Cu(II) por catecol é mostrado no Esquema 2. Portanto, existem várias vias envolvendo compostos fenólicos e íons metálicos que potencialmente podem aumentar a eficiência da reaçao de Fenton.19,20
Neste trabalho, relatamos uma investigaçao do mecanismo envolvido na degradaçao do fenol pelas reaçoes de Fenton e cupro-Fenton, utilizando a análise eletroquímica in situ. A técnica utilizada é a voltametria cíclica que é uma ferramenta poderosa que contribui para a elucidaçao do mecanismo reacional envolvido durante o processo de degradaçao.
PARTE EXPERIMENTAL Materiais e métodos Sulfato de ferro heptahidratado (FeSO4.7H2O, Synth), sulfato de cobre pentahidratado (CuSO4.5H2O, Synth), sulfato de sódio (Na2SO4, Vetec), peróxido de hidrogênio (H2O2, 30%, Synth), ácido sulfúrico (H2SO4, Synth), hidróxido de sódio (NaOH, Merck), fenol (Aldrich), catecol (Acros), ácido acético (Merck), ácido fórmico (Aldrich), ácido oxálico (Aldrich) e acetonitrila (JT Baker). Procedimento geral para os experimentos de degradaçao As soluçoes de fenol foram preparadas por dissoluçao direta da quantidade desejada de fenol em soluçao aquosa. O reator utilizado para a degradaçao do fenol foi um reator de bancada com um volume interno de 1,0 L, protegido da luz incidente de modo a minimizar o efeito das reaçoes fotoquímicas.3 A temperatura da soluçao foi controlada a 30 ºC, utilizando um banho termostático e com agitaçao magnética. Inicialmente, adicionou-se ao reator uma soluçao contendo 10 mmol L-1 de fenol, 0,5 mmol L-1 de Fe(II) e 0,5 mmol L-1 de Cu(II) em pH = 3,0. Adicionou-se lentamente peróxido de hidrogênio aquoso (3,33 mmol L-1 min-1), com a ajuda de uma bomba peristáltica, durante os primeiros 60 minutos de reaçao, para minimizar a formaçao do radical hidroperóxido. Em intervalos de tempo selecionados, foram coletados 5 mL de soluçao de amostra e adicionaram-se imediatamente 2 gotas de uma soluçao de 2,0 mol L-1 de NaOH, aumentando o pH para ~ 12. O aumento de pH precipitou Fe(III), parando a reaçao. As amostras foram filtradas através de um cartucho (0,22 µm Millipore Durapore) para remover as espécies de ferro precipitadas. Após filtraçao, a amostra foi reacidificada até um pH de cerca de 3,0 para manter as mesmas condiçoes que no reator e o carbono orgânico total (COT) foi analisado com um analisador Shimadzu Modelo TOC-5000A.21 Procedimento geral para a análise por Cromatografia Líquida de Alto Desempenho (HPLC) O fenol e os principais produtos de degradaçao (hidroxiaromáticos e ácidos alifáticos) foram identificados e quantificados por cromatografia líquida de alta eficiência (para hidroxiaromáticos - Shimadzu 2010A LC-MS e para ácidos alifáticos - Shimazdu 20AD HPLC) utilizando compostos padroes para identificaçao e calibraçao. Para a determinaçao de intermediários aromáticos, utilizou-se uma coluna de fase reversa C18 (5 µm, 4,6 x 150 mm) com detecçao a 270 nm. A fase móvel consistiu numa soluçao aquosa contendo 0,2% de ácido acético (A) e acetonitrila contendo ácido acético a 0,2% (B). Durante três minutos, a fase móvel (fluxo de 0,7 mL min-1) foi de 18% de B:82% de A, seguido de um gradiente de 18-58% de B ao longo de 10 minutos e completando a análise por reverter durante 1 minuto a 18% de B:82% A. Para determinar os ácidos intermediários, utilizou-se uma coluna de troca iônica, marca Hamilton PRP-X300, com detecçao a 220 nm. A fase móvel consistiu numa soluçao aquosa de H2SO4 (pH 2,00 ± 0,02), a um fluxo de 1 mL min-1, mantendo-se a temperatura da coluna a 30 ºC. Antes de serem injetadas na coluna de troca iônica, as amostras foram filtradas através de um cartucho, C18, previamente ativado com metanol. Este passo removeu os compostos aromáticos remanescentes, uma vez que estes compostos sao fortemente retidos na coluna de troca iônica, resultando em bandas largas que impedem a análise e podem ser irreversivelmente retidos na coluna.22 Procedimento geral para os experimentos eletroquímicos Os experimentos eletroquímicos foram realizados utilizando uma célula convencional de três eletrodos sem separaçao. Utilizou-se um eletrodo de carbono vítreo de 2 mm de diâmetro como eletrodo de trabalho, um fio de platina como eletrodo auxiliar e um eletrodo Ag/AgCl/KCl (sat.) como referência. Os estudos foram conduzidos num meio aquoso contendo 0,5 mol L-1 de Na2SO4 a pH 3,0, ajustado com H2SO4, utilizando um potenciostato-galvanostato Autolab PGSTAT20. Para auxiliar na compreensao do mecanismo envolvido na reaçao de Fenton, o comportamento voltamétrico do catecol foi examinado por voltametria cíclica, variando o meio reacional.23 A degradaçao do catecol pelas reaçoes cupro-Fenton, Fenton clássica e combinado Fenton clássica + cupro-Fenton foi monitorada utilizando voltamogramas registrados in situ no reator utilizado para conduzir a reaçao de Fenton.
RESULTADOS E DISCUSSAO Taxa e eficiência da degradaçao A eficiência das reaçoes de Fenton e cupro-Fenton para a mineralizaçao (reduçao de COT) de fenol foi determinada em funçao do tempo e é mostrada na Figura 1. A reaçao cupro-Fenton resultou na degradaçao de apenas 8% do COT inicial. Na reaçao de Fenton com Fe(II), o sistema exibe uma rápida taxa de degradaçao no início da reaçao, atingindo uma degradaçao máxima de 45% a 30 minutos de reaçao, e após esse valor o COT permanece constante. Por combinaçao das duas reaçoes, Fenton e cupro-Fenton, no entanto, a degradaçao atinge 60% no final da reaçao (Figura 1).
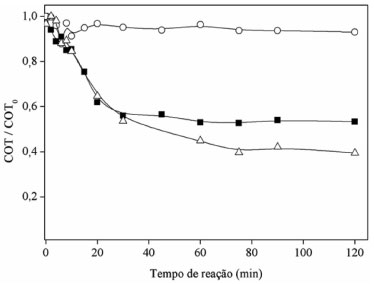 Figura 1. Efeito da adiçao de íons Fe(II) e Cu(II) na degradaçao de fenol durante reaçao de Fenton. Condiçoes experimentais: [fenol]inicial = 800ppm de carbono; [H2O2] = 200 mmol L-1; pHinicial = 3,0; (■) 0,5 mmol L-1 Fe(II); (○) 0,5 mmol L-1 Cu(II); (⃤) 0,5 mmol L-1 Cu(II) + 0,5 mmol L-1 Fe(II)
Em todas estas condiçoes, a degradaçao nao foi total devido à formaçao de intermediários que interferem na reaçao de Fenton. Alguns compostos catalisam a reaçao e outros inibem o processo. A análise dos intermediários por cromatografia mostrou a formaçao inicial de catecol, que pode atuar como catalisador para as reaçoes clássicas de Fenton23 e cupro-Fenton11 devido à regeneraçao de Fe(II) e Cu(I) (Eq. 1). No entanto, na presença de Cu(II) sozinho, a quantidade de catecol produzido foi muito menor, justificando a menor extensao da degradaçao catalítica do fenol. A análise dos compostos orgânicos presentes no final da reaçao indicou a formaçao de ácido oxálico (AO) (Figura 2A) e ácido fórmico (AF) (Figura 2B).
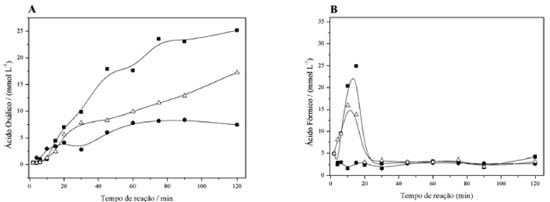 Figura 2. Variaçao das concentraçoes de ácido oxálico (A) e ácido fórmico (B) com o tempo. Efeito de íons inorgânicos na degradaçao de 10 mM de fenol. Con diçoes experimentais: [H2O2] = 200 mmol L-1, pHinicial = 3,0 and T = 30 ºC. Adiçao de íons: (■) 0,5 mmol L-1 Fe(II); (●) 0,5 mmol L-1 Cu(II) e (⃤) 0,5 mmol L-1 Fe(II) + 0,5 mmol L-1 Cu(II)
O ácido oxálico é um agente inibidor da reaçao de Fenton, pois ele nao é degradado no escuro na presença de ferro, Figura 2A, devido à formaçao do complexo de oxalato férrico, que remove o ferro livre da soluçao, diminuindo a eficiência da reaçao de Fenton. Na reaçao de cupro-Fenton a complexaçao do cobre nao ocorre e, portanto, nas reaçoes de Fenton + cupro-Fenton, a oxidaçao de ácidos alifáticos nao é totalmente inibida, resultando num valor COT final inferior, como mostrado na Figura 1. Embora o aumento da eficiência da reaçao de cupro-Fenton para a reduçao de COT tenha sido apenas 15% em comparaçao com a reaçao de Fenton clássica, a compreensao do mecanismo envolvido pode contribuir para outros estudos nos quais a abstraçao de ferro do meio é mais significativa. Estudos eletroquímicos O comportamento voltamétrico do catecol apresentou um par de picos quase reversíveis correspondentes à transferência de dois elétrons, refletindo a transformaçao do catecol em o-benzoquinona.23 A adiçao de Fe(II) provoca um aumento nas correntes anódica e catódica do catecol, indicando um efeito catalítico (Figura 3).24
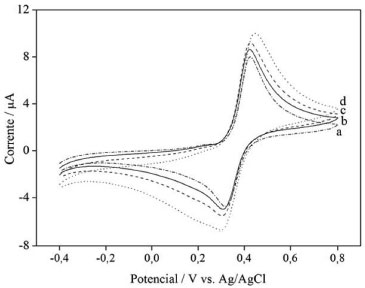 Figura 3. Voltamogramas cíclicos de 0,5 mmol L-1 de catecol em 0,5 mol L-1 Na2SO4, pH=3,0; em: a- ausência de Fe(II); b, c e d- 0,50, 1,0 e 1,5 mmol L-1 Fe(II), respectivamente. A=0,031 cm2; velocidade de varredura 50 mV s-1
Na presença de Cu(II), há um pico anódico intenso em torno de -0,05 V (pico 1), atribuído à oxidaçao de Cu(I) a Cu(II). Um segundo pico (pico 2) é atribuído à reduçao de Cu(II) a Cu(I) e um terceiro pico (pico 3) é atribuído à reduçao de Cu(I) a Cu(0) (Figura 4).16
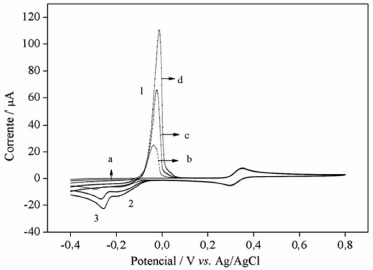 Figura 4. Voltamogramas cíclicos de 0,5 mmol L-1 de catecol em 0,5 mol L-1 Na2SO4, pH=3,0; em: a-ausência de Cu(II); b, c e d- 0,50, 1,0 e 1,5 mmol L-1 Cu(II), respectivamente. A=0,031 cm2; velocidade de varredura 50 mV s-1
Os voltamogramas cíclicos foram registrados in situ no reator durante a degradaçao de catecol. A concentraçao inicial de catecol foi de 1,0 mmol L-1 de catecol na presença de 0,5 mmol L-1 Fe(II) e 0,5 mmol L-1 Cu(II). A concentraçao final de H2O2 foi 25 mmol L-1, sendo que o peróxido foi adicionado nos primeiros 20 minutos à mesma taxa (3,33 mmol L-1 min-1) como no reator de bancada utiliazdo na degradaçao do fenol. O comportamento voltamétrico do catecol em funçao do tempo de reaçao é mostrado na Figura 5.
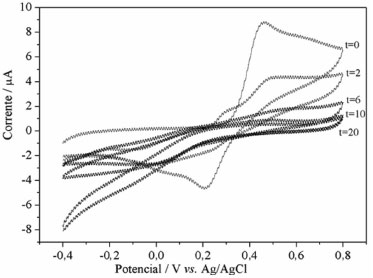 Figura 5. Voltamogramas cíclicos registrados in situ da reaçao de Fenton no reator a t=0, 2, 6, 10 e 20 min. A soluçao continha 1,0 mmol de L-1 catecol e 0,5 mmol de L-1 Fe(II) a pH = 3,0. Adicionou-se H2O2 continuamente durante a reaçao (concentraçao final de 25 mmol L-1)
Neste estudo, observamos que, tanto nas reaçoes de Fenton como de cupro-Fenton (Figuras 5 e 6), todo o catecol foi oxidado após 20 minutos de reaçao, indicado pela diminuiçao dos picos anódicos e catódicos do catecol. Na reaçao de Fenton clássica (Figura 5), o aumento da corrente catódica a -0,4V é atribuído à oxidaçao/reduçao de H2O2.23
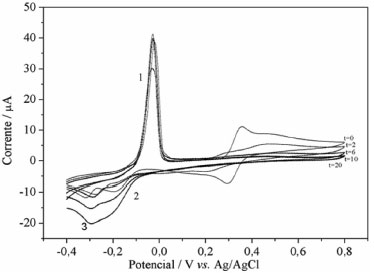 Figura 6. Voltamogramas cíclicos registrados in situ da reaçao de Fenton + cupro-Fenton no reator a t=0, 2, 6, 10 e 20 min. A soluçao continha 1,0 mmol de L-1 catecol, 0,5 mmol de L-1 Fe(II) e 0,5 mmol L-1 Cu(II) a pH = 3,0. Adicionou-se H2O2 continuamente durante a reaçao (concentraçao final 25 mmol L-1)
Na reaçao de Fenton+cupro-Fenton (Figura 6), os picos 1, 2 e 3 correspondem à oxidaçao de Cu(I) a Cu(II) e as reduçoes de Cu(II) a Cu(I) e Cu(I) para Cu(0), respectivamente. Com a concentraçao crescente de H2O2, há uma diminuiçao no pico anódico de Cu(I)/Cu(II) e um aumento nas correntes para Cu(II)/Cu(I) e Cu(I)/Cu(0). Esse comportamento pode estar associado ao fato de que com a adiçao de peróxido o cobre(I) é consumido gerando Cu(II) (reaçoes 2 e 3) aumentando a concentraçao de cobre(II) e, consequentemente, os picos de reduçao de Cu(II)/Cu(I) e Cu(I)/Cu(0) aumentam. 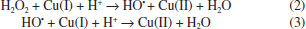 Na presença de H2O2, o Cu(II) é regenerado pela reaçao de Fenton entre Cu(I) e H2O2 sob condiçoes experimentais nas quais sao formados radicais HO•. Na presença de um excesso de H2O2, o radical HO• produzido pela oxidaçao de Cu(I) pode ser consumido por outra molécula de H2O2 para produzir HOO• e O2•-.17 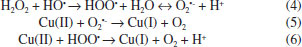 Em estudos de degradaçao do fenol, verificou-se que o ácido oxálico inibe a reaçao de Fenton devido à remoçao de ferro (III) da soluçao por complexaçao.10 O efeito inibitório dos ácidos alifáticos na reaçao de Fenton foi avaliado pela adiçao de 0,5 mmol L-1 de ácido oxálico (AO), fórmico (AF) ou ácido acético (AA) à reaçao de degradaçao do catecol. O comportamento voltamétrico do catecol foi registrado in situ e a concentraçao de catecol avaliada a partir da corrente de pico anódica, ipico (Figura 7).
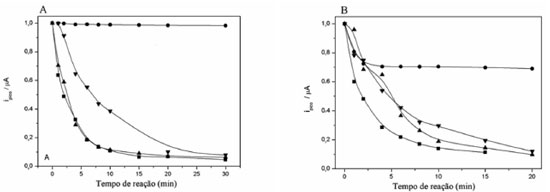 Figura 7. Valores das correntes normalizadas (ipico) para o catecol na reaçao de Fenton (A) e na reaçao de Fenton + cupro-Fenton (B) (■) na ausência de ácidos orgânicos e na presença de: (●) ácido oxálico (AO), (▲) ácido acético (AA) e (▼) ácido fórmico (AF)
Na ausência destes ácidos alifáticos houve uma reduçao de 90% na concentraçao de catecol, tanto para a reaçao de Fenton como para a reaçao cupro-Fenton. Após a adiçao de ácido oxálico à reaçao de Fenton clássica, nao houve essencialmente oxidaçao do catecol devido à complexaçao de Fe(III) pelo ácido oxálico, devido à remoçao do ferro livre da soluçao, interrompendo o ciclo redox do catecol com Fe(III)/Fe(II). Em contraste, há uma reduçao de 30% na concentraçao de catecol na reaçao Fenton + cupro-Fenton na presença de AO. Esta reduçao provavelmente se deve à reaçao cupro-Fenton, uma vez que o Fe(III) está complexo completamente nestas condiçoes. Os efeitos dos outros ácidos sao consistentes com a seguinte ordem de interaçao de Fe(III) com os ácidos orgânicos: AO>>AF>AA.
CONCLUSAO Embora os íons de ferro e cobre acelerem a degradaçao do fenol pela reaçao de Fenton na presença de ambos os íons, a degradaçao mostrou sinergia positiva e significativa. Estudos eletroquímicos e cromatográficos fornecem evidência direta do efeito catalítico do catecol sobre a reciclagem dos pares Fe(III)/Fe(II) e Cu(II)/Cu(I) e confirmam seu papel na degradaçao do fenol na presença destes íons.
AGRADECIMENTOS L. C. Friedrich agradece ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), Brasília, pelo apoio à pesquisa, C.L.P.S. Zanta agradece à FAPEAL, A. Machuleck Jr. e F. H. Quina agradecem ao CNPq, à FUNDECT e ao INCT-Catálise pelo financiamento.
REFERENCIAS 1. Leyva, E.; Moctezuma, E.; Ruíz, G. M.; Torres-Martínez, L.; Catal. Today 1998, 40, 367. 2. Kavitha, V.; Palanivelu, K.; Chemosphere 2004, 55, 1235. 3. Pontes, R. F. F.; Moraes, J. E. F.; Machuleck Jr, A.; Pinto, J. M.; J. Hazard. Mater. 2010, 176, 402. 4. Esplugas, S.; Giménez, J.; Contreras, S.; Pascual, E.; Rodríguez, M.; Water Res. 2002, 36, 1034. 5. Maciel, R.; Sant'Anna Jr., G. L.; Dezotti, M.; Chemosphere 2004, 57, 711. 6. Du, Y.; Zhou, M.; Lei, L.; J. Hazard. Mater. 2006, 136, 859. 7. Arantes, V.; Baldocchi, C.; Milagres, A. M. F.; Chemosphere 2006, 63, 1764. 8. Mijangos, F.; Varona, F.; Villota, N.; Environ. Sci. Technol. 2006, 40, 5538. 9. Jiang, C.; Pang, S.; Ouyang, F.; Ma, J.; Jiang, J.; J. Hazard. Mater. 2010, 174, 813. 10. Pignatello, J. J.; Oliveros, S. E.; Mackay, A.; Crit. Rev. Environ. Sci. and Technol. 2006, 36, 1. 11. Jellison, J.; Goodell, B.; Doyle, B.; Illman, B.; Fekete, F.; Ostrofsky, A.; Int. J. Biodeterior. Biodegrad. 1997, 39, 165. 12. Valenzuela, R.; Contreras, D.; Oviedo, C.; Freer, J.; Rodríguez, J.; Int. J. Biodeterior. Biodegrad. 2008, 61, 345. 13. Shah, V.; Verma, P.; Stopka, P.; Gabriel, J.; Baldrian, P.; Nerud, F.; Appl. Catal., B 2003, 46, 287. 14. Aguiar, A.; Ferraz, A.; Chemosphere 2007, 66, 947. 15. Goodell, B.; Jellison, J.; Liu, J.; Daniel, G.; Paszczynski, A.; Fekete, F.; Krishnamurthy, S.; Jun, L.; Xu, G.; J. Biotechnol. 1997, 53, 133. 16. Xu, G.; Goodell, B.; J. Biotechnol. 2001, 87, 43. 17. Liu, R.; Goodell, B.; Jellison, J.; Amirbahman, A.; Environ. Sci. Technol. 2005, 39, 175. 18. Aguiar, A.; Ferraz, A.; Contreras, D.; Rodríguez, J.; Quim. Nova 2007, 30, 623. 19. Hamilton, G. A.; Friedman, J. P.; Campbell, P. M.; J. Am. Chem. Soc. 1966, 88, 5266. 20. Chen, R.; Pignatello, J. J.; Environ. Sci. Technol. 1997, 31, 2399. 21. Friedrich, L. C.; Mendes, M. A.; Silva, V. O.; Zanta, C. L. P. S.; Machulek Jr., A.; Quina, F. H.; J. Braz. Chem. Soc. 2012, 23, 1372. 22. Machuleck Jr., A.; Moraes, J. F.; Vautier-Giongo, C.; Silverio, C. A.; Friedrich, L. C.; Nascimento, C. A. O.; Gonzalez, M. C.; Quina, F. H.; Environ. Sci. Technol. 2007, 41, 8459. 23. Zanta, C. L. P. S.; Friedrich, L. C.; Machuleck Jr, A.; Higa, K. M.; Quina, F. H.; J. Hazard. Mater. 2010, 178, 258. 24. Bard, A. J.; Faulkner, L. R.; Electrochemical Methods. Fundamentals and Applications, 2ª ed., Wiley: Hoboken, 2001, cap. 6. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access