Artigo
|
|
| Fermentação alcoólica de hidrolisado hemicelulósico de torta de girassol por Galactomyces geotrichum UFVJM-R10 e Candida akabanensis UFVJM-R131 Alcoholic fermentation of hemicellulosic hydrolyzate from sunflower cake by Galactomyces geotrichum UFVJM-R10 and Candida akabanensis UFVJM-R131 |
|
Jéssica Pereira de MatosI,*; Kelton Rodrigues de SouzaI; Alexandre Soares dos SantosII; Lílian de Araújo PantojaI
IInstituto de Ciência e Tecnologia, Universidade Federal dos Vales do Jequitinhonha e Mucuri, 39100-000 Diamantina - MG, Brasil Recebido em 29/04/2017 *e-mail: jessicamatos.biotec@gmail.com The use of the hemicellulosic fraction of plants for the production of second generation bioethanol depends on microorganisms capable to ferment pentoses. Two yeast strains habile to xylose fermenting in synthetic medium, Candida akabanensis UFVJM-R131 and Galactomyces geotrichum UFVJM-R10, not yet registered in the literature for the production of bioethanol, were evaluated here in the alcoholic fermentation of the hemicellulosic hydrolyzate from sunflower cake. The biomass hydrolysis was performed by 38 minutes at 120 ºC / 1 atm with 6% H2SO4 solution and solid / liquid ratio of 1:3.2. Chromatographic characterization of the hemicellulosic hydrolyzate showed the presence of glucose (7.57 g L-1), xylose (19.53 g L-1) and arabinose (8.85 g L-1), besides 5-hydroxymethylfurfural (0.71 g L-1), furfural (0.05 g L-1) and acetic acid (5.27 g L-1). Both yeasts were able to produce ethanol from the acid hydrolyzate from sunflower cake. The fermentation carried out with G. geotrichum UFVJM-R10 and C. akabanensis UFVJM-R131 presented YP/S values of 0.29 and 0.27 g ethanol g-1sugars, respectively. The amounts of the inhibitors identified in the hydrolyzate did not affect the efficiency of the alcoholic fermentation. The supplementation of the hydrolyzate with nitrogen and mineral sources increased the rate of consumption of xylose and arabinose. INTRODUÇÃO A crescente procura por fontes renováveis de energia provém de metas estabelecidas por governos em resposta, principalmente, a uma crescente consciência acerca das alterações climáticas promovidas pela emissão de gases de efeito estufa (GEE) e da finitude dos recursos de origem fóssil.1,2 Os biocombustíveis surgem neste contexto como alternativa viável e de curto prazo para reduzir a dependência por combustíveis líquidos não renováveis, derivados do petróleo, e as emissões de GEEs.3-5 Nas últimas décadas o etanol lignocelulósico, também conhecido como etanol de segunda geração, tem sido apontado como alternativa avançada, por possuir maior impacto na redução da emissão de GEEs6-9 e por diminuir o risco à segurança alimentar mediante a possibilidade de uso de resíduos agroindustriais como matéria-prima.10-13 As biomassas lignocelulósicas incluem resíduos agrícolas, culturas energéticas, gramíneas, resíduos de madeira, resíduos florestais e industriais.7,5 A viabilidade econômica do etanol de segunda geração tem como premissa ou alvo a utilização de todos os polissacarídeos presentes nas biomassas vegetais, especialmente a celulose e a hemicelulose.14,15 Devido à recalcitrância do material lignocelulósico, o uso de tratamento da biomassa, anterior à etapa de sacarificação da celulose, é um passo necessário para a obtenção dos açúcares fermentescíveis.16-18 A conversão efetiva das biomassas lignocelulósicas a açúcares solúveis e fermentescíveis pode ser considerada etapa chave para o sucesso desta tecnologia.11 O tratamento por via química, que emprega ácido inorgânico diluído, é um dos métodos mais utilizados para a remoção da fração hemicelulósica do complexo lignocelulósico.14,19 Esta intervenção tem por consequência a hidrólise das ligações glicosídicas entre os resíduos de monossacarídeos que compõem as hemiceluloses, principalmente D-xilose e L-arabinose, e a liberação destes para a fração solúvel. Na etapa de fermentação alcoólica, um dos desafios para a eficiente produção de etanol é o uso de micro-organismos capazes de fermentar as pentoses liberadas no processo hidrolítico das hemiceluloses.20,21 Saccharomyces cerevisiae, levedura comumente empregada na fermentação alcoólica para produção de etanol de primeira geração, não é capaz de realizar a conversão de monossacarídeos de cinco carbonos a etanol.22,23 A levedura Scheffersomyces stipitis (Pichia stipitis) é um dos poucos micro-organismos de ocorrência natural que, frequentemente, é utilizada para a fermentação alcoólica de pentoses.10,24,25 Recentemente, duas espécies não convencionais de leveduras capazes de converter xilose em etanol foram descritas, Candida akabanensis UFVJM-R131 e Galactomyces geotrichum UFVJM-R10.26 Entre os possíveis coprodutos agroindustriais com potencial para atender ao mercado nascente de etanol de segunda geração está a torta de girassol, subproduto da extração do óleo das sementes do Helianthus annuus L. O girassol é uma cultura agrícola que atende ao mercado de grãos e óleo comestíveis e à indústria do biodiesel.27,28 A torta ou farelo de girassol possui alto teor de celulose e hemicelulose, com potencial, portanto, para a produção de etanol de segunda geração. Considerando que não existe na literatura registro do uso de Candida akabanensis e Galactomyces geotrichum para a produção etanol a partir de hidrolisados hemicelulósicos e, considerando escassos os estudos sobre o aproveitamento da fração hemicelulósica da torta de girassol para a produção de etanol, o presente artigo teve por objetivo avaliar a capacidade das linhagens C. akabanensis UFVJM-R131 e G. geotrichum UFVJM-R10 em fermentar o hidrolisado hemicelulósico da torta de girassol, obtido por catálise com ácido inorgânico diluído, e produzir etanol.
METODOLOGIA Obtenção e preparo da torta de girassol A torta de girassol foi obtida junto à empresa BIOSEP Complexo dos Lagos - Energia e Agronegócio Ltda, localizada no município de Três Pontas, MG, Brasil. A torta in natura foi submetida à secagem em estufa com circulação forçada de ar a 60 ºC por período de 48 horas. Em seguida foi cominuída em moinhos de facas, peneirada em malha de 1,0 mm, acondicionada em potes de plástico a temperatura ambiente (25±2 ºC) e reservada para uso posterior. Hidrólise da fração hemicelulósica da torta de girassol com H2SO4 diluído A hidrólise química da torta de girassol seca e cominuída foi realizada empregando solução de ácido sulfúrico (H2SO4) a 6% e razão sólido-líquido (S/L) de 1:3,2. O ensaio foi conduzido em autoclave à temperatura de 120 ºC, 1 atm, por 38 minutos. Na sequência, o hidrolisado foi filtrado a vácuo sobre papel de filtro (grau 292, 100 x 150 mm, Sartorius®) e foram recuperadas as frações insolúvel e solúvel. A fração solúvel do hidrolisado hemicelulósico foi neutralizada com Ca(OH)2. O resíduo sólido remanescente deste processo foi lavado com 100 mL de água destilada e o líquido recolhido também teve seu pH neutralizado com Ca(OH)2 e reservado. O resíduo sólido após sucessivas lavagens com água e filtração a vácuo sobre papel de filtro foi submetido à secagem em estufa com circulação de ar forçada a 65 ºC por 24 horas e reservado para posterior caracterização físico-química. A fração solúvel recuperada após a hidrólise ácida foi analisada quanto ao teor de açúcares redutores.29 L-arabinose, D-xilose, D-glicose, ácido acético, furfural, 5-hidroximetilfurfural (HMF) e glicerol também foram determinados no hidrolisado. Esta quantificação foi realizada por cromatografia líquida de alta eficiência com uso do sistema Shimadzu Prominence UFLC 20A, equipado com coluna Rezex ROA-Shodex® (300 x 7.5 mm) mantida a 60 ºC e uso de H2SO4 0,0025 mol L-1 como eluente a 0,6 mL min-1. As amostras foram injetadas de forma automatizada em volumes de 5 uL. A detecção por índice de refração foi usada para a determinação dos monossacarídeos, glicerol e ácido acético. A detecção espectrofotométrica foi usada para as determinações do furfural e HMF a 254 nm. Padrões externos foram usados para as determinações qualitativas e quantitativas. Preparo do inóculo com as linhagens fermentadoras de pentose As linhagens leveduriformes Galactomyces geotrichum UFVJM-R10 e Candida akabanensis UFVJM-R131 foram obtidas no banco de linhagens microbianas do Laboratório de Bioprocessos e Biotransformação da Universidade Federal dos Vales do Jequitinhonha e Mucuri. As linhagens, mantidas em glicerol 10% a -20 ºC, foram reativadas em meio YMPD (Yeast Malt Peptone Dextrose), contendo 0,3% de extrato de levedura, 0,3% de extrato de malte, 0,5% de peptona, 1% de glicose e 1,5% de ágar p/v. As culturas foram incubadas a 28 ºC em incubadora microbiológica por 48 horas. O inóculo foi preparado a partir de uma alçada das linhagens reativadas em 100 mL do meio descrito por Toquero e Bolado,30 formulado com 10 g L-1 de extrato de levedura, 20,0 g L-1 de peptona, 35,0 g L-1 de D-glicose, 20,0 g.L-1 de D-xilose, 0,47 g L-1 de (NH4)2SO4, 12,8 g L-1 de KH2PO4, 0,51 g L-1 de Na2HPO4 e 0,47 g L-1 de MgSO4.7H2O. As culturas cresceram em frascos cônicos de 250 mL incubados a 28 ºC sob agitação de 150 rpm por tempo suficiente para se atingir 1 unidade de densidade óptica (D.O), equivalente à leitura espectrofotométrica de suspensão celular livre de meio de cultura com valor de absorbância igual a uma unidade a 600 nm. Após o período de crescimento, o meio foi centrifugado por 15 minutos em centrífuga analítica a 4000 rpm e o sobrenadante foi descartado. As células foram lavadas 3 vezes com água destilada estéril a fim de retirar o resíduo do meio de cultura, ressuspensas finalmente em 100 mL de água estéril e, nessa forma, usadas como inóculo na proporção de 10% v/v. Fermentação alcoólica do hidrolisado hemicelulósico da torta de girassol O ensaio fermentativo foi conduzido em frascos cônicos de 50 mL contendo o hidrolisado hemicelulósico com e sem suplementação. O hidrolisado suplementado recebeu a adição do mesmo meio de cultivo usado para o preparo do inóculo, sem a presença de glicose e xilose, na proporção de 1:1. O processo fermentativo foi realizado em triplicata. Alíquotas de 1 mL foram colhidas a intervalos de 4 horas e centrifugadas a 15.000 g por 5 minutos. Os sobrenadantes foram armazenados a - 20 ºC para determinações analíticas posteriores e as células foram resuspensas a 1 mL com água destilada para determinação da D.O600nm. L-arabinose, D-xilose, D-glicose, xilitol, glicerol, etanol, ácido acético, furfural e 5-hidroximetilfurfural foram determinados por cromatografia líquida como já descrito anteriormente. O processo fermentativo foi avaliado ainda, quanto aos seguintes parâmetros: rendimento do produto em função do consumo do substrato, YP/S (getanol gaçúcar-1); produtividade volumétrica de etanol, QP (g L-1 h-1) e eficiência fermentativa, Ef (%).31 Caracterização química da torta de girassol antes e após o tratamento ácido Foram determinados os teores de fibra em detergente neutro - FDN, fibra em detergente ácido - FDA, celulose, lignina e hemicelulose.32,33 O teor de amido foi determinado de acordo com McCready et al.34 Todas as análises foram realizadas em triplicata. Análise estatística Para a comparação de médias foi utilizado o Teste de Tukey com nível de significância (p) igual a 0,05. As análises foram conduzidas utilizando o software ASSISTAT Versão 7.7.
RESULTADOS E DISCUSSÃO Caracterização da torta de girassol e das frações recuperadas após a hidrólise ácida A torta de girassol analisada nesse estudo apresentou 26% de hemicelulose, 13% de celulose e 10,5% de amido (Tabela 1). Juntos, esses carboidratos somam 49,5% do peso seco da torta de girassol, o que revela seu potencial para a produção de bioetanol.

O teor de holocelulose (soma do conteúdo de celulose e hemicelulose) determinado na torta de girassol foi de 39%. Os valores de holocelulose em tortas de girassol podem variar consideravelmente (18-60%) a depender da origem do resíduo.14,35,36 A composição química da torta de girassol e de outras biomassas lignocelulósicas é influenciada pelo estágio da maturação dos frutos/sementes e também por fatores edafoclimáticos, pela composição do solo, pela fase de colheita, estocagem e pela forma de extração do óleo.37 O valor de 4% de lignina encontrado na torta de girassol (Tabela 1) pode ser considerado baixo se comparado aos valores relatados para outras biomassas lignocelulósicas, tais como a torta de pinhão-manso (33,3%),13 a torta de dendê (36,0%),10 o bagaço de cana-de-açúcar (20,7%)38 e a palha de girassol (22,3%).39 O baixo teor de lignina é vantajoso, pois essa macromolécula aumenta a recalcitrância da estrutura lignocelulósica a ataques químicos e enzimáticos, dificultando a liberação dos açúcares passíveis de fermentação.40,41 Além disso, uma eventual hidrólise ou solubilização da lignina pode liberar compostos fenólicos (4-hidroxibenzóico, vanilina, catecol e siringaldeído) que comprometem o metabolismo dos micro-organismos e sua integridade celular e inibem a atividade de enzimas essenciais ao processo fermentativo, como a álcool desidrogenase, a aldeído desidrogenase e a piruvato desidrogenase.42-44 O tratamento ácido da torta de girassol foi capaz de remover toda a hemicelulose. Por outro lado, o teor de celulose no material insolúvel tratado aumentou em 2,5 vezes. A concentração da fração de celulose era esperada por se tratar de polissacarídeo recalcitrante ao tratamento com ácido diluído. Segundo Hendriks e Zeeman45 e Mosier et al.,46 o processo de hidrólise que ocorre por ação do ácido sulfúrico diluído induz a remoção da hemicelulose, que possui massa molecular menor e cadeias laterais de açúcares curtas e amorfas, o que a torna mais susceptível ao ataque ácido se comparada à celulose, que possui estrutura linear com alto grau de cristalinidade. Após o tratamento ácido, o teor de lignina no material insolúvel recuperado foi 2,8 vezes superior ao valor encontrado na torta de girassol (Tabela 2). De fato, o tratamento ácido de biomassas lignocelulósicas é ineficiente para a remoção de lignina, podendo gerar um material com teor de lignina maior ou igual ao material de partida.47,48 De forma geral, a remoção de um ou mais componentes da biomassa lignocelulósica durante o tratamento ácido promoveu um aumento da concentração dos componentes recalcitrantes. Esse aumento foi inversamente proporcional ao valor da massa que se perdeu com a solubilização ou decomposição dos componentes susceptíveis ao ataque ácido.

A fração solúvel recuperada após o tratamento ácido da torta de girassol continha 38 g L-1 de açúcares redutores, mais da metade deles, 19,5 g L-1, constituído por xilose (Tabela 2). Além da xilose, foram encontrados 8,8 g L-1 de arabinose e 7,6 g L-1 de glicose no hidrolisado. Outro componente presente em concentrações elevadas no hidrolisado hemicelulósico foi o glicerol (Tabela 2). Provavelmente, este glicerol se originou da hidrólise de triglicerídeos ainda presentes na torta de girassol mesmo após a prensagem das sementes para extração do óleo. Embora o principal objetivo do tratamento ácido de biomassas lignocelulósicas seja a remoção da hemicelulose para favorecimento da sacarificação enzimática da celulose, este mesmo tratamento envolve frequentemente reações secundárias, que resultam em subprodutos derivados da hidrólise de grupos acetila presentes na hemicelulose e da desidratação de monossacarídeos, gerando o ácido acético, o furfural e o 5-hidroximetilfurfural como principais produtos.49 Todos esses subprodutos podem levar à inibição de processos bioquímicos a jusante. No presente estudo a concentração dos inibidores pesquisados, ácido acético (5,27 g L-1), furfural (0,05 g L-1) e 5-hidroximetilfurfural (0,71 g L-1) (Tabela 2), foram distintos dos valores relatados na literatura para hidrolisados hemicelulósicos de farelo de girassol tratados com H2SO4. Em estudos com hidrolisado de farelo de girassol, Tavares et al.50 observaram valores de 0,03 g L-1 de furfural e 0,03 g L-1 de HMF, enquanto Antonopoulou et al.39 encontraram valores de 0,04 g L-1 e 0,36 g L-1, respectivamente. Quanto ao ácido acético, Tavares et al.50 e Antonopoulou et al.39 relataram valores de 3,56 g L-1 e 0,85 g L-1, respectivamente, no hidrolisado ácido de farelo de girassol. De acordo com Gonzales et al.,51 a concentração máxima de inibidores que um micro-organismo suporta pode variar, pois depende do tipo de micro-organismo utilizado, da sua adaptação ao meio, do tipo de processo fermentativo empregado e ainda do efeito sinérgico de todos os inibidores presentes na solução. Dentre os inibidores encontrados no hidrolisado de torta de girassol aqui estudado, o furfural e o HMF podem ser considerados os mais danosos para os micro-organismos. Ambos podem causar rompimento da membrana celular e interferir no metabolismo intracelular.52 Todavia, de acordo com Behera et al.,53 o furfural apresenta efeitos mais acentuados se comparado a ação tóxica do HMF. O furfural inibe as enzimas do catabolismo primário do carbono, tais como as hexoquinases, as aldolases e a triosefosfato desidrogenase. Contudo, esses dois furanos têm ação inibitória sobre outras enzimas, como aquelas importantes na conversão dos açúcares a etanol, como a piruvato desidrogenase e a aldeído desidrogenase.52 Estes compostos podem, ainda, interferir em atividades moleculares causando redução na disponibilidade de NADH e ATP, bem como causar relaxamento e quebra de DNA.54 Os ácidos acético, fórmico e levulínico também podem afetar a membrana celular microbiana e diminuir o pH interno, aumentando a pressão de turgor e, por consequência, causando a lise celular.55 Fermentação alcoólica do hidrolisado hemicelulósico Alguns dos inibidores presentes no hidrolisado hemicelulósico foram completamente consumidos ou biotransformados ao longo do processo fermentativo pelas leveduras estudadas (Figura 1). G. geotrichum UFVJM-R10 e C. akabanensis UFVJM-R131 foram capazes de consumir completamente o ácido acético presente no hidrolisado suplementado (Figura 1C e 1D). Entretanto, no hidrolisado não suplementado o ácido acético foi consumido parcialmente e mais lentamente que no meio suplementado (Figura 1A e 1B). Cabe destacar que o meio suplementado recebeu adição de volume correspondente a 50% do volume final na forma de solução de macro e micronutrientes. Esta suplementação implicou na diluição dos inibidores presentes no hidrolisado como pode ser notado no tempo zero dos gráficos ilustrados nas Figuras 1C e 1D. O furfural foi consumido por ambos os micro-organismos nas primeiras 12 horas de fermentação nos meios sem suplementação e com suplementação (Figura 1). O HMF foi consumido pelas duas espécies de leveduras em no máximo 36 horas após o início da fermentação nas condições sem e com suplementação (Figura 1).
 Figura 1. Perfil do consumo do glicerol, ácido acético, furfural e 5-hidroximetilfurfural (HMF) pelas leveduras G. geotrichum UFVJM-R10 (A e C) e C. akabanensis UFVJM-R131 (B e D) nos sistemas fermentativos com o hidrolisado hemicelulósico de torta de girassol não suplementado (A e B) e suplementado (C e D)
Apesar da presença de inibidores no hidrolisado avaliado, foi notável o crescimento dos micro-organismos estudados (G. geotrichum UFVJM-R10 e C. akabanensis UFVJM-R131) durante o processo de fermentação alcoólica, mostrando, assim, a capacidade de adaptação dessas células microbianas frente a esses compostos. As leveduras estudadas apresentaram um crescimento que as levaram de valores de D.O600nm iniciais próximos de 1 a valores entre 17 a 30 unidades de D.O600nm em 92 horas de fermentação (Figura 2). Segundo Landaeta et al.,56 algumas leveduras apresentam a capacidade de converter compostos tóxicos, gerados na etapa de hidrólise ácida de materiais lignocelulósicos, em compostos com menor toxicidade, porém com reflexo sobre a fase de latência, que se torna mais longa, e com consequente redução da produtividade. Não foram observados efeitos dos inibidores presentes no hidrolisado ácido da torta de girassol que tivessem prolongado a fase lag de crescimento (Figura 2).
 Figura 2. Perfil do crescimento celular baseado na leitura direta da densidade óptica (D.O600nm) das linhagens Galactomyces geotrichum UFVJM-R10 e Candida akabanensis UFVJM-R131 durante a fermentação do hidrolisado hemicelulósico da torta de girassol não suplementado (A) e suplementado (B)
O perfil do consumo dos monossacarídeos presentes no hidrolisado está representado na Figura 3. A glicose foi totalmente consumida nas primeiras 12 horas pelo G. geotrichum UFVJM-R10 e C. akabanensis UFVJM-R131, nos meios suplementados (Figura 3C e 3D). No meio não suplementado, apenas a C. akabanensis UFVJM-R131 foi capaz de consumir a glicose nas 12 primeiras horas (Figura 3B). O perfil de consumo da glicose por G. geotrichum UFVJM-R10 no meio não suplementado foi semelhante ao do consumo da xilose, e foi concluído com 60 horas (Figura 3A). No meio isento de suplementação (Figura 3A e 3B), os micro-organismos consumiram apenas cerca de 40% da arabinose em 92 horas. A suplementação do hidrolisado com fontes de nitrogênio e minerais provavelmente contribuiu para a aceleração do metabolismo das duas leveduras avaliadas de forma que nesta condição a glicose, xilose e arabinose foram totalmente esgotadas em apenas 32 horas e com taxas de consumo semelhantes (Figura 3C e 3D). Entretanto, não se pode desprezar a contribuição do efeito diluente da solução de macro e microelementos que foi adicionada ao hidrolisado para constituição do meio suplementado. Tal diluição reduziu à metade a concentração dos prováveis inibidores e, por isso, pode ter favorecido também o metabolismo dos carboidratos.
 Figura 3. Perfil do consumo de açúcares (D-glicose, D-xilose e L-arabinose) e produção de etanol pelas leveduras G. geotrichum UFVJM-R10 (A e C) e C. akabanensis UFVJM-R131 (B e D) nos sistemas fermentativos com o hidrolisado hemicelulósico de torta de girassol não suplementado (A e B) e suplementado (C e D)
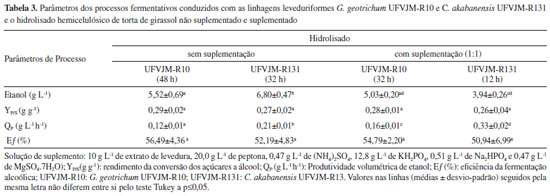
Os resultados referentes à produção de etanol e os parâmetros do processo fermentativo estão apresentados na Tabela 3.
Os parâmetros de processo foram calculados considerando os tempos nos quais foram observados os maiores valores de concentração de etanol. Em tais tempos, a totalidade dos açúcares não foi necessariamente consumida (Figura 3). A maior produção de etanol foi observada com a levedura C. akabanensis UFVJM-R131 (6,85 g L-1) no hidrolisado não suplementado após 48 horas de fermentação. G. geotrichum UFVJM-R10 apresentou o melhor resultado de produção de etanol (5,52 g L-1) com 48 horas de fermentação no hidrolisado não suplementado. Em ambos os casos, podemos afirmar que o uso combinado da glicose e da xilose presentes no meio fermentativo foi necessário para se chegar aos valores destacados de etanol, pois a conversão exclusiva de glicose explicaria no máximo a produção de apenas 3,87 g L-1 de etanol, no primeiro caso, e de 3,47 g L-1, no outro caso. A conversão exclusiva da arabinose, por sua vez, representaria no máximo uma produção de 1,85 g L-1 de etanol, no primeiro caso, e de 1,32 g L-1, no outro. Os rendimentos YP/S e, por consequência, a eficiência dos processos fermentativos conduzidos, quer com o hidrolisado suplementado, quer com o hidrolisado não suplementado, não foram diferentes entre si (Teste de Tukey com p>0,05) e resultaram em valores próximos a 0,27 g etanol g-1açúcares, ou valores de eficiência fermentativa próximos a 53% (Tabela 3). Embora a suplementação não tenha contribuído para o aumento do rendimento, os valores de produtividade volumétrica (QP) foram superiores no hidrolisado suplementado (Tabela 3). Isso implica dizer que os processos conduzidos com a suplementação de fontes de nitrogênio e minerais chegaram a termo (produção máxima de etanol) mais rapidamente (Tabela 3). Foram 48 horas no hidrolisado não suplementado contra 32 horas no hidrolisado suplementado, usando G. geotrichum UFVJM-R10, e 32 horas no hidrolisado não suplementado contra 12 horas no hidrolisado suplementado, usando C. akabanensis UFVJM-131R. Nos ensaios conduzidos com o hidrolisado suplementado, ambas as espécies de leveduras entraram em estado de diauxia e consumiram todo o etanol produzido. Foi possível observar que o consumo do etanol iniciou após o esgotamento de todos os monossacarídeos (Figura 3C e 3D) e o consumo do glicerol (somente com G. geotrichum UFVJM-R10) (Figura 1C) e do ácido acético presentes (Figura 1C e 1D). O fenômeno de diauxia também teve reflexo na retomada do crescimento celular no hidrolisado suplementado, que foi observada próximo a 72 horas do inicio do processo fermentativo (Figura 2B). Possivelmente, o mesmo consumo de etanol não ocorreu no ensaio com o hidrolisado não suplementado porque a principal fonte de carbono (açúcares) não foi completamente esgotada no intervalo de tempo avaliado. Geistlinger et al.57 relataram, em seus estudos envolvendo o fenômeno de diauxia em Saccharomyces cerevisiae, que a glicose é a fonte preferencial para produção de energia e que, após depleção desse açúcar, as leveduras recorrem a uma fonte de carbono não fermentável como o etanol, lactato, glicerol ou ácidos graxos. C. akabanensis UFVJM-R131 não utilizou o glicerol presente no hidrolisado da torta de girassol (Figura 1B) quando a fermentação foi conduzida no hidrolisado não suplementado. E mesmo no hidrolisado suplementado, o consumo de glicerol foi muito inferior ao observado com a G. geotrichum UFVJM-R10 (Figura 1D). Não há na literatura registro do metabolismo de glicerol para C. akabanensis. Por outro lado, há vários estudos de produção de glicerol por espécies do gênero Candida a partir de glicose58,59 e outros estudos de utilização do glicerol por espécies do gênero Candida como única fonte de carbono.60-62 Dessa forma, é inconclusiva a avaliação do comportamento esperado para C. akabanensis.
CONCLUSÃO As leveduras Candida akabanensis UFVJM-R131 e Galactomyces geotrichum UFVJM-R10 foram capazes de produzir etanol a partir da fração solúvel do hidrolisado ácido da torta de girassol a despeito da presença de ácido acético (5,27 g L-1), furfural (0,05 g L-1) e 5-hidroximetilfurfural (0,71 g L-1), reconhecidos como inibidores fermentativos. As leveduras foram capazes de assimilar glicose, xilose, arabinose e glicerol. Foram também capazes de biodegradar o furfural, o 5-hidrometilfurfural e o ácido acético. Glicose e xilose foram fermentadas a etanol pelas duas leveduras. A eficiência dos processos fermentativos com base no consumo dos açúcares foi de pouco mais que 50%. A suplementação do hidrolisado com meio contendo fontes de nitrogênio e minerais não afetou o rendimento, mas reduziu o tempo da fermentação em cerca de 40% para ambas as leveduras. As duas leveduras também se mostraram capazes de consumir etanol após esgotamento dos carboidratos, processo conhecido como diauxia. Esta é a primeira vez, considerada a literatura disponível no banco de dados da ScienceDirect (http://www.sciencedirect.com) e em consulta ao sistema de buscas do Google Acadêmico (https://scholar.google.com), que as espécies de leveduras avaliadas foram empregas na fermentação alcoólica de hidrolisado hemicelulósico.
REFERÊNCIAS 1. Scully, S.; Orlygsson, J.; Energies 2014, 8, 1. 2. Sebayang, A. H.; Masjuki, H. H.; Ong, H. C.; Dharma, S.; Silitonga, A. S.; Kusumo, F.; Milano, J.; Ind. Crops Prod. 2017, 97, 146. 3. Carrasco, C.; Baudel, H.; Roslander, C.; Galbe, M.; Lidén, G.; J. Sustainable Bioenergy Syst. 2013, 3, 99. 4. Macrelli, S.; Galbe, M.; Wallberg, O.; Biotechnol. Biofuels 2014, 7, 26. 5. Singh, Y. D.; Mahanta, P.; Bora, U.; Renew. Energy 2017, 103, 490. 6. Shuai, L.; Yang, Q.; Zhu, J. Y.; Lu, F. C.; Weimer, P. J.; Ralph, J.; Pan, X. J.; Bioresour. Technol. 2010, 101, 3106. 7. Naseeruddin, S.; Desai, S.; Venkateswar Rao, L.; Renew. Energy 2017, 103, 701. 8. Udeh, B. A.; Erkurt, E. A.; Bioresour. Technol. 2017, 224, 702. 9. Vaithanomsat, P.; Chuichulcherm, S.; Apiwatanapiwat, W.; International Journal of Biological, Biomolecular, Agricultural, Food and Biotechnological Engineering 2009, 3, 140. 10. Brito, P. L.; de Azevedo Ferreira, C. M.; Silva, A. F. F.; Pantoja, L. de A.; Nelson, D. L.; dos Santos, A. S.; Waste Biomass Valor (2017), doi:10.1007/s12649-017-9882-4 DOI: http://dx.doi.org/10.1007/s12649-017-9882-4 11. Canabarro, N. I.; Alessio, C.; Foletto, E. L.; Kuhn, R. C.; Priamo, W. L.; Mazutti, M. A.; Renew. Energy 2017, 102, 9. 12. Uju; Goto, M.; Kamiya, N.; Bioresour. Technol. 2016, 214, 487. 13. Santos, R. S.; Pimenta, J. L.; Coura, A. P.; Macedo, A.; Vanzela, A. P. F. C.; Pantoja, L.; Santos, A. S.; Revista Sodebras 2015, 10, 11. 14. Camargo, D.; Gomes, S. D.; Felipe, M. D. G. D. A.; Sene, L.; J. Food Agric. Environ. 2014, 12, 239. 15. Pérez-Pimienta, J. A.; Vargas-Tah, A.; López-Ortega, K. M.; Medina-López, Y. N.; Mendoza-Pérez, J. A.; Avila, S.; Singh, S.; Simmons, B. A.; Loaces, I.; Martinez, A.; Bioresour. Technol. 2017, 225, 191. 16. Alvira, P.; Tomás-Pejó, E.; Ballesteros, M.; Negro, M. J.; Bioresour. Technol. 2010, 101, 4851. 17. Gupta, A.; Verma, J. P.; Renew. Sust. Energ. Rev. 2015, 41, 550. 18. Smuga-Kogut, M.; Zgórska, K.; Kogut, T.; Kukiełka, K.; Wojdalski, J.; Kupczyk, A.; Dróżdż, B.; Wielewska, I.; Fuel 2017, 191, 266. 19. Menon, V.; Rao, M.; Prog. Energy Combust. Sci. 2012, 38, 522. 20. Lisov, A. V.; Belova, O. V.; Lisova, Z. A.; Vinokurova, N. G.; Nagel, A. S.; Andreeva-Kovalevskaya, Z. I.; Budarina, Z. I.; Nagornykh, M. O.; Zakharova, M. V.; Shadrin, A. M.; Solonin, A. S.; Leontievsky, A. A. ; AMB Express 2017, 7. 21. Osiro, K. O.; de Camargo, B. R.; Satomi, R.; Hamann, P. R. V.; Silva, J. P.; de Sousa, M. V.; Quirino, B. F.; Aquino, E. N.; Felix, C. R.; Murad, A. M.; Noronha, E. F.; Enzyme Microb. Technol. 2017, 97, 43. 22. Mert, M. J.; laGrange, D. C.; Rose, S. H.; van Zyl, W. H.; J. Ind. Microbiol. Biotechnol. 2016, 43, 431. 23. Zhu, J.-Q.; Li, X.; Qin, L.; Li, W.-C.; Li, H.-Z.; Li, B.-Z.; Yuan, Y.-J.; Bioresour. Technol. 2016, 218, 380. 24. Kurtzman, C. P.; Suzuki, M.; Mycoscience 2010, 51, 2. 25. Günan Yücel, H.; Aksu, Z.; Fuel 2015, 158, 793. 26. Valinhas, R. V.; Dissertação de Mestrado, Universidade Federal dos Vales do Jequitinhonha e Mucuri, Brasil, 2016. 27. Antonopoulou, G.; Vayenas, D.; Lyberatos, G.; Biochem. Eng. J. 2016, 116, 65. 28. Naureen, R.; Tariq, M.; Yusoff, I.; Chowdhury, A. J. K.; Ashraf, M. A. ; Saudi J. Biol. Sci. 2015, 22, 332. 29. Miller, G. L. ; Anal. Chem. 1959, 31, 426. 30. Toquero, C.; Bolado, S. ; Bioresou. Technol. 2014, 157, 68. 31. Hiss, H.; Cinética de Fermentações: Uma análise matemática da atividade microbiana, 1ª ed., Edição do Autor: São Paulo, 2013. 32. Van Soest, P. J.; J. Anm. Sci. 1967, 26, 119. 33. Van Soest, P. J.; Moore, L. A.; Proceedings of the 9th international Grassland Congress, São Paulo, Brasil, 1965. 34. McCready, R. M.; Guggolz, J.; Silviera, V.; Owens, H. S.; Anal. Chem. 1950, 22, 1156. 35. Castro, A. M. de; Castilho, L. dos R.; Freire, D. M. G.; Ind. Crops Prod. 2016, 83, 140. 36. Fernández-Cegrí, V.; de la Rubia, M. A.; Raposo, F.; Borja, R.; Ultrason. Sonochem. 2012, 19, 1003. 37. Tsuzuki, E. T.; Garcia, E. R. M.; Murakami, A. E.; Sakamoto, M. I.; Galli, J. R.; Rev. Bras. Cienc. Avic. 2003, 5, 179. 38. Machado, A. da S.; Ferraz, A.; Bioresour. Technol. 2017, 225, 17. 39. Antonopoulou, G.; Dimitrellos, G.; Beobide, A. S.; Vayenas, D.; Lyberatos, G.; Waste Biomass Valor 2015, 6, 733. 40. Higuchi, T. In New Trends in Research and Utilization of Solar Energy through Biological Systems; Mislin, H., Bachofen, R., eds.; Birkhäuser Basel: Basel, 1982; pp. 87-94. 41. Sannigrahi, P.; Kim, D. H.; Jung, S.; Ragauskas, A.; Energy Environ. Sci. 2011, 4, 1306. 42. Fosso Kankeu, E.; Marx, S.; Meuyer, A.; Afr. J. Biotechnol. 2015, 14, 2383. 43. Heipieper, H. J.; Weber, F. J.; Sikkema, J.; Keweloh, H.; de Bont, J. A. M. ; Trends Biotechnol. 1994, 12, 409. 44. Modig, T.; Lidén, G.; Taherzadeh, M. J.; Biochem. J. 2002, 363, 769. 45. Hendriks, A. T. W. M.; Zeeman, G.; Bioresour. Technol. 2009, 100, 10. 46. Mosier, N.; Bioresour. Technol. 2005, 96, 673. 47. Cao, S.; Pu, Y.; Studer, M.; Wyman, C.; Ragauskas, A. J.; RSC Adv. 2012, 2, 10925. 48. Samuel, R.; Pu, Y.; Raman, B.; Ragauskas, A. J.; Appl. Biochem. Biotechnol. 2010, 162, 62. 49. Jönsson, L. J.; Martín, C.; Bioresour. Technol. 2016, 199, 103. 50. Tavares, B.; Sene, L.; Christ, D.; Rev. Bras. Eng. Agríc. Ambient. 2016, 20, 1036. 51. Gonzales, R. R.; Sivagurunathan, P.; Parthiban, A.; Kim, S.-H.; Int. Biodeterior. Biodegrad. 2016, 113, 22. 52. van der Pol, E. C.; Bakker, R. R.; Baets, P.; Eggink, G.; Appl. Microbiol. Biotechnol. 2014, 98, 9579. 53. Behera, S.; Arora, R.; Nandhagopal, N.; Kumar, S.; Renew. Sust. Energ. Rev. 2014, 36, 91. 54. Sarris, D.; Papanikolaou, S.; Eng. Life Sci. 2016, 16, 307. 55. Hasunuma, T.; Kondo, A.; Biotechnol. Adv. 2012, 30, 1207. 56. Landaeta, R.; Aroca, G.; Acevedo, F.; Teixeira, J. A.; Mussatto, S. I.; Appl. Energy 2013, 102, 124. 57. Geistlinger, L.; Csaba, G.; Dirmeier, S.; Kuffner, R.; Zimmer, R. ; Nucleic Acids Res. 2013, 41, 8452. 58. Sivasankaran, C.; Ramanujam, P. K.; Shanmugam, S.; Sathendra, R.; Balasubramanian, B.; Mani, J.; Int. J. ChemTech Res. 2014, 6, 5058. 59. Zhuge, J.; Fang, H. Y.; Wang, Z. X.; Chen, D. Z.; Jin, H. R.; Gu, H. L.; Appl. Microbiol. Biotechnol. 2001, 55, 686. 60. Raimondi, S.; Rossi, M.; Leonardi, A.; Bianchi, M.; Rinaldi, T.; Amaretti, A.; Microb. Cell Fact. 2014, 13, 83. 61. Santos, E. O.; Michelon, M.; Gallas, J. A.; Kalil, S. J.; Burkert, C. A. V.; Int. J. Food Eng. 2013, 9, 413. 62. Syverson, R. E.; J. Clin. Microbiol. 1981, 13, 163. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access