Revisão
|
|
| A versatilidade do eletrodo de gota pendente de mercúrio em química analítica - uma revisão sobre recentes aplicações The versatility of the hanging mercury drop electrode in analytical chemistry - a review about recent applications |
|
Chalder Nogueira NunesI; Vanessa Egéa dos AnjosII; Sueli Pércio QuináiaI,*
I Departamento de Química, Universidade Estadual do Centro-Oeste, 85040-080 Guarapuava - PR, Brasil Recebido em 30/05/2017 *e-mail: spquinaia@unicentro.br Voltammetry using mercury electrode as working electrode has been employed in the determination of organic and inorganic compounds in several samples. A review on the applications of this analytical tool is present, covering the period of the last ten years. The emphasis of this work is directed to the hanging mercury drop electrode (HMDE), its advantages, disadvantages and applications. Voltammetric measurements are easily carried out, and present low cost. The review discusses that the use of mercury in the measurements can be a limitation due the toxicity of the element. However, nowadays the necessary of volume of Hg in the measurements is very small, and it can be reused. Thus, the correct disposal of the small amount of waste generated can be minimize environmental risks and human health, according to the principles of Green Chemistry. INTRODUÇAO Técnicas eletroquímicas têm sido usadas por muitos anos devido as suas características vantajosas, tais como elevada frequência analítica, simplicidade, baixo custo, capacidade de detecçao em níveis de concentraçao baixa, resposta dependente das formas químicas de um mesmo elemento, análise de misturas, entre outras. Os primeiros estudos eletroquímicos iniciaram no século XVIII na Itália e evoluíram até os métodos atuais, envolvendo diversos tipos de eletrodos indicadores e de trabalho, como eletrodos sólidos, de mercúrio, ultramicroeletrodos, etc.1-4 Cada tipo de eletrodo desenvolvido possui vantagens e desvantagens intrínsecas. Eletrodos de trabalho sólidos, por exemplo, apresentam como vantagem a possibilidade de serem modificados, aumentando assim sua seletividade, além de possuírem diversas formas e tamanhos que ampliam sua aplicabilidade. Entretanto, processos de limpeza e polimento sao comumente necessários devido ao envenenamento da superfície eletrolítica, que podem comprometer a reprodutibilidade de sua área superficial. O eletrodo de gota pendente de mercúrio, do inglês hanging mercury drop electrode (HMDE), por sua vez, por ser renovável apresenta excelente reprodutibilidade, uma superfície extremamente lisa e uniforme a cada gota. Além disso, um elevado sobrepotencial à reduçao de hidrogênio, uma ampla faixa negativa de potencial (de 0 a -2 V dependendo do eletrólito suporte) assim como a superfície reprodutível a cada gota, sao vantagens deste eletrodo.5 Entretanto, o HMDE apresenta baixa resistência mecânica, limitando suas aplicaçoes, bem como relativa seletividade para compostos orgânicos, pode sofrer com interferências causadas por matéria orgânica dissolvida em amostras ambientais, estreita faixa de trabalho na regiao anódica, etc. Além disso, muitas discussoes vêm sendo realizadas com relaçao à toxicidade do mercúrio e a necessidade de buscar materiais alternativos para o desenvolvimento de outros eletrodos de trabalho mais condizentes com os aspectos de Química Verde. Contudo, é importante salientar que após ser usado, o mercúrio (Hg) pode ser purificado com elevado grau de pureza (99,9999%) por meio de destilaçao, seguida por lavagem com ácido nítrico diluído e reutilizado.6 Além disso, a quantidade de resíduos de Hg gerados através dos métodos mais atuais é bastante reduzido, minimizando os aspectos negativos do Hg. O Hg vem sendo utilizado como eletrodo na polarografia clássica desde a década de 20.7 Em 1922, Jaroslav Heyrovsky desenvolveu um método para determinar qualitativamente e quantitativamente várias substâncias em soluçoes usando mediçoes elétricas. Heyrovsky utilizou o eletrodo gotejante de mercúrio (DME, do inglês dropping mercury electrode) como eletrodo de trabalho e chamou a técnica de polarografia. Essa descoberta, rendeu ao pesquisador em 1959, o Prêmio Nobel de Química por ter desenvolvido os métodos polarográficos de análise.8 A maior contribuiçao de Heyrovsky foi correlacionar, através de parâmetros experimentais otimizados, a corrente de um analito, em um potencial característico, à concentraçao do mesmo em uma soluçao aquosa, e possibilitar estudos eletroquímicos em sistemas que sao irreversíveis.9 As primeiras medidas com eletrodo gotejante de mercúrio demandavam quantidades significativas de mercúrio metálico no decorrer de uma análise, devido ao constante fluxo de Hg. Nessas medidas eram alcançados elevados limites de quantificaçao em relaçao aos limites atuais. Contudo, ao longo dos anos, a necessidade de limites de detecçao e de quantificaçao cada vez menores foi aumentando, com isso, a indispensabilidade de métodos instrumentais cada vez mais sensíveis. Na década de 70, ocorreu um crescimento no uso de técnicas de separaçao para melhorar a sensibilidade dos métodos analíticos, destacando-se a cromatografia gasosa (CG), seguida mais tarde pela cromatografia líquida (HPLC). Essas técnicas aliadas à sistemas de detecçao sao ideais para determinaçoes de compostos orgânicos. Para os compostos inorgânicos, a espectrometria de absorçao atômica (AAS) se tornou uma ferramenta valiosa muito utilizada.10 No entanto, a instrumentaçao necessária para determinaçoes usando HPLC, CG e AAS é custosa. Além disso, processos de tratamento de amostra como pré-concentraçao e limpeza (cleanup) sao usualmente empregados em especial para as técnicas cromatográficas. Tais desvantagens apresentadas, como os elevados custos, sao menos latentes para as técnicas voltamétricas, uma vez que a instrumentaçao é relativamente de baixo custo e suprimentos nao sao requeridos, bem como a necessidade de pré-tratamentos da amostra, tantas vezes dispensáveis na voltametria. Atualmente, com o avanço tecnológico instrumental e a utilizaçao do eletrodo de Hg no modo de gota pendente (HMDE), o volume de Hg gasto durante uma análise é consideravelmente menor em relaçao ao modo gotejante, diminuído o volume de resíduos gerados. É muito comum, observar apontamentos a respeito da toxicidade do Hg sem ao menos avaliar cientificamente as vantagens que o mesmo oferece nas determinaçoes de um número imenso de analitos e matrizes complexas diferentes. Embora o Hg, seja um elemento tóxico, as determinaçoes empregando o HMDE dispensam, na maioria dos casos, a utilizaçao de outros reagentes e solventes tóxicos. Além disso, tomados os devidos cuidados com o descarte dos resíduos gerados, riscos ambientais e ao analista sao evitados. Este balanço entre benefícios alcançados e consideraçoes negativas deve ser feito nao só para o eletrodo de Hg, mas também para outras técnicas analíticas. No entanto, embora a voltametria com o HMDE fosse uma técnica consolidada, eletrodos alternativos de amálgama surgiram na tentativa de diminuir o volume de metal utilizado e melhorar a estabilidade mecânica do eletrodo de trabalho sem perder suas propriedades eletroquímicas.11,12 Eletrodos de amálgama como os de metais amalgamados, pasta de amálgama com e sem ligante líquido e eletrodos sólidos de amálgama sao algumas variaçoes do eletrodo de mercúrio.13 Cada um desses eletrodos apresenta vantagens e desvantagens. Os eletrodos sólidos de mercúrio se destacam por possuírem propriedades eletroquímicas semelhantes ao HMDE, porém, com uma superfície eletroquímica completamente sólida.13 Além disso, aplicaçoes em sistemas em fluxo e in situ também sao vantagens destes eletrodos. Uma variaçao do eletrodo sólido de amálgama consiste na modificaçao da superfície da amálgama com um filme de mercúrio. Este último eletrodo apresenta como vantagens uma maior estabilidade e melhor reprodutibilidade da superfície do filme quando comparado aos eletrodos de metais amalgamado, além de resposta similar ao tradicional eletrodo de Hg.13 Embora os eletrodos de amálgama apresentem diversas vantagens e aplicaçoes, a presença do Hg em sua composiçao impulsionou a busca por outros eletrodos com similares propriedades, tais como os de filme de bismuto, carbono vítreo, diamante dopado com boro, etc.14-17 Os eletrodos de filme de bismuto, por exemplo, possuem vantagens tais como baixa corrente residual, larga faixa de potencial de trabalho negativo, boa estabilidade química e mecânica, baixa interferência causada pelo oxigênio, além de serem mais ambientalmente amigáveis devido à baixa toxicidade do bismuto. Devido às qualidades apresentadas pelos eletrodos de filme de bismuto, estes têm sido frequentemente empregados em determinaçoes de compostos orgânicos e inorgânicos.18-22 Nesse sentido, Carvalho e colaboradores realizaram um estudo comparativo entre os eletrodos de filme de bismuto e filme de Hg como eletrodos de trabalho para a determinaçao simultânea de Cd, Pb, Tl e Cu em amostras salinas. Estes eletrodos foram ainda comparados com o HMDE na determinaçao dos metais. Dentre os eletrodos de trabalho, o eletrodo de filme de Hg se mostrou mais adequado para a determinaçao simultânea dos metais. Baixos limites de detecçao (LD) foram alcançados e as determinaçoes foram conduzidas em amostras altamente salinas nao diluídas sem quaisquer interferências, sendo esta uma grande vantagem quando comparado às técnicas espectrométricas.12 Os eletrodos sólidos foram empregados com sucesso na determinaçao de diversos compostos em substituiçao ao HMDE. Além da resistência mecânica, a possibilidade de varredura em potencias positivos e a ausência do Hg líquido sao vantagens destes eletrodos. Entretanto, a passivaçao da superfície e heterogeneidade da mesma frequentemente estao associadas, comprometendo a reprodutibilidade das análises voltamétricas.13 Sendo assim, o HDME continua sendo uma opçao a ser considerada devido as suas propriedades eletroquímicas. Desta forma, uma ponderaçao entre os resultados que podem ser obtidos e os custos, reagentes e resíduos gerados deve ser realizada para a escolha da técnica ou instrumentaçao para as análises. A preocupaçao em torno da toxicidade do Hg utilizado em análises voltamétricas deve estar sempre presente. Entretanto, usualmente, volumes inferiores a 1 μL de Hg podem ser utilizados em uma determinaçao completa empregando HMDE.23 Essa quantidade necessária de mercúrio pode ser considerada desprezível frente a outras fontes de Hg, tais como na produçao de ouro, responsável pela liberaçao anual de toneladas de Hg ao ambiente em forma de vapores e no seu estado elementar.24-26 Zumam cita em seu artigo que “...vivemos em uma era de mercurofobia irracional”, pois o Hg metálico em temperatura ambiente é inócuo, nas pequenas quantidades usadas com o eletrodo no modo pendente. Os compostos organomercuriais apresentam uma toxicidade mais elevada, porém estes nao sao formados durante as análises eletroanalíticas.9 Embora Zumam afirme a ausência de riscos na utilizaçao do Hg como eletrodo, cuidados para evitar a volatilizaçao e descarte inadequado deste elemento sao apreciados. Problemas à saúde do analista e contaminaçoes ambientais sao efeitos colaterais indesejados na pesquisa científica e aplicaçao empresarial, de um modo geral. No caso das técnicas voltamétricas que empregam eletrodos de trabalho com mercúrio, pode-se minimizar e evitar esses efeitos de saúde e contaminaçao ambiental, permitindo o total aproveitamento das vantagens que estes eletrodos podem oferecer. Atualmente, os procedimentos de utilizaçao do Hg junto com as técnicas pulsadas, como pulso diferencial e onda quadrada aliadas às técnicas de redissoluçao, permitiram à voltametria alcançar limites de quantificaçao comparáveis aos obtidos pelas técnicas cromatográficas e espectrométricas. Desta forma, a voltametria de redissoluçao empregando o HMDE é uma interessante ferramenta para a determinaçao de níveis traço de compostos orgânicos e íons metálicos em diversas amostras. A aplicaçao desta técnica de análise vai desde o controle de qualidade em produtos farmacêuticos ao monitoramento de espécies orgânicas e inorgânicas em compartimentos ambientais. Outro fato relevante do emprego do HMDE refere-se à distribuiçao geográfica das publicaçoes. Um levantamento bibliográfico realizado em diversos periódicos através de pesquisas no Science Direct, SciELO, PubMed, ferramenta de busca do Mendeley (Literature Search), University of Manitoba Libraries, Google Acadêmico e Google, com as palavras chave: eletrodo de mercúrio, HMDE, hanging mercury drop electrode, voltametria, voltammetry, determinaçao voltamétrica e voltammetric determination, resultou em 151 publicaçoes nos últimos 10 anos. Os trabalhos encontrados foram entao organizados levando em conta seu país de origem e notou-se que a distribuiçao global dos grupos de pesquisa que publicaram com este eletrodo abrange quase todos os continentes, e até mesmo países europeus continuam utilizando tal técnica de análise (Figura 1). Esta avaliaçao demonstra que mesmo existindo outras técnicas de análise mais sofisticadas que surgiram com o avanço tecnológico expressivo no campo científico, o HMDE nao foi completamente abandonado. Entretanto, é possível notar que esta técnica de análise está sendo utilizada principalmente por países de terceiro mundo, onde os recursos financeiros para pesquisa sao mais escassos e o uso de metodologias de baixo custo é priorizada.
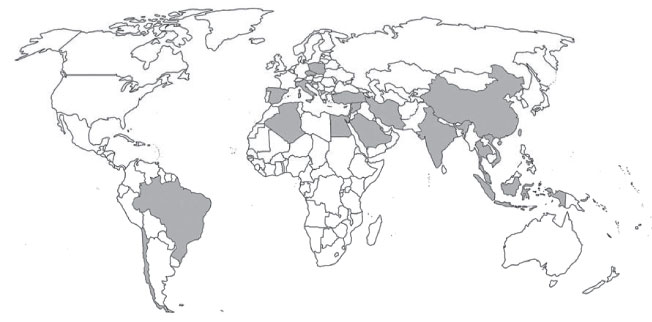 Figura 1. Distribuiçao geográfica de publicaçoes empregando HMDE nos últimos dez anos. Em negrito países que publicaram empregando HMDE através da busca bibliográfica realizada em ferramentas de busca tais como o Science Direct, SciELO, PubMed, ferramenta de busca do Mendeley, University of Manitoba Libraries, Google Acadêmico e Google. Modificado de <http://www.estadosecapitaisdobrasil.com>, acessado 25.05.2017
Embora nesta revisao tenham sido encontradas publicaçoes oriundas de vinte países, alguns destes representam parcelas expressivas na contribuiçao deste levantamento bibliográfico. Brasil, India e Turquia ocupam os primeiros lugares em número de publicaçoes com HMDE, seguidos pela Arábia Saudita e Egito com 8,6 e 7,3% de participaçao, respectivamente. A Figura 2 apresenta a colaboraçao de cada país para com estudos realizados com HMDE nos últimos dez anos avaliados no presente trabalho.
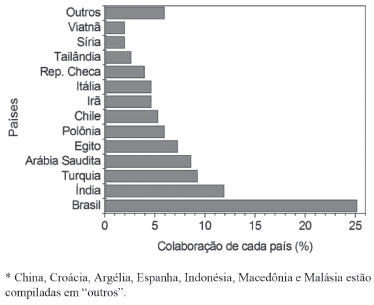 Figura 2. Contribuiçao de cada país na produçao científica de trabalhos empregando HMDE através da busca bibliográfica realizada em ferramentas de busca tais como o Science Direct, SciELO, PubMed, ferramenta de busca do Mendeley, University of Manitoba Libraries, Google Acadêmico e Google
Os trabalhos científicos empregando eletrodo de gota pendente de Hg apresentados neste artigo pertencem a uma lacuna temporal de dez anos. Artigos científicos publicados desde o ano de 2007 até 2016, foram apresentados nesta revisao com o intuito de elucidar as recentes aplicaçoes, em especial do HMDE, em estudos de objetivos variados. Relacionando o número com a data de publicaçao, pode-se observar ausência de uma tendência que aponte para um decréscimo ou aumento da utilizaçao desta técnica analítica nos últimos anos (Figura 3A). Nesta figura, nota-se que os anos compreendidos entre 2010 e 2014 apresentaram publicaçoes acima da média, seguido por um decréscimo nos dois anos subsequentes. Entretanto, para o ano de 2016 foram encontrados mais artigos publicados que em 2009 por exemplo. A Figura 3B relaciona o número de publicaçoes encontradas para cada ano avaliado, distinguindo entre estudos com compostos orgânicos e íons metálicos. Entre analitos orgânicos e inorgânicos, comportamentos similares foram observados em funçao do número de publicaçoes por ano, tendo apenas em 2008, 2010 e 2013 mais trabalhos encontrados com íons metálicos. Porém, nestes últimos anos, de forma geral, foram encontrados mais trabalhos com fármacos, corantes, pesticidas, etc., do que com íons metálicos, que representaram apenas 40% do total.
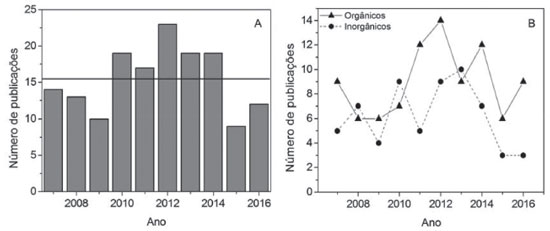 Figura 3. Gráficos relativos ao número de publicaçoes por ano empregando HMDE. (A) Publicaçoes totais. (B) Segregaçao entre publicaçoes com compostos orgânicos e inorgânicos
Nesse contexto, fica claro que a voltametria empregando o HMDE continua sendo utilizada mesmo após o surgimento de técnicas analíticas mais avançadas e eletrodos alternativos. É natural que com o surgimento de outras técnicas, o número de publicaçoes com HMDE reduza. Entretanto, os dados mostrados neste artigo apontam para o nao abandono deste eletrodo. Sendo assim, o presente trabalho teve por objetivo mostrar que o HMDE continua tendo importância significativa na pesquisa científica, principalmente em países em desenvolvimento, onde recursos financeiros destinados à pesquisa nao sao tao abundantes. De forma geral, quando cuidados adequados sao tomados durante a utilizaçao e descarte do Hg, o HMDE apresenta qualidades indiscutíveis, podendo ser empregado em estudos variados. Determinaçao de íons metálicos usando o HMDE O eletrodo de Hg de gota pendente, HMDE, apresenta grande aplicabilidade na determinaçao de espécies inorgânicas. Sua aplicaçao na determinaçao de íons metálicos é respeitada como uma técnica altamente sensível, exata e precisa, possibilitando quantificaçoes de metais em níveis traço nas mais distintas amostras. A possibilidade de pré-concentraçao em uma forma de amálgama seguida pela redissoluçao da espécie de interesse, proporciona limites de quantificaçao consideravelmente baixos. Outra vantagem se relaciona com a possibilidade de obter informaçoes sobre o estado de oxidaçao do analito e, portanto, sobre a especiaçao de um mesmo elemento. Nesse sentido, dependendo do método voltamétrico usado, é possível estimar a concentraçao de espécies metálicas livres ou espécies que formam complexos cineticamente reversíveis (espécies lábeis). Essas formas sao consideradas lábeis e eletroativas no HMDE, enquanto que as espécies que formam complexos sao consideradas inertes.27,28 Portanto, nas medidas voltamétricas com HMDE, as espécies que podem ser determinadas devem ser eletroativas, isto é, sofrem processos de reduçao ou oxidaçao dento da faixa de potencial adequado para esse eletrodo de trabalho ou, ainda, devem ser adsorvidas no eletrodo para métodos voltamétricos específicos. Também é possível determinar analitos inertes após a sua conversao em espécies eletroativas, por exemplo, através da sua complexaçao com ligantes. A maioria dos protocolos analíticos desenvolvidos com a voltametria e HMDE sao empregados em meio aquoso, porém, é possível ainda serem realizados em meios nao aquosos.29,30 Contudo, as espécies eletroativas devem ser solúveis em um solvente que deve ser condutor.9 Vantagens como maior faixa de potencial e oxidaçao do Hg em potencias mais positivos, além da maior solubilidade de algumas amostras e analitos, podem ser citados para determinaçoes em meio nao aquoso.30 O HMDE permite, dentre outras aplicaçoes, a avaliaçao da presença de íons metálicos em amostras ambientais, farmacêutica, toxicológica, nutricional, etc. A determinaçao de íons metálicos em solos, águas e em organismos vivos expostos a contaminaçao é frequente.31-34 Repula et al. estudaram a presença de Cr e Pb em briófitas e pteridófitas coletadas em um córrego que recebe descarte de curtume. O HMDE e técnica de pulso diferencial foram utilizados para as determinaçoes dos íons metálicos. Concentraçoes elevadas destes metais que foram determinadas nas amostras podem indicar uma contaminaçao ambiental no ponto de coleta.31 Repula et al., em outro trabalho, determinaram as concentraçoes de Cr e Pb em tecidos de peixes (musculo e fígado) do mesmo córrego empregando o HMDE como eletrodo de trabalho. No trabalho é relatado que os metais bioacumularam preferencialmente no fígado dos peixes e as concentraçoes encontradas foram maiores que as permitidas para o consumo humano.32 Estudos com As, Cu, Pb, Cd e Zn foram realizados na tentativa de determinar a concentraçao destes elementos em plantas possivelmente contaminadas.35,36 Locatelli e Melucci desenvolveram um método sequencial de duas etapas para a determinaçao de Hg, Cu, Pb, Cd e Zn em amostras de vegetais como espinafre, alface e tomate empregando um eletrodo de ouro e o HMDE. O HMDE foi utilizado na determinaçao do Cu, Pb, Cd e Zn e o eletrodo de ouro empregado na determinaçao de Hg e Cu. O método mostrou-se adequado e tratamentos da amostra foram desnecessários. Uma comparaçao entre os resultados obtidos entre os vegetais lavados e nao lavados mostrou uma maior concentraçao de espécies metálicas nas amostras nao higienizadas. A concentraçao determinada de Pb e Cd foi maior que a permitida por lei.35 A presença de metais em ambientes aquáticos pode ter origem natural ou entao pode ser um indício de possível contaminaçao antrópica devido descartes inadequados e utilizaçao de defensivos agrícolas. A preocupaçao com este compartimento ambiental é significativa, devido aos possíveis riscos aos quais organismos aquáticos estao expostos.33,34,37-43 No mesmo sentido, alguns trabalhos também avaliaram a presença de metais em águas de torneira e água envasada. 44-49 Arab and Alshikh avaliaram a presença de Cd, Cu, Fe, Pb Zn, Se em amostras de águas de torneira de diferentes pontos da cidade de Jeddah na Arábia Saudita, durante um ano empregando voltametria de redissoluçao por pulso diferencial e HMDE como eletrodo de trabalho. Várias amostras coletadas apresentaram concentraçoes elevadas dos metais estudados, porém, consideradas aceitáveis pela Organizaçao Mundial da Saúde.44 Raj e colaboradores analisaram amostras de água de torneira de Delhi (India) empregando voltametria de redissoluçao anódica por pulso diferencial.47 Rojas e colaboradores desenvolveram um método eletroquímico para a determinaçao de concentraçoes traço de Sb(III) na presença do ácido quercetina-5-sulfônico em amostras de água. Estudos de recuperaçao em água ultrapura, de água mineral e água de torneira provaram a aplicabilidade do método. Amostras de água de torneira apresentaram concentraçao de 3.59 ± 0.09 µg L -1 de Sb(III).48 Embora a aplicaçao dos métodos voltamétricos com HMDE ocorra de forma bem ampla para amostras de água natural, é possível encontrar trabalhos publicados para outras amostras de interesse ambiental, como o ar e solo.34,37,41,50 Catrambone e colaboradores otimizaram e validaram um método baseado na extraçao de Cr solúvel, com auxílio de ultrassom de amostras de material particulado atmosférico para determinaçao de Cr(III) e Cr(VI). Voltametria adsortiva de redissoluçao e ácido dietileno triamino pentaacético como complexante na presença de nitrato foram utilizados nas determinaçoes. A especiaçao do Cr foi possível e a análise das amostras coletadas em sítios industrias indicou significativa presença de Cr(VI). Para as áreas rurais, os teores de Cr(VI) foram abaixo do limite de detecçao. Os autores relatam que o Cr(VI) permanece principalmente no material particulado fino, e possui origem majoritariamente industrial, enquanto que o Cr(III) apresentou distribuiçao bimodal, já que possui origem antropogênica e natural.50 Devido à versatilidade da voltametria e baixa ou inexistente necessidade de tratamento de amostra, diferentes matrizes além das ambientais pertencem ao escopo que podem ser estudadas pela técnica. Amostras como composiçoes farmacêuticas,51-54 fluidos biológicos,55,56 alimentos,57-62 entre outras, foram estudadas.40,63,64 A grande versatilidade da voltametria para com a determinaçao de íons metálicos em distintas matrizes encontra-se apresentada na Tabela 1.
Como pode ser visto na Tabela 1, diferentes amostras podem ser analisadas empregando voltametria com o HMDE como eletrodo de trabalho na determinaçao de íons metálicos. Alguns trabalhos empregaram um agente complexante ou ligante para possibilitar ou otimizar a determinaçao por voltametria. Limites de detecçao na ordem de partes por bilhao podem ser considerados comparáveis aos obtidos por técnicas espectrométricas. A faixa linear de trabalho alcançada é variável com o método voltamétrico empregado. Os métodos nos quais sao empregados tempos de pré-concentraçao do analito (métodos de redissoluçao) sao frequentemente empregados especialmente para analitos presentes em baixas concentraçoes, possibilitando minimizar os limites de detecçao. Determinaçao de compostos orgânicos usando HMDE Determinaçoes quantitativas de compostos orgânicos em matrizes complexas empregando métodos voltamétricos que usam como eletrodo de trabalho o HMDE sao amplamente realizadas para amostras ambientas, farmacêuticas, etc. As vantagens já sao conhecidas como adequada frequência analítica, medidas de baixo custo, etc. Além disso, outro aspecto vantajoso é a possibilidade de realizar as medidas voltamétricas de modo direto, sem a necessidade de procedimentos prévios de separaçao e extraçao do analito. Contudo, é conhecido que a seletividade da voltametria para compostos orgânicos pode ser mais limitada, sendo em alguns casos necessário aliar os procedimentos de extraçao, separaçao e cleanup previamente às medidas voltamétricas. Esses aspectos sao mais importantes para as amostras ambientais, especialmente pela presença de matéria orgânica dissolvida, que é um interferente reconhecido. Nesse contexto, a voltametria pode ser empregada como uma ferramenta de “varredura” (screening) para avaliar a presença de compostos alvo, produtos de degradaçao e/ou metabólitos de maneira rápida e barata. Atualmente existem alguns trabalhos publicados que empregam a voltametria com esse tipo de abordagem.92-95 Volke fez um levantamento bibliográfico de aplicaçoes e vantagens da polarografia e voltametria em relaçao a outras técnicas de análise comumente utilizadas para estudos na química farmacêutica e farmacológica. O grande número de sítios ativos (reduzíveis ou oxidáveis) de compostos orgânicos, a possibilidade de determinaçao simultânea de diferentes substâncias, fácil preparaçao de amostra, a ausência de interferências oriundas por coloraçao ou turbidez de amostras, baixos limites de quantificaçao e volumes reduzidos de amostra sao vantagens elencadas no que se trata da determinaçao de compostos farmacêuticos.7 O HMDE vem sendo utilizado na determinaçao de compostos orgânicos em amostras ambientais, biológicas e comerciais. Sua aplicaçao na determinaçao de fármacos permeia desde o controle de qualidade, até estudos ambientais, farmacocinéticos e forenses. Embora nao seja a técnica de referência para fármacos, a determinaçao destes compostos em composiçoes farmacêuticas é frequente e apresenta grande importância na avaliaçao da estabilidade das drogas bem como na determinaçao da concentraçao do princípio ativo nos medicamentos.54,96,97 Várias classes de fármacos podem ser estudadas empregando eletrodos de Hg. Antibióticos,98 anti-inflamatórios,99 fármacos psicoativos,92 antiparasitários,97 antieméticos,100 entre outros. Grupos nitro, amino, duplas e triplas ligaçoes entre carbonos, etc., sao centros eletroativos responsáveis pela resposta voltamétrica dos fármacos frente a aplicaçao de potencial101. Alguns mecanismos de reaçoes envolvendo a reduçao eletroquímica de fármacos no HMDE estao listados na Tabela 2.

Análises de formulaçoes farmacêuticas por voltametria com HMDE sao frequentes. Embora os excipientes possam ser eletroativos e os corantes presentes nas formulaçoes possam adsorver no eletrodo de trabalho, em geral, estes apresentam pouca ou nenhuma interferência sobre o sinal analítico do analito.102-104 Técnicas de diluiçao da amostra juntamente com a aplicaçao de um potencial de pré-concentraçao quando sao usadas técnicas de redissoluçao podem ser suficientes na minimizaçao de possíveis interferências de matriz. Além disso, simples extraçoes dos fármacos empregando pequenas quantidades de solventes orgânicos podem ser empregadas.100,105 Ainda no âmbito de formulaçoes, técnicas voltamétricas foram empregadas para a avaliaçao da presença de fármacos como adulterantes em composiçoes fitoterápicas. Este estudo conduzido por Carvalho e colaboradores focou na presença de fármacos benzodiazepínicos (psicoativos) e anfepramona (anorexígeno) em medicamentos para emagrecimento teoricamente isentos de fármacos sintéticos. O eletrodo de trabalho HMDE e a técnica de redissoluçao por pulso diferencial foram empregados nesta investigaçao de adulterantes. Das 12 amostras analisadas, 4 apresentaram contaminaçao por benzodiazepínicos. As determinaçoes foram realizadas com sucesso sem interferências de matriz, demonstrando a aplicabilidade do método desenvolvido. Quatro picos voltamétricos bem definidos correspondentes a quatro grupos de fármacos foram observados simultaneamente.54 Outra aplicaçao de interesse sao as análises de amostras ambientais, e que pode ainda ser considerada um desafio analítico, principalmente devido à seletividade e sensibilidade.92,93,95 Nunes et al. desenvolveram um método voltamétrico de screening para a determinaçao do benzodiazepínico (BDZ) alprazolam em águas superficiais. A técnica voltamétrica de redissoluçao catódica por pulso diferencial foi utilizada em determinaçoes quantitativas. Amostras coletadas a jusante de uma estaçao de tratamento de água apresentaram uma concentraçao de 5 µg L -1. Hormônios (semissintéticos e sintéticos) como o 17α-etinilestradiol e o 17α-metiltestosterona (MT) também foram determinados em amostras de águas naturais empregando o HMDE.93,95 Aguas de rios e de tanques de criaçao de peixes foram analisadas por Miranda e colaboradores. As amostras coletadas em rios ficaram abaixo do LQ (10,78 µg L -1), entretanto, das amostras coletadas em tanques de criaçao de peixes, as concentraçoes encontradas do hormônio MT variaram de 48 ± 5,4 a 142 ± 15,5 µg L -1. Além de fármacos e hormônios, defensivos agrícolas também sao contaminantes de ambientes naturais e vêm sendo estudados. Nas últimas décadas, o uso desenfreado de produtos na agricultura fez despertar o interesse dos cientistas acerca da ocorrência e permanência de inseticidas, herbicidas, fungicidas, entre outros defensivos no solo e corpos aquáticos próximos.94,106-108 A presença destes contaminantes no ambiente pode ocasionar desequilíbrios ambientais além de efeitos nocivos, ainda nao completamente elucidados, para a biota local e seres humanos. Assim como para os outros compostos orgânicos, técnicas cromatográficas sao consideradas padrao para a determinaçao destas substâncias. Entretanto, a voltametria toma frente como técnica alternativa de análise destas substâncias em diversas matrizes. Trabalhos, inclusive brasileiros, empregaram o HMDE na determinaçao de pesticidas em distintas matrizes. Dos Santos et al. desenvolveram um método voltamétrico empregando a técnica de onda quadrada para a determinaçao do herbicida glifosato em amostras de águas naturais. Aguas de rio e de um lago foram analisadas, sendo determinado o contaminante em uma das amostras analisadas do rio.108 Uma vez que defensivos agrícolas sejam utilizados para o controle de pragas na agricultura e consequentemente maior produçao agrícola, estas substâncias nocivas estao inevitavelmente presentes nos alimentos e água que consumimos. Alimentos como vinho, frutas e graos foram estudados a fim de determinar a contaminaçao e persistência de defensivos utilizados nos cultivares.109-113 Um método voltamétrico para a determinaçao do inseticida cifenotrina em formulaçoes, vegetais e graos foi desenvolvido por Kumar e Sreedhar. Pulso diferencial e o eletrodo HMDE foram empregados nas determinaçoes voltamétricas em formulaçoes, repolhos, tomates, trigo e arroz. Uma simples extraçao do analito empregando solventes orgânicos foi necessária, seguido pela determinaçao voltamétrica. Otimas recuperaçoes alcançadas demonstraram a eficácia do método.109 Galli e colaboradores, além de avaliarem a presença do herbicida pendimetalina em águas naturais e sedimentos, também realizaram a determinaçao deste composto em comida de bebê utilizando HMDE. Tal preocupaçao se justificou pelo fato de alguns ingredientes utilizados na elaboraçao do alimento, como maça e mamao, serem culturas onde a aplicaçao de herbicidas é frequente. Embora altas concentraçoes de açucares e proteínas estivessem presentes nas amostras, determinaçoes diretas, ou seja, sem pré-tratamentos, foram possíveis, e boas recuperaçoes foram alcançadas pra amostras enriquecidas com o herbicida.114 A diversidade de compostos orgânicos determinados e matrizes analisadas mostra a enorme versatilidade do eletrodo de Hg. Substâncias como fármacos podem ser determinados em composiçoes, fluidos biológicos, amostras ambientais, entre outros de forma rápida, barata e simples. A aplicabilidade do HMDE se estende a compostos orgânicos das mais diferentes classes, como corantes, flavonoides, proteínas, pesticidas.115-119 De modo geral, todas as moléculas orgânicas que possuem sítios eletroativos podem ser determinadas empregando o eletrodo de Hg. Moléculas nao eletroativas na faixa de potencial de aplicaçao deste eletrodo, podem ser modificadas e assim tornar-se detectáveis por tal técnica.120,121 A Tabela 3 elenca diversas publicaçoes realizadas nos últimos 10 anos com compostos orgânicos empregando HMDE como eletrodo de trabalho.
Na Tabela 3 nota-se a ampla aplicabilidade dos métodos voltamétricos na determinaçao de compostos orgânicos. Obviamente, as consideráveis vantagens supracitadas deste eletrodo, como o baixo custo operacional e de equipamento, simplicidade e versatilidade, foram decisivas para a escolha da técnica de análise por tantos pesquisadores.
CONSIDERAÇOES FINAIS A utilizaçao do HMDE como eletrodo de trabalho vem ocorrendo a muitos anos devido suas inúmeras vantagens. A dispensabilidade ou simplicidade de pré-tratamentos de amostra reduz custos e aumenta a frequência analítica da técnica, além de evitar perdas do analito e contaminaçoes das amostras. Baixos limites de detecçao e sensibilidade tornam a voltametria com HMDE uma opçao plausível para uma gama de finalidades. Os artigos apresentados nesta revisao exemplificam e ressaltam a diversidade de analitos e amostras que podem ser determinados e analisadas, respectivamente. Mesmo com o advento de novas técnicas analíticas, seja para compostos orgânicos ou nao, a voltametria empregando o HMDE pode ter perdido um pouco de espaço, especialmente nos países mais desenvolvidos, mas ainda vem sendo empregada em diversos estudos nas áreas ambientais, farmacêuticas, forenses, entre outros. Em relaçao a toxicidade do eletrodo, vale ressaltar que volumes ínfimos de Hg sao utilizados e todos os cuidados cabíveis podem ser tomados para evitar a volatilizaçao do Hg durante as análises e na estocagem do resíduo gerado. Além disso, os resíduos de Hg gerados podem ser recuperados, purificados e reutilizados, nao restando resíduos tóxicos descartáveis após as mediçoes voltamétricas. Porém, assim como para outras técnicas analíticas, os pontos negativos devem ser considerados no momento da escolha da técnica.
AGRADECIMENTOS Capes, CNPq, Fundaçao Araucária - Fundaçao Parque Tecnológico Itaipu e Prof. Dr. Fauze J. Anaissi pelo incentivo à publicaçao deste tema.
REFERENCIAS 1. Pacheco, W. F.; Semaan, F. S.; de Almeida, V. G. K.; Ritta, A. G. S. L.; Aucélio, Q.; Rev. Virtual Quim. 2013, 5, 516. 2. Bockris, J. O.; Reddy, A. K. N.; Gamboa-Aldeco, M.; Modern Electrochemistry: Fundamentals of Electrodics, 2nd ed., Springer, 2000. 3. Shukla, A. K.; Kumar, T. P.; Electrochem. Soc. 2008, 307483, 31. 4. Bagotsky, V. S.; Fundamentals of Electrochemistry, 2nd ed., John Wiley & Sons, Inc.: Hoboken, 2005. 5. Arslan, E. Y.; Çakir, S.; South African J. Chem. 2010, 63, 152. 6. EPA/625/R-94/004; Hanbook: Recycling and Reuse of Material Found on Superfund Sites 1994. 7. Volke, J.; J. Eletroanalytical Chem. 1983, 155, 7. 8. Bard, A. J.; Faulkner, L. R.; Electrochemical Methods: Fundamentals and Applications, 2nd ed., Wiley, 2001. 9. Zuman, P.; Microchem. J. 2002, 72, 241. 10. Srikanth, P.; Somasekhar, S. A.; Kanthi, G. K.; Babu, K. R.; International Journal of Environment, Ecology, Family and Urban Studies 2013, 3, 127. 11. Janíková, L.; Šelešovská, R.; Rogozinská, M.; Tomášková, M.; Chylková, J.; Monatsh. Chem. 2016, 147, 219. 12. de Carvalho, L. M.; do Nascimento, P. C.; Koschinsky, A.; Bau, M.; Stefanello, R. F.; Spengler, C.; Bohrer, D.; Jost, C.; Electroanalysis 2007, 19, 1719. 13. de Souza, D.; Melo, L. C.; Correia, A. N.; de Lima-Neto, P.; Fatibello-Filho, O.; Mascaro, L. H.; Quim. Nova 2011, 34, 487. 14. Cao, L.; Jia, J.; Wang, Z.; Electrochim. Acta 2008, 53, 2177. 15. de Figueiredo-Filho, L. C. S.; Baccarin, M.; Janegitz, B. C.; Fatibello-Filho, O.; Sens. Actuators, B 2017, 240, 749. 16. Jain, R.; Yadav, R. K.; J. Pharm. Anal. 2012, 2, 123. 17. Santos, M. C. G.; Tarley, C. R. T.; Dall’Antonia, L. H.; Sartori, E. R.; Sens. Actuators, B 2013, 188, 263. 18. Zidaric, T.; Jovanovski, V.; Menart, E.; Zorko, M.; Kolar, M.; Veber, M.; Hocevar, S. B.; Sens. Actuators, B 2017, 245, 720. 19. Romih, T.; Hočevar, S. B.; Jemec, A.; Drobne, D.; Electrochim. Acta 2016, 188, 393. 20. Grabarczyk, M.; Wasag, J.; Talanta 2015, 144, 1091. 21. Kong, D.; Kong, W.; Khan, Z. U. H.; Wan, P.; Chen, Y.; Yang, M.; Fuel 2016, 182, 266. 22. Gerent, G. G.; Spinelli, A.; J. Hazard. Mater. 2016, 308, 157. 23. Barbosa, A. M. J.; de Araújo, T. A.; Trindade, M. A. G.; Ferreira, V. S.; J. Appl. Electrochem. 2011, 41, 249. 24. Yang, M.; Wang, S.; Zhang, L.; Wu, Q.; Wang, F.; Hui, M.; Yang, H.; Hao, J.; J. Geochem. Explor. 2016, 170, 72. 25. Black, P.; Richard, M.; Rossin, R.; Telmer, K.; Environ. Res. 2017, 152, 462. 26. Wasserman, J.; Hacon, S.; Mundo e Vida 2001, 2, 46. 27. dos Anjos, V. E.; Abate, G.; Tadeu, G. M.; Quim. Nova 2010, 33, 1307. 28. Tonietto, A. E.; Grassi, M. T.; Quim. Nova 2012, 35, 170. 29. Mohran, H. S.; Am. J. Appl. Sci. 2009, 6, 964. 30. da Silveira, G. D.; Hoinacki, C. K.; Bueno Goularte, R.; do Nascimento, P. C.; Bohrer, D.; Cravo, M.; Leite, L. F. M.; de Carvalho, L. M.; Fuel 2017, 202, 206. 31. Repula, C. M. M.; Quináia, S. P.; de Campos, B. K.; Ganzarolli, E. M.; Lopes, M. C.; Bull. Environ. Contam. Toxicol. 2012, 88, 84. 32. Repula, C. M. M.; de Campos, B. K.; Ganzarolli, E. M.; Lopes, M. C.; Quináia, S. P.; Quim. Nova 2012, 35, 905. 33. Arancibia, V.; Zúñiga, M.; ZUñiga, M. C.; Segura, R.; Esteban, M.; J. Braz. Chem. Soc. 2010, 21, 255. 34. Junsomboon, J.; Sooksamiti, P.; Grudpan, K.; Lapanantnoppakhun, S.; Thavornyuthikarn, P.; Jakmunee, J.; Chiang Mai J. Sci. 2009, 36, 369. 35. Locatelli, C.; Melucci, D.; Cent. Eur. J. Chem. 2013, 11, 790. 36. Chooto, P.; Wararattananurak, P.; Kangkamano, T.; Innuphat, C.; Sirinawin, W.; ScienceAsia 2015, 41, 187. 37. Ba-Shami, R. M.; Gazzaz, H.; Bashammakh, A. S.; Al-Sibaai, A. A.; El-Shahawi, M. S.; Anal. Methods 2014, 6, 6997. 38. El-Shahawi, M. S.; Bashammakh, A. S.; Al-Sibaai, A. A.; Bahaffi, S. O.; Al-Gohani, E. H.; Electroanalysis 2011, 23, 747. 39. Gamboa, J. C. M.; Cornejo, L.; Acarapi, J.; Squella, J. A.; J. Chil. Chem. Soc. 2013, 4, 2031. 40. Gholivand, M. B.; Pourhossein, A.; Turk. J. Chem. 2011, 35, 839. 41. Baranowska, I.; Kowalski, B.; Polkowska-Motrenko, H.; Samczyński, Z.; Polish J. Environ. Stud. 2015, 24, 1911. 42. Rojas, C.; Arancibia, V.; Gómez, M.; Nagles, E.; Electroanalysis 2013, 25, 439. 43. dos Anjos, V. E.; da C. Machado, E.; Grassi, M. T.; Aquat. Geochem. 2012, 18, 407. 44. Arab, S.; Alshikh, A.; Nat. Sci. 2010, 8, 292. 45. González, M. J. G.; Renedo, O. D.; Martínez, M. J. A.; Talanta 2007, 71, 691. 46. Nagles, E.; Arancibia, V.; Ríos, R.; Int. J. Eletrochem. Sci. 2012, 7, 4545. 47. Raj, J.; Raina, A.; Mohineesh; Dogra, T. D.; E3S Web Conf. 2013, 9009, 3. 48. Rojas, C.; Arancibia, V.; Gómez, M.; Nagles, E.; Sens. Actuators, B 2013, 185, 560. 49. Şahin, I.; Ertaş, F. N.; Nakiboǧlu, N.; Anal. Lett. 2008, 41, 2621. 50. Catrambone, M.; Canepari, S.; Perrino, C.; Web Conf. 2013, 7005, 1. 51. González, A. G.; Herrador, M. A.; TrAC - Trends Anal. Chem. 2007, 26, 227. 52. Kierszniewska, A.; Krzek, J. A. N.; Acta Pol. Pharm. 2012, 69, 611. 53. Nascimento, P. C.; Schneider, A. B.; Bohrer, D.; de Carvalho, L. M.; Jost, C. L.; J. Braz. Chem. Soc. 2011, 22, 820. 54. de Carvalho, L. M.; Correia, D.; Garcia, S. C.; de Bairros, A. V.; Nascimento, P. C. Do; Bohrer, D.; Forensic Sci. Int. 2010, 202, 75. 55. de Carvalho, L. M.; Spengler, C.; Garmatz, J. C.; do Nascimento, P. C.; Bohrer, D.; Del-Fabro, L.; Radis, G.; Bolli, A. A.; Garcia, S. C.; Moro, A.; da Rosa, M. B.; Quim. Nova 2008, 31, 1336. 56. Attar, T.; Harek, Y.; Larabi, L.; Mediterr. J. Chem. 2014, 2, 691. 57. Alghamdi, A. H.; J. Saudi Chem. Soc. 2010, 14, 1. 58. Melucci, D.; Locatelli, C.; Microchem. J. 2007, 85, 321. 59. Locatelli, C.; Melucci, D.; Food Chem. 2012, 130, 460. 60. Suwannasom, P.; Ruangviriyachai, C.; Int. Food Res. J. 2011, 808, 803. 61. Wararattananurak, P.; Chooto, P.; Sherdshoopongse, P.; Chuaynukool, C.; Innuphat, C.; ScienceAsia 2014, 40, 355. 62. Campos, B. K. de; Prazeres, J. P. dos; Torres, Y. R.; Anjos, V. E. dos; Quináia, S. P.; Quim. Nova 2014, 37, 1479. 63. Bento, F. R.; Grassi, M. T.; Sales, A.; Mascaro, L. H.; Int. J. Eletrochem. Sci. 2008, 3, 1523. 64. Trindade, J. M.; Martiniano, L. C.; Gonçalves, V. R. A.; Souza, A. G.; Marques, A. L. B.; Baugis, G. L.; Fonseca, T. C. O.; Song, C.; Zhang, J.; Marques, E. P.; Fuel 2012, 91, 26. 65. Biçer, E.; Arat, C.; J. Chil. Chem. Soc. 2008, 4, 1734. 66. Dadda, A. S.; Teixeira, A. C.; Feltes, P. K.; Campos, M. M.; Leite, C. E.; Moriguchi-Jeckel, C. M.; J. Braz. Chem. Soc. 2014, 25, 1621. 67. Domingos, D.; Ferreira Neta, M. D. L. S.; Massa, A. R. C. G.; Reboucas, M. V.; Teixeira, L. S. G.; J. Braz. Chem. Soc. 2016, 27, 1594. 68. de Carvalho, L. M.; Garmatz, J. C.; Spengler, C.; do Nascimento, P. C.; Bohrer, D.; Canabarro, C. M.; Garcia, S. C.; da Rosa, M. B.; J. Braz. Chem. Soc. 2010, 21, 701. 69. de Carvalho, L. M.; do Nascimento, P. C.; Bohrer, D.; Stefanello, R.; Pilau, E. J.; da Rosa, M. B.; Electroanalysis 2008, 20, 776. 70. de Carvalho, J. M.; Leandro, K. C.; Rev. Inst. Adolfo Lutz 2012, 71, 100. 71. Dias, D.; do Nascimento, P. C.; Jost, C. L.; Bohrer, D.; de Carvalho, L. M.; Koschinsky, A.; Electroanalysis 2010, 22, 1066. 72. Erden, S.; Durmus, Z.; Kiliç, E.; Electroanalysis 2011, 23, 1967. 73. Gholivand, M. B.; Sohrabi, A.; Abbasi, S.; Electroanalysis 2007, 19, 1609. 74. Locatelli, C.; J. Sci. Food Agric. 2007, 87, 305. 75. Matar, R.; Salami, M.; Int. J. Pharm. Sci. Rev. Res. 2014, 28, 224. 76. Melucci, D.; Locatelli, M.; Locatelli, C.; Food Chem. Toxicol. 2013, 62, 901. 77. Mohineesh; Raina, A.; Raj, J.; Dogra, T. D.; E3S Web Conf. 2013, 1, 1. 78. Muratt, D. T.; M. de Carvalho, L.; Viana, C.; C. do Nascimento, P.; Reis, G.; R. Dal Molin, T.; Grassmann, C.; Smidt, G.; Koschinsky, A.; Electroanalysis 2015, 27, 1625. 79. Nosal-Wiercińska, A.; Dalmata, G.; Monatsh. Chem. 2009, 140, 1421. 80. Nascimento, P. C.; Del-Fabro, L. D.; Bohrer, D.; De Carvalho, L. M.; Rosa, M. B.; Noremberg, S. M.; Electroanalysis 2008, 20, 1078. 81. do Nascimento, P. C.; Jost, C. L.; de Carvalho, L. M.; Bohrer, D.; Koschinsky, A.; Anal. Chim. Acta 2009, 648, 162. 82. Nascimento, D. S.; Insausti, M.; Band, B. S. F.; Lemos, S. G.; Fuel 2014, 137, 172. 83. Opoka, W.; Adamek, D.; Plonka, M.; Reczynski, W.; Bas, B.; Drozdowicz, D.; Jagielski, P.; Sliwowski, Z.; Adamski, P.; Brzozowski, T.; J. Physiol. Pharmacol. 2010, 61, 581. 84. Opydo, J.; Proc. ECOpole 2008, 2, 363. 85. Rojas-Romo, C.; Arancibia, V.; Moreno-Da Costa, D.; Tapia, R. A.; Sens. Actuators, B 2016, 224, 772. 86. Shahbazi, Y.; Ahmadi, F.; Fakhari, F.; Food Chem. 2016, 192, 1060. 87. Scheffer, E. W. O.; Grassi, M. T.; Quim. Nova 2010, 33, 1254. 88. Sobhanardakani, S.; Tayebi, L.; Farmany, A.; World Appl. Sci. J. 2011, 14, 1453. 89. Sodré, F. F.; Schnitzler, D. C.; Scheffer, E. W. O.; Grassi, M. T.; Aquat. Geochem. 2012, 18, 389. 90. Yilmaz, S.; Öztürk, B.; Özdemir, D.; Eroǧlu, A. E.; Ertaş, F. N.; Turk. J. Chem. 2013, 37, 316. 91. Zarei, K.; Atabati, M.; Karami, M.; Anal. Chim. Acta 2009, 649, 62. 92. Nunes, C. N.; Pauluk, L. E.; dos Anjos, V. E.; Lopes, M. C.; Quináia, S. P.; Anal. Bioanal. Chem. 2015, 407, 6171. 93. Nunes, C. N.; Pauluk, L. E.; Felsner, M. L.; Egéa, V.; Quináia, S. P.; J. Anal. Methods Chem. 2016, 2016, 1. 94. dos Santos, L. B. O.; Abate, G.; Masini, J. C.; J. Braz. Chem. Soc. 2006, 17, 36. 95. Miranda, L.; Galli, A.; Quináia, S. P.; Rev. Virtual Quim. 2014, 6, 416. 96. Ramadan, A. A.; Mandil, H.; Ghazal, N.; Innovare Acad. Sci. 2015, 7, 300. 97. El-Desoky, H. S.; Ghoneim, M. M.; Abdel-Galeil, M. M.; J. Braz. Chem. Soc. 2010, 21, 669. 98. Al-Ghamdi, A. F.; J. Saudi Chem. Soc. 2009, 13, 235. 99. Beltagi, A. M.; El-Attar, M. A.; Ghoneim, E. M.; Cent. Eur. J. Chem. 2007, 5, 835. 100. Jain, R.; Sharma, R.; J. Pharm. Anal. 2012, 2, 447. 101. Samiec, P.; Navrátilová, Z.; Fischer, J.; Monatsh. Chem. 2016, 147, 127. 102. Jain, R.; Radhapyari, K.; Jadon, N.; J. Electrochem. Soc. 2007, 154, F199. 103. Hoang, V. D.; Yen, N. T.; Trop. J. Pharm. Res. 2013, 12, 783. 104. Ghoneim, M. M.; Abdel-Azzem, M. K.; El-Desoky, H. S.; Ghoneim, A. M.; Khattab, A. E.; J. Braz. Chem. Soc. 2014, 25, 1407. 105. Taşdemir, I. H.; J. Food Drug Anal. 2014, 22, 527. 106. Guziejewski, D.; Brycht, M.; Nosal-Wiercinska, A.; Smarzewska, S.; Ciesielski, W.; Skrzypek, S.; J. Environ. Sci. Health, Part B 2014, 49, 550. 107. Erdoǧdu, G.; J. Anal. Chem. 2008, 63, 762. 108. dos Santos, S. C.; Galli, A.; Felsner, M. L.; Justi, K. C.; Rev. Virtual Quim. 2014, 6, 866. 109. Kumar, K. N. S.; Sreedhar, N. Y.; Indian J. Adv. Chem. Sci. 2012, 1, 33. 110. Pelit, F. O.; Ertas, H.; Ertaş, F. N.; J. Appl. Electrochem. 2011, 41, 1279. 111. El-Shahawi, M. S.; Hamza, A.; Bashammakh, A. S.; Al-Sibaai, A. A.; Al-Saggaf, W. T.; Electroanalysis 2011, 23, 1175. 112. Qiu, P.; Tian, X. C.; Asian J. Chem. 2013, 25, 4457. 113. Wyantuti, S.; Tjokronegoro, R.; Rochani, S.; Proceeding Int. Semin. Chem. 2008, 2008, 374. 114. Galli, A.; De Souza, D.; Machado, S. A. S.; Microchem. J. 2011, 98, 135. 115. Večerková, R.; Hernychová, L.; Dobeš, P.; Vrba, J.; Josypčuk, B.; Bartošík, M.; Vacek, J.; Anal. Chim. Acta 2014, 830, 23. 116. Kumar, K. N. S.; Sreedhar, N. Y.; Indian J. Adv. Chem. Sci. 2016, 4, 484. 117. Zainudin, N. S.; Yaacob, M. H.; Muslim, N. Z. M.; Malaysian J. Anal. Sci. 2016, 20, 1254. 118. Babu, T. R.; Sivasankar, K.; Sujana, P.; Environ. Sci. 2012, 7, 5. 119. Carvalho, J. M.; Silva, A. R. da; Cunha, A. L. M. C. da; Aucélio, R. Q.; Alberti, A. L. M.; Leandro, K. C.; Quim. Nova 2012, 35, 988. 120. da Silva, J. G.; e Silva, M. R. L.; de Oliveira, A. C.; de Souza, J. R.; Vaz, C. M. P.; de Castro, C. S. P.; J. Food Compos. Anal. 2012, 25, 1. 121. Ensaifi, A. A.; Khayamian, T.; Taei, M.; Talanta 2009, 78, 942. 122. Al-Ghamdi, A. F.; Hefnawy, M. M.; Al-Majed, A. A.; Belal, F. F.; Chem. Cent. J. 2012, 6, 362. 123. Černocká, H.; Ostatná, V.; Paleček, E.; Electrochem. Commun. 2015, 61, 114. 124. de Carvalho, L. M.; do Nascimento, P. C.; Bohrer, D.; Correia, D.; de Bairros, A. V.; Pomblumc, V. J.; Pomblum, S. G.; J. Braz. Chem. Soc. 2007, 18, 789. 125. Adam, V.; Krizkova, S.; Zitka, O.; Trnkova, L.; Petrlova, J.; Beklova, M.; Kizek, R.; Electroanalysis 2007, 19, 339. 126. Garbellini, G. S.; Pedrosa, V. A.; Salazar-Banda, G. R.; Avaca, L. A.; Quim. Nova 2007, 30, 2025. 127. Taşdemir, I. H.; Arabian J. Chem. 2016, 9, 86. 128. Hoang, V. D.; Huyen, D. T.; Phuc, P. H.; J. Anal. Chem. 2013, 12, 1. 129. Jain, R.; Dwivedi, A.; Mishra, R.; Langmuir 2009, 25, 10364. 130. Al-Omar, M. A.; Al-ghamdi, A. F.; Al-ghamdi, A. H.; Saudi Pharm. J. 2008, 16, 231. 131. Lakshmi, D.; Sharma, P. S.; Prasad, B. B.; Biosens. Bioelectron. 2007, 22, 3302. 132. El-Shal, M. A.; J. Pharm. Res. 2012, 5, 280. 133. Guziejewski, D.; Skrzypek, S.; Ciesielski, W.; Environ. Monit. Assess. 2012, 184, 6575. 134. Nascimento, P. C.; Hilgemann, M.; Guterres, M. V.; de Carvalho, L. M.; Bohrer, D.; Chemom. Intell. Lab. Syst. 2007, 89, 97. 135. Sreedhar, N. Y.; Sreenivasulu, A.; Sunil Kumar, M.; Nagaraju, M.; Int. J. PharmTech Res. 2012, 4, 1303. 136. Jain, R.; Yadav, R. K.; Dwivedi, A.; Colloids Surfaces A Physicochem. Eng. Asp. 2010, 359, 25. 137. Alghamdi, A. F.; Kooli, F.; J. Mater. Environ. Sci. 2013, 4, 762. 138. Habib, I. H. I.; Rizk, M. S.; El-Alamin, M. M. A.; Imam, G. S.; Port. Electrochim. Acta 2016, 34, 343. 139. Pawlak, M. K.; Ecol. Chem. Eng. S 2008, 15, 263. 140. Eş, Z.; Taşdemir, I. H.; Turk. J. Chem. 2015, 39, 54. 141. El-desoky, H. S.; J. Braz. Chem. Soc. 2009, 20, 1790. 142. Reddy, C. N.; Prasad, P. R.; Sreedhar, N. Y.; Int. J. Pharm. Pharm. Sci. 2011, 3, 141. 143. Ribeiro, F. W. P.; Mendonça, G. L. F.; Soares, J. E. S.; Freire, V. N.; de Souza, D.; Casciano, P. N. S.; de Lima-Neto, P.; Correia, A. N.; Electrochim. Acta 2014, 137, 564. 144. Temerk, Y. M.; Ibrahim, M. S.; Kotb, M.; J. Braz. Chem. Soc. 2011, 22, 2056. 145. El-Desoky, H. S.; Ghoneim, M. M.; Habazy, A. D.; J. Braz. Chem. Soc. 2011, 22, 239. 146. Ghani, N. T. A.; El-Ries, M. A.; El-Shall, M. A.; Anal. Sci. 2007, 23, 1053. 147. Habib, I. H. I.; Weshahy, S. A.; Toubar, S.; Port. Electrochim. Acta 2008, 4, 315. 148. Erdoǧdu, G.; Titretir, S.; J. Anal. Chem. 2007, 62, 777. 149. Mirceski, V.; Guziejewski, D.; Skrzypek, S.; Ciesielski, W.; Croat. Chem. Acta 2010, 83, 121. 150. Miranda, L.; Felsner, M. L.; Torres, Y. R.; Hoss, I.; Galli, A.; Quináia, S. P.; Quim. Nova 2015, 38, 419. 151. Alghamdi, A. F.; Port. Electrochim. Acta 2014, 32, 51. 152. Thuong, N. T. K.; Huyen, T. C.; J. Chem. 2010, 48, 604. 153. Gupta, V. K.; Jain, R.; Antonijevic, M. M.; Khani, H.; Siddiqui, M. N.; Dwivedi, A.; Mishra, R.; Agarwal, S.; Int. J. Electrochem. Sci. 2011, 6, 37. 154. Guziejewski, D.; Nosal-wierci, A.; Skrzypek, S.; Ciesielski, W.; Smarzewska, S.; J. Chem. 2016, 2016, 1. 155. Biçer, E.; Çetinkaya, P.; J. Chil. Chem. Soc. 2009, 1, 46. 156. Öztürk, F.; Küçükkolbasi, S.; Kaçar, C.; Kiliç, E.; J. Braz. Chem. Soc. 2014, 25, 920. 157. Sreedhar, N. Y.; Sreenivasulu, A.; Sunil Kumar, M.; Nagaraju, M.; Int. J. Pharm. Sci. Res. 2012, 3, 2320. 158. Pushpalatha, M.; Balaji, K.; Reddy, C. S.; Int. J. Chem. Sci. Technol. 2011, 1, 171. 159. Alghamdi, A. F.; J. Mol. Liq. 2016, 218, 186. 160. Dar, R. A.; Brahman, P. K.; Tiwari, S.; Pitre, K. S.; Colloids Surf., B 2012, 98, 72. 161. Paleček, E.; Římánková, L.; Electrochem. Commun. 2014, 44, 59. 162. Adnan, L. A.; Yusoff, A. R. M.; Hadibarata, T.; Khudhair, A. B.; Water. Air. Soil Pollut. 2014, 225, 2119. 163. Mandil, H.; Sakur, A. A.; Alulu, S.; Int. J. Pharm. Pharm. Sci. 2013, 5, 502. 164. Guida, M.; Maria, M. S.; Salvatore, F.; Biochem. Physiol.: Open Access 2015, 4, 1. 165. Al-Ghamdi, A. F.; Hefnawy, M. M.; Arabian J. Chem. 2012, 5, 383. 166. Cvrkovic-Karloci, Ž.; Krznaric, D.; Šeruga, M.; Cosovic, B.; Int. J. Electrochem. 2011, 2011, 1. 167. Frka, S.; Dautović, J.; Kozarac, Z.; Ćosović, B.; Hoffer, A.; Kiss, G.; Tellus B 2012, 64, 1. 168. Gómez, M.; Arancibia, V.; Aliaga, M.; Núnez, C.; Rojas-Romo, C.; Food Chem. 2016, 212, 807. 169. Majnooni, M. B.; Gholivand, M. B.; Khodadadian, M.; Afnanzade, N.; Bahrami, G.; J. Rep. Pharm. Sci. 2012, 1, 34. 170. Gómez, M.; Arancibia, V.; Rojas, C.; Nagles, E.; Int. J. Electrochem. Sci. 2012, 7, 7493. 171. Al-Ghamdi, A. F.; Am. J. Anal. Chem. 2011, 2, 174. 172. Kaçar, C.; Durmus, Z.; Kiliç, E.; Asian J. Chem. 2014, 26, 1931. 173. Bandzuchová, L.; Selesovská, R.; Navrátil, T.; Chylková, J.; Electrochim. Acta 2013, 113, 1. 174. Habib, I. H. I.; Weshahy, S. A.; Toubar, S.; El-Alamin, M. M. A.; Pharmazie 2008, 63, 337. 175. Leandro, K. C.; Moreira, J. C.; Farias, P. A. M.; J. Pharm. 2013, 2013, 1. 176. Reddy, C. N.; Prasad, P. R.; Sreedhar, N. Y.; J. Anal. Methods Chem. 2013, 2013, 1. 177. Reddy, C. N.; Chandrasekhar, G.; Sreedhar, N. Y.; Anal. Pharm. Biomed. Sci. 2013, 2, 27. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access