Educação
|
|
| Determinação de sódio em cachaça por espectrometria de emissão atômica: efeito das propriedades físico-quimicas da solução† Determination of sodium in cachaça by atomic emission spectrometry: effect of the physico-chemical properties of the solution |
|
Junia Graziele PereiraI; Luiz Antonio RamosI; Éder Tadeu Gomes CavalheiroI,*; Joaquim de Araújo NóbregaII
I. Instituto de Química de São Carlos, Universidade de São Paulo, Avenida Trabalhador São-carlense, 400 - CEP 13566-590, São Carlos - SP, Brasil Recebido em 18/07/2017 *e-mail: cavalheiro@iqsc.usp.br The use of samples from students quotidian can get their attention for teaching contents to be presented. We have already presented a series of simple experiments demonstrating the use of flame atomic emission spectrometry in the determination of cations in samples present in our day life. Here sodium is determined in cachaça (sugar cane spirit), a very popular Brazilian drink, to demonstrate de effect of matrix composition and its physico-chemical properties in the volume of sample nebulized in a flame photometer and consequently in analytical signals by using different ethanol:water solvent mixtures for calibration. INTRODUÇAO A aplicaçao de experimentos envolvendo amostras cotidianas e ressaltando a importância da química na vida diária, tem por objetivo estimular os alunos a participarem das aulas e atividades didáticas em geral, despertando seu interesse para os conteúdos, pelo fato de que a curiosidade dos alunos atrai sua atençao para o tema abordado, com consequências diretas no processo de aprendizagem, com aperfeiçoamentos inclusive no aspecto disciplinar nos níveis fundamental e médio.1 Assim, a contextualizaçao do conteúdo e a presença de aspectos como a interdisciplinaridade e multidisciplinaridade no processo de ensino sao incentivadas pelos parâmetros curriculares nacionais (PCN) e, também, pelas Leis de Diretrizes e Bases da Educaçao (LDB), propostos com o objetivo de melhorar a qualidade das aulas e a participaçao dos alunos do ensino fundamental e médio, mas certamente também podem ser úteis no ensino superior.2 A introduçao do contexto histórico também contribui para atrair a atençao dos alunos, se esse for apresentado de maneira que possa contribuir para o processo de ensino, podendo conter o desenvolvimento do processo científico em questao, seus erros e discussoes.3 A teoria envolvida no presente trabalho é relativamente simples e acessível a alunos em início do curso de análise instrumental, servindo para demonstrar princípios básicos de análise dos métodos ópticos, usando amostras do cotidiano e que envolvam a inter e a multidisciplinaridade. Ela se encontra descrita em um trabalho anteriormente apresentado nessa mesma linha, no qual algumas consideraçoes sobre um breve histórico do desenvolvimento da espectrometria atômica, processos que ocorrem durante a medida por espectrometria de emissao atômica, além de experimentos envolvendo a determinaçao de cloreto de sódio em soro fisiológico, de lítio em formulaçoes para controle de variaçoes bruscas de humor, de cálcio em águas naturais e de íons de sódio e potássio em bebidas isotônicas foram apresentados.1,4 Em um trabalho mais recente, a importância do preparo de amostras foi destacada usando a determinaçao de cálcio em cascas de ovos.2 Além de ser uma amostra presente no cotidiano, a cachaça representa um importante produto na economia brasileira, sendo largamente consumida pura, na forma de coquetéis ("drinks") como as batidas e a caipirinha - o mais popular dentre eles - e vem ganhando também o mercado externo. Entretanto, se consumida em excesso pode trazer danos à saúde, tanto pelo álcool, como por outros constituintes. Assim, infere-se a importância do controle de qualidade da bebida, principalmente quanto à sua composiçao química. O sódio foi escolhido como analito, devido à possibilidade de sua determinaçao com a espectrometria de emissao atômica (também conhecida como "fotometria de chama"), uma técnica simples e de baixo custo, mas com significativa carga conceitual e aos problemas inerentes à saúde humana, quando a bebida contendo esse íon é ingerida em excesso. Neste trabalho, dando continuidade a essa linha, é apresentada uma proposta didática para demonstrar o efeito da composiçao da matriz analítica, que afeta parâmetros físico-químicos como densidade, viscosidade e tensao superficial, na determinaçao de sódio em amostras de cachaça, uma soluçao hidroetanólica cuja diferença de densidade em relaçao às soluçoes aquosas provoca alteraçao na massa de amostra aspirada pelo espectrômetro, sob vazao constante, resultando em erro se os padroes nao forem preparados em matriz semelhante à da amostra. Para corrigir esse efeito é preciso ajustar as propriedades físico-químicas das soluçoes analíticas de calibraçao. Bebidas alcoólicas destiladas, como a cachaça, podem ser utilizadas como amostras do cotidiano envolvendo esse conceito, ao se determinar íons nelas presentes. Algumas consideraçoes subsidiárias para a discussao da importância do analito (sódio) e da matriz (a cachaça), envolvendo alguns aspectos históricos, geográficos, econômicos, legais e de saúde, que representam a contextualizaçao de ambos, também sao apresentados. Subsídios para discussao sobre o tema Consideraçoes sobre o efeito das propriedades físico-químicas das soluçoes no sinal analítico, em espectroscopia de emissao atômica por chama Rocha e Nóbrega5 apresentaram um artigo sobre o efeito das propriedades físico-químicas da soluçao no sinal analítico de absorbância de cobre e crômio em espectrofotometria de absorçao atômica por chama. Os autores destacaram que os instrumentos sempre fornecerao resultados, mas a qualidade e confiabilidade dos mesmos devem ser avaliadas pelo operador, que, para tanto, precisa considerar os parâmetros experimentais e instrumentais envolvidos na análise. O fenômeno da nebulizaçao, que ocorre pela formaçao de um aerossol a partir da amostra aspirada em uma câmara no interior do instrumento, promove a inserçao de gotículas da soluçao, contendo o analito, na chama, onde ocorre a atomizaçao. Processo semelhante acontece nos fotômetros, que realizam as medidas de emissao atômica. Os autores5 apontaram para a eficiência limitada da nebulizaçao, que é afetada pela viscosidade, densidade e tensao superficial da amostra. Esses parâmetros influenciam a resposta analítica e podem gerar resultados imprecisos quando afetam as etapas de nebulizaçao e atomizaçao. Foi observado que a viscosidade mais elevada diminui a vazao de aspiraçao, promovendo diminuiçao na quantidade de analito aspirada, nebulizada e atomizada, resultando em menores sinais de absorbância. Consideraçoes sobre a cachaça A cachaça, também conhecida como aguardente de cana ou pinga, é uma bebida alcoólica tipicamente brasileira. Segundo alguns autores, seu nome pode ter sido originado da língua ibérica - cachaza - ou vinho de borra, um vinho de qualidade inferior consumido em Portugal e Espanha. Pode ainda ser derivado de "cachaço", que se refere ao porco, ou ao feminino "cachaça", referente à porca; pois a carne dos porcos selvagens, encontrados nas matas do Nordeste brasileiro, apresentava consistência muito dura e a cachaça era utilizada para amolecê-la.6 Uma abordagem interessante sobre vários aspectos históricos, de produçao e da composiçao da cachaça, foi apresentada por Pinheiro, Leal e de-Araújo, no periódico Química Nova na Escola.7 Ainda nao se tem um registro histórico definitivo que aponte, indubitavelmente, onde seria o local exato da primeira destilaçao da cachaça. O cultivo da cana-de-açúcar com seus engenhos se disseminou pela colônia, tendo início na ilha de Fernao de Noronha, em 1504. O fato é que ela ocorreu no atual território brasileiro, "(sic) ... em algum engenho do litoral, entre os anos de 1516 e 1532, sendo, portanto, o primeiro destilado da América Latina, antes mesmo do aparecimento do pisco peruano, da tequila mexicana e do rum caribenho".8,9 No Brasil colonial, consta que "cachaça" era o nome dado à primeira espuma que flotava na superfície do caldo de cana enquanto era fervido, durante a produçao do açúcar. Essa espuma era oferecida aos animais ou descartada. Já a segunda espuma era consumida pelos escravos e pessoas de baixa renda, principalmente depois de fermentar, tendo também passado a ser conhecida como cachaça.6 Assim a cachaça é, sem dúvida, uma bebida de importância cultural, social e econômica para o Brasil, relacionando-se diretamente com o início da colonizaçao portuguesa do país e à atividade açucareira, que tendo por base a mesma matéria-prima da cachaça, possibilitou a implantaçao dos primeiros estabelecimentos produtores da bebida.10 Sua história se confunde com a história do nosso país e reflete nossa diversidade étnica e cultural, pois sua criaçao se deu a partir da cana-de-açúcar, tendo como atores "(sic)... o imigrante português e o escravo africano, que juntos, em uma Terra de Indios, criaram a bebida que reflete o modo de viver e o espírito descontraído do brasileiro",11 sendo consumida por todas as classes sociais, sem distinçao de etnias e pelos estrangeiros que nos visitam.11 O processo produtivo da cachaça pode ser resumido pelos seguintes estágios, envolvendo processos químicos relevantes frequentemente usados na preparaçao de outros alimentos e bebidas, que permitem explorar a interdisciplinaridade do tema: preparaçao da matéria prima, corte da cana-de-açúcar, transporte e armazenamento, extraçao do caldo e sua fermentaçao, destilaçao em alambique, geralmente de cobre, a partir do qual se obtém a cachaça, envelhecimento da mesma em tonéis de madeira e, finalmente, engarrafamento, distribuiçao e comercializaçao. A definiçao de cachaça é apresentada no Artigo 53, do Decreto nº 6.871, de 04/Junho/2009 da Legislaçao Brasileira, o qual estabelece que:12 "A cachaça é a denominaçao típica e exclusiva da aguardente de cana produzida no Brasil , com graduaçao alcoólica de trinta e oito a quarenta e oito por cento em volume, a vinte graus Celsius (ºC), obtida pela destilaçao do mosto fermentado de cana-de-açúcar com características sensoriais peculiares, podendo ser adicionada de açúcares até seis gramas por litro."12 A cachaça é a bebida destilada mais consumida no Brasil, ficando atrás da cerveja, que é uma bebida fermentada. Alguns números expressam a grande importância econômica dessa bebida. Calcula-se que seu consumo anual seja da ordem de cinco vezes maior que o do uísque (348 milhoes de litros) e da vodca (270 milhoes de litros). Em números oficiais, pois ainda existe grande mercado informal, cuja qualidade nao é submetida a nenhum controle, o Brasil conta com uma capacidade instalada de produçao da ordem de 1,2 bilhao de litros anuais, sendo 70% cachaça industrial e 30% cachaça artesanal, proveniente de alambiques, envolvendo mais de 40 mil produtores, que fornecem material para 5 mil marcas. O setor gera cerca de 600 mil empregos, diretos e indiretos. Apenas a título de ilustraçao, até 2008 apenas 1% da produçao nacional era exportada para 55 países, gerando receitas da ordem de 16,5 milhoes de dólares. Os principais importadores sao Alemanha, Estados Unidos, Reino Unido, Japao e França.13,14 Por outro lado, o consumo, que chega aos 11,5 litros/habitante-ano, preocupa em relaçao à saúde, pois a ingestao de álcool, em excesso, pode trazer sérios problemas sendo responsável desde uma simples intoxicaçao aguda, uso nocivo ou abusivo, podendo levar à dependência psíquica e química.15 Segundo Lewis,16 o álcool etílico (CAS: 64-17-5), quando ingerido em altas doses, é um agente carcinogênico, que causa distúrbios do sono, alucinaçoes, convulsoes, mudanças nas atividades motoras, dor de cabeça e náuseas. Pode trazer problemas de infertilidade, além de efeitos nas dimensoes corporais e dependência de drogas em neonatos, quando consumido pelas maes durante a gestaçao. Portanto, o lema: "APRECIE COM MODERAÇAO", vale aqui e para qualquer outra bebida alcoólica. O Instituto de Química de Sao Carlos da Universidade de Sao Paulo muito contribuiu para o desenvolvimento da qualidade da cachaça, por meio do Laboratório para o Desenvolvimento da Química da Aguardente (LDQA-IQSC/USP), uma iniciativa dos Profs. Douglas Wagner Franco e Benedito dos Santos Lima Neto, iniciada em 1993,17 com o propósito de melhorar o produto, visando adequar padroes de qualidade para consumo interno e exportaçao, agregando valor à bebida. Ao longo dos anos, muitos colaboradores se juntaram à iniciativa. Além da formaçao de pessoal qualificado para o mercado e inúmeras publicaçoes relevantes, os resultados desse trabalho trouxeram contribuiçoes ao estabelecimento de normas e regulamentos firmados na Legislaçao do Estado de Sao Paulo e Federal. Um breve exemplo da contribuiçao deste laboratório é dado pelas referências,18-24 mas há várias outras publicaçoes resultantes desse trabalho, que podem ser encontradas na forma de citaçoes da referência,17 assim como apresentaçao de seus colaboradores. Tais estudos envolvem aspectos de legislaçao, congêneres, contaminantes e aditivos, tipificaçao e envelhecimento. A relevância da determinaçao de sódio25 As amostras de cachaça utilizadas neste trabalho sao amostras de fácil aquisiçao e manipulaçao, estando presentes no cotidiano dos alunos e podem servir para atrair sua atençao para o ensino do conteúdo de técnicas analíticas instrumentais envolvendo emissao atômica no âmbito da proposta didática deste trabalho. Em sua composiçao há diversos analitos de importância a serem controlados, visando tanto melhorar sua qualidade, quanto proteger a saúde dos consumidores. A importância do sódio para a saúde humana é descrita a seguir. No meio biológico, o sódio é encontrado na forma do seu cátion (Na+), cuja funçao é manter a eletroneutralidade celular e conservar a tonicidade, via pressao osmótica intracelular para que a célula nao retenha quantidades excessivas de água, o que prejudica sua atividade. Pode ser encontrado em fluidos extra e intracelulares nas concentraçoes de 0,01 e 0,15 mol L-1, respectivamente. Isso se deve à bomba de sódio e potássio, que retira os íons sódio do interior das células através da liberaçao de energia da hidrólise de ATP. Sendo a membrana celular semipermeável, permitindo o transporte por osmose, a entrada da glicose na célula está associada à entrada dos íons sódio pelo gradiente de concentraçao. Em seguida, o sódio é removido do meio intracelular pela bomba de sódio e potássio. Para manter esse equilíbrio, deve-se ingerir uma quantidade de sódio compatível com essas concentraçoes. Assim, a Organizaçao Mundial da Saúde (OMS) recomenda a ingestao diária de sódio proporcional àquela contida em 5 g de cloreto de sódio, NaCl (da ordem de 1,97 g de sódio, Na). Entretanto, no Brasil, o consumo médio chega a 12 g de cloreto de sódio/dia, mais que o dobro da quantidade máxima recomendada. Além disso, o sódio está presente naturalmente em alimentos e bebidas, devendo-se somar a essa quantidade aquela adicionada como condimento. Segundo alguns autores, para cada 9 g de sal ingerido, o corpo retém, em média, 1 L de água,26 isso porque o excesso de sal fica dissolvido no sangue, tornando-se necessário reter líquidos para diluir esse fluido, no sentido de manter o equilíbrio osmótico entre os meios extra e intracelular. A retençao de excesso de líquido obriga o coraçao a forçar a passagem de maior volume de sangue pelas artérias, o que é um dos fatores que contribuem para a hipertensao, razao pela qual o controle na ingestao de sódio é um parâmetro importante na nutriçao humana. O aumento da pressao arterial pode levar a fissuras que favorecem depósitos de gordura, rompimento de vasos no caso de acidentes vasculares cerebrais (AVC) e até infarto do miocárdio, entre outros problemas.27 Para saber mais sobre hipertensao, causas, definiçoes e tratamentos, recomenda-se o primeiro fascículo da Revista Brasileira de Hipertensao, no seu volume 17, publicado em 201028 e informaçoes da página da OMS na Internet.29 Dessa forma, o controle de sódio em alimentos e bebidas é importante para controle da quantidade de sódio ingerida diariamente. A cachaça pode conter quantidades significativas de sódio, tornando-a uma matriz com relevância para estudo, quando se considera esse elemento e considerando-se o elevado consumo da bebida em nosso país.
OBJETIVOS Os objetivos desta proposta didática incluem:
PARTE EXPERIMENTAL Reagentes e soluçoes Todas as soluçoes foram preparadas usando água purificada em sistema BarnsteadTM EasyPure® RoDi (Thermoscientific, D13321, resistividade ≥ 18 MΩ cm) e os reagentes foram usados conforme recebidos, sem purificaçao prévia. Os principais reagentes usados foram NaCl (P.A., Mallinckrodt) e etanol (HPLC Grade, Tédia Brazil). Para a preparaçao das soluçoes e suas diluiçoes foram usados baloes volumétricos de 10,0; 25,0; 100,0 mL, pipetas graduadas de 5,0 e 10,0 mL e micropipetas de 1000 µL, devidamente calibrados por pesagem de água, considerando-se a temperatura ambiente e a densidade, sendo as pesagens feitas em triplicata. Equipamentos As medidas foram realizadas usando um Espectrômetro de Emissao Atômica por Chama (Fotômetro de Chama), DIGMED, modelo DM-61 e acessórios. Amostras de cachaça As amostras de cachaça foram gentilmente cedidas pelo Laboratório para o Desenvolvimento da Química da Aguardente (LDQA) do IQSC/USP e rotuladas como Amostras 1, 2 e 3. Essas amostras foram selecionadas considerando-se diversos aspectos físico-químicos, entre eles sua composiçao. No presente caso, focou-se no teor de sódio, com diferentes níveis de concentraçao, e no teor alcoólico que se encontrava entre 40±1 % (v/v). Uma vez que se dispunha de amostras com teores de etanol similares, optou-se pelo uso da calibraçao externa com soluçoes analíticas para as determinaçoes quantitativas. Entretanto, o procedimento de adiçoes de padrao é recomendável quando se está trabalhando com amostras com maiores variaçoes entre seus teores alcoólicos. As cachaças utilizadas continham teores de sódio de 4,1; 12,1 e 13,1 mg L-1, os quais foram determinados pelo laboratório que forneceu as amostras usando espectrometria de emissao atômica com plasma indutivamente acoplado.30 Segundo Reche,30 o sódio, juntamente com outras espécies metálicas, pode ser incorporado às bebidas pela água e contaminaçoes durante o processo de produçao. Assim, as quantidades desse íon, na bebida, dependem, fortemente, da regiao produtora, do processo de produçao, entre outros fatores, e varia significativamente. O autor estudou um universo de 107 amostras de cachaça para tipificaçao, e usou sódio como um dos discriminantes da regiao de procedência da bebida, juntamente com outros compostos orgânicos (aldeídos, cetonas, carbamatos, ácido acético, álcoois e dimetilsufeto) e inorgânicos (manganês, alumínio, cálcio, crômio, estrôncio, ferro, cadmio e potássio). Nenhum tratamento prévio foi realizado com as amostras. Caso o intervalo de leitura nao coincidisse com os das soluçoes de referência, essa deveria entao ser diluída para que sua concentraçao estivesse adequada às soluçoes de calibraçao contendo sódio, nos diferentes meios. A curva analítica foi construída em meio de etanol:água 40% (v/v), considerando-se o teor alcoólico das amostras de cachaça a serem analisadas. Preparaçao das soluçoes de calibraçao de Na+ Preparou-se uma soluçao estoque de sódio pesando-se 0,2922 g de NaCl, previamente seco em estufa por 24 h a 100 ºC.31 O sal foi dissolvido em água destilada e transferido para um balao volumétrico de 100,0 mL e completou-se o volume com água destilada. Essa soluçao pode ser considerada como padrao primário conforme vários autores,31 mas pode, alternativamente, ser padronizada pelos métodos clássicos de Mohr, Volhard ou Fajans, com base no teor de cloreto.32,33 Essa soluçao corresponde a uma concentraçao de NaCl 0,500 mol L-1, equivalente a 1.150 mg L-1 Na+. Preparo das soluçoes de etanol:água 10%, 40% e 50 % (v/v) Mediram-se os volumes necessários de etanol para o preparo das soluçoes de etanol:água 10%, 40% e 50% (v/v) de etanol, transferiu-se o volume para baloes volumétricos de 100,0 mL e completou-se o volume com água destilada. Preparo das soluçoes de referência de sódio e obtençao da curva analítica Foram preparadas as soluçoes de referência de sódio por diluiçao a partir da soluçao padrao estoque, em concentraçoes de 2,00; 5,00; 10,0; 20,0; 30,0; 40,0 mg Na+ L-1, medindo-se os volumes com a micropipeta, que foram transferidas para baloes volumétricos de 25,0 mL, completando-se os volumes com as soluçoes 10, 40 e 50% de etanol (v/v). Sendo assim, três conjuntos de soluçoes foram preparados contendo diferentes concentraçoes de etanol, para cada referência. Os sinais de emissao foram medidos em quintuplicata e determinaram-se a média e o desvio padrao para a soluçao de referência.
RESULTADOS E DISCUSSAO Efeito da composiçao do solvente/matriz na resposta analítica em espectrometria de emissao atômica O experimento proposto baseia-se em demonstrar o efeito do solvente ou matriz no sinal analítico de medidas de espectrometria de emissao atômica com chama. A composiçao da soluçao é importante nessa técnica, como será visto a seguir, pois afeta parâmetros físico-químicos como, densidade, viscosidade e tensao superficial, conforme foi visto na Introduçao. Um aspecto que deve ser considerado na análise instrumental com métodos de absorçao e emissao atômica com chama envolve a introduçao da amostra no nebulizador. A amostra, normalmente em fase aquosa, é aspirada até o nebulizador a uma vazao controlada e constante, de forma a suprir a chama com o analito e prevenir oscilaçoes no sinal do detector por variaçao na quantidade de analito presente na chama. Entretanto, se soluçoes com diferentes densidades, viscosidades e tensoes superficiais sao inseridas, a massa de analito que é atomizada na chama pode variar, levando a erros quantitativos se a calibraçao for feita com soluçao aquosa e o analito determinado em amostras nao aquosas, por exemplo. Desta forma, é importante que as soluçoes padrao e as amostras nao apresentem variaçoes marcantes de densidade, viscosidade e tensao superficial, pois tais parâmetros interferem intensamente na vazao da soluçao e, consequentemente, na massa de analito presente na chama. Uma forma de demonstrar tal efeito é o estudo de soluçoes aquosas e misturas de etanol/água, em diferentes proporçoes. A demonstraçao do efeito da composiçao do solvente em soluçoes a serem analisadas por espectrometria de emissao atômica com chama pode ser feita medindo-se o sinal de soluçoes contendo íons sódio com concentraçao conhecida em meios com diferentes teores alcoólicos. Um exemplo típico de resultado para este tipo de determinaçao pode ser visto na Figura 1, na qual soluçoes de calibraçao contendo Na+ com 10,0; 30,0; 50,0; e 80,0 mg L-1 em meio aquoso e hidroetanólicas contendo etanol 10% (v/v) e etanol 50% (v/v) foram inseridas no fotômetro de chama.
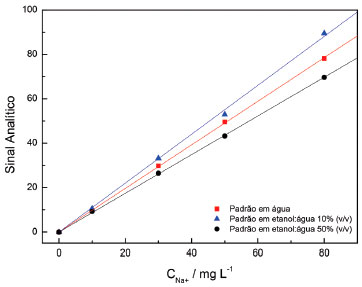 Figura 1. Curvas analíticas obtidas para Na+ em água e misturas de água/etanol contendo etanol 10% e 50 % (v/v)
A Tabela 1 apresenta os valores de coeficiente linear, coeficiente angular e coeficiente de correlaçao das curvas analíticas apresentadas na Figura 1. Todas apresentam linearidade e passam pela origem. Entretanto, há significativa variaçao no coeficiente angular, parâmetro que representa a sensibilidade da determinaçao.
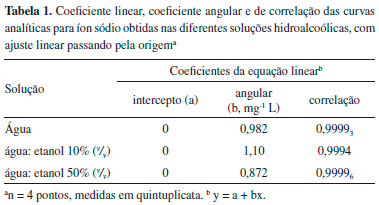
Pode-se observar que, ao adicionar 10% (v/v) de etanol, os sinais aumentaram em relaçao àqueles medidos em água. Isso pode ser explicado pela diminuiçao da tensao superficial, quando se adicionam quantidades relativamente pequenas de solventes em soluçoes aquosas, o que permite a formaçao de gotículas com maior facilidade, aumentando a eficiência da atomizaçao.4 Entretanto, para soluçoes etanol:água 1:1 (v/v), ou etanol 50% (v/v), ocorre queda de sinal devido à diminuiçao da densidade da soluçao, o que, sob vazao constante, faz com que menos massa de soluçao chegue até a chama, no mesmo intervalo de tempo, com consequente menor quantidade de íons sódio, compensando o efeito da tensao superficial observada na soluçao contendo 10% de etanol (v/v). Outro fator importante a considerar aqui é que soluçoes contendo 50% etanol (v/v) apresentam maior viscosidade que a água ou etanol puros e as demais misturas, levando, portanto, a menores taxas de aspiraçao.5 A densidade das soluçoes utilizadas é apresentada na Tabela 2.34 No primeiro caso, etanol 10% (v/v), uma vez que a diferença de densidade nao é tao significativa, o efeito da tensao superficial prevalece e o sinal aumenta. Já no segundo caso, com etanol 50% (v/v), prevalecem os efeitos da densidade e viscosidade.

Fica, assim, claramente demonstrado o efeito do solvente na análise por espectrometria de emissao atômica em relaçao aos efeitos da densidade, no transporte de soluçao e da tensao superficial na formaçao das gotículas. Assim, é preciso inserir as soluçoes de calibraçao em meio com características físico-químicas semelhantes àquelas da amostra. Determinaçao de sódio nas amostras de cachaça Como dito anteriormente, a cachaça é uma bebida que contém álcool e água em sua composiçao. Por legislaçao, cachaça é a bebida que contém entre 38-48% de etanol (v/v)12 e, como foi visto acima, é preciso calibrar adequadamente o fotômetro de chama para determinaçoes de íons metálicos nesse meio. Nesse caso, para a determinaçao de sódio usando calibraçao externa foi necessário preparar soluçoes de calibraçao com concentraçoes conhecidas e em meio etanol-água com composiçao próxima à da amostra, já que se os padroes estiverem em soluçao aquosa haverá um erro no sinal, como demonstrado na Figura 1. Escolheu-se uma concentraçao de etanol 40% (v/v) para preparo dos padroes, considerando-se a semelhança com a matriz, lembrando que foram escolhidas amostras de cachaça contendo 40±1% de álcool (v/v), conforme descrito na parte experimental. A Figura 2 apresenta a curva analítica referente à calibraçao do fotômetro, em etanol 40% (v/v).
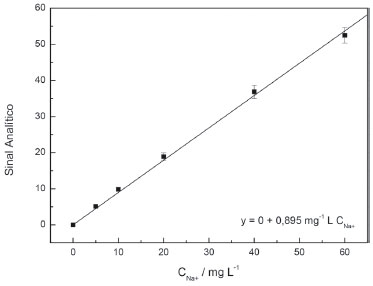 Figura 2. Curva analítica para sódio em etanol-água 40% (v/v), usando o fotômetro de chama. Cada ponto é a média de cinco determinaçoes. Neste intervalo de concentraçao obteve-se uma relaçao linear apresentada como inserçao na figura e R2 = 0,9993, para n = 5 pontos
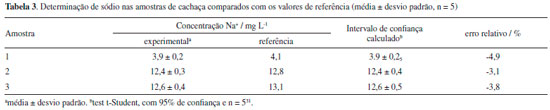
Depois de realizada a leitura das soluçoes analíticas de calibraçao, seguiram-se as leituras das amostras de cachaça. Os resultados obtidos sao apresentados na Tabela 3 e comparados com os valores de referência fornecidos pelo Laboratório para Desenvolvimento da Química da Aguardente - LDQA.
Os valores de intervalo de confiança calculados pelo teste t-Student evidenciam que, ao comparar os valores medidos e de referência, há concordância entre eles em um nível de confiança de 95%, pois esses intervalos incluem os valores de referência.32 Essa concordância mostra a eficiência do procedimento de obtençao da curva analítica em meio hidroetanólico quando se consideram amostras de referência selecionadas em dois níveis diferentes de concentraçao, aproximadamente 4 e 13 mg L-1 de Na+, e duas no mesmo nível de concentraçao, aproximadamente 13 mg L-1.
CONSIDERAÇOES DIDATICAS Ao final do experimento os alunos teriam:
CONCLUSAO Os experimentos desenvolvidos utilizando o fotômetro de chama envolvem conceitos sobre os princípios da espectrometria de emissao atômica, com aplicaçoes a diversos tipos de amostra, conferindo a liberdade para explorar amostras encontradas no cotidiano dos alunos. A principal vantagem de se utilizar o fotômetro de chama é a simplicidade da instrumentaçao e o baixo custo, quando comparados a outras técnicas que envolvem instrumentaçao mais dispendiosa. Esses experimentos envolvem uma quantidade considerável de conceitos, que incluem aspectos instrumentais, cálculo estequiométrico e estatístico, dentre outros. O experimento do estudo da matriz ou solvente, desenvolvido para as amostras de cachaça, pode ser usado para mostrar aos alunos a importância da escolha do solvente no desenvolvimento de um método de análise. Além disso, as quantidades de sódio sao geralmente rotuladas e tais valores podem ser comparados com os obtidos na análise, verificando a qualidade do produto e avaliando a equidade dos valores obtidos no experimento pelo teste de t-Student. Quando disponíveis, valores de referência ou até mesmo certificados podem ser usados para comparaçao entre métodos utilizados e os valores rotulados, permitindo valiosa discussao.
AGRADECIMENTOS Os autores agradecem aos Programas CNPq-PIBIC/USP (JGP fellowship) e PROCONTES-USP (LAR).
REFERENCIAS 1. Okumura, F.; Cavalheiro, E. T. G.; Nóbrega, J. A.; Quím. Nova 2004, 27, 832. 2. Pereira, J. G.; Okumura, F.; Ramos, L. A.; Cavalheiro, E. T. G.; Nóbrega, J. A.; Quim. Nova 2009, 32, 1661. 3. Denari, G. B.; Cavalheiro, E. T. G.; Contribuiçoes ao Ensino de Análise Térmica: Desenvolvimento Histórico e Experimentos, RiMa Editora: Sao Carlos, 2016. 4. Skoog, D. A., Holler, F. J., Niemann, T. A.; Princípios de Análise Instrumental, Caracelli, I., trad., 5ª ed., Bookman: Porto Alegre, 2002. 5. Rocha, F. P. R.; Nóbrega, J. A.; J. Chem. Educ. 1996, 73, 982. 6. Cavalcante, M. S.; A Verdadeira História da Cachaça, Sá Editora: Sao Paulo, 2011. 7. Pinheiro, P. C.; Leal, M. C.; de-Araújo, D. A.; Quim. Nova Esc. 2003, 18, 3. 8. da-Silva, J. M.; Cachaça, o mais Brasileiro dos Prazeres, 2ª. ed., Anhembi Morumbi: Sao Paulo, 2008. 9. http://www.ocachacista.com.br/, acessada em novembro de 2017. 10. Ceribeli, D. L.; da-Silva, D. F.; de-Queiroz, I. G.; Ferreira, C. L.; Coronel, D. A.; Lírio, V. S.; Revista de Política Agrícola 2010, XIX, 21. 11. http://www.ibrac.net/index.php/o-ibrac/historico, acessada em novembro de 2017. 12. http://www.planalto.gov.br/ccivil_03/_Ato2007-2010/2009/Decreto/D6871.htm, acessada em novembro de 2017. 13. https://www.cachacaexpress.com.br/estatistica, acessada em novembro de 2017. 14. http://www.sebraemercados.com.br/oportunidades-para-a-cachaca-no-mercado-interno-e-externo, acessada em novembro de 2017. 15. http://www.saudemental.net/alcoolismo.htm, acessada em novembro de 2017. 16. Lewis, G. R.; 1001 Chemicals in everyday products, 2nd ed., Willey: New York,1999. 7. da-Silva A. A.; Galinaro C. A.; Cardoso, D. R.; Lima-Neto, B. S.; Franco, D. W.; A qualidade de destilados de cana de açúcar. Em Indústria de bebidas: Inovaçao, Gestao e Produçao; Venturini-Filho, W. G., ed.; Blucher: Sao Paulo, 2011, Vol. 3, cap. 17. 18. Nascimento, R. F.; Cardoso, D. R.; Lima-Neto, B. S.; Franco D. W.; Farias, J. B.; Quim. Nova 1998, 21, 735. 19. Cardoso, D. R.; Lima-Neto, B. S.; Franco, D. W.; do-Nascimento, R. F.; Quim. Nova 2003,26, 165. 20. Sobrinho, L. G. A., Cappelini, L. T. D.; da-Silva, A. A.; Galinaro, C. A.; Buchviser, S. F.; Cardoso, D. R.; Franco, D. W.; Quim. Nova 2009, 32, 116. 21. Galinaro, C. A.; Franco, D. W.; Quim. Nova 2009,32, 1447. 22. Odello, L.; Braceschi, G. P.; Seixas, F. R. F.; da-Silva, A. A.; Galinaro, C. A.; Franco, D. W.; Quim. Nova 2009, 32, 1839. 23. Galinaro, C. A.; Franco, D. W. Quim. Nova 2011, 34, 996. 24. Serafim, F. A. T.; da-Silva, A A; Galinaro, C. A.; Franco, D.W.; Quim. Nova 2012, 35, 1412. 25. Lee, J. D.; Química Inorgânica nao tao concisa, Edgard Blücher: Sao Paulo, 1996. 26. https://drauziovarella.com.br/hipertensao/sal-e-pressao-alta, acessada em novembro de 2017. 27. http://www.minhavida.com.br/saude/materias/15066-por-que-o-sodio-e-o-vilao-da-hipertensao, acessada em novembro de 2017. 28. Rev. Bras. Hipertens. 2010, 17, pp. 1-64. 29. http://www.who.int/features/qa/82/en, acessada em novembro de 2017. 30. Reche, R.V.; Dissertaçao de Mestrado, IQSC/USP, Sao Carlos, 2006, 154 pp. 31. Morita, T.; Assumpçao, R. M. V.; Manual de Soluçoes, Reagentes e Solventes, 2ª. ed., Edgard Blücher: Sao Paulo, 2007. 32. Harris, D. C.; Análise Química Quantitativa; Bonapace, J. A. P.; Barcia, O. E., trad., 6ª. ed., LTC: Rio de Janeiro, 2005. 33. Baccan, N.; de-Andrade, J. C.; Godinho, O. E. S.; Barone, J. S.; Química Analítica Quantitativa Elementar, 3ª. ed., Blucher: Sao Paulo, 2001. 34. Tablas Auxiliares Para El Laboratorio Químico, Merck: Darmstadt, 1985.
† Em homenagem ao Prof. Dr. Douglas Wagner Franco (21/03/1945 - 07/04/2016, In Memoriam), Prof. Titular do IQSC/USP, por sua dedicaçao ao desenvolvimento da Química no Brasil. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access