Artigo
|
|
| Organofilização e silanização de argila bentonita Organophilization and silanization of bentonite clay |
|
Amanda F. BaruelI; Rita C. L. DutraI; Maurício R. BaldanI,III; Cristina M. A. LopesI,II; Silvana N. CassuI,II,*
I Instituto Tecnológico da Aeronáutica, Departamento de Ciência e Tecnologia Aeroespacial, 12228-904 São José dos Campos - SP, Brasil Recebido em: 30/06/2017 *e-mail: silvanasnc@iae.cta.br Clays have been used in several technological areas. One of the most usual applications is their incorporation into organic materials. Nonetheless, natural clays are hydrophobic being incompatible with organic medium. Clay organophilization can be reached by several methods such as by exchange of the interlayer sodium cations by organic cations, and by silanization of the clay layers. In this study the bentonite clay was organophilized by the addition of the methoxymethyltriphenylphosphonium chloride (CTFF). Further, the organoclay was silanized with (3-glycidyloxypropyl) trimethoxysilane (GPTMS). X-ray fluorescence results, infrared and XPS spectroscopy showed the presence of phosphorus in the organophilic clay. The interlayer space, obtained by X-ray diffraction, increased in 55% after the CTFF addition showing the cationic exchange in the clay lamellar region. After the silanization of the organoclay the interlayer space was slightly reduced from 1,78 nm to 1,72 nm, indicating that the silane molecules were preferential bound in the clay edges. INTRODUÇAO A argila é definida como um material terroso, de granulaçao fina, apresenta alta plasticidade em água1-3 e é formada pelo empacotamento de lamelas cristalinas.1,3-5 A bentonita uma das argilas de maior interesse tecnológico,3,6,7 apresenta em sua configuraçao cátions interlamelares, que podem ser trocados por cátions orgânicos ou inorgânicos quando presentes em soluçao aquosa, influenciando suas propriedades físico-químicas e alterando seu espaçamento basal, essa propriedade é chamada de capacidade de troca catiônica (CTC).2-4,8,9 O termo bentonita é comumente usado para designar argilas constituídas principalmente por argilomineral ou argilominerais esmectíticos, sendo o argilomineral mais frequentemente encontrado a montmorilonita. Essa classe de argilas é constituída principalmente por silicatos de alumínio e magnésio do tipo 2:1, no qual uma folha octaédrica está entre duas folhas tetraédricas. Esse silicato possui deficiência de cargas positivas em sua estrutura cristalina, resultando em excesso de cargas negativas, que é contrabalanceado por cátions interlamelares alcalinos, Na+ ou K+. A montmorilonita é caracterizada pela sua capacidade de troca catiônica, que permite que os cátions inorgânicos sejam substituídos por cátions orgânicos, aumentando seu caráter apolar, e possibilitando sua incorporaçao em meios orgânicos.3 Após a troca catiônica as argilas sao denominadas argilas organofílicas ou organofilizadas, e a partir dessas é possível se obter complexos argila-compostos orgânicos.2,10 As argilas organofilizadas sao mais facilmente incorporadas em sistemas orgânicos, como em cosméticos, tintas à base de solventes orgânicos, polímeros apolares e lubrificantes. A substituiçao de cátions de sódio por cátions orgânicos, em geral, causa um aumento da distância basal da argila, o que pode ser observado pela técnica de difraçao de raios-X (XRD) e, usualmente, quanto maior a cadeia orgânica do sal maior será a distância interlamelar alcançada.11 Sais quaternários de amônio sao os mais comumente utilizados para esse tipo de modificaçao, já que podem facilmente substituir os cátions mono ou divalentes presentes na argila bentonita.12-17 Porém, os cátions quaternários de amônio nao conseguem suportar temperaturas de processamento muito elevadas,18-21 sendo assim, argilas organofílizadas por meio de um sal de amônio sao menos adequadas para utilizaçao em materiais que utilizam altas temperaturas de processamento, como em polímeros contendo argilas como reforço, que sao submetidos a processos de extrusao.20 Na literatura, a estabilidade térmica dos sais de fósforo é descrita sendo superior à apresentada por sais de amônio.10,20-23 Compostos de fósforo sao utilizados em diversas aplicaçoes, tais como retardantes de chama para papeis e têxteis, e também como absorvedores de radiaçao ultra violeta em materiais poliméricos. A adiçao de argilas organofilizadas com sais de fósforo vem sendo investigada em matrizes poliméricas visando aumentar sua resistência térmica e retardância à chama.22,23 Outro método estudado para modificar a argila é a sua silanizaçao.24,25 Neste método é utilizado um organosilano, contendo pelo menos dois grupos reacionais, um que pode se condensar com os grupos hidroxila da argila, formando ligaçoes covalentes entre o silano e os grupos funcionais presentes na superfície das lamelas do mineral, e outro grupo reacional que reagirá ou apresentará forte interaçao com o meio no qual a argila será incorporada.26-30 A reaçao de silanizaçao é irreversível, diferentemente da troca catiônica, devido às ligaçoes covalentes formadas entre a argila e o silano.24,25 Este estudo propoe a organofilizaçao menos estudada, por meio da incorporaçao de um sal de fósforo à argila bentonita, visando modificar seu caráter hidrofílico. Além da organofilizaçao, a argila foi também submetida à silanizaçao com o objetivo de se introduzir grupos epóxidos à sua estrutura, com isso aumentando sua reatividade em relaçao a compostos que contenham grupos amina ou anidrido. As argilas modificadas foram caracterizadas por diversas técnicas, sendo possível se verificar tanto a substituiçao dos cátions de sódio por cátions do sal quaternário de fósforo, como a incorporaçao do silano à argila.
PARTE EXPERIMENTAL Materiais A argila bentonita sódica expansível em água foi fornecida pela empresa Bentonisa do Nordeste. A capacidade de troca catiônica da argila foi determinada utilizando-se o método de azul de metileno (MB),31-33 dissolvendo-se 1 g de argila em 60 mL de água deionizada e gotejando-se uma soluçao de 0,15 mol L -1 de azul de metileno. A determinaçao da área superficial da argila também empregou o método de azul de metileno31-33 O sal quaternário de fósforo utilizado para a organofilizaçao foi o cloreto de (metoximetil) trifenil fosfônio (CTFF) (Sigma Aldrich). O silano empregado foi o (3-glicidilpropil) trimetoxisilano (GPTMS). As estruturas químicas do CTFF e GPTMS sao apresentadas na Figura 1.
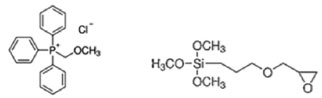 Figura 1. Estrutura química do CTFF e GPTMS34
Organofilizaçao da argila bentonita Para a retirada de parte das impurezas da argila, como quartzo e feldspato, a argila bentonita foi seca em estufa a 100 °C por 24 h, e entao foi passada em peneira com abertura da malha de 53 µm. Essa argila foi chamada de argila P. A organofilizaçao da argila4,17,21 foi realizada a partir de uma dispersao de cerca de 15 g de argila em 900 mL de água deionizada, que foi agitada por 20 min em agitador mecânico, marca Marconi, modelo MA 259, com hélice do tipo roseta dentada, com diâmetro de 45 mm, e haste com 280 mm de comprimento, diâmetro de 3/8 pol, ambos em aço inoxidável. A velocidade empregada para obtençao da dispersao aquosa da argila foi de 700 rpm. Em seguida preparou-se uma soluçao de 6 g de CTFF, em 120 mL de dimetilformamida (DMF), que foi adicionada à dispersao de argila e agitada por 8 h a 25 ºC sob agitaçao a 1500 rpm. A massa de CTFF foi calculada tendo por base a capacidade de troca catiônica da argila, e considerando-se que cada molécula do CTFF poderia substituir um átomo de sódio. Após agitaçao, realizou-se a lavagem da argila organofilizada resultante, aproximadamente 9,5 g, com cerca de 8 L de água deionizada até a completa remoçao dos sais, visualizada pela adiçao de nitrato de prata (AgNO3) 0,1 mol L -1 à água de lavagem até que nao se verificou a formaçao de precipitado branco de cloreto de prata (AgCl).1,35 Realizou-se uma lavagem com 200 mL de tetrahidrofurano (THF) e uma última lavagem com 200 mL de acetona, a fim de arrastar o residual de água ainda presente na dispersao de argila. Para caracterizaçao, a argila foi seca em estufa a vácuo, a 50 °C (temperatura suficiente para remoçao da acetona e demais voláteis sob vácuo), por 24 h, e nomeada de AO. Silanizaçao da argila organofílica A silanizaçao da argila organofilizada (AO) foi feita de acordo com a literatura,24,35,36 partindo-se de 3 mL de AO (aproximadamente 0,5 g) dispersa em 20 mL de acetona sob agitaçao por 10 min. Após agitaçao foi adicionado 0,0496 g de GPTMS e 10 mL de acetona (10% em massa), mantidos sob agitaçao por 1 h e 40 min. Após esse período a dispesao foi submetida ao ultrassom de alta potência com amplitude de 60% e ciclo 1 por 1 h e 30 min. A argila organofilizada e silanizada (AOS) foi seca em estufa a 70 °C, desagregada em almofariz de ágata e, entao, caracterizada. Caracterizaçao As argilas foram caracterizadas por fluorescência de raios-X (XRF), difraçao de raios-X (XRD), termogravimetria (TGA), espectroscopia fotoeletrônica de raios-X (XPS), análise elementar CHN e espectroscopia no infravermelho com transformada de Fourier (FT-IR). A análise por XRF foi realizada no equipamento Axios Advanced, PanAnalytical, com tubo de Rh e potência de 2,5 W. A aquisiçao de dados foi feita com o software Super Q Manager, sendo o resultado normalizado para 100%. A amostra foi analisada na forma de pastilha prensada. A análise de XRD foi realizada no equipamento X Pert Pro MPD da PanAnalytical, operando à tensao de 40 kV, corrente de 45 mA, na faixa 2θ de 3º até 90º, raios-X obtidos utilizando-se tubo de cobre e filtros de níquel e comprimento de onda do raio incidente de 0,1541 nm. A lei de Bragg, λ = 2dsenθ, foi usada para calcular a distância interplanar basal (001). As análises termogravimétricas foram realizadas no equipamento TG/DTA6200 SII Nanotechnology, em faixa de temperatura de 25 °C a 1000 °C, com taxa de aquecimento de 10 °C min -1, em porta amostra de alumina com atmosfera de nitrogênio com fluxo de 100 mL min -1. As análises foram realizadas em duplicata, desde que desvios da ordem de até 1% em massa fossem obtidos. A avaliaçao dos elementos presentes nas superfícies da argila P e argilas AO e AOS foi feita utilizando-se a técnica de espectroscopita fotoeletrônica de raios X (XPS), empregando-se o equipamento AXIS Ultra DLD com fonte de raios X de Mg Kα (1253,6 eV). O XPS foi calibrado com padrao prata e a faixa de energia variou de 0 a 1200 eV. A análise por CHN foi realizada no equipamento 2400 CHNS/O Analyser Series II da PerkinElmer, utilizando como gás de arraste hélio 4.5 com pressao de 18 psi e como gás de combustao oxigênio 6.0 com pressao de 15 psi, faixa de massa entre 3,5 e 4,5 mg. Os espectros de infravermelho foram obtidos utilizando-se o equipamento Spectrum One FT-IR Spectrometer-PerkinElmer, faixa espectral de 4000 a 550 cm -1, ganho 1, resoluçao 4 cm -1, 20 varreduras. Os espectros foram obtidos no modo de reflexao por meio do acessório Drift ou utilizando-se o acessório de refletância total atenuada universal (UATR) aplicando-se uma força de 120 N.
RESULTADOS E DISCUSSAO Inicialmente foram estimados os valores de capacidade de troca catiônica e área superficial da argila P pelo método de azul de metileno, obtendo-se o valor de 114 meq/100 g de argila para a capacidade de troca catiônica, que está de acordo com o descrito na literatura2,37 para argilas dos tipos bentonita e montmorilonita, que varia entre 80 meq/100 g de argila a 150 meq/100 g de argila. A área superficial da argila P foi estimada em 894,5 m2 g -1, estando dentro da faixa descrita38,39 para esse tipo de argila (470 m2 g -1 a 1150 m2 g -1). Neste estudo a argila P foi organofilizada pela troca catiônica de íons de sódio por íons de fósforo. As argilas, antes e após a organofilizaçao, foram avaliadas por fluorescência de raios-X (Tabela 1), observando-se que ocorreu uma reduçao da concentraçao dos cátions de cálcio, magnésio e, principalmente, de sódio, que variou de 3,27% a 0,35%, e um aumento na concentraçao de fósforo de 0,093% para 3,82% após o processo de organofilizaçao. Esse resultado evidencia a eficiência da metodologia empregada na organofilizaçao da argila.

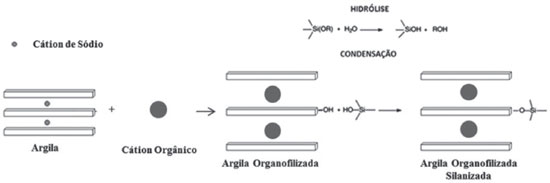
A argila AO foi tratada com silano, GPTMS, visando a incorporaçao de anéis epóxidos a esse material. A silianizaçao da argila é interessante, pois possibilita a formaçao de ligaçoes covalentes entre as partículas de argila silanizadas e moléculas orgânicas que possuam grupos funcionais reativos. Um esquema representativo da organofilizaçao e da reaçao de silanizaçao é mostrado na Figura 2. A silanizaçao pode ocorrer nas superfícies internas ou externas e, também, nas arestas das lamelas da argila.24,26,40
A Figura 3 apresenta os padroes de difraçao de raios-X da argila natural, argila retida em peneira de 53 μm, argila P, e das argilas AO e AOS, observando-se um espaçamento interlamelar basal (001) de 1,15 nm, 1,78 nm e 1,72 nm, para as argilas P, AO e AOS, respectivamente. Nota-se que a argila retida em peneira apresenta picos entre 20° e 30° devido à presença de quatzo, feldspato e clinoptilolite.5 O padrao de difraçao da argila P nao apresenta picos entre 20º e 30º, indicando a retirada de feldspato e quartzo. Os demais picos nao sofrem alteraçao após o peneiramento da argila. O aumento de 55% na distância interlamelar da AO em relaçao à argila P evidencia a intercalaçao do CTFF no espaço interlamelar da argila, como proposto na Figura 2, nao causando alteraçao em sua organizaçao estrutural.1,2,4,9,41 Já a silanizaçao tem uma influência mínima na distancia basal, causando uma reduçao de cerca de 0,3%, o que sugere que o silano se ligou principalmente aos grupos reativos presentes nas arestas e superfície da argila, o que pode ser explicado devido ao espaço interlamelar estar preenchido com o CTFF, dificultando a difusao do GPTMS entre as lamelas, como descrito pelos autores Chen et al. e Wang et al.35,42 Esses autores relataram comportamento semelhante ao observado neste estudo ao silanizarem uma argila montmorilonita organofilizada. Wang et al. obtiveram valores de 1,2 nm para a argila montmorilonita, 1,9 nm para argila organofílica e 1,88 nm para a argila organofílica silanizada.35
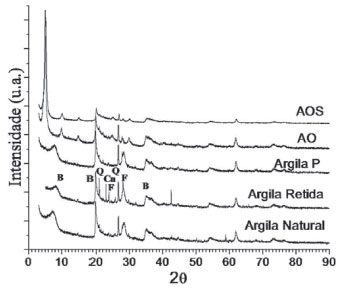 Figura 3. Difratogramas da Argila Natural, Argila Retida, Argila P, AO e AOS (B: Bentonita; Q: Quartzo; F: Feldspato; Cn: Clinoptilolite)
Os espectros no infravermellho obtidos para a argila P, AO e CTFF sao mostrados na Figura 4, verificando-se alteraçoes espectrométricas que evidenciam a presença do CTFF na AO, caracterizada pela presença das bandas em 750 cm -1, 720 cm -1 e 690 cm -1 relativas ao grupo CH aromático do sal de fósforo, observa-se ainda a banda em 1436 cm -1 atribuída à ligaçao entre o fósforo e o anel aromático. Também foi possível se observar um deslocamento da banda referente ao grupo Si-O de 994 cm -1 para 1015 cm -1 e o seu estreitamento. Estas alteraçoes espectrométricas sugerem que a provável interaçao entre os grupos Si-OH tenha sido enfraquecida pela presença do CTFF devido ao afastamento das lamelas da argila. Pode-se observar ainda uma reduçao das intensidades das bandas em 3421 cm -1 e 1633 cm -1, referentes ao estiramento e à deformaçao do grupo OH, relativos à presença de umidade, caracterizando uma maior hidrofobicidade da AO.43,44
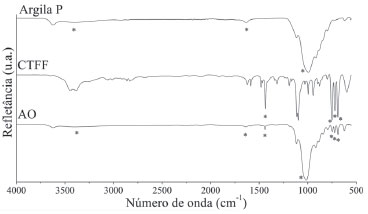 Figura 4. Espectros FT-IR (Reflexao - UATR) da Argila P, CTFF e AO
Na Figura 5, verificam-se alteraçoes espectrométricas que evidenciam a presença do GPTMS na AOS, caracterizada pela presença das bandas em 2943 cm -1 e 2841 cm -1 relativas ao grupo CH do anel epóxido e Si-O-CH3 do GPTMS, respectivamente. Observa-se, ainda, o alargamento da banda na regiao de 1254 cm -1 relativa ao grupamento COC do anel epóxido do silano.44
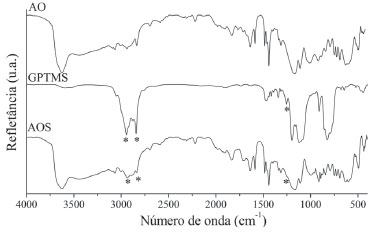 Figura 5. Espectros FT-IR (Reflexao - Drift) da AO, AOS e GPTMS
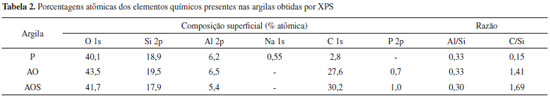
A superfície das argilas foi avaliada por XPS (Figura 6), sendo mostradas as porcentagens relativas dos diferentes elementos encontrados nas argilas na Tabela 2.
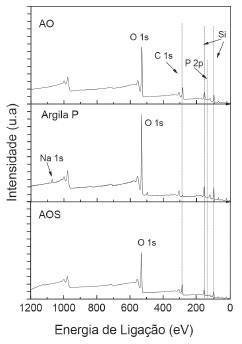 Figura 6. Espectros XPS da argila P e argilas modificadas, AO e AOS
O sódio, Na 1s (1072 eV), é identificado apenas na argila P, como esperado, e o fósforo, P 2p (132,7 eV), é detectado em baixas quantidades nas argilas AO e AOS devido à substituiçao dos cátions de sódio por cátions de fósforo. Destaca-se que os teores de Na 1s e P 2p detectados por essa técnica sao inferiores a 1%, o que deve estar relacionado à profundidade superficial dessa análise, que varia de 2 a 5 nm. Como esses cátions se encontram preferencialmente nas regioes interlamelares, a detecçao desses elementos é baixa por XPS. O carbono, C 1s (285 eV), aparece em baixo teor na argila P devido à presença de CO2 adsorvido à sua superfície.31,45,46 Nas argilas modificadas o C 1s é observado em maiores teores, o que pode ser explicado considerando-se as estruturas químicas do CTFF e do GPTMS (Figura 1) incorporados a essas argilas. Também a razao C/Si aumenta de acordo com argila P < AO < AOS. De acordo com os resultados de espaçamento lamelar obtidos pela difraçao de raios X, o CTFF deve ocupar preferencialmente os espaços interlamelares, enquanto o GPTMS as arestas e a superfície da argila. A detecçao do CTFF pela análise XPS deve-se principalmente ao fato da distância interlamelar ser da ordem de 1,78 nm na argila contendo CTFF, e a profundidade da análise XPS ser da ordem de 5 nm. Com base na diferença das quantidades de C 1s encontradas nas argilas AO e AOS, pode-se inferir que o aumento na quantidade de C 1s observado para a argila AOS é devido à ligaçao do GPTMS à supefície da argila organofilizada, podendo-se estimar um teor de silano incorporado à AOS entre 2-3%. Quando se observa a variaçao da razao Al/Si, nota-se uma ligeira reduçao nesse valor para a argila AOS. De acordo com He et al., essa reduçao na identificaçao das placas octaédricas constituidas de AlO(OH) intercaladas entre duas placas tetraédricas Si-O da argila pode estar associada à ligaçao dos grupos GPTMS à superfície da argila AOS, que interferem em sua identificaçao.45 A avaliaçao elementar das argilas foi realizada por meio da análise CHN, sendo identificados diferentes teores de carbono e hidrogênio nas argilas submetidas aos diferentes tratamentos (Tabela 3). Conforme esperado, a presença de nitrogênio nao foi detectada para estes materiais. O carbono representa 78,18% do CTFF e 45,76% do GPTMS; a partir desses valores foi possível estimar a quantidade em massa de CTFF na AO (20,9 ± 0,1)%, e de GPTMS na AOS (3,2 ± 0,8)%.

Os perfis de decomposiçao térmica das argilas e dos compostos empregados em sua modificaçao sao mostrados na Figura 7. As argilas P, AO, AOS e o CTFF apresentaram mais de uma perda de massa, sendo que a primeira variaçao de massa observada entre 25 °C e 150 °C, é referente à liberaçao de água adsorvida tanto nas argilas como no CTFF. As variaçoes devido à eliminaçao de água corresponderam à (4,6 ± 0,3)%, (1,8 ± 0,1)%, (1,1 ± 0,1)% e (2,6 ± 0,1)%, para a argila P, AO, AOS e CTFF, respectivamente. Essa variaçao de massa foi menor para as argilas AO e AOS em relaçao à variaçao observada na argila P, indicando uma maior hidrofobicidade das argilas modificadas.29,47 A menor hidrofobicidade dessas argilas também foi observada pelos espectros no infravermelho desses materias (Figura 4). A decomposiçao térmica do CTFF ocorreu em um único estágio, entre 150 °C e 300 °C. O GPTMS mostrou decomposiçao térmica em uma única etapa, ocorrendo até 200 °C, com variaçao de massa de (94,8 ± 0,3)% referente à parte orgânica desse material.
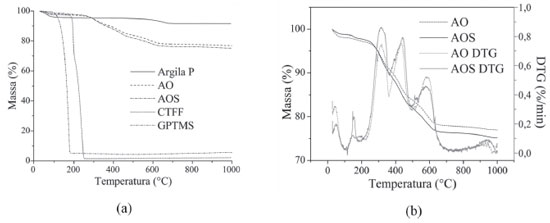 Figura 7. Curvas de variaçao de massa obtidas para Argila P, AO, AOS, CTFF E GPTMS (a) ampliaçao das curvas de variaçao de massa e as respectivas curvas derivadas obtidas para as argilas AO e AOS
A argila P apresentou a segunda perda de massa em uma faixa de temperatura maior que aquela observada para as argilas modificadas, ocorrendo entre 400 °C e 750 °C, sendo de (3,8 ± 0,2)%. Essa variaçao de massa está relacionada à desidroxilaçao da argila.29,35 Em relaçao à decomposiçao térmica das argilas organolifizadas, na literatura sao descritas temperaturas de ínicio de decomposiçao térmica entre 150 °C e 220 °C10,14,23,48 em argilas para as quais a troca catiônica foi realizada com sais de amônio, enquanto argilas organofilizadas com sais de fósforo apresentam início de decomposiçao térmica entre 190 °C e 320 °C.10,23,48 A argila AO apresentou temperatura de decomposiçao térmica inicial em aproximadamente 220 °C, estando no ínicio da faixa de temperatura descrita para argilas organofilizadas com sais de fósforo. A variaçao de massa observada para as argilas AO e AOS entre 220 °C e 800 °C foi de (19,2 ± 0,3)% para a AO e (21,5 ± 0,1)% para a AOS. Essa variaçao está relacionada à desidroxilaçao da argila, como já mencionado para a argila P somada à decomposiçao térmica dos modificadores CTFF e GPTMS presentes nessas argilas. A variaçao de massa observada para a argila AOS foi maior em relaçao à observada no caso da argila AO, caracterizando a presença do GPTMS nessa argila, que pode ser estimado em cerca de 2% a partir dessa diferença. Esse resultado é coincidente com os valores obtidos por CHN e XPS, que ficaram em torno de 3%.
CONCLUSAO A organofilizaçao da argila bentonita foi realizada com sucesso, sendo evidenciada pelo aumento no teor de fósforo e pela reduçao no teor de sódio quando comparadas a argila AO à argila P de acordo com os resultados de FRX. A variçao no teor de carbono determinada por CNH e por XPS também confirmaram a substituiçao catiônica do sódio pelo sal quaternário de fósforo. A incorporaçao interlamelar do sal quaternário de fósforo na estrutura da argila causou um aumento de 55% na distância interlamelar na AO em relaçao à argila P, de acordo com os resultados de XRD. As alteraçoes espectrométricas observadas nos espectros FT-IR indicaram a presença de CTFF na AO e sugeriram uma maior hidrofobicidade dessa argila em comparaçao à argila P, que foi confirmada pela reduçao nos teores de umidade determinados por termogravimetria. A presença de GPTMS na AOS foi evidenciada pelas alteraçoes espectrométrica nos espectros no infravermelho e pelo aumento do teor de carbono determinado pelas técnicas de CHN e XPS. A reduçao da distância interlamelar de cerca de 0,3% causada pela silanizaçao da argila organofilizada indicou que as moléculas do silano se ligaram preferencialmente à superfície e às arestas da argila. A metodologia empregada mostrou-se adequada na organofilizaçao de argila do tipo bentonita sódica, permitindo sua incorporaçao em meios orgânicos diversos, tais como matrizes poliméricas utilizadas na obtençao de nanocompósitos ou em dispersoes como tintas e recobrimentos.
AGRADECIMENTOS A Coordenaçao de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) pela bolsa concedida, e também a M. F. Diniz, M. F. P. Azevedo, A. Garcia, R. R. Cunha e M. A. M. de Souza pela assistencia técnica nas análises realizadas.
REFERENCIAS 1. Cavalcanti, J. V. F. L.; Abreu, C. A. M.; Sobrinho, M. A. M.; Baraúna, O. S.; Portela, L. A. P.; Quim. Nova 2009, 32, 2051. 2. Menezes, R. R.; Avila Júnior, M. M.; Santana, L. N. L.; Neves, G. A.; Ferreira, H. C.; Cerâmica 2008, 54, 152. 3. Teixeira-Neto, E.; Teixeira-Neto, A. A.; Quim. Nova 2009, 32, 809. 4. Araújo, S. S.; Araújo, P. E. R.; Raposo, C. M.; Carvalho, L. H.; Silva, S. M. L.; Anais do Congresso Brasileiro de Engenharia e Ciência dos Materiais, Foz do Iguaçu, Brasil, 2006. 5. Önal, M.; Sarikaya, Y.; Alemdaroğlu, T.; Bozdoğan, I.; Turk. J. Chem. 2003, 27, 683. 6. Díaz, F. R. V.; Santos, P. S.; Quim. Nova 2001, 24, 345. 7. Coelho, A. C. V.; Santos, P. S.; Santos, H. S.; Quim. Nova 2007, 30, 1282. 8. Baltar, C. A. M.; Luz, A. B.; Insumos Minerais Para Perfuraçao De Poços De Petróleo, CTPETRO: Recife, 2003, cap. 2. 9. Ferreira, H. S.; Menezes, R. R.; Ferreira, H. S.; Martins, A. B.; Neves, G. A.; Ferreira, H. C.; Cerâmica 2008, 54, 77. 10. Hedley, C. B.; Yuan, G.; Theng, B. K. G.; App. Clay Sci. 2007, 35, 180. 11. Azeez, A. A.; Rhee, K. Y.; Park, S. J.; Hui, D.; Composites 2013, 45, 308. 12. Barbosa, R.; Araújo, E. M.; De Oliveira, A. D.; De Melo, T. J. A.; Cerâmica 2006, 52, 264. 13. Xi, Y.; Frost R. L.; He, H.; Kloprogge, T.; Bostrom, T.; Langmuir 2005, 21, 8675. 14. Xie, W.; Gao, Z.; Pan, W. P.; Hunter, D.; Singh, A.; Vaia, R.; Chem. Mater. 2001, 13, 2979. 15. Yeşilyurt, Z.; Boylu, F.; Çinku, K.; Esenli, F.; Çelik, M. S.; Appl. Clay Sci. 2014, 95, 176. 16. Nguemtchouin, M. G. M.; Ngassoum, M. B.; Kamga, R.; Deabate, S.; Lagerge, S.; Gastaldi, E.; Chalier, P.; Cretin, M.; App. Clay Sci., 2015, 104, 110. 17. Dutta, A.; Singh, N.; Environ.Sci. Pollut. Res. 2015, 22, 3876. 18. Suin, S.; Shrivastava, N. K.; Maiti, S.; Khatua, B. B.; Eur. Polym. J. 2013, 49, 49. 19. Cui, L.; Bara, J. E.; Brun, Y.; Yoo, Y.; Yoon, P. J.; Paul, D. R.; Polymer 2009, 50, 2492. 20. Patel, H. A.; Somani, R. S.; Bajaj, H. C.; Jasra, R. V.; Appl. Clay Sci. 2007, 35, 194. 21. Calderon, J. U.; Lennox, B.; Kamal, M. R.; Appl. Clay Sci. 2008, 40, 90. 22. Ollier, E.; Rodriguez, E.; Alvarez, V.; Composites, Part. A 2013, 48, 137. 23. Xie, W.; Xie, R.; Pan, W. P.; Hunter, D.; Koene, B.; Tan, L. S.; Vaia, R.; Chem. Mater. 2002, 14, 4837. 24. Gianni, A.; Amerio, E.; Monticelli, O.; Bongiovanni, R.; Appl. Clay Sci. 2008, 42, 116. 25. Bertuoli, P. T.; Piazza, D.; Scienza, L.C.; Zattera, A. J.; Appl. Clay Sci. 2014, 87, 46. 26. He, H.; Tao, Q.; Zhu, J.; Yuan, P.; Shen, W.; Yang, S.; Appl. Clay Sci. 2013, 71, 15. 27. Qin, Z.; Yuan, P.; Zhu, J.; He, H.; Liu, D.; Yang, S.; Appl. Clay Sci. 2010, 50, 546. 28. Chen, G. X.; Yoon, J. S.; Polym. Degrad. Stab. 2005, 88, 206. 29. Qian, X.; Liao, M.; Zhang, W.; Polym. Int. 2007, 56, 399. 30. Vennerberg, D.; Rueger, Z.; Kessler, M. R.; Polymer 2014, 55, 1854. 31. Bugyi, L.; Oszk'o, A.; Solymosi, F.; Surf. Sci. 2000, 461, 177. 32. Kahr, G.; Madsen, F. T.; Appl. Clay Sci. 1995, 9, 327. 33. Yukselen, Y.; Kaya, A.; Eng. Geol. 2008, 102, 38. 34. http://www.sigmaaldrich.com, acessada em novembro 2017. 35. Wang, W. S.; Chen, H. S.; Wu, Y. W.; Tsai, T. Y.; Chen-Yang, Y. W.; Polymer 2008, 49, 4826. 36. Fonseca. M. G.; Airoldi, C.; Quim. Nova 2003, 5, 699. 37. Bergaya, F.; Theng, B. K. G.; Lagaly, G.; Handbook of clay science, 1st ed., Elsevier: Oxford, 2006. 38. Hang, P. T.; Brindley, G.W. Clays Clay Miner. 1970, 18, 203. 39. Foletto, E.; Morgado, A. F.; Porto, L. M.; Anais do 44° Congresso Brasileiro de Cerâmica, Sao Pedro, Brasil, 2000. 40. Spencer, M. W.; Hunter, D. L.; Knesek, B. W.; Paul, D. R.; Polymer 2011, 52, 5369. 41. Rodrigues, A. W.; Brasileiro, M. I.; Araújo, W. D.; Araújo, E. M.; Neves, G. A.; Melo, T. J. A.; Polim.: Cienc. Tecnol. 2007, 17, 219. 42. Chen, G. X.; Kim, H. S.; Yoon, J. S.; Polym. Int. 2007, 56, 1159. 43. Bellamy, L. J.; The Infra-Red Spectra of Complex Molecules, 3rd ed., Wiley: New York, 1975. 44. Smith, A. L.; Applied Infrared Sprectroscopy, Wiley: New York , 1979. 45. He, H.; Zhou, Q.; Frost, R. L.; Wood, B. J.; Duong, L. V.; Kloprogge, J. T.; Spectrochim. Acta, Part A 2007, 66, 1180. 46. Park, Y.; Ayoko, G. A.; Frost, R. L.; J. Colloid Interface Sci. 2011, 360, 440. 47. Djouani, F.; Herbst F.; Chehimi, M. M.; Benzarti, K.; Constr. Build. Mater. 2011, 25, 424. 48. Seyidoglu, T.; Yilmazer, U.; J. Thermoplast. Compos. Mater. 2015, 28, 86. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access