Revisão
|
|
| A POLIANILINA NO CENÁRIO AMBIENTAL: UMA ABORGAGEM SOBRE FOTOCATÁLISE HETEROGÊNEA POLYANILINE IN THE ENVIRONMENTAL SCENARIO: AN APPROACH ON HETEROGENEOUS PHOTOCATALYSIS |
|
Vanessa M. M. VargasI, Carla DalmolinI, Sérgio H. PezzinI, Marcela Mohallem OliveiraII e Patricio Peralta-ZamoraIII,*
I. Centro de Cências Tecnológicas, Universidade do Estado de Santa Catarina, 89219-710 Joinville - SC, Brasil Recebido em 27/07/2017 *e-mail: zamora@ufpr.br Polyaniline is a conducting polymer that has recently been studied regarding its potential in the removal of contaminants by heterogeneous photocatalysis. Since it is a polymer with a high absorption capacity of photons in the visible region, it promotes the photosensitization of catalysts that are typically inactive in solar systems. The increasing number of publications applying photocatalysis and composite catalysts based on polyaniline highlights the importance of this subject. This review systematizes the most important and specific contributions of composite catalysts formed by polyaniline. The main mechanisms proposed for photosensitization, which show the synergism between the phases of the composite, are summarized. Moreover, the relevance of morphology and conductivity of the composite catalyst, operating parameters (eg. pH, and light source contaminant) are some of the aspects discussed, revealing how these differ from traditional catalysts. Future prospects for the continuation and improvement of this issue mainly involve a greater variety of contaminant removal tests and understanding of relations between the structure of the material and its photocatalytic property. INTRODUÇAO Nos últimos 20 anos, inúmeros trabalhos demonstraram a elevada eficiência de degradaçao da fotocatálise heterogênea, frente a inúmeras espécies químicas consideradas poluentes prioritários ou emergentes. A fotocatálise heterogênea é viabilizada pela geraçao de pares elétron/buraco (e-/h+), gerados quando um semicondutor é irradiado com fótons de energia maior ou igual ao seu band gap. Embora elétrons e buracos sejam bastante reativos, admite-se que a principal rota de degradaçao é mediada por radical hidroxila (OH.) que surge da reaçao da lacuna com íon hidroxila o moléculas de água previamente adsorvidas na superfície do semicondutor.1-4 Infelizmente, grande parte dos fotocatalisadores correspondem a óxidos semicondutores que apresentam band gap de energia correspondente aos comprimentos de onda da regiao ultravioleta do espectro, como TiO2 (λ ≈ 388 nm) e ZnO (λ ≈ 370 nm), o que faz com que a sua eficiência catalítica em sistemas assistidos por radiaçao solar seja muito baixa.5-9 Desta forma, a procura de sistemas catalíticos assistidos por energia solar tem sido alvo constante de pesquisas, objetivando, nao apenas a reduçao de custos, mas também a implementaçao de sistemas operando em grande escala. Dentre as principais alternativas utilizadas para ampliar a foto-resposta de catalisadores pouco ativos sob luz visível destacam-se o desenvolvimento de catalisadores dopados por metais e nao-metais, de catalisadores associados a outros semicondutores e o uso de processos sensibilizados por corantes. 8-10 Recentemente, uma nova estratégia em síntese de catalisadores compósitos surgiu como resposta à necessidade de potencialisar a fotocatálise de contaminantes sob luz visível ou solar, que consiste na associaçao de catalisadores inorgânicos, usualmente óxidos semicondutores, e polímeros condutores (PC) coloridos. Dentre os principais polímeros condutores a polianilina merece destaque, em virtude do seu baixo custo, da sua facilidade de síntese, do seu caráter atóxico, da sua elevada estabilidade térmica e à exposiçao à luz, da sua ampla absorçao de luz visível e infravermelho próximo e da alta mobilidade e separaçao de cargas.7,11-15 Vários trabalhos ressaltam a ocorrência de um efeito sinérgico entre polianilina e catalisadores inorgânicos, o que resulta em sistemas fotocatalíticos promissores para a remoçao de contaminantes.6,7,12,13,15-22 Polianilina A partir da década de 70, com a descoberta das formas dopadas de polímeros capazes de conduzir corrente elétrica, uma vasta área de pesquisa e de aplicaçoes destes materiais foi estabelecida. A polianilina (PANI), dentre os polímeros condutores (PC), tem recebido destaque devido a sua boa estabilidade, fácil obtençao e amplo leque de aplicaçoes. Os principais estudos e aplicaçoes da polianilina se relacionam com sensores/biosensores, transistores, eletrodos em baterias, supercapacitores, coberturas anticorrosivas, dispositivos fotovoltaicos e eletrocrômicos, fotocatalisadores, entre outras.7,17,23,24 O uso da polianilina em aplicaçoes ambientais envolve células solares sensibilizadas,17,25,26 produçao de hidrogênio,27,28 e fotocatálise heterogênea para remoçao de contaminantes e desinfecçao.21,29-31 Na última década houve crescente aumento das publicaçoes abordando processos fotocatalíticos e polianilina, além de outros polímeros condutores (Figura 1). Embora esse levantamento da literatura nao considere exatamente todas as publicaçoes, os dados obtidos evidenciam uma tendência geral do crescente interesse da comunidade científica quanto ao uso de polímeros condutores (especialmente a polianilina) em processos fotocatalíticos. Contudo, menos de 1% ao ano das publicaçoes em fotocatálise incluem o uso da polianilina ou outros polímeros condutores, o que justifica a importância de desenvolver mais pesquisas com este tema.
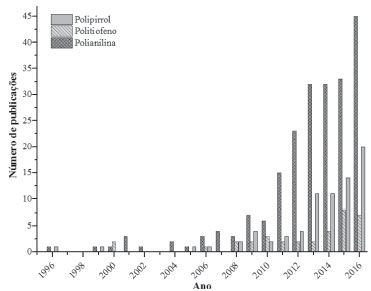 Figura 1. Números anuais de publicaçoes envolvendo fotocatálise heterogênea e polianilina, polipirrol e politiofeno. (fonte: http://www.scopus.com, termos de pesquisa para cada polímero: "Photocatalytic and Polyaniline")
Dentre os primeiros estudos publicados, que contemplaram o uso da polianilina como modificador, se destaca o trabalho realizado por Liu, Guo e Jin32 em 1991, que demostrou a elevada capacidade de degradaçao do catalisador compósito formado por TiO2 e polianilina na degradaçao de fenol por processos assistidos por radiaçao solar. Outro estudo pioneiro no cenário em avaliaçao foi publicado por um grupo brasileiro em 1996 (Zamora et al.),33 o qual mostrou o desempenho da polianilina na degradaçao de efluente têxtil, ficando evidente a direçao para uso de materiais compósitos. A partir de entao, conforme a Figura 1, apenas após 2011 houve aumento significativo de publicaçoes nesse tema. Pei e Luan34 em 2012 e Tahir e Amin35 em 2013 fizeram citaçoes indicando polímeros condutores como uma nova e promissora linha de fotossensibilizadores. É importante destacar que recentemente (2015), Reddy, Hassan e Gomes,31 Riaz, Ashraf e Kashyap29 e Ansari et al.36 publicaram os primeiros artigos de revisao sobre catalisadores fotossensibilizados por polímeros condutores, considerando TiO2 e PC, catalisadores inorgânicos e PC, e catalisadores inorgânicos e politiofeno, respectivamente. A divulgaçao desses trabalhos representa, de certo modo, a consolidaçao de polímeros condutores como uma nova classe de fotossensibilizadores. Entretanto, ainda há um campo fértil de pesquisa a ser explorado quanto à síntese, condiçoes de fotocatálise, mecanismos de fotossensibilizaçao, entre outros aspectos envolvendo novos catalisadores compósitos baseados em polianilina. A polianilina, obtida a partir da polimerizaçao da anilina, é formada por unidades de repetiçao que contém uma forma reduzida (dois anéis benzenóides) e outra oxidada (um anel quinóide e um benzenóide) (Figura 2), sendo que a forma chamada de esmeraldina (y = 0,5), quando dopada por protonaçao, é a que pode apresentar os maiores valores de condutividade elétrica.
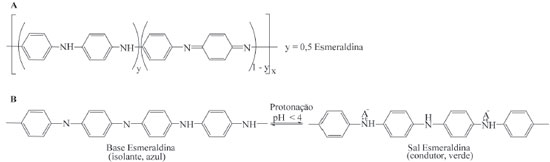 Figura 2. (A) Unidade de repetiçao da polianilina na forma conhecida como esmeraldina. (B) reaçao de dopagem via protonaçao da forma básica (base esmeraldina) para o sal esmeraldina
A Figura 2 mostra que a dopagem da PANI ocorre em meio ácido, através da protonaçao do átomo de nitrogênio dos sítios básicos (aminas e iminas), situaçao na qual há despopulaçao parcial do sistema de elétrons π (oxidaçao parcial), caracterizando dopagem do tipo p. A partir dessa etapa haverá a formaçao de estados eletrônicos localizados no gap, conhecidos como estados polarônicos, resultado das distorçoes da cadeia polimérica em torno das cargas geradas na protonaçao. Devido à carga positiva gerada no processo de dopagem, a eletroneutralidade da cadeia polimérica é garantida pela açao de ânions, chamados dopantes, normalmente vindos do próprio ácido utilizado para a protonaçao. A condutividade da PANI está diretamente relacionada com o tipo de ânion e o grau de dopagem, extensao da conjugaçao do sistema π e conformaçao das cadeias poliméricas. Quando a polianilina é submetida ao processo de dopagem com ácidos que contenham ânions volumosos e solventes que interajam com estes ânions, as cadeias poliméricas passam a assumir uma conformaçao estendida, o que facilita o processo de transporte de cargas, aumentando a condutividade. Nas cadeias com conformaçao estendida existe maior interaçao entre os estados polarônicos, promovendo deslocalizaçao e maior extensao da conjugaçao π e, consequentemente, aumento da condutividade. Outro fator importante relacionado ao aumento da condutividade da PANI está associado com a total protonaçao dos grupos iminas, por isso, o grau de dopagem deste polímero depende do pH da soluçao ácida em que está inserido (Figura 2B).37-42 O desempenho da polianilina em doar elétrons, receber e transportar buracos sob incidência de fotóns com energia na regiao visível do espectro sugere um grande potencial para sua aplicaçao em fotocatálise heterogênea.13,15,43 A polianilina como fotossensibilizador em fotocatálise heterogênea As propriedades ópticas da polianilina sao responsáveis pelo seu potencial em atuar como fotossensibilizador de óxidos metálicos semicondutores como o TiO2, ZnO, entre outros, que sao normalmente inativos à luz visível. As transiçoes eletrônicas da PANI dopada de coloraçao verde (sal esmeraldina) sao bem conhecidas e marcadas pela presença de estados polarônicos no gap. O espectro UV-Vis do sal esmeraldina apresenta três bandas características: duas bandas em aproximadamente ~ 320 - 380 nm e ~ 415 - 450 nm referentes as transiçoes π - π* e pôlaron - π*, respectivamente, e uma terceira banda larga situada na faixa do visível entre ~ 700 à 850 nm indicando a transiçao π - pôlaron.15,40,41,44-46 Portanto, num catalisador compósito, o sinergismo entre a polianilina e o óxido metálico potencializa a oxidaçao de contaminantes sob radiaçao solar, aproveitando grande parte da energia incidente que corresponde à faixa do visível. A propriedade de conduçao elétrica da polianilina também é fundamental no mecanismo de fotossensibilizaçao. Polianilina na sua forma dopada (sal esmeraldina) pode apresentar valores de condutividade comparáveis aos encontrados em semicondutores, na ordem de 0.1 - 10 S cm-1.19,23,40,44,47-50 Em funçao das condiçoes experimentais de síntese e dopagem, a polianilina pode apresentar comportamento metálico de conduçao, sendo que valores acima de 200 S cm-1 e chegando na ordem de 103 S cm-1 já foram obtidos.37,40,51 A influência dessa propriedade na fotocatálise está associada às junçoes n-p formadas entre óxidos metálicos e polianilina, descritos como semicondutores tipo n e p, respectivamente.13,29,52 A partir dessas junçoes, quando a polianilina recebe fótons que promovam seus elétrons à estados de energia mais elevados, o óxido pode recebê-los em sua banda de conduçao, em seguida, a polianilina passa a transportar carga positiva (buraco: h+) e o óxido, negativa (elétrons: e-).53,54 Assim, o aumento da eficiência pelo uso de catalisadores compósitos está relacionado com as propriedades de transporte de carga, maior separaçao de cargas e reduçao da recombinaçao elétron/buraco.13,29,55 Associando as informaçoes anteriores, o mecanismo de fotossensibilizaçao pode ser compreendido pela disposiçao dos níveis de energia LUMO (lowest unoccupied molecular orbital) da polianilina (PANI) e da banda de conduçao (BC) do óxido metálico (OM). Ao incidir fótons de energia correspondente à faixa visível do espectro (hν(vis)), elétrons dos orbitais HOMO do polímero sao promovidos para os orbitais LUMO, que sao transferidos para a BC do óxido metálico. Esses elétrons sao transferidos para superfície do catalisador e participam de reaçoes com O2 (aceptor de elétrons) que levam a formaçao de radicais O2•- (Eq. 2) e •OH (Eq. 3) capazes de oxidar moléculas de contaminantes (Figura 3A).6,7,12,13,15-22,54-58 Esta via de fotossensibilizaçao é a mais amplamente divulgada na literatura, e as equaçoes 1 a 3 sumarizam as reaçoes marcantes desta via mecanística.
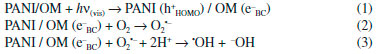
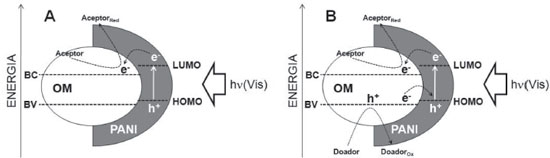 Figura 3. Representaçao esquemática das principais vias mecanísticas de fotossensibilizaçao de catalisadores compósitos baseados em polianilina sob luz visível. (A) Mecanismo fundamentado na transferência de elétrons excitados em LUMO da PANI para a BC do óxido metálico (OM), (B) Mecanismo complementar em que elétrons da BV do OM sao transferidos para o buraco gerado em HOMO na PANI, resultando num buraco em BV do óxido com potencial oxidante
Uma descriçao complementar do mecanismo propoe que ocorre a transferência do elétron da banda de valência (BV) do óxido para o buraco gerado em HOMO (highest occupied molecular orbital) na polianilina. Esse evento resulta num buraco na BV do óxido com potencial oxidante capaz de reagir com as moléculas do contaminante ou ainda com a água, formando •OH (Figura 3B e Equaçoes 4 - 6).7,52,59 Nesse mecanismo, fica evidente que há um sistema cíclico de elétrons, que é sustentado pelas reaçoes entre as substâncias do meio e transferências eletrônicas entre as fases do compósito. Pei e Luan34 descrevem a importância da regeneraçao do fotossensibilizador quanto à falta de elétrons, para que se sustente o ciclo de fotoreaçoes; o que corrobora para a validaçao dessa via mecanística.
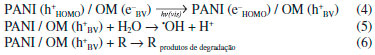
Outra sugestao de mecanismo considera a incidência apenas de radiaçao UV. Nessa situaçao, elétrons do óxido metálico (OM) e da polianilina sao promovidos aos seus estados de energia mais altos, resultando numa maior densidade de elétrons na banda de conduçao tanto do óxido quanto no LUMO do polímero, além de buracos na banda de valência e no HOMO. Em funçao da disposiçao dos níveis de energia, a separaçao de cargas é favorecida, devido às transferências de elétrons do LUMO da PANI para a BC do óxido metálico, e buracos da BV para o HOMO (Figura 4). A formaçao de radicais hidroxila e a degradaçao do contaminante (R) ocorrem através de reaçoes nos sítios redutores e oxidantes do óxido metálico (Equaçoes 7 - 9).13,43,60,61
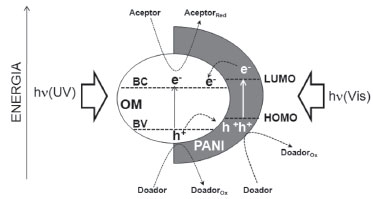 Figura 4. Representaçao esquemática da via mecanística de fotossensibilizaçao de catalisadores compósitos baseados em polianilina sob luz UV ou visível incluindo a excitaçao do OM por radiaçao UV. A formaçao de radicais hidroxila e a degradaçao do contaminante ocorrem através de reaçoes nos sítios redutores e oxidantes do material (Equaçoes 7 - 9)
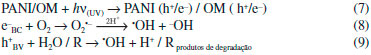
Em alguns casos, o catalisador inorgânico já possui bandgap de energia correspondente aos comprimentos de onda da regiao visível do espectro (exemplos: CdS e Bi2WO6) e, portanto, quando associados a polianilina, ambos absorvem fótons que promovem seus elétrons para níveis mais altos de energia. Por isso, assim como descrito para sistemas que operam com UV, há alta densidade de elétrons e buracos tanto na polianilina quanto no catalisador inorgânico. As transferências dessas cargas e a formaçao de sítios oxidantes e redutores também ocorrem de forma similar àquela para UV (Figura 4).62-66 Em sistemas solares quando uma parcela de radiaçao UV está presente, ou ainda, com o uso de radiaçao artificial sem filtros, haverá contribuiçao de ambos os mecanismos propostos para luz visível e ultravioleta.13 Os estudos que envolvem apenas luz UV ou visível sao importantes justamente porque em sistemas solares ambas estao presentes, e por isso é preciso compreender como os catalisadores formados por PANI respondem a cada uma delas. Finalmente, é importante salientar que alguns autores sugerem que os buracos formados na polianilina, seja sob radiaçao visível ou UV, sao capazes de oxidar moléculas do contaminante (R) e também de reagirem com água para produzir •OH (Equaçao 10 e Figura 4).13,19,60,63,67,68
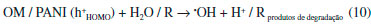
Diante dessas propostas de mecanismos encontradas na literatura, a potencialidade desses materiais compósitos pode ser analisada sob dois aspectos: o primeiro trata efetivamente sobre a fotossensibilizaçao à luz visível, que viabiliza o uso de energia solar. Já um segundo aspecto se refere à melhora na separaçao das cargas geradas (elétron/buraco), à reduçao da taxa de recombinaçao, e à maior disponibilidade de sítios onde há formaçao de espécies oxidantes como •OH, o que ocorre sob luz visível ou ultravioleta.13 Por isso, sao encontrados trabalhos em que somente a radiaçao ultravioleta é aplicada em sistemas com compósitos baseados em polianilina.6,11,12,22,43,60,61,69-71 Em diversos casos, o catalisador sensibilizado com PANI demonstra maior eficiência fotocatalítica, sob luz UV, quando comparado aos catalisadores convencionais de óxidos metálicos isolados.6,11,22,54,56,61,70-74 Esse cenário mostra a abrangência e o potencial da polianilina frente aos sistemas convencionais e já consolidados em fotocatálise que envolvem a luz UV. A forma como o fotossensibilizador (polianilina) interage com o catalisador inorgânico, seja por ligaçao covalente ou interaçao eletrostática, exerce grande influência nas transferências eletrônicas e eficiência fotocatalítica.34 Portanto, o estudo da interface do material compósito é fundamental na compreensao dos efeitos sinérgicos das junçoes n-p e na consolidaçao das propostas de mecanismos descritas até aqui. Diante disso, algumas técnicas de caracterizaçao de materiais, especialmente as espectroscópicas e fotoeletroquímicas, trazem informaçoes importantes sobre as transferências de carga na interface do compósito.43,54,75 As espectroscopias de fotoluminescência (EL) e de impedância eletroquímica (EIE) têm sido aplicadas para evidenciar a separaçao e mobilidade de cargas (elétron/buraco) entre as fases do compósito. Diversos estudos de EL e EIE têm demonstrado que a presença da polianilina é fundamental na separaçao e transferência de cargas, o que se traduz em melhor atividade fotocatalítica para o catalisador compósito em relaçao ao catalisador isolado.6,14,15,43,52,54,55,61,75-78 A determinaçao da fotocorrente gerada pelo catalisador e a conversao de fóton incidente em corrente (IPCE) também estao relacionadas diretamente com a maior eficiência fotocatalítica de catalisadores compósitos.9,52,54,66,76,78,79 Deng et al.78 mostraram que catalisador PANI.TiO2-microesfera foi capaz de gerar cerca de 0,11 μA cm-2 em fotocorrente e remoçao de corantes acima de 95% sob luz visível, enquanto que, apenas TiO2-microesfera em torno de 0,03 μA cm-2 e 60 a 70% de remoçao de corantes. No estudo feito por Li et al.52 com PANI.TiO2-nanotubos na remoçao de rodamina b sob luz visível, dentre todos os materiais sintetizados, aquele com maior geraçao de fotocorrente (6 μA cm-2) promoveu maior remoçao do corante, cerca de 90%. Além disso, nesse estudo, o uso de apenas nanotubos de TiO2 apresentou um desempenho inferior aos demais catalisadores testados, com fotocorrente 1,4 μA cm-2 e cerca de 35% de remoçao de corante. A relaçao entre a conversao de fóton incidente em corrente (IPCE) e a eficiência na remoçao de contaminantes sob luz visível foi estudada por Zhang e Zhu.76 Esses autores mostraram que o catalisador PANI.CdS com maior conversao de fótons em corrente (5,82%) promoveu remoçao superior a 90% de azul de metileno, ao passo que apenas CdS apresentou IPCE em 3,27% e remoçao em torno de 60%.76 Em suma, a presença da polianilina como uma das fases de catalisadores compósitos promove maior separaçao e mais rápida transferência de cargas, bem como maior fotocorrente, IPCE e eficiência em fotocatálise frente aos catalisadores semicondutores aplicados isoladamente. Adicionalmente, conhecer as espécies ativas nas reaçoes de oxidaçao das moléculas do contaminante auxilia no entendimento das diferentes vias mecanísticas propostas. Portanto, alguns autores procederam a fotocatálise na presença de substâncias sequestrantes de buracos (h+) e radicais (•OH e O2•-) e, assim, foi possível avaliar qual o impacto na remoçao do contaminante em funçao da espécie ativa suprimida no processo de catálise. Conforme ocorre diminuiçao da eficiência catalítica, na presença de um determinado sequestrante, é possível identificar qual espécie ativa (radicais ou buracos) possui maior contribuiçao na oxidaçao das moléculas.6,43,54,55,76,78-81 Substâncias como EDTA-2Na (sal disódico do ácido etilenodiaminotetraacético), trietanolamina e oxalato de amônio sao comumente empregadas para sequestrar buracos, álcool terc-butílico (tBuOH) para radicais, e isopropanol e p-benzoquinona para radicais •OH e O2•-, respectivamente. Associado ao estudo de espécies ativas por sequestrantes, a aplicaçao de técnicas como ressonância paramagnética eletrônica vem a agregar e aprimorar a compreensao do mecanismo através da identificaçao de radicais.6,14,82 É importante pontuar que as espécies ativas sao dependentes de cada sistema (catalisador e condiçoes de catálise), nao sendo possível indicar, pelos trabalhos avaliados, uma concordância geral sobre quais sao as espécies ativas preferenciais em sistemas com catalisadores baseados em polianilina. Apesar da associaçao mais estudada em fotossensibilizaçao com PANI se refira aos óxidos metálicos, tais como TiO2 e ZnO, os mecanismos apresentados também representam o que ocorre em compósitos de polianilina com outros óxidos, sulfetos e materiais carbonáceos como o grafeno (GR) e óxido de grafeno (OG).56,68,73,76,83-86 Além disso, há catalisadores formados por mais de duas fases, resultando em associaçoes como PANI/Fe3O4/SiO2/TiO2, PANI/Fe3O4/ZnO e PANI/Ag3PO4/OG. Em geral, as estratégias em adicionar outros materiais envolvem: (i) separaçao do catalisador do meio por sedimentaçao, imobilizaçao em substratos, ou por campo magnético; (ii) melhor separaçao e transporte de cargas, como, por exemplo, através do uso materiais com alta afinidade por elétrons como OG e GR e (iii) aumento das interaçoes entre contaminante e catalisador. 55,61,68,70,84,87-90 Em linhas gerais, o mecanismo de fotossensibilizaçao ocorre a partir da absorçao de fótons por uma das fases do compósito (polianilina), e pela distribuiçao dos níveis de energia entre as fases, de modo que haja transferência de cargas, geraçao do par elétron/buraco e, consequentemente, espécies reativas para fotocatálise de contaminantes. Catalisadores compósitos formados por polianilina O avanço e a divulgaçao de pesquisas envolvendo fotocatálise e polianilina na última década permitiram traçar um panorama geral sobre os diversos aspectos que estao sendo abordados dentro deste tema. A Tabela 1 sumariza os principais trabalhos em fotocatálise heterogênea que tiveram como objetivo estudar a influência da polianilina sobre TiO2. Os aspectos levantados foram: morfologia do compósito, condiçoes operacionais de fotocatálise e eficiência de remoçao do contaminante em estudo. Os valores de eficiência envolvendo apenas TiO2 nao foram incluídos, tendo em vista que o desempenho dos catalisadores compósitos se mostrou superior.
Principais parâmetros em fotocatálise com catalisadores baseados em polianilina O propósito deste tópico foi sistematizar as principais contribuiçoes dos artigos apresentados na Tabela 1, abordando os aspectos específicos ao sistema de fotocatálise heterogênea que opera com catalisadores formados por polianilina. Apesar do enfoque em PANI.TiO2, existe ainda grande variedade de catalisadores formados por PANI e outros óxidos metálicos, metais, sais e materiais carbonáceos. Destaca-se que materiais como ZnO, SiO2, MnO2, Cu2O, CoFe2O4, CdS, Ag3PO4, Ag, Fe2O3, grafeno e óxido de grafeno têm sido associados à polianilina em sistemas binários à quaternários com diferentes morfologias e condiçoes fotocatalíticas.27,56,63,68,73,76,83-86,103,104 Alguns desses catalisadores foram contemplados nos itens a seguir, de modo a exemplificar fatores coincidentes para os mais diversos catalisadores formados por polianilina. Morfologia e quantidade de polianilina Em catalisadores compósitos com morfologia core-shell (casca-caroço) em que nanopartículas sao encapadas por uma camada de polímero, a influência da espessura desta camada exerce papel fundamental no desempenho fotocatalítico (Figura 5A). A morfologia core-shell também pode ser encontrada em catalisadores em que microesferas sao encapadas com polianilina.55,64,78,99,105,106 Os estudos que abordaram essa morfologia demonstraram, por microscopia eletrônica de transmissao (MET) de alta resoluçao, que espessuras menores que 1 nm de polímero resultam em melhores resultados em fotocatálise.6,43,54,76,107 Radoicic et al.13 e Zhang et al.6 obtiveram maior eficiência catalítica através de PANI.TiO2 com camada de aproximadamente 0,7 nm, e assumiram que se tratava de uma monocamada de polianilina, considerando que a estrutura benzênica apresenta 0,5 nm de diâmetro. Semelhantemente, Pei et al.43 obtiveram cerca de 82% de remoçao de COT na fotodegradaçao de 4-clorofenol no uso de PANI.ZnO com monocamada de polímero (espessura de 0,56 nm). Zhang e Zhu76 atingiram reduçao de 90% de COT na fotocatálise de AM quando utilizado PANI.CdS com monocamada de polímero (0,67 nm) sobre CdS. Razak, Nawi e Haitham15 mostraram que a espessura de 0,9 nm de PANI sobre óxido de titânio foi a mais favorável para a fotocatálise; valores de espessura maiores que este resultaram em decréscimo da eficiência catalítica, devido à baixa transmissao da luz em direçao ao TiO2.
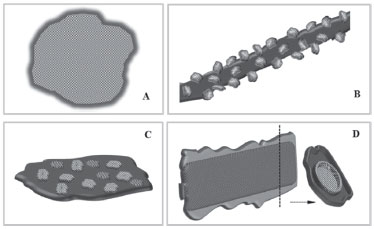 Figura 5. Diferentes morfologias de obtençao de catalisadores compósitos, onde a cor lisa representa a PANI e a textura o semicondutor. (A) Core-shell (casca-caroço), onde nanopartículas estao encapadas pela PANI, (B) nanotubos ou nanofibras de PANI decorados com nanopartículas, (C) matriz polimérica de PANI contendo nanopartículas, e (D) nanotubos, nanobastoes ou fibras de óxidos encapados com polianilina; detalhe da seçao transversal
O planejamento da morfologia do catalisador foi pensado por Gu et al.,12 de maneira que TiO2 estivesse livre para interagir mais facilmente com a luz e o contaminante, sem que houvesse a passivaçao da superfície do óxido ou dificuldade para a transmissao da luz no sistema. Portanto, a polianilina foi obtida inicialmente como nanofibras, e num segundo passo a síntese de nanoparticulas de TiO2 foi realizada decorando as mesmas (Figura 5B). Arranjos semelhantes a esse, utilizando nanotubos de PANI, foram elaborados por Jeong et al.,21 Yang et al.69 e Cheng et al.96 A polianilina ainda pode ser obtida como massa contínua, servindo de matriz polimérica para suportar nanopartículas (Figura 5C).56,75,79,108,109 Outras morfologias encontradas consistem em nanotubos, nanobastoes ou fibras de óxidos encapados com nanopartículas de polianilina89 ou ainda como filme fino de PANI (Figura 5D).52,74,77,110-112 Adicionalmente, alguns trabalhos estudaram o efeito da presença de óxido de grafeno (OG) e grafeno (GR), obtendo catalisadores com nanotubos68 ou nanofibras84 de PANI distribuídas sobre folhas de GR e OG, respectivamente. A quantidade em massa de polímero é um parâmetro que também exerce influência no desempenho fotocatalítico dos catalisadores. Por isso, tem sido comumente abordada na literatura a relaçao mássica ótima de polianilina, de modo a beneficiar as interaçoes entre as fases do compósito e contaminante. De modo geral, grande parte dos estudos indica valores abaixo de 3% m/m de PANI no compósito.7,15,18,22,54,57,89 Li e colaboradores57 prepararam catalisadores TiO2-PANI imobilizados em nanotubos de haloisita (aluminosilicato) e demonstraram que a massa de polianilina no compósito com maior eficiência fotocatalítica foi de 2,63%. Quando catalisadores apresentaram massa de polímero inferior à otimizada, esses autores sugeriram que nao houve formaçao de par elétron/buraco por unidade de tempo suficiente para promover remoçao satisfatória do contaminante. Já em catalisadores com percentual de massa de PANI mais elevadas, os sítios superficiais do TiO2 estavam mais ocupados e os elétrons excitados nao foram eficientemente transferidos para a BC do óxido. Assim, a recombinaçao elétron/buraco foi favorecida e a atividade fotocatalítica reduziu. Medidas de condutividade mostraram que conforme aumentou a massa de polianilina nos catalisadores, houve aumento de condutividade, porém este aumento nao se traduziu em melhor atividade fotocatalítica, o que evidencia o efeito predominante do percentual da massa de PANI frente à condutividade do catalisador compósito.57 Liu et al.89 acrescentam que em catalisadores com massa de PANI superior a 2,3% houve decréscimo da remoçao de corante, decorrente da baixa transmissao de luz através do sistema, inviabilizando as transferências de cargas no compósito. Associado ao estudo morfológico dos compósitos, a caracterizaçao por espectroscopia fotoeletrônica de raios X (EFX) e infravermelho (IV) traz informaçoes importantes sobre a interaçao interfacial entre o polímero e as demais fases. Interaçoes do tipo ligaçao de hidrogênio e ligaçoes covalentes como C-Ti-O ou O−C=N−Ti contribuem para a transferência de carga entre as fases do compósito (PANI.TiO2) e, consequentemente, aumento da atividade fotocatalítica.6,12,14,31,61,72 Adicionalmente, essas interaçoes garantem maior estabilidade térmica e física do catalisador.13,18,61 Em certos trabalhos, a avaliaçao conjunta dos dados de IV e EFX mostraram que interaçoes do tipo ligaçoes de hidrogênio entre grupos amina e imina da polianilina e a superfície do TiO2 (contribuiçao de grupos OH) estavam presentes em compósitos PANI.TiO2.12,61,72 Ligaçoes covalentes entre a polianilina e TiO2 foram obtidas através de rotas sintéticas específicas, como a proposta por Li et al.,61 na qual o precursor de nanopartículas de TiO2 (peróxido de titânio) também continha o potencial oxidante necessário para polimerizar a anilina. Desta forma, as cadeias de polianilina foram ancoradas no óxido através de ligaçoes covalentes do tipo Ti-O-N-C e Ti-O-C. pH e Condutividade da polianilina A propriedade de conduçao elétrica da polianilina sobre a atividade fotocatalítica tem se apresentado essencial nos resultados finais de remoçao de contaminantes. Em catalisadores compósitos, o papel da polianilina está ligado à sua condutividade e às heterojunçoes tipo n-p, e nao somente à sensibilizaçao similar ao de corantes.13,14,29,36,52 Como exemplo disto, o catalisador PANI-TiO2-HA, submetido ao ácido nítrico, foi dopado para sal esmeraldina (forma condutora da PANI), e promoveu aumento da remoçao de rodamina b de 44,46% (desdopado) para 74,47% (dopado). O mesmo processo fotocatalítico para o catalisador controle sem o polímero (TiO2-HA) resultou na remoçao de ~ 53% de corante, valor superior a todos compósitos com PANI desdopada.57 Portanto, o desempenho do compósito em fotocatálise está diretamente relacionado com uso da polianilina dopada (sal esmeraldina). A capacidade de conduçao do polímero é importante na transferência de elétrons para a BC do óxido, reduzindo a taxa de recombinaçao e-/h+, e no aumento da atividade fotocatalítica.57 Conclusoes semelhantes foram obtidas por Li e colaboradores,61 quando a maior remoçao de AM foi atingida com o catalisador PANI.TiO2 com maior condutividade. A dopagem da polianilina está relacionada à protonaçao de seus sítios básicos, que ocorre principalmente pela adiçao de ácidos inorgânicos (Figura 2). Por isso, o pH do meio possui forte influência sobre o estado de protonaçao (dopagem) e, consequentemente, na condutividade da PANI. Liao et al.47 e Malinauskas113 destacaram que, em soluçao, a condutividade da polianilina reduz drasticamente quando o pH está acima de 3. Diante disso, o pH utilizado durante o processo de fotocatálise é de alta relevância na compreensao das interaçoes entre as fases do compósito e no mecanismo geral de fotossensibilizaçao com polianilina. Lin e Wu77 associaram o nível de dopagem da polianilina em catalisadores PANI.ZnO-nanotubos e a eficiência fotocatalítica em diferentes valores de pH. Esses pesquisadores demonstraram por espectroscopia de impedância eletroquímica que o nível de dopagem da polianilina diminui conforme o aumento do pH, especialmente para valores acima de 7. A capacidade de remoçao de rodamina b foi mais pronunciada quando a fotocatálise procedeu em pH 2,5, situaçao na qual o polímero apresentou maior nível de dopagem. Ahmad e Mondal,98 na aplicaçao de PANI.TiO2 como catalisador, encontraram pH ótimo em 3 com 87,6% de remoçao de AM, enquanto que em pH 12 houve apenas 29%. Apesar desses resultados, o entendimento das relaçoes entre pH, condutividade e interaçoes entre fases nao foi explorado. Situaçao similar foi apresentada por Ghavami et al.87 em estudos envolvendo o catalisador OG/PANI/TiO2/γFe2O3, que mostrou maior eficiência de remoçao de rodamina b em pH 3 (94%) do que em pH 9 (65%). Num estudo cinético de fotodegradaçao de corantes, Salem, Al-Ghonemiy e Zaki60 demonstraram que a constante de velocidade (k) reduziu consideravelmente quando o meio reacional esteve com pH ajustado em 8. Os pesquisadores atribuíram a esse resultado a diminuiçao da capacidade do polímero em adsorver os corantes, em funçao da mudança de carga superficial (desprotonaçao) que ocorre quando o sal esmeraldina é convertido à base esmeraldina em valores de pH elevados. Rasoulifard et al.65 também relacionaram o efeito do pH à mudança de carga superficial do catalisador Quitosana/PANI/CdS. A degradaçao fotocatalítica do corante RB19 foi mais pronunciada em valores de pH abaixo do ponto de carga zero do catalisador (pHPcz 7,2), situaçao na qual foi favorecida a adsorçao do corante (carga negativa) à superfície positiva do Quitosana/PANI/CdS. Em contrapartida, alguns trabalhos mostraram uma tendência diferente, situaçoes nas quais valores de pH mais elevados foram mais adequados. O estudo realizado por Sabbaghi, Mohammadi e Ebadi71 avaliou a remoçao de benzeno por PANI.TiO2 em pH 3, 5, 7, 9 e 11 sob luz solar. Nesse caso, a viabilidade do sistema operar em pH 7 foi comprovada quando a remoçao de benzeno foi cerca de 5% superior à encontrada em pH 3. Nabid et al.,59 na remoçao de alaranjado de metila por PANI.TiO2.ZnO.Fe3O4, encontraram condiçoes mais favoráveis em pH acima de 7 devido à adsorçao ser desfavorecida pela repulsao entre as cargas iguais que o catalisador e corante apresentam em pH ácido. Conforme apresentado na Tabela 1, apenas 24% dos trabalhos publicados informam as condiçoes de pH nos ensaios de fotocatálise e poucos desses trabalhos descrevem a otimizaçao desse parâmetro. A compreensao desse parâmetro ainda se revela um campo fértil para estudos futuros. Contaminantes No que se refere ao contaminante modelo submetido à fotocatálise, a principal abordagem tem sido a capacidade de ser adsorvido pela polianilina na superfície do catalisador. Os estudos que procederam a fotocatálise com corantes sugerem que o caráter aniônico ou catiônico destes substratos e a carga do polímero quando dopado ou desdopado (sal ou base esmeraldina, Figura 2) influenciam na adsorçao e no desempenho de fotodegradaçao de corantes.13,60,65,70,89 Neste âmbito, conforme já abordado no item anterior, o estudo do efeito pH na fotocatálise torna-se relevante na compreensao da adsorçao de diversos contaminantes em catalisadores baseados em polianilina. A capacidade de absorçao de radiaçao visível pelo contaminante é outro importante aspecto a ser considerado em pesquisas com catalisadores fotossensibilizados. A exemplo disso, existem corantes como o alaranjado de metila, azul de metileno e rodamina b, que sao amplamente utilizados em ensaios de fotocatálise. No entanto, quando a molécula do corante é irradiada pela luz visível, o elétron em HOMO é promovido para LUMO e, entao, a molécula pode transferir elétrons para a banda de conduçao (BC) do óxido, resultando em espécies reativas que degradam o próprio corante. Esse mecanismo é conhecido por fotossensibilizaçao por corantes,9,10,34,35 e é semelhante às transferências de carga que ocorrem na fotossensibilizaçao por polímeros condutores (Figura 3A). Por essa razao, na avaliaçao de desempenho de catalisadores compósitos sensibilizados, o uso de contaminantes que em fase aquosa sejam incolores é recomendado para a melhor compreensao de mecanismo de fotossensibilizaçao, sem que haja interferência por parte do contaminante.9 Wang et al.19 observaram que a eficiência na remoçao de azul de metileno (AM) sob luz visível ocorreu pela fotossensibilizaçao do TiO2 pelo corante, enquanto que nos ensaios com o compósito PANI.TiO2 houve contribuiçao de ambos, corante e polianilina, na sensibilizaçao do óxido. A influência do corante também foi abordada por Gülce et al.56 num sistema de fotocatálise com PANI e PANI.CdO sob luz solar. Os pesquisadores sugeriram que as moléculas do corante AM excitadas pela luz solar promoveram a fotossensibilizaçao da PANI e PANI.CdO, o que resultou na remoçao de COT em 52% e 71%, respectivamente. As equaçoes 11 a 16 foram propostas para o efeito do corante, em que SCM refere-se ao catalisador PANI ou PANI.CdO, hν(solar) energia luminosa, e-BC e h+BV elétron e buraco, e coranteads molécula de corante adsorvido na superfície do catalisador.56

De acordo com essas reaçoes, a degradaçao do AM é potencializada pela transferência de elétrons para a BC do compósito, gerando espécies radicalares que degradam o próprio corante. Somado a essa via de remoçao do AM, em paralelo devem ocorrer reaçoes com e- e h+ gerados no catalisador devido à radiaçao incidente (Figura 4).56 Conclusoes similares a essas foram relatadas por Eskizeybek et al.114 e Yang e Luan115 na remoçao de corantes num sistema sob luz solar utilizando PANI.ZnO, e luz visível utilizando PANI.Bi2SnTiO7, respectivamente. Apesar da interferência do corante no mecanismo de fotossensibilizaçao, as interaçoes das moléculas do corante com o catalisador nao sao tao favorecidas quanto aquelas obtidas num material compósito de polianilina e TiO2, por exemplo. Pelaez et al.9 e Pei e Luan34 frisam que o mecanismo é dependente da transferência eletrônica interfacial, e por isso é influenciado pela natureza do semicondutor, corante e a interaçao entre eles. Assim, o sinergismo e a estabilidade de um compósito (catalisador e PC) sao mais acentuados que aquele entre catalisador e corante.11,12,34,36 Conforme levantamento apresentado na Tabela 1, os corantes ainda sao os contaminantes modelo mais utilizados, sendo que 81% dos artigos contemplaram corantes na avaliaçao de catalisadores PANI.TiO2. Em virtude do que se apresentou sobre fotossensibilizaçao por corantes, ainda há uma vasta área de estudo em catalisadores compósitos fotossensibilizados frente a contaminantes incolores em soluçao aquosa. Além disso, é necessário ampliar cada vez mais pesquisas em fotocatálise quanto à remoçao de contaminantes emergentes (por exemplo fármacos), compreendendo os processos de degradaçao de uma variedade maior de moléculas do que apenas àquelas tradicionalmente estudadas, como sao os corantes. Aeraçao A importância do gás oxigênio dissolvido (O2) relaciona-se principalmente com a supressao da recombinaçao do par elétron/buraco a partir da acepçao de elétrons na banda de conduçao do semicondutor (Equaçoes 2 e 8). Além disso, contribui para o aumento de espécies reativas, como o radical hidroxila, previne reaçoes de reduçao, e promove a mineralizaçao e o aumento da taxa fotodegradaçao de compostos intermediários.10,116 A Figura 3A mostra que, na principal via mecanística de fotossensibilizaçao de nanocompósitos baseados em polianilina, oxigênio dissolvido apresenta funçao marcante na geraçao de espécies reativas. Neste âmbito, o parâmetro aeraçao mostra-se relevante em estudos de fotossensibilizaçao. Contudo, nos trabalhos levantados para PANI.TiO2 (Tabela 1), apenas uma pequena porçao contemplou a aeraçao ou estudou seus efeitos. Este parâmetro foi avaliado por Lin et al.14 para PANI.TiO2, em estudo que demonstrou que a aeraçao constante durante todo o período de irradiaçao promoveu o aumento da velocidade de remoçao do corante alaranjado de metila, decorrente da geraçao de uma variedade espécies reativas. Nesse trabalho também foi estudada a ausência de oxigênio dissolvido, através da purga da soluçao com N2. Como resultado, foi observada uma reaçao de reduçao e a formaçao de hidrazina. Adicionalmente, Pei et al.43 também mostraram a formaçao de derivados de hidrazina num sistema com purga de N2, o que mostrou o efeito indispensável do oxigênio dissolvido na completa remoçao de alaranjado de metila por PANI.ZnO. Zhang, Zong e Zhu54 e Zhang et al.6 demonstraram, num estudo com sequestrantes, que catalisadores PANI.ZnO e PANI.TiO2, respectivamente, sob luz visível, promoveram a fotocatálise de AM através de radicais (•OH e O2•-). Tal resultado reforça a principal via mecanística de fotossensibilizaçao apresentada na Figura 3A. Além desses trabalhos, ainda há outros que mostram essa tendência.79,80 Portanto, é prioritário que esse parâmetro operacional seja cada vez mais explorado em pesquisas com catalisadores sensibilizados por polianilina. Fonte luminosa O advento do uso de polímeros condutores em fotocatálise, como a polianilina, está motivado pela crescente necessidade de fontes renováveis de energia em tratamento de efluentes. Propriedades como alta absortividade de luz visível e condutividade elétrica conferem à polianilina potencial para atuar como fotossensibilizador sob luz solar em sistemas de fotocatálise heterogênea.7,11-15,68 Portanto, a escolha da fonte luminosa nas pesquisas em fotocatálise é crucial para a real avaliaçao do desempenho de catalisadores sob luz solar. Lâmpadas de xenônio e halógena sao as que melhor representam a luz solar, pois possuem emissao em grande parte na regiao do visível (vis) e infravermelho próximo e menor parcela na regiao do ultravioleta (UV).9,117 Em conformidade com esse contexto, a Tabela 1 mostra que 51% dos trabalhos publicados especificaram o uso de luz solar (natural ou simulada), lâmpada de xenônio ou halógena. Adicionalmente, com intuito avaliar o efeito apenas da luz visível, grande parte das pesquisas utilizaram filtros específicos para remover toda emissao de UV que as lâmpadas poderiam emitir. Lin et al.14 procederam a fotocatálise de alaranjado de metila sob lâmpada de xenônio com dois tipos de filtros, um permitindo a passagem de 420 nm < λ < 800 nm e outro 550 nm < λ < 800 nm, com o intuito de avaliar o efeito da fraçao visível no desempenho de compósitos PANI.TiO2 frente ao óxido isolado. Os pesquisadores mostraram que com o espectro menor de emissao de luz, a remoçao do corante pelo compósito passou de 96% para 85%, já o efeito sob o TiO2 foi maior (reduçao de 65% para 14%), ficando claro o potencial da polianilina em fotossensibilizar o óxido de titânio. Razak, Nawi e Haitham15 utilizaram lâmpada fluorescente e catalisador TiO2/PANI imobilizado em vidro na remoçao fotocatalítica do corante vermelho reativo 4 e realizaram ensaios com e sem filtro para UV. Os resultados mostraram que, quando há presença de todo espectro de emissao da lâmpada (UV e vis), a descoloraçao foi cerca de 99% em 60 minutos. Já no ensaio realizado com filtro (apenas luz visível), o valor obtido foi aproximadamente 78% no mesmo tempo de irradiaçao. Apesar desse resultado nao ter sido abordado pelos autores, tem-se a evidência do efeito predominante da fraçao visível na eficiência fotocatalítica, o que reflete a capacidade de fotossensibilizaçao da PANI. A faixa de comprimento de onda emitida pela fonte luminosa é determinante sobre as vias mecanísticas em que o processo de fotocatálise ocorre, conforme já abordado nas equaçoes 1 a 10 e ilustrado nas Figuras 3 e 4. Entretanto, ainda é importante ressaltar que a performance do sistema fotocatalítico também é funçao da potência (W) da fonte luminosa artificial e da forma como esta está posicionada em relaçao a soluçao de contaminantes. Já em sistemas sob radiaçao solar, a performance é funçao das condiçoes climáticas e do horário do dia em que a fotocatálise é aplicada.5,10,116,118 Diante disso, para auxiliar a compreensao quanto ao comprimento de onda da fonte, alguns pesquisadores se dedicaram em avaliar, paralelamente, o desempenho de seus catalisadores sob lâmpadas com emissao no visível e também sob aquelas que emitem majoritariamente no UV.6,11,12,54,73,79 Xiong et al.,79 por exemplo, mostraram que a remoçao de alaranjado de metila por CoFe2O4.PANI sob luz UV, proveniente de uma lâmpada de vapor de mercúrio (500 W), ocorreu em menor tempo e com maior percentual de remoçao em relaçao ao ensaio com apenas luz visível a partir de uma lâmpada de xenônio (500 W) e filtro. Nesse estudo, as diferenças foram marcantes: sob luz UV em 120 minutos houve aproximadamente 100% de remoçao do corante, enquanto que, sob luz visível, cerca de 84% foram removidos em 9 horas de ensaio. Zhang et al.,6 com catalisador PANI.TiO2, observaram que a constante de velocidade (k) e a remoçao de azul de metileno sob luz UV (11 W, λ = 254 nm) foram 0,0091 min-1 e cerca de 99% em 75 minutos, ao passo que, sob luz visível (500 W xenônio e filtro), encontraram 0,0071 min-1 e cerca de 80% em 300 minutos. Em outro estudo, optou-se por fixar o tempo de fotocatálise com PANI.TiO2 em 120 minutos e entao avaliar o desempenho na remoçao de alaranjado de metila sob uma lâmpada halógena de 50 W associada a um filtro e lâmpada UV de 30 W. Decorrido o mesmo tempo de ensaio, houve remoçao de 49,9% (k = 0,0037 min-1) e 92,9% (k = 0,0235 min-1) do corante sob luz visível e UV, respectivamente.11 Conforme já citado anteriormente, nesse caso, a luz UV também promove transferências de carga no óxido metálico semicondutor (Figura 4), gerando maior densidade de corrente e espécies reativas, o que se traduz em melhores condiçoes cinéticas e remoçao de contaminante.13,43,60,61,66 Portanto, sob luz UV, a contribuiçao do óxido metálico é significativa no desempenho fotocatalítico. Essa observaçao foi demonstrada por Zhang, Zong e Zhu,54 quando obtiveram aproximadamente 8 vezes mais fotocorrente pelo catalisador PANI.ZnO (suportado em ITO - indium tin oxide) sob luz UV em relaçao àquela obtida sob luz visível. Os resultados desses autores mostraram que a remoçao de AM foi mais pronunciada sob luz UV, correlacionando a maior geraçao de fotocorrente ao melhor desempenho fotocatalítico. Capacidade de reuso Por se tratar de uma nova linha de catalisadores compósitos, há necessidade de se investigar o desempenho destes materiais ao longo de repetidos ciclos de fotocatálise. Avaliar essa capacidade de reuso é fundamental na identificaçao da estabilidade e longevidade desses catalisadores. É importante salientar que, além da resposta em remoçao de contaminantes, a estabilidade e longevidade dos catalisadores estao relacionadas à estrutura química e física do catalisador após o reuso. Por isso, para uma avaliaçao apropriada da capacidade de reuso, há necessidade de associar a caracterizaçao do material ao seu desempenho em fotocatálise após alguns ciclos de reuso. Li et al.67 demonstraram reduçao gradual da atividade catalítica (cerca de 12%) ao longo de 4 ciclos de reuso do catalisador PANI.TiO2 imobilizado em nanotubos de haloisita, porém, enfatizam boa sedimentabilidade e que nao houve limpeza do material entre os ciclos. O reuso do catalisador TiO2.SiO2 nanofibras/membrana e PANI, elaborado por Liu et al.,89 apresentou decréscimo da atividade fotocatalítica (87% para 70%). Contudo, os autores pontuam que o material ainda possui bom desempenho, principalmente devido ao reuso ter sido continuado sem tratamento prévio, e ainda acrescenta imagens de microscopia eletrônica de varredura (MEV) comprovando a estabilidade do material. Alto desempenho no reuso, após 10 ciclos, foi obtido por Razak, Nawi e Haitham,15 a partir de catalisadores TiO2/PANI/ENR/PVC imobilizados em lâminas de vidro tendo policloreto de vinila (PVC) e borracha natural epoxidada (ENR) como adesivos. Wang et al.62 obtiveram o catalisador PANI.Bi2WO6 imobilizado em malha de aço, o qual após 5 ciclos manteve seu desempenho fotocatalítico inalterado. A capacidade de reúso para sistemas fotocatalíticos com catalisador disperso também tem sido reportada na literatura.7,12,14,43,59,73,78 A exemplo disto, Leng et al.,73 Gu et al.,12 Lin et al.,14 Li et al.7 e Deng et al.78 demonstraram decréscimo inferior a 10% em fotocatálise após 5 ciclos de reuso. Deng et al.78 ainda salienta que nao houve limpeza do catalisador entre os ciclos, ressaltando ainda mais a capacidade de reuso deste material. Adicionalmente, Zhang et al.55 e Kim, Jung e Lee110 mostraram reduçao inferior a 10% na remoçao de corantes, após 7 e 3 ciclos, respectivamente. Em contrapartida, existem outros trabalhos com reduçao de eficiência mais pronunciada ao longo dos ciclos de reuso, chegando a valores entre 20 a 30%.59,114 Leng et al.,73 através de espectroscopia infravermelho (IV) e microscopia eletrônica de transmissao (MET), mostraram estabilidade do material após reuso, porém, houve reduçao da área superficial (BET) em decorrência da adsorçao de produtos de reaçao como NH4+ e NO3-. Através da caracterizaçao por IV dos catalisadores após vários ciclos de reuso, Gu et al.,12 Li et al.,7 Nabid et al.59 e Eskizeybek et al.114 também mostraram a estabilidade e capacidade de reuso de seus materiais. De modo geral, após alguns ciclos de reuso a eficiência catalítica tende a reduzir. No entanto, a capacidade de reuso é relativa e dependente do sistema fotocatalítico utilizado (catalisador e condiçoes experimentais), podendo revelar, em muitos casos, o potencial dos catalisadores baseados em polianilina de serem estáveis e eficientes quando reutilizados.
CONCLUSOES E PROSPECÇAO PARA PESQUISAS FUTURAS A performance da polianilina em catalisadores compósitos tem sido marcante na fotossensibilizaçao frente à luz visível. Para catalisadores tradicionalmente inativos nessa faixa do espectro solar, uma nova estratégia surge pela associaçao com polímeros condutores, em especial a polianilina. O papel da PANI transcende a absorçao de fótons e contribui na separaçao e transporte de cargas, e minimizaçao da recombinaçao elétron/buraco. A grande variedade de associaçoes com a polianilina sejam óxidos ou outros materiais, bem como as diferentes morfologias e características, e as mais diversas condiçoes operacionais, evidenciam a versatilidade e o potencial deste polímero em contribuir para o melhor desempenho em sistemas fotocatalíticos. No entanto, ainda há um vasto campo de estudo a ser explorado, principalmente no que se refere: (i) à remoçao de contaminantes emergentes, (ii) ao planejamento fatorial de condiçoes operacionais, (iii) à fotocatálise em escala piloto e sistemas com catalisador imobilizado, e (iv) à compreensao da relaçao entre estrutura e propriedade fotocatalítica. Catalisadores apenas orgânicos, formados por PANI e GO ou GR, possuem perspectivas futuras interessantes por favorecem a mobilidade de cargas e reduzirem a recombinaçao elétron/buraco. Catalisadores baseados em polianilina têm apresentado resultados promissores na fotocatálise de contaminantes, o que representa seu potencial em tratamento de efluentes sob luz solar, bem como a sua consolidaçao como uma nova classe de fotossensibilizadores.
REFERENCIAS 1. Alfano, O. M.; Bahnemann, D.; Cassano, A. E.; Dillert, R.; Goslich, R.; Catal. Today 2000, 58, 199. 2. Fujishima, A.; Zhang, X.; Tryk, D. A.; Int. J. Hydrogen Energy 2007, 32, 2664. 3. Homem, V.; Santos, L.; J. Environ. Manage. 2011, 92, 2304. 4. Srikanth, B.; Goutham, R.; Narayan, R. B.; Ramprasath, A.; Gopinath, K. P.; Sankaranarayanan, A. R.; J. Environ. Manage. 2017, 200, 60. 5. Parra, S.; Malato, S.; Pulgarin, C.; Appl. Catal., B 2002, 36, 131. 6. Zhang, H.; Zong, R.; Zhao, J.; Zhu, Y.; Environ. Sci. Technol. 2008, 42, 3803. 7. Li, X.; Wang, D.; Cheng, G.; Luo, Q.; An, J.; Wang, Y.; Appl. Catal., B 2008, 81, 267. 8. Mourao, H. A. J. L.; De Mendonça, V. R.; Malagutti, A. R.; Ribeiro, C.; Quim. Nova 2009, 32, 2181. 9. Pelaez, M.; Nolan, N. T.; Pillai, S. C.; Seery, M. K.; Falaras, P.; Kontos, A. G.; Dunlop, P. S. M.; Hamilton, J. W. J.; Byrne, J. A.; O'Shea, K.; Entezari, M. H.; Dionysiou, D. D.; Appl. Catal., B 2012, 125, 331. 10. Malato, S.; Fernández-Ibáñez, P.; Maldonado, M. I.; Blanco, J.; Gernjak, W.; Catal. Today 2009, 147, 1. 11. Olad, A.; Behboudi, S.; Entezami, A. A.; Bull. Mater. Sci. 2012, 35, 801. 12. Gu, L.; Wang, J.; Qi, R.; Wang, X.; Xu, P.; Han, X.; J. Mol. Catal. A: Chem. 2012, 357, 19. 13. Radoičić, M.; Šaponjić, Z.; Janković, I. A.; Ćirić-Marjanović, G.; Ahrenkiel, S. P.; Čomor, M. I.; Appl. Catal., B 2013, 136-137, 133. 14. Lin, Y.; Li, D.; Hu, J.; Xiao, G.; Wang, J.; Li, W.; Fu, X.; J. Phys. Chem. C 2012, 116, 5764. 15. Razak, S.; Nawi, M. A.; Haitham, K.; Appl. Surf. Sci. 2014, 319, 90. 16. Gou, Y.; Chen, D.; Su, Z.; Appl. Catal., A 2004, 261, 15. 17. Senadeera, G. K. R.; Kitamura, T.; Wada, Y.; Yanagida, S.; J. Photochem. Photobiol., A 2004, 164, 61. 18. Li, J.; Zhu, L.; Wu, Y.; Harima, Y.; Zhang, A.; Tang, H.; Polymer 2006, 47, 7361. 19. Wang, F.; Min, S.; Han, Y.; Feng, L.; Superlattices Microstruct. 2010, 48, 170. 20. Prastomo, N.; Ayad, M.; Kawamura, G.; Matsuda, A.; J. Ceram. Soc. Jpn. 2011, 119, 342. 21. Jeong, W.-H.; Amna, T.; Ha, Y.-M.; Hassan, M. S.; Kim, H.-C.; Khil, M.-S.; Chem. Eng. J. 2014, 246, 204. 22. Li, X.; Wang, D.; Luo, Q.; An, J.; Wang, Y.; Cheng, G.; J. Chem. Technol. Biotechnol. 2008, 83, 1558. 23. Salvatierra, R. V.; Oliveira, M. M.; Zarbin, A. J. G.; Chem. Mater. 2010, 22, 5222. 24. Tian, Z.; Yu, H.; Wang, L.; Saleem, M.; Ren, F.; Ren, P.; Chen, Y.; Sun, R.; Sun, Y.; Huang, L.; RSC Adv. 2014, 4, 28195. 25. Su'ait, M. S.; Rahman, M. Y. A.; Ahmad, A.; Sol. Energy 2015, 115, 452. 26. Abdulalmohsin, S.; Li, Z.; Mohammed, M.; Wu, K.; Cui, J.; Synth. Met. 2012, 162, 931. 27. Nsib, M. F.; Saafi, S.; Rayes, A.; Moussa, N.; Houas, A.; J. Energy Inst. 2015, 1. 28. Zhang, S.; Chen, Q.; Jing, D.; Wang, Y.; Guo, L.; Int. J. Hydrogen Energy 2012, 37, 791. 29. Riaz, U.; Ashraf, S. M.; Kashyap, J.; Mater. Res. Bull. 2015, 71, 75. 30. Pathania, D.; Sharma, G.; Kumar, A.; Kothiyal, N. C.; J. Alloys Compd. 2014, 588, 668. 31. Reddy, K. R.; Hassan, M.; Gomes, V. G.; Appl. Catal., A 2015, 489, 1. 32. Liu, X. J.; Guo, Z. P.; Jin, C. Q.; Synth. Met. 1991, 41-43, 1139. 33. Peralta-Zamora, P.; Moraes, S. G. de; Reyes, J.; Durán, N.; Polym. Bull. 1996, 37, 531. 34. Pei, D.; Luan, J.; Int. J. Photoenergy 2012, 2012, 1. 35. Tahir, M.; Amin, N. S.; Energy Convers. Manage. 2013, 76, 194. 36. Ansari, M. O.; Khan, M. M.; Ansari, S. A.; Cho, M. H.; J. Saudi Chem. Soc. 2015, 19, 494. 37. Lee, K.; Cho, S.; Park, S. H.; Heeger, a J.; Lee, C.-W.; Lee, S.-H.; Nature 2006, 441, 65. 38. Bredas, J. L.; Street, G. B.; Acc. Chem. Res. 1985, 18, 309. 39. MacDiarmid, A. G.; Epstein, A. J.; Synth. Met. 1995, 69, 85. 40. Xia, Y.; Wiesinger, J. M.; MacDiarmid, A. G.; Epstein, A. J.; Chem. Mater. 1995, 7, 443. 41. Chinn, D.; Dubow, J.; Li, J.; Janata, J.; Josowicz, M.; Chem. Mater. 1995, 7, 1510. 42. Huang, W.-S.; Humphrey, B. D.; MacDiarmid, A. G.; J. Chem. Soc., Faraday Trans. 1 1986, 82, 2385. 43. Pei, Z.; Ding, L.; Lu, M.; Fan, Z.; Weng, S.; Hu, J.; Liu, P.; J. Phys. Chem. C 2014, 118, 9570. 44. Stejskal, J.; Dybal, J.; Trchová, M.; Synth. Met. 2014, 197, 168.. 45. Schnitzler, D. C.; Zarbin, A. J. G.; J. Braz. Chem. Soc. 2004, 15, 378. 46. Huang, W. S.; MacDiarmid, A. G.; Polymer 1993, 34, 1833. 47. Liao, Y.; Zhang, C.; Zhang, Y.; Strong, V.; Tang, J.; Li, X.; Kalantar-zadeh, K.; Hoek, E. M. V; Wang, K. L.; Kaner, R. B.; Nano Lett. 2011, 11, 954. 48. King, R. C. Y.; Roussel, F.; Brun, J. F.; Gors, C.; Synth. Met. 2012, 162, 1348. 49. Ansari, M. O.; Khan, M. M.; Ansari, S. A.; Lee, J.; Cho, M. H.; RSC Adv. 2014, 4, 23713. 50. Bu, Y.; Chen, Z.; ACS Appl. Mater. Interfaces 2014, 6, 17589. 51. Kohlman, R. S.; Tanner, D. B.; Ihas, G. G.; Synth. Met. 1997, 84, 709. 52. Li, H.; Zhou, J.; Lu, X.; Wang, J.; Qu, S.; Weng, J.; Feng, B.; J. Mater. Sci. Mater. Electron. 2015, 26, 7723. 53. Moliton, A.; Hiorns, R. C.; Polym. Int. 2004, 53, 1397. 54. Zhang, H.; Zong, R.; Zhu, Y.; J. Phys. Chem. C 2009, 113, 4605. 55. Zhang, X.; Wu, J.; Meng, G.; Guo, X.; Liu, C.; Liu, Z.; Appl. Surf. Sci. 2016, 366, 486. 56. Gülce, H.; Eskizeybek, V.; Haspulat, B.; Sari, F.; Gülce, A.; Avci, A.; Ind. Eng. Chem. Res. 2013, 52, 10924. 57. Li, C.; Wang, J.; Guo, H.; Ding, S.; J. Colloid Interface Sci. 2015, 458, 1. 58. Wang, Q.; Hui, J.; Li, J.; Cai, Y.; Yin, S.; Wang, F.; Su, B.; Appl. Surf. Sci. 2013, 283, 577. 59. Nabid, M. R.; Sedghi, R.; Gholami, S.; Oskooie, H. A.; Heravi, M. M.; Photochem. Photobiol. 2013, 89, 24. 60. Salem, M. A.; Al-Ghonemiy, A. F.; Zaki, A. B.; Appl. Catal., B 2009, 91, 59. 61. Li, Y.; Yu, Y.; Wu, L.; Zhi, J.; Appl. Surf. Sci. 2013, 273, 135. 62. Wang, W.; Xu, J.; Zhang, L.; Sun, S.; Catal. Today 2014, 224, 147. 63. Sharma, S.; Singh, S.; Khare, N.; Colloid Polym. Sci. 2016, 294, 917. 64. Mohamed, R. M.; Aazam, E. S.; Appl. Catal., A 2014, 480, 100. 65. Rasoulifard, M. H.; Seyed Dorraji, M. S.; Amani-Ghadim, A. R.; Keshavarz-Babaeinezhad, N.; Appl. Catal., A 2016, 514, 60. 66. Ansari, M. O.; Khan, M. M.; Ansari, S. A.; Cho, M. H.; New J. Chem. 2015, 39, 8381. 67. Li, C.; Wang, J.; Guo, H.; Ding, S.; J. Colloid Interface Sci. 2015, 458, 1. 68. Neelgund, G. M.; Bliznyuk, V. N.; Oki, A.; Appl. Catal., B 2016, 187, 357. 69. Yang, C.; Liang, A.; Zongshan, Z.; Guanghui, W.; J. Wuhan Univ. Technol. Mater. Sci. Ed. 2014, 29, 468. 70. Mahanta, D.; Manna, U.; Madras, G.; Patil, S.; Appl. Mater. Interfaces 2011, 3, 84. 71. Sabbaghi, S.; Mohammadi, M.; Ebadi, H.; J. Environ. Eng. 2016, 142, 1. 72. Wei, J.; Zhang, Q.; Liu, Y.; Xiong, R.; Pan, C.; Shi, J.; J. Nanopart. Res. 2011, 13, 3157. 73. Leng, C.; Wei, J.; Liu, Z.; Xiong, R.; Pa, n, C.; Shi, J.; J. Nanopart. Res. 2013, 15:1643, 1. 74. Li, Q.; Zhang, C.; Li, J.; Appl. Surf. Sci. 2010, 257, 944. 75. Ansari, M. O.; Khan, M. M.; Ansari, S. A.; Raju, K.; Lee, J.; Cho, M. H.; Appl. Mater. Interfaces 2014, 6, 8124. 76. Zhang, H.; Zhu, Y.; J. Phys. Chem. C 2010, 114, 5822. 77. Lin, L.; Wu, Q.; Polym. Polym. Compos. 2012, 20, 367. 78. Deng, Y.; Tang, L.; Zeng, G.; Dong, H.; Yan, M.; Wang, J.; Hu, W.; Wang, J.; Zhou, Y.; Tang, J.; Appl. Surf. Sci. 2016, 387, 882. 79. Xiong, P.; Chen, Q.; He, M.; Sun, X.; Wang, X.; J. Mater. Chem. 2012, 22, 17485. 80. Li, W.; Tian, Y.; Zhao, C.; Zhang, Q.; Geng, W.; Chem. Eng. J. 2016, 303, 282. 81. Chen, X.; Li, H.; Wu, H.; Wu, Y.; Shang, Y.; Pan, J.; Xiong, X.; Mater. Lett. 2016, 172, 52. 82. Ziolli, R. L.; Jardim, W. F.; Quim. Nova 1998, 21, 319. 83. Ameen, S.; Seo, H. K.; Shaheer Akhtar, M.; Shin, H. S.; Chem. Eng. J. 2012, 210, 220. 84. Zhang, J.; Bi, H.; He, G.; Zhou, Y.; Chen, H.; J. Environ. Chem. Eng. 2014, 2, 952. 85. Miao, J.; Xie, A.; Li, S.; Huang, F.; Cao, J.; Shen, Y.; Appl. Surf. Sci. 2016, 360, 594. 86. Gemeay, A. H.; El-Sharkawy, R. G.; Mansour, I. A.; Zaki, A. B.; Appl. Catal., B 2008, 80, 106. 87. Ghavami, M.; Kassaee, M. Z.; Mohammadi, R.; Koohi, M.; Haerizadeh, B. N.; P; Solid State Sci. 2014, 38, 143. 88. Huang, X.; Wang, G.; Yang, M.; Guo, W.; Gao, H.; Mater. Lett. 2011, 65, 2887. 89. Liu, Z.; Miao, Y.-E.; Liu, M.; Ding, Q.; Tjiu, W. W.; Cui, X.; Liu, T.; J. Colloid Interface Sci. 2014, 424, 49. 90. Su, H.; Wang, T.; Zhang, S.; Song, J.; Mao, C.; Niu, H.; Jin, B.; Wu, J.; Tian, Y.; Solid State Sci. 2012, 14, 677. 91. özbay, B.; Genç, N.; özbay, İ.; Bağhaki, B.; Zor, S.; Clean Technol. Environ. Policy 2016, 18, 2591. 92. Li, C.; Zhou, T.; Zhu, T.; Li, X; RSC Adv. 2015, 5, 98482. 93. Yang, S.-B. ; Jo, W.-K., Cho, S.-B.; Yu, M.-S.; Asian J. Chem. 2015, 27, 4179. 94. Subramanian, E.; Subbulakshmi, S.; Murugan, C.; Mater. Res. Bull. 2014, 51, 128. 95. Ramli, C. A. Z.; Asim, N.; Isahak, W. N. R. W.; Emdadi, Z.; Ahmad-ludin, N.; Yarmo, M. A.; Sopian, K.; Sci. World J. 2014, 2014, 1. 96. Cheng, Y.; An, L.; Gao, F.; Wang, G.; Li, X.; Chen, X.; Res. Chem. Intermed. 2013, 39, 3969. 97. Jo, W.-K.; Kang, H.; Mater. Chem. Phys. 2013, 143, 247. 98. Ahmad, R.; Mondal, P. K.; J. Dispersion Sci. Technol. 2012, 33, 380. 99. Liao, G.; Chen, S.; Quan, X.; Zhang, Y.; Zhao, H.; Appl. Catal., B 2011, 102, 126. 100. Wang, Y.; Xu, J.; Zong, W.; Zhu, Y.; J. Solid State Chem. 2011, 184, 1433. 101. Sarmah, S.; Kumar, A.; Indian J. Phys 2011, 85, 713. 102. Min, S.; Wang, F.; Han, Y.; J. Mater. Sci. 2007, 42, 9966. 103. Wang, X.; Chen, G.; Zhang, J.; Catal. Commun. 2013, 31, 57. 104. Kannusamy, P.; Sivalingam, T.; Colloids Surf., B 2013, 108, 229. 105. Huang, X.; Wang, G.; Yang, M.; Guo, W.; Gao, H.; Mater. Lett. 2011, 65, 2887. 106. Ma, H.; Li, C.; Yin, J.; Pu, X.; Zhang, D.; Su, C.; Wang, X.; Shao, X.; Mater. Lett. 2016, 168, 107. Wu, W.; Liang, S.; Shen, L.; Ding, Z.; Zheng, H.; Su, W.; Wu, L.; J. Alloys Compd. 2012, 520, 108. Kant, S.; Kalia, S.; Kumar, A.; J. Alloys Compd. 2013, 578, 249. 109. Sharma, G.; Naushad, M.; Kumar, A.; Devi, S.; Khan, M. R.; Iran. Polym. J. 2015, 24, 1003. 110. Kim, K. N.; Jung, H.-R.; Lee, W.-J.; J. Photochem. Photobiol., A 2016, 321, 257. 111. Li, X.; Teng, W.; Zhao, Q.; Wang, L.; J. Nanopart. Res. 2011, 13, 6813. 112. Xu, H.; Zhang, J.; Chen, Y.; Lu, H.; Zhuang, J.; Li, J.; Mater. Lett. 2014, 117, 21. 113. Malinauskas, A.; J. Power Sources 2004, 126, 214. 114. Eskizeybek, V.; Sari, F.; Gülce, H.; Gülce, A.; Avci, A.; Appl. Catal., B. 2012, 119-120, 197. 115. Yang, Y.; Luan, J.; Molecules 2012, 17, 2752. 116. Ahmed, S.; Rasul, M. G.; Brown, R.; Hashib, M. A.; J. Environ. Manage. 2011, 92, 311. 117. Baguckis, A.; Novickovas, A.; Mekys, A.; Tamošiunas, V.; J. Photonics Energy 2016, 6, 35501. 118. Malato, S.; Maldonado, M. I.; Fernández-Ibáñez, P.; Oller, I.; Polo, I.; Sánchez-Moreno, R.; Mater. Sci. Semicond. Process. 2016, 42, 15. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access