Educação
|
|
| A metodologia de resolução de problemas: uma experiência para o estudo das ligações químicas The problem solving methodology: an experience for the study of chemical bonds |
|
Franciane S. C. de Lima; Leliz T. Arenas; Camila G. Passos*
Departamento de Química Inorgânica, Instituto de Química, Universidade Federal do Rio Grande do Sul, 91501-970 Porto Alegre - RS, Brasil Recebido em 07/08/2017 *e-mail: camila.passos@ufrgs.br This article presents an experience of the use of the Problem Solving (PR) methodology with undergraduate students of the Licentiate Course in Chemistry of UFRGS, for the study of Ionic Bonding (LI). Salar de Uyuni salts were used to contextualize the problems employed. The Field Log records of the researchers and the presentations of the undergraduates show that the implemented didactic sequence favored conceptual learning, such as the relation between chemical bond theories and some properties of the materials, procedural learning, such as public argument, as reading and handling of different bibliographical reference sources and attitude learning, such as interpersonal relations among students and teachers during the different problem solving stages. Additionally, the results brought to evidence that, from the Problem Solving experience with the Ionic Bond contents, the future teachers were able to perceive work alternatives for their future classrooms. INTRODUÇAO O presente artigo apresenta uma experiência da utilizaçao da metodologia de Resoluçao de Problemas (RP) com licenciandos do curso de Licenciatura em Química da UFRGS, para o estudo de ligaçoes químicas, especificamente, Ligaçoes Iônicas (LI). Esse conteúdo foi escolhido, pois há um pequeno número de relatos na literatura sobre o ensino de ligaçoes químicas a partir de perspectivas investigativas. Além disso, esse tema é importante para o entendimento de outros conteúdos de química e de propriedades da matéria como condutividade elétrica, solubilidade e pontos de fusao e ebuliçao.1,2 De acordo com alguns pesquisadores, devido às dificuldades de compreensao dos conceitos científicos, e, também, falta de domínio do uso de metodologias alternativas ao modelo de ensino tradicional, os professores de Ciências podem afastar seus alunos do mundo científico, pois exigem que os estudantes aprendam pela memorizaçao e nao pelo entendimento dos conceitos.3-5 Essas práticas podem estar relacionadas às fragilidades na formaçao inicial, no que se refere à falta de um eixo formativo que possua a funçao de integrar conhecimentos conceituais da Química às contemporâneas metodologias de ensino.6-8 Herreid9 destaca que dentre os professores, os de Ciências, Química e Física sao os que menos empregam metodologias ativas de aprendizagem. Nesse âmbito,acredita-se que trabalhar a RP com os licenciandos no papel de alunos pode favorecer que estes se utilizem dessa metodologia nas suas futuras salas de aula com maior propriedade, como apresenta-se no decorrer do texto.
FUNDAMENTAÇAO TEORICA Resoluçao de problemas Diversos relatos na literatura apontam que o uso da metodologia de Resoluçao de Problemas (RP) no ensino de Química, tanto nos contextos de sala de aula,10-13 como nos cursos de formaçao de professores,14-16 contribui significativamente para a aprendizagem dos estudantes, por envolver alunos e professores na construçao do conhecimento científico contextualizado, no uso de seus aportes teóricos e ferramentas tecnológicas. A RP caracteriza-se por incitar os estudantes a pensar e a criar, logo, é uma estratégia que permite aos sujeitos desenvolver uma açao ativa durante sua educaçao científica.9 Esta perspectiva de aprendizagem é uma das variantes do método Problem Based Learning (PBL). Esse método de ensino foi implantado na década de 1960 na Faculdade de Medicina da Universidade McMaster, Canadá, para superar lacunas formativas quanto à integraçao de conhecimentos teóricos e práticos e fazer com que os estudantes pudessem ter contato com situaçoes reais de sua futura prática profissional.17 Nesse sentido, mostrou-se tao eficiente que foi disseminado para outras universidades e cursos de diferentes áreas do conhecimento. A PBL pode ser utilizada como estratégia didática de uma disciplina, um conjunto de disciplinas ou para fundamentar o currículo de um curso.9,17 No ensino de Ciências, passou a ser utilizada na década de 1990.18 Atualmente encontram-se trabalhos sobre o uso da PBL relacionados ao aprendizado de determinados conteúdos químicos.9,19 Todavia, a maioria dos artigos descreve a utilizaçao do método para o desenvolvimento de habilidades necessárias aos futuros profissionais da Química,9,20-22 como uso da linguagem,21 consciência cultural num contexto de globalizaçao econômica,22 assim como para a aquisiçao de uma maior consciência ambiental.19 Em contrapartida, o uso da RP está mais direcionado à aprendizagem de conhecimentos científicos através da resoluçao de situaçoes-problema. Nessa perspectiva de aprendizagem, um problema é entendido como uma situaçao que apresenta certo nível de dificuldade e para o qual nao se tem de imediato uma soluçao.10,15 Dessa forma, para resolver um problema, se requer a utilizaçao de determinados procedimentos que envolvem processos intelectuais, motivacionais e operatórios semelhantes aos processos seguidos em uma investigaçao científica.13 Os princípios da estratégia da RP contemplam atividades multifacetadas que integram pequenas investigaçoes práticas ou em campo, com os conteúdos conceituais e os exercícios de lápis e papel.5,13 Os trabalhos do grupo de Daniel Gil-Pérez e outros investigadores da Universidade de Valência sao pioneiros na utilizaçao da RP desde a década de 1980 para o ensino de Ciências,23 na Educaçao Básica,10 na Educaçao Superior15 e na formaçao de professores.16 Em especial para a formaçao de professores, os autores apontam que a RP pode contribuir para a transformaçao dos sistemas de educaçao universitária, pois é uma metodologia interativa, que visa o maior envolvimento e a autonomia dos estudantes no processo de ensino-aprendizagem. Dessa forma, os futuros professores, a partir de açoes formativas que estimulem o caráter social e coletivo da investigaçao científica, poderao desenvolver conhecimentos científicos e profissionais de forma ativa e integrada.15,16 Como consequência, inovaçoes pedagógicas sao esperadas para suas futuras práticas profissionais. Desde entao, pesquisadores buscam compreender quais as dificuldades dos estudantes ao resolverem problemas,13,23,24 quais as modelagens utilizadas pelos alunos para resolverem as situaçoes-problema16,25 e quais as possíveis estratégias para o uso da resoluçao dos problemas.15,26 Na perspectiva de aprendizagem por RP, os alunos sao considerados investigadores novatos e os professores sao os orientadores da investigaçao.4,15 Nas atividades investigativas, a construçao de conhecimento se dá através da resoluçao de problemas que envolve etapas como observaçoes, elaboraçao de questoes e hipóteses, consulta a fontes de informaçao, planejamento e execuçao de planos, coleta, análise e interpretaçao de dados, proposiçao de explicaçoes, compartilhamento de informaçoes.25-27 Essa metodologia requer dos alunos um comportamento ativo e um empenho para obter seus próprios resultados e está baseada na apresentaçao de situaçoes abrangentes e sugestivas. Martinéz Aznar e Varela Nieto15 sugerem alguns passos para a implementaçao da RP:
Acrescido do aporte teórico da Didática das Ciências, verifica-se que os princípios investigativos da RP convergem às orientaçoes das atuais Diretrizes Curriculares Nacionais para a formaçao inicial em nível superior.28 No Art. 5º, há a indicaçao de que a formaçao de professores deve estar fundamentada na concepçao de educaçao como processo emancipatório e permanente, respeitando a especificidade do trabalho docente, para que haja articulaçao entre teoria e prática e que o futuro profissional possa vivenciar dinâmicas pedagógicas que
Ademais, alguns estudos apresentam vantagens no uso da metodologia de RP na formaçao de professores, por possibilitar uma sólida formaçao científica e cultural, pois normalmente os problemas articulam os conhecimentos científicos com temas sociais.29-31 Dessa forma, instiga o futuro docente a desencadear várias habilidades que envolvem o seu processo de formaçao, ao pensar e criar situaçoes investigativas.31 Esse exercício possibilita ao professor em formaçao relacionar o conhecimento de ciências a contextos, para favorecer o desenvolvimento da capacidade de abstraçao e raciocínio dos estudantes, contribuindo, assim, na construçao do processo didático-pedagógico e também orienta o processo de estruturaçao de metodologias mais coerentes para as atuais necessidades educativas.30-32 Nesse sentido, propicia uma maior autonomia ao futuro docente para a elaboraçao dos planejamentos de aulas, tornando-se, dessa maneira, apropriada para a abordagem dos conteúdos científicos nos cursos de formaçao de professores. Abreu e colaboradores30 inferem que a atividade de RP motiva os futuros docentes a ensinar Ciências Naturais, pois oportuniza o contato com situaçoes de aprendizagem próximas à prática científica. Além disso, a discussao coletiva proporciona ao futuro docente rever seus conhecimentos prévios, suas crenças e concepçoes a respeito de como ensinar e aprender e, também, sobre os conhecimentos científicos. Possibilitando, assim, construir açoes formativas ajustadas às suas necessidades de sala de aula. No entanto, os autores relatam que alguns sujeitos da pesquisa tiveram resistências para registrar o que tinham feito e aprendido durante as atividades, principalmente as elaboraçoes escritas que deveriam ser feitas fora das horas de formaçao.30 Na investigaçao sobre o conceito de energia através da RP, na formaçao inicial de professores,15 é relatado que os licenciandos estao mais acostumados a obter a resoluçao para um problema proposto que verbalizar suas estratégias dessa resoluçao, principalmente quando se necessita de variáveis científicas. Essa tendência é justificada pela falta de familiarizaçao com o exercício de explicar e explanar, indicando que é possivelmente uma questao inerente ao quadro teórico no qual os estudantes de licenciatura estao inseridos. Além disso, os licenciandos que trabalham com o modelo de resoluçao de problemas propostos evoluíram para visoes mais complexas do conteúdo abordado.15 Goi e Santos31 apontam que açoes formativas que possibilitam a autoria do professor na proposiçao de problemas e o aprofundamento teórico sobre as questoes epistemológicas, pedagógicas e psicológicas da RP auxiliam no protagonismo do professor para o uso da metodologia nas aulas de Ciências. Em vista disso, o objetivo principal desta experiência é identificar as formas de contribuiçao do uso da estratégia de RP para o desenvolvimento profissional de licenciandos em Química, no que tange aos aspectos teóricos e práticos da metodologia associada ao conteúdo de Ligaçoes Iônicas. Ligaçoes químicas O estudo das estruturas dos compostos depende basicamente da capacidade de relacionar suas propriedades químicas com as respectivas estruturas eletrônicas, por isso o entendimento sobre ligaçoes químicas torna-se necessário.33 As ligaçoes químicas entre átomos formam-se através do arranjo estrutural de seus elétrons no nível de valência.34 Num sólido iônico, por exemplo, a ligaçao pode ser descrita como o arranjo resultante de íons positivos e negativos mantidos pela atraçao eletrostática entre eles. Esse tipo de interaçao geralmente é chamada de ligaçao iônica.34 Os mesmos princípios utilizados no entendimento das moléculas também sao usados no estudo desse tipo de sólidos. Portanto, compreender as alteraçoes de energia presentes na formaçao dos íons e como eles interagem torna-se interessante para o estudo das propriedades dos sólidos iônicos, como solubilidade, pontos de fusao e condutividade elétrica.35 Nesse sentido, para estudar a ligaçao nos sólidos iônicos, utilizam-se teorias para facilitar a transiçao da química macroscópica para a química microscópica, como a Teoria Eletrostática36 e a Teoria de Bandas,37 principalmente em nível de formaçao superior. No contexto da RP, optou-se por discutir sobre ligaçoes químicas, mais especificamente sobre LI, visto o pequeno número de publicaçoes sobre o tema relacionado às metodologias de ensino investigativas. Ademais, o conteúdo é de grande importância para a compreensao de outros conceitos químicos. Fernandez e Marcondes33 mostram que os alunos possuem grandes dificuldades conceituais sobre ligaçoes químicas, como: a) confusao entre ligaçao iônica e covalente; b) antropomorfismos; c) regra do octeto; d) geometria das moléculas e polaridade; e) energia nas ligaçoes químicas e f) representaçao das ligaçoes. Alguns autores argumentam que a dificuldade em aprender conceitos de ligaçoes químicas está associada à sequência como as teorias sao apresentadas, normalmente na ordem: ligaçao iônica, ligaçao covalente, polaridade e geometria.38,39 Além disso, estudos apontam que a estrutura curricular e os livros didáticos de diferentes países apresentam uma visao molecular da estrutura microscópica dos compostos iônicos. Esta configuraçao favorece que alunos descrevam que existem fórmulas moleculares para sais como o cloreto de sódio e o cloreto de potássio.1,2 Muitos equívocos como estes estao relacionados à sequência didática utilizada para ilustrar que na ligaçao iônica um único átomo de metal reage com um único átomo nao metálico que forma uma unidade de fórmula, por exemplo, NaCl ou algum composto similar. Uma unidade de fórmula desenhada no quadro ou apresentada em um livro, sem uma explicaçao adequada, é idêntica para compostos moleculares tais como cloreto de hidrogênio. Neste contexto, os estudantes acabam nao entendendo a ligaçao iônica como nao direcional e as interaçoes envolvidas na constituiçao dos retículos cristalinos dos sólidos iônicos e, por vezes, memorizam a compreensao de compostos iônicos como constituídos por moléculas.1,2 Além das simplificaçoes e generalizaçoes que sao apresentadas para o estudo das teorias envolvidas, outro aspecto a ser considerado é o nível de abstraçao necessário para a compreensao destas teorias.2 Assim, os estudantes nao conseguem interrelacionar os modelos utilizados para representar cada tipo de ligaçao com situaçoes da vida real, como o estudo das propriades fisico-químicas dos materiais.2,38,39 As afirmaçoes feitas acima sobre as lacunas formativas dos alunos da educaçao básica sao aplicáveis aos contextos de formaçao de professores nos cursos de licenciatura.1,38,39 Neste âmbito, considera-se que a vivência de uma açao formativa que aborde a contextualizaçao dos princípios teóricos sobre ligaçoes químicas, através da investigaçao sobre algumas propriedades fisico-químicas da matéria, como a experiência que é apresentada neste artigo, possa contribuir para a compreensao mais aprofundada dos conhecimentos químicos e dos pedagógicos referentes à metodologia de RP.
A SEQUENCIA DIDATICA Neste trabalho, apresenta-se uma experiência de utilizaçao da metodologia de RP na formaçao inicial de professores como forma de abordagem dos conceitos de LI. O estudo foi desenvolvido com cinco licenciados matriculados no Estágio de Docência em Ensino de Química I-C do curso de Licenciatura em Química Noturno da UFRGS, no segundo semestre de 2014. Os dados foram coletados através de registros no Diário de Campo40 das professoras formadoras e com as produçoes escritas produzidas pelos licenciandos. A sequência didática implementada foi adaptada de estudos anteriores15,25 e envolveu sete momentos distribuídos na seguinte ordem:
Esses sete momentos foram desenvovidos em três semanas de quatro períodos cada, conforme se ilustra com a Tabela 1. Todas as atividades foram realizadas nas aulas presenciais realizadas no Laboratório de Informática.
A fim de propor uma abordagem sobre ligaçoes em compostos iônicos, utilizaram-se como contextualizaçao41 os sais presentes no Salar de Uyuni para a elaboraçao das situaçoes-problema.O Salar de Uyuni é o maior deserto de sal do mundo e está situado ao sul da Bolívia, a mais de 3.000 metros acima do nível do mar.42 Esse salar possui uma crosta de sal de aproximadamente 10 metros de espessura e em seus interstícios se encontra uma salmoura. Os componentes majoritários da salmoura sao: ións de sódio, magnésio, potássio, lítio, boro, cálcio, cloretos e sulfatos. A crosta de sal é formada principalmente por camadas de halita (cloreto de sódio - NaCl) porosa (88-99%), pequenas quantidades de gesso (sulfato de cálcio hidratado - CaSO4.2H2O) em grao fino e ulexita (borato de sódio e cálcio hidratado - NaCaBO9.8H2O).43 O composto de maior interesse econômico do Salar de Uyuni é o lítio, que é extraido por um processo que forma carbonato de lítio. Também desse salar sao obtidos outros produtos como o cloreto de sódio, de magnésio e o de lítio.42,43 Considera-se que, devido aos aspectos geográficos, históricos e dos processos fisico-químicos envolvidos na origem do salar, acrescido dos aspectos econômicos e ambientais associados aos processos de extraçao e utilizaçao dos diferentes sais que o constituem, o Salar de Uyuni é um apropriado contexto41 para o estudo das ligaçoes químicas, principalmente as LI. De acordo com Pozo e Crespo,44 os problemas propostos nesta experiência didática sao classificados como escolares, os quais têm por objetivo desenvolver conceitos, procedimentos e atitudes cabíveis à ciência que possibilitam a compreensao dos acontecimentos cotidianos; semiabertos, pois os enunciados apresentam parcialmente os subsídios necessários para a sua resoluçao; qualitativo, uma vez que os estudantes podem utilizar conceitos científicos e teorias, sem a necessidade de cálculos ou raciocínio matemático; e teórico-prático, porque aceita estratégias experimentais e raciocínios teóricos para resolvê-los. Destaca-se que os problemas semiabertos qualitativos possibilitam que os próprios estudantes incorporem ideias e estratégias com as quais seja possível definir e resolver a tarefa. Os três problemas elaborados foram validados por pesquisadores da área de Ensino de Química, quanto à adequaçao conceitual, contextual e estrutural dos problemas. O Problema 1 "O deserto de Uyuni é o maior Salar do mundo, contendo mais de 64 bilhoes de toneladas de cloreto de sódio, 150 milhoes de toneladas de cloreto de potássio, 100 milhoes de cloreto de magnésio e ainda guarda uma imensa reserva de Lítio com cerca de 100 milhoes de toneladas. Atualmente a regiao do Salar vivencia a exploraçao de lítio, visto que esse metal atualmente é utilizado para diferentes finalidades. Pesquise qual o processo utilizado para a extraçao de Lítio no deserto de Uyuni. Cite duas aplicaçoes do Lítio na atualidade e explique se essas aplicaçoes causam impactos ambientais positivos ou negativos" visa ao estudo teórico sobre as aplicaçoes do Lítio e questoes ambientais, dessa forma, está relacionado a um dos contextos apresentados no Vídeo utilizado para a motivaçao inicial sobre o processo de extraçao do metal. Os Problemas 2 e 3 possuem por finalidade um aprofundamento no conteúdo de ligaçoes iônicas. O Problema 2 "A Oceanografia Química é a ciência que estuda a composiçao e a concentraçao dos compostos presentes nos oceanos. A composiçao da água do mar é basicamente constante e possui mais de 70 elementos dissolvidos. Embora a água do mar seja constituída de 3,5% de sais dissolvidos, somente dois terços sao cloreto de sódio. Como o Salar de Uyuni foi originado da evaporaçao de águas do Oceano Pacífico, pesquise quais sao os principais íons que compoem a água do mar. Represente com modelos físicos (palitos, bolas, desenhos, representaçoes teatrais) como seria a imagem submicroscópica dos íons quando estao solvatados na água. Explique duas propriedades da água do mar que estao relacionadas à presença destes íons" apresenta alguns dados sobre a composiçao da água do mar e, através dessa informaçao, solicita aprofundamento quanto à representaçao submicroscópica da solvataçao dos íons em água e favorecendo a discussao sobre a composiçao dos retículos cristalinos e das propriedades dos compostos iônicos. Esse problema está relacionado ao histórico apresentado aos licenciandos sobre o Salar, visto que esse, provavelmente, tenha se originado durante o processo de formaçao das Cordilheiras dos Andes, aprisionando parte das águas do Oceano Pacífico e formando lagos salgados que, com o passar do tempo, evaporaram formando o Salar.42,43 No caso do Problema 3, "Os períodos de chuvas, entre dezembro e março, contribuem para a expansao das margens do Salar de Uyuni. Sabe-se que isso acontece por conta do processo constante de evaporaçao da água. Explique, utilizando teorias de ligaçoes químicas, a grande diferença de Ponto de Fusao da água e dos sais que constituem o Salar. Simule experimentos práticos para ilustrar essa diferença" optou-se por utilizar um evento natural do Salar para abordar sobre o processo de evaporaçao da água e, assim, questionar sobre o ponto de fusao dos sais presentes, complementando a discussao iniciada no Problema 2 sobre as propriedades dos compostos iônicos. Nesse problema, foi solicitado que os futuros professores utilizassem atividades experimentais, a fim de explicar as diferenças encontradas. O intuito da atividade formativa foi instrumentalizar os docentes para o uso da metodologia em suas futuras salas de aula. Entende-se que a vivência da metodologia investigativa no papel de aluno pode favorecer a compreensao dos futuros professores sobre a importância do uso de perspectivas didáticas contemporâneas nas aulas de Química. De acordo com Santos e Goi,31 muitos professores têm carências conceituais e metodológicas para trabalhar em sala de aula a metodologia de RP e é visível o quanto esses educadores utilizam basicamente estratégias do ensino tradicional devido à falta de preparo.
RESULTADOS E DISCUSSAO Aspectos conceituais, procedimentais e atitudinais No momento I, de aproximaçao dos licenciandos ao conteúdo de ligaçoes químicas, foi realizada uma abordagem em nível de revisao de conteúdos, sobre a ligaçao dos sólidos iônicos e suas propriedades (solubilidade, pontos de fusao, ponto de ebuliçao, condutibilidade). Para motivar a discussao, foi apresentado um vídeo sobre o Salar de Uyuni. Durante a apresentaçao do vídeo sobre o Salar, os licenciandos demonstraram muito interesse sobre o local e solicitaram informaçoes sobre seu histórico e principalmente sobre o Hotel de Sal que é apresentado no documentário, onde móveis e estrutura física sao de blocos de sal. Conforme registros no Diário de Campo, um dos licenciandos questionou: "Professora, mas como que os blocos nao se desmancham com a água no período das chuvas, ou quando um hóspede deixa cair um copo de água sobre um móvel? " Esse questionamento foi enriquecedor, pois possibilitou que a professora formadora introduzisse a discussao sobre a relaçao do tipo de ligaçao química e solubilidade das substâncias em água. Com respeito à ligaçao química, foi possível aprofundar os conceitos de ligaçoes em sólidos iônicos, especificamente pelo modelo eletrostático e pela definiçao de energia reticular. O modelo eletrostático define que os sólidos iônicos sao formados por interaçoes eletrostáticas de íons de cargas opostas. A energia reticular representa a energia liberada quando um mol de pares de íons no estado gasoso se aproxima até atingir uma distância de equilíbrio a fim de gerar um sólido iônico.35 A energia reticular pode ser explicada com a equaçao de Born-Landé (Equaçao 1), na qual sao consideradas as forças de atraçao e as forças de repulsao entre os íons de carga oposta.36 A energia reticular é fortemente influenciada pela carga dos íons e a distância entre os íons. 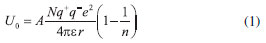 Na Equaçao 1, Uo é a energia reticular, e=1,6x10-19 C (carga do elétron), A é a constante de Madelung (os valores dependem do tipo de sólido iônico), ε é a permissividade de carga no vácuo (8,5x10-12 C2 J-1 m-1), q+ e q- sao as cargas dos íons, n é o expoente de Born (o valor depende da configuraçao eletrônica dos íons) e r é a distancia entre os íons. Também foi possível explicar o mecanismo de dissoluçao dos sólidos iônicos. A solubilidade dos sólidos iônicos em água está relacionada diretamente com a energia reticular e pode ser influenciada pela diferença do tamanho do raio dos íons.35 Geralmente, quando o sólido iônico está formado por cátions e ânions de raios semelhantes, possuem fraca atraçao com as moléculas de água, portanto possuem pouca solubilidade. Entretanto, se os íons sao de raios diferentes, geralmente sao mais solúveis em água.36 Compreende-se que, para o estudante, os blocos eram conformados somente do sal cloreto de sódio (NaCl) que é solúvel em água. Entretanto a composiçao dos blocos, extraídos do Salar, compreende também outros minerais, em menor quantidade, como por exemplo o gesso (CaSO4.2H2O), que é pouco solúvel em água.43 Esse sólido iônico é conformado por íons de tamanhos semelhantes e a pouca solubilidade pode ser devida à considerável energia reticular que nao pode ser compensada pela entalpia de solvataçao.35,37 O mecanismo de formaçao de soluçoes depende das intensidades relativas de forças atrativas entre as partículas do soluto (energia reticular) e forças atrativas entre as partículas do solvente (entalpia de intrusao), além das forças que surgem entre as partículas do soluto e do solvente (entalpia de solvataçao), durante o processo de dissoluçao.35 No caso da dissoluçao de compostos iônicos, a soluçao é formada quando a atraçao eletrostática entre os íons no retículo (energia reticular) é superada pela entalpia de solvataçao.37 Portanto, a capacidade de dissoluçao de um sal é fortemente influenciada pela energia envolvida na dissoluçao do soluto (entalpia de dissoluçao), conforme Equaçao 2.37  Apesar da intensidade da interaçao íon-íon ser maior do que a da interaçao dipolo-dipolo do solvente, e do que a da interaçao soluto-solvente (íon-dipolo), o elevado número de interaçoes íon-dipolo, que atua em cada íon, pode compensar a força de atraçao eletrostática que mantém os íons unidos no retículo.37 Dessa forma, o momento I, além de motivar a atividade investigativa, também favoreceu a introduçao de conceitos importantes para a elaboraçao das hipóteses de resoluçao para os problemas. Entende-se que esse momento de discussao pode ter contribuído para esclarecer as dificuldades conceituais dos licenciandos sobre a relaçao ligaçao química/solubilidade, além de servir como um exemplar de abordagem para os conteúdos de ligaçoes químicas no ensino médio. Isso se deve ao fato de os professores em formaçao relatarem dificuldades acerca de formas de adequaçao do conteúdo abordado e de metodologias apropriadas para explicar Ligaçoes Químicas, pois os conteúdos adquiridos na formaçao acadêmica foram apresentados de forma expositiva e sem vínculo com algum tema ou contexto. Após a discussao sobre o vídeo, no momento II, os licenciandos foram divididos em um trio chamado de grupo A e em uma dupla chamada de grupo B. No momento III, foram apresentados e lidos os três problemas desenvolvidos para a atividade formativa com o intuito de verificar possíveis obstáculos iniciais por parte dos futuros professores e, também, mostrar as sugestoes de referências, a fim de facilitar o desenvolvimento da atividade. Nesse terceiro momento os sujeitos foram informados de que deveriam elaborar hipóteses de resoluçao para os problemas em sequência. Os grupos nao apresentaram dificuldades quanto à compreensao dos enunciados dos problemas e buscaram algumas informaçoes nos materiais indicados pelas professoras formadoras e em outras fontes na Internet para elaboraçao das hipóteses, conforme indicado na Tabela 1. Durante o momento IV do processo formativo, surgiram discussoes entre os licenciandos e a professora formadora, a qual em todos os momentos questionava-os sobre suas hipóteses e afirmaçoes. De acordo com Carvalho e Gil-Pérez,5 os professores assumem o papel de orientadores e mediadores nas atividades de investigaçao dirigida. Nesse sentido, devem argumentar sobre o problema em questao, para que os estudantes possam compreendê-lo, auxiliar no acesso a outras fontes de conhecimento e discutir os dados obtidos interligando-os com as hipóteses levantadas, para verificar se a tarefa está efetivamente sendo realizada pelas modelaçoes de resoluçao propostas. No decorrer do quarto momento, o Grupo A fez alguns questionamentos como "Será que o aluno nao irá sentir-se frustrado pornao achar a resposta logo de cara"? Entende-se que essa pergunta do licenciando refletiu a sua própria sensaçao de frustraçao, visto que o grupo apresentou dificuldades em descrever e relacionar os conhecimentos teóricos sobre LI e as propriedades dos sais. O Grupo B também se mostrou com dificuldades em relacionar conceitos químicos: "os alunos conseguiriam fazer a conexao entre ligaçoesquímicas e ponto de fusao"? Compreende-se que essa indagaçao está diretamente relacionada à dificuldade enfrentada pelo Grupo B em esclarecer a relaçao entre ponto de fusao e ponto de ebuliçao, com o tipo de ligaçao dos materiais. Dúvida que surgiu durante o trabalho de elaboraçao das hipóteses de trabalho. Goi e Santos31 apontam que lacunas conceituais sao normalmente identificadas no momento de elaboraçao ou de resoluçao dos problemas. Frente a esse questionamento, a professora formadora introduziu a relaçao da energia reticular dos sólidos iônicos com os valores de pontos de fusao e ebuliçao. Destacou que quanto maior a energia reticular, maior sao os valores de ponto de fusao.36 Comparado aos sólidos iônicos, a água apresenta um menor ponto de fusao e ebuliçao. A água é uma molécula formada por ligaçoes covalentes entre o oxigênio e o hidrogênio, de geometria angular e de momento de dipolo 1,85 debye, logo, é polar.34 No estado condensado da água, sao as ligaçoes de hidrogênio que interatuam e que sao muito mais fracas que a ligaçao iônica, fazendo com que ela apresente ponto de fusao e ebuliçao mais baixos que os sólidos iônicos.34,35 As dificuldades conceituais identificadas durante a discussao, possivelmente, sao oriundas do processo de memorizaçao que esses sujeitos recorrem durante a sua formaçao acadêmica. Conforme estudos realizados sobre o Curso de Licenciatura em Química da UFRGS, a maioria das disciplinas de conhecimentos específicos possui um perfil mais conceitual, nas quais o método de transmissao dos conhecimentos teóricos e acadêmicos é o mais utilizado.45 Outra questao apontada pelo Grupo B foi sobre o tempo disponibilizado para a resoluçao dos problemas em sala de aula, "Masafinal, daremos conta de vencer o conteúdo, disponibilizando tempoem sala de aula para a elaboraçao das pesquisas"? As professoras formadoras esclareceram que a atividade de RP favorece a elaboraçao de argumentos sobre os conteúdos estruturantes selecionados e contextos trabalhados, auxiliando na apropriaçao dos conhecimentos científicos, conforme verificado em estudos anteriores.5,13,27,29 Durante o momento V, o Grupo B interagiu bastante entre si e engajou-se na utilizaçao da bibliografia indicada pelas professoras formadoras e na busca de outras fontes de informaçoes, assim como na organizaçao das explicaçoes e nas ilustraçoes que utilizaram para preparar sua apresentaçao com as resoluçoes. O Grupo A apresentou-se menos interativo e mais disperso, buscaram recursos na internet como repositórios digitais de práticas de laboratório. Conforme os registros no Diário de Campo, esse grupo foi pouco organizado na elaboraçao da apresentaçao das resoluçoes. Eles utilizaram os Livros didáticos após argumentaçao e sugestao da professora formadora, demonstrando menor autonomia que o Grupo B. Segundo Vasconcellos,46 os conteúdos sao um conjunto de conhecimentos, hábitos e atitudes, organizados pedagógica e didaticamente. Eles sao o meio para a concretizaçao das finalidades que o educador tem ao preparar o seu curso a partir da realidade. Ainda segundo o autor, existem três tipos de conteúdos: conceitual, procedimental e o atitudinal. Os conteúdos conceituais envolvem o conhecimento de fatos, fenômenos, princípios e leis, enquanto que os conteúdos procedimentais abrangem o saber fazer, o domínio das habilidades. Por fim, os atitudinais compreendem o saber ser, o envolvimento, o interesse, a postura e as vontades dos alunos. Nesse sentido, entende-se que a sequência didática desenvolvida contribuiu para o desenvolvimento de aprendizagens conceituais como a relaçao entre as teorias de ligaçoes iônicas e algumas propriedades dos materiais; procedimentais como a argumentaçao em público, a leitura e manipulaçao de diferentes fontes de referências bibliográficas; e atitudinais como a interaçao entre os discentes e docentes durante as diferentes etapas da açao formativa, a autonomia na proposiçao de hipóteses para a resoluçao dos problemas e a capacidade de trabalhar em grupo. Ademais, os problemas elaborados possibilitaram a vivência de atividades que associaram o estudo de teorias, representaçoes submicroscópicas e fenômenos macroscópicos. As resoluçoes dos problemas O momento VI foi direcionado à apresentaçao de todas as informaçoes utilizadas para a resoluçao dos problemas, assim como a modelaçao utilizada para resolvê-los. Na resoluçao do problema 2, as hipóteses do Grupo B foram "Agua do mar contém NaCl e outros sais que conhecemos", "A água do mar conduz eletricidade" e "Na água os íons estao soltos". Na plenária, o grupo apresentou uma tabela composta por íons presentes na água doce e na água salgada, para destacar que alguns íons estao presentes nos dois meios. Também utilizaram a representaçao da estrutura cristalina do cloreto de sódio, e deste sal em sua forma solvatada em água, para explicar a condutividade em água. As ilustraçoes utilizadas pelo grupo representaram de forma apropriada os íons estabilizados na forma solvatada, pois estes estavam coordenados pelas moléculas de água por interaçao intermolecular do tipo íon-dipolo. Os cátions Na+ estavam interagindo com o dipolo negativo (oxigênio das moléculas de água) e os ânions Cl- estavam interagindo com o dipolo positivo (os hidrogênios das moléculas de água). As imagens utilizadas pelo grupo foram extraídas de um dos artigos indicados pelas professoras formadoras como fonte de consulta (http://www.quimica.net/emiliano/artigos/2005ago_qnc_sal.pdf). No momento das apresentaçoes, as professoras formadoras enfatizaram a relevância de esclarecer para os alunos que as fórmulas químicas utilizadas para representar os sólidos iônicos (NaCl para o cloreto de sódio) expressam somente a razao entre os íons em uma cela unitária36 e nao o número de coordenaçao dos íons (número de contra-íons em torno dos íons) no retículo do sólido.1,34 Os modelos representativos dos retículos cristalinos e dos íons solvatados apresentados pelo Grupo B foram utilizados para ilustrar essa etapa da discussao. O Grupo A apresentou as hipóteses de que "Há mais tipos de sais na água do mar em relaçao à água do lago" e de que "A água do mar pode conduzir corrente elétrica assim como a água com NaCl"? Na plenária, o grupo demonstrou as diferenças de propriedades entre os dois tipos de água com um vídeo sobre um experimento de condutividade entre soluçoes de ácido, de base, de sal e de açúcar. Os licenciandos apenas explicaram o mecanismo de dissoluçao dos sais em água, mas nao utilizaram e nem ilustraram representaçoes da interaçao entre íons e água. O vídeo utilizado foi localizado pelo grupo nos momentos de acesso à internet (http://www.pontociencia.org.br/experimentos/visualizar/testador-de-condutividade/203). Conforme relatos na literatura, os professores podem favorcer a maior compreensao dos conteúdos relacionados às ligaçoes químicas ao enfatizarem a relaçao entre o nível macroscópico e submicroscópico, seja com modelos físicos, modelos matemáticos, diagramas de energia, representaçoes simbólicas e fenômenos observacionais como as propriedades fisico-químicas dos materiais.1,2,47 Alguns autores destacam a importância dos estudantes se apropriarem dos aspectos fundamentais das ligaçoes, como as interaçoes eletrostáticas, no caso da ligaçao iônica, para poderem complexificar tais conhecimentos quanto à força das ligaçoes, às estruturas e propriedades dos distintos materiais analisados. 1,2,47 O Grupo B, na resoluçao do Problema 3, tomou por hipóteses que "O ponto de ebuliçao dos sais deve ser muito mais elevado que da água, porque virou um deserto de sal devido à evaporaçao da água" e que "Um experimento pode ser feito com água normal e água com bastante sal e ver o que ocorre". Na plenária, apresentaram os pontos de fusao dos sais que compoem o Salar e da água, assim como vídeos com experimentos que mostram as diferenças entre os pontos de fusao das substâncias em questao; também trouxeram uma tabela com as principais fontes de lítio, suas propriedades, como ocorre a solvataçao e como isso afeta as propriedades químicas e imagens do Salar de Uyuni. Além disso, explicaram uma tabela comparativa entre a composiçao do Salar e a composiçao da água do mar; buscaram na internet os pontos de fusao e ebuliçao dos principais sais presentes no deserto de sal; e teorizaram através dos livros didáticos e de ilustraçoes as diferenças entre as ligaçoes químicas presentes nos sais (ligaçoes iônicas) e na água (ligaçao covalente e ligaçao de hidrogênio). Já o Grupo A nao propôs hipóteses para o Problema 3. Os licenciandos preferiram pesquisar as definiçoes dos tipos de ligaçoes (iônica e covalente) na internet, para explicar de forma genérica a diferença entre o ponto de fusao do cloreto de sódio e da água. O grupo utilizou um vídeo que mostrava um experimento caseiro de evaporaçao da água do mar (https://www.youtube.com/watch?v=osmsWTIpNss). Entende-se que esse grupo, por nao ter pesquisado quais os sais que compoem o Salar, generalizou suas conclusoes para o cloreto de sódio, visto que a prática demonstrada resultava nesse sal sólido após a evaporaçao da água. A professora formadora finalizou essa etapa explicando que outra propriedade dos sólidos iônicos é a desprezível condutividade elétrica, pois geralmente apresentam um gap muito alto. Existe um impedimento do movimento dos elétrons quando a diferença de energia entre a banda de valência e a banda de conduçao, o gap, for maior que 3.0 eV36 e também a banda de valência for preenchida, gerando um material isolante.37 Por exemplo, o NaCl apresenta um gap de 7.0 eV, entretanto, quando dissolvido em solventes aquosos a condutividade é dada por conduçao iônica.37 Conforme registros no Diário de Campo, nos momentos iniciais da açao formativa os estudantes apenas expressaram dificuldades sobre como adequar os conteúdos de ligaçoes químicas para o nível da Educaçao Básica, porém, durante a atividade de resoluçao dos problemas apresentaram algumas dificuldades ao terem que aplicar tais conhecimentos aos fenômenos e contextos que foram discutidos em aula. Os dados revelaram pequena diversificaçao das estratégias teóricas para a resoluçao dos problemas, pois os licenciandos optaram por utilizar majoritariamente as fontes de pesquisa indicadas pelas professoras formadoras. Entretanto, os grupos inovaram com a utilizaçao de vídeos que apresentavam práticas experimentais ao invés de proporem experimentos com vidrarias e reagentes. Entende-se que a realizaçao das atividades no Laboratório de Informática favoreceu essa escolha. A utilizaçao dos vídeos com diferentes testes de condutibilidade elétrica enriqueceu a discussao sobre o mecanismo de dissoluçao dos sólidos iônicos e das propriedades físico-químicas da água do mar. Contribuiçoes da açao formativa No momento VII, as professoras formadoras conduziram o debate sobre as principais modelaçoes de resoluçoes utilizadas, as dificuldades enfrentadas e os conceitos fundamentais abordados. Para tanto, discutiu-se sobre alguns aspectos das apresentaçoes dos dois grupos, mostrando algumas lacunas conceituais identificadas, como a expressao "soltos" utilizada pelo Grupo B, assim como a falta da explicaçao do experimento de condutividade das soluçoes de sal, de base, de ácido e de açúcar utilizado pelo Grupo A. Esse comportamento foi relatado na investigaçao realizada por Martinéz Aznar e Varela Nieto.15 Os referidos autores verificaram que os licenciandos estao mais acostumados a obter a resoluçao para um problema proposto do que verbalizar suas estratégias dessa resoluçao, principalmente quando se necessita de termos científicos. Ademais, destaca-se que os grupos nao utilizaram modelos físicos para representar a imagem submicroscópica dos íons solvatados na água, entretanto, os grupos demonstraram certo domínio conceitual para explicar as interaçoes entre soluto (sais) e solvente (água) no mecanismo de dissoluçao. Outro apontamento da professora formadora foi que os dois grupos utilizaram a condutividade elétrica como propriedade da água do mar para resolver o Problema 2. No momento final da plenária, a participaçao dos estudantes foi efetiva na discussao sobre as possibilidades de resoluçoes sobre os problemas. Dessa forma, foi possível verificar que os licenciandos se apropriaram dos conhecimentos conceituais trabalhados, como a teoria eletrostática e o mecanismo de dissoluçao e, enfim, conseguiram relacioná-los às propriedades dos materiais. Os licenciandos foram questionados se durante a atividade de RP surgiu alguma dúvida sobre os conteúdos de LQ. As colocaçoes em aula, majoritariamente, apontaram que os licenciandos apresentam-se inseguros, principalmente sobre o nível de profundidade da abordagem para a Educaçao Básica, conforme ilustra-se com os registros do Diário de Campo:
Quando questionados sobre as dificuldades e contribuiçoes da experiência de resolver problemas, os licenciandos descreveram que a vivência da metodologia investigativa favoreceu a compreensao sobre a importância de abordagens que possibilitam a relaçao entre as propriedades dos materiais para o estudo dos conteúdos de LQ, pois conseguiram mitigar dúvidas conceituais sobre teorias e modelos representacionais já estudados em disciplinas anteriores. Esse grupo de sujeitos também apontou que vivenciar atividades para serem realizadas em grupo é um diferencial, visto que na maior parte das disciplinas de conhecimentos específicos do curso as açoes formativas sao individuais. Destaca-se que o trabalho em grupo favoreceu a interaçao entre os sujeitos. Além disso, os estudantes afirmaram que a atividade contribuiu para esclarecer como a perspectiva investigativa de ensino e a contextualizaçao podem motivar e instigar os alunos no estudo dos conhecimentos químicos, pois foi assim que eles se sentiram. Essas colocaçoes apontam a relevância de açoes formativas sobre os conteúdos que sao fundamentais para a futura prática profissional docente, associados à experimentaçao de metodologias ativas de ensino com eles no papel de alunos. Sendo assim, destaca-se que essa proposta didática de perspectiva investigativa relaciona as propriedades dos materiais, como solubilidade, condutividade, pontos de fusao e ebuliçao com o tipo de ligaçao química das substâncias, e atende às contemporâneas orientaçoes sobre o ensino de Química.7,29,38 Ademais, considera-se que o desenvolvimento de atividades que associam conhecimentos conceituais da Química aos didáticos das Ciências, como a metodologia de RP, podem favorecer a formaçao de professores mais autônomos e seguros para utilizar diferentes recursos metodológicos em suas futuras açoes profissionais na Educaçao Básica.
CONCLUSOES A análise da experiência formativa desenvolvida evidenciou que a vivência da metodologia de RP no papel de alunos favoreceu a identificaçao de possibilidades de perspectivas de ensino, para os conteúdos de Ligaçoes Iônicas/Químicas, para as futuras atuaçoes profissionais dos licenciandos que participaram desta investigaçao. Salienta-se que experienciar a metodologia de ensino estudada contribui para a apropriaçao dos recursos didáticos necessários para a conduçao das rotinas de sala de aula frente a uma abordagem investigativa de aprendizagem. Conforme as DCN28 e pesquisadores da área de formaçao de professores,6-8,15 a situaçao de formaçao profissional do professor é inversamente simétrica à situaçao de seu exercício profissional, logo, ele deve viver como aluno as organizaçoes e orientaçoes pedagógicas que lhes serao exigidas em futura atuaçao profissional. Além disso, evidenciaram-se contribuiçoes da sequência didática implementada para o desenvolvimento de conteúdos conceituais, procedimentais e atitudinais.46 Como conhecimentos procedimentais infere-se que a açao formativa possibilitou um espaço para a leitura de diferentes fontes de referências bibliográficas, para a argumentaçao em público e para inter-relacionar conhecimentos específicos da Química com os pedagógicos. Como atitudinais verificou-se a expressiva interaçao entre os discentes e docentes durante as diferentes etapas da açao formativa, a autonomia na proposiçao de hipóteses para a resoluçao dos problemas e a capacidade de trabalhar em grupo. Quanto aos aspectos conceituais destaca-se a relaçao entre as teorias de ligaçoes iônicas e algumas propriedades dos materiais, como a solubilidade dos sólidos iônicos em água, que é influenciada pela diferença no tamanho do raio dos íons e está relacionada diretamente com a energia reticular,35 assim como os elevados pontos de fusao e ebuliçao.36 Considera-se que a escolha do tema Salar de Uyuni, para a aproximaçao dos estudantes com o conteúdo, motivou os grupos e mostrou-se rico para a contextualizaçao dos conhecimentos científicos com os ambientais, sociais e tecnológicos apresentados nos problemas que foram propostos. Ademais, os problemas elaborados possibilitaram a vivência de atividades que associaram o estudo de teorias, representaçoes submicroscópicas e fenômenos macroscópicos. Entretanto, percebeu-se que os estudantes que participaram da sequência didática, mesmo cursando etapas finais do curso de licenciatura, possuiam dificuldades conceituais sobre ligaçoes químicas, sobre como adequar os conhecimentos acadêmicos para a Educaçao Básica, sobre como resolver problemas, trabalhar em grupo e tomar decisoes. Dessa forma, a metodologia de ensino apresentada nesse estudo mostrou-se eficaz para o aperfeiçoamento desses conhecimentos e, portanto, para a formaçao profissional desses estudantes.
REFERENCIAS 1. Vladusic, R.; Bucatb, R. B.; Ozic, M.; Chem. Educ. Res. Pract. 2016, 17, 685. 2.Nimmermark, A.; Öhrström, L.; Martenssona J.; Davidowitz, B.; Chem. Educ. Res. Pract. 2016, 17, 985. 3. Vieira, H.; Morais, C.; Paiva, J.; Quim. Nova 2014, 37, 1573. 4. Cortés, A. L. G.; de la Gándara, M. G.; Enseñanza de las Ciencias 2006, 25, 435. 5. Carvalho, A. M. P.; Gil-Pérez, D.; Formaçao de Professores de Ciências: tendências e inovaçoes, Cortez: Sao Paulo, 2006. 6. Maldaner, O. A.; A Formaçao Inicial e Continuada de Professores de Química: Professores/Pesquisadores.Unijuí: Ijuí, 2000. 7. Schnetlzer, R. Apontamentos sobre a história do ensino de química no Brasil; Santos, W. L. P., Maldaner, O. A., orgs.; Unijuí: Ijuí, 2010, cap. 2. 8. Pinheiro, A. N.; Medeiros, E. L.; Oliveira, A. C.; Quim. Nova 2010, 33, 1996. 9. Herreid, C. F.; J. Chem. Educ. 2013, 90, 256. 10. Gil-Pérez, D.; Ensen. Cienc. 1994,12, 154. 11. Silva, S. F.; Núñez, I. B.; Quim. Nova 2002, 25, 1197. 12. Gil-Pérez, D.; Furió, C. M.; Valdés, P.; Salinas, J.; Torregrosa, J. M.; Guisasola, J.; González, E.; Dumascarré, A.; Goffard, M.; Carvalho, A. M. P.; Enseñanza de las Ciencias 1999, 17, 311. 13. Yuriev, E.; Naidu, S.; Schembri, L. S.; Short, J. L.; Chem. Educ. Res. Pract. 2017, 18, 486. 14. Passos, C. G.; Santos, F. M. T.; Anais do XV Encontro Nacional de Ensino de Química, Brasília, Brasil, 2010. 15. Martinéz Aznar, M. M.; Varela Nieto, M. P.; Enseñanza de las Ciencias 2009, 27, 343. 16. Bodner, G. M.; Bhattacharyya, G.; Educ. Quim. 2005, 16, 222. 17. Sá, L. P.; Queiroz, S. L.; Estudo de Casos no ensino de Química, Editora Atomo: Campinas, SP, 2010. 18. Herreid, C. F.; J. Chem. Educ. 1994, 23, 221. 19. Ozdilek, Z.; Chem. Educ. Res. Pract. 2015, 16, 39. 20. Massena, E. P.; Guzzi Filho, N. J. de, Sá, L. P.; Quím. Nova 2013, 36, 1066. 21. Velloso, A. M. S.; Motheo, A. J.; Queiroz, S. L.; Revista Electrónica de Enseñanza de las Ciencias 2009, 8, 593. 22. Overton, T. L.; Bradley, J. S.; Chem. Educ. Res. Pract. 2010, 11, 124. 23. Martínez, F. P.; Martínez Aznar, M. M.; Enseñanza de las Ciencias 2014, 32, 469. 24. Gulacar, O.; Overton, T., Bowman, C. R.; Fynewever, H.; Chem. Educ. Res. Pract. 2013, 14, 507. 25. Goi, M. E. J.; Santos, F. M. T.; Quim. Nova Esc. 2009, 31, 203. 26. Shahat, M. A.; Ohle, A.; Treagust, D.; Fischer, H. E.; Int. J. Sci. Math. Educ. 2013, 11, 1157. 27. Hofstein, A.; Lunetta, V. N.; Sci. Educ. 2004,88, 28. 28. Brasil. Ministério da Educaçao. Conselho Nacional de Educaçao. Diretrizes Curriculares Nacionais para a Formaçao Inicial em Nível Superior (cursos de licenciatura, cursos de formaçao pedagógica para graduados e cursos de segunda licenciatura) e para a formaçao continuada. Resoluçao CNE/CP 02, 2015. 29. Vilches, A.; Gil-Pérez, D.; Tecné, Episteme y Didaxis 2007, 22, 67. 30. Abreu, L.; Bejarano, N.; Hohenfeld, D.; Investigaçoes em Ensino de Ciências 2013,18, 23. 31. Goi, M. E. J.; Santos, F. M. T.; Investigaçoes em Ensino de Ciências 2014, 19, 431. 32. Sevian, H.; Bernholt, S.; Szteinberg, G. A.; Augustea, S.; Pérez, L. C.; Chem. Educ. Res. Pract. 2015, 16, 429. 33. Fernandez, C.; Marcondes, M. E. R.; Quim. Nova Esc. 2006, 24, 20. 34. Atkins, P. W.; Princípios de química: questionando a vida moderna e o meio ambiente, 5. ed., Bookman: Porto Alegre, 2012. 35. Shriver, D. F.; Atkins, P. W.; Inorganic chemistry, 4 th ed., Bookman: Porto Alegre, 2008. 36. Benvenutti, E. V.; Química inorgânica: átomos, moléculas, líquidos e sólidos, 3ª ed., Editora da UFRGS: Porto Alegre, 2011. 37. Huheey, J. E.; Química Inorgánica: Principios de estructura y reactividad, 4ª ed., Oxford University Press: México, 1997. 38. Dhindsa, H. S.; Treagust, D. F.; Chem. Educ. Res. Pract. 2014, 15, 435. 39. Nahum, T. L., Mamlok-Naaman, R.; Hofstein, A.; J. Chem. Educ. 2008, 85, 1680. 40. Porlán, R.; Martín, J.; El diario del profesor: Un recurso para la investigación en el aula, 6ª ed., Díada: Sevilla, 1998. 41. Santos; W. L. P.; Ciência & Ensino 2007, 1, 1. 42. Andrade, M. F.; Zaratti, F.; Revista Boliviana de Física 2007, 13, 11. 43. Balderrama Flores, F. A.; Revista Metalúrgica 2012, 31, 5. 44. Pozo, J. I.; Crespo, M. A. G. Em A soluçao de problemas em ciências da natureza; Pozo, J. I., ed.; Artmed: Porto Alegre, 1998. 45. Passos, C. G.; Del Pino, J. C.; Quim. Nova 2017, 40, 219. 46. Vasconcellos, C. S.; Planejamento: Projeto de Ensino-Aprendizagem e Projeto Político-Pedagógico, Libertad: Sao Paulo, 2008. 47. Luxford, C. J.; Bretz, S. L.; J. Chem. Educ. 2014, 91, 312. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access