Artigo
|
|
| Hidrogéis nanocompósitos de polissacarídeo com zeólita: avaliação do processo de adsorção do pesticida paraquat Polysaccharide-based nanocomposite hydrogels with zeolite: evaluation of the sorption process of pesticide paraquat |
|
Diego H. O. BarbosaI,II,#; Marcia R. de MouraII,#; Fauze A. AouadaII,*,#
I. Pró-Reitoria de Pesquisa, Inovação e Pós-Graduação, Instituto Federal do Mato Grosso do Sul, 79021-000 Campo Grande - MS, Brasil II. Departamento de Física e Química, Faculdade de Engenharia de Ilha Solteira, Universidade Estadual Paulista Recebido em 21/08/2017 *e-mail: faouada@yahoo.com.br In this work, nanocomposites formed from the natural polymer carboxymethylcellulose in combination with the polyacrylamide polymer and zeolite were obtained and characterized in relation to pesticide sorption capability. Hydrogels are three-dimensional network with large capacity of water or biological fluid adsorption. They have biocompatibility, biodegradability and non-toxicity properties, ensuring this class of polymers is widely used in different agriculture fields. Thus, the objective of the work was to investigate the process of paraquat sorption using a novel biodegradable nanocomposite. By mathematical modeling, it was possible to found that better models were the Freundlich-Langmuir isotherm and pseudosecond order kinetic, indicating that sorption is heterogeneous and similar to chemisorption process. Thus, such nanocomposites have great potential to be applied as an adsorbent material for removal of pesticides from contaminated water. INTRODUÇAO Os hidrogéis podem ser definidos como materiais formados por dois ou mais componentes constituídos de uma rede polimérica tridimensional com capacidade de adsorver, absorver (mas sem se dissolver) e reter grande quantidade de água ou outro fluído.1 Normalmente, em seu estado intumescido, a fraçao de água presente no hidrogel é muito maior que a fraçao de massa do polímero.2,3 Além disso, os hidrogéis também apresentam biocompatibilidade e capacidade de imitar o ambiente da matriz extracelular (massa que une as células dos animais, composta de proteínas e polissacarídeos).4,5 Em relaçao ao processo de síntese, os hidrogéis apresentam reticulaçoes, que podem ser físicas ou químicas, que garantem a capacidade do polímero de nao se dissolver em água. Os hidrogéis reticulados quimicamente sao, normalmente, polimerizados via radical livre e iniciados por meio de tratamento térmico, fotoiniciaçao ou radiaçao. Ademais, também podem ser obtidos utilizando alta energia de irradiaçao e reaçao enzimática. Por outro lado, os hidrogéis reticulados fisicamente sao resultados de interaçoes nao-covalentes em nível molecular, podendo ser formados por interaçoes iônicas e ligaçao de hidrogênio entre as cadeias.6,7 Dentre as diversas caracterizaçoes a serem realizadas na área de hidrogéis, a propriedade hidrofílica é a mais importante. Sendo assim, sua capacidade de absorver água ou fluído está relacionada com os grupos hidrofílicos presentes em sua estrutura. No início do processo de intumescimento ocorre a interaçao entre a água e os grupamentos carregados existentes no hidrogel. Simultaneamente ocorre uma pequena interaçao entre a parte hidrofóbica da matriz polimérica e a água (interaçoes fracas). As moléculas de água preenchem todos os espaços vazios disponíveis na rede tridimensional. Portanto, a porosidade, o grau de reticulaçao e densidade de cadeias sao alguns dos fatores que afetam a capacidade de absorçao do material.8 Além desses fatores, as interaçoes que influenciam o intumescimento do hidrogel também incluem a capilaridade, pressao osmótica e as forças de hidrataçao, as quais sao contrabalanceadas pela força em resistir a expansao exercida pela cadeia reticulada do polímero. A magnitude de oposiçao dessas forças determina algumas características importantes do hidrogel como o ponto de equilíbrio de absorçao de água, a resistência mecânica e a difusao interna.9 Existem diversos monômeros vinílicos que podem ser utilizados para a síntese de hidrogéis, dentre eles a acrilamida. Os hidrogéis de poliacrilamida sao normalmente preparados pela copolimerizaçao de um ou mais monômeros funcionais e acrilamida com a presença de um agente reticulador, como por exemplo, o N',N'-metilenobisacrilamida (MBAAm). As principais características atribuídas a esse tipo de hidrogel sao atoxidade, inércia biológica, massa molar elevada, capacidade para preservar a sua forma, resistência mecânica e propriedades químicas ajustáveis. Contudo, quando intumescido, o hidrogel pode se tornar quebradiço em razao da falta de um mecanismo de dissipaçao de energia eficiente, e irregularidade dos pontos de reticulaçao na cadeia polimérica.10 Como forma de melhorar as propriedades do hidrogel de poliacrilamida, e devido à boa compatibilidade existente entre os materiais, a zeólita pode ser facilmente inserida como uma classe de aditivo ou cargas de síntese de hidrogéis poliméricos, obtendo-se, portanto, nanocompósitos híbridos ou híbridos nanoestruturados. As zeólitas incluem um número grande de minerais naturais e sintéticos que apresentam características em comum. Classicamente sao definidas como minerais aluminossilicatos cristalinos hidratados de metais alcalinos ou alcalinos terrosos, predominantemente de cálcio, sódio, potássio e magnésio estruturados em redes cristalinas tridimensionais, compostas por tetraedros de SiO4 ou AlO4 unidos por ligaçoes com oxigênio.11 A estrutura das zeólitas possui canais e cavidades interconectadas, de dimensoes moleculares, podendo agir como uma peneira molecular. Essa estrutura microporosa proporciona às zeólitas a capacidade de perder ou absorver água, adsorver moléculas com diâmetro adequado (por exemplo nutrientes e pesticidas) e trocar seus cátions constituintes sem uma grande mudança em sua estrutura.12 Atualmente estao sendo desenvolvidas pesquisas que buscam soluçoes tecnológicas para a preservaçao do meio-ambiente e melhor utilizaçao dos recursos naturais. Dentre os diferentes dispositivos que estao sendo desenvolvidos, os hidrogéis se destacam como materiais promissores na busca da eficácia ambiental. Nessa vertente, o desenvolvimento de fertilizantes de liberaçao controlada é uma tecnologia verde que reduz a perda de fertilizantes causada por volatilizaçao e lixiviaçao, e também altera a cinética de liberaçao de nutrientes, o que, por sua vez, fornece os nutrientes para as plantas em velocidade mais compatível com as suas necessidades metabólicas. Em se tratando de um fertilizante específico, a ureia é muitas vezes escolhida para aplicaçoes de liberaçao controlada de fertilizantes, devido ao seu baixo custo. Porém, diversos outros compostos sao estudados para tal finalidade.13 Além da liberaçao de insumos agrícolas, os hidrogéis podem ser utilizados como dispositivos de liberaçao controlada de água afetando positivamente na taxa de sobrevivência de mudas.14 Outra aplicaçao recorrente de hidrogéis é na liberaçao controlada de agrotóxicos, como pesticidas e herbicidas, em razao dos grupamentos polares presentes na cadeia polimérica do material, possibilitando, assim, a adsorçao desses compostos utilizados para o controle de pragas.15 A produçao agrícola tem crescido de forma acentuada durante a última década, acompanhando o aumento da populaçao mundial. O crescimento da agricultura só foi possível com a utilizaçao de pesticidas, que se tornaram parte importante da agricultura moderna. Embora o uso de pesticidas seja uma prática antiga, seu desenvolvimento e utilizaçao se acentuaram de forma vertiginosa após a Segunda Guerra Mundial.16 Dentre os diferentes pesticidas existentes, o herbicida paraquat tem recebido grande atençao devido a sua alta eficiência e nao seletividade. O paraquat (1-1'-dimetil-4-4'-bipiridilo) é um sal de amônio, normalmente sintetizado como sal diclorídrico. Sua utilizaçao iniciou-se em 1962, ele é utilizado em mais de 100 países no plantio de fumo, algodao, arroz, café, cana-de-açúcar, feijao, maça, soja, uva, entre outros.17 Esse herbicida é extremamente solúvel em água e insolúvel em solventes orgânicos nao polares, nao é inflamável na forma aquosa e é corrosivo para metais. Facilmente se reduz para o estado catiônico pela perda de um único elétron.18 Quando em contato com a superfície dos vegetais, sofre uma degradaçao fotoquímica produzindo compostos menos tóxicos do que o original. No solo, o paraquat é facilmente adsorvido pelos minerais que estao no solo. Por outro lado, o paraquat livre sofre degradaçao a partir de microrganismos, tornando-se inerte no solo.19 O paraquat é extremamente tóxico. No organismo humano ocorre a sua reduçao através da enzima NADPH, formando o radical paraquat, que por sua vez, em contato com oxigênio, oxida-se formando um ânion radical superóxido e regenerando o paraquat. Assim, esses ciclos repetidos causam uma grande quantidade de espécies de oxigênio reduzido que levam o organismo ao estresse oxidativo. Além disso, estudos apontam que o paraquat possui substâncias tóxicas que contribuem para a morte de neurônios, e que podem estar relacionados com a ocorrência de Mal de Parkinson.19 Pelo exposto, é notório que o uso de matrizes compostas por hidrogéis híbridos pode contribuir para reduçao da poluiçao ambiental. Portanto, o objetivo desse estudo foi estudar os mecanismos de interaçao existentes entre o pesticida paraquat e nanocompósitos híbridos por meio da investigaçao dos modelos cinéticos de adsorçao, buscando o desenvolvimento de um nanocompósito com possível aplicaçao na agricultura (como veículo remediador em águas contaminadas ou em liberaçao controlada de pesticidas).
PARTE EXPERIMENTAL Síntese dos hidrogéis nanoestruturados Neste trabalho, os hidrogéis foram formados por poliacrilamida (PAAm) e pelo polissacarídeo carboximetilcelulose (CMC) (Synth-Brasil PA). As matrizes poliméricas foram obtidas através da polimerizaçao química do monômero acrilamida (AAm) (Vetec-Brasil ≥ 98% de pureza) em soluçao aquosa contendo zeólita ZS-403H (99% de pureza), com diâmetro de poro de 4Å, volume de poros de 15%, área superficial específica de 40 m2 g-1 e capacidade de troca catiônica de aproximadamente 1,85 meq g-1 (dados fornecidos pelo fabricante St. cloud zeolite), previamente dispersa em água, CMC, reticulador N'-N'-metilenobisacrilamida (MBAAm) (18,6 µmol mL-1) (Vetec-Brasil 98% pureza), catalisador N-N-N'-N'-tetrametiletilenodiamina (TEMED) (6,67 mmol L-1) (Sigma-Aldrich 99% de pureza) e persulfato de sódio como iniciador (Sigma-Aldrich ≥ 99% de pureza). A análise de Espectroscopia de energia dispersiva de raios-X, obtida por meio de um microscópio eletrônico de varredura ZEISS (modelo EVO LS15), indicou que os cátions trocáveis M+ da zeólita podem ser os elementos potássio, sódio, ferro, cálcio ou magnésio. Os procedimentos foram baseados nos descritos por Aouada20 e as concentraçoes dos reagentes foram estabelecidas pelo nosso grupo de pesquisa GCNH alocado no Departamento de Física e Química (DFQ) da Universidade Estadual Paulista Júlio de Mesquita Filho (Unesp - Ilha Solteira). Foram sintetizados hidrogéis com diferentes teores de zeólita, 0%, 10%, 15% e 20% m/v, mantendo as concentraçoes de AAm e CMC fixas em 6% (m/v) e 1% (m/v), respectivamente. Estudos anteriores realizados pelo grupo de pesquisa GCNH apontam que essas concentraçoes de zeólita no hidrogel apresentam os melhores resultados na síntese, uma vez que níveis superiores a 20% de zeólita causam alta viscosidade na soluçao, impossibilitando, assim, a dissoluçao de CMC a posteriori. Adsorçao de pesticida pelos hidrogéis Os testes de adsorçao do herbicida paraquat ocorreram por meio da inserçao de um hidrogel seco em 20 mL da soluçao do herbicida com concentraçao previamente conhecida (5, 10, 15, 20, 25, 30 e 40 ppm). Após determinados períodos de tempo, uma pequena fraçao da soluçao era retirada e sua concentraçao determinada por meio de um espectrofotômetro de UV-Vis Shimadzu (modelo UV 2600). Esse procedimento foi realizado até o estado de equilíbrio, no qual o hidrogel nao adsorvia quantidade significativa de pesticida. Assim, as concentraçoes foram determinadas por meio da curva de calibraçao, anteriormente construída em seu comprimento de onda máximo de absorçao UV-Vis, sendo 257 nm para o paraquat. A quantidade de pesticida adsorvida foi calculada por meio da equaçao abaixo:  na qual qt é a quantidade de hidrogel adsorvida em um tempo t, C0 e Ct sao as concentraçoes inicial e no tempo t, respectivamente. V é o volume inicial da soluçao e m é a massa do hidrogel seco utilizado no ensaio. Modelagem do processo de adsorçao Também foi investigado o processo de adsorçao por meio de isotermas de adsorçao, modelos matemáticos que descrevem as relaçoes entre a quantidade de determinado composto adsorvido e sua quantidade remanescente na soluçao de equilíbrio.21 Dentre as diversas isotermas existentes, neste trabalho, foram investigadas as 4 isotermas mais estudadas em processos aplicados na agricultura: Langmuir, Freundlich, Harkins-Jura e Freundlich-Langmuir. A isoterma de Langmuir é um dos modelos matemáticos mais utilizados, possui como pressupostos que há no material adsorvente um número definido de sítios, que as moléculas adsorvidas nao interagem entre si, que a adsorçao ocorre apenas em uma camada e que cada sítio pode comportar apenas uma molécula adsorvida.22 A isoterma de Langmuir linearizada respeita a seguinte equaçao:  na qual qe é a quantidade de soluto adsorvida por grama de adsorvente em equilíbrio, αL é a energia de adsorçao, KL é a constante de interaçao entre o adsorvato e o adsorvente e Ce é a concentraçao de adsorvato no equilíbrio. A isoterma de Freundlich foi uma das primeiras equaçoes a propor uma relaçao entre a quantidade de material adsorvida e a concentraçao do material na soluçao. O modelo considera o material adsorvente heterogêneo possuindo vários tipos de sítios de adsorçao com diferentes energias de ativaçao. Assim, sendo aplicado em sistemas nao ideias, com adsorçao em multicamadas.22 A equaçao a seguir representa a isoterma de Freundlich, na sua forma linear. 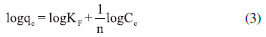 na qual qe é a quantidade de soluto adsorvida, Ce é a concentraçao da soluçao em equilíbrio, 1/n é uma constante relacionada à heterogeneidade do material e KF é a constante de capacidade de adsorçao de Freundlich. O modelo de Harkins-Jura admite uma adsorçao em multicamadas e uma distribuiçao irregular de sítios de adsorçao.23 A forma linear da isoterma de Harkins-Jura é apresentada na equaçao a seguir:  na qual A e B sao as constantes de adsorçao de Harkins-Jura, qe é a quantidade de soluto adsorvida e Ce é a concentraçao da soluçao em equilíbrio. A isoterma de Freundlich-Langmuir é um modelo matemático que considera os aspectos básicos da adsorçao, assim como a isoterma de Langmuir, e também o caráter heterogêneo da adsorçao.24 A seguir é apresentada a equaçao linearizado da isoterma de Freundlich-Langmuir:  na qual n é o grau de heterogeneidade do material adsorvente, qm é a quantidade máxima adsorvida e K' é a constante de equilíbrio. Além disso, também foi investigada a cinética de adsorçao através de dois modelos matemáticos, o modelo de pseudoprimeira ordem e o modelo de pseudosegunda ordem. Ambas as equaçoes estao representadas a seguir. Pseudoprimeira ordem:  em que qe e qt sao as quantidades adsorvidas no equilíbrio e após um tempo t e k1 é a constante da taxa de adsorçao de pseudoprimeira ordem. Pseudosegunda ordem:  em que K2 é a constante de taxa de adsorçao de pseudosegunda ordem.
RESULTADOS E DISCUSSAO Adsorçao de pesticida pelos hidrogéis Os espectros de absorçao UV-Vis da soluçao de pesticida paraquat com concentraçao inicial 40 ppm sao apresentados na Figura 1. Os hidrogéis secos com massa conhecida foram adicionados na soluçao, e como descrito anteriormente, em tempos conhecidos foram retiradas alíquotas e quantificadas. É possível notar para ambos os hidrogéis (0% e 20% de zeólita), a absorbância da soluçao de pesticida decaiu praticamente a valores de absorbância iguais a zero, indicando que o pesticida foi praticamente 100% sorvido pelo hidrogel, e chegando ao estado de equilíbrio em aproximadamente 48 h. Dessa forma, o tempo de 48 h foi estabelecido como o tempo de equilíbrio, sendo esse utilizado na determinaçao das isotermas, como descrito a seguir.
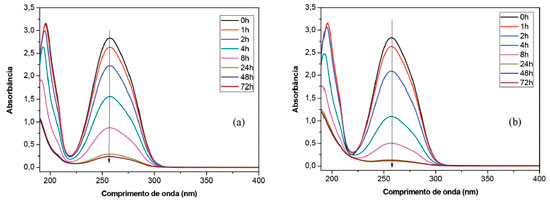 Figura 1. Espectros de absorçao do paraquat na regiao ultravioleta para a concentraçao de 40ppm nos hidrogéis de 0% (a) e 20% (b) m/v de zeólita
Modelagem do processo de adsorçao Como forma de investigar os processos de adsorçao, utilizou-se os quatro modelos de isoterma mais utilizados na literatura: Langmuir, Freundlich, Harkins-Jura e Freundlich-Langmuir. Nas Figuras 1-4S sao apresentados os gráficos que foram plotados a partir das equaçoes de cada modelo matemático para a adsorçao de paraquat. Os valores das constantes das isotermas e o coeficiente de regressao linear para cada estudo sao apresentados na Tabela 1.
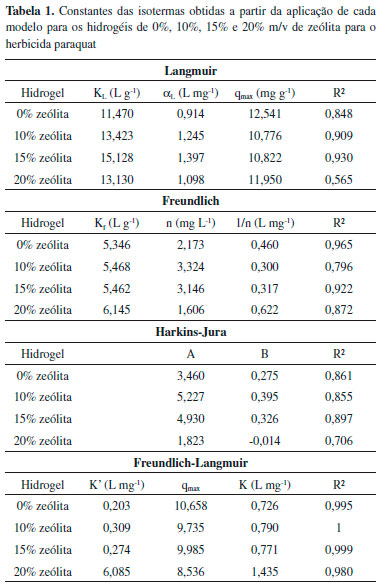
Utilizando o coeficiente de regressao linear como parâmetro de análise, o modelo de isoterma que melhor se aplica aos dados experimentais é o de Freundlich-Langmuir. Essa isoterma é uma uniao entre as isotermas de Langmuir e Freundlich, diferenciando-se apenas pelo grau de heterogeneidade n, no qual valores acima de 1 indicam adsorçao em multicamadas. As constantes K' e K sao diretamente proporcionais à afinidade entre os hidrogéis e o paraquat. Desse modo, o hidrogel com 20% m/v de zeólita apresenta alta afinidade com o herbicida, o que proporcionaria uma liberaçao mais controlada do paraquat, ou seja, o hidrogel liberaria uma quantidade menor de paraquat diariamente, aumentando, assim, a quantidade de dias liberando herbicida e, portanto, a cinética de liberaçao se tornaria mais lenta. Os outros hidrogéis com zeólita possuem uma afinidade um pouco maior que o hidrogel controle. Assim, considerando uma aplicaçao para liberaçao controlada de herbicida, o hidrogel com 20% m/v de zeólita aparenta ser mais promissor, uma vez que possui um grau de afinidade maior com o herbicida. Possivelmente, os pontos de interaçoes da matriz polimérica estao ocorrendo entre os grupamentos -OH e CH2COOH presentes na estrutura do polímero CMC e do nitrogênio com caráter catiônico presente nos 2 anéis piridínicos do paraquat. O processo de adsorçao dos herbicidas deve ocorrer de forma similar ao processo de absorçao de água. Os grupamentos hidroxilas e carboxilas presentes nos hidrogéis de PAAm/CMC interagem com o grupamento N+ existente na estrutura dos pesticidas, ocasionando assim a adsorçao do pesticida. Além disso, mesmo que de maneira menos efetiva, ocorrem interaçoes hidrofóbicas (forças van der Waals, dipolo-induzido e outras) pesticida-matriz que auxiliam na sorçao desses. Com a inserçao da zeólita, acredita-se que para a adsorçao do paraquat, os hidrogéis com 10%, 15% e 20% m/v de zeólita diminuem a capacidade de adsorçao do material, uma vez que a zeólita tende a compactar mais a estrutura de poros do hidrogel e enrijecer as cadeias do polímero. Contudo, as interaçoes com o pesticida dever ser intensificadas por meio de interaçoes com os elementos Al e O, os quais possuem caráteres aniônicos24 (Esquema 1). Além disso, acredita-se que o paraquat nao penetrou nos poros da zeólita, uma vez que a o tamanho aproximado da molécula de pesticida é em torno de 15 Å, enquanto o poro da zeólita é em torno de 4 Å.
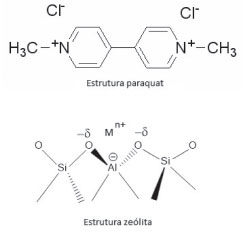 Esquema 1. Estruturas do herbicida paraquat e da zeólita, indicando os possíveis pontos de interaçoes entre os materiais. Mn+ indica metal alcalino, alcalino terroso, prótons ou complexos catiônicos presentes na estrutura da zeólita
A cinética de adsorçao foi também investigada utilizando os modelos matemáticos de pseudoprimeira ordem e pseudosegunda ordem obtidos para o herbicida paraquat (Figuras 2 e 3).
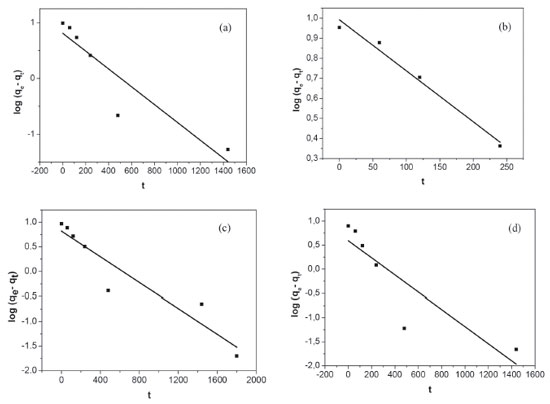 Figura 2. Curvas de pseudoprimeira ordem para adsorçao de paraquat pelos hidrogéis de 0% (a), 10% (b), 15% (c) e 20% (d) m/v de zeólita
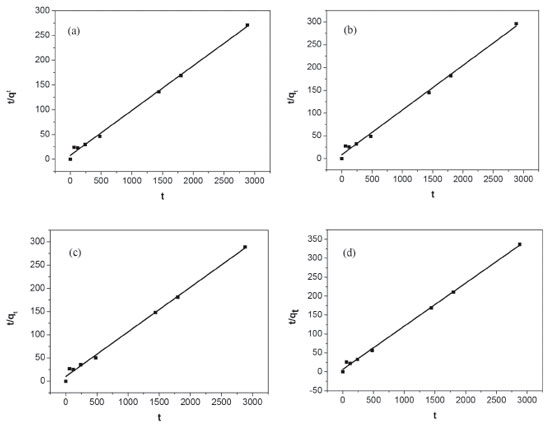 Figura 3. Curvas de pseudosegunda ordem para adsorçao de paraquat pelos hidrogéis de 0% (a), 10% (b), 15% (c) e 20% (d) m/v de zeólita
Na Tabela 2, estao elencados os valores das constantes de pseudoprimeira ordem e pseudosegunda ordem obtidos para o estrudo do sistema paraquat-nanocompósitos.
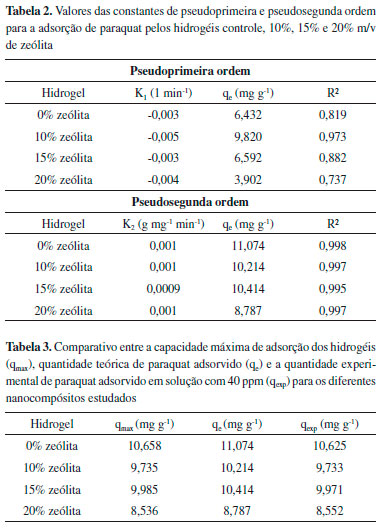
Os resultados apontam que o processo que governou a adsorçao foi o de pseudosegunda ordem. Nesse modelo, o mecanismo de adsorçao se aproxima de uma adsorçao química, ocorrendo o processo de adsorçao preferencialmente em monocamadas, o que corrobora com a hipótese de que os hidrogéis possuem grande afinidade com o herbicida paraquat. Por outro lado, a constante que indica a velocidade de adsorçao K2 nao sofreu alteraçoes com o aumento da concentraçao de zeólita na matriz do polímero. Analisando os resultados da isoterma, a quantidade máxima de paraquat que os hidrogéis suportam adsorver é expressa pelo parâmetro qmax obtidos a partir da isoterma de Freundlich-Langmuir (Tabela 1). Os valores obtidos a partir do modelo cinético de pseudosegunda ordem (qe) sao muito próximos dos valores obtidos experimentalmente para adsorçao de paraquat (qexp) na concentraçao de 40 ppm (Tabela 3), sugerindo que os hidrogéis estavam próximos do seu ponto de saturaçao. Além disso, a quantidade teórica de paraquat adsorvida até o estado de equilíbrio, qe, também está bem próxima dos valores obtidos experimentalmente.
CONCLUSOES Os resultados indicaram que as quantidades de reagentes utilizadas foram apropriadas, uma vez que ao adicionar a zeólita nas diferentes concentraçoes nao houve precipitaçao, formando com sucesso os hidrogéis. Os resultados de espectroscopia UV-Vis apontam que tanto o hidrogel com zeólita quanto o hidrogel sem zeólita foram capazes de adsorver praticamente todo pesticida presente na soluçao em que foram alojados. Analisando os resultados das isotermas, temos que, para ambos hidrogéis, o modelo matemático mais apropriado, considerando o coeficiente de regressao linear, é o de Freundlich-Langmuir. Utilizando o parâmetro K, podemos afirmar que o hidrogel com 20% de zeólita possui um grau de afinidade maior com pesticida do que o hidrogel sem zeólita. O modelo cinético de pseudosegunda ordem foi o que melhor se ajustou aos dados experimentais obtidos, indicando que o modelo de sorçao do pesticida paraquat se assemelha ao modelo de quimiosorçao. Diante dos resultados, esses novos hidrogéis apresentam-se como materiais promissores para aplicaçao na agricultura, mais especificamente, na remediaçao de águas contaminadas por pesticidas e em sistemas de liberaçao controlada de herbicidas.
MATERIAL SUPLEMENTAR No material suplementar, disponível gratuitamente em http://quimicanova.sbq.org.br na forma de arquivo PDF, estao apresentados os gráficos referentes às isotermas de Langmuir, Freundlich, Harkins-Jura e Freundlich-Langmuir, respectivamente (Figuras 1S-4S).
AGRADECIMENTOS Os autores agradecem ao CNPq, à CAPES e à Fapesp pelas bolsas concedidas e pelo suporte financeiro.
REFERENCIAS 1. Ferreira Junior, C. R.; Moura, M. R.; Aouada, F. A.; J. Nanosci. Nanotechnol. 2017, 17, 5878. 2. Costa, A. M. S.; Mano, J. F.; Eur. Polym. J. 2015, 72, 344. 3. Ooi, S. Y.; Ahmad, I.; Amin, M. C. I. M.; Ind. Crops Prod. 2016, 93, 227. 4. Fernandes, R. S.; Moura, M. R.; Aouada, F. A.; Quim. Nova 2017, 40, 60. 5. Nguyen, Q. V.; Huyn, D. P.; Park, J. H.; Lee, D. S.; Eur. Polym. J. 2015,72, 602. 6. Ma, S.; Yu, B.; Pei, X.; Zhou, F.; Polymer 2016,98, 516. 7. Kamoun, E. A.; Chen, X.; Eldin, M. S. M.; Kenawy, E. S.; Arabian J. Chem. 2015,8, 1. 8. Guilherme, M. R.; Aouada, F. A.; Fajardo, A. R.; Martins, A. F.; Paulino, A. T.; Davi, M. F. T.; Rubira, A. F.; Muniz, E. C.; Eur. Polym. J. 2015,72, 365. 9. Buwalda, S. J.; Boere, K. W. M.; Dijkstra, P. J.; Feijen, J.; Vermonden, T.; Hennink, W. R.; J. Control. Release 2014,190, 254. 10. Zhou, C.; Wu, Q.; Colloids Surf., B. 2011,84, 155. 11. Colella, C.; Wise, W. S.; Microporous Mesoporous Mater. 2014,189, 4. 12. Montolavo, S.; Guerrero, L.; Borja, R.; Sánchez, E.; Milán, Z.; Cortés, I.; La Rubia, M. A.; Appl. Clay Sci. 2012,58, 125. 13. Maulvi, F. A.; Lakdawala, D. H.; Shaikh, A. A.; Desai, A. R.; Choksi, H. H.; Vaidya, R. J.; Ranch, K. M.; Koli, A. R.; Vyas, B. A.; Shah, D. O.; J. Control. Release 2016, 226, 47. 14. Lopes, J. L. W.; Silva, M. R.; Saad, J. C. C.; Angélico, T. S.; Ciência Florestal 2010, 20, 217. 15. Alemzadeh, I.; Vossoughi, M.; Chem. Eng. Process. 2002, 41, 707. 16. Morillo, E.; Villaverde, J.; Sci. Total Environ. 2017,586, 576. 17. Almeida, G. L.; Schmitt, G. C.; Bairros, A. V.; Emanuelli, T.; Garcia, S. C.; Ciência Rural 2007,37, 1506. 18. Serra, A.; Domingos, F.; Prata, M. M.; Acta Med. Port. 2003,16, 25. 19. Martins, T.; Semina 2013,34, 175. 20. Aouada, F. A.; Tese de Doutorado, Universidade Federal de Sao Carlos, Brasil, 2009. 21. Oliveira, L. F. C.; Lemke-de-Castro, M. L.; Rodrigues, C.; Borges, J. D.; Revista Brasileira de Engenharia Agrícola e Ambiental 2010, 17, 776. 22. Nascimento, R. F.; Lima, A. C. A.; Vidal, C. B.; Melo, D. Q.; Raulino, G. S. C.; Imprensa Universitária da Universidade Federal do Ceará, 2014. 23. Mushtaq, M.; Bhatti, H. N.; Iqbal, M.; Noreen, S.; J. Environ. Manage. 2016,176, 21. 24. Sousa, D. N. R.; Dissertaçao de Mestrado, Universidade Federal de Sao Carlos, Brasil, 2011.
# Programa de Pós-Graduaçao em Ciência dos Materiais (PPGCEM), FEIS, Ilha Solteira - SP, Brasil |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access





