Revisão
|
|
| Aplicaciones biomédicas de poliuretanos Biomedical applications of polyurethanes |
|
Yomaira L. Uscategui; Luis E. Díaz; Manuel F. Valero*
Facultad de Ingeniería, Universidad de La Sabana, Campus Universitario del Puente del Común, Autopista Norte de Bogotá, D.C. Chía, Cundinamarca, Colombia Recebido em 23/10/2017 *e-mail: manuel.valero@unisabana.edu.co Polyurethanes (PUs) are generating increasing interest in the biomedical field due to its characteristic properties. The objective of this article was review general properties of PUs and related with their biomedical applications, also to show the importance of the synthesis of PUs and how each one of the reagents used influences both mechanical properties and biological response of the designed medical devices. It is important to look for a correlation between mechanical properties and biological properties from the synthesis process of the PUs which allow to maintain the biocompatibility required by each medical device. In this work, the PUs are evaluated into three groups of applications: equipment and surgical instruments, temporary applications within the body, and permanent applications within the body. This review can show the broad field of use of PUs in biomedical applications. INTRODUCCION Los poliuretanos (PUs) representan una clase importante de polímeros termoplásticos y termoestables cuyas propiedades mecánicas, térmicas, y químicas pueden ser modificadas desde la síntesis.1 Los PUs se conocen a menudo como copolímeros de bloques segmentados, ya que están conformados por segmentos duros o rígidos y suaves o blandos cuyas propiedades finales pueden ser manipuladas al cambiar la relación o la química de dichos componentes. El proceso de síntesis consiste en la reacción de un poliisocianato con un poliol o grupos funcionales hidroxilo, en presencia de otros reactivos.2-4 Es así como durante la síntesis de un PU, se pueden controlar las variables del proceso para obtener productos acordes con las aplicaciones requeridas. Entre esas variables se incluyen la optimización de las cantidades relativas de los reactivos, las variaciones en la funcionalidad del poliol, la relación isomérica del isocianato, y el proceso de mezclado de los reactivos, entre otras.5-8 Cada uno de los segmentos duros y blandos están conectados por medio de enlaces de uretano, donde el segmento duro proporciona los entrecruzamientos físicos dentro de la matriz del segmento blando.9 El segmento duro generalmente se refiere a la combinación del extensor de cadena y los componentes de diisocianato, mientras que los segmentos blandos se refieren a dioles poliméricos.10 Zia et al.1,11-14 han realizado diferentes estudios sobre la síntesis de PUs. En uno de estos estudios, se sintetizaron y caracterizaron elastómeros de PU con poli(ε-caprolactona) y diisocianato 4,4-difenilmetano con α,ω-alcanodioles como extensores de cadena, y encontraron que la cristalinidad y la hidrofilicidad eran mayores con el aumento de la longitud del extensor de cadena.13 En otro estudio, se sintetizaron y caracterizaron elastómeros de PU con poli(ε-caprolactona) variando el diisocianato (4,4-etilenbis-ciclohexilisocianato y diisocianato hexametileno) y la estructura de los extensores de cadena (quitina y 1,4-butanodiol), encontrando que el tipo de diisocianato afecta el comportamiento cristalino del polímero.14 También se encontró que la presencia de la quitina favorece la formación de una estructura ordenada. Estas modificaciones generan diversas reacciones químicas con numerosas propiedades y esto es lo que le confiere a los PUs gran interés para su uso en diversas aplicaciones industriales. Adicional a esto, los PUs se caracterizan por su versatilidad y son ampliamente conocidos por sus propiedades mecánicas (adhesividad, resistencia, elasticidad), propiedades biológicas, bioquímicas y no toxicidad.9,15-18 El objetivo de esta revisión es resaltar la importancia de la síntesis de los PUs y cómo cada uno de los reactivos utilizados influye tanto en las propiedades mecánicas como en la respuesta biológica en el diseño de dispositivos médicos. Es importante buscar una correlación entre las propiedades mecánicas y las propiedades biológicas del proceso de síntesis de los PUs que permiten mantener la biocompatibilidad requerida por el diseño de dispositivos médicos que sean biodegradables, no tóxicos y que cumplan con las especificaciones mecánicas de cada aplicación.
POLIMEROS COMO BIOMATERIALES Históricamente los polímeros se han empleado en diferentes dispositivos de aplicaciones biomédicas. Así por ejemplo, el Polimetacrilato de metilo (PMMA) fue el primer polímero usado como material de prótesis en odontología en el año de 1937. El PMMA también fue utilizado para reparar defectos del cráneo desde 1940, y fue empleado en la manufactura de lentes intraoculares desde 1949. En 1950, el PMMA fue identificado como cemento óseo en la fijación del fémur. En 1958 se desarrolló el Poli-tetrafluoroetileno (PTFE). En 1940 elastómeros de silicona fueron usados para reparar el conducto biliar. En 1950 suturas de dacrón fueron usadas en cirugía. En 1960 los geles de silicona fueron desarrollados para implantes de glándula mamaria, y el tereftalato de polietileno (PET) fue identificado clínicamente para uso en prótesis vascular sintética.19 Los polímeros biodegradables han ganado mucha atención hoy en día en el campo de la medicina con el objetivo de buscar nuevos materiales para tratamientos de problemas de salud debido a atractivas propiedades físicas y buena biocompatibilidad.19-21 Las propiedades como facilidad de procesado, durabilidad, funcionalidad superficial, flexibilidad, biocompatibilidad y bioestabilidad los hacen superiores para el desarrollo de materiales para la liberación de fármacos, ingeniería de tejidos y para el desarrollo de dispositivos médicos en general.17 Un polímero ideal usado en medicina debería exhibir las siguientes propiedades: no inducir inflamación, no generar reacciones tóxicas o enfermedades alérgicas en el cuerpo; tener una buena procesabilidad para diseñar el producto final; debe ser fácil de esterilizar; no debe cambiar las propiedades luego de la esterilización; debe ser biocompatible; durable, funcional y fiable.6
POLIURETANOS EN EL CAMPO BIOMÉDICO Entre los polímeros que han ganado interés en aplicaciones biomédicas se encuentran los PUs que representan una clase importante de polímeros sintéticos.22 Por lo tanto, el desarrollo de PUs biodegradables con propiedades fisicoquímicas, mecánicas y de biocompatibilidad adecuadas se ha convertido en factores fundamentales de evaluación para el diseño de biomateriales.23 El método de síntesis de PUs puede depender del tipo de medio que se utiliza donde se puede tener una masa o una solución, o se puede identificar por medio de las etapas que son necesarias para realizar la síntesis, una o más etapas.24 es así como el enlace uretano en los PUs se puede formar a través de un proceso de dos pasos. El paso inicial es una reacción que implica la nivelación final de los segmentos blandos, macrodioles (poliéter, poliéster, policarbonato, o polisiloxano), con diisocianato para formar un prepolímero. La segunda reacción es el acoplamiento del prepolímero con una cadena de bajo peso molecular, como un extensor de cadena, un diol o una diamina.10 Zieleniewska et al.25 Sintetizaron PUs utilizando el método del prepolímero en masa para diseñar cultivos de tejidos óseos destinados a la aplicación en ingeniería de tejidos y emplearon como poliol el aceite de colza. Los autores encontraron que este método era adecuado para el diseño de materiales porosos con gran potencial en la ingeniería de tejidos.25 La reacción clásica de PUs, como ya se mencionó, corresponde a la reacción entre un compuesto hidroxilado y un compuesto di, tri o poliisocianato para generar enlaces uretano.26 El isocianato con grupo funcional NCO hace parte del segmento duro del PU.23 Los diisocianatos empleados en la síntesis de PUs se pueden clasificar como alifáticos y aromáticos según se observa en la Figura 1. La selección del tipo de diisocianato a utilizar influye directamente sobre las propiedades mecánicas y biológicas del material.27 Ionescu et al.27 sintetizaron espumas de PU con tres tipos de diisocianatos, alifático, cicloalifático y aromático. Con el diisocianato m-xileno, diisocianato alifático, se sintetizaron elastómeros de PU gomosos. Al utilizar 4,4'-diisocianato de diciclohexilmetano (cicloalifático) se obtuvieron materiales moderadamente rígidos. Y con el diisocianato de difenilmetano (aromático) se sintetizaron PUs amorfos rígidos con propiedades mecánicas mayores comparadas con los otros materiales sintetizados. Los autores encontraron que el proceso de síntesis con los diisocianatos alifáticos es más fácil comparado con el aromático, debido a la baja reactividad de los mismos.27
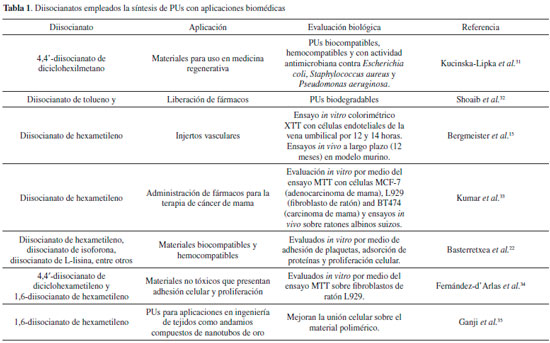
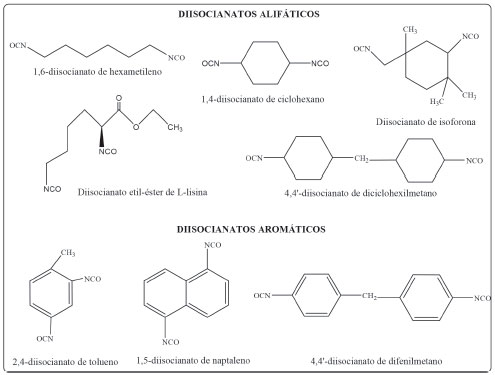 Figura 1. Estructura química de diisocianatos alifáticos y aromáticos comunes en la síntesis de PUs22,28,29
En la síntesis de PUs son más usados los diisocianatos aromáticos dada la elevada reactividad que presentan. Es así como PUs comerciales para aplicaciones biomédicas se producen de diisocianato de difenilmetano.23 Nguyen Dang et al.30 sintetizaron un poliuretano con aceite de higuerilla y un diisocianato aromático, 4,4'-diisocianato de difenilmetano. La biocompatibilidad del material fue evaluada sobre la línea celular 3T3 de fibroblastos de ratón durante 4 días y determinaron que los materiales eran biocompatibles ya que presentaban una adhesión y viabilidad celular buena comparada con un biomaterial de vidrio usado como control. Los autores proponen a estos PUs como aptos para el diseño de materiales biomédicos.30 En la actualidad existen investigaciones relacionadas sobre la evaluación del efecto tóxico que pueden presentar los monómeros utilizados en la síntesis de PUs, como los diisocianatos, donde se indica que los diisocianatos aromáticos pueden presentar diaminas carcinogénicas y mutagénicas luego de un proceso de degradación.22,26,31 Esta es una de las razones por las cuales los materiales sintetizados con diisocianatos aromáticos se emplean por lo general en el diseño de biomateriales para aplicaciones permanentes para el organismo donde no se presenten productos de degradación.24 De esta forma en la actualidad los diisocianatos que han ganado interés en el diseño de PUs para el campo biomédico son los alifáticos para evitar los posibles efectos tóxicos a largo plazo generados por los aromáticos.23 En la Tabla 1 se presenta un listado de diisocianatos empleados en aplicaciones biomédicas que han presentado evaluaciones biológicas demostrando que pueden ser materiales aptos en el diseño de biomateriales.
Las primeras aplicaciones de PUs en el campo biomédico correspondían a dispositivos para aplicaciones cardiovasculares desde la década de los ochenta, tales como bolsas de sangre, catéteres vasculares, corazón artificial total y pequeños injertos de acceso vascular y cirugía de bypass.36 Estos dispositivos presentaban ventajas a largo plazo, pero después con el tiempo se encontraron inconvenientes en cuanto a la variabilidad de las propiedades mecánicas. Es por esto que se han desarrollado diversos estudios para mejorar la bioestabilidad y la mecánica de los PUs por medio de modificaciones químicas.37 Desde principios de 1990 los elastómeros de PU se han estudiado para la ingeniería de tejidos blandos, especialmente, el tejido cardiovascular. Esto es debido a la elasticidad de ciertos elastómeros de PU que son ideales para la reparación del músculo cardíaco. Durante la siguiente década, los PUs fueron ampliamente investigados por ser susceptibles a la biodegradación. Este tipo de investigaciones generó un sin número de aplicaciones novedosas y mejoradas de implantación a largo plazo, así como una nueva clase de PUs bioreabsorbibles. Recientes investigaciones se han enfocado en buscar un balance entre biodegradabilidad y estabilidad para lograr materiales versátiles en diversas aplicaciones, para lo cual se hace necesario un amplio estudio de las propiedades mecánicas y de biocompatibilidad de los PUs.36 Según el buscador de patentes internacionales Lens, las patentes solicitadas y concedidas relacionadas con PUs en el campo biomédico están incrementando desde 1990, presentando más de mil documentos publicados para el 2016 como se observa en la Figura 2.38
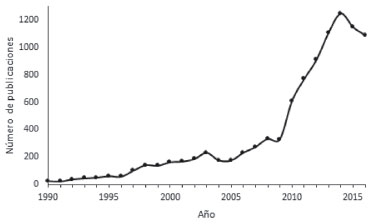 Figura 2. Número de documentos publicados de patentes para PUs con aplicaciones biomédicas. Referencia: Datos tomados de la base de datos de patentes Lens38
Los PUs como familia de polímeros, han ganado importancia en las aplicaciones biomédicas y farmacéuticas debido a propiedades como compatibilidad con la sangre, resistencia a la biodegradación,2,39-42 y propiedades elastoméricas, las cuales pueden ser modificadas por medio de la variación de la composición de las unidades monoméricas y por el tamaño de los bloques de diferentes monómeros dentro de la cadena.37,43 Es así como los PUs juegan un papel importante en el diseño de dispositivos biomédicos e implantes presentando excelentes resultados. De esta forma los PUs se pueden utilizar para usos internos, especialmente en aplicaciones a corto plazo, como catéteres o implantes, o para aplicaciones de uso externo, como por ejemplo los sistemas de liberación controlada de medicamentos.44 En la Figura 3 se presenta un listado de algunas de las aplicaciones relevantes de los PUs en el campo biomédico. De acuerdo con una revisión en la base de datos de Science Direct sobre las aplicaciones listadas, se determinó un porcentaje relacionado con el número de publicaciones científicas encontradas hasta la fecha de dichas aplicaciones.45
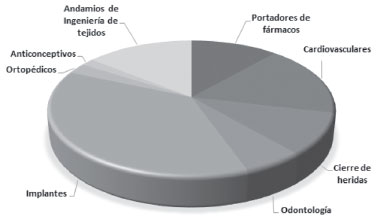 Figura 3. Aplicaciones médicas de poliuretanos. Referencia: Datos tomados de la base de datos Science Direct45
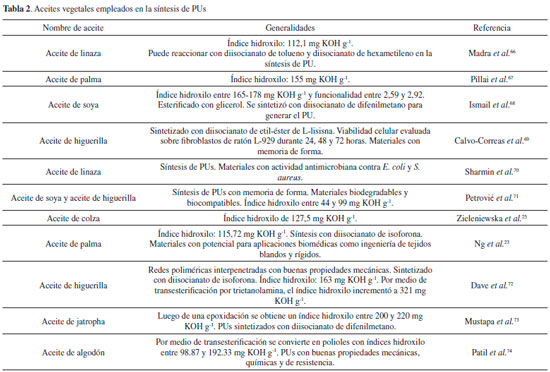
En el listado presentado en la Figura 3 se observa que los implantes a partir de PUs tienen un 37% de publicaciones a pesar de presentar una reducción alrededor de los años noventa por temas de seguridad en los pacientes y por las limitaciones presentadas por la FDA (Food and Drug Administration) previa a la comercialización de los implantes.46 Dispositivos cardiovasculares, andamios para ingeniería de tejidos,47 portadores de fármacos47 y dispositivos para cierre de heridas48 hacen parte de las aplicaciones más publicadas.45 Algunas aplicaciones de los dispositivos médicos en los que se emplean PUs, están en contacto con la sangre, incluyendo los dispositivos de soporte circulatorio, catéteres, endoprótesis, dispositivos de asistencia ventricular izquierda, aislamiento de cables de marcapasos, injertos vasculares y válvulas cardíacas. Estos materiales han encontrado un uso generalizado debido a las propiedades mecánicas, resistencia a la fatiga y hemocompatibilidad aceptable para muchas aplicaciones.49 Por medio de modificaciones estructurales se logran diversas propiedades, es así como la exposición de PUs a ambientes acuosos puede dar lugar a la reorientación significativa y reordenamiento de dominios en la superficie. Adicionalmente, las superficies de poli(éter uretano)s que son de naturaleza dinámica, bajo ambientes acuosos, reducen al mínimo la energía libre superficial a través de la reorientación de dominio, lo que resulta en la mejora de los dominios duros polares en la superficie.10,50,51 De esta manera, los PUs pueden servir como materiales que tienen contacto temporal o permanente con la sangre debido a propiedades anti-trombogénicas. Una de las propiedades más importantes de PUs utilizados en el campo biomédico es la capacidad de ser biocompatibles para evitar reacciones inflamatorias en los tejidos. Adicional a esto, los PUs deben ser biodegradables bajo las condiciones existentes en el organismo de acuerdo con la aplicación final.52-56 La biodegradabilidad de los PUs se logra generalmente por la incorporación de fracciones fáciles de transformar e hidrolizables dentro de las cadenas principales del polímero.21 Adicional a esto, se ha encontrado una correlación entre flexibilidad y biodegradabilidad, lo que indica que cuanto más flexible sea el PU, éste será más susceptible a biodegradación.20 Dentro de este marco, se han empleado los aceites vegetales de diferentes semillas oleaginosas (soya, coco, girasol, higuerilla, palma, entre otros) para sintetizar PUs biodegradables como se observa en la Tabla 2, por presentar variadas estructuras químicas y sitios reactivos que permiten la modificación del aceite generando de esta forma monómeros con diferentes funcionalidades,57 son económicos, no tóxicos, abundantes y contienen grupos hidroxilos secundarios y triglicéridos de ácidos grasos.58-65
Los aceites vegetales se componen principalmente de triglicéridos de ácidos grasos de cadenas largas con insaturaciones como dobles enlaces,68 como se observa en la Figura 4. La composición de los ácidos grasos depende del tipo de aceite vegetal.28 Los triglicéridos son abundantes, renovables, biodegradables y se han convertido en una fuente alternativa en la síntesis de materiales poliméricos.28,66 Los aceites vegetales se pueden modificar para incrementar la funcionalidad del poliol por medio de la adición de grupos hidroxilo haciendo uso de las insaturaciones presentes en la estructura.75 Esto se realiza mediante diversas técnicas como alcoholisis, epoxidación, transesterificación, entre otros.71,75-77
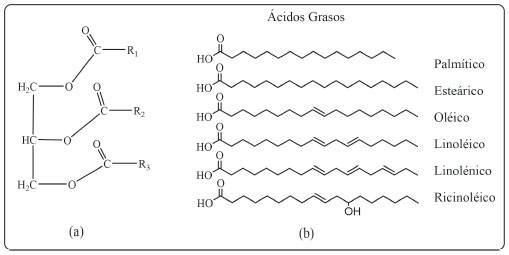 Figura 4. Estructuras químicas representativas (a) Estructura de triglicérido (R1, R2, y R3 representan cadenas de ácidos grasos); (b) Acidos grasos comunes presentes en los aceites vegetales.28,66,69,75,78
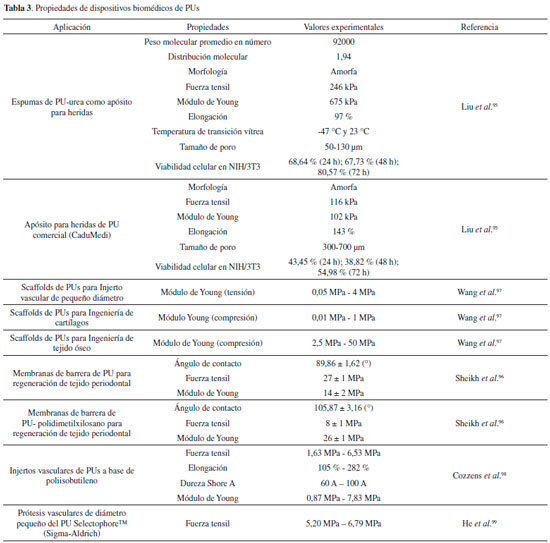
Uno de los aceites que se ha utilizado en los últimos días es el aceite de higuerilla (Ricinus communis) cuyo contenido de ácido ricinoléico es de aproximadamente el 90% (peso/peso), el cual contiene grupos hidroxilo en su cadena que reaccionan con isocianatos polifuncionales para formar PUs con diferentes propiedades morfológicas, mecánicas (buena flexibilidad y elasticidad), entre otras, gracias a la cadena larga de ácidos grasos presentes.79-83 Otro compuesto de igual importancia que el aceite de higuerilla es el polietilenglicol que se caracteriza por la biocompatibilidad y se ha utilizado para la síntesis de PUs biodegradables como diol de bajo peso molecular.61 Existen diversas investigaciones relacionadas con la síntesis de materiales poliméricos con posibles aplicaciones biomédicas tipo PUs con polioles obtenidos del aceite de higuerilla. Valero et al. obtuvo PUs con polioles derivados del aceite de higuerilla con diisocianato de isoforona (IPDI) y poli-isocianatos de lisina (metil éster diisocianato de lisina y triisocianato de lisina). En esta investigación se observó que el tipo de isocianato utilizado le confiere variaciones en las propiedades mecánicas dependiendo del grado de funcionalidad de cada uno y el grado de entrecruzamiento del polímero. Los PUs obtenidos presentaron propiedades mecánicas aptas para ser utilizados en aplicaciones de ingeniería de tejidos.84 Investigaciones posteriores se basaron en la síntesis de PUs con polioles derivados del aceite de higuerilla e IPDI, en las cuales los polioles fueron modificados químicamente para buscar un incremento de la funcionalidad del mismo. Los materiales obtenidos presentaron degradación in vitro por medio de buffer fosfato salino y temperatura,85 y por medio de bacterias como Escherichia coli y Pseudomonas aeruginosa. Los PUs y sus productos de degradación no fueron tóxicos frente a fibroblastos de ratón (L-929 y NIH/3T3, respectivamente) indicando su posible uso en aplicaciones biomédicas.86 En el 2016, se sintetizaron PUs con polioles a partir de aceite de higuerilla modificado empleando IPDI y con adición de policaprolactona con el objetivo de aumentar su biocompatibilidad, encontrándose que el incremento de la funcionalidad del poliol es proporcional con las propiedades mecánicas. Se determinó que los materiales poliméricos eran aptos como candidatos para aplicaciones biomédicas ya que no presentaron toxicidad frente a líneas celulares de fibroblasto murino (L-929 y NIH/3T3) tanto en contacto directo como con sus productos de degradación, y mostraron actividad antimicrobiana frente a Escherichia coli y Pseudomonas aeruginosa.87 Acorde con esta línea de investigación, recientemente se evaluó el efecto de la incorporación de quitosano para mejorar la biocompatibilidad y la actividad antibacteriana, a la matriz conformada por polioles derivados de aceite de higuerilla con IPDI y policaprolactona. Se determinó que la adición del quitosano tenía efecto sobre las propiedades fisicoquímicas, mecánicas y biológicas de los materiales sintetizados, los cuales no presentaron efectos tóxicos sobre líneas celulares de fibroblastos de ratón L-929 en contacto directo con los PUs y NIH/3T3 en contacto con los productos de degradación, y presentaron actividad antimicrobiana frente a Escherichia coli (Gram negativa) y Staphylococcus aureus (Gram positiva).88 Aplicaciones biomédicas de PUs Existen algunas técnicas de procesamiento de PUs para diseñar biomateriales dependiendo de las aplicaciones específicas. Las técnicas de procesamiento corresponden a las usadas para el procesamiento de polímeros de forma general como, por ejemplo, el moldeo de materiales fundidos, el moldeo a partir de soluciones, la fabricación de láminas, fibras, entre otros.24 Así por ejemplo, una de las técnicas empleadas en la fabricación de catéteres es la extrusión. La extrusión es una técnica de procesamiento que permite la incorporación de materiales al producto final con el fin de modificar una propiedad.89 Stevenson et al.89 diseñaron un catéter central periférico utilizando un poliuretano termoplástico grado médico. Al PU le adicionaron un tinte fluorescente (IRDye 800CW) para controlar la ubicación del catéter dentro del paciente. Los investigadores buscaban un método de fotografiar catéteres sin el uso de radiación ionizante para evitar al máximo efectos secundarios adversos. Los pellets de PU se mezclaron con el tinte para formar una lámina, luego se pasaron por un proceso de extrusión para generar cilindros de catéteres. El proceso de extrusión no afectó las propiedades mecánicas del polímero y no se presentó interacción química ente el tinte y el PU, así como tampoco se presentaron efectos adversos sobre células endoteliales, demostrando que los materiales pueden ser utilizados como biomateriales.89 En otra investigación, mediante extrusión de fusión en caliente y moldeo por inyección se diseñaron PUs termoplásticos para la fabricación de matrices de liberación controlada logrando resultados adecuados para el suministro de fármacos.90 Otro de los métodos de manufactura de dispositivos para aplicaciones biomédicas consiste en el espumado de PUs. Un ejemplo de espumados se observa en la investigación desarrollada por Laube et al.26 quienes diseñaron espumas degradables de PU in situ para ser insertadas como líquido o como una mezcla viscosa dentro de los tejidos suaves defectuosos. Los materiales se sintetizaron con monómeros de L-lactide y ε-caprolactona con diisocianato de etil-éster de L-lisina Se evaluó la respuesta biológica in vitro por medio de la determinación de la citotoxicidad sobre la línea celular 3T3 de fibroblastos de ratón durante 24 horas, y adicional a esto se realizó una evaluación in vivo utilizando un modelo murino por un periodo de 2 semanas, 3 y 6 meses. Los autores proponen a estos materiales aptos para ser usados en el campo biomédico.26 Un método para fabricar apósitos para heridas a partir de PUs consiste en la fabricación de fibras por medio de Electrospinning. El Electrospinning es una técnica versátil y rentable, que consiste en aplicar alto voltaje a materiales poliméricos para convertirlos en nanofibras.91 Manikandan et al.91 fabricaron un nanocompuesto de PU con aceite de murivenna para apósitos para heridas. La caracterización de las propiedades mecánicas y biológicas de los materiales presentaron características que son esenciales durante el proceso de curación de heridas y que permitiría el diseño de andamios de apósitos para las heridas. Son diversas las aplicaciones de PUs en el campo biomédico debido a la variabilidad de propiedades que presenta este tipo de polímeros. Según se ha indicado en párrafos anteriores las propiedades mecánicas, fiscoquímicas, térmicas, morfológicas y biológicas dependen del tipo de reactivos empleados durante la síntesis. Las longitudes de las cadenas son responsables de las características del material. Los PUs están formados por segmentos duros compuesto por cadenas alifáticas o aromáticas, y segmentos flexibles compuestos por poliéteres o poliésteres lineales o alifáticos o policarbonatos.92 Es así como es necesario realizar una caracterización específica de cada uno de los materiales sintetizados para determinar la funcionalidad como dispositivo biomédico. Las propiedades físicas y mecánicas dependen de la estructura atómica y molecular de los materiales empleados en la síntesis. La naturaleza de los enlaces y las sub-unidades de la estructura afectan las propiedades mecánicas y por lo tanto propiedades de tensión/deformación, corte/torsión, flexión y viscoelásticas, las cuales son de interés para la evaluación de biomateriales. Uno de los ensayos más comunes es el de tensión-deformación con el que se puede determinar la fuerza tensil, el módulo de Young y elongación a la rotura. Un ensayo mecánico es fundamental para determinar la aplicación de determinado biomaterial, ya que permite obtener los parámetros de carga que son requeridos para un tejido de interés.93 Las características elastoméricas y las propiedades térmicas de PUs son atribuidos a los dominios de segmentos blandos y duros, respectivamente.3 Dependiendo de la estructura de los segmentos duros y suaves, los dominios cristalinos y amorfos se pueden formar y eso define la rigidez y estabilidad del material.92 Por su parte la morfología depende de factores como la composición química, tamaño y funcionalidad de los segmentos, la temperatura de transición vítrea, etc.94 Estructuras morfológicas amorfas afectan directamente la tenacidad y la flexibilidad de los PUs. La determinación de la temperatura de transición vítrea permite reproducir la tenacidad de un dispositivo médico a temperatura ambiente.95 La superficie química y la morfología son importantes para determinar la biocompatibilidad y el comportamiento de sistemas de liberación de compuestos. El ángulo de contacto proporciona información acerca de la hidrofobicidad/hidrofilicidad y podría ser un indicador indirecto de la movilidad molecular de la superficie. La humectabilidad de la superficie puede afectar la adsorción de proteínas en la superficie y la biocompatibilidad.96 En la Tabla 3 se presentan las propiedades de algunos dispositivos biomédicos diseñados con PUs utilizando diferentes reactivos para la síntesis.
Según se observa en la Tabla 3 las propiedades de los PUs son muy variadas y por lo tanto las aplicaciones como dispositivos médicos son diversas. Los valores presentados en la Tabla 3 se encuentran comparables con los reportados en la Tabla 4 que corresponden a propiedades mecánicas de vasos sanguíneos de injertos vasculares.
Los dispositivos médicos deben cumplir con estándares internacionales relacionados con evaluaciones de biocompatibilidad que a su vez está directamente relacionado con el tipo de aplicación que cumple cada dispositivo. Es así como según la FDA (Food and Drug Administration) todos los dispositivos médicos tienen una agrupación dependiendo del nivel de control necesario para garantizar seguridad y efectividad del dispositivo. De esta forma se tienen tres grandes grupos denominados dispositivos Clase I, dispositivos Clase II y los dispositivos Clase III.101 En el grupo Clase I se encuentran los dispositivos médicos que están relacionados con equipos e instrumentos quirúrgicos que por lo general no se introducen en el organismo. En la Clase II se encuentran los dispositivos que se usan de forma temporal y que no superan los treinta días dentro del organismo. Por último, los dispositivos Clase III corresponde a aquellos que cumplirán una función permanente dentro del organismo. A continuación, se presenta una descripción del tipo de dispositivos que se diseñan con PUs en el campo biomédico teniendo en cuanta la clasificación general dada por la FDA. Equipos e instrumentación quirúrgica Los PUs actualmente se están empleando en diversas aplicaciones como biomateriales cardiovasculares, línea fija de sangre para hemodiálisis, catéteres venosos centrales, bolsas intravenosas, etc. Las propiedades que hacen de estos materiales un gran atractivo para cumplir con estas aplicaciones son la hidrofobicidad, buena estabilidad y compatibilidad térmica y mecánica.102 Con el fin de mejorar la biocompatibilidad con la sangre de este tipo de sustratos de PU, Lin et al.102 inmovilizaron quitosano soluble en agua y sulfato de dextrano a través de polimerización inducida con ozono por injerto de ácido poliacrílico sobre la superficie de un PU termoplástico. Ellos encontraron que la compatibilidad con la sangre mejoró luego de la inmovilización del complejo sobre la superficie de las membranas de PU. De esta forma se observó que el tiempo de coagulación se prolonga, y la adhesión plaquetaria y la adsorción de proteínas se reducen eficazmente, incrementando la proliferación celular y la viabilidad. La necesidad de disminuir las infecciones bacterianas generadas por transmisión debidas a dispositivos empleados en el área médica, como por ejemplo las bolsas para sangre o suero, adhesivos, vendas, agujas, entre otros, ha despertado el interés por investigar materiales que disminuyan la aparición de enfermedades generadas por transmisión. Un ejemplo de esto es el uso de cloruro de polivinilo en las bolsas para almacenar sangre que se caracteriza por ser durable, resistente a cambios térmicos y químicos, pero que necesita plastificantes, debido a su fragilidad, que le confieren otras propiedades deseables para este fin como: flexibilidad, ser inertes y transparentes. La búsqueda de materiales como estos es compleja debido a las propiedades que deben cumplir como producto final. Incluso los requisitos necesarios para un material como la bolsa de sangre son la resistencia al calor y productos químicos, especialmente durante la esterilización, y permeabilidad de los gases para asegurar que el pH y el nivel de oxígeno se mantengan constantes, no ser cancerígenos, entre otros. Es así como se buscan sustitutos de materiales poliméricos para reemplazar los existentes, entre los que se tienen los PUs cuya ventaja es que no requiere plastificantes adicionales. Los PUs son atractivos debido a su estructura química porque están disponibles en una gran variedad estructural, tienen buen rendimiento a baja temperatura, son esterilizables por diferentes métodos, permiten el tratamiento de radiación de alta frecuencia, tienen resistencia y tenacidad, son biodegradables y exhiben el menor grado de trombogenicidad. Aunque los monómeros isocianato son altamente tóxicos, el nivel de residuos es principalmente indetectable, lo que resulta en un bajo riesgo de toxicidad.103 Aplicaciones temporales dentro del organismo En esta clasificación, al igual que el grupo anterior, los materiales deben cumplir con propiedades específicas para evitar factores negativos dentro del organismo. Las aplicaciones agrupadas en esta clasificación son las siguientes:
Dentro de estos materiales quirúrgicos, los más utilizados son las suturas, filamentos estériles utilizados para aproximar y mantener el tejido hasta que la curación proporcione a la herida la adecuada fuerza para soportar tensiones mecánicas. Las suturas se pueden clasificar en función del origen de los materiales en sintéticos o naturales y según el tipo de material en absorbibles y no absorbibles; y configuraciones físicas como monofilamento, multifilamento, o trenzado.10 Los materiales de fabricación de las suturas deben inhibir la fibroplasia en la cicatrización de heridas, y deben promover el crecimiento celular fundamentalmente. Como una fuente natural se ha empleado la quitina y sus derivados como material alternativo en el desarrollo de elastómeros degradables, por sus propiedades de biodegradabilidad, disponibilidad y bajo costo. Pero aun así se tienen algunas desventajas como por ejemplo la baja solubilidad lo que afecta directamente las propiedades físicas y funcionales de los polímeros sintetizados.20 De acuerdo con Vogels et al. al utilizar suturas se pueden generar lesiones sobre la cicatrización de la herida debido a la necrosis y la destrucción de los tejidos adyacentes generada por las elevadas tensiones de los materiales de sutura. Una solución es utilizar materiales de sutura con capacidad de regular la tensión a través de la elasticidad, esto podría mejorar el proceso de cicatrización de heridas. Los autores desarrollaron hilos de PUs con los cuales se evalúo in vivo la respuesta celular y los cambios funcionales en la tensión de la sutura. No se presentaron señales de infección de la herida ni anomalías debidas al material implantado, concluyendo que los hilos de PUs generaron una menor constricción y probablemente menos necrosis.104 Es así como Zia et al. sintetizaron elastómeros de PU biodegradable a base de quitina con potenciales biomédicos. La síntesis se realizó mediante la reacción de Poli(ε-caprolactona) y diisocianato 4,4-difenilmetano. Para la extensión del pre-polímero utilizaron quitina y 1,4-butanodiol. Los investigadores observaron que al incorporar quitina en el PU se disminuye la energía libre superficial y el componente polar, es decir, la hidrofilicidad decrece con la extensión de quitina al pre-polímero. Esto es importante para la degradación debido a que estos polímeros están diseñados para desarrollarse y degradarse en entornos biológicos, por lo tanto la capacidad de absorción de agua es importante. Esta propiedad puede ser empleada para obtener materiales hidrofóbicos como suturas no absorbibles.11
Ding et al. desarrollaron un multibloque de PUs a partir de policaprolactona con grupos de polietilenglicol para mejorar las propiedades del polímero y hacerlo útil y versátil para aplicaciones de liberación de fármacos. Ellos encontraron que se mejoran las tasas de degradación hidrolítica y enzimática, y adicional observaron viabilidad celular con células de fibroblastos de ratón.109 Similares resultados encontraron Liu et al.110 quienes sintetizaron un PU a partir de poli-adipato de butilenglicol, polietilenglicol y polipropilenglicol, junto con 4,4-metilenbis(ciclohexil isocianato), y encontraron que este material era candidato como sistema de liberación de fármacos.
Acerca de este aspecto, los polímeros son materiales adecuados para la fabricación de andamios para diversas aplicaciones en ingeniería de tejidos, donde los PUs corresponden al grupo más representativo, que como ya se mencionó, esto es gracias a las diversas propiedades físicas y mecánicas que los hacen adecuados en muchas áreas de la ingeniería de tejidos, ya sea para la regeneración de tejido blando, cartílago o regeneración de hueso.113 Hoy en día la ingeniería de tejidos es uno de los campos de mayor investigación donde se incluye el uso de células vivas en el control y desarrollo de sustitutos biológicos para implantarlos dentro del cuerpo y promover la remodelación de los tejidos. De esta forma se puede mencionar que entre los objetivos de la ingeniería de tejidos se tiene restaurar, intercambiar, preservar o incrementar la función de un tejido o de un órgano.114 Los sistemas de andamios/liberación presentan algunas limitaciones entre las que se pueden mencionar las dificultades de manipulación, bajo control sobre las propiedades finales, problemas con la curación, etc. Es por esto que se investigan diversos compuestos para disminuir los inconvenientes generados, entre los que se tiene por ejemplo el uso de PUs biodegradables.115 Los PUs son útiles para aplicaciones de soporte como por ejemplo los andamios de hueso donde las propiedades pueden ser modificadas para encontrar la adecuada composición de segmentos suaves y duros.17 Guelcher et al.116 sintetizaron andamios de PU a partir de diisocianato de lisina y triisocianato de lisina buscando mejorar la manipulación y propiedades de los andamios encontrando una presión de vapor más baja y viscosidad comparada con los diisocianatos alifáticos. Otra de las aplicaciones de la ingeniería de tejidos de los polímeros biodegradables que ha ganado especial interés es el uso en la regeneración ósea. Kim et al.115 diseñaron un sistema de andamio/liberación para ingeniería de tejidos para regenerar defectos óseos cráneo faciales. Aplicaciones permanentes dentro del organismo Esta clasificación debe cumplir con algunas características esenciales en el campo biomédico. Una de ellas es que los materiales tienen que conservar las propiedades por largos períodos de tiempo (propiedades mecánicas, por ejemplo), ser biocompatibles, no provocar coagulación, no ser tóxicos. Dentro de esta clasificación se agrupan las siguientes aplicaciones:
Rangel et al.121 utilizaron materiales reforzados mezclados y soportados de PU poroso con partículas de hidroxiapatita para ser empleados en prótesis como sustitutos de hueso, y evaluaron la hidrólisis enzimática de los mismos. Determinaron que los compuestos son vulnerables a las reacciones de hidrólisis, pero de todas formas los porcentajes de pérdida en peso son adecuados para las aplicaciones propuestas. De igual forma Laschke et al.122 presentaron resultados similares sobre la síntesis de un PU junto con hidroxiapatita, cuyas propiedades lo convierten en un material prometedor en la ingeniería de tejido óseo.
Una de las aplicaciones de ingeniería de tejidos está relacionada con los injertos vasculares que deben conservar las propiedades de los tejidos que van a remplazar. Los materiales a base de PUs se han evaluado para cumplir con estas funciones debido a propiedades mecánicas, biodegradabilidad, procesabilidad y biocompatibilidad.124 Adicional a esto se ha encontrado que injertos de tejidos vasculares biodegradables con un elevado rendimiento in vivo presentan ventajas sobre las prótesis permanentes no degradables. Los principales problemas asociados con las aplicaciones vasculares están relacionados con pequeños diámetros de los injertos, con la trombogenicidad y los desajustes biomecánicos.15 Es así como Bergmeister et al.15 evaluaron la biocompatibilidad in vivo e in vitro de injertos porosos vasculares con una pared delgada a partir de PU termoplástico biodegradable, encontrando un buen rendimiento in vivo de estos ensayos en roedores, donde características como las delgadas paredes del injerto, funcionalidad y propiedades mecánicas se conservaban durante el tiempo del ensayo, y los productos de la degradación no fueron tóxicos. Tsai et al.54 sintetizaron andamios de PU esponjoso para ser caracterizado en términos de la estructura porosa, humectabilidad, propiedades mecánicas, degradabilidad y productos de degradación. Como resultados encontraron una buena interconectividad de los poros, buenas propiedades de tracción, una buena recuperación al esfuerzo de compresión y la citotoxicidad fue insignificante. Por tal motivo los autores sugirieron que los andamios de PU podrían ser candidatos en las aplicaciones de ingeniería de tejido del cartílago.
Una de las complicaciones relacionadas con los implantes de siliconas en el seno corresponde a la contractura capsular. Bergmann et al.126 evaluaron 80 mini implantes en ratas hembras Wistar (40 implantes de geles de silicona y 40 implantes de PU). Los implantes de PU presentaron menor contractura capsular que los implantes de silicona. Los autores consideran que los implantes de PU presentan tasas de contractura capsular bajas debido a una fuerte adherencia de los tejidos circundantes con los implantes, lo que estimula el crecimiento de los fibroblastos evitando el endurecimiento alrededor del implante.126 En un estudio retrospectivo de 15 años realizado por de la Peña-Salcedo et al.127 se evaluaron 996 implantes mamarios cubiertos con PU, y se evidenció que el 95% de los pacientes obtuvieron resultados satisfactorios junto con una baja incidencia de contractura capsular (0.4%) y excelentes resultados estéticos. Los autores afirman que la contractura capsular es baja comparada con los reportes en literatura para implantes lisos e implantes texturizados (aproximadamente 6 y 3%, respectivamente).127 Para minimizar el efecto de la contractura capsular tardía, Rancati et al.128 realizaron una reconstrucción de un solo paso en pacientes con cáncer de mama y utilizaron implantes cubiertos con PU. Sólo el 1.8% de los pacientes desarrollaron contractura capsular y por lo tanto los autores afirman que el uso de este tipo de reconstrucción junto con implantes recubiertos de PU se convierte en una opción para disminuir la contractura capsular.128
Por medio de esta revisión se puede inferir que de acuerdo a la estructura química de los materiales a utilizar en el proceso de síntesis es posible predecir el tipo de propiedades mecánicas, fisicoquímicas y morfológicas de los PUs e igualmente impactar positivamente en las propiedades biológicas que están directamente relacionadas con las propiedades mecánicas; de esta forma es fundamental la adecuada selección de los monómeros para la síntesis de un PU con una aplicación biomédica específica. Las propiedades de los polímeros dependen de factores como el peso molecular de los monómeros, la naturaleza química de las unidades que componen el polímero y la morfología en estado sólido de los mismos.131 La microestructura, la rugosidad de la superficie, las propiedades mecánicas y las propiedades biológicas deseables en aplicaciones biomédicas son reflejo de la estructura química ajustable de los PUs que está dada por la alternancia entre los segmentos duros y blandos presentes en la cadena polimérica.132 Además, el uso de aditivos, extensores de cadena, mezclas con otros polímeros o biopolímeros tienen efecto directo en las propiedades biológicas mejorando la biocompatibilidad y generando valor agregado a los dispositivos como la capacidad de inhibir o prevenir el crecimiento de bacterias sobre la superficie del mismo. En los últimos años se han investigado polímeros bio-derivados de fuentes renovables que favorezcan propiedades mecánicas, que sean biodegradables y biocompatibles como resultado de las preocupaciones sociales, ambientales y económicas a nivel mundial.133,134
CONCLUSIONES Los PUs han tenido un impacto significativo en el avance de la búsqueda de materiales para las diversas aplicaciones biomédicas, y permanecerán siendo objeto de estudio en las siguientes generaciones. La biodegradabilidad de los PUs y el resto de propiedades característicos de los mismos, son los atractivos para seguir investigaciones en el campo biomédico y de esa forma superar las desventajas que aún presentan estos materiales. Las aplicaciones presentadas en esta revisión son sólo una parte de la gran variedad de materiales que están surgiendo para el campo biomédico, debido a la integración de ciencias actuales, que implica la medicina, la biología, la ciencia de los materiales e ingeniería, con lo que se tiene un mayor conocimiento sobre la relación de interacción de los biomateriales con la respuesta biológica y demás propiedades de los órganos humanos. Se debe resaltar la importancia de buscar una correlación entre las propiedades mecánicas y las propiedades biológicas desde el proceso de síntesis de los PUs que permitan mantener la biocompatibilidad que requiera cada dispositivo médico. De esta forma, el futuro de la búsqueda de PUs funcionales biocompatibles y biodegradables está directamente relacionado con la formación de equipos multidisciplinarios para llevar a cabo las investigaciones necesarias.
AGRADECIMIENTOS A la Universidad de La Sabana por la financiación del proyecto de investigación ING-160-2015 y a Colciencias por la beca-préstamo doctoral bajo la convocatoria 617-2 de 2014.
REFERENCIAS 1. Zia, K. M.; Bhatti, H. N.; Ahmad Bhatti, I.; React. Funct. Polym. 2007, 67, 675. 2. Mahkam, M.; Sharifi-Sanjani, N.; Polym. Degrad. Stab. 2003, 80, 199. 3. Chashmejahanbin, M. R.; Daemi, H.; Barikani, M.; Salimi, A.; Appl. Surf. Sci. 2014, 317, 688. 4. Vroman, I.; Tighzert, L.; Materials (Basel) 2009, 2, 307. 5. Trinca, R. B.; Felisberti, M. I.; Eur. Polym. J. 2015, 62, 77. 6. Domanska, A.; Boczkowska, A.; Polym. Degrad. Stab. 2014, 108, 175. 7. Estrada, A.; Herrera, J.; Rev. Iberoam. Polímeros 2013, 14, 28. 8. Vega-Baudrit, J.; Rev. Iberoam. Polímeros 2008, 9, 408. 9. Murray, K. A.; Kennedy, J. E.; McEvoy, B.; Vrain, O.; Ryan, D.; Cowman, R.; Higginbotham, C. L.; Eur. Polym. J. 2013, 49, 1782. 10. He, W.; Benson, R. Em Handbook of Biopolymers and Biodegradable Plastics: Properties, Processing and Applications; Ebnesajjad, S., org.; Elsevier, 2013, cap. 5. 11. Zia, K. M.; Barikani, M.; Zuber, M.; Bhatti, I. A.; Barmar, M.; Int. J. Biol. Macromol. 2009, 44, 182. 12. Zia, K. M.; Barikani, M.; Zuber, M.; Bhatti, I. A.; Sheikh, M. A.; Carbohydr. Polym. 2008, 74, 149. 13. Zia, K. M.; Barikani, M.; Zuber, M.; Bhatti, I. A.; Bhatti, H. N.; Iran. Polym. J. 2008, 17, 61. 14. Zia, K. M.; Bhatti, I. A.; Barikani, M.; Zuber, M.; Sheikh, M. A.; Int. J. Biol. Macromol. 2008, 43, 136. 15. Bergmeister, H.; Seyidova, N.; Schreiber, C.; Strobl, M.; Grasl, C.; Walter, I.; Messner, B.; Baudis, S.; Fröhlich, S.; Marchetti-Deschmann, M.; Griesser, M.; di Franco, M.; Krssak, M.; Liska, R.; Schima, H.; Acta Biomater. 2015, 11, 104. 16. Gregorí, B.; Guerra, M.; Mieres, G.; Alba, L.; Adolfo, B.; Norma, R.-V.; Mercedes, S.; Yohana, de la H.; Rev. Iberoam. Polímeros 2008, 9, 377. 17. Shelke, N.; Nagarale, R.; Kumbar, S. Em Natural and Synthetic Biomedical Polymers; Kumbar, S., Laurencin, C., Deng, M., eds.; Elsevier: Saint Louis, MO, USA, 2014, cap. 7. 18. Soriano, S.; Cassella, R. J.; J. Braz. Chem. Soc. 2013, 24, 1172. 19. Subramaniam, A.; Sethuraman, S.; Em Natural and Synthetic Biomedical Polymers; Kumbar, S., Laurencin, C., Deng, M., eds.; Elsevier, Oxford, 2014, cap. 18. 20. Zia, K. M.; Barikani, M.; Bhatti, I. A.; Bhatti, M.; Bhatti, H. N.; J. Appl. Polym. Sci. 2008, 110, 769. 21. Zhou, L.; Yu, L.; Ding, M.; Li, J.; Tan, H.; Wang, Z.; Fu, Q.; Macromolecules 2011, 44, 857. 22. Basterretxea, A. Haga, Y.; Sanchez-Sanchez, A.; Isik, M.; Irusta, L.; Tanaka, M.; Fukushima, K.; Sardon, H.; Eur. Polym. J. 2016, 84, 750. 23. Ng, W. S.; Lee, C. S.; Chuah, C. H.; Cheng, S. F.; Ind. Crops Prod. 2017, 97, 65. 24. Caracciolo, P. C.; Abraham, G. A. Em Biomateriales aplicados al diseño de sistemas terapéuticos avanzados; Sousa, H., Braga, M., Sosnik, A., eds.; Universidad de Coimbra: Coimbra, 2015, p. 147. 25. Zieleniewska, M.; Auguscik, M.; Prociak, A.; Rojek, P.; Ryszkowska, J.; Polym. Degrad. Stab. 2014, 108, 241. 26. Laube, T.; Weisser, J.; Berger, S.; Börner, S.; Bischoff, S.; Schubert, H.; Gajda, M.; Bräuer, R.; Schnabelrauch, M.; Mater. Sci. Eng. C 2017, 78, 163. 27. Ionescu, M.; Radojčić, D.; Wan, X.; Shrestha, M.; Petrović, Z.; Upshaw, T.; Eur. Polym. J. 2016, 84, 736. 28. Zhang, C.; Garrison, T. F.; Madbouly, S. A.; Kessler, M. R.; Prog. Polym. Sci. 2017, 71, 91. 29. Mangeon, C.; Renard, E.; Thevenieau, F.; Langlois, V.; Mater. Sci. Eng. C 2017, 80, 760. 30. Nguyen Dang, L.; Le Hoang, S.; Malin, M.; Weisser, J.; Walter, T.; Schnabelrauch, M.; Seppala, J.; Eur. Polym. J. 2016, 81, 129. 31. Kucinska-Lipka, J.; Gubanska, I.; Janik, H.; Sienkiewicz, M.; Mater. Sci. Eng., C 2015, 46, 166. 32. Shoaib, M.; Bahadur, A.; Saif, M.; Iqbal, S.; Ifzan, M.; Asif, M.; Mahmood, T.; J. Drug Deliv. Sci. Technol. 2017, 39, 277. 33. Kumar, A.; Lale, S. V.; Alex, M. R. A.; Choudhary, V.; Koul, V.; Colloids Surf., B 2017, 149, 369. 34. Fernández-d'Arlas, B.; Alonso-varona, A.; Palomares, T.; Corcuera, M. A.; Eceiza, A.; Polym. Degrad. Stab. 2015, 122, 153. 35. Ganji, Y.; Kasra, M.; Salahshour, S.; Bagheri, M.; Mater. Sci. Eng., C 2014, 42, 341. 36. Chen, Q.; Liang, S.; Thouas, G. A.; Prog. Polym. Sci. 2013, 38, 584. 37. St John, K. R.; J. Biomed. Mater. Res. Part B 2014, 102, 1332. 38. https://www.lens.org, accesado Diciembre 2017. 39. Qiu, H.; Li, D.; Chen, X.; Fan, K.; Ou, W.; Chen, K. C.; Xu, K.; J. Biomed. Mater. Res., A 2013, 101, 75. 40. Shourgashti, Z.; Khorasani, M. T.; Khosroshahi, S. M. E.; Radiat. Phys. Chem. 2010, 79, 947. 41. Gunatillake, P.; Mayadunne, R.; Adhikari, R.; Biotechnol. Annu. Rev. 2006, 12, 301. 42. Dulińska-Molak, I.; Lekka, M.; Kurzydłowski, K. J.; Appl. Surf. Sci. 2013, 270, 553. 43. Kiran, S.; James, N. R.; Jayakrishnan, A.; Joseph, R.; J. Biomed. Mater. Res. A 2012, 100, 3472. 44. Rodríguez-Galán, A.; Franco, L.; Puiggal, J. Em Handbook of Biodegradable Polymers: Synthesis, Characterization and Applications; Lendlein, A., Sisson, A., orgs.; First 2011, cap. 6. 45. http://www.sciencedirect.com/, accesado Diciembre 2017. 46. Duxbury, P. J.; Harvey, J. R.; J. Plast. Reconstr. Aesthetic Surg. 2016, 69, 452. 47. Zandén, C.; Hellström Erkenstam, N.; Padel, T.; Wittgenstein, J.; Liu, J.; Kuhn, H. G.; Nanomedicine: Nanotechnology, Biology and Medicine 2014, 10, 949. 48. Da, L.; Gong, M.; Chen, A.; Zhang, Y.; Huang, Y.; Guo, Z.; Li, S.; Li-Ling, J.; Zhang, L.; Xie, H.; Acta Biomater. (2017), doi:10.1016/j.actbio.2017.05.041. 49. Rocco, K. a; Maxfield, M. W.; Best, C. a; Dean, E. W.; Breuer, C. K.; Tissue Eng., Part B 2014, 20, 628. 50. Xu, L.-C.; Runt, J.; Siedlecki, C. A.; Acta Biomater. 2010, 6, 1938. 51. Dawlee, S.; Jayabalan, M.; Biomed. Mater. 2011, 6, 55002. 52. Marzec, M.; Kucińska-Lipkaa, J.; Kalaszczyńskab, I.; Janik, H.; Mater. Sci. Eng. C. 2017,80, 736. 53. Li, Y.; Shimizu, H.; Macromol. Biosci. 2007, 7, 921. 54. Tsai, M.-C.; Hung, K.-C.; Hung, S.-C.; Hsu, S.; Colloids Surf., B 2015, 125, 34. 55. Wang, W.; Guo, Y.; Otaigbe, J.; Polymer 2008, 49, 4393. 56. van Minnen, B.; Stegenga, B.; van Leeuwen, M. B. M.; van Kooten, T. G.; Bos, R. R. M.; J. Biomed. Mater. Res., A 2006, 76, 377. 57. Maisonneuve, L.; Chollet, G.; Grau, E.; Cramail, H.; Oilseeds and fats, Crops and Lipids 2016, 23, D508. 58. Bakhshi, H.; Yeganeh, H.; Mehdipour-Ataei, S.; Shokrgozar, M. A.; Yari, A.; Saeedi-Eslami, S. N.; Mater. Sci. Eng. C 2013, 33, 153. 59. Das, B.; Konwar, U.; Mandal, M.; Karak, N.; Ind. Crops Prod. 2013, 44, 396. 60. Firdaus, F. E.; Mater. Sci. Eng. 2014, 58, 12023. 61. Gao, Z.; Peng, J.; Zhong, T.; Sun, J.; Wang, X.; Yue, C.; Carbohydr. Polym. 2012, 87, 2068. 62. Miao, S.; Wang, P.; Su, Z.; Zhang, S.; Acta Biomater. 2014, 10, 1692. 63. Thakur, S.; Karak, N.; Prog. Org. Coatings 2013, 76, 157. 64. Valério, A.; Araújo, P.; Sayer, C.; Polímeros 2013, 23, 451. 65. Saciloto, T. R.; Cervini, P.; Cavalheiro, É. T. G.; J. Braz. Chem. Soc. 2013, 24, 1461. 66. Madra, H.; Tantekin-Ersolmaz, B.; Guner, F. S.; Polym. Test. 2009, 28, 773. 67. Pillai, P. K. S.; Li, S.; Bouzidi, L.; Narine, S. S.; Ind. Crop. Prod. 2016, 83, 568. 68. Ismail, E. A.; Motawie, A. M.; Sadek, E. M.; Egypt. J. Pet. 2011, 20, 1. 69. Calvo-Correas, T.; Santamaria-Echart, A.; Saralegi, A.; Martin, L.; Valea, A.; Corcuera, M.; Eceiza, A.; Eur. Polym. J. 2015, 70, 173. 70. Sharmin, E.; Zafar, F.; Akram, D.; Ahmad, S.; Prog. Org. Coatings 2013, 76, 541. 71. Petrović, Z. S.; Milic, J.; Zhang, F.; Ilavsky, J.; Polymer 2017, 121, 26. 72. Dave, V. J.; Patel, H. S.; J. Saudi Chem. Soc. 2017, 21, 18. 73. Mustapa, S. R.; Aung, M. M.; Ahmad, A.; Mansor, A.; TianKhoon, L.; Electrochim. Acta 2016, 222, 293. 74. Patil, C. K.; Rajput, S.; Marathe, R.; Kulkarni, R.; Phadnis, H.; Sohn, D.; Mahulikar, P.; Gite, V.; Prog. Org. Coatings 2017,106, 87. 75. Pfister, D. P.; Xia, Y.; Larock, R. C.; ChemSusChem 2011, 4, 703. 76. Jayavani, S.; Sunanda, S.; Varghese, T. O.; Nayak, S. K.; J. Clean. Prod. 2017, 162, 795. 77. Lligadas, G.; Ronda, J. C.; Galià, M.; Cádiz, V.; Biomacromolecules 2010, 11, 2825. 78. Juita; Dlugogorski, B. Z.; Kennedy, E. M.; Mackie, J. C.; Fire Sci. Rev. 2012, 1. 79. dos Santos, D.; Tavares, L.; Batalha, G.; Journal of Achievements in Materials and Manufacturing Engineering 2012, 54, 211. 80. Luo, Z.; Shi, Y.; Zhao, D.; He, M.; Procedia Eng. 2011, 18, 37. 81. Miléo, P. C.; Mulinari, D. R.; Baptista, C. A. R. P.; Rocha, G. J. M.; Gonçalves, A. R.; Procedia Eng. 2011, 10, 2068. 82. Valero, M. F.; Gonzalez, A.; J. Elastomers Plast. 2012, 44, 433. 83. Valero-Valdivieso, M.; Ortegon, Y.; Uscategui, Y.; Dyna 2013, 80, 171. 84. Valero, M. F.; Díaz, L. E.; Quim. Nova 2014, 37, 1441. 85. Perales-Alcacio, J. L. A.; Santa-Olalla Tapia, J.; Mojica-Cardoso, C.; Vargas-Coronado, R. F.; Chan-Chan, L. H.; Headen, D. M.; García, a J.; Cervantes-Uc, J. M.; Cauich-Rodríguez, J. V.; J. Biomater. Sci. Polym. Ed. 2013, 24, 1601. 86. Uscategui, Y. L.; Díaz, L. E.; Valero, M. F.; Quim. Nova 2017, 40, 131. 87. Uscátegui, Y.; Arévalo, F.; Díaz, L.; Cobo, M.; Valero, M.; J. Biomater. Sci. Polym. Ed. 2016, 27, 1860. 88. Arevalo, F.; Uscategui, Y. L.; Diaz, L.; Cobo, M.; Valero, M. F.; J. Biomater. Appl. 2016, 31, 708. 89. Stevenson Jr., A. T.; Reese, L.; Hill, T.; McGuire, J.; Mohs, A.; Shekhar, R.; Bickford, L.; Whittington, A.; Biomaterials 2015, 54, 168. 90. Claeys, B.; Vervaeck, A.; Hillewaere, X.; Possemiers, S.; Hansen, L.; Beer, T.; Paul, J.; Vervaet, C.; Eur. J. Pharm. Biopharm. 2015, 90, 44. 91. Manikandan, A.; Mani, M. P.; Jaganathan, S. K.; Rajasekar, R.; Jagannath, M.; Polym. Test. 2017,61, 106. 92. Braun, U.; Lorenz, E.; Weimann, C.; Sturm, H.; Karimov, I.; Ettl, J.; Meier, R.; Wohlgemuth, W. A.; Berger, H.; Wildgruber, M.; J. Mech. Behav. Biomed. Mater. 2016, 64, 281. 93. Temenoff, J. S.; Mikos, A. G.; Biomaterials Pearson/Prentice Hall: Upper Saddle River, N.J., 2008. 94. Almeida Júnior, J. H. S.; Bertuol, D. A.; Meneguzzi, A.; Ferreira, C. A.; Amado, F. D. R.; Mater. Res. 2013, 16, 860. 95. Liu, X.; Niu, Y.; Chen, K. C.; Chen, S.; Mater. Sci. Eng., C 2017, 71, 289. 96. Sheikh, Z.; Khan, A. S.; Roohpour, N.; Glogauer, M.; Rehman, I. U.; Mater. Sci. Eng., C 2016, 68, 267. 97. Wang, Y. F.; Barrera, C. M.; Dauer, E. A.; Gu, W.; Andreopoulos, F.; Huang, C. Y. C.; J. Mech. Behav. Biomed. Mater. 2017, 65, 657. 98. Cozzens, D.; Wei, X.; Faust, R.; J. Polym. Sci., Part B: Polym. Phys. 2013, 51, 452. 99. He, W.; Hu, Z.; Xu, A.; Liu, R.; Yin, H.; Wang, J.; Wang, S.; Cell Biochem. Biophys. 2013, 66, 855. 100. Montini-Ballarin, F.; Abraham, G. A.; Caracciolo, P. C. Em Advances in Polyurethane Biomaterials; Cooper, S. L., Guan, J., eds.; Woodhead Publishing: Langford Lane, 2016, cap. 15. 101. Khan, W.; Muntimadugu, E.; Jaffe, M.; Domb, A. J. Em Focal Controlled Drug Delivery; Domb, A. J.; Khan, W., orgs.; Springer US, 2014, cap. 2. 102. Lin, W. C.; Yu, D. G.; Yang, M. C.; Colloids Surf., B 2005, 44, 82. 103. Simmchen, J.; Ventura, R.; Segura, J.; Transfusion Medicine Reviews 2012, 26, 27. 104. Vogels, R. R. M.; Lambertz, A.; Schuster, P.; Jockenhoevel, S.; Bouvy, N. D.; Disselhorst-Klug, C.; Neumann, U. P.; Klinge, U.; Klink, C. D.; J. Biomed. Mater. Res., Part B 2017, 105, 99. 105. Cherng, J. Y.; Hou, T. Y.; Shih, M. F.; Talsma, H.; Hennink, W. E.; Int. J. Pharm. 2013, 450, 145. 106. de Mulder, E. L. W.; Hannink, G.; Koens, M. J. W.; Löwik, D. W. P. M.; Verdonschot, N.; Buma, P.; J. Bomedical Mater. Res. P,, art A 2013, 101, 919. 107. Mandru, M.; Ciobanu, C.; Ignat, M.; Journal of Nanomaterials and Biostructures 2011, 6, 1227. 108. Mattu, C.; Pabari, R. M.; Boffito, M.; Sartori, S.; Ciardelli, G.; Ramtoola, Z.; Eur. J. Pharm. Biopharm. 2013, 85, 463. 109. Ding, M.; Qian, Z.; Wang, J.; Li, J.; Tan, H.; Gu, Q.; Fu, Q.; Polym. Chem. 2011, 2, 885. 110. Liu, C.; Zhang, Z.; Liu, K. L.; Ni, X.; Li, J.; Soft Matter 2013, 9, 787. 111. Hafeman, A. E.; Zienkiewicz, K. J.; Zachman, A. L.; Sung, H.-J.; Nanney, L. B.; Davidson, J. M.; Guelcher, S. A.; Biomaterials 2011, 32, 419. 112. Mondal, S.; Martin, D.; Polym. Degrad. Stab. 2012, 97, 1553. 113. Bil, M.; Ryszkowska, J.; Roether, J. A; Bretcanu, O.; Boccaccini, A. R.; Biomed. Mater. 2007, 2, 93. 114. Barikani, M.; Oliaei, E.; Seddiqi, H.; Honarkar, H.; Iran. Polym. J. 2014, 23, 307. 115. Kim, J.; Hollinger, J. O.; Biomed. Mater. 2012, 7, 45008. 116. Guelcher, S.; Srinivasan, A.; Dumas, J.; Biomaterials 2008, 29, 1762. 117. Guelcher, S. a; Gallagher, K. M.; Didier, J. E.; Klinedinst, D. B.; Doctor, J. S.; Goldstein, A. S.; Wilkes, G. L.; Beckman, E. J.; Hollinger, J. O.; Acta Biomater. 2005, 1, 471. 118. Das, B.; Mandal, M.; Upadhyay, A.; Chattopadhyay, P.; Karak, N.; Biomed. Mater. 2013, 8, 35003. 119. Belmonte, G.; Catanzaro-Guimaraes, S.; Polim.: Cienc. Tecnol. 2013, 23, 462. 120. Campos, E.; Cordeiro, R.; Santos, A. C.; Matos, C.; Gil, M. H.; Colloids Surf., B. 2011, 88, 477. 121. Rangel Vásquez, N.; De Alva Salazar, H.; Romero García, J.; García-Hernández, E.; Rivera Armenta, J.; Rev. Iberoam. Polímeros 2009, 10, 180. 122. Laschke, M.; Strohe, A.; Menger, M.; Alini, M.; Eglin, D. Acta Biomater. 2010, 6, 2020. 123. Baudis, S.; Nehl, F.; Ligon, S. C.; Nigisch, A.; Bergmeister, H.; Bernhard, D.; Stampfl, J.; Liska, R.; Biomed. Mater. 2011, 6, 1. 124. Baheiraei, N.; Yeganeh, H.; Ai, J.; Gharibi, R.; Azami, M.; Faghihi, F.; Mater. Sci. Eng., C 2014, 44, 24. 125. Pereira, I. H. L.; Ayres, E.; Patrício, P. S.; Góes, A. M.; Gomide, V. S.; Junior, E. P.; Oréfice, R. L.; Acta Biomater. 2010, 6, 3056. 126. Bergmann, P. A.; Tamouridis, G.; Lohmeyer, J. A.; Mauss, K. L.; Becker, B.; Knobloch, J.; Mailänder, P.; Siemers, F.; Journal of Plastic, Reconstructive & Aesthetic Surger 2014, 67, 1364. 127. De La Peña-Salcedo, J. A.; Soto-Miranda, M. A.; Lopez-Salguero, J. F.; Aesthetic Plast. Surg. 2012, 36, 331. 128. Rancati, A.; Soderini, A.; Dorr, J.; Gercovich, G.; Tessari, L.; Gonzalez, E.; J. Plast. Reconstr. Aesthetic Surg. 2013, 66, 1671. 129. Fernando, S.; McEnery, M.; Guelcher, S. A. Em Advances in Polyurethane Biomaterials; Cooper, S. L., Guan, J., eds.; Woodhead Publishing: Langford Lane, 2016, cap. 16. 130. Dumas, J. E.; Davis, T.; Holt, G. E.; Yoshii, T.; Perrien, D. S.; Nyman, J. S.; Boyce, T.; Guelcher, S. A.; Acta Biomater. 2010, 6, 2394. 131. Solanki, A.; Mehta, J.; Thakore, S.; Carbohydr. Polym. 2014, 110, 338. 132. Giannitelli, S. M.; Basoli, F.; Mozetic, P.; Piva, P.; Bartuli, F. N.; Luciani, F.; Arcuri, C.; Trombetta, M.; Rainer, A.; Licoccia, S.; Mater. Sci. Eng., C 2015, 51, 329. 133. Zhang, L.; Xiong, Z.; Shams, S. S.; Yu, R.; Huang, J.; Zhang, R.; Zhu, J.; Polymer (United Kingdom) 2015, 64, 69. 134. Mazo, P.; López, L.; Restrepo, D.; Rios, L.; Polímeros 2010, 20, 134. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access