Revisão
|
|
| Éteres difenílicos polibromados (PBDE) como contaminantes persistentes: ocorrência, comportamento no ambiente e estratégias analíticas Polybrominated diphenyl ethers (PBDE) as persistent contaminants: origin, behavior in the environment and analytical strategies |
|
Daniel L. R. AnnunciaçaoI; Fernanda V. AlmeidaI; Emerson L. Y. HaraII; Marco T. GrassiII; Fernando F. SodréI,*
I. Instituto de Química, Universidade de Brasília, Campus Darcy Ribeiro, 70910-000 Brasília – DF, Brasil Recebido em 07/12/2017 *e-mail: ffsodre@unb.br Flame retardants are substances mixed with numerous materials to inhibit the combustion process, reducing risks and damages caused by fires. Among these substances, polybrominated diphenyl ethers (PBDEs) have been widely used for decades due to their low cost and high efficiency. However, since they are mixed and not chemically bonded to the materials, PBDEs can be released over time being transported through numerous pathways until they reach soils and aquatic systems, where they can accumulate in sediments and biota. Due to their high chemical stability, an essential feature for flame retardants, they are considered persistent contaminants. Several studies report the presence of PBDEs in atmospheric and aquatic particulate matter, sediments, soils and biological matrices such as marine animals, tissues and human fluids. In Brazil, little is known about the use and commercialization of PBDEs, as well as their levels in different environmental compartments. Thus, this review provides an overview of the origin of PBDEs in the environment as well as information inherent to the understanding of the behavior and presence of this contaminants of recent interest in different environmental compartments. Finally, the manuscript also brings state-of-the-art analytical approaches used for environmental sampling, preservation, preparation and sample analysis. INTRODUÇAO Os avanços na ciência dos materiais, ocorridos nas últimas décadas, permitiram o desenvolvimento industrial de diversas classes de polímeros, com propriedades e aplicaçoes distintas. Tais produtos podem ser encontrados em grande parte dos objetos de uso cotidiano, como em peças de vestuário, equipamentos eletroeletrônicos, mobiliário, veículos, na construçao civil, entre outros. Tendo em sua grande maioria o petróleo como matéria prima, esses materiais conferem inflamabilidade aos objetos, sendo necessária a adoçao de medidas que atendam aos requisitos mínimos de segurança.1,2 Neste contexto, retardantes de chama (do inglês flame retardants – FR) sao substâncias que, ao serem misturadas a diferentes materiais, agem inibindo o processo de combustao e reduzindo riscos e danos provocados por incêndios. Dentre as mais de 175 substâncias utilizadas como FR, os éteres difenílicos polibromados (do inglês polybrominated diphenyl ethers - PBDE) têm sido amplamente utilizados desde a década de 1960, em virtude de seu baixo custo e elevada eficiência.1,3,4 Contudo, por serem aditivos misturados aos materiais e nao quimicamente ligados,5 os PBDE podem ser liberados com a açao do tempo, contaminando a poeira acumulada sobre objetos e o material particulado atmosférico, tanto em ambientes abertos quanto confinados.6,7 Em funçao de inúmeros processos, tanto antropogênicos quanto naturais, os PBDE podem surgir em ambientes aquáticos onde irao sedimentar e/ou acumular na biota.8,9 Como apresentam elevada estabilidade química, característica essencial dos FR, os PBDE sao considerados contaminantes ambientais persistentes, sendo que alguns de seus congêneres foram incluídos na lista de Poluentes Orgânicos Persistentes (POP) da Convençao de Estocolmo.10,11 Vários estudos já investigaram a presença dos PBDE em materiais particulados atmosféricos6,12 e aquáticos,13,14 no sedimento aquático14–17 e em solos.15,18 Além disso, esses compostos também foram identificados em animais marinhos,19,20 em sangue21–24 e tecidos humanos,25–27 assim como em leite materno humano.28,29 Estudos toxicológicos sugerem que a exposiçao humana aos PBDE pode estar acompanhada de alteraçoes imunológicas, hepatotóxicas e neurotóxicas, bem como de açao interferente endócrina.29–32 No Brasil pouco se sabe sobre a utilizaçao dos PBDE, bem como sobre seus níveis ambientais. Sabe-se, porém, que os principais processos de contaminaçao em regioes urbanas de todo o mundo estao intimamente associados ao aporte de esgoto bruto, ao descarte de efluentes de estaçoes de tratamento de esgoto (ETE) e ao uso de lodos de esgoto para fins de reciclagem agrícola.33,34 Nesse contexto, esta revisao analisa de forma crítica e abrangente a literatura recente sobre a presença e a distribuiçao de PBDE no ambiente, bem como os métodos de determinaçao em diferentes compartimentos e matrizes ambientais. Além disso, para essa finalidade, buscou-se discutir o estado da arte das formas de coleta das amostras, das técnicas de extraçao, estratégias de limpeza das amostras e análise. É importante destacar, no entanto, que os dados apresentados sao de pesquisas conduzidas majoritariamente fora do Brasil, uma vez que ainda sao escassos os dados sobre esses compostos em âmbito nacional. Nao obstante, espera-se que a partir desse trabalho haja um incremento no interesse sobre o tema, com a realizaçao de novos estudos, tanto em grupos individuais quanto em rede, tendo em vista que a ubiquidade dos PBDE nos ecossistemas é uma questao preocupante, especialmente em nosso país, que apresenta uma grande deficiência na questao do saneamento básico.
ORIGEM E USO DOS PBDE PBDE sao substâncias orgânicas halogenadas cujas estruturas apresentam um átomo de oxigênio de uma funçao éter ligado a dois grupos fenil. Na estrutura mostrada na Figura 1, nota-se a existência de 10 posiçoes disponíveis nos dois anéis aromáticos que podem ser ocupadas por 1 a 10 átomos de bromo. A variaçao do número de átomos de bromo, bem como suas posiçoes nos anéis, faz com que seja possível a formaçao de 209 congêneres (Tabela 1S do Material Suplementar), embora apenas alguns sejam estáveis e comercialmente relevantes.35 Para facilitar a identificaçao, os 209 congêneres sao diferenciados de acordo com o sistema desenvolvido por Ballschmiter e Zell,36 que segue as regras da IUPAC para caracterizaçao de substituintes em anéis bifenílicos. O sistema Ballschmiter-Zell também é usado para dar nome a outro importante grupo de contaminantes ambientais persistentes, as bifenilas policloradas (do inglês, polychlorinated biphenyls – PCB) (Figura 1). Neste sistema de nomenclatura, cada congênere é precedido do acrônimo BDE e numerado de 1 a 209 em funçao da quantidade de átomos de bromo e de suas posiçoes nos anéis.37 Por exemplo, o PBDE decabromado é designado como BDE-209 (Tabela 2S do Material Suplementar).
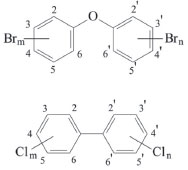 Figura 1. Estruturas básicas do PBDE e PCB. Para ambas as classes m + n = 1 a 10
A açao dos PBDE como retardantes de chama se dá pela liberaçao de radicais bromo durante o processo de combustao que é comumente dividido em etapas de aquecimento, pirólise, igniçao, combustao/propagaçao e extinçao.38 Durante a pirólise ocorre decomposiçao térmica dos PBDE resultando na homólise das ligaçoes R – Br com a consequente liberaçao de radicais bromo capazes de reagir com ligaçoes R – H, abstraindo o hidrogênio para formaçao do brometo de hidrogênio. Na etapa de combustao/propagaçao o ácido formado reage com outros radicais altamente reativos formados durante a etapa de pirólise, tais como o H• e o HO• (equaçoes 1 e 2). 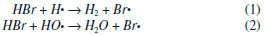 Durante a combustao, o ácido bromídrico irá competir com o oxigênio por radicais livres de forma que seja minimizada a ocorrência de reaçoes exotérmicas. Como consequência, o sistema é resfriado, reduzindo a fase gasosa e inibindo a combustao. Os radicais Br• gerados como produto das reaçoes 1 e 2 podem regenerar o ácido bromídrico dando sequência a novas reaçoes radicalares que culminarao com a etapa de extinçao38 A principal rota sintética dos PBDE na indústria baseia-se na bromaçao do difenil éter com excesso de Br2 utilizando o catalisador de Friedel-Craft conforme a reaçao apresentada na Figura 2.39,40 A mistura dos reagentes é realizada à vácuo sob agitaçao, com temperatura inicial de 30 °C por 1 a 2 h, sendo que a taxa de bromaçao é verificada pela liberaçao de HBr. Após a bromaçao, a temperatura é aumentada para 40 °C e mantida por mais 4 h. A obtençao do produto final ainda está condicionada a etapas de lavagem, filtraçao, secagem, moagem e empacotamento. Apesar de ser um processo de produçao relativamente simples e barato, ao longo de todas as etapas sao perdidos cerca de 60 kg t-1.39
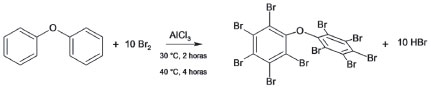 Figura 2. Reaçao simplificada para síntese do BDE-209 a partir da bromaçao do difenil éter
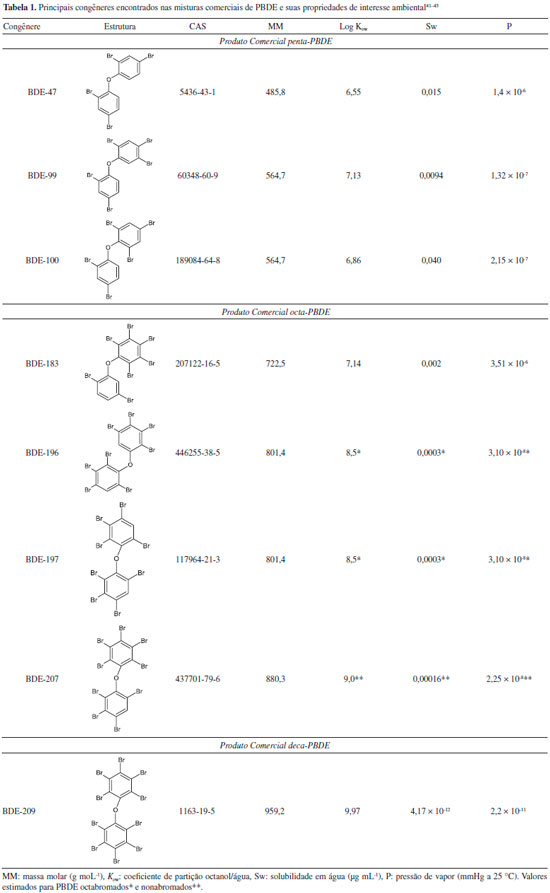
Existem três formulaçoes comerciais de PBDE denominadas penta-BDE, octa-BDE e deca-BDE que contêm misturas de diferentes congêneres com diferentes propriedades, conforme pode ser visto na Tabela 1.
O penta-BDE possui maiores percentuais dos congêneres BDE-47, -99 e -100, pois é utilizado em espumas de poliuretano, mobiliários, materiais isolantes e têxteis, com demanda mundial estimada de aproximadamente 7500 toneladas em 2006.1,41,44 A formulaçao octa-BDE, com demanda mundial em 2006 de cerca de 3790 toneladas, é encontrada em computadores, eletrodomésticos, telefones e peças automotivas. Os congêneres mais prevalentes sao o BDE-183, -196, -197 e -207. O produto comercial deca-BDE apresentou o maior consumo mundial em 2006, com mais de 56000 toneladas comercializadas. É majoritariamente formado pelo BDE-209 (99%) com traços de outros congêneres. É encontrado em materiais sintéticos, resinas de poliéster, poliolefinas, materiais têxteis e carcaças de equipamentos eletroeletrônicos.1,41,44 No Brasil, nao existem registros sobre a produçao de FR contendo PBDE, uma vez que a aquisiçao desses compostos ocorre principalmente por meio de importaçao. Segundo o Ministério do Desenvolvimento, Indústria e Comércio Exterior (MDIC),45 entre os anos de 1989 e 1996 foram importadas 1010 toneladas do produto classificado como "éter decabromo difenílino", provavelmente o deca-BDE. Entretanto, após esse período, o produto foi reclassificado como "outros éteres aromáticos", nao sendo possível definir os dados de importaçao de 1997 até os dias atuais. Embora os registros do MDIC nao contenham dados dos produtos penta-BDE e octa-BDE, grandes quantidades de bens de consumo podem ter sido importadas contendo esses produtos comerciais como FR, tornando cada vez mais complexa a tarefa de inventariar o uso de PBDE no país. Somando-se a isso, ao ser signatário da Convençao de Estocolmo,46 o Brasil proibiu a utilizaçao de FR contendo PBDE, embora ainda sejam inexistentes quaisquer tipos de açoes voltadas ao controle da produçao, importaçao, exportaçao e uso destas substâncias.
PROPRIEDADES DE RELEVANCIA AMBIENTAL Aspectos tais como transporte, destino e comportamento de substâncias químicas no ambiente podem ser previstos conhecendo-se tanto as características do compartimento ambiental investigado quanto algumas propriedades físico-químicas inerentes às substâncias químicas, tais como pressao de vapor, solubilidade em água e coeficiente de partiçao octanol/água (Kow).47 Estas propriedades sao mostradas nas Tabelas 1, 2 e 3 para os principais congêneres dos três produtos comerciais disponíveis. Congêneres com valores elevados de Log Kow sao muito hidrofóbicos, com tendência a serem acumulados junto a matéria orgânica biótica e abiótica, além de partículas, solos e sedimentos. Valores próximos a 6, por exemplo, implicam em concentraçoes cerca de 1.000.000 de vezes maiores no octanol, solvente anfifílico utilizado para mimetizar a matéria orgânica, em comparaçao à fase aquosa. Nas Tabelas 1 a 3, é possível observar valores que variam entre 6,55 (BDE-47) e 9,99 (BDE-209). Consequentemente, a elevada repulsao a ambientes aquosos implica em baixos valores de solubilidade em água, de 1,5 × 10-2 (BDE-47) a 4,17 × 10-12 µg mL-1 (BDE-209).40,48 Os PBDE mais relevantes sob o ponto de vista comercial apresentam pressao de vapor variando entre 2,21 × 10-11 (BDE-209) a 1,4 × 10-6 mmHg (BDE-47).40,42 As baixas solubilidade e volatilidade dos PBDE resultam em elevado acúmulo no ambiente. Assim, o transporte destes contaminantes entre compartimentos ambientais torna-se notadamente dependente do grau de associaçao junto ao material particulado, seja ele atmosférico ou aquático.9,12,40,48–51 Com efeito, os PBDE adsorvidos nas partículas, ao serem transportados, se distribuem em solos, permanecem em suspensao nos corpos de água e, eventualmente, tendem a acumular no sedimento de fundo. Suas propriedades hidrofóbicas também representam maior facilidade à bioconcentraçao e bioacumulaçao, tornando-os persistentes e ao mesmo tempo móveis junto à cadeia trófica.48–51 Por sua vez, a estabilidade química dos PBDE é outro fator preponderante, pois ao serem distribuídos nos diversos compartimentos ambientais, persistem em virtude da baixa susceptibilidade às reaçoes de degradaçao. Essas reaçoes só ocorrerao a menos que seja obtida energia necessária para homólise das ligaçoes entre os átomos de bromo e carbono (280 kJ mol-1). Logo, isto será possível mediante uma fonte de aquecimento, como ocorre nas situaçoes de combustao, ou irradiaçao de luz.52 Alguns estudos sugerem reaçoes de desbromaçao redutiva mediadas por fotólise ou por micro-organismos anaeróbicos, nas quais PBDE superiores sofrem desalogenaçao para espécies inferiores com menores níveis de bromaçao.53–55 Em suma, com essas observaçoes é possível prever que os PBDE estao sujeitos a serem transportados por longas distâncias, sendo distribuídos em diversos compartimentos onde podem persistir e/ou bioacumular. Essas informaçoes demonstram a importância de estudos fundamentados na distribuiçao e comportamento de PBDE no ambiente, haja vista que tais aspectos ainda nao estao completamente elucidados.56
PRESENÇA E COMPORTAMENTO NO AMBIENTE Mesmo diante da carência de um panorama global sobre a distribuiçao dos PBDE no ambiente, sua presença tem sido confirmada há décadas em várias matrizes de interesse ambiental ao redor do planeta. A Figura 3 mostra as principais rotas de distribuiçao dos PBDE em diferentes compartimentos ambientais.
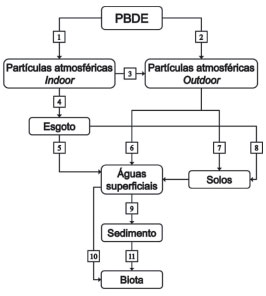 Figura 3. Principais rotas de aporte (1 a 11) e distribuiçao dos PBDE no ambiente
Considerando que os PBDE sao aditivos misturados aos bens de consumo, o esquema da Figura 3 foi simplificado para abordar a ocorrência destes contaminantes em ambientes urbanos, onde o uso de materiais contendo FR é mais significativo. As rotas 1 e 2 mostram a liberaçao destes contaminantes com o consequente enriquecimento de materiais particulados orgânicos e inorgânicos que compoe os aerossóis atmosféricos. Em ambientes confinados, como escritórios e residências, os PBDE podem ser liberados da mistura polimérica enriquecendo a poeira que se acumula sobre os materiais (rota 1). Assim, ao interagir com as partículas de poeira, irao se acumular no material particulado indoor sendo continuamente depositados sobre superfícies e ressuspendidos. A presença de PBDE no material particulado de atmosferas confinadas foi investigada durante dois anos por Harrad et al.12 em ambientes fechados de Birmingham, na Inglaterra. Os autores verificaram maiores concentraçoes médias no interior de veículos (709 pg m-3), seguido de escritórios (166 pg m-3), pequenos espaços públicos (112 pg m-3) e residências (52 pg m-3).12 Neste estudo, os BDE-47 e -99 foram os congêneres mais prevalentes nas amostras investigadas. Em um trabalho semelhante realizado na Suécia, Björklund et al.6 obtiveram resultados de até 92 pg m-3 de PBDE totais (10 congêneres) no material particulado de residências, enquanto que em creches e escritórios observaram níveis significativamente mais elevados de até 4700 e 1200 pg m-3, respectivamente. Os autores também analisaram as saídas dos sistemas de ventilaçao dos ambientes no intuito de identificar o transporte de PBDE para ambientes externos (rota 3) e observaram concentraçoes médias de 93, 660 e 3700 pg m-3, nos sistemas de ventilaçao de residências, creches e escritórios, respectivamente.6 Kang et al.7 coletaram e analisaram amostras da poeira acumulada em filtros de aparelhos de ar condicionado de vários prédios públicos. Em todas as amostras foram detectados 21 congêneres de PBDE, sendo que o valor obtido para o somatório destes congêneres (Σ21PBDE) foi de 5620 ng g-1 em escritórios, 4780 ng g-1 em escolas, 7230 ng g-1 em centros comerciais, 4940 ng g-1 em hospitais e 14400 ng g-1 em indústrias eletrônicas. Stasinska et al.21 coletaram a poeira de 30 residências urbanas e rurais da Austrália com aspirador doméstico a fim de avaliar a possível presença de 32 congêneres e observaram que sete deles apresentaram maiores concentraçoes, especialmente nas casas da regiao urbana. O somatório Σ32PBDE variou de 60,4 ng g-1 a 82400 ng g-1. Embora os vários trabalhos evidenciem a importância da contaminaçao ambiental proveniente de bens de consumo contendo PBDE, a liberaçao destes contaminantes para atmosferas externas (rota 2) também pode ocorrer de maneira pontual, ou seja, a partir de perdas durante sua produçao e uso em ambientes industriais, conforme mencionado anteriormente.57,58 Uma vez acumulados no material particulado atmosférico, os PBDE podem atingir longas distâncias em funçao da movimentaçao das massas de ar. Möller et al.,13 por exemplo, identificaram os congêneres BDE-28, -47, -66, -85, -99, -100, -153, -154, -183 e -209 em amostras de ar e de material particulado atmosférico em regioes distantes como as do mar da Groenlândia Oriental. As concentraçoes foram significativamente menores que as encontradas em atmosferas confinadas variando entre 0,06 e 1,6 pg m-3 no ar e entre 0,03 e 0,46 pg m-3 no material particulado atmosférico.6,12 Dentre os congêneres estudados, os BDE-47, -99 e -100, prevalentes do produto comercial penta-PBDE, representaram 89% do total quantificado. O transporte dos PBDE na atmosfera pode levar também à contaminaçao de solos (rota 7). Parolini et al.59 investigaram amostras de solos em pastagens localizadas na regiao dos Alpes italianos e identificaram os congêneres BDE-47, -99, -100 e -183, sob níveis médios de 0,71 ng g-1. Nesta regiao, longe de centros urbanos e industriais, a presença dos PBDE foi atribuída à elevada estabilidade química e hidrofobicidade dos congêneres, que mantiveram suas principais propriedades durante o processo de transporte. Os autores concluíram também que ocorria maior prevalência de PBDE em solos contendo maiores teores de carbono orgânico.59 Wang et al.15 determinaram PBDE em amostras de solo da província de Zhejiang, na China, uma regiao caracterizada pela presença de indústrias de reciclagem de resíduos eletrônicos. As concentraçoes médias de BDE-209 foram elevadas, atingindo níveis de até 58 µg g-1. Segundo os autores, tais níveis de concentraçao foram similares aos da poeira coletada no piso das oficinas de reciclagem de eletrônicos, cujos valores variaram de 5,5 a 80 µg g-1.15 Luo et al.60 investigaram solos em rodovias próximas a algumas das 1300 usinas de reciclagem de produtos eletrônicos presentes na regiao de Longtang, na China e detectaram PBDE em 97% das amostras sendo que a concentraçao de Σ21PBDE variou entre 121,7 a 3159 ng g-1 em funçao das atividades intensas de descarte e reaproveitamento de produtos eletrônicos que contribuíam para o espalhamento dos compostos por via aérea. Da mesma forma, o material particulado atmosférico contendo PBDE também pode se depositar sobre ambientes aquáticos naturais (rota 6), conforme confirmado por Möller et al.,13 que também evidenciaram a presença de PBDE em amostras de águas do mar da Groelândia Oriental. Os autores observaram concentraçoes de PBDE entre 0,03 e 0,64 pg L-1, com prevalência dos congêneres BDE-47 e -99, corroborando a capacidade do material particulado atmosférico em transportar essas substâncias para regioes remotas do planeta. Kirchgeorg et al.61 investigaram a presença de PBDE nos Alpes italianos e detectaram oito congêneres de PBDE na faixa de 0,4 a 43,5 ng L-1. Com base nos dados de Σ8PBDE, os autores calcularam um acúmulo mensal entre 5 e 316 ng m-2, sendo que amostras coletadas durante a primavera e o verao apresentaram maiores níveis de concentraçao devido às correntes atmosféricas convectivas que, nestas épocas, sao capazes de transportar poluentes provenientes de regioes de menor altitude, altamente povoadas e industrializadas. De um modo geral, poucos estudos foram realizados para determinaçao de PBDE em águas, afinal, a baixa solubilidade destes contaminantes limita seu enriquecimento no meio aquoso. Além disso, sao esperados níveis de concentraçao bastante baixos, o que confere uma gama de fatores limitantes à obtençao de resultados confiáveis sob o ponto de vista analítico. Parte dos trabalhos com este intuito foi realizada em regioes próximas a complexos industriais, tal qual o trabalho desenvolvido por Moon et al.14 no lago artificial Shihwa, na Coréia do Sul. A concentraçao de Σ23PBDE nas amostras de água variou na faixa de 0,16 a 11 ng L-1, enquanto que amostras de sedimento, coletadas nos mesmos pontos, apresentaram concentraçoes significativamente maiores, na faixa de 1,3 a 18700 ng g-1, em funçao do caráter hidrofóbico dos PBDE que tendem a adsorver no material particulado aquático. A maior parte dos trabalhos envolvendo a presença de PBDE em ambientes aquáticos é realizada em regioes que sofrem influência direta da urbanizaçao. Neste contexto, muitas evidencias indicam que os PBDE atingem ambientes aquáticos por meio do lançamento de esgoto, seja ele bruto ou tratado.62,63 Neste caso, acredita-se que a presença de PBDE nas águas residuárias urbanas será influenciada por uma sequência de processos comuns em ambientes domésticos, comerciais e até mesmo industriais. Nestes ambientes, a limpeza das superfícies faz com que partículas de poeira sejam transferidas para as águas de lavagem, permanecendo na forma de partículas suspensas em um meio aquoso. Após a limpeza destes ambientes, a água de lavagem poderá ser eliminada tanto via ralos, atingindo sistemas pluviais ou de esgotamento sanitários (rota 4), quanto por meio de bueiros, atingindo redes de escoamento pluvial. Ao serem eliminados junto às águas residuárias, os PBDE podem atingir ambientes aquáticos de forma direta ou ainda a partir de efluentes de estaçoes de tratamento de esgotos (ETE), caso os processos operantes em tais estaçoes nao sejam suficientes para a remoçao destes contaminantes. Ambos os processos de contaminaçao de águas sao representados pela rota 7. A presença de PBDE em efluentes de ETE foi investigada por Xiang et al.,62 que observaram níveis de 1,68 a 4,64 ng L-1 de diferentes congêneres em Xangai, na China. Da mesma forma, Deng et al.,63 ao investigarem a presença de PBDE em quatro ETE de Hong Kong, evidenciaram que entre 52 a 80% dos congêneres permaneceram no efluente final, sendo posteriormente lançados aos corpos aquáticos receptores. Os autores também sugeriram que, durante o tratamento, entre 21 e 45% dos PBDE foram acumulados no lodo do esgoto.63 Gaylor et al.64 investigaram a presença de PBDE no lodo de esgoto utilizado em solos agricultáveis e detectaram cinco dos 11 PBDE selecionados no estudo sob concentraçao total de 17600 µg kg-1. Vários estudos têm evidenciado a contaminaçao de solos à partir da reciclagem agrícola do lodo de esgoto (rota 8).65–68 Segundo Kim et al.,66 o uso de lodo de esgoto ao longo de anos é capaz de aumentar de uma a duas ordens de magnitude a concentraçao de PBDE em solos em relaçao aos níveis iniciais. A contaminaçao de plantas e de águas subterrâneas em regioes que receberam lodo de esgoto também foi reportada recentemente.69,70 Em funçao de sua elevada afinidade a meios hidrofóbicos, os PBDE irao se acumular na biota aquática (rota 10), nos sólidos em suspensao e, invariavelmente, no sedimento de fundo (rota 9). A presença dos PBDE na biota foi verificada por Yu et al.71 entre os anos de 2005 a 2007, no estuário do Rio das Pérolas na China, demonstrando o potencial de biomagnificaçao de PBDE em quatro espécies de invertebrados e em dez espécies de peixes. Também na China, Gao et al.72 detectaram a presença desses poluentes em 16 espécies, dentre peixes, caranguejos e camaroes, no delta do Rio Yangtze. Sedimentos marinhos e de água doce têm sido extensivamente investigados na literatura com relaçao à presença de PBDE. Sao formados de partículas de matéria orgânica e inorgânica de diferentes tamanhos, que se acumulam de forma nao consolidada nos leitos de lagos, rios, represas, áreas alagáveis e oceanos. Em geral, esse material tem o ambiente terrestre como origem, onde partículas de solos se desprendem e sao transportados como material particulado, depositando nos corpos hídricos e formando camadas sedimentares em diferentes áreas de acordo com suas propriedades. Entretanto, existem outras fontes capazes de contribuir para a formaçao de sedimentos, tais como sólidos presentes em águas de drenagem, águas residuárias e efluentes industriais. Em funçao de suas propriedades, sedimentos sao considerados o sumidouro de uma grande variedade de poluentes persistentes e detritos biológicos e/ou químicos. O acúmulo e a disponibilidade de espécies químicas para a cadeia alimentar aquática sao objetos de preocupaçao, uma vez que inúmeros organismos aquáticos passam grande parte de seus ciclos de vida em contato com o sedimento ou ali vivendo. Por estes motivos, sedimentos desempenham um importante papel na caracterizaçao de ambientes aquáticos.73–76 Vários estudos evidenciam altas concentraçoes de PBDE em sedimentos aquáticos em regioes sob influência de pontos de descarga de águas residuárias e de efluentes de ETE. Dentre essas regioes, podem ser citadas a Baia de Sao Francisco nos EUA, onde os autores detectaram PBDE em todas as 122 amostras de sedimento coletadas e calcularam uma concentraçao média de 4,3 ng g-1 para Σ13PBDE,16 enquanto que na China foi encontrado o valor médio de 5,21 ng g-1 para Σ25PBDE calculado à partir de 28 amostras de sedimentos coletadas no Lago Taihu.77 No Rio Niágara, entre os EUA e Canadá, os níveis de Σ9PBDE no sedimento variaram entre 1,10 e 148,0 ng g-1.49 No Lago Shihwa, na Coréia do Sul, a concentraçao para Σ23PBDE no sedimento variou entre 1,3 ng g-1 e 18700 ng g-1.14 O trabalho realizado por Gao et al.72 no delta do Rio Yangtze permitiu correlacionar as concentraçoes de PBDE em sedimentos com aquelas determinadas em espécies da biota aquática, evidenciando padroes similares de acúmulo de PBDE nas amostras. Segundo os autores, sedimentos enriquecidos com PBDE podem ser uma importante fonte de contaminaçao de organismos aquáticos.72 Outros estudos também têm confirmado o papel dos sedimentos aquáticos na disponibilidade de contaminantes para cadeias tróficas aquáticas, notadamente na comunidade bêntica.78–81 Na Figura 3, esses processos, representados pela rota 11, sao mediados por organismos menores que compoem essa cadeia como crustáceos, moluscos, vermes, insetos e outros. Por fim, embora os estudos na literatura demonstrem ubiquidade dos PBDE no ambiente, informaçoes sobre esses contaminantes no Brasil ainda sao restritas aos poucos estudos voltados à contaminaçao da biota aquática em regioes afetadas pela urbanizaçao e industrializaçao. Dentre estes estudos, destacam-se aqueles envolvidos com a presença de PBDE em cetáceos e peixes tanto marinhos82–85 quanto de água doce.86 Mais recentemente, um estudo realizado com amostras do Lago Paranoá, no Distrito Federal, revelou níveis de 2,51 ng g-1 para o BDE-47 e 8,1 ng g-1 para o BDE-66.87 PBDE também foram identificados em sedimentos de regioes de recarga do aquífero Guarani na cidade de Ribeirao Preto, em Sao Paulo.88
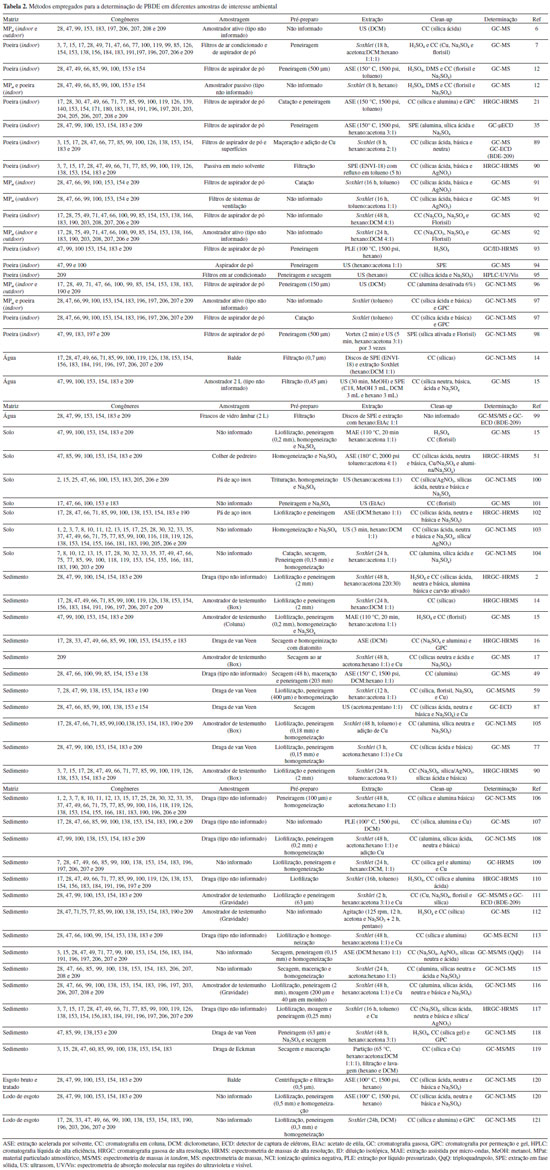
DETERMINAÇAO DE PBDE EM MATRIZES AMBIENTAIS A determinaçao das concentraçoes de PBDE em matrizes de interesse ambiental envolve o estabelecimento de etapas de amostragem, preparo de amostras e determinaçao analítica. Tendo-se em vista que um resultado analítico é o maior balizador em tomadas de decisao, em especial nas questoes ambientais, todas estas etapas devem ser sujeitas a protocolos baseados em critérios de controle/garantia de qualidade. A Tabela 2 traz um compêndio dos principais métodos empregados para análise de diferentes tipos de amostras visando a determinaçao de congêneres de PBDE.
Amostragem e preservaçao A etapa de amostragem é a que possui maiores especificidades em relaçao ao tipo de matriz que será objeto de estudo, enquanto que nas etapas subsequentes, os métodos guardam certa similaridade. A coleta de amostras de material particulado atmosférico é comumente realizada de forma acumulada empregando-se diferentes modelos de amostradores ativos ou passivos. A amostragem acumulada é preferível em funçao das baixas concentraçoes de PBDE geralmente encontradas no ar (ng m-3 a pg m-3). Tanto na amostragem passiva quanto na ativa sao empregados filtros e adsorventes sólidos para coleta dos analitos nas fases gasosa e/ou do material particulado.32,63,91,122,123 Alguns trabalhos aproveitam os sistemas de ar condicionado para recolher nos seus filtros amostras de material particulado atmosférico, sendo entao possível estimar a concentraçao de PBDE no interior de ambientes e analisar a exposiçao de humanos a esses contaminantes.7,123–126 Outra alternativa vem sendo a utilizaçao de aparelhos aspiradores de pó para coleta de amostras de poeira depositadas sobre a superfície de objetos no interior de residências,21,91,93,96 escritórios,89,92 creches,6 automóveis e pequenos espaços públicos.12 Para a determinaçao de PBDE em amostras de água, os métodos de amostragem reportados na literatura sao os mesmos comumente utilizados para a determinaçao de compostos orgânicos em ambientes aquáticos. Ou seja, sao empregadas garrafas de amostragem, como as do tipo Hale e Van Dorn,15 bem como frascos de vidro do tipo âmbar.99 Moon et al.14 fizeram o uso de baldes presos a cordas para amostragem instantânea (grab sampling) de águas superficiais do Lago Shihwa, na Coréia. Essa prática permite, juntamente com o uso de amostradores do tipo Swing, a coleta em ambientes com acesso limitado, onde a pessoa responsável precisa alcançar distâncias onde nao é possível o controle da abertura e fechamento de frascos. Outro aspecto importante é que o uso de baldes permite a coleta de grandes volumes de amostra, haja vista a baixa concentraçao dos analitos nessa matriz. Amostras de gelo também têm sido objeto de interesse para determinaçao de PBDE, conforme mostraram Kirchgeorg et al.,61 que coletaram testemunhos de gelo com 10 m de profundidade e 10 cm de largura durante diferentes estaçoes do ano com o auxílio de uma broca manual. As amostras permaneceram congeladas até chegarem ao laboratório e foram mantidas a temperatura ambiente apenas momentos antes do preparo. A coleta de solos tem sido executada tanto com ferramentas usuais como pás e espátulas de aço, quanto com materiais específicos como amostradores tubulares e trados equipados com diferentes tipos de brocas, tais como rosca, holandês, caneco e meia-lua.51,100–102,104 Enxadas, pás de jardinagem e sondas sao também perfeitamente utilizáveis nessa etapa.64,74 Nesse sentido, Luo et al.60 utilizaram uma espátula metálica para coletar amostras de solo em rodovias próximas a algumas das 1300 usinas de reciclagem de produtos eletrônicos da regiao de Longtang na China. As amostras foram embaladas em papel alumínio e seladas em sacos de polietileno e, em seguida, armazenadas a -20° C até a análise. Para sedimentos aquáticos, a amostragem tem sido realizada através do emprego de diversos modelos de dragas.2,15,59,90,105,113,116,117 Esses equipamentos permitem uma amostragem representativa de diferentes tipos de sedimento, coletando grandes volumes de amostra em variadas profundidades. Parolini et al.59 coletaram amostras de sedimento da lagoa de Veneza, na Itália, com o auxílio de uma draga de van Veen e foram capazes de retirar um volume médio de 120 cm3 de material a partir dos primeiros 5 cm da superfície do leito. Por sua vez, Liu et al.113 utilizaram um amostrador de fundo de aço inoxidável para coletar amostras de sedimento em nove regioes distintas da costa sul da China e determinar treze PBDE. Os amostradores foram posicionados para retirada dos cinco primeiros centímetros de sedimento de forma que os autores pudessem avaliar se a deposiçao dos PBDE nas águas oceânicas estava relacionada ao seu transporte pelo ar atmosférico e pelos rios em uma regiao com grande quantidade de indústrias que utilizam FR nos produtos. Preparo de amostras Para amostras sólidas, o preparo envolve, geralmente, o estabelecimento de etapas de secagem, extraçao de analitos e remoçao de interferentes (clean-up). A etapa inicial de secagem de amostras em filtros contendo material particulado atmosférico objetiva a remoçao de água acumulada na forma de vapor. Em amostras de solo o conteúdo de água, atribuído à soluçao do solo, pode ser maior enquanto que em amostras de sedimento a quantidade de água pode ser bastante elevada, sendo necessário o uso de sistemas mais robustos de secagem. Geralmente sao usados sistemas liofilizadores,14,15,90,108 estufas de secagem com circulaçao de ar ou capelas de exaustao,21,49,95 bem como de agentes dessecantes como o sulfato de sódio anidro.16,51,100 Após a secagem, é necessária ainda a remoçao das impurezas sólidas, tais como pedras, folhas, galhos e raízes, além da reduçao do tamanho das partículas por trituraçao e/ou peneiraçao. Para a extraçao de PBDE em amostras sólidas sao empregadas diferentes técnicas, porém a maioria baseia-se na partiçao tipo sólido-líquido. As técnicas utilizadas envolvem a extraçao Soxhlet, o uso de ultrassom, extraçao assistida por micro-ondas e extraçao com solvente em sistemas pressurizados. A extraçao Soxhlet é a mais comum, principalmente por sua grande eficiência na extraçao em matrizes complexas como os sedimentos, tendo a Agência de Proteçao Ambiental dos Estados Unidos (Environmental Protection Agency – US EPA) adotado como um dos seus métodos padrao para determinaçao de PBDE em matrizes como solos, sedimentos e tecidos bióticos.127 Os tempos de extraçao variam de 8 a 48 horas com misturas de solventes polares e apolares em proporçoes distintas.17,89,91,92,104,109 Trata-se de um método de grande eficiência por permitir percentuais elevados de recuperaçao do analito, mas, em contrapartida, necessita de longos períodos de extraçao, além da necessidade de grandes quantidades de amostra (>200 g), misturas de solventes (>200 mL) e energia elétrica. Desta forma, sao geradas quantidades excessivas de resíduos de solventes orgânicos tóxicos, haja vista que, nas etapas subsequentes, haverá necessidade de concentraçao dos extratos, principalmente por evaporaçao.128,129 Contudo, recentemente, tem sido crescente a demanda e a substituiçao das técnicas atuais por outras que sejam concomitantemente eficientes e ambientalmente amigáveis.95,101 Outro método, também recomendado pela EPA, baseia-se no uso de ultrassom, mas apenas para compostos orgânicos de baixa volatilidade em amostras como solos e lodos.130 O princípio baseia-se na sonicaçao em um solvente na qual a amostra estará imersa, sendo que, sob açao de ondas de baixa frequência, ocorrerá o fenômeno da cavitaçao, ou seja, formaçao de bolhas de alta pressao que difundem o solvente no interior da amostra e elevam a temperatura do solvente aumentando a solubilidade do analito.131 Em geral, sao utilizadas pequenas quantidades de amostra (<5,0 g) e baixos volumes de solventes (<50 mL) com sonicaçao durante poucos minutos, sendo o extrato, em seguida, separado da amostra por centrifugaçao.87,98,132 O procedimento é repetido com nova adiçao de solvente obtendo-se, ao final, um extrato acumulado. A instrumentaçao consiste no emprego de sondas95 ou mesmo equipamentos mais simples e baratos como banhos ultrassônicos.6,101 A utilizaçao desses equipamentos permite que a extraçao seja realizada de forma simples, em períodos relativamente curtos (<30 min) e com baixos volumes de solventes. Já a extraçao assistida por micro-ondas (Microwave-Assisted Extraction - MAE) emprega a energia dessas radiaçoes eletromagnéticas para gerar a rotaçao e movimento desorganizado de moléculas com dipolo permanente, levando ao aquecimento do solvente que se difunde na amostra e solubiliza os analitos. Eventualmente, nao é possível a utilizaçao de apenas um alcano puro como solvente de extraçao, sendo necessária a composiçao de uma mistura com solventes mais polares.133,134 Na extraçao acelerada por solvente (Accelerated Solvent Extraction - ASE), também conhecida como extraçao por líquido pressurizado (Pressurized Liquid Extraction - PLE), o procedimento é realizado utilizando solventes em temperaturas (50 a 200 °C) e pressoes (10 a 15 MPa) elevadas, permanecendo este ainda no estado líquido. Essas condiçoes favorecem a quebra das interaçoes entre a matriz e o analito, que pode ser assim solubilizado no solvente de extraçao. Como vantagens sobre os outros métodos se tem a economia de tempo (≈ 20 min), uso de solvente (< 15 mL) e eficiência na recuperaçao dos analitos. No entanto, a utilizaçao dessa técnica esbarra nos elevados custos de aquisiçao dos equipamentos 133,134 Este método tem sido empregado para análise de diversas matrizes como material particulado atmosférico,35 poeira,12,21,93 solos51,102 e sedimentos aquáticos.16,49,107 Para as extraçoes de PBDE em amostras aquosas é reportado o emprego de cartuchos de extraçao em fase sólida (Solid Phase Extraction - SPE), empregando-se, geralmente, fase sorvente à base de C18 (octadecil). Após passagem da amostra pelo cartucho, os analitos sao eluídos com misturas de solventes polar e apolar.14,15,99 Cartuchos SPE e colunas empacotadas também têm sido empregadas para a limpeza de extratos. Após a aplicaçao de diferentes métodos de extraçao, os analitos estarao solubilizados em um solvente mais apropriado, porém, outras substâncias interferentes também poderao ser encontradas no extrato resultante. Assim, torna-se necessária a remoçao destes interferentes que poderao prejudicar a detecçao dos congêneres de PBDE a depender do método empregado para a identificaçao e quantificaçao dos mesmos. Essa etapa de clean-up tem sido realizada empregando-se fases sólidas como sílica neutra, sílica ácida e sílica básica, alumina, nitrato de prata, florisil, sulfato de sódio anidro, cobre metálico, entre outros.16,35,73,87,99,135 Determinaçao analítica Por se tratar de contaminantes ambientais que se distribuem em diferentes compartimentos ambientais e sob baixos níveis de concentraçao, a determinaçao dos PBDE exige técnicas instrumentais capazes de separar, identificar e quantificar os analitos com elevada detectabilidade e precisao. A principal técnica de separaçao consiste no uso de equipamentos de cromatografia gasosa (Gas Chromatography – GC)136,137 devido a características como volatilidade e polaridade dos PBDE, bem como à resoluçao obtida durante a separaçao dos diferentes congêneres presentes nas misturas comerciais ou produzidos nas matrizes de interesse por meio dos mecanismos de desbromaçao.53–55 Dessa forma, as colunas cromatográficas devem ser escolhidas no intuito de que haja maior eficiência na resoluçao dos analitos sem perdas por meio da degradaçao. Assim, de acordo com o Método 1614A da US EPA,127 que estabelece protocolos analíticos para a determinaçao de PBDE em água, solo, sedimento e tecidos, as colunas recomendadas podem ter comprimento de 15 ou 30 m, 0,25 mm de diâmetro interno e, em ambos os casos, devem ser revestidas por um filme de 0,1 µm de espessura composto por 95% metil, 4% fenil e 1% vinil silicone. Korytár e colaboradores,138 empregando a cromatografia gasosa, investigaram a separaçao de 126 congêneres presentes na formulaçao de duas misturas comerciais de retardantes de chama (70-5DE e 79-8DE) em sete colunas cromatográficas distintas. Avaliaram critérios como eficiência de separaçao, sobreposiçao de picos e coeluiçao. Os autores mostraram que colunas com 5% de difenil e 95% de dimetilpolisiloxano foram mais eficientes, porém, sugerem o uso de colunas apolares, com 100% de metilpolissiloxano, como alternativa para análises rotineiras, com elevada frequência analítica, pois apresentam menores problemas relacionados à degradaçao de congêneres com níveis de bromaçao maiores que sete. Problemas relacionados à degradaçao de PBDE durante a análise cromatográfica sao mais frequentes para os congêneres com elevada quantidade de bromos que apresentam tempos de retençao consideravelmente elevados. O maior tempo de residência na coluna associado ao aumento gradativo da temperatura durante a separaçao promove diminuiçao do sinal analítico para os congêneres mais bromados de modo que, em temperaturas de aproximadamente 300 °C, os congêneres que ainda nao chegaram ao detector podem ser degradados termicamente.138,139 Conforme preconiza o Método 1614A da US EPA, colunas curtas sao mais indicadas para a determinaçao de FR, pois assim os compostos permanecem um tempo mais curto no interior da coluna com um risco menor de serem degradados.140 Em situaçoes como esta alguns trabalhos sugerem a realizaçao de uma análise à parte para os PBDE mais bromados empregando colunas cromatográficas curtas, ou seja, de 7 a 15 m de comprimento, de modo que a separaçao dos PBDE possa ocorrer em tempos de retençao e temperaturas menores.14,99,115 Esta estratégia pode ser mais efetiva para a determinaçao de congêneres de maior massa molar, especialmente, octa-, nona- e deca-BDE.127 Para a detecçao, as técnicas descritas na literatura baseiam-se principalmente na captura de elétrons (Electron Capture Detector - ECD) e espectrometria de massas (Mass Spectrometry - MS). Apesar da GC-ECD ser seletiva a compostos halogenados como os PBDE, seu emprego requer uma rigorosa etapa de limpeza dos extratos (clean-up) de modo a remover possíveis interferentes.89,141 Nestes casos, a determinaçao de PBDE em sedimentos, um ambiente naturalmente redutor, deve também ser precedida pelo clean-up das amostras com cobre metálico para que seja eliminada a interferência causada pela presença de enxofre.87 Além disso, o uso de ECD demanda cuidados adicionais na etapa de separaçao cromatográfica de modo que a co-eluiçao dos congêneres nao inviabilize a determinaçao analítica. Por estes motivos, a determinaçao de PBDE por GC-ECD tem sido preterida, dando espaço ao uso da espectrometria de massas. Existem várias configuraçoes possíveis para o acoplamento entre espectrômetros de massas e cromatógrafos gasosos. Para a produçao de íons moleculares, muitos trabalhos optam pela ionizaçao química negativa (Negative Chemical Ionization – NCI),6,92,104,112 utilizando metano como reagente ionizante,116,118,142 em comparaçao à ionizaçao por impacto de elétrons (Electron Ionization - EI),12,89,91,143 que pode apresentar problemas para moléculas com pesos moleculares elevados, tais como os PBDE.142 Mesmo sendo menos eficiente para a determinaçao de PBDE, muitos trabalhos lançam mao da ionizaçao por impacto de elétrons em funçao da maior disponibilidade de equipamentos com esta configuraçao. Mais recentemente, equipamentos com esta fonte de ionizaçao têm se mostrado tao eficientes quantos aqueles equipados com NCI, o que tem difundido ainda mais o uso de EI para determinaçao de PBDE.15,89 Dentre os componentes de um MS, o analisador de massas desempenha um papel crucial na determinaçao dos compostos de interesse. Contudo, uma maior detectabilidade está diretamente relacionada a um maior custo de aquisiçao e manutençao destes equipamentos. Nao obstante, há MS equipados com analisadores de massas de baixo custo, versáteis e de relativa resoluçao, por exemplo, os de quadrupolo simples (Q) e os armadilha de íons (ion trap - IT). Um GC-QMS geralmente é operado no modo SIM (do inglês, Select Ion Monitoring) que possibilita alcançar limites de quantificaçao na ordem de ng mL-1 on column em funçao da obtençao de melhores razoes sinal/ruído (signal to noise ratio – S/N). Esta maior detectabilidade de espécies com razoes massa/carga pré-selecionadas permite eliminar interferências durante a aquisiçao do sinal analítico e, eventualmente, tornar a etapa de clean-up menos laboriosa. Outra estratégia utilizada para aumentar a razao S/N é utilizar cromatografia bidimensional. Assim, há um aumento da razao S/N ao se transferir apenas uma pequena quantidade do eluente do GC contendo os analitos para uma segunda coluna acoplada a MS. Dessa forma, há uma significativa diminuiçao dos interferentes e um aumento de S/N. O analisador IT consiste de um anel toroidal e de um par de eletrodos convexos de modo que em seu interior seja formado um campo eletromagnético onde os íons dos analitos permanecem armazenados até serem liberados para o detector. Assim, é a grande vantagem do IT consiste em permitir o monitoramento de íons sob demanda, ao passo que o QMS analisa os íons conforme sao gerados. Dessa forma, em comparaçao ao GC-QMS, o GC-ITMS possui melhor resoluçao. Outra forma de melhorar a detectabilidade é a utilizaçao de um GC-MS/MS em que é possível atingir níveis de concentraçao na ordem de pg mL-1. Nesta configuraçao, após a injeçao da amostra, o íon molecular atravessa o primeiro QMS e é direcionado para uma câmara de colisao para que haja uma fragmentaçao sob condiçoes controladas. Os fragmentos gerados seguem para o terceiro QMS a fim de serem classificados e quantificados. Apesar do sinal do analito ser reduzido na câmara de ionizaçao e no terceiro quadrupolo, o mesmo ocorre com o ruído o que possibilita o aumento da razao S/N. No entanto, uma limitaçao consiste no alto custo de aquisiçao e manutençao de um GC-MS/MS.140
CONCLUSOES Os PBDE, assim como quaisquer substâncias persistentes, podem atingir o ambiente via solo, água ou atmosfera. Porém, independentemente da fonte, este grupo de contaminantes deverá se acumular nos compartimentos ambientais com maior teor de matéria orgânica e sítios apolares devido à sua elevada hidrofobicidade. Em regioes urbanizadas, o lançamento de esgotos tem se mostrado a principal fonte de PBDE para ambientes aquáticos, sendo que no Brasil, onde a maior parte do esgoto gerado nao é tratada, sedimentos aquáticos tornam-se importantes sumidouros para essas substâncias. Por outro lado, outra fraçao dos PBDE, disponível em corpos aquáticos, irá se acumular na biota, o que provavelmente justifica a predominância de estudos realizados no Brasil envolvendo PBDE em cetáceos e peixes. Os métodos para determinaçao de PBDE em amostras ambientais utilizam, em sua maioria, a cromatografia gasosa acoplada a espectrometria de massas devido aos avanços em sensibilidade e seletividade quando comparada ao detector de captura de elétrons, mais específico para substâncias halogenadas. Por outro lado, sistemas analisadores de massa em linha (GC-MS-MS) podem promover sensibilidade ainda superiores aos GC-ECD e GC-MS por detectarem seletivamente fragmentos das substâncias de interesse. A utilizaçao desses métodos pode até dispensar algumas etapas de limpeza do extrato, tornando o método analítico mais simples e rápido. Finalmente, dentro de um contexto ambiental dos PBDE, é importante destacar que ao mesmo tempo que o Brasil é um país de riquezas naturais e uma grande economia em termos mundiais, a questao do saneamento básico é comparável à de países subsaarianos, ou seja, praticamente inexistente. Assim, falar em tratamento de esgoto que contém toda sorte de contaminantes pode ser considerado utópico, no entanto, urgente e necessário. Ao mesmo tempo, nesse cenário de crise moral e política pelo qual o país atravessa, a pesquisa básica que é feita em universidades supre a lacuna deixada por agências ambientais e empresas de saneamento básico, mesmo sofrendo cortes financeiros, o que inviabiliza o trabalho de pesquisadores. Majoritariamente, sao esses trabalhos que indicam o nível de contaminaçao dos mananciais. Nesse sentido, espera-se que esse trabalho possa contribuir para o desenvolvimento de pesquisas que visem a determinaçao simultânea de PBDE e outros contaminantes em todos os compartimentos ambientais, inclusive na biota.
MATERIAL SUPLEMENTAR As características gerais dos 209 congêneres dos PBDE, bem como suas nomenclaturas, estao disponíveis em http://quimicanova.sbq.org.br, em arquivo pdf, com livre acesso.
AGRADECIMENTOS Os autores agradecem ao Instituto Nacional de Ciências e Tecnologias Analíticas Avançadas (INCTAA).
REFERENCIAS 1. Alaee, M.; Arias, P.; Sjödin, A.; Bergman, Å.; Environ. Int. 2003, 29, 683. 2. Mariani, G.; Canuti, E.; Castro-Jiménez, J.; Christoph, E. H.; Eisenreich, S. J.; Hanke, G.; Skejo, H.; Umlauf, G.; Chemosphere 2008, 73, S114. 3. Yogui, G. T.; Sericano, J. L.; Environ. Int. 2009, 35, 655. 4. Papachlimitzou, A.; Barber, J. L.; Losada, S.; Bersuder, P.; Law, R. J.; J. Chromatogr. A 2012, 1219, 15. 5. Lokensgard, E.; Plásticos Industriais: Teoria e Aplicaçoes, 5th ed., Cengage Learning: Sao Paulo, 2013. 6. Björklund, J. A.; Thuresson, K.; Cousins, A. P.; Sellström, U.; Emenius, G.; De Wit, C. A.; Environ. Sci. Technol. 2012, 46, 5876. 7. Kang, Y.; Wang, H. S.; Cheung, K. C.; Wong, M. H.; Atmos. Environ. 2011, 45, 2386. 8. Hale, R. C.; Alaee, M.; Manchester-Neesvig, J. B.; Stapleton, H. M.; Ikonomou, M. G.; Environ. Int. 2003, 29, 771. 9. De Wit, C. A.; Chemosphere 2002, 46, 583. 10. Wang, G.; Peng, J.; Xu, X.; Zhang, D.; Li, X.; Chemosphere 2016, 144, 2097. 11. Wang, X.-T.; Chen, L.; Wang, X.-K.; Zhang, Y.; Zhou, J.; Xu, S.-Y.; Sun, Y.-F.; Wu, M.-H.; Chemosphere 2015, 133, 22. 12. Harrad, S.; Hazrati, S.; Ibarra, C.; Environ. Sci. Technol. 2006, 40, 4633. 13. Möller, A.; Xie, Z.; Sturm, R.; Ebinghaus, R.; Environ. Pollut. 2011, 159, 1577. 14. Moon, H. B.; Choi, M.; Yu, J.; Jung, R. H.; Choi, H. G.; Chemosphere 2012, 88, 837. 15. Wang, J.; Lin, Z.; Lin, K.; Wang, C.; Zhang, W.; Cui, C.; Lin, J.; Dong, Q.; Huang, C.; J. Hazard. Mater. 2011, 197, 211. 16. Klosterhaus, S. L.; Stapleton, H. M.; La Guardia, M. J.; Greig, D. J.; Environ. Int. 2012, 47, 56. 17. Yang, R.; Wei, H.; Guo, J.; Li, A.; Environ. Sci. Technol. 2012, 46, 3119. 18. Parolini, M.; Guazzoni, N.; Binelli, A.; Tremolada, P.; Arch. Environ. Contam. Toxicol. 2012, 63, 29. 19. Li, Q.; Yan, C.; Luo, Z.; Zhang, X.; Mar. Pollut. Bull. 2010, 60, 464. 20. Ríos, J. M.; Lana, N. B.; Berton, P.; Ciocco, N. F.; Altamirano, J. C.; Emerg. Contam. 2015, 1, 54. 21. Stasinska, A.; Reid, A.; Hinwood, A.; Stevenson, G.; Callan, A.; Odland, J. Ø.; Heyworth, J.; Chemosphere 2013, 91, 187. 22. Fromme, H.; Albrecht, M.; Appel, M.; Hilger, B.; Völkel, W.; Liebl, B.; Roscher, E.; Int. J. Hyg. Environ. Health 2015, 218, 41. 23. Sagiv, S. K.; Kogut, K.; Gaspar, F. W.; Gunier, R. B.; Harley, K. G.; Parra, K.; Villaseñor, D.; Bradman, A.; Holland, N.; Eskenazi, B.; Neurotoxicol. Teratol. 2015, 52, 151. 24. Kalantzi, O. I.; Geens, T.; Covaci, A.; Siskos, P. A.; Environ. Int. 2011, 37, 349. 25. She, J.; Petreas, M.; Winkler, J.; Visita, P.; McKinney, M.; Kopec, D.; Chemosphere 2002, 46, 697. 26. Schecter, A.; Johnson-Welch, S.; Tung, K. C.; Harris, T. R.; Päpke, O.; Rosen, R.; J. Toxicol. Environ. Heal. Part A 2006, 70, 1. 27. Leonetti, C.; Butt, C. M.; Hoffman, K.; Miranda, M. L.; Stapleton, H. M.; Environ. Int. 2016, 88, 23. 28. Siddique, S.; Xian, Q.; Abdelouahab, N.; Takser, L.; Phillips, S. P.; Feng, Y. L.; Wang, B.; Zhu, J.; Environ. Int. 2012, 39, 50. 29. Xu, P.; Lou, X.; Ding, G.; Shen, H.; Wu, L.; Chen, Z.; Han, J.; Wang, X.; Sci. Total Environ. 2015, 536, 215. 30. Gascon, M.; Vrijheid, M.; Martínez, D.; Forns, J.; Grimalt, J. O.; Torrent, M.; Sunyer, J.; Environ. Int. 2011, 37, 605. 31. Lin, S. M.; Chen, F. A.; Huang, Y. F.; Hsing, L. L.; Chen, L. L.; Wu, L. S.; Liu, T. Sen; Chang-Chien, G. P.; Chen, K. C.; Chao, H. R.; Int. J. Hyg. Environ. Health 2011, 214, 115. 32. Wang, Y.; Wang, S.; Xu, Y.; Luo, C.; Li, J.; Zhang, G.; Environ. Pollut. 2015, 205, 1. 33. Li, B.; Sun, S.-J.; Huo, C.-Y.; Li, W.-L.; Zhu, N.-Z.; Qi, H.; Kong, L.-J.; Li, Y.-F.; Ma, W.-L.; Environ. Sci. Pollut. Res. 2016, 23, 19246. 34. Melymuk, L.; Robson, M.; Csiszar, S. A.; Helm, P. A.; Kaltenecker, G.; Backus, S.; Bradley, L.; Gilbert, B.; Blanchard, P.; Jantunen, L.; Diamond, M. L.; Environ. Sci. Technol. 2014, 48, 3732. 35. Król, S.; Namieśnik, J.; Zabiegała, B.; Chemosphere 2014, 110, 91. 36. Ballschmiter, K.; Zell, M.; Fresenius Z. Anal. Chem. 1980, 302, 20. 37. Penteado, J. C. P.; Vaz, J. M.; Quim. Nova 2001, 24, 390. 38. Gallo, J. B.; Agnelli, J. A. M.; Polímeros 1998, 8, 23. 39. Chen, Y.; Li, J.; Liu, L.; Zhao, N.; J. Environ. Manage. 2012, 113, 22. 40. Rahman, F.; Langford, K. H.; Scrimshaw, M. D.; Lester, J. N.; Sci. Total Environ. 2001, 275, 1. 41. Talsness, C. E.; Environ. Res. 2008, 108, 158. 42. Tittlemier, S. a; Halldorson, T.; Stern, G. a; Tomy, G. T.; Environ. Toxicol. Chem. 2002, 21, 1804. 43. Mackay, D.; Shiu, W. Y.; Ma, K-C.; Lee, S. C.; Handbook of Physical-Chemical Properties and Environmental Fate for Organic Chemicals, 2nd ed., Taylor & Francis: Boca Raton, 2006. 44. Ward, J.; Mohapatra, S. P.; Mitchell, A.; Environ. Int. 2008, 34, 1148. 45. http://aliceweb.desenvolvimento.gov.br, acessada em Novembro de 2016. 46. http://www.planalto.gov.br/ccivil_03/_ato2004-2006/2005/decreto/d5472.htm, acessada em Novembro de 2016. 47. Feitosa, R. S.; Sodré, F. F.; Maldaner, A. O.; Quim. Nova 2013, 36, 291. 48. Braekevelt, E.; Tittlemier, S. A.; Tomy, G. T.; Chemosphere 2003, 51, 563. 49. Samara, F.; Tsai, C. W.; Aga, D. S.; Environ. Pollut. 2006, 139, 489. 50. Barón, E.; Eljarrat, E.; Barceló, D.; J. Chromatogr. A 2012, 1248, 154. 51. Gorgy, T.; Li, L. Y.; Grace, J. R.; Ikonomou, M. G.; Water. Air. Soil Pollut. 2012, 223, 2297. 52. Solomons, T. W. G.; Fryhle, C. B.; Organic Chemistry, 10th ed., John Wiley & Sons: Hoboken, 2009. 53. Tokarz, J. A.; Ahn, M. Y.; Leng, J.; Filley, T. R.; Nies, L.; Environ. Sci. Technol. 2008, 42, 1157. 54. Lee, L. K.; He, J.; Appl. Environ. Microbiol. 2010, 76, 794. 55. Huang, H. W.; Chang, B. V.; Lee, C. C.; Int. Biodeterior. Biodegrad. 2014, 87, 60. 56. Palm, A.; Cousins, I. T.; Mackay, D.; Tysklind, M.; Metcalfe, C.; Alaee, M.; Environ. Pollut. 2002, 117, 195. 57. Sakai, S.; Watanabe, J.; Honda, Y.; Takatsuki, H.; Aoki, I.; Futamatsu, M.; Shiozaki, K.; Chemosphere 2001, 42, 519. 58. Jugan, M. L.; Levi, Y.; Blondeau, J. P.; Biochem. Pharmacol. 2010, 79, 939. 59. Parolini, M.; Binelli, A.; Marin, M. G.; Matozzo, V.; Masiero, L.; Provini, A.; Environ. Monit. Assess. 2012, 184, 2001. 60. Luo, Y.; Luo, X.-J.; Lin, Z.; Chen, S.-J.; Liu, J.; Mai, B.-X.; Yang, Z.-Y.; Sci. Total Environ. 2009, 407, 1105. 61. Kirchgeorg, T.; Dreyer, A.; Gabrielli, P.; Gabrieli, J.; Thompson, L. G.; Barbante, C.; Ebinghaus, R.; Environ. Pollut. 2016, 218, 804. 62. Xiang, N.; Zhao, X.; Meng, X. Z.; Chen, L.; Sci. Total Environ. 2013, 461–462, 391. 63. Deng, W. J.; Zheng, J. S.; Bi, X. H.; Fu, J. M.; Wong, M. H.; Environ. Int. 2007, 33, 1063. 64. Gaylor, M. O.; Mears, G. L.; Harvey, E.; La Guardia, M. J.; Hale, R. C.; Environ. Sci. Technol. 2014, 48, 7034. 65. Cincinelli, A.; Martellini, T.; Misuri, L.; Lanciotti, E.; Sweetman, A.; Laschi, S.; Palchetti, I.; Environ. Pollut. 2012, 161, 229. 66. Kim, M.; Li, L. Y.; Gorgy, T.; Grace, J. R.; Environ. Pollut. 2017, 220, 753. 67. Andrade, N. A.; McConnell, L. L.; Anderson, M. O.; Torrents, A.; Ramirez, M.; Environ. Pollut. 2017, 222, 412. 68. Navarro, I.; de la Torre, A.; Sanz, P.; Pro, J.; Carbonell, G.; de los Angeles Martínez, M.; Environ. Res. 2016, 149, 32. 69. Li, H.; Qu, R.; Yan, L.; Guo, W.; Ma, Y.; Chemosphere 2015, 123, 87. 70. Gottschall, N.; Topp, E.; Edwards, M.; Payne, M.; Kleywegt, S.; Lapen, D. R.; Sci. Total Environ. 2017, 574, 1345. 71. Yu, M.; Luo, X.-J.; Wu, J.-P.; Chen, S.-J.; Mai, B.-X.; Environ. Int. 2009, 35, 1090. 72. Gao, Z.; Xu, J.; Xian, Q.; Feng, J.; Chen, X.; Yu, H.; Chemosphere 2009, 75, 1273. 73. Mozeto, A. A.; Umbuzeiro, G. A.; Jardim, W. F.; Métodos de Coleta, Análises Físico-Químicas e Ensaios Biológicos e Ecotoxicológicos de Sedimentos de Agua Doce, Multimídia: Sao Carlos, 2006. 74. Rocha, J. C.; Rosa, A. H.; Cardoso, A. A.; Introduçao à Química Ambiental, 2th ed., Bookman: Porto Alegre, 2009. 75. Garrison, T.; Fundamentos de Oceanografia, 4th ed., Cengage Learning: Sao Paulo, 2010. 76. Manahan, S. E.; Environmental chemistry, 7th ed., Lewis Publishers: Boca Raton, 1999. 77. Zhou, P.; Lin, K.; Zhou, X.; Zhang, W.; Huang, K.; Liu, L.; Guo, J.; Xu, F.; Chemosphere 2012, 88, 1375. 78. Yin, G.; Zhou, Y.; Strid, A.; Zheng, Z.; Bignert, A.; Ma, T.; Athanassiadis, I.; Qiu, Y.; Environ. Sci. Pollut. Res. 2017, 24, 7740. 79. Brandsma, S. H.; Leonards, P. E. G.; Leslie, H. A.; de Boer, J.; Sci. Total Environ. 2015, 505, 22. 80. Burd, B. J.; Macdonald, T. A.; Macdonald, R. W.; Ross, P. S.; Arch. Environ. Contam. Toxicol. 2014, 67, 310. 81. Shin, P. K. S.; Gopalakrishnan, S.; Chan, A. K. Y.; Qian, P. Y.; Wu, R. S. S.; Mar. Pollut. Bull. 2014, 85, 425. 82. Dorneles, P. R.; Lailson-Brito, J.; Dirtu, A. C.; Weijs, L.; Azevedo, A. F.; Torres, J. P. M.; Malm, O.; Neels, H.; Blust, R.; Das, K.; Covaci, A.; Environ. Int. 2010, 36, 60. 83. Lavandier, R.; Quinete, N.; Hauser-Davis, R. A.; Dias, P. S.; Taniguchi, S.; Montone, R.; Moreira, I.; Chemosphere 2013, 90, 2435. 84. Lavandier, R.; Arêas, J.; Dias, P. S.; Taniguchi, S.; Montone, R.; de Moura, J. F.; Quinete, N.; Siciliano, S.; Moreira, I.; Mar. Pollut. Bull. 2015, 101, 947. 85. Lavandier, R.; Arêas, J.; Quinete, N.; De Moura, J. F.; Taniguchi, S.; Montone, R.; Siciliano, S.; Moreira, I.; Environ. Pollut. 2016, 208, 442. 86. Quinete, N.; Lavandier, R.; Dias, P.; Taniguchi, S.; Montone, R.; Moreira, I.; Mar. Pollut. Bull. 2011, 62, 440. 87. Annunciaçao, D. L. R.; Almeida, F. V.; Sodré, F. F.; Microchem. J. 2017, 133, 43. 88. Souza, A. O.; Ferrari, R. S.; Annunciaçao, D.; Sodré, F. F.; Dorta, D. J.; Toxicol. Lett. 2016, 259, S119. 89. Kefeni, K. K.; Okonkwo, J. O.; Chemosphere 2012, 87, 1070. 90. Moon, H. B.; Kannan, K.; Choi, M.; Choi, H. G.; Mar. Pollut. Bull. 2007, 54, 1402. 91. Takigami, H.; Suzuki, G.; Hirai, Y.; Sakai, S.; Chemosphere 2009, 76, 270. 92. Batterman, S.; Godwin, C.; Chernyak, S.; Jia, C.; Charles, S.; Environ. Int. 2010, 36, 548. 93. Sjödin, A.; Päpke, O.; McGahee, E.; Focant, J. F.; Jones, R. S.; Pless-Mulloli, T.; Toms, L. M. L.; Herrmann, T.; Müller, J.; Needham, L. L.; Patterson, D. G.; Chemosphere 2008, 73, S131. 94. Quirós-Alcalá, L.; Bradman, A.; Nishioka, M.; Harnly, M. E.; Hubbard, A.; McKone, T. E.; Eskenazi, B.; Environ. Int. 2011, 37, 592. 95. Fulong, C. R. P.; Espino, M. P. B.; Chemosphere 2013, 90, 42. 96. Shoeib, M.; Harner, T.; Webster, G. M.; Sverko, E.; Cheng, Y.; Environ. Pollut. 2012, 169, 175. 97. Karlsson, M.; Julander, A.; van Bavel, B.; Hardell, L.; Environ. Int. 2007, 33<, /i>, 62. 98. Ali, N.; Harrad, S.; Goosey, E.; Neels, H.; Covaci, A.; Chemosphere 2011, 83, 1360. 99. Guzzella, L.; Poma, G.; De Paolis, A.; Roscioli, C.; Viviano, G.; Environ. Pollut. 2011, 159, 2552. 100. Yuan, G.-L.; Han, P.; Xie, W.; Che, X.-C.; Wang, G.-H.; Sci. Total Environ. 2012, 433, 44. 101. Sánchez-Brunete, C.; Miguel, E.; Tadeo, J. L.; Talanta 2006, 70, 1051. 102. Zheng, X.; Liu, X.; Jiang, G.; Wang, Y.; Zhang, Q.; Cai, Y.; Cong, Z.; Environ. Pollut. 2012, 161, 101. 103. Zhang, Y.; Fu, S.; Liu, X.; Li, Z.; Dong, Y.; J. Environ. Sci. 2013, 25, 2443. 104. Jiang, Y.; Wang, X.; Zhu, K.; Wu, M.; Sheng, G.; Fu, J.; Chemosphere 2012, 89, 936. 105. Li, Y. Y.; Lin, T.; Chen, Y. J.; Hu, L. M.; Guo, Z. G.; Zhang, G.; Environ. Pollut. 2012, 171, 155. 106. Li, F.; Zhang, H.; Meng, X.; Chen, L.; Yin, D.; J. Environ. Sci. 2012, 24, 1934. 107. Dodder, N. G.; Maruya, K. A.; Lauenstein, G. G.; Ramirez, J.; Ritter, K. J.; Schiff, K. C.; Environ. Toxicol. Chem. 2012, 31, 2239. 108. Cai, M. G.; Hong, Q. Q.; Wang, Y.; Luo, X. J.; Chen, S. J.; Cai, M. H.; Qiu, C. R.; Huang, S. Y.; Mai, B. X.; Deep Sea Res., Part II 2012, 81, 95. 109. Lee, I.-S.; Kim, K.-S.; Kim, S.-J.; Yoon, J. H.; Choi, K. H.; Choi, S.-D.; Oh, J.-E.; Sci. Total Environ. 2012, 432, 128. 110. Chen, C.-Y.; Tien, C.-J.; Sun, Y.-M.; Hsieh, C.-Y.; Lee, C.-C.; Chemosphere 2013, 90, 2420. 111. Guzzella, L.; Roscioli, C.; Binelli, A.; Chemosphere 2008, 73, 1684. 112. Zegers, B. N.; Lewis, W. E.; Booij, K.; Smittenberg, R. H.; Boer, W.; de Boer, J.; Boon, J. P.; Environ. Sci. Technol. 2003, 37, 3803. 113. Liu, L. Y.; Wang, J. Z.; Qiu, J. W.; Liang, Y.; Zeng, E. Y.; Environ. Toxicol. Chem. 2012, 31, 1194. 114. Zhao, G.; Zhou, H.; Liu, X.; Li, K.; Zhang, P.; Wen, W.; Yu, Y.; Sci. Total Environ. 2012, 427, 139. 115. Wu, F.; Guo, J.; Chang, H.; Liao, H.; Zhao, X.; Mai, B.; Xing, B.; Environ. Pollut. 2012, 162, 262. 116. Vane, C. H.; Ma, Y. J.; Chen, S. J.; Mai, B. X.; Environ. Geochem. Health 2010, 32, 13. 117. Zhao, X.; Zhang, H.; Ni, Y.; Lu, X.; Zhang, X.; Su, F.; Fan, J.; Guan, D.; Chen, J.; Chemosphere 2011, 82, 1262. 118. de Boer, J.; Wester, P. G.; van der Horst, A.; Leonards, P. E. G.; Environ. Pollut. 2003, 122, 63. 119. Zheng, G. J.; Martin, M.; Richardson, B. J.; Yu, H.; Liu, Y.; Zhou, C.; Li, J.; Hu, G.; Lam, M. H. W.; Lam, P. K. S.; Mar. Pollut. Bull. 2004, 49, 520. 120. Deng, D.; Chen, H.; Tam, N. F. Y.; Sci. Total Environ. 2015, 502, 133. 121. Yang, C.; Meng, X.-Z.; Chen, L.; Xia, S.; Chemosphere 2011, 85, 418. 122. Xie, Z.; Ebinghaus, R.; Anal. Chim. Acta 2008, 610, 156. 123. Besis, A.; Katsoyiannis, A.; Botsaropoulou, E.; Samara, C.; Environ. Pollut. 2014, 188, 64. 124. Tan, J.; Cheng, S. M.; Loganath, A.; Chong, Y. S.; Obbard, J. P.; Chemosphere 2006, 66, 985. 125. Ni, H. G.; Cao, S. P.; Chang, W. J.; Zeng, H.; Environ. Pollut. 2011, 159, 1957. 126. Wang, W.; Zheng, J.; Chan, C. Y.; Huang, M. juan; Cheung, K. C.; Wong, M. H.; Atmos. Environ. 2014, 89, 786. 127. https://www.epa.gov/sites/production/files/2015-08/documents/method_1614a_2010.pdf, acessada em Janeiro de 2018. 128. Cotta, J. A. O.; Rezende, M. O. O.; Landgraf, M. D.; Quim. Nova 2009, 32, 2026. 129. de Castro, M. D. L.; Priego-Capote, F.; J. Chromatogr. A 2010, 1217, 2383. 130. https://www.epa.gov/sites/production/files/2015-12/documents/3550c.pdf, acessada em Janeiro de 2018. 131. Bendicho, C.; Calle, I. D. La; Pena, F.; Costas, M.; Cabaleiro, N.; Lavilla, I.; TrAC, Trends Anal. Chem. 2012, 31, 50. 132. Ali, N.; Harrad, S.; Muenhor, D.; Neels, H.; Covaci, A.; Anal. Bioanal. Chem. 2011, 400, 3073. 133. Camel, V.; TrAC, Trends Anal. Chem. 2000, 19, 229. 134. Fidalgo-Used, N.; Blanco-González, E.; Sanz-Medel, A.; Anal. Chim. Acta 2007, 590, 1. 135. Sahlström, L.; Sellström, U.; de Wit, C. A.; Anal. Bioanal. Chem. 2012, 404, 459. 136. Dirtu, A. C.; Ravindra, K.; Roosens, L.; van Grieken, R.; Neels, H.; Blust, R.; Covaci, A.; J. Chromatogr. A 2008, 1186, 295. 137. Mydlová, J.; Krupčík, J.; Korytár, P.; Sandra, P.; J. Chromatogr. A 2007, 1147, 95. 138. Korytár, P.; Covaci, A.; De Boer, J.; Gelbin, A.; Brinkman, U. A. T.; J. Chromatogr. A 2005, 1065, 239. 139. Tollbäck, P.; Björklund, J.; Östman, C.; J. Chromatogr. A 2003, 991, 241. 140. Gauthier, L. T.; Potter, D.; Hebert, C. E.; Letcher, R. J.; Environ. Sci. Technol. 2009, 43, 312. 141. Yang, M.; Jia, H. L.; Ma, W. L.; Qi, H.; Cui, S.; Li, Y. F.; Atmos. Environ. 2012, 55, 73. 142. Pavia, D. L.; Lampman, G. M.; Kriz, G. A.; Vyvyan, J. R.; Introduction to Spectroscopy, 5th ed., Cengage Learning: Stamford, 2014. 143. Moon, H.-B.; Kannan, K.; Lee, S.-J.; Choi, M.; Chemosphere 2007, 66, 585. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access