Artigo
|
|
| Influência do método extrativo no teor de flavonoides de Cnidoscolus quercifolius pohl (Euphorbiaceae) e atividade antioxidante Influence of extraction process on flavonoid content from Cnidoscolus quercifolius pohl (Euphorbiaceae) and antioxidant activity |
|
Daniel da S. TorresI; Emanuella C. V. PereiraI; Pedrita A. SampaioI; Nathália A. C. de SouzaI; Christiane A. A. FerrazII; Ana P. de OliveiraI,II; Celuane A. MouraII; Jackson R. G. S. AlmeidaI,II; Pedro J. Rolim-NetoIII; Raimundo G. de Oliveira-JúniorI,II; Larissa A. RolimI,II,*
I. Central de Análise de Fármacos, Medicamentos e Alimentos, Universidade Federal do Vale do São Francisco, 56304-205 Petrolina - PE, Brasil Recebido em 30/01/2018 *e-mail: rolim.lar@gmail.com Cnidoscolus quercifolius Pohl is a Brazilian medicinal plant from Caatinga biome and possesses several pharmacological properties. Phytochemical investigations have attributed some of these properties to the presence of flavonoids. In this paper, we report the influence of the extraction process on the flavonoid content obtained from leaves of C. quercifolius and its antioxidant activity. A factorial design 22 was performed, using temperature and agitation as independent variables. Qualitative and quantitative analyzes of the extracts were performed by HPLC-DAD. Rutin and apigenin were identified in the extracts and chosen as analytical markers. Pareto chart and Surface response plots suggested that rutin content was increased up to 3.93 times when temperature was employed during the extraction process. However, apigenin content was significantly reduced in the method whose temperature or agitation were used (p<0.05). A higher antioxidant activity was observed in extracts whose rutin extraction was favored, suggesting that this flavonoid contributes at least in part to the antioxidant potential of the species. INTRODUÇAO Cnidoscolus quercifolius (syn. C. phyllacanthus (Mull. Arg.) Pax & L. Hoffm.) é uma planta medicinal brasileira, endêmica do bioma Caatinga, frequentemente encontrada no semiárido nordestino, em especial nos estados de Pernambuco, Bahia, Ceará, Paraíba, Piauí e Rio Grande do Norte, além do estado de Minas Gerais, na regiao sudeste. Essa espécie é conhecida popularmente como "favela", "faveleira" ou "urtiga-branca", sendo tradicionalmente utilizada no tratamento de dores e processos inflamatórios, infecçoes, problemas estomacais e cicatrizaçao de feridas.1,2 Estudos farmacológicos realizados previamente demonstraram que extratos etanólicos obtidos das folhas e cascas do caule da espécie apresentam atividade antinociceptiva3 e anti-inflamatória4 em modelos animais. Além disso, também foi demonstrado o potencial antioxidante e antimicrobiano de diferentes extratos de C. quercifolius.5-7 Essas propriedades terapêuticas têm sido frequentemente correlacionadas ao elevado teor de compostos fenólicos e, principalmente, flavonoides. Recentemente, Paula et al.8 descreveu o isolamento de triterpenos e bis-norditerpenos das cascas do caule da planta. De fato, bis-norditerpenos do tipo benzilcicloheptano (denominados de favelinhas)9,10 e novos derivados ciclopropano (favelanona) e ciclobuteno tetracíclicos (neofavelanona)11 têm sido relatados com frequência para essa espécie, podendo ser considerados seus marcadores quimiotaxonômicos. Esses compostos apresentam atividade citotóxica significativa em diversas linhagens de células tumorais humanas, sendo atribuída a eles a propriedade antitumoral verificada para extratos de C. quercifolius.8,12 Apesar de C. quercifolius ser considerada uma espécie de uso tradicional amplamente difundido em diversas comunidades do Nordeste brasileiro, com algumas de suas propriedades farmacológicas avaliadas e comprovadas cientificamente, ainda existem poucos estudos químicos e farmacológicos envolvendo esta planta. Além disso, as atividades farmacológicas verificadas para C. quercifolius sao normalmente atribuídas a classes de metabólitos secundários distintas, o que torna necessário o desenvolvimento de métodos extrativos que favoreçam a obtençao de compostos de interesse para determinadas propriedades terapêuticas. Nesse trabalho, nós relatamos a influência do método extrativo no teor de flavonoides obtidos das folhas de C. quercifolius, em especial os flavonoides rutina e apigenina, que puderam ser identificados através de análises por CLAE-DAD. Adicionalmente, foi avaliada a atividade antioxidante in vitro dos extratos obtidos, correlacionando-a com o teor de flavonoides verificado.
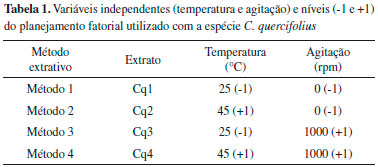
PARTE EXPERIMENTAL Material vegetal As folhas da espécie C. quercifolius foram coletadas no Campus de Ciências Agrárias (CCA), da Universidade Federal do Vale do Sao Francisco (UNIVASF), no município de Petrolina-PE, em agosto de 2015, e foram comparadas com uma exsicata da planta previamente depositada no Herbário do Vale do Sao Francisco (n° 19202), na UNIVASF. Em seguida, o material (10 kg) foi seco em estufa de circulaçao de ar e pulverizadas em moinho de facas, fornecendo 2,044 kg da planta pulverizada. Aplicaçao de planejamento fatorial 22 para avaliaçao do método extrativo Para avaliar a influência do método de extraçao sobre o teor dos flavonoides obtidos da espécie, foi realizado um planejamento fatorial envolvendo dois fatores estudados em dois níveis diferentes (+1 e -1), caracterizando um planejamento fatorial 22. Para todos os métodos, foi utilizada a proporçao planta/solvente de 1:10 (m/v), utilizando 10 g da planta pulberizada para 100 mL de solvente. O tempo de extraçao foi mantido em duas horas e todos os extratos foram preparados utilizando etanol absoluto como solvente. Os extratos foram preparados em triplicata, variando-se a temperatura de extraçao (a frio ou a quente) e a agitaçao do meio (com ou sem agitaçao), conforme descrito na Tabela 1. Em seguida, a soluçao extrativa obtida foi levada ao aparelho evaporador rotativo para eliminaçao do solvente, resultando nos diferentes extratos brutos (Cq1, Cq2, Cq3 e Cq4). O rendimento do método extrativo foi calculado com base na massa final obtida para cada extrato em relaçao à massa de material vegetal utilizada, sendo expresso em percentual (%, m/m).
Análises por CLAE-DAD Todos os extratos foram submetidos a uma análise quali-quantitativa por CLAE-DAD visando a identificaçao e quantificaçao dos flavonoides presentes na espécie. As análises foram realizadas em cromatógrafo líquido Shimadzu® (LC-20 AT) equipado com um amostrador automático (SIL-20 A) e um detector de arranjo de diodos (SPD-M20A) controlado por software LC-Solution 1.0; e uma coluna Zorbax, Agilent (250 x 4,6 mm e 5 um) com pré-coluna. Todas as soluçoes foram degaseificadas e filtradas através de membrana filtrante de 0,22 µm (Chromafil® Xtra, EUA), antes de serem analisadas no cromatógrafo. Os extratos (Cq1-Cq4) foram analisados na concentraçao de 10 mg/mL, solubilizados em metanol, à temperatura de 37 ºC, com fluxo de 1 mL min-1 e volume de injeçao de 50 µL, sendo o tempo de análise de 70 min e a fase móvel constituída de dois solventes: solvente A (soluçao de ácido fórmico 0,1%) e solvente B (acetonitrila); em eluiçao gradiente: 0 min (100% A), 50 min (40% A e 60% B), 60 min (40% A e 60% B), 70 min (100% A). Todas as análises foram realizadas em triplicata e os cromatogramas foram obtidos em 320 nm. Para identificaçao dos compostos, foram utilizados padroes analíticos obtidos da Sigma® (Brasil). Todos os padroes foram analisados por CLAE-DAD sob as mesmas condiçoes de análise dos extratos. A identificaçao dos compostos foi realizada com base na comparaçao dos valores de tempo de retençao e dos comprimentos de onda de absorçao máxima (λmax) dos picos encontrados nos cromatogramas das amostras com aqueles verificados nos cromatogramas dos padroes analíticos. Quantificaçao dos flavonoides rutina e apigenina Após o desenvolvimento dos métodos extrativos e a identificaçao dos compostos, foi realizada a curva padrao para quantificaçao dos flavonoides rutina (CAS 153-18-4, Sigma®) e apigenina (CAS 520-36-5, Sigma®) por CLAE-DAD. A quantificaçao desses marcadores nos diferentes extratos foi realizada a partir da equaçao da reta obtida de suas respectivas curvas de calibraçao: 40 a 60 µg mL-1 de rutina (y = 32588x - 294690, com R2 = 0,98) e 0 a 1 µg mL-1 de apigenina (y = 6000000x - 187553, com R2 = 0,99). O teor dos flavonoides foi expresso em µg/mg de extrato, empregando-se valores de média ± desvio padrao. Avaliaçao da atividade antioxidante A atividade antioxidante dos extratos de C. quercifolius foi avaliada através do método do sequestro do radical 2,2-difenil-1-picrilhidrazila (DPPH).13,14 Soluçoes estoques das amostras (Cq1-Cq4, 1 mg/mL) e padrao (ácido ascórbico, 1 mg/mL) foram preparadas e diluídas até concentraçoes finais de 1, 3, 9, 27, 81 e 243 µg/mL, em etanol absoluto. Uma soluçao contendo o radical DPPH foi preparada em etanol, na concentraçao de 50 µg mL-1. Em seguida, adicionou-se 1 mL desta soluçao a 2,5 mL de cada uma das soluçoes diluídas dos extratos. Após 30 minutos de reaçao em temperatura ambiente e ao abrigo da luz, foram realizadas as leituras das absorbâncias em espectrofotômetro (QUIMIS®, Brasil), em 518 nm. Os valores de absorbância foram convertidos em percentual de atividade antioxidante através da seguinte equaçao: AA(%) = [(Acontrole – Aamostra)/ Acontrole] x 100, em que Acontrole representa a absorbância do controle negativo (1 mL da soluçao de DPPH + 2,5 mL de etanol absoluto) e Aamostra representa a absorbância da amostra. Soluçoes de etanol (1 mL) com as amostras (2,5 mL) foram utilizadas como branco. Todos os experimentos foram realizados em triplicata e os valores de percentual de atividade antioxidante foram convertidos para CE50 através de análise de regressao nao linear. Análise estatística Todos as determinaçoes foram realizadas em triplicata. A análise dos dados da quantificaçao dos flavonoides apigenina e rutina foi realizada utilizando o software OriginPro8®. Os gráficos de Pareto e de Superfície-Resposta foram obtidos através do software Statistica® (StatSoft, versao 5.0), considerando os valores significativamente diferentes quando p < 0,05. Os valores de CE50 e de percentual de atividade antioxidante foram calculados com o auxílio do programa GraphPad Prism6®.
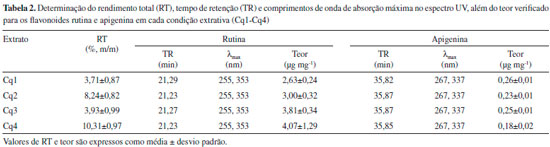
RESULTADOS E DISCUSSAO Inicialmente, foi avaliado o rendimento dos extratos obtidos de acordo com as condiçoes de extraçao utilizadas. De modo geral, o emprego de temperatura e agitaçao facilitou a extraçao dos constituintes químicos da planta (Tabela 2), um resultado previsível, uma vez que esses fatores aumentam a difusao e solubilidade do composto, além de diminuírem a viscosidade do solvente, resultando assim na melhoria da extraçao.
Após obtençao, todos os extratos foram analisados por CLAE-DAD sob as mesmas condiçoes cromatográficas. Todos os extratos apresentaram perfil cromatográfico semelhante, variando apenas a intensidade dos picos registrados (Figura 1). Os cromatogramas obtidos (320 nm) revelaram diversos picos com bandas de absorçao UV características de derivados flavonoídicos (λmax 250-270 e 320-360 nm). Dentre esses, dois foram identificados como sendo os flavonoides rutina e apigenina,15 com base na comparaçao do tempo de retençao (TR) e o perfil de absorçao UV registrados para os padroes analíticos utilizados (Figura 2). A Tabela 2 sumariza os valores de TR e λmax, além do teor de rutina e apigenina calculados para cada extrato.
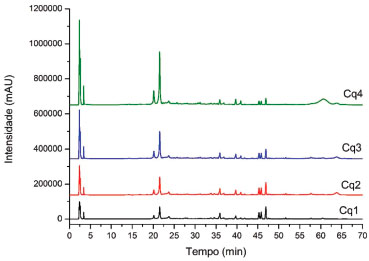 Figura 1. CLAE-DAD (320 nm) dos extratos (Cq1-Cq4) obtidos através diferentes métodos extrativos empregados, conforme apresentado na Tabela 1
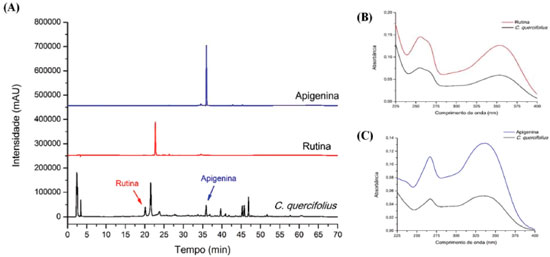 Figura 2. CLAE-DAD (320 nm) dos padroes rutina e apidenina, e do extrato de C. quercifolius (A). Espectro de absorçao UV obtidos para rutina (B) e apigenina (C), comparados aos picos correspondentes em extratos de C. quercifolius
A aplicaçao do planejamento fatorial permitiu avaliar a influência dos fatores temperatura e agitaçao na extraçao dos flavonoides identificados. O gráfico de Superfície-Resposta apresentado na Figura 3 demonstra que quanto maior a temperatura empregada, maior o teor de rutina obtido durante a preparaçao dos extratos. O diagrama de Pareto corrobora essa informaçao, revelando que a temperatura influencia positivamente na extraçao da rutina (p<0.05) (Figura 3). Por outro lado, o emprego de agitaçao ou a combinaçao das duas variáveis (agitaçao + temperatura) nao interferem de modo significativo no teor do composto. Desse modo, Cq3 e Cq4 foram consideradas as melhores condiçoes de extraçao da rutina, apresentando teores de 3,81±0,34 e 4,07±1,29 µg/mg, respectivamente (Tabela 2).
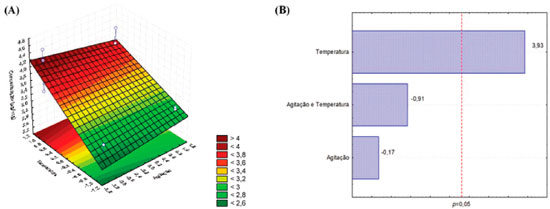 Figura 3. Gráfico de Superfície-Resposta (A) e diagrama de Pareto (B) mostrando a influência dos fatores temperatura e agitaçao no teor de rutina obtido durante o processo extrativo
O uso da temperatura como um fator que melhora a extraçao de compostos fenólicos, em especial os flavonoides, tem sido amplamente descrito na literatura.16-18 Além disso, por se tratar de um derivado glicosilado, é natural que a rutina seja mais facilmente extraída em temperaturas elevadas.19 Contudo, também é sabido que o emprego de altas temperaturas pode levar à degradaçao desse composto,20,21 o que torna necessário o desenvolvimento de novas metodologias de otimizaçao do método extrativo a fim de selecionar as melhores condiçoes de extraçao, sem que a substância seja degradada durante o processo extrativo. Diferentemente do que foi verificado para rutina, o gráfico de Superfície-Resposta apresentado na figura 4 revela que o uso de temperatura ou agitaçao diminuem a eficiência de extraçao do flavonoide apigenina. De acordo com o diagrama de Pareto (figura 4), o emprego dessas variáveis influencia negativamente na extraçao do composto (p<0.05), justificando o menor teor de apigenina verificado para o extrato Cq4 (0,18±0,02 µg mg-1) e o maior teor verificado para a condiçao Cq1 (0,26±0,01 µg mg-1).
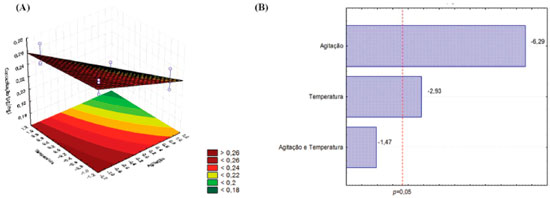 Figura 4. Gráfico de Superfície-Resposta (A) e diagrama de Pareto (B) mostrando a influência dos fatores temperatura e agitaçao no teor de apigenina obtido durante o processo extrativo
Levando em consideraçao que os flavonoides têm sido relatados como os constituintes químicos responsáveis pelo potencial antioxidante de C. quercifolius,5-7 nós resolvemos investigar a atividade antioxidante dos extratos obtidos nas diferentes condiçoes (Cq1-Cq4), utilizando o método do sequestro do radical DPPH. Este é um modelo clássico para avaliaçao do potencial antioxidante in vitro de amostras de natureza orgânica, sendo amplamente empregado na avaliaçao da atividade antioxidante de produtos naturais, incluindo extratos vegetais.13,14 De acordo com a Figura 5, foi verificado que o extrato Cq4 apresentou maior atividade antioxidante em comparaçao com os demais extratos, alcançando cerca de 90% de atividade na última concentraçao testada (243 µg mL-1). De fato, Cq4 apresentou o menor valor de CE50 (75,89± 2,71 µg mL-1) entre os extratos (Tabela 3), sugerindo que o emprego de fatores que favorecem a extraçao do flavonoide rutina tendem a melhorar a atividade antioxidante do extrato. Isso porque esse flavonoide apresenta elevado potencial antioxidante tanto em modelos in vitro, quanto em modelos in vivo, sendo utilizado, inclusive, como uma substância de referência (controle positivo) em alguns testes.22,23
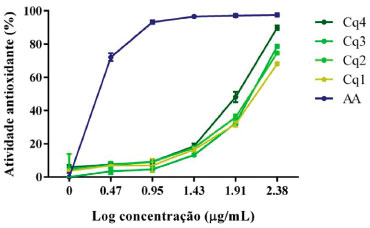 Figura 5. Atividade antioxidante (%) verificada para os extratos obtidos em diferentes condiçoes (Cq1-Cq4) e para o padrao ácido ascórbico (AA)
CONCLUSAO O planejamento fatorial aplicado nesse estudo permitiu identificar a temperatura como sendo um fator que favorece a extraçao de rutina, mas desfavorece a extraçao de apigenina. A agitaçao também prejudica a extraçao de apigenina, mas nao influencia significativamente no teor de rutina. Esses resultados sugerem que diferentes condiçoes de temperatura e agitaçao podem ser empregadas na extraçao de flavonoides de C. quercifolius a depender do tipo de substâncias que se deseja obter (flavonoides glicosilados, como rutina; ou agliconas, como apigenina). Além disso, foi verificado uma maior atividade antioxidante quando empregadas condiçoes que favoreceram a extraçao de rutina, sugerindo que este flavonoide pode estar relacionado, pelo menos em parte, ao potencial antioxidante da espécie. Vale ressaltar que outros compostos fenólicos também podem ter contribuído para a melhoria da atividade antioxidante do extrato, sendo necessário o desenvolvimento de estudos fitoquímicos posteriores que permitam o isolamento e caracterizaçao desses constituintes. Embora preliminar, esse trabalho fornece informaçoes importantes para estudos posteriores que visem a otimizaçao do processo extrativo de flavonoides de C. quercifolius, baseado nos compostos de interesse e nas atividades farmacológicas desejadas.
AGRADECIMENTOS Os autores agradecem à FACEPE (Fundaçao de Amparo à Ciência e Tecnologia do Estado de Pernambuco), ao CNPq (Conselho Nacional de Desenvolvimento Científico e Tecnológico) e à UNIVASF (Universidade Federal do Vale do Sao Francisco) pelo apoio financeiro.
REFERENCIAS 1. Albuquerque, U. P.; Araujo, E. L.; El-Deir, A. C. A.; Lima, A. L. A.; Souto, A.; Bezerra, B. M.; Ferraz, E. M. N.; Freire, E. M. X.; Sampaio, E. V. S. B.; Las-Casas, F. M. G.; Moura, G. J. B.; Pereira, G. A.; Melo, J. G. M.; Ramos, M. A.; Rodal, M. J. N.; Schiel, N.; Lyra-Neves, R. M.; Alves, R. R. N.; Azevedo-Junior, S. M.; Telino-Junior, W. R.; Severi, W.; The Sci. World. J (2012), doi: 10.1100/2012/205182. 2. Albuquerque, U. P.; Medeiros, P. M.; Almeida, A. L. S.; Monteiro, J. M.; Lins-Neto, E. M. F.; Gomes, J. M.; Santos, J. P.; J. Ethnopharmacol. 2007, 114, 325. 3. Gomes, L. M. C.; Lima-Saraiva, S. R. G.; Andrade, T. M. D.; Silva, J. C.; Diniz, T. C.; Barreto, V. N. S.; Mendes, R. L.; Quintans-Júnior, L. J.; Quintans, J. S. S.; Lima, J. T.; Almeida, J. R. G. S.; J. Young Pharm. 2014, 6, 64. 4. Gomes, L. M. A.; Andrade, T. M. D.; Silva, J. C.; Lima, J. T.; Quintans-Júnior, L. J.; Almeida, J. R. G. S.; Pharmacogn. Res. 2014, 6, 345. 5. Morais, N. R. L.; Oliveira-Neto, F. B.; Melo, A. R.; Bertini, L. M.; Silva, F. F. M.; Alves, L. A.; Rev. Bras. Plantas Med. 2016, 18, 180. 6. Paredes, P. F. M.; Vasconcelos, F. R.; Paim, R. T. T.; Marques, M. M. M.; Morais, S. M.; Lira, S. M.; Braquehais, I. D.; Vieira, I. G. P.; Mendes, F. N. P.; Guedes, M. I. F.; J. Evidence-Based Complementary Altern. Med. 2016, 2016, 1. 7. Santos, K. A.; Aragao-Filho, O. P.; Aguiar, C. M.; Milinsk, M. C.; Sampaio, S. C.; Palú, F.; Silva, E. S.; Ind. Crops. Prod. 2017, 97, 368. 8. Paula, A. C.; Melo, K. M.; Silva, A. M.; Ferreira, D. A.; Monte, F. J. Q.; Santiago, G. M. P.; Lemos, T. L. G.; Braz-Filho, R.; Militao, G. C. G.; Silva, P. B. N.; Silva, T. G.; Rev. Virtual. Quim. 2016, 8, 231. 9. Endo, Y.; Ohta, T.; Nozoe, S.; Tetrahedron. Lett. 1991, 32, 3083. 10. Lemos, T. L. G.; Silveira, E. R.; Oliveira, M. F.; Braz-Filho, R.; J. Braz. Chem. Soc. 1991, 2, 105. 11. Endo, Y.; Ohta, T.; Nozoe, S.; Tetrahedron. Lett. 1991, 32, 5555. 12. Peixoto-Sobrinho, T. J.; Tavares, E. A.; Castro, V. T. N. A.; Veras-Filho, J.; Militao, G. C. G.; Silva, T. G.; Amorim, E. L. C.; Mol. Clin. Pharmacol. 2012, 3, 55. 13. Mensor, L. L.; Menezes, F. S.; Leitao, G. G.; Reis, A. S.; Santos, T. C.; Coube, C. S.; Leitao, S. G.; Phytother. Res. 2001, 15, 127. 14. Falcao, D. Q.; Costa, E. R.; Alviano, D. S.; Alviano, C. S.; Kuster, R. M.; Menezes, F. S.; Braz. J. Pharmacogn. 2006, 16, 73. 15. Oliveira-Júnior, R. G.; Dissertaçao de Mestrado, Universidade Federal do Vale do Sao Francisco, Brasil, 2017. 16. Liu, Y.; Wang, H.; Cai, X.; J. Food Sci. Technol. 2015, 52, 2336. 17. Azahar, N. F.; Gani, S. S. A.; Mokhtar, N. F. M.; Chem. Cent. J. 2017, 11, 96. 18. Bassani, D. C.; Nunes, D. S.; Granato, D.; An. Acad. Bras. Ciênc. 2014, 86, 923. 19. Kraujalis, P.; Venskutonis, P. R.; Ibáñez, E.; Herrero, M.; J. Supercrit. Fluids 2015, 104, 234. 20. Buchner, N.; Krumbein, A.; Rohn, S.; Kroh, L. W.; Rapid Commun. Mass Spectrom. 2006, 20, 3229. 21. Ravber, M.; Pečar, D.; Gorsek, A.; Iskra, J.; Knez, Z.; Skerget, M.; J. Agric. Food Chem. 2016, 64, 9196. 22. Al-Dhabi, N. A.; Arasu, M. V.; Park, C. H.; Park, S. U.; EXCLI Journal 2015, 14, 59. 23. La Casa, C.; Villegas, I.; La Lastra, C. A.; Motilva, V.; Calero, M. J. M.; J. Ethnopharmacol. 2000, 71, 45. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access