Nota Técnica
|
|
| Dosimetria de luz efetivamente absorvida (Dabs) pelo azul de metileno em processos de fotossensibilização utilizando fontes de luz policromáticas Light dosimetry effectively absorbed (Dabs) by methylene blue in photosensitization processes employing polychromatic light sources |
|
Bruno R. RabelloI,II,*; Wilker CaetanoII
I. Instituto Federal de Educação, Ciência e Tecnologia Catarinense, 89703-720 Concórdia - SC, Brasil Recebido em: 12/02/2017 *e-mail: rabello_bruno@hotmail.com This work presents an equation concerning effective light doses (Dabs; J cm-2) absorbed by photosensitizer molecules that are involved directly in photochemical and photodynamic processes. These molecules are photostimulated by different polychromatic LED sources with distinct photonic properties. The inherent photosensitizer photobleaching process, source irradiation emission spectrum (wavelength range), light source power, irradiation time, and LED-methylene blue spectral overlap degree were the relevant parameters considered for Dabs. This was performed with an experimental system comprised of methylene blue and its photosensitization ability on substrate DFBF (1,3-diphenylisobenzofuran) photodegradation, starting from different polychromatic LED sources. We demonstrated that such factors significantly affect photosensitizer light absorption, thus influencing the efficiency of a specific photochemical process. This occurs due to the selection of non-optimal experimental conditions associated with less precision from photonic source measurements, and therefore, less control on the actual Dabs. Such insights are interestingly absent in various studies with regards to a plethora of systems. INTRODUÇAO As reaçoes fotoquímicas estao inseridas em uma grande gama de aplicaçoes em diferentes ramos da ciência, como por exemplo: reaçoes de fotopolimerizaçao,1 degradaçao fotocatalítica de poluentes em meio aquoso,2-5 síntese de moléculas envolvendo etapas com reaçoes fotoquímicas,6-9 entre outras. No caso específico de aplicaçoes na área da saúde, tem-se observado resultados promissores empregando-se terapias que envolvem processos de absorçao de luz, como por exemplo, fotopolimerizaçao odontológica em restauraçao dentária, fotoesterilizaçao, em processos de regeneraçao celular fotoinduzida em processos de cicatrizaçao tecidual utilizando inicialmente luz LASER de baixa potência (do inglês Low Level Laser Therapy - LLLT), ou modalidades clínicas recentemente investigadas e exploradas envolvendo, por exemplo, a Terapia Fotodinâmica (TFD) e a Inativaçao Fotodinâmica de Microrganismos (IFMO).9,10 Estas últimas atuam através da fotoexcitaçao de um composto fotossensibilizador (FS) localizado no tecido afetado (tumor ou infecçao) que promove a fotodestruiçao de células/tecidos tumorais (TFD) ou microrganismos como bactérias, vírus, fungos e protozoários (IFMO), através espécies citotóxicas que danificam substratos biológicos de interesse, como o oxigênio singlete (1O2) e espécies radicalares (O2-• e OH•).9-20 Por exemplo, estudos mostraram resultados importantes na alteraçao de prognósticos de amputaçao de membros inferiores de pacientes diabéticos acometidos com infecçao, utilizando derivados fenotiazínicos como o azul de metileno (AM) e fontes de irradiaçao a base de diodos emissores de luz (light emitting diode - LED).20 O AM é um composto fotossensibilizador amplamente empregado em TFD e IFMO, sendo bastante conhecido por sua capacidade de produçao de 1O2 e outras espécies reativas na presença de luz, como AM• e O2-•, que apresentam alto potencial citotóxico.20-24 Quanto a sistemas de iluminaçao empregados em fotorreaçoes ou fotoprocessos em geral, tem-se observado o emprego crescente de LEDs em substituiçao às fontes de luz tradicionais, como por exemplo, LASERs (fontes monocromáticas bastante empregadas previamente em TFD) e lâmpadas de halogênio ou de vapor de mercúrio (fontes policromáticas empregadas em diversas fotorreaçoes).1-3,7,15,16,20,25-27 Neste caso, o crescente emprego de LEDs tem-se mostrado bastante viável devido ao avanço tecnológico e disponibilidade de sistemas com diodos montados sobre superfície (do inglês: "Surface Mounted Diodes" - SMD LEDs) com relativo baixo custo viabilizando a obtençao de fontes com diferentes potências e regioes espectrais de irradiaçao, favorecendo adaptaçoes a sistemas que possuam elevado grau de sobreposiçao espectral LED/FS sem a necessidade do uso de filtros para eliminaçao de radiaçoes indesejadas.18,25,28,29 Em relaçao ao estudo de processos fotoquímicos, os experimentos realizados inicialmente em escala laboratorial sao essenciais para produzir informaçoes relevantes que contribuam com a otimizaçao do processo em questao em termos de irradiaçao do sistema, considerando a potência da fonte, o tempo de exposiçao à irradiaçao luminosa e a regiao espectral de irradiaçao.28-30 Neste sentido, é relevante considerar os efeitos específicos causados após a absorçao de luz efetiva pela amostra em funçao de diferentes variáveis envolvendo as propriedades fotônicas, tanto da fonte emissora quanto do sistema em questao, uma vez que somente os fótons que foram absorvidos pelo FS podem induzir processos fotoquímicos/fotofísicos desejáveis (lei de Grotthus-Draper).29,30 Apesar da importância da avaliaçao de luz efetivamente absorvida nos estudos envolvendo processos fotoquímicos, muitos trabalhos na literatura nao consideram este aspecto, nos quais diversos tipos de fontes de luz com diferentes potências e perfis espectrais sao empregados de forma qualitativa, por exemplo, considerando apenas a potência absoluta de emissao da fonte de irradiaçao associada a um possível recobrimento espectral entre FS e fonte de luz.1,2,4,6,8,9,12-18,25 Adicionalmente, destaca-se o processo de fotobranqueamento sofrido por FSs durante a fotorreaçao, que é um efeito bastante negligenciado na literatura e que pode alterar significativamente a absorçao de luz pelo FS em funçao do tempo de irradiaçao.28,29,31 Estudos realizados sem um controle quantitativo sobre a luz absorvida sao verificados principalmente quando se empregam fontes de luz policromáticas, os quais exigem um formalismo matemático específico e mais complexo em relaçao a sistemas que empregam fontes monocromáticas, como LASERs.28,29 Contrapondo este cenário, a literatura apresenta ampla discussao e diversas equaçoes para determinaçao de luz absorvida pelo FS em soluçao, incluindo equaçoes destinadas a sistemas que empregam fontes policromáticas,22,26,28,29,32-34 utilizadas para determinaçao de diversas propriedades fotofísicas, como: rendimento quântico de fluorescência (ΦF),35,36 rendimento quântico de fotobranqueamento (ΦFB),31 rendimento quântico de geraçao de oxigênio singlete 1O2 (ΦΔ 1O2) ou de outras espécies reativas de oxigênio.3,28,29,31 Em trabalhos previamente publicados,28,29 foi apresentada uma equaçao para determinaçao de número de fótons absorvidos por FSs em soluçao (Nabs), visando o aprimoramento de metodologias químicas relacionadas à determinaçao de valores de ΦΔ 1O2 para diferentes FSs, empregando uma única fonte de irradiaçao de acordo com a classe de FS.28,29 Por sua vez, neste trabalho é apresentada uma equaçao mais apropriada referente à dose de luz efetivamente absorvida (Dabs; [J cm -2]) por uma molécula fotossensibilizadora, termo bastante empregado em estudos de sistemas biológicos,12-16 no sentido de fornecer valores reais de dose de luz absorvida para avaliaçoes relativas de fotoatividade de compostos FSs envolvidos diretamente em processos fotoquímicos ou fotodinâmicos, sob influência de fotoestimulaçao proporcionada por diferentes fontes de LED policromáticas com distintas propriedades fotônicas, sem a necessidade de padroes específicos. A equaçao Dabs proposta considera os fatores: potência da fonte de luz, tempo de exposiçao do FS ao fluxo de fótons, espectro de emissao (regiao de comprimento de onda) de irradiaçao da fonte, grau de recobrimento espectral FS/fonte de luz, e principalmente, o processo inerente de fotodegradaçao ou fotobranqueamento do FS, desta forma levando em conta os principais parâmetros referentes à dependência da absorçao de luz pela molécula de interesse. Neste trabalho, a equaçao Dabs proposta foi empregada no estudo da fotoatividade do AM para avaliar seu potencial de geraçao de 1O2 sob irradiaçao com diferentes fontes de luz a base de LEDs, com diferentes potências e comprimentos de onda de irradiaçao. Sua fotoatividade foi correlacionada com seus respectivos valores de Dabs para cada sistema fotorreacional, no sentido de indicar qual das fontes LED empregadas é mais eficiente para produçao de 1O2, considerando todas as variáveis mencionadas. O AM foi estudado em meio etanólico e em concentraçao relativamente baixa (7.2 x 10-6 mol L-1), condiçoes em que se encontra somente a espécie monomérica do FS e seu mecanismo de fotoatividade é somente por tipo II (geraçao de 1O2).23 A geraçao de 1O2 foi monitorada indiretamente por espectrofotometria de absorçao eletrônica através do consumo do substrato antioxidante 1,3-difenilisobenzofurano (DFBF), um supressor químico para 1O2.32,37,38
MATERIAIS E MÉTODOS O fotossensibilizador azul de metileno/AM foi adquirido da B'Herzog e o substrato antioxidante 1,3-difenilisobenzofurano/DFBF foi adquirido da Sigma-Aldrich; etanol de grau analítico adquirido da Synth foi utilizado como solvente. Para irradiaçao luminosa do sistema (Esquema 1) foram utilizados quatro diferentes conjuntos de LEDs com propriedades fotônicas distintas, adquiridos da Cromatek: LED azul (84 mW cm-2; λmáx 473 nm), LED verde (30 mW cm-2; λmáx 519 nm), LED laranja (31 mW cm-2; λmáx 590nm) e LED vermelho (8 mW cm-2; λmáx 642nm).
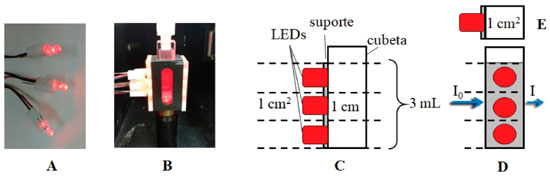 Esquema 1. (A) Arranjo de LEDs; (B) Arranjo experimental (espectrofotômetro): cubeta adaptada com arranjo do sistema de irradiaçao a base de LEDS (A); (C) Representaçao esquemática de (B): vista frontal; (D) Representaçao esquemática de (B): vista lateral: arranjo de LEDs perpendicular ao feixe incidente (I0) do espectrofotômetro; (E) Representaçao esquemática de (B): vista superior
A reaçao foi conduzida com 3.00 mL de amostra contendo azul de metileno/AM (7.2 x 10-6 mol L-1) e 1,3-difenilisobenzofurano/DFBF (2.5 x 10-5 mol L-1) em cubeta de quartzo e irradiada por conjuntos de 3 LEDs (modelo 5 mm) adaptados nas laterais da cubeta e perpendicular à direçao do feixe de um espectrofotômetro de absorçao eletrônica UV-Vis (Varian, modelo Cary 50), conforme apresentado no Esquema 1. Os parâmetros dos LEDs (espectro de emissao e irradiância espectral; [W cm-2 nm-1]) foram obtidos por um radiômetro modelo USB 2000 (Ocean Optics). Os processos fotorreacionais foram realizados diretamente no porta-amostras do espectrofotômetro mantendo a irradiaçao constante na amostra por cada sistema de LEDs, sem a observaçao de interferência pela luz emitida pelos LEDs no monitoramento dos espectros de absorçao eletrônica do AM e DFBF no sistema devido ao equipamento utilizar o modo de radiaçao em fase.
RESULTADOS E DISCUSSAO A Figura 1 apresenta os espectros de absorçao eletrônica para o AM (7.2 x 10-6 mol L-1) e DFBF (2.5 x 10-5 mol L-1), sobrepostos aos espectros de irradiância espectral (I0; [W cm-2 nm-1]) dos diferentes LEDs empregados no estudo, evidenciando as diferenças em suas propriedades fotônicas (espectro de emissao e irradiância). O sistema estudado é bastante conveniente devido à ausência de sobreposiçao do espectro de absorçao eletrônica do substrato DFBF ao do fotossensibilizador AM, possibilitando o monitoramento do consumo do DFBF (λmáx 411 nm) sem interferências causadas por compartilhamento de fótons entre FS e substrato, o que também poderia influenciar no processo de fotoexcitaçao do AM. Outro fator importante é que o DFBF praticamente nao apresenta sobreposiçao de seu espectro de absorçao eletrônica nas regioes espectrais de irradiaçao dos LEDs, ressaltando que a sobreposiçao espectral nao significativa DFBF/LED azul (<1% de absorçao de fótons do LED pelo DFBF) nao induziu sua fotodegradaçao direta na ausência de AM (resultados nao mostrados). Os espectros de emissao dos LEDs vermelho (λmáx 642 nm) e laranja (λmáx 590 nm) apresentam um maior grau de sobreposiçao espectral com o espectro de absorçao eletrônica do AM (regioes de máxima absorçao eletrônica), já os LEDs verde (λmáx 519 nm) e azul (λmáx 473 nm) irradiam em regioes de baixa sobreposiçao espectral com o espectro absorçao eletrônica do AM, a princípio gerando um baixo percentual de luz absorvida em comparaçao aos LEDs vermelho e laranja. Contudo, observaçoes qualitativas referentes à potência ou ao recobrimento espectral LED/AM nao indicam qual sistema de LEDs empregado neste caso promove maior dose de luz efetivamente absorvida pelo AM, sendo necessário determinar sua dose de luz efetivamente absorvida durante o processo (Dabs; [J cm-2]), por exemplo.
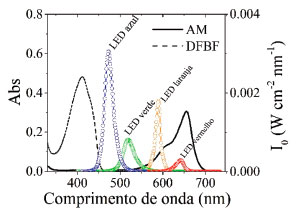 Figura 1. Espectros de absorçao eletrônica para o AM (7.2 x 10-6 mol L-1) e DFBF (2.5 x 10-5 mol L-1) em etanol a 25 ºC, sobrepostos aos espectros de irradiância absoluta (I0; [W cm-2 nm-1]) dos diferentes LEDs: LED azul (84 mW cm-2; λmáx 473 nm), LED verde (30 mW cm-2; λmáx 519 nm), LED laranja (31 mW cm-2; λmáx 590 nm) e LED vermelho (8 mW cm-2; λmáx 642 nm)
Inicialmente, a equaçao (1) foi utilizada para determinaçao dos valores de irradiância emitida (Iem; [W cm-2]) para cada conjunto de LEDs, fornecendo seu respectivo valor de área espectral:3,28  em que λi e λf sao respectivamente os comprimentos de onda inicial e final do espectro de emissao do LED (nm), e I0 é a irradiância espectral do LED (W cm-2 nm-1). Através dos espectros de absorçao eletrônica (Abs), a quantidade de luz absorvida pelo FS em soluçao é determinada através de sua fraçao de luz absorvida (Xabs; equaçao (2)):28,34,39  Por sua vez, a irradiância absorvida pelo FS (Iabs; [W cm-2]) é dada pelo produto da sobreposiçao espectral entre Iem (equaçao (1)) e Xabs (equaçao (2)) para cada comprimento de onda, fornecendo a equaçao (3):3,28 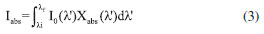 em que λi e λf sao respectivamente os comprimentos de onda inicial e final do espectro onde ocorre sobreposiçao espectral LED/FS. Como exemplo, a Figura 2 apresenta espectros referentes aos fatores Xabs, Iem e Iabs para um sistema contendo AM (7.2 x 10-6 mol L-1) em soluçao etanólica sob irradiaçao com o LED vermelho, mostrando os espectros de Iem do LED (8 mW cm-2) e Iabs pelo AM (3.1 mW cm-2).
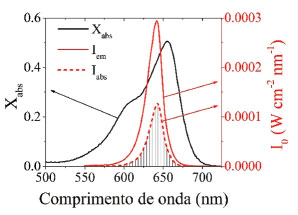 Figura 2. Espectro de Xabs para o AM (7.2 x 10-6 mol L-1) em etanol sobreposto aos espectros de irradiância espectral emitida pelo LED (Iem = 8mW cm-2) e absorvida pelo AM (Iabs = 3.1 mW cm-2)
De posse dos valores de Iabs para um sistema, os valores de dose de luz absorvida (Dabs; [W s cm-2 ou J cm-2]) para FSs fotoestáveis podem ser determinados através da equaçao (4):32 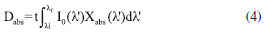 em que λi e λf sao respectivamente os comprimentos de onda inicial e final do espectro onde ocorre sobreposiçao espectral LED/FS, e t é o tempo de irradiaçao da amostra. A equaçao (4) é coerente apenas para sistemas fotoestáveis, nos quais nao há fotodegradaçao significativa do FS durante a irradiaçao da amostra. Contudo, é comum verificar efeitos fotodegradativos de FSs de diferentes classes, podendo resultar numa considerável reduçao da taxa efetiva de fótons absorvidos, que é dependente da potência da fonte, recobrimento espectral LED/FS, tempo de irradiaçao e fotobranqueamento do FS.9,28,29 Desta forma, é importante considerar a variaçao da taxa de fótons efetivamente absorvidos durante o processo, que pode ser corrigido através da substituiçao do termo t pelo 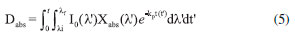 Em que kp é a constante cinética de primeira ordem referente ao fotobranqueamento do FS.28,29 A integral em t' corrige o fotobranqueamento considerando a variaçao da fraçao de moléculas fotodegradadas em funçao do tempo. A equaçao (5) é coerente para sistemas na ausência e na presença de fotobranqueamento, uma vez que nao ocorrendo o fotobranqueamento o valor de kp tende a 0, logo o termo O comportamento temporal dos espectros de absorçao eletrônica para esta fotorreaçao foi exemplificado com o sistema empregando o LED vermelho (Figura 3-A), em que o consumo do substrato DFBF ocorreu durante a fotoexcitaçao do AM, mostrando um consumo do DFBF relativamente rápido (~20 min) em relaçao ao processo concomitante de fotodegradaçao do AM. A Figura 3-B apresenta o perfil de degradaçao do DFBF para obtençao de seu respectivo valor de constante cinética de fotorreaçao (kD = 0.63 min-1) ajustado por equaçao exponencial de primeira ordem,29 sendo consumido majoritariamente pelo 1O2 formado durante a irradiaçao da amostra.24 A Figura 3-C apresenta os perfis cinéticos de consumo para o DFBF empregando os quatro diferentes conjuntos de LEDs, nos quais as velocidades de consumo estao relacionadas majoritariamente à taxa de produçao de 1O2 em soluçao, que por sua vez depende da quantidade efetiva de fótons absorvidos pelo AM.
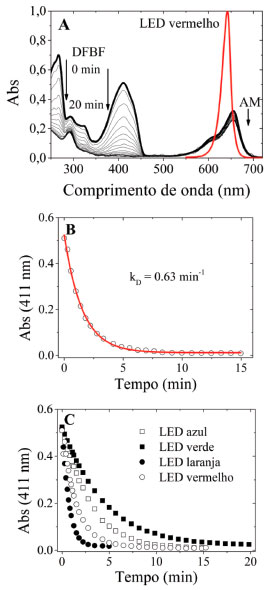 Figura 3. (A) Comportamento espectral para a fotorreaçao contendo AM (7.2 x 10-6 mol L-1) e DFBF (2.5 x 10-5 mol L-1) em etanol a 25 ºC, associado ao espectro normalizado do LED vermelho (8 mW cm-2; λmáx 642 nm) utilizado para irradiaçao da amostra durante 20 min (a linha mais grossa representa o espectro inicial); (B) Respectivo ajuste do perfil cinético de degradaçao de primeira ordem do DFBF em seu λmáx 411 nm para obtençao de kD (0.63 min-1); (C) Perfil cinético de consumo (fotodegradaçao) do DFBF empregando os diferentes conjuntos de LEDs
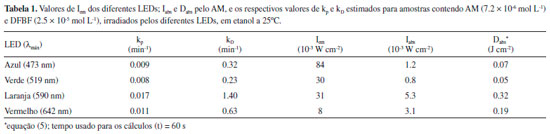
A Tabela 1 apresenta os valores de Iem, Iabs, Dabs, kp e kD empregando os diferentes LEDs para irradiaçao das amostras. A ordem apresentada pelos valores de Iem (LED vermelho < LED laranja ≈ LED verde < LED azul), que está relacionada exclusivamente à potência de luz emitida por cada LED, a qual se mostrou diferente da ordem apresentada pelos valores estimados experimentalmente de Dabs (LED verde ≈ LED azul < LED vermelho < LED laranja), evidenciando que, além da potência de emissao da fonte de luz, devem ser considerados outros fatores como a sobreposiçao espectral LED/AM, o tempo de irradiaçao, além de eventuais processos de fotobranqueamento do FS.
Por exemplo, para o intervalo de tempo calculado de 60 s, o resultado calculado de Dabs para o LED vermelho, de menor valor de Iem (8 mW cm-2), foi superior ao observado pelo LED azul, que apresentou o maior valor de Iem (84 mW cm-2). Por sua vez, o LED laranja de valor intermediário de Iem (31 mW cm-2, similar ao LED verde), apresentou o maior valor de Dabs devido a sua considerável potência de emissao e elevado grau de recobrimento espectral AM/LED laranja, embora apresentasse o dobro do grau de fotobranqueamento comparado aos outros LEDs. Neste caso o LED verde, com metade do grau de fotobranqueamento em relaçao ao LED laranja e similar aos outros, apresentou o menor valor de Dabs. Adicionalmente, a Figura 4 mostra que, neste estudo apresentado, os valores de kD seguiram a mesma ordem dos valores de Dabs (LED verde ≈ LED azul < LED vermelho < LED laranja), indicando que a taxa de geraçao de 1O2 foi mais elevada para os sistemas que apresentaram maior dose de luz efetivamente absorvida pelo AM durante um mesmo intervalo de tempo, sendo que os valores de Dabs refletem a relevância dos fatores experimentais considerados na equaçao 5 para a eficiência máxima do fotoprocesso.
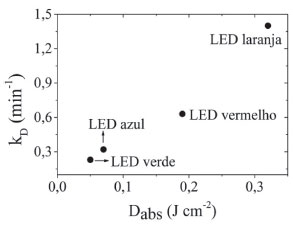 Figura 4. Gráfico de kD vs Dabs utilizando os diferentes LEDs
Simultaneamente ao consumo do substrato, foram observados processos fotodegradativos do AM durante a irradiaçao das amostras, e seus respectivos valores de kp (Tabela 1) foram extraídos de ajustes das curvas de fotobranqueamento através de equaçao cinética de primeira ordem (dados nao apresentados). Os valores de kp foram utilizados para correçao dos resultados de Dabs através do termo
CONCLUSAO O presente estudo propoe uma equaçao apropriada referente à dose efetiva de luz absorvida (Dabs) por uma molécula fotossensibilizadora envolvida diretamente em processos fotoquímicos e fotodinâmicos, sob influência de irradiaçao luminosa proporcionada por diferentes fontes policromáticas (LEDs) com propriedades fotônicas distintas. Neste estudo, a dependência de fatores experimentais presentes no sistema fotodinâmico compreendendo o FS azul de metileno, através de sua capacidade de fotossensibilizaçao do substrato DFBF por oxigênio singlete sobre açao da luz, foi analisada calculando-se Dabs pelas diferentes fontes. Para o intervalo de tempo calculado de 60 s, o valor de Dabs para o LED vermelho, de menor valor de irradiância (Iem = 8 mW cm-2), foi superior ao observado pelo LED azul, que apresentou o maior valor de Iem (84 mW cm-2). Por sua vez o LED laranja de valor intermediário de Iem (31 mW cm-2, e similar ao LED verde), apresentou o maior valor de Dabs devido a sua considerável potência de emissao e elevado grau de recobrimento espectral AM/LED laranja, embora apresentasse o dobro do grau de fotobranqueamento comparado aos outros LEDs. Neste caso o LED verde, com metade do grau de fotobranqueamento em relaçao ao LED laranja e similar aos demais, apresentou o menor valor de Dabs. Assim a ordem LED verde ≈ LED azul < LED vermelho < LED laranja evidenciada pelos valores de Dabs reflete a relevância dos fatores experimentais considerados na equaçao 5 para a eficiência máxima do fotoprocesso, fornecendo assim maior aproximaçao dos valores reais de Dabs e indicando a fonte LED mais eficiente. Demonstramos através deste estudo que os fatores considerados na equaçao 5 influenciam na eficiência de processos fotoquímicos, podendo reduzir esta eficiência por meio da escolha de condiçoes experimentais menos apropriadas associadas à menor precisao inferida de mediçoes de fontes fotônicas, o que interessantemente tem sido verificado em estudos em diferentes ramos. Portanto, o fator de dose efetivamente absorvida (Dabs) aqui proposto visa fornecer uma avaliaçao quantitativa da dose real de luz absorvida pelos sistemas fotoquímicos/fotodinâmicos.
AGRADECIMENTOS Os autores agradecem ao CNPq, CAPES, Fundaçao Araucária e SETI/UGF - Paraná pelo suporte e apoio financeiro.
REFERENCIAS 1. Xiao, P.; Dumur, F.; Graff, B.; Zhang, J.; Morlet-Savary, F.; Gigmes, D.; Fouassier, J. P.; Lalevee, J.; J. Polym. Sci., Part A: Polym. Chem. 2015, 53, 567. 2. Agboola, B.; Ozoenema, K. I.; Nyokong, T.; J. Mol. Catal. A: Chem. 2006, 248, 84. 3. Goldstein, S.; Aschengrau, D.; Diamant, Y.; Rabani, J.; Environ. Sci. Technol. 2007, 41, 7486. 4. Kluson, P.; Drobek, M.; Kalaji, A.; Zarubova, S.; Krysa, J.; Rakusan, J.; J. Photochem. Photobiol., A 2008, 199, 267. 5. Weller, C.; Horn, S.; Herrmann, H.; J. Photochem. Photobiol., A 2013, 255, 41. 6. Kim, S. W.; Park, J. H.; Yang, S. D.; Hur, M. G.; Choi, C. W.; Yu, K. H.; Bull. Korean Chem. Soc. 2008, 29, 2023. 7. Hager, B.; Strauss, W. S. L.; Falk, H.; Photochem. Photobiol. 2009, 85, 1206. 8. Lin-Fang, H.; Zeng-Hui, W.; Shi-Lin, C.; Chin. J. Nat. Med. 2014, 12, 81. 9. Gonçalves, R. S.; Rabello, B. R.; Cesar, G. B.; Pereira, P. C. S., Ribeiro, M. A. S.; Meurer, E. C.; Hioka, N.; Nakamura, C. V.; Bruschi, M. L. Caetano, W.; Org. Process Res. Dev. 2017, 21, 2025. 10. Bressler, N. M.; Arch. Ophthalmol. 2001, 119, 198. 11. Reis, V. V.; Nonose, D. S. S. L.; Oyama, J.; Lalucci, M. P. P. S.; Demarchi, I. G.; Aristides, S. M. A.; Teixeira, J. J. V.; Silveira, T. G. V.; Lonardoni, M. V. C.; Photodiagn. Photodyn. Ther. 2018, 21, 294. 12. Cizekova, L.; Grolmusova, A.; Ipothova, Z.; Barbierikova, Z.; Brezova, V.; Hunakova, L.; Imrich, J.; Janovec, L.; Dovinova, I.; Paulikova, H.; Bioorg. Med. Chem. 2004, 22, 4684. 13. Agrawal, N.; Ray, R. S.; Farooq, M.; Pant, A. B.; Hans, R. K.; Photochem. Photobiol. 2007, 83, 1226. 14. Li, W. T.; Tsao, H. W.; Chen, Y. Y.; Cheng, S. W.; Hsu, Y. C.; Photochem. Photobiol. Sci. 2007, 6, 1341. 15. Fotinos, N.; Convert, M.; Piffaretti, J. C.; Gurny, R.; Lange, N.; Antimicrob. Agents Chemother. 2008, 52, 1366. 16. Kussovski, V.; Mantareva, V.; Angelov, I.; Orozova, P.; Wohrle, D.; Schnurpfeil, G.; Borisova, E.; Avramov, L.; FEMS Microbiol. Lett. 2009, 294, 133. 17. Zhao, Y.; Xia, Q.; Yin, J. J.; Lin, G.; Fu, P. P.; Toxicol. Lett. 2011, 205, 302. 18. Xu, H.; Liu, C.; Mei, J.; Yao, C.; Wang, S.; Wang, J.; Li, Z.; Zhang, Z.; Int. J. Nanomed. 2012, 7, 5029. 19. Simplicio, F. I.; Maionchi, F.; Hioka, N.; Quim. Nova 2002, 25, 801. 20. Tardivo, J. P.; Adami, F.; Correa, J. A.; Pinhal, M. A. S.; Baptista, M. S.; Photodiagn. Photodyn. Ther. 2014, 11, 342. 21. Kasimova, K. R.; Sadasivam, M.; Landi, G.; Sarna, T.; Hamblin, M. R.; Photochem. Photobiol. Sci. 2014, 13, 1541. 22. Macdonald, I. J.; Dougherty, T. J.; J. Porphyrins Phthalocyanines 2001, 5, 105. 23. Junqueira, H. C.; Severino, D.; Dias, L. G.; Gugliotti, M. S.; Baptista, M. S.; Phys. Chem. Chem. Phys. 2002, 4, 2320. 24. Severino, D.; Junqueira, H C.; Gugliotti, M.; Gabrielli, D. S.; Baptista, M. S.; Photochem. Photobiol. 2003, 77, 459. 25. Poutaraud, A.; Gregorio, F.; Tin, V. C. F.; Girardin, P.; Planta. Med. 2001; 67, 254. 26. Ricatto, L. G. O.; Conrado, L. A. L.; Turssi, C. P.; França, F. M. G.; Basting, R. T.; Amaral, F. L. B.; Eur. J. Dent. 2014, 28, 509. 27. Montanha, M. C.; Silva, L. L.; Pangoni, F. B B.; Cesar, G. B.; Gonçalves, R. S.; Caetano, W.; Hioka, N.; Tominaga, T. T.; Consolaro, M. E. L.; Diniz, A.; Kimura, E.; J. Photochem. Photobiol., B 2017, 170, 247. 28. Rabello, B. R.; Gerola, A. P.; Pellosi, D. S.; Tessaro, A. L.; Aparicio, J. L.; Caetano, W.; Hioka, N.; J. Photochem. Photobiol., A 2012, 238, 53. 29. Gerola, A. P.; Semensato, J.; Pellosi, D. S.; Batistela, V. R.; Rabello, B. R.; Hioka, N.; Caetano, W.; J. Photochem. Photobiol., A 2012, 232, 14. 30. Bolton, J.; Mayor-Smith, I.; Linden, K. G.; Photochem. Photobiol. 2015, 91, 1252. 31. Hadjur, C.; Lange, N.; Rebstein, J.; Monnier, P.; Bergh, H.; Wagnières, G.; J. Photochem. Photobiol., B. 1998, 45, 170. 32. Dougherty, T. J.; Gomer, C. J.; Weishaupt, K. R.; Cancer Res. 1976, 36, 2330. 33. Gandin, E.; Lion, Y.; J. Photochem. 1982, 20, 77. 34. Bonacin, J. A.; Engelmann, F. M.; Severino, D.; Toma, H. E.; Baptista, M. S.; J. Braz. Chem. Soc. 2009, 20, 31. 35. Vilsinski, B. H.; Gerola, A. P.; Enumo, J. A.; Campanholi, K. S. S.; Pereira, P. C. S.; Braga, G.; Hioka, N.; Kimura, E.; Tessaro, A. L.; Caetano, W.; Photochem. Photobiol. 2015, 91, 518 36. Pereira, P. C. S.; Costa, P. F. A.; Pellosi, D. S.; Calori, I. R.; Vilsinski, B. H.; Estevao, B. M.; Hioka, N.; Caetano, W.; J. Mol. Liq. 2017, 230, 674. 37. Gandin, E.; Lion, Y.; Vorst, A. V.; Photochem. Photobiol. 1983, 37, 271. 38. Redmond, R. W.; Gamlin, J. N.; Photochem. Photobiol. 1999, 71, 391. 39. Krishna, C. M.; Uppuluri S.; Riesz, P.; Zigler, J. S.; Balasubramanian, D.; Photochem. Photobiol. 1991, 54, 51. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access






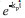 termo integrado em funçao do tempo, conforme mostra a equaçao (5):28,29,31
termo integrado em funçao do tempo, conforme mostra a equaçao (5):28,29,31