Artigo
|
|
| Hidrólise enzimática, fermentação e produção de biocombustíveis através da coroa de Ananas comosus Enzymatic hydrolysis, fermentation and biofuels production from Ananas comosus crown |
|
Jumelice dos S. SilvaI,#; Valéria R. dos S. MaltaI; Martha S. R. dos Santos-RochaII; Renata M. R. G. AlmeidaII; Márcia A. GomesIII; Cecília D. VicenteIV; Kledson L. BarbosaI,*
I. Instituto de Química e Biotecnologia, Universidade Federal de Alagoas, 57072-900 Maceió - AL, Brasil Recebido em 26/04/2017 *e-mail: kledsonlopesb@gmail.com Problems related to the use of fossil fuels and greenhouse gas emissions have become global concerns. To address this issue, the strategy adopted in the present study was to use Ananas comosus residues as a source of fermentable carbohydrates to produce second generation ethanol and briquettes. The demand for biofuel is addressed in the present study by the integrated processing of several stages of treatment of the lignocellulosic substrate: chemical characterization, pretreatment, enzymatic hydrolysis and fermentation. It was verified under the conditions used that the enzymatic hydrolysis liberated after 72 hours 58.44 and 21.91 g L-1 of glucose and xylose, respectively. Conversion of the sugars in the fermentation step resulted in 18.80 g L-1 ethanol in 24 hours. The briquettes produced from the remaining solid fraction of the enzymatic hydrolysis presented a calorific value of 18.41 kJ kg -1. INTRODUÇAO A rápida expansao da populaçao humana mundial, o aumento da frequência e intensidade de regioes secas, e a diminuiçao de umidade do solo, tornaram-se os principais problemas da sociedade no século XXI.1-3 Esses agravos comprometem a segurança alimentar e o futuro energético, uma vez que aumenta-se a disputa por recursos hídricos e terrestres, sejam na produçao urbana ou na agricultura, exigindo cada vez mais o uso de água doce.4 No entanto, a existência e o desenvolvimento de novas tecnologias buscam mitigar esses desafios através do uso de plantas com metabolismo especializado de fotossíntese, que as tornam capazes de suportar o estresse hídrico em regioes de seca.5 Essa direçao positiva para tais plantas as tornam alvo para o estudo de culturas bioenergéticas.4 O progresso no uso de plantas com metabolismo ácido crassuláceo (CAM) pode ser alcançado através da transferência genética das características das plantas CAM para as culturas de alimentos e de biomassa já existentes. Algumas espécies de plantas CAM já estao sendo investigadas para a produçao de biocombustíveis devido a seu rendimento teórico de biomassa, como, por exemplo, Agave spp.,6 Opuntia ficus-indica7 e Sisal spp.8 Outro ponto importante é que com o uso de plantas CAM, podem-se alcançar rendimentos maiores de colheita em regioes de intenso calor e seca, além de contribuir com a possibilidade de utilizar terras abandonadas e semiáridas para a produçao agrícola.4 Considerada uma alternativa à produçao de biocombustível, a biomassa lignocelulósica trata-se de uma fonte de energia renovável de baixo custo, com grande disponibilidade geográfica e com reduçao líquida nas emissoes de carbono na atmosfera.9-11 A biomassa pode ser processada em diferentes equipamentos e apresentar diferentes tamanhos de partículas. Em uma usina de energia, por exemplo, os pellets de biomassa sao utilizados sob a forma de pequenas partículas, o que permite seu uso como carvao.12,13 A biotransformaçao dos resíduos agrícolas em açúcares fermentescíveis com posterior produçao de etanol de segunda geraçao é economicamente viável. Entretanto, as tecnologias empregadas para bioconversao da biomassa lignocelulósica, através dos resíduos agroindustriais ainda nao sao totalmente eficientes para produçao de etanol em escala industrial, haja vista os custos com capital e operacionais.14,15 Mesmo com esses desafios, as fontes de energias renováveis continuam sendo uma alternativa para substituir gradualmente o uso de combustíveis fósseis. Além disso, é importante para a geraçao de empregos nas áreas rurais e pode substituir a importaçao de combustível refinado.16-18 Nesse sentido, o presente estudo teve como objetivo produzir etanol de segunda geraçao a partir da coroa do Ananas comosus (parte superior do fruto) utilizando etapas integradas de pré-tratamento à base de água em temperaturas moderadas, hidrólise enzimática e fermentaçao. Além disso, o trabalho também teve o objetivo de propor o uso dos resíduos remanescentes da hidrólise enzimática para gerar combustível sólido na forma de briquetes.
PARTE EXPERIMENTAL Materiais Os resíduos de Ananas comosus foram obtidos a partir de um mercado local em Maceió - Alagoas. Para fins analíticos, foi utilizado neste estudo apenas a coroa do abacaxi (parte superior do fruto). A caracterizaçao química foi realizada de acordo com o procedimento analítico descrito por Sluiter et al.19 modificado por Rocha et al.20 e validado por Gouveia et al.21 Os ensaios foram realizados no Laboratório de Bebidas e Tecnologia de Alimentos, localizado no Centro de Tecnologia da Universidade Federal de Alagoas, durante o ano de 2017. Pré-tratamento Para o pré-tratamento dos resíduos de Ananas comosus, 10 g de biomassa foram suspensas em 90 mL de água destilada em frascos de Erlenmeyer em reator do tipo autoclave a 121 °C por 30 minutos de reaçao. Depois de retornar à temperatura ambiente, as misturas foram filtradas para recuperaçao da fraçao sólida. No final do procedimento, a fraçao sólida foi seca em estufa a 50 °C até atingir um teor de umidade abaixo de 10%, e entao armazenada à temperatura ambiente para uso posterior na etapa de hidrólise enzimática. Hidrólise enzimática A biomassa pré-tratada foi hidrolisada com uma carga de sólidos de 15% (p/v), equivalente a 7,5 g de biomassa seca, utilizando 20 FPU/g de biomassa do complexo enzimático Cellic® CTec2-Cellulase (Novozymes Latin America Ltda) em meio reacional de 50 mL contendo tampao citrato 50 mmol L-1 (pH 5,0). Os ensaios foram incubados em um agitador a 50 °C, 150 rpm por 24 horas, com retiradas de alíquotas nos tempos de 0, 6, 12, 24, 48 e 72 horas para quantificar os açúcares liberados por cromatografia líquida de alta eficiência (HPLC). A atividade enzimática do complexo celulolítico foi determinada de acordo com Ghose.22 Preparaçao de inóculo de levedura A reativaçao da levedura Saccharomyces cerevisiae JAY-270 foi realizada suspendendo as células cerca de 0,1% em 100 mL (v/v) de meio de cultura líquido YEPD (1% de extrato de levedura; 1% de peptona de carne e 2% dextrose) e incubou-se a 28 °C por 48 horas a 100 rpm. Após o período de incubaçao, o meio de cultura foi centrifugado para retirada da biomassa de levedura. Fermentaçao do licor sacarificado Inoculou-se 5% de cultura de células em 20 mL do licor hidrolisado de Ananas comosus (v/v), suplementado com extrato de levedura (6,8 g L-1), MgSO4(1,4 g L-1), uréia (5,3 g L-1) e KH2PO4(5,6 g L-1). As fermentaçoes foram realizadas em um agitador a 30 °C e 150 rpm por 24 horas. Em seguida, amostras foram coletadas nos tempos de 0, 2, 4, 8 e 24 horas para monitorar a cinética do consumo de açúcares e a produçao de etanol por HPLC. Produçao de briquetes Esta etapa foi realizada na mini Usina de adensamento de biomassa da Universidade Federal de Alagoas - UFAL, fazendo uso da prensa IKA-WERKE, com 0,5 g do material, sob pressao por 3 minutos. Em seguida, foram realizadas análises físico-químicas de poder calorífico, umidade e teor de cinzas. Análise estatística Os ensaios foram realizados usando-se três réplicas para cada amostra. Os dados sao expressos como a média da triplicata ± o desvio padrao. Para análise estatística utilizou-se o software Origin versao 8.0.
RESULTADOS E DISCUSSAO Caracterizaçao química A composiçao química média da coroa de Ananas comosus nao tratada aplicada neste estudo é apresentada na Tabela 1.
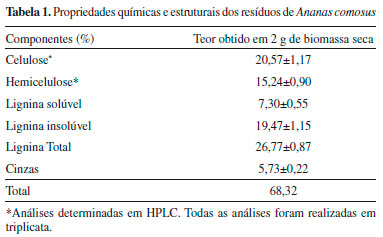
Huang et al.23 também determinaram as propriedades físico-químicas das fibras das cascas do abacaxi como um ingrediente potencial. Os autores mostraram que os principais açúcares presentes na biomassa seca eram glicose e xilose, afirmando ainda que os resíduos do abacaxi sao formados majoritariamente por celulose. Considerando o balanço de massa referente a caracterizaçao química da biomassa, é possível constatar que apenas 68,32% da composiçao do material lignocelulósico de Ananas comosus foi determinada. Possivelmente, a porcentagem de 31,68% esteja relacionada com outros componentes estruturais, como proteínas, lipídeos e outros açúcares nao quantificados nesse estudo. Com o objetivo de introduzir um novo processo para produçao de etanol, Pourbarani et al.24 registraram também a composiçao química do resíduo de laranja, demonstrando que esse substrato cítrico continha em sua composiçao 22% de celulose, 11,09% de hemicelulose e 2,19% de lignina. Comparando a composiçao estrutural desse resíduo com o de Ananas comosus, pode-se afirmar que a porcentagem dos complexos poliméricos (celulose e hemicelulose) foi bem próxima a dos resultados descritos neste estudo. Contudo, uma expressiva diferença para a fraçao lignina, provavelmente, por ser um dos principais constituintes da planta, sendo responsável pela sua resistência,25 característica encontrada nas folhas de Ananas comosus, que compoe a coroa. Outra possível explicaçao pode estar relacionada com sua menor solubilidade o que faz com que esse polímero nao seja facilmente digerido. Hidrólise enzimática da coroa de Ananas comosus Na Figura 1 é mostrada a biotransformaçao da biomassa lignocelulósica através da hidrólise enzimática. Após quantificaçao em HPLC, 58,44 e 21,91 g L-1 de glicose e xilose, respectivamente, foram alcançados.
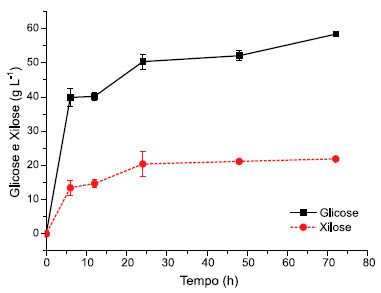 Figura 1. Biotransformaçao dos resíduos da coroa de Ananas comosus durante a hidrólise enzimática (os valores sao dados em g açúcar/L soluçao)
Os resultados obtidos nesse estudo afirmam, portanto, que a hidrólise da coroa de Ananas comosus, utilizada como substrato, teve impacto positivo no metabolismo enzimático para a produçao de açúcares fermentescíveis. Além disso, é possível deduzir que a atividade enzimática teve crescimento exponencial à medida que o tempo de hidrólise enzimática prosseguia, mostrando que esse processo resultou em diminuiçao das fibras de biomassa e um aumento concomitante dos açúcares solúveis, porém, com menor taxa de liberaçao para xilose. Para os carboidratos totais quantificados nesse estudo (Tabela 1), o teor de glicose foi 37,47% maior no licor sacarificado em relaçao à liberaçao de xilose, o que pode representar uma hidrólise mais eficiente para conversao de celulose em glicose, visto que o complexo enzimático utilizado caracteriza-se por conter em sua formulaçao celulases. Além disso, esses resultados foram obtidos com uma carga enzimática de 20 FPU/g de biomassa, sugerindo, portanto, ser um dado potencial para aplicaçao futura de novos ensaios de hidrólise enzimática com diferentes cargas de sólidos e enzima, assim como, testes de hidrólise combinada empregando-se celulases e hemicelulases na mesma reaçao. Por outro lado, ainda que a condiçao de hidrólise tenha sido favorável à celulose, a concentraçao de xilose alcançada (21,91 g L-1) mostrou-se bastante significativa, levando-se a considerar a importância do uso de leveduras recombinantes, capazes de fermentar simultaneamente glicose e xilose, visando uma produçao de etanol mais atrativa. Segundo Tropea et al.,26 essa alternativa de uso de microrganismos melhorados geneticamente pode valorizar as concentraçoes e a produtividade finais de etanol, uma vez que as pentoses (majoritariamente xilose) poderiam ser também fermentadas a partir do licor sacarificado. Ainda sobre a reduçao de açúcares da biomassa da coroa de Ananas comosus, Boonwong et al.27 investigaram o seu potencial para produçao de açúcares por via enzimática. Após o pré-tratamento da biomassa empregando o ácido sulfúrico como catalisador da reaçao para desestruturar as fibras da coroa do abacaxi, os autores empregaram a enzima cellulase (Cellic®CTec2) na etapa de hidrólise enzimática obtendo-se 113,70 g L-1 de açúcares redutor. No entanto, esses resultados apontam fragilidades no que se refere a quantificaçao específica dos diferentes carboidratos presentes nas fraçoes celulose e hemicelulose da biomassa, uma vez que nao houve, por exemplo, distinçao das hexoses e pentoses. A fermentaçao dos açúcares redutores totais com a cepa de Saccharomyces cerevisiae TISTR 5596 alcançou a produçao máxima de 33,58 g L-1 de etanol, demonstrando que os resíduos da coroa do abacaxi podem ser um material adequado para produçao de etanol. Fermentaçao do licor hidrolisado de Ananas comosus Na Figura 2 é mostrado o curso da produçao de etanol bem como o consumo dos açúcares presentes na biomassa. A taxa de utilizaçao de açúcares pela levedura Saccharomyces cerevisiae JAY-270 nas quatro primeiras horas foi relativamente alta e a produçao de etanol apresentou considerável declínio após 5 horas de fermentaçao. A produçao de etanol foi de 18,80 g L-1 em 24 horas, porém, seu mais alto grau foi obtido após as primeiras 4 horas de fermentaçao alcançando 31,10 g L-1 de etanol. A produçao de etanol a partir dos resíduos das folhas de Ananas comosus foi investigada por Chintagunta et al.28 em um estudo descrito na literatura e, para isto, utilizaram-se estratégias de hidrólise enzimática e fermentaçao simultânea. Os autores alcançaram produçao de etanol de 7,12% (v/v) em 24 horas de fermentaçao, o que reforça a valorizaçao dos resíduos das folhas de Ananas comosus obtidos dos setores agrícola e agroindustrial.
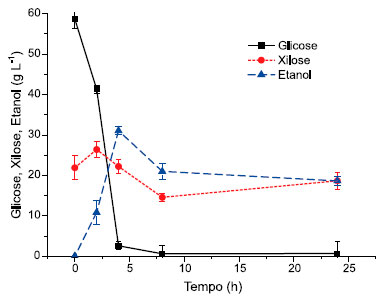 Figura 2. Consumo dos açúcares e produçao de etanol ao longo da fermentaçao etanólica
Bhandari et al.29 estudaram a produçao de etanol celulósico a partir das cascas de frutas Ananas comosus em um processo de fermentaçao sem aeraçao e revelaram rendimento de etanol de 4,38 g L-1, com percentual de conversao de 84,2%. Esses resultados apresentam um futuro promissor para o reaproveitamento desses resíduos celulósicos para a produçao de etanol. Embora esse achado tenha sido inferior ao alcançado no presente estudo (18,80 g L-1 etanol) utilizando a coroa de Ananas comosus. O estudo da produçao simples e aprimorada de etanol lignocelulolítico por hidrólise ácida sobre os resíduos das cacas de Ananas comosus foi investigado por Niwaswong et al.,30 os resultados indicaram que o caldo fermentado com a levedura Saccharomyces cerevisiae TISTR 5048 produziu etanol com rendimento de 65,27 ± 2,45%, relatando um processo de baixo custo para as indústrias. No entanto, a hidrólise ácida apresenta certa desvantagem, uma vez que propicia a formaçao de inibidores que afetam o metabolismo das leveduras e como consequência, diminui o rendimento etanólico, sendo necessário avaliar o pré-tratamento mais adequado a fim de evitar tais interferentes. Experimentos para produçao de etanol a partir dos resíduos da folha de abacaxi com etapas integradas de sacarificaçao enzimática (celulase e xilanase) e fermentaçao simultânea alcançaram produçao máxima de etanol de 7,12% (v/v) em 24 h de fermentaçao com taxa de conversao de 75,53%. Estabelecendo desta forma, um processo valioso para geraçao de energia para atender os problemas abordados sobre a crise energética por meio deste e do nosso estudo que utilizou os resíduos lignocelulósicos de Ananas comosus como substrato rico em polissacarídeos para conversao em etanol. 31 Gil e Maupoey32 propuseram um processo de otimizaçao da produçao de etanol por meio de diferentes etapas de processamento da biomassa de Ananas comosus, dentre estas: fermentaçao do licor hidrolisado, sacarificaçao e fermentaçao consecutiva dos resíduos sólidos, e sacarificaçao e fermentaçao simultânea. Os resultados apontaram a sacarificaçao e fermentaçao simultânea como a melhor condiçao de processamento da biomassa, uma vez que a produçao de etanol foi de 5,4% (v/v), enquanto que com a fermentaçao direta do hidrolisado obteve-se 4,7% e com a sacarificaçao e fermentaçao dos resíduos sólidos a produçao de etanol foi de 4,9%. Sendo assim, esses resultados indicam que a sacarificaçao e fermentaçao simultânea pode ser uma condiçao a ser adotada para a fermentaçao da biomassa de Ananas comosus, visto que proporcionou melhor rendimento de etanol tendo um direcionamento positivo para diminuir os custos com o uso de enzimas celulolíticas. Verifica-se que nas condiçoes empregadas, a fermentaçao deveria encerrar-se nas 4 primeiras horas (Figura 2), visto que após esse tempo houve reduçao no teor de etanol produzido. Sugere-se que, na falta da fonte primária de carbono (glicose), a levedura passe a consumir o etanol. Desta forma, esse mecanismo torna-se economicamente inviável, visto que o objetivo da fermentaçao é a obtençao de etanol, e seu consumo é indesejado devendo-se, portanto, encerrar a reaçao de fermentaçao antes que isso ocorra. Outro artifício a ser considerado é a suplementaçao de diferentes fontes de nitrogênio para aumentar a biomassa de leveduras,24 a partir das quais espera-se acelerar a conversao de açúcares para etanol. De acordo com essas observaçoes, o inóculo da levedura fez com que o conteúdo de carboidratos fermentescíveis diminuissem de 58,44 para 0,67 g L-1, no caso da glicose e de 21,91 para 18,83 g L-1, no caso da xilose, representando 87,22% e 1,16% de consumo, respectivamente. No final da fermentaçao, a xilose residual representa, presumivelmente, a atividade enzimática remanescente no licor sacarificado. Após 2 horas de adiçao da levedura, a xilose apresentou incremento em razao das outras amostragens. Produçao de briquetes Os briquetes produzidos a partir do resíduo sólido da hidrólise enzimática apresentaram poder calorífico de 18,41 kJ kg-1, 11,64% de umidade e 5,94% de cinzas. Considerando seu potencial energético, o resíduo sólido remanescente do processo de produçao de etanol de segunda geraçao torna-se, portanto, um substrato complementar para combustao direta em fornos industriais em substituiçao a lenha. Além disso, o valor de aquecimento é um fator de qualidade importante para a combustao, assim como relataram Demirbas e Sahin.33 Sendo assim, os testes de laboratório mostraram que os briquetes produzidos podem complementar o processo de combustao, tornando-se combustíveis cujas perspectivas parecem ser boas para aplicaçao relacionada ao calor em pequenas indústrias. As análises complementares no estudo da produçao de combustível sólido (briquetes) incluíram a produçao de cinzas e umidade. Quanto ao teor de cinzas, sabe-se que este componente representa os óxidos inorgânicos que permanecem após a combustao completa dos materiais.34 Os briquetes produzidos neste estudo apresentaram menor teor de cinzas (5,4%) quando comparado com outro estudo descrito na literatura, sobre a viabilidade de produçao de briquetes através da mistura de vários resíduos de biomassa, em que o teor de cinzas variou entre 14,6 e 31%.35 Quanto ao teor de umidade, sabe-se que este parâmetro pode influenciar no valor do aquecimento do material.36 No entanto, nao avaliamos neste estudo se um menor ou maior teor de umidade poderia causar alteraçoes no valor de aquecimento do briquete. Outras condiçoes de fabricaçao, tais como a temperatura e pressao também sao responsáveis por influenciar o poder calorífico.37,38 Ademais, outro ponto positivo para a produçao de briquetes neste estudo está relacionado com a natureza homogênea do resíduo lignocelulósico de Ananas comosus utilizado, em que se pode supor que o material forma uma ligaçao mais forte, tornando o briquete mais denso e estável.39 Combustível sólido como serragem, briquete de biocarvao, lenha e carvao, apresentam valor de aquecimento em torno de 18,65 a 27,98 MJ kg-1 (8.000 a 12.000 Btu lb-1). Já o carvao betuminoso, o mais utilizado nas indústrias, apresenta variaçoes entre 24,48 e 36,14 MJ kg-1 (10.500 a 15.500 Btu lb-1).40 Isso implica em dizer que a tecnologia de briquetagem empregada neste estudo, considerando o reaproveitamento de resíduos sólidos de Ananas comosus e o padrao de baixo custo de produçao, tornou possível a produçao de combustível sólido para atender, ainda que de forma nao consolidada, a complementariedade das demandas energéticas de pequenos produtores.
CONCLUSAO Através dos ensaios de hidrólise enzimática realizados no presente trabalho, é possível destacar a importância da aplicaçao de enzimas celulolíticas sobre o resíduo lignocelulósico de Ananas comosus a fim de obter maiores concentraçoes de açúcares no licor sacarificado e, por conseguinte, maior rendimento etanólico na etapa de fermentaçao. Conforme verificado no perfil de hidrólise, a enzima empregada nao sofreu perdas de sua atividade catalítica pelos parâmetros utilizados, a 50 °C, 150 rpm, 24 horas. Deve-se ressaltar também que o uso combinado de enzimas celulases e hemicelulases é um processo que merece ser explorado, no sentido de aumentar as concentraçoes de açúcares fermentescíveis e maior reaproveitamento dessa biomassa. De fato, os resultados da fermentaçao etanólica do licor sacarificado foram dados adicionais para elucidar a configuraçao dos processos de fermentaçao, tendo como base a utilizaçao de substratos lignocelulósicos de Ananas comosus através da integraçao de pré-tratamentos a base de água em temperaturas moderadas e tratamento enzimático. Isso significa dizer que este artigo apresenta dados primários que garantem a reduçao do tempo no processo de produçao de etanol de segunda geraçao, assim como, melhorias futuras nas etapas experimentais que podem acarretar em menores custos operacionais. A incorporaçao do resíduo da biomassa remanescente da hidrólise enzimática para produçao de briquetes (obtido dos mercados alagoanos) proporciona uma oportunidade de alavancar estudos nessa perspectiva, uma vez que essa integraçao ainda é incipiente. Ademais, essa nova aplicabilidade da biomassa destaca seu potencial, dada a sua versatilidade capaz de gerar duas formas de energia (líquida e sólida). A tecnologia empregada para briquetagem é de fácil operaçao e de baixo custo, o que torna o briquete produzido nesse estudo uma fonte renovável de combustível sólido com boa relaçao custo-benefício.
REFERENCIAS 1. Gerland, P.; Raftery, A. E.; Sevcikova, H.; Li, N.; Gu, D.; Spoorenberg, T.; Alkema, L.; Fosdick, B. K.; Chunn, J.; Lalic, N.; Bay, G.; Buettner, T.; Heilig, G. K.; Wilmoth, J.; Science 2014, 346, 234. 2. Dai, A.; Nat. Clim. Change 2013, 3, 52. 3. Cook, B.; Smerdon J.; Seager, R.; Coats, S.; Climate Dynamics 2014, 43, 1. 4. Yang, X.; Cushman, J. C.; Borland, A. M.; Edwards, E. J.; Wullschleger, S. D.; Tuskan, G. A.; Owen, N. A.; Griffiths, H.; Smith, J. A. C.; Paoli, H. C. D.; Weston, D. J.; Cottingham, R.; Hartwell, J.; Davis, S. C.; Silvera, K.; Ming, R.; Schlauch, K.; Abraham, P.; Stewart , J. R.; Guo, H. B.; Albion, R.; Ha, J.; Lim, S. D.; Wone, B. W.; Yim, W. C.; Garcia, T.; Mayer, J. A.; Petereit, J.; Nair, S. S.; Casey, E.; Hettich, R. L.; Ceusters, J.; Ranjan, P.; Palla, K. J.; Yin, H.; Reyes-García, C.; Andrade, J. L.; Freschi, L.; Beltrán, J. D.; Dever, L. V.; Boxall, S. F.; Waller, J.; Davies, J.; Bupphada, P.; Kadu, N.; Winter, K.; Sage, R. F.; Aguilar, C. N.; Schmutz, J.; Jenkins, J.; Holtum, J. A.; New Phytol. 2015, 207, 491. 5. Borland, A. M.; Griffiths, H.; Hartwell, J.; Smith, J. A. C.; J. Exp. Bot. 2009, 60, 279. 6. Davis, S. C.; LeBauer, D. S.; Long, S. P.; J. Exp. Bot. 2014, 65, 3471. 7. Kuloyo, O. O.; du Preez, J. C.; García-Apricio, M. P.; Kilian, S. G.; Steyn, L.; Gorgens, J.; World J. Microbiol. Biotechnol. 2014, 30, 3173. 8. Lima, C. S. S.; Conceiçao, M. M.; Silva, F. L. H.; Lima, E. E.; Conrado, L. S.; Leao, D. A. S.; Appl. Energy. 2013, 102, 254. 9. Li, J.; Paul, M. C.; Younger, P. L.; Watson, I.; Hossain, M.; Welch, S.; Fuel 2014, 165, 205. 10. Williams, A.; Jones, J. M.; Ma, L.; Pourkashanian, M.; Prog. Energy Combust. Sci. 2012, 38, 113. 11. Capablo, J.; Salvado, J.; Renewable Energy 2017, 105, 449. 12. Saeed, U.; Rehman, M.; Applied Mathematics and Computation 2015, 264, 310. 13. Souza, N.; Azevedo, J. L. T.; Fuel 2016, 185, 948. 14. Larsen, J.; Haven, M. O.; Thirup, L.; Biomass Bioenergy 2012, 46, 36. 15. Viikari, L.; Vehmaanpera, J.; Koivula, A.; Biomass Bioenergy 2012, 46, 13. 16. Bhutto, A. W.; Qureshi, K.; Harijan, K.; Abro, R.; Abbas, T.; Bazmi, A. A.; Karim, S.; Yu, G.; Energy 2017, 122, 724. 17. Mulakhudair, A. R.; Hanotu, J.; Zimmerman, W.; Biomass Bioenergy 2016, 93, 187. 18. Cai, J.; He, Y.; Yu, X.; Banks, S. W.; Yang, Y.; Zhang, X.; Yu, Y.; Liu, R.; Bridgwater.; Renewable Sustainable Energy Rev. 2017, 76, 309. 19. Sluiter, A.; Ruiz, R.; Scarlata, C.; Sluiter, J.; Templeton, D.; Crocker, D.; National Renewable Energy Laboratory, Laboratory Analytical Procedure, 2008, disponível em https://www.nrel.gov/docs/gen/fy13/42618.pdf, acessado em agosto 2018. 20. Rocha, G. J. M.; Silva, F. T.; Curvelo, A. A. S.; Araújo, G. T.; Resumos do 5th Brazilian Symposium on the Chemistry of Lignins and Other Wood Components, Brasil, 1997. 21. Gouveia, E. R.; Nascimento, R. T.; Souto-Maior, A. M.; Rocha, G. J. M.; Quim. Nova 2009, 32, 1500. 22. Ghose, T. K.; Pure Appl. Chem. 1987, 59, 257. 23. Huang, Y. L.; Chow, C. J.; Fang, Y. J.; J. Food Drug Anal. 2011, 19, 318. 24. Pourbarani, M.; Forgács, G.; Horváth, I. S.; Niklasson, C.; Taherzadeh, M. J.; Bioresour. Technol. 2010, 101, 4246. 25. Meschede, D. K.; Velini, E. D.; Carbonari, C. A.; Moraes, C. P.; Planta Daninha 2012, 30, 121. 26. Tropea, A.; Wilson, D.; Torre, L. G. L.; Curto, R. B. L.; Saugman, P.; Troy-Davies, P.; Dugo, Giacomo.; Waldron, K. W.; J. Food Res. 2014, 30, 60 27. Boonwong, T.; Karnnasuta, S.; Srinorakutara, T.; KKU Research Journal 2014, 19, 369. 28. Chintagunta, A. D.; Ray, S.; Banerjee, R.; J. Cleaner Prod. 2017, 165, 1508. 29. Bhandari, S. V.; Panchapakesan, A.; Shankar, N.; Kumar, H. G. A.; International Journal of Scientific Research & Technology 2013, 2, 362. 30. Niwaswong, C.; Chaiyamate, P.; Chotikosaijkanon, P.; Ruangviriyachai, C.; Afr. J. Biotechnol. 2014, 13, 3928. 31. Chintagunta , A. D.; Ray, S.; Banerjee, R.; J. Cleaner Prod. 2017, 165, 1508. 32. Gil, L. S.; Maupoey, P. F. J. Cleaner Prod. 2018, 172, 1224. 33. Demirbas, A.; Sahin, A.; Fuel Process. Technol. 1998, 55, 175. 34. Speight, J. G.; Synthetic Fuels Handbook: Properties, Process and Performance, McGraw-Hill Companies, Inc.: New York, 2008. 35. Romallosa, A. R. D.; Kraft, E.; Resources 2017, 6, 1. 36. Voicea, I.; Danciu, A.; Matache, M.; Voicu, G.; Vladut, V.; Ann. Fac. Eng. Hunedoara 2013, 11, 59. 37. Tumuru, J. S.; Sokhansanji, S.; Lim, C. J.; Bi, T.; Lau, A.; Melin, S.; Sowlati, T.; Oveisi, E.; Applied Engineering in Agriculture 2010, 26, 1013. 38. Adapa, P. K.; Schoe, G. J.; Tabil, L. G.; Sokhanasanj, S.; Crerar, B.; Pelleting of Fractionated Alfalfa Products, American Society of Associated Executives (ASAE): Washington, DC, 2003; pp. 104-115. 39. Olorunnisola, A.; Production of Fuel Briquettes from Waste Paper and Coconut Husk Admixtures, disponível em https://ecommons.cornell.edu/handle/1813/10628, acessado em Agosto 2018. 40. Kentucky Educational Television, disponível em https://www.ket.org/public-affairs/coal-advocate-makes-case-greenhouse-gas-regulations/, acessado em agosto 2018. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access





