Assuntos Gerais
|
|
| O conceito de valência em livros didáticos de química geral entre as décadas de 1890 e 1940 The concept of valence in general chemistry textbooks from the 1890s to the 1940s |
|
Helena S. Alvares NogueiraI,*; Paulo Alves PortoII
I. Instituto de Química, Universidade de São Paulo, 05508-000 São Paulo - SP, Brasil Recebido em: 30/05/2018 *e-mail: helena.savignani.leite@usp.br This paper aims to investigate the presentation of the concept of valence in college-level, general chemistry textbooks published in the USA between the 1890s and the 1940s. The delimited period covers the emergence of theories about atomic structure, electronic distribution and chemical bonding. Transition from the classical concept of valence (as the combining power of a chemical element), which resulted from either the analysis of formulas of compounds or experimental results, into the concept related to the electronic structure of elements, according to which the valence is determined by the number of electrons in the last shell, was observed. In general, valence was presented in textbooks in order to serve as an instrument for the writing of formulas of compounds, and historical approaches to the construction of the concept were not contemplated by the authors. INTRODUÇAO Os livros didáticos para o ensino superior revestem-se de reconhecida importância no processo de formaçao de novos cientistas e professores.1,2 Já foi observado que os livros didáticos exercem grande influência sobre os estudantes e professores, sendo considerados inquestionáveis por muitos deles.3,4 Apesar disso, ainda há uma carência nas investigaçoes científicas sobre livros didáticos para o ensino superior quanto a aspectos ontológicos e epistemológicos dos conceitos químicos, e suas implicaçoes para o processo de ensino-aprendizagem.5,6 De acordo com a concepçao de Kuhn, os livros didáticos sao responsáveis pela transmissao dos paradigmas aceitos e da linguagem usada pela comunidade científica da época em que foram publicados, exercendo, por isso, papel fundamental na formaçao de novos cientistas e profissionais.1 Choppin, por sua vez, destaca que os livros didáticos sao também responsáveis, além do suporte à transmissao dos conhecimentos considerados necessários, por permitir a prática de métodos didáticos, a construçao de uma identidade de grupo, e pelo desenvolvimento do espírito crítico das novas geraçoes.7 Além disso, vale ressaltar que os livros didáticos sofrem pressoes políticas, sociais e econômicas e que, para serem publicados e utilizados, precisam ser negociados entre o autor, o público (professores e universidades), a mídia (editoras) e o Estado.5,8 Dessa forma, esses aspectos justificam que os livros didáticos sejam tomados como fontes históricas para caracterizar a ciência e seu ensino em uma determinada época. Trabalhos recentes buscaram relacionar a análise de livros didáticos de química à história da ciência, sob diferentes perspectivas. Niaz,9 Fernandes e Porto10 e Leite e Porto11 investigaram a inclusao de aspectos da história da ciência no conteúdo dos livros, mas os resultados apontaram para a ausência de questoes históricas na maioria das obras analisadas e para a superficialidade na abordagem dessas questoes, quando estao presentes. Niaz investigou a apresentaçao da teoria cinética molecular dos gases em livros didáticos para o ensino médio publicados nos EUA no final do século XX.9 Fernandes e Porto investigaram como a história da química é abordada em alguns dos livros didáticos mais recomendados em cursos de química de nível superior no Brasil.10 Leite e Porto, por sua vez, investigaram a apresentaçao da tabela periódica em livros de química geral voltados para o ensino superior, publicados no Brasil ao longo do século XX.11 Esses trabalhos evidenciam algumas das dificuldades do processo de ensino e aprendizagem dos conceitos e, principalmente, do fazer ciência, causadas pela ausência e superficialidade da abordagem histórica utilizadas pelos livros didáticos. O presente artigo adota um viés investigativo semelhante ao de Leite e Porto.11 Nosso objetivo é analisar a apresentaçao do conceito de valência em uma amostra de livros didáticos para o ensino superior publicados nos EUA entre a última década do século XIX e as primeiras décadas do século passado. A escolha se justifica pela influência dos EUA na construçao da ciência e no desenvolvimento de diversas teorias químicas no período adotado para estudo. Nessa época, o conceito de valência, que desempenhava papel relevante no corpo do conhecimento químico, sofreu modificaçoes em funçao do desenvolvimento das teorias sobre a estrutura atômica. Assim, partimos da suposiçao de que os livros precisaram desenvolver estratégias para conciliar sua natural tendência conservadora (ou de inserçao no paradigma vigente, na concepçao kuhniana) com as novas teorias que foram se desenvolvendo no início do século XX e que mudaram bastante a química. Em particular, procuramos investigar as mudanças na valência no contexto das teorias sobre estrutura, ligaçao química e periodicidade química. É preciso considerar que mudanças nas teorias podem implicar em mudanças nas formas de representaçao, incluindo a linguagem e a nomenclatura. Além disso, uma das possíveis estratégias didáticas para conciliar continuidades e rupturas em um momento de transformaçao na ciência é abordar a história do desenvolvimento dos conceitos, o que nos motivou a investigar o uso dessa estratégia na amostra considerada. Dessa forma, buscamos fornecer contribuiçoes para a compreensao do processo que envolve a consolidaçao e a difusao do conhecimento químico por meio dos livros didáticos.
A IMPORTANCIA DO CONCEITO DE VALENCIA De acordo com o Compendium of Chemical Terminology (ou Gold Book) da IUPAC, valência é "the maximum number of univalent atoms (originally hydrogen or chlorine atoms) that may combine with an atom of the element under consideration, or with a fragment, or for which an atom of this element can be substituted" [o número máximo de átomos univalentes (originalmente, átomos de hidrogênio ou cloro) que podem se combinar com um átomo do elemento sob consideraçao, ou com um fragmento, ou pelo qual um átomo desse elemento pode ser substituído].12 O termo "valência" também é utilizado como adjetivo em expressoes como camada de valência, elétrons de valência e ligaçao de valência, por exemplo. Assim, esse termo é usado em várias áreas da química, ainda que a definiçao clássica pareça nao dar conta, à primeira vista, de todos os contextos em que a palavra é empregada. O conceito de valência (que inicialmente foi designado por outros nomes) já era considerado importante nas investigaçoes sobre a composiçao e estrutura da matéria desde a segunda metade do século XIX. Nessa época, o conceito de valência estava relacionado à ideia de afinidade química e à existência de alguma coisa que fizesse determinados elementos ficarem juntos - ainda que suas causas fossem desconhecidas. Por muito tempo, a valência foi considerada como sinônimo de ligaçao química, ou como sua causa. A importância do conceito de valência no processo de desenvolvimento da química foi assim sumarizada por Araújo Neto:
Tendo em vista a importância do conceito de valência no desenvolvimento da química, e também no contexto do ensino dessa ciência, entendemos ser relevante a investigaçao de sua presença em livros didáticos. A metodologia adotada e os resultados obtidos nessa investigaçao sao apresentados a seguir.
METODOLOGIA A análise dos livros didáticos utilizou elementos da análise textual discursiva, de forma semelhante à utilizada por Pimentel.14 De acordo com essa metodologia, primeiramente, sao escolhidos os livros a serem analisados; em seguida, o material é organizado, destacando-se o que se considera mais importante para a pesquisa, por meio de uma primeira leitura, fichamento dos livros e seleçao das unidades de análise. A organizaçao, leituras e análises do material sofrem, entao, sucessivas revisoes e reelaboraçoes até o final da pesquisa, conforme os critérios e as categorias criadas no processo de análise dos documentos. Por fim, é feita uma análise das categorias criadas (devem ser internamente homogêneas, externamente heterogêneas, coerentes e plausíveis), por meio de interpretaçoes e inferências dos pesquisadores, resultando numa síntese de tudo aquilo que foi encontrado. Essa metodologia foi escolhida por permitir duas reconstruçoes concomitantes, relevantes para o estudo, de acordo com Moraes e Galiazzi: as reconstruçoes "1. do entendimento de ciência e de seus caminhos de produçao. 2. do objeto da pesquisa e de sua compreensao".15 Dessa forma, a análise textual discursiva pode ser útil em estudos de história da ciência, pois permite estudar e compreender o assunto rompendo com ideias e interpretaçoes já existentes, bem como permite verificar mudanças nas diferentes categorias de análise construídas. Além disso, a análise textual discursiva propicia um trabalho investigativo constante. Ao longo do processo, sao reconstruídos conceitos e visoes, e sao reinterpretados os materiais já analisados e reanalisados constantemente, partindo do princípio de que, no início da pesquisa, nao se tem uma visao clara e completa do que se vai encontrar. Os livros didáticos analisados foram selecionados a partir de um conjunto de obras localizadas na biblioteca da Chemical Heritage Foundation (CHF, Filadélfia, EUA), uma instituiçao dedicada à preservaçao da memória sobre a química nos EUA. Em estágio de pesquisa realizado entre junho e julho de 2015, o segundo autor deste trabalho fez um levantamento de livros didáticos de química geral publicados nos EUA entre 1890 e 1959 disponíveis na biblioteca da CHF. O total de livros foi delimitado buscando-se localizar sua presença também nos catálogos de bibliotecas de algumas universidades estadunidenses selecionadas, destacadas pela pesquisa e ensino de química no século passado (a saber: Harvard University, Johns Hopkins University, University of Wisconsin-Madison e University of California - Los Angeles). Assim, chegou-se a uma amostra de 84 livros, em geral presentes em duas ou mais das instituiçoes consultadas, os quais foram copiados em parte, ou baixados na íntegra quando disponíveis na Internet. Dessa amostra foram pré-selecionados 62 livros do período compreendido entre 1894 e 1949, que apresentavam e discutiam o conceito de valência. Sobre essa amostra foi feita uma primeira análise, e dela foram selecionados, para análise mais aprofundada, os livros mais representativos de cada década ou abordagem. Foi encontrada uma quantidade significativa de livros para cada década. A análise dos livros visou identificar as características do ensino e suas modificaçoes ao longo do tempo. O período de abrangência da pesquisa foi definido considerando a relevância do conceito de valência no contexto do ensino, sendo que, a partir do final dos anos 1940, as explicaçoes eletrônicas e quânticas para conceitos clássicos da química ganharam força, com a gradativa substituiçao de um conceito abrangente de valência por outros derivados dele. Além disso, também optamos por nao avançar no período posterior ao lançamento do Sputnik (1957), considerado como um marco que levou a reflexoes sobre o ensino de ciências em geral (incluindo o ensino de química) no Ocidente e ao surgimento de diferentes projetos para a reformulaçao desse ensino. A Tabela 1 mostra a distribuiçao da quantidade de livros por década em nossa amostra.
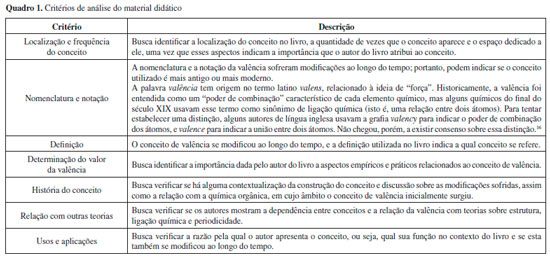
A análise dos livros foi feita de acordo com critérios propostos a partir de leituras preliminares do material, descritos no Quadro 1. Esses critérios se voltam para a investigaçao da natureza do conceito de valência, a presença ou ausência da história do conceito, qual a abordagem e a relevância dada ao conceito, e qual a posiçao em que o conceito se encontra no texto em relaçao a outros conceitos relacionados (como a tabela periódica dos elementos, por exemplo). Nesse processo, se procurou investigar as mudanças nos livros didáticos e suas relaçoes com mudanças na própria ciência química durante as primeiras décadas do século XX.
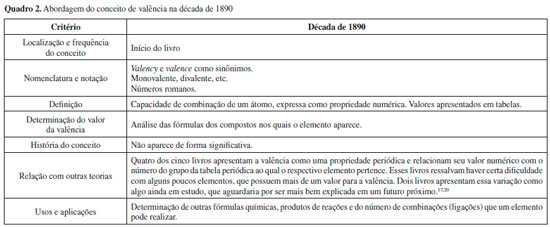
ANALISE DOS LIVROS DIDATICOS DE QUIMICA GERAL Foi realizada uma análise preliminar de um total de 62 livros, os quais foram agrupados por décadas e tiveram delineadas as principais características de suas abordagens para o conceito de valência. Em seguida, foram selecionados dez livros, considerados mais representativos das diferentes tendências e abordagens identificadas, os quais foram objeto de análise mais aprofundada. As seçoes que se seguem trazem a análise geral das tendências em cada década,bem como a análise mais detalhada de como o conceito de valência foi apresentado nos dez livros escolhidos. Anos 1890 Desse período, foram analisados os seguintes livros: Attfield (1894), Freer (1894), Sadtler e Trimble (1895), Ostwald (1895) e Long (1898).17-21 O Quadro 2 sumariza as características observadas nesse conjunto de livros.
De modo geral, os livros da década de 1890 apresentam a valência como uma propriedade numérica e periódica dos elementos químicos, a qual indica a capacidade de combinaçao dos respectivos átomos, sendo apresentada no início do livro entre outros conceitos básicos, e é indicada por números romanos. Desse período foi analisado em maior profundidade o livro de Attfield,17 por ser o livro mais antigo e mostrar uma visao peculiar da química. Logo no prefácio, o autor enumera as razoes pelas quais se deve ensinar e estudar química: segundo Attfield (p. viii), a química é um "instrumento da cultura mental", que aguça e expande o poder da observaçao, amplia e fortalece a memória e a imaginaçao, desenvolve e elabora o pensamento e a razao.17 Nesse livro, o conceito de valência é apresentado no capítulo 4, intitulado "Os princípios gerais da filosofia química". A valência é definida como o "valor" do átomo, de forma análoga aos valores de moedas e notas. O autor ressalta que há vários nomes para esse conceito, sendo que ele opta por quantivalence ou valency. Attfield também destaca que esse conceito nao está relacionado com a intensidade da uniao dos átomos nem com a estabilidade de compostos, e que os valores das valências devem ser decorados para facilitar a escrita correta de fórmulas, e para isso sao fornecidos valores em tabelas. Por fim, Attfield apresenta elementos com mais de uma valência, como o ferro, observando que, naquele momento, nao havia uma explicaçao científica para tal fato.17 Dois aspectos do livro de Attfield chamam a atençao. O autor enfatiza bastante o fato de a química trabalhar com modelos - como os de átomo e as fórmulas estruturais dos compostos - que sao entes hipotéticos e nao objetos reais. Outro aspecto observado é que o autor usa vários termos para o conceito de valência, nomeado ao longo da obra como quantivalence, valency e valence, de forma indiscriminada e, às vezes, em uma mesma seçao.17 Anos 1900 Desse período, foram analisados os seguintes livros: Fetterolf (1900), Tillman (1904), McPherson e Henderson (1906), Pond (1906), Brownlee (1907), Smith (1908), Baskerville (1909) e Ostwald (1909).22-29 O Quadro 3 sumariza as características observadas nesse conjunto de livros.
De modo geral, o conceito de valência é apresentado nos livros da década de 1900 como poder de combinaçao dos elementos e como uma das propriedades periódicas, com valores tabelados obtidos pela análise de fórmulas, sendo apresentado no início dos livros. Os compostos sao caracterizados como saturados ou insaturados, conforme o uso total ou parcial da valência do elemento considerado. Desse período, foi analisado em maior profundidade o livro de McPherson e Henderson,24 por apresentar um capítulo exclusivo sobre valência (capítulo 11 - Valence), o qual se segue à apresentaçao de vários conceitos químicos, como átomo, lei das proporçoes definidas, pesos atômicos e moleculares e cálculo estequiométrico. Nesse capítulo, define-se o conceito de valência como uma propriedade numérica do elemento, a qual determina o número de átomos com que o elemento irá se combinar. McPherson e Henderson ressaltam que a valência é apenas um número, uma grandeza qualitativa, e que nao está relacionada com a intensidade da uniao ou afinidade entre os elementos. Os autores partem da análise de fórmulas para chegar aos valores das valências e depois usam esses números para escrever outras fórmulas e prever produtos de reaçao (atividade que é feita nao só pelos autores no corpo do texto, mas também nos exercícios propostos ao final do capítulo). A análise de fórmulas relacionada à valência é feita novamente no capítulo sobre a tabela periódica, para demonstrar que essa é uma das propriedades periódicas.24 Merece destaque nesse livro, a seguinte afirmaçao feita pelos autores:
Nesse trecho, os autores deixam claro que a natureza da valência era, entao, desconhecida, e que esse conceito era empírico, baseado apenas em resultados de experimentos. A mesma justificativa é dada para os elementos que apresentam mais de um valor para a valência, sendo observado que sempre há um valor mais comum que forma compostos mais estáveis.24 O livro de McPherson e Henderson traz princípios químicos junto com aplicaçoes práticas. Porém, os autores afirmam, no prefácio, que seu livro apresenta uma forma simplificada e parcial dos conceitos, com o intuito de fornecer uma base para o estudante avançar com maior facilidade em estudos mais aprofundados, uma vez que existe uma grande distância entre as fronteiras da ciência e o aluno iniciante.24 Essa ressalva é relevante e mostra uma preocupaçao dos autores, na época, que permanece atual, considerando que a referida distância aumentou ao longo do último século. Anos 1910 Foram analisados os seguintes livros desse período: Molinari (1912), Newell (1912, 1914), Pond (1912), Blake (1913), Jones (1913), McPherson e Henderson (1913, 1915, 1917), Cady (1916), Smith (1916) e Hildebrand (1918).30-41 O Quadro 4 sumariza as características observadas nesse conjunto de livros.
Todos os livros analisados da década de 1910 definem a valência como poder de combinaçao, sendo usada para escrever fórmulas e reaçoes químicas. É apresentada no início dos livros, como um dos conceitos fundamentais para a continuidade da abordagem da química nos capítulos que se seguem. A maioria dos livros aponta que Mendeleev já considerava a valência como uma propriedade periódica, embora reconheçam que é preciso estar atento ao fato de que a valência de um elemento pode variar - gerando compostos saturados e insaturados, conforme o uso total ou parcial de suas valências. Desse período, destacamos aqui o livro de Molinari,30 pois ele se diferencia dos outros por ser um livro italiano traduzido para o inglês (o que é raro) e por apresentar um pouco de contextualizaçao histórica para o conceito de valência. Interessante notar que o livro traz uma seçao sobre história da química, embora o prefácio deixe claro que o foco do livro recai sobre a prática da química, principalmente questoes industriais, uma vez que "chemistry has been one of the most powerful factors of progress, civilisation, and improvement in all countries" [a química tem sido um dos mais poderosos fatores de progresso, civilizaçao e crescimento em todos os países], segundo o autor (p. viii).30 Esse livro apresenta uma seçao, logo em seu início, em que é descrito o "progresso da ciência química" ao longo dos séculos, começando da Antiguidade, abordando China, Egito, India, Roma, Grécia, passando pela Idade Média, discorrendo sobre alquimia e iatroquímica, e terminando com a chamada química moderna, citando os trabalhos de Lavoisier e algumas das leis fundamentais dessa ciência (conservaçao da matéria, lei das proporçoes constantes, estequiometria, teoria atômica) (p. 9-22).30 No livro de Molinari, o conceito de valência é apresentado na primeira parte do livro, dedicada a conceitos gerais da química. A valência é apresentada da seguinte maneira:
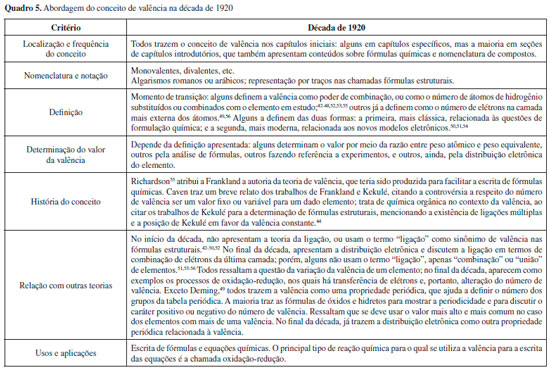
Com essa afirmaçao o autor faz uso da história da química de uma forma bem característica da época, ou seja, exaltando grandes cientistas e os feitos da ciência. De qualquer forma, Molinari registra que a valência teve sua origem no âmbito da química orgânica. Depois dessa introduçao histórica, o autor define valência como a capacidade de saturaçao de combinaçao de um elemento. Molinari a diferencia de afinidade, afirmando que a valência é uma propriedade quantitativa e nao qualitativa, sendo determinada por uma fórmula matemática: a razao entre o peso atômico e o peso equivalente no composto estudado.30 Por fim, cabe ressaltar que Molinari relaciona a valência de um elemento com a carga do respectivo íon; e relaciona essa carga com a quantidade de elétrons no átomo. O autor menciona a valência variável como uma característica dos compostos inorgânicos, nos quais os elementos apresentam diferentes graus de saturaçao e, portanto, possuem uma valência máxima que nem sempre é utilizada em sua totalidade.30 Anos 1920 Foram analisados os seguintes livros desse período: McCoy e Terry (1920), Brownlee (1921), Caven (1921), McPherson e Henderson (1921), Holmes (1922, 1925), Deming (1923, 1925), Foster (1924), Schlesinger (1925), Brinkley (1926), Kendall (1927), McCutcheon e Seltz (1927), Richardson (1927) e Babor (1929).42-56 O Quadro 5 sumariza as características observadas nesse conjunto de livros.
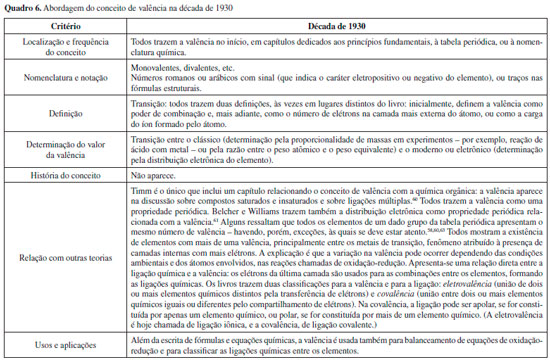
Observa-se, nos livros da década de 1920, o início de um processo de transiçao na abordagem do conceito de valência: no início da década, os livros ainda o definem apenas da maneira clássica, como poder de combinaçao. A partir de meados da década, surge a definiçao em termos de número de elétrons na camada mais externa dos átomos, e alguns livros passam a incluir a nova definiçao eletrônica ao lado da definiçao clássica. A introduçao das novas teorias sobre estrutura eletrônica nos livros didáticos modifica também a abordagem para a tabela periódica: no final da década, os livros já incluem a distribuiçao eletrônica como outra propriedade periódica, relacionada com a valência.42-48,50-56 A ligaçao entre átomos, até entao descrita nos livros como consequência das valências, começa a ser discutida em termos de combinaçao de elétrons de valência, ou seja, dos elétrons da última camada dos átomos. Desse período, foi analisado em maior profundidade o livro de Caven, por apresentar um pouco da história do conceito de valência e por ser o único autor do período a abordar a química orgânica no contexto da valência. Além disso, o autor deixa claro no prefácio que o objetivo do livro é mostrar fatos da ciência química de uma forma compreensível e agradável ao estudante, para que ele passe a apreciar essa área, o que faz com que o livro nao seja tao focado nos conteúdos e traga essas discussoes sobre história e aplicaçao da ciência de uma forma acessível aos iniciantes.44 Nessa obra, o conceito de valência é abordado em vários momentos do livro com diferentes enfoques, como era comum na época. A primeira mençao ao conceito ocorre no capítulo 2, dedicado aos pesos atômicos e moleculares, no qual a valência é definida matematicamente como a razao entre o peso atômico e o peso equivalente de um elemento em determinado composto, ou seja, é um valor numérico. O capítulo 3 é dedicado à valência (grafada como valency), e nele Caven retoma a história, citando Frankland e Kekulé. Frankland é descrito como o cientista que mostrou e definiu o que era o poder de combinaçao dos elementos e sua capacidade de saturaçao ao formar compostos, e Kekulé é citado como o cientista que desenvolveu a química orgânica e estudou profundamente o carbono e seus compostos. Nesse capítulo, a valência é definida como um número que indica a quantidade de átomos com os quais um elemento pode se combinar. A partir dessa definiçao, Caven classifica os elementos e traz vários exemplos, incluindo as fórmulas gráficas, criadas por Archibald Couper (1831-1892) para representar as unidades de valência que unem os átomos.44 Outro aspecto interessante da obra de Caven é a discussao sobre a variaçao da valência. O autor apresenta as controvérsias da época de construçao do conceito e os argumentos dos diferentes grupos de cientistas. Caven explica que Kekulé defendia a constância da valência com base em seus estudos sobre os compostos de carbono e sua teoria das ligaçoes múltiplas entre os átomos, e mostra que Frankland defendia a variaçao da valência com base em seus estudos com os compostos de nitrogênio e sua classificaçao em saturados ou insaturados conforme o uso total ou parcial da valência. Caven também ressalta, alguns capítulos adiante, que, apesar dessa discussao e de alguns elementos possuírem mais de uma valência, essa propriedade foi utilizada como um dos critérios para a construçao da tabela periódica, sendo que o número de cada grupo da tabela está relacionado diretamente ao número de valência mais comum para os elementos que o integram.44 Por fim, cabe mencionar que Caven retoma a valência em mais três momentos no livro, como ao relacioná-lo com a carga do íon formado por um dado elemento. Em outro momento, ao final do capítulo dedicado à valência, o autor discute brevemente sua natureza eletrônica, relacionando a valência com a perda ou ganho de elétrons por um elemento. Caven cita diversos autores, como Humphry Davy (1778 - 1829), Jöns Jacob Berzelius (1779-1848), Michael Faraday (1791-1867) e William Crookes (1832-1919), que contribuíram para o desenvolvimento de ideias que relacionavam a eletricidade com a composiçao das substâncias, para enfim apontar J. J. Thomson (1856-1940) e William Ramsay (1852-1916) como elaboradores de uma teoria que relacionou a valência aos elétrons. Finalmente, Caven retoma o conceito de valência no estudo das reaçoes de oxidaçao-reduçao, e o utiliza para explicar o processo e balancear as equaçoes que o representam (sem fazer mençao a elétrons, apenas considerando oxidaçao e reduçao como, em geral, aumento ou diminuiçao da valência).44 Anos 1930 Foram analisados os seguintes livros desse período: Hopkins (1930), Foster (1931), Brinkley (1932), Timm (1932), Belcher e Williams (1934), Bond (1935), Briscoe (1935), Dunbar (1939), Irwin e Sherwood (1939) e Sears (1939).57-66 O Quadro 6 sumariza as características observadas nesse conjunto de livros.
A transiçao iniciada na década anterior prossegue nos anos 1930: os livros didáticos definem a valência como poder de combinaçao e como número de elétrons na última camada do átomo, ou como a carga do íon mais estável. A determinaçao do valor da valência é feita pela análise das fórmulas dos compostos e, também, pela distribuiçao eletrônica. A valência é relacionada diretamente com a tabela periódica, por meio da distribuiçao eletrônica, e, também, com os tipos de ligaçao química (entao chamados de eletrovalência e covalência). Desse período, analisamos mais detidamente o livro de Timm,60 que se destaca pelo posicionamento do autor em defesa de uma mudança no ensino da química - a qual seria necessária em decorrência dos desenvolvimentos recentes dessa ciência. Timm argumenta em favor de uma abordagem mais filosófica, cujo foco recaia sobre o desenvolvimento das teorias, diminuindo, por outro lado, discussoes matemáticas muito aprofundadas. Segundo o autor, seria mais importante ensinar como a ciência funciona, seus procedimentos e aplicaçoes. Isso dá margem a um maior uso da história da ciência, o que é verificado em capítulos iniciais, nos quais a abordagem histórica é usada para construir conceitos a partir de ideias e definiçoes anteriores. Essa abordagem é usada também para o conceito de valência, o qual é apresentado na seçao 7 do capítulo 8 (intitulado "A taquigrafia da química", e que traz conceitos como símbolos químicos, fórmulas, equaçoes químicas, etc.). Nesse capítulo, Timm inicia com a definiçao clássica de poder de combinaçao, a qual foi proposta pelo estudo da composiçao de diversas substâncias. Nessa parte, a valência é representada por números romanos, e seus valores sao sistematizados numa tabela na qual os elementos sao classificados por sua valência mais comum. Em seçoes subsequentes, o autor passa a relacionar a valência com a ligaçao química. Timm introduz uma ilustraçao na qual os átomos sao dotados de ganchos (um gancho para cada uma de suas valências), cujo engate é substituído, nas representaçoes que aparecem na sequência, pelos traços das fórmulas estruturais.60
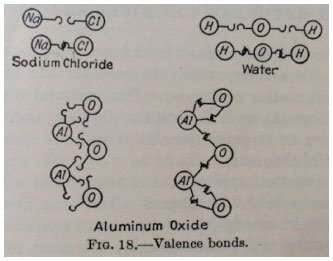 Figura 1. Representaçao das valências como ganchos, e das chamadas "ligaçoes de valência" como engates entre os ganchos (reproduzido da ref. 60, p. 89)
A respeito dessa ilustraçao, Timm escreveu:
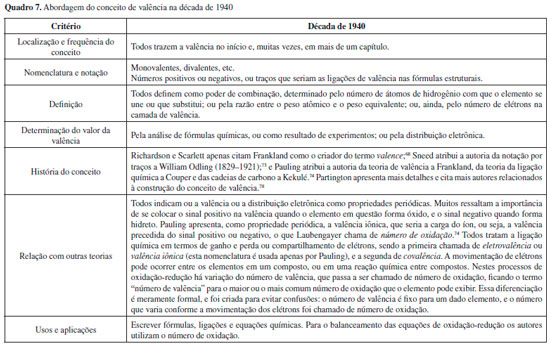
Mais adiante no livro, a valência é retomada como uma propriedade periódica (capítulo 16), e ressignificada com a definiçao eletrônica (capítulo 18). Timm entao apresenta a valência como a quantidade de elétrons da última camada eletrônica de um átomo, mas ressalva que há processos que envolvem perda e ganho de elétrons, os quais alteram o valor dessa propriedade nos produtos das reaçoes. Além disso, há compostos nos quais elétrons de camadas mais internas também podem ser utilizados, o que também leva a uma alteraçao no número de valência do elemento. Além de trazer essa nova definiçao, Timm aborda as reaçoes de oxidaçao-reduçao de forma aprofundada, e sumariza o que ele chama de "natureza da valência". Esse resumo se assemelha muito às regras de utilizaçao dos números de oxidaçao, utilizados no ensino de química na atualidade, e inclui os seguintes pontos: valência é igual à carga elétrica do átomo; valência é igual a zero para elementos nao combinados; valência é positiva para metais e negativa para ametais, com exceçao de ametais ligados a oxigênio, que possuem valência positiva; a variaçao da valência está ligada ao número de elétrons perdidos ou recebidos no processo; e a soma dos números de valência é nula para compostos, ou igual à carga para íons. Essa relaçao com a carga do íon é retomada nos capítulos específicos sobre dissociaçao eletrolítica e eletrólitos (capítulos 26 e 27).60 Anos 1940 Foram analisados os seguintes livros desse período: Babor e Lehrman (1940), Richardson e Scarlett (1940), Young e Porter (1940), Brinkley (1941), MIT (1943), Deming (1944), Sneed (1944), Partington (1966; 1ª. ed., 1946), Pauling (1947), Currier e Rose (1948), Laubengayer (1949) e Sisler, Van der Werf e Davidson (1949).67-78 O Quadro 7 sumariza as características observadas nesse conjunto de livros.
Observa-se, nos livros da década de 1940, a continuidade do processo de proposiçao de novos termos que decorrem de diferenciaçoes e elaboraçoes a partir do conceito de valência - como visto na década anterior, com o uso dos termos eletrovalência e covalência. Pauling propoe o termo valência iônica,74 e aparece, pela primeira vez entre os livros analisados, o termo número de oxidaçao. É clara a relaçao entre essa nova expressao e a antiga questao da valência ser variável para um dado elemento químico. Assim, o número de oxidaçao passa a designar as diferentes "valências" possíveis de um elemento, enquanto o termo valência passa a ser atribuído apenas ao valor máximo ou mais comum observado para um dado elemento. Desse período, foram analisados com maior profundidade três livros: Deming,72 por ser um autor recorrente no início do século XX, tendo publicado várias ediçoes de seus livros didáticos; Pauling,74 pela influência de seu autor, tanto no campo da química como no ensino dessa ciência, e particularmente pelo fato da obra selecionada apresentar questoes históricas e proposiçoes para se alterar o ensino do conceito de valência; e Partington,78 pelo fato de o autor haver se notabilizado como historiador da química. Em relaçao ao livro de Deming, cabe ressaltar que há um grande enfoque em aplicaçoes práticas do conhecimento químico na indústria, o que, segundo o autor, estava ligado ao esforço de guerra dos EUA. Além disso, é um livro cujo objetivo, anunciado no prefácio, era ser flexível, dando ao professor e ao aluno liberdade para estudar os capítulos que fossem mais convenientes, na ordem que achassem melhor. Dessa forma, os capítulos sao independentes, e retomam alguns conteúdos trabalhados anteriormente de forma sucinta.72 Nessa obra, o conceito de valência é introduzido pela primeira vez no capítulo 11, dedicado aos elementos, no qual é apresentada e discutida a tabela periódica, sendo a valência incluída como uma das propriedades periódicas. O valor da valência de um elemento é apresentado como sendo numericamente igual ao número do grupo ao qual o elemento pertence. A valência é definida como a quantidade de átomos de hidrogênio com a qual o átomo de um determinado elemento se combina ou desloca em uma reaçao química, podendo, em alguns casos, assumir mais de um valor, porém nao há explicaçao para tal fato nesse ponto. Mais adiante no livro, o autor afirma que as propriedades periódicas, e a própria tabela periódica, estao relacionadas com a distribuiçao eletrônica nos átomos. Pode-se inferir que, como a valência se inclui entre essas propriedades, ela também estaria relacionada com os elétrons.72 O livro de Deming retoma a valência em outros dois pontos: ao definir os tipos de valência, relacionando-os com os tipos de ligaçao química, uma vez que ambas as classificaçoes utilizam os mesmos nomes, iônica e covalente; e na discussao sobre reaçoes de oxidaçao-reduçao, as quais sao explicadas pelo ganho ou perda de elétrons, que seria equivalente a diminuiçao ou aumento do número de valência do elemento. Além desses pontos, cabe ressaltar que o conceito de valência aparece em locais diversos do livro, sendo descrito como uma das propriedades dos elementos químicos apresentados, usado para escrever fórmulas e para prever produtos de reaçoes químicas.72 No livro de Pauling, um dos aspectos mais relevantes em relaçao ao conceito de valência é a ressalva que o autor faz a respeito do uso indiscriminado do termo valence. Após defini-lo de forma clássica como poder de combinaçao de um elemento, e discorrer sobre fórmulas químicas e ligaçoes de valência, Pauling adverte:
Seguindo essa linha de pensamento, Pauling entao discute cada um dos termos e aspectos relacionados ao conceito de valência, fazendo uso dos outros termos citados acima. O autor aborda a proporçao entre os elementos nos óxidos, quando discute as propriedades periódicas. Discute os tipos de ligaçao química - iônica, covalente e coordenada - em termos eletrônicos, ou seja, como doaçao de elétrons, compartilhamento de elétrons e doaçao com compartilhamento de elétrons, respectivamente. Pauling usa as fórmulas de Lewis para montar as moléculas e em seguida as representa usando as fórmulas estruturais, a partir das quais discute geometria, polaridade e outras propriedades moleculares. Também discute os processos de oxidaçao-reduçao em termos da variaçao do número de oxidaçao, sendo explicados pela transferência de elétrons entre os elementos.74 Ao final da discussao dos termos mais específicos, Pauling apresenta uma seçao chamada "Desenvolvimento da Teoria Eletrônica de Valência", na qual faz um pequeno resumo da história dessa teoria. Começa mencionando os estudos que levaram à teoria dualística no início do século XIX proposta por Berzelius, e os problemas surgidos com o advento da química orgânica, cujos compostos nao se encaixavam naquela teoria. Na sequência, Pauling cita os trabalhos de Frankland que, em 1852, afirmou que os átomos tinham um poder de combinaçao definido, o qual determina as fórmulas dos compostos. Também sao citados Couper, que em 1858 teria escrito as primeiras fórmulas estruturais, e Kekulé, que também em 1858 realizou diversos estudos sobre o carbono e desenvolveu a teoria da química orgânica com base nas cadeias de carbono. Ainda no século XIX, Pauling menciona as contribuiçoes de Jacobus Henricus Van't Hoff (1852-1911) e Joseph Le Bel (1847-1930) sobre a geometria dos compostos orgânicos. Ao final desse apanhado histórico, o autor focaliza ideias desenvolvidas no século XX, citando os trabalhos de Gilbert Lewis (1875-1946) que, em 1916, explicou a valência com base nos elétrons. Pauling conclui essa seçao afirmando que, naquele momento (anos 1940) estavam sendo realizados diversos estudos sobre a estrutura das moléculas utilizando a química quântica. Essa discussao histórica, embora se possa dizer que é mais completa que a de outros livros do período, é feita de forma bem resumida, e está colocada após a apresentaçao do conceito de valência e de seus usos. Isso pode fazer com que a discussao histórica seja encarada como tendo um caráter complementar ou meramente informativo, nao sendo essencial e estando isolada da discussao conceitual anterior.74 Em relaçao a Partington, seu viés de historiador da química transparece no fato de dedicar a introduçao de seu livro à história da química, incluindo uma seçao sobre a história do conceito de valência, na qual sao abordadas a teoria unitária, a teoria dos tipos e a teoria dos radicais, sendo citados vários químicos [Frankland, Adolph Kolbe (1818-1884), Robert Bunsen (1811-1899), Jean-Baptiste Dumas (1800-1884), Charles Gerhardt (1816-1856)]. Partington atribui a Frankland a teoria de valência e a Couper a representaçao por traços. Também é abordada a discussao entre Frankland e Kekulé sobre a variaçao da valência. Essa parte do texto termina relacionando o dualismo e a nova teoria eletrônica, mencionando a teoria da ligaçao de valência, atribuída a Lewis. Essa discussao é retomada e resumida nos primeiros parágrafos do capítulo 10, dedicado à teoria quântica, o que demonstra a importância atribuída ao conceito de valência pelo autor.78 De acordo com Partington:
Seguindo o enfoque histórico da introduçao, o livro apresenta primeiramente a definiçao clássica de valência como poder de combinaçao, em termos do número de átomos de hidrogênio com o qual um dado elemento pode se combinar. Ao discutir a tabela periódica, no capítulo 7, o autor explica que: "The arrangement of the elements, or of groups of elements, in the order of their atomic weights, corresponds with their so-called valencies" (p. 174) [O arranjo dos elementos, ou dos grupos de elementos, na ordem de seus pesos atômicos tem correspondência com suas assim chamadas valências].78 A definiçao eletrônica é apresentada posteriormente, no capítulo 8, no qual, após discutir a estrutura atômica, Partington passa a relacionar a valência com os elétrons da última camada. Partington define os tipos de valência, também chamados pelo autor de tipos de ligaçao química (eletrovalência, covalência e coordenaçao), usando nessa parte as fórmulas de Lewis junto com a notaçao por traços. Partington retoma a valência e a ligaçao química no capítulo 10, sobre teoria quântica, discutindo ambos os conceitos em termos de orbitais, funçoes de ondas e spins eletrônicos.78
CONSIDERAÇOES FINAIS Ao comparar as abordagens dos livros didáticos ao longo das décadas, buscou-se identificar estratégias didáticas para o ensino do conceito de valência, observando-se modificaçoes e permanências na forma de apresentá-lo. No início do século XX, a valência era apresentada como um conceito empírico, e os autores recorriam a ele especialmente com uma finalidade bastante prática: escrever fórmulas de compostos químicos. Na época, nao havia receio em admitir que a origem ou a causa da valência era desconhecida. O advento de teorias sobre a estrutura eletrônica dos átomos levou a mudanças nessa abordagem. Observou-se a existência de um período de transiçao entre o conceito clássico e o conceito eletrônico, que ocorreu entre os anos 1920 e 1930, no qual ambas as definiçoes passaram a ser apresentadas pelos livros, muitas vezes em passagens distintas na mesma obra. Nesse período, que coincide historicamente com o período entre guerras, novas ideias foram aceitas e antigas ideias foram abandonadas. Dois exemplos disso, observados nos livros didáticos analisados, sao as abordagens para o conceito de átomo e o conceito de valência, o qual foi abordado no presente artigo. Nas décadas seguintes, passa a haver um gradual predomínio da abordagem eletrônica para a valência. Os modelos explicativos desenvolvidos no período anterior passam a ocupar um lugar central na apresentaçao didática da química geral, e o conceito de valência passa a ser relacionado a outros, como ligaçao química e número de oxidaçao. A determinaçao do valor da valência aparece de diferentes formas ao longo dos períodos, sendo mais comum, até os anos 1930, a análise das fórmulas dos compostos, ou seja, uma determinaçao empírica. A distribuiçao eletrônica e contagem dos elétrons na última camada se disseminam nos anos subsequentes. Além dessas, também sao citadas a determinaçao por meio da análise dos produtos das reaçoes de metais com ácidos, ou pela razao entre o peso atômico e o peso equivalente, apresentada por alguns livros de forma isolada ou juntamente com as determinaçoes mais comuns. A maioria dos livros apresenta tabelas com os valores de valência que devem ser usados para facilitar o trabalho de escrita de fórmulas, seja no próprio corpo do texto ou em anexos ao fim das obras. Cabe ressaltar a grande importância que os livros dao para o conceito de ligaçao química, o qual se modificou ao longo do período estudado. Inicialmente, a ligaçao química era considerada apenas como a uniao dos átomos, sendo sinônimo de valência, nao havendo discussoes sobre sua natureza. Após os anos 1930, com o uso maior da teoria eletrônica, a forma de apresentaçao é invertida: a valência passa a ter menor importância diante da ligaçao química, que se torna um conceito mais relevante. Em relaçao à nomenclatura, percebe-se que, no período estudado, os livros usam predominantemente o termo valence (em detrimento de valency e de termos antigos, como quantivalence). As notaçoes variaram gradualmente: os algarismos romanos, mais usados no início do período estudado, foram sendo abandonados em favor dos arábicos. Isso ocorreu juntamente com a adoçao de sinais de positivo e negativo associados aos valores das valências, tendência que afinal se diferenciou no conceito de número de oxidaçao. Os traços entre os símbolos dos elementos nas fórmulas estruturais - que, no início, representavam valências - com o tempo passaram a representar ligaçoes químicas. As fórmulas estruturais, em particular, demonstram um aspecto de interesse no contexto das estratégias didáticas utilizadas nos livros investigados. Embora essas formas de representaçao fossem bastante utilizadas, os livros nao discutem em profundidade a teoria estrutural para os compostos no contexto da valência. A relaçao do conceito de valência com a tabela periódica aparece em quase todas as obras analisadas, inicialmente em termos empíricos e, posteriormente, com a inserçao da explicaçao de ambas em termos de distribuiçao eletrônica. A ausência de maiores consideraçoes sobre a química orgânica na discussao da valência pode ser explicada por uma estratégia didática comum a muitos dos autores - que é fazer o foco principal da química geral recair sobre a química inorgânica. Também o uso da história do conceito de valência foi uma estratégia didática pouco explorada pelos autores cujas obras foram investigadas. Algum aspecto histórico aparece em livros de todos os períodos estudados, com diferentes graus de aprofundamento; mas, em geral, somente se apresentam nomes e atribuiçoes de prioridade de forma superficial e sem discutir o processo de desenvolvimento do conceito de valência. Da década de 1950 em diante, consolida-se a abordagem eletrônica para a valência. A distribuiçao eletrônica é apresentada como uma propriedade periódica dos elementos, e a valência é vista como decorrência dela. Alguns livros didáticos passam a apresentar o número de oxidaçao como uma propriedade periódica, ou seja, o número de valência com sinal positivo ou negativo, indicando a carga elétrica. Discute-se a variaçao da valência em termos de variaçao do número de oxidaçao pela transferência de elétrons, caracterizando os processos de oxidaçao-reduçao, com o envolvimento dos elétrons mais internos no caso dos metais de transiçao. Os conceitos surgidos nas décadas precedentes (número de oxidaçao, tipos de ligaçoes químicas, transferência de elétrons), relacionados à antiga ideia de valência, nao ficam restritos aos capítulos iniciais, mas disseminam-se por vários capítulos dos livros. Porém, ao contrário do que, segundo Pauling, muitos esperavam, o termo valência nao caiu em desuso.74 A valência continuou a ser usada, durante a década de 1950 e adiante, para escrever fórmulas e equaçoes químicas. Para o balanceamento das equaçoes de oxidaçao-reduçao, consolidou-se o uso dos números de oxidaçao. Uma característica cuja transformaçao foi possível observar nos livros didáticos do período estudado diz respeito às certezas e incertezas referentes ao conhecimento. Nas décadas iniciais do século XX, os autores de livros didáticos de química reconhecem explicitamente algumas lacunas no conhecimento, como a falta de explicaçoes para a natureza da valência ou para a variaçao periódica das propriedades dos elementos. Com o passar do tempo, essas lacunas vao sendo preenchidas, os livros didáticos vao se livrando das incertezas, e seus autores expressam confiança de que as teorias correntes seriam capazes de explicar toda a química - uma tendência que parece se estender até os dias atuais.
AGRADECIMENTOS Os autores agradecem à Fundaçao de Amparo à Pesquisa do Estado de Sao Paulo (FAPESP) pela concessao de bolsas de mestrado (2016/09213-5) e de pesquisa no exterior (2014/24213-6), ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) pelo auxílio à pesquisa (426519/2016) e pela concessao de bolsa de produtividade em pesquisa (307652/2017-3).
REFERENCIAS 1. Kuhn, T. S.; A Estrutura das Revoluçoes Científicas. Perspectiva: Sao Paulo, 2009. 2. Campos, C.; Cachapuz, A.; Quim. Nova Esc. 2010, 32, 107. 3. Coracini, M. J.; Interpretaçao, autoria e legitimaçao do livro didático, Pontes: Sao Paulo, 1999. 4. Campanario, J. M.; Enseñanza de las ciencias 2001, 19, 351. 5. Bensaude-Vincent, B.; Sci. Educ. 2006, 15, 667. 6. Souza, K. A. F. D.; Mate, C. H.; Porto, P. A.; Ciência & Educaçao 2011, 17, 679. 7. Choppin, A.; Educaçao e Pesquisa 2004, 30, 549. 8. Olesko, K. M.; Sci. Educ. 2006, 15, 863. 9. Niaz, M. A.; Instructional Science 2000, 28, 23. 10. Fernandes, M. A. M.; Porto, P. A.; Quim. Nova 2012, 35, 420. 11. Leite, H. S. A.; Porto, P. A.; Quim. Nova 2015, 38, 580. 12. https://doi.org/10.1351/goldbook.V06588, acessada em novembro de 2018. 13. Araújo Neto, W. N.; Cad. Temáticos Quim. Nova Esc. 2007, 7, 13. 14. Pimentel, A.; Cadernos de Pesquisa 2001, 114, 179. 15. Moraes, R.; Galiazzi, M. C.; Ciência & Educaçao 2006, 12, 117. 16. Russell, C. A.; History of valency.University of Chicago Press: Chicago, 1971. 17. Attfield, J.; Chemistry: general, medical, and pharmaceutical, including the chemistry of the U. S. Pharmacopœia; a manual on the general principles of the science, and their applications in medicine and pharmacy, 14th ed., Lea Brothers & Co.: Philadelphia, 1894. 18. Freer, P. C.; Descriptive inorganic general chemistry - A text book for colleges, Ediçao revisada, Allyn and Bacon: Boston, 1894. 19. Sadtler, S. P.; Trimble, H. A text-book of chemistry, intended for the use of pharmaceutical and medical students. Lippincott: Philadelphia, 1895. 20. Ostwald, W.; Outlines of general chemistry, Walker, J., trad.; 2nd ed., Macmillan: London, 1895. 21. Long, J. H.; Elements of general chemistry, with experiments. E. H. Colegrove: Chicago, 1898. 22. Fetterolf, D. W.; 300 questions and answers on general chemistry: The answers given in these notes are adapted from the text-books of recognized authorities, Privately printed: Philadelphia, 1900. 23. Tillman, S. E.; Descriptive general chemistry - a text-book for short course, 3rd ed. rev., J. Wiley: New York, 1904. 24. McPherson, W.; Henderson, W. E. An elementary study of chemistry. Ginn & Company: Boston, 1906. 25. Pond, G. G.; An outline of a course of instruction in general chemistry, 5th ed., Lippincott: Philadelphia, 1906. 26. Brownlee, R. B.; First Principles of Chemistry, Allyn and Bacon: Boston, 1907. 27. Smith, A.; General chemistry for colleges. Century: New York, 1908. 28. Baskerville, C.; General inorganic chemistry, D. C. Heath & Co.: Boston, 1909. 29. Ostwald, W. Outlines of general chemistry, Taylor, W. W., trad.; 3rd ed., Macmillan and Co.: London, 1909. 30. Molinari, E.; Treatise on general and industrial inorganic chemistry. P. Blakiston's Son & Co.: Philadelphia, 1912. 31. Newell, L. C.; General chemistry, D. C. Heath & Co.: Boston, 1912. 32. Newell, L. C.; General chemistry, D. C. Heath & Co.: Boston, 1914. 33. Pond, G. G.; An outline of a course of instruction in general chemistry, 7th ed., Lippincott: Philadelphia, 1912. 34. Blake, J. C.; General chemistry, theoretical and applied. Macmillan: New York, 1913. 35. Jones, H. C.; A new era in chemistry: some of the more important developments in general chemistry during the last quarter of a century, D. Van Nostrand Co.: New York, 1913. 36. McPherson, W.; Henderson, W. E.; A course in general chemistry, Ginn: Boston, 1913. 37. McPherson, W.; Henderson, W. E.; A course in general chemistry, Ginn: Boston, 1915. 38. McPherson, W.; Henderson, W. E.; A course in general chemistry, Ginn: Boston, 1917. 39. Cady, H. P.; General chemistry, McGraw-Hill: New York 1916. 40. Smith, A.; General chemistry for colleges, 2nd ed., The Century Co.: New York, 1916. 41. Hildebrand, J. H.; Principles of chemistry, The Macmillan Co.: New York, 1918. 42. McCoy, H. N.; Terry, E. M.; Introduction to general chemistry, 2nd ed., McGraw-Hill: New York, 1920. 43. Brownlee, R. B.; Elementary Principles of Chemistry. Allyn and Bacon: Boston, 1921. 44. Caven, R. M. The foundations of chemical theory: the elements of physical and general chemistry, Van Nostrand: New York 1921. 45. McPherson, W.; Henderson, W. E. A course in general chemistry. Boston: Ginn, 1921. 46. Holmes, H. N.; General chemistry, Macmillan Co.: New York, 1922. 47. Holmes, H. N.; General chemistry, Macmillan Co.: New York, 1925. 48. Deming, H. G.; General chemistry: an elementary survey emphasizing industrial applications of fundamental principles. J. Wiley & Sons: New York, 1923. 49. Deming, H. G.; General chemistry: an elementary survey, emphasizing industrial applications of fundamental principles, 2nd. ed., J. Wiley & Sons: New York, 1925. 50. Foster, W.; Introduction to general chemistry. Princeton University Press: Princeton, 1924. 51. Schlesinger, H. I.; General chemistry, Longmans, Green and Co.: New York, 1925. 52. Brinkley, S. R.; Principles of general chemistry. Macmillan: New York, 1926. 53. Kendall, J.; General chemistry: a cultural course based upon the texts of the late Alexander Smith, Century Co.: New York, 1927. 54. McCutcheon, T. P.; Seltz, H. General chemistry, theoretical and descriptive. D. Van Nostrand: New York, 1927. 55. Richardson, L. B.; General chemistry. H. Holt and Co.: New York, 1927. 56. Babor, J. A.; General chemistry; a text-book for college students. Thomas Y. Crowell: New York, 1929. 57. Hopkins, B. S.; General chemistry for colleges, D. C. Heath: Boston, 1930. 58. Foster, W.; An introduction to general chemistry, Princeton University Press: Princeton, 1931. 59. Brinkley, S. R.; Introductory general chemistry. Macmillan: New York, 1932. 60. Timm, J. A.; An introduction to chemistry, a pandemic text, 2nd ed., McGraw-Hill: New York, 1932. 61. Belcher, J. E.; Williams, G. Y.; Essentials of general chemistry, Semco Color Press: Oklahoma, 1934. 62. Bond, P. A.; The fundamentals of general chemistry, Farrar & Rinehart: New York, 1935. 63. Briscoe, H. T.; General chemistry for colleges, Houghton Mifflin: Boston, 1935. 64. Dunbar, R. E.; Visual outline of general chemistry, Longmans: New York, 1939. 65. Irwin, F. C.; Sherwood, G. R.; General and inorganic chemistry, P. Blakiston's Son & Co.: Philadelphia, 1939. 66. Sears, G. W.; Essentials of general chemistry: an introductory college course, International Textbook Co.: Scranton, 1939. 67. Babor, J. A.; Lehrman, A.; General college chemistry, Thomas Y. Crowell: New York, 1940. 68. Richardson, L. B.; Scarlett, A. J.; General college chemistry, H. Holt: New York, 1940. 69. Young, L. E.; Porter, C. W.; General chemistry; a first course. Prentice-Hall: New York, 1940. 70. Brinkley, S. R.; Principles of general chemistry, 3rd ed., Macmillan Co.: New York, 1941. 71. Massachusetts Institute of Technology (MIT); General chemistry: 5.01-5.02. [S.l.]: [s.i.], 1943. 72. Deming, H. G.; General chemistry: an elementary survey emphasizing industrial applications of fundamental principle, 5th ed., J. Wiley & Sons: New York, 1944. 73. Sneed, M. C.; General college chemistry. D. Van Nostrand Co.: New York, 1944. 74. Pauling, L.; General chemistry: an introduction to descriptive chemistry and modern chemical theory, Hayward, R., illust.; W. H. Freeman: San Francisco, 1947. 75. Currier, A. J.; Rose, A.; General and applied chemistry, a brief college course, McGraw-Hill: New York, 1948. 76. Laubengayer, A. W.; General chemistry, Rinehart: New York, 1949. 77. Sisler, H. H.; Van der Werf, C. A.; Davidson, A. W.; General chemistry, a systematic approach,Macmillan: New York, 1949. 78. Partington, J. R.; General and inorganic chemistry for university students, 4th. ed., St. Martin's Press: New York, 1966; Partington, J. R.; General and inorganic chemistry for university students, 1st ed., St. Martin's Press: New York, 1946. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access