Artigo
|
|
| Composição química e atividade antileishmania de Tocoyena hispidula Chemical composition and anti-leishmania activity from Tocoyena hispidula |
|
Elcilene A. de SousaI; Amauri Porto A. RosaI; Rodolfo Ritchelle L. dos SantosII; Ingredy L. dos SantosII; Valéria C. de SousaII; Fernando Aécio de A. CarvalhoII; Gerardo M. Vieira JúniorI; Mariana H. ChavesI,*
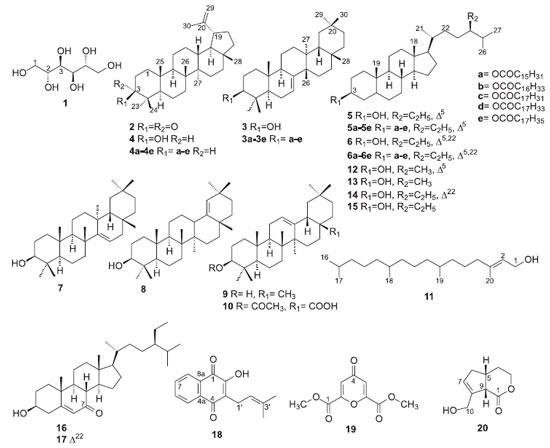
I. Departamento de Química, Universidade Federal do Piauí, 64049-550 Teresina - PI, Brasil Recebido em: 15/09/2018 *e-mail: mariana@ufpi.edu.br Phytochemical investigation of the CHCl3 fraction from EtOH extract of Tocoyena hispidula (Rubiaceae) stem resulted in the isolation and identification of D-(+)-mannitol, lupenone, 3-O-acetyloleanolic acid, lapachol, dimethyl chelidonate, morindolide and four mixtures (M1-M4): M1 (palmitate, margarate, linoleate, oleate e stearate of the multiflorenyl, lupeyl, sitosteryl and stigmasteryl), M2 (lupeol, taraxerol, germanicol, β-amyrin and E-fitol), M3 (campesterol, campestanol, stigmasterol, Δ22-stigmastenol, sitosterol and sitostanol) and M4 (7-ketositosterol and 7-ketostigmasterol). Structural identification of the compounds was performed by analysis 1H and 13C NMR spectra and by GC-MS. Extract, fractions, dimethyl chelidonate and morindolide inhibited the growth of Leishmania major promastigotes, being the CHCl3 (IC50 = 26.25 µg mL-1) and EtOAc (IC50 = 29.77 µg mL-1) fractions the more active. INTRODUÇAO Rubiaceae é considerada, entre as Angiospermas, a quarta maior família com 650 gêneros e 13.000 espécies.1 É caracterizada como uma das mais importantes da flora brasileira, com 126 gêneros e 1.412 espécies.2,3 É constituída pelas subfamílias Rubioideae, Ixoroideae e Cinchonoideae, as quais possuem como marcadores quimiotaxonômicos antraquinonas, iridoides e alcaloides indólicos, respectivamente. Plantas da família Rubiaceae sao também conhecidas por acumularem triterpenoides, saponinas, diterpenoides, esteroides, cumarinas, flavonoides, lignanas, derivados fenólicos e taninos, sendo os triterpenoides amplamente distribuídos em todas as subfamílias.4 Diversas atividades biológicas têm sido relatadas em plantas da família Rubiaceae tais como, anti-inflamatória, analgésica, antiviral, antibacteriana, antioxidante, antifúngica, antimicrobiana, anticâncer, anti-helmíntica, antidiabética, antimalárica, hepatoprotetora e antileishmania.5,6 O gênero Tocoyena (Rubiaceae) é típico do Cerrado, ocorre na regiao neotropical, sendo constituído por 30 espécies de hábito arbustivo ou árvores de pequeno porte. No Brasil há registro de 12 espécies, sendo cinco endêmicas, distribuídas em todas as regioes brasileiras.7 Esse gênero pertence à subfamília Ixoroideae, tribo Gardenieae-Gardenineae.1,8 Somente quatro espécies de Tocoyena possuem estudo químico (T. formosa, T. bullata, T. brasiliensis e T. sellowiana, sinonímia T. selloana), para as quais sao relatadas a presença de iridoides, flavonoides, esteroides, cumarinas, derivados fenólicos, triterpenoides e saponinas triterpênicas.8-10 Algumas atividades biológicas têm sido relatadas, como anti-inflamatória, antinociceptiva, antifúngica, estimulante em útero de ratas, antioxidante e gastroprotetora para T. formosa e capacidade de diminuiçao da perda óssea em ratos com periodontite para T. sellowiana.9,11 Tocoyena hispidula Standl é conhecida popularmente por flor-do-cerrado/angelca e jenipapinho, sendo encontrada nas regioes Norte (Pará) e Nordeste (Maranhao e Piauí) do Brasil na forma de arbustos ou subarbustos. Tradicionalmente suas raízes sao utilizadas no combate a dor de barriga e inflamaçao do útero,12 entretanto, nao há registros de estudo químico e biológico sobre esta espécie. O presente trabalho relata o isolamento e identificaçao estrutural de constituintes químicos da fraçao CHCl3 do extrato etanólico do caule de T. hispidula, bem como a avaliaçao do seu potencial antileishmania.
PARTE EXPERIMENTAL Procedimentos experimentais gerais Os espectros de RMN foram obtidos em espectrômetros Varian INOVA-modelo 400 (LAUREMN/UFPI), operando a 400 MHz (1H) e 100 MHz (13C) e Bruker Ascend-modelo 600 operando a 600 MHz (1H) e 150 MHz (13C). Foram utilizados CDCl3 ou DMSO-d6 como solventes e TMS como referência interna. O espectro de absorçao na regiao do infravermelho (IV) foi registrado em espectrômetro PerkinElmer, modelo Spectrum 100FT-IR, com faixa de número de onda de 4000 a 400 cm-1. O ponto de fusao foi obtido em equipamento da Microquímica Ind. e Com. Ltda, modelo MQAPF-301, com taxa de aquecimento de 1 °C min-1. A rotaçao específica foi obtida em polarímetro Automático Digital da Jasco-Modelo P2000 (Fonte: Hg, λ=546 nm). A análise dos esteroides e dos ésteres metílicos por CG-EM foi realizada em cromatógrafo GCMS-QP2010 (Shimadzu), equipado com coluna Rtx-5MS (30 m x 0,25 mm x 0,250 µm), fase estacionária difenildimetilpolissiloxano (5% de difenil e 95% de dimetilpolissiloxano), usando modo split (100:1) e espectrômetro de massas operando com ionizaçao por elétrons (EI 70 eV) com faixa de massas m/z 45 a 700 Da, utilizando hélio como gás de arraste, com fluxo de 1 mL min-1. As condiçoes de operaçao da análise cromatográfica dos esteroides foram: temperatura inicial do forno de 100 °C por 2 minutos, com taxa de aquecimento de 10 °C min-1 até 300 °C permanecendo por 10 minutos. A temperatura do injetor foi de 280 °C, da interface 290 °C e da fonte 270 °C. Para os ésteres metilícos foi utilizada a seguinte programaçao: temperatura inicial do forno de 70 °C por 2 minutos, com taxa de aquecimento de 6 °C min-1 até 310 °C, permanecendo por 10 minutos. A temperatura do injetor foi de 300 °C, da interface 310 °C e da fonte 260 °C. Os compostos foram identificados por comparaçao dos espectros de massas obtidos com os da biblioteca Wiley229. As placas cromatográficas foram preparadas utilizando uma suspensao de gel de sílica 60 da Macherey-Nagel em água destilada e as revelaçoes das cromatoplacas foram feitas por nebulizaçao com soluçao de Ce(SO4)2. Os solventes e reagentes utilizados na preparaçao dos extratos e fracionamentos foram todos de pureza analítica (P.A.) obtidos da Synth. Nas separaçoes por cromatografia em coluna foram empregados, gel de sílica 0,060-0,200 mm da Macherey-Nagel e Sephadex LH-20 da Aldrich. Material vegetal O caule de Tocoyena hispidula Standl foi coletado na fazenda Lourdes (S 04° 51' 32,4'' W 42° 03' 42,9'', altitude: 154 m), no município de Jatobá do Piauí-PI, em 31 de maio de 2015. O material vegetal foi identificado pela botânica Dra. Ruth Raquel Soares de Farias e, uma exsicata encontra-se depositada no Herbário Graziela Barroso da UFPI com o número TEPB 30.572. Isolamento dos constituintes químicos O caule seco e moído (1,4 kg) foi submetido à maceraçao exaustiva com etanol (95%). O material obtido foi concentrado em evaporador rotativo e liofilizado, fornecendo 48 g (3,5%) de extrato EtOH. Uma alíquota de 41 g do extrato foi solubilizada em MeOH, ocorrendo a formaçao de um precipitado, identificado como o composto 1 (4,5 g; 9,4%). A parte solúvel em MeOH do extrato (36,5 g) foi submetida à cromatografia em coluna filtrante de gel de sílica, utilizando hexano, CHCl3, AcOEt e MeOH como eluentes. A fraçao CHCl3 (2,8 g) foi aplicada em coluna cromatográfica de gel de sílica, eluída com hexano/AcOEt em ordem crescente de polaridade. Foram coletadas 82 fraçoes e reunidas em 16 grupos após análise por CCDC. O grupo CC9 (340,7 mg) foi submetido à cromatografia em coluna de Sephadex LH-20 utilizando hexano/CH2Cl2 (1:4) e cromatografia em coluna de gel de sílica, eluída com hexano/AcOEt 98:2, fornecendo a subfraçao CC9-7-2 (161,2 mg) e o composto 2 (14,3 mg). Uma alíquota de 50 mg da subfraçao CC9-7-2 (M1) foi submetida à reaçao de hidrólise alcalina,13 fornecendo, após extraçao com éter etílico, as fases etérea (FE; 25,2 mg)eaquosa (FA). A fase etérea (FE) foi aplicada em coluna cromatográfica de gel de sílica utilizando hexano/AcOEt 95:5, resultando nas fraçoes FE-21 (2,7 mg) e FE-35 (10,4 mg), identificadas como as misturas de 3+4 e 5+6, respectivamente. A fase aquosa (FA) foi acidificada com H2SO4 a 30% (pH=4), extraída com éter etílico e metilada com diazometano,13 resultando em 10 mg da mistura dos ésteres metílicos dos ácidos palmítico (a: 16:0, 33,72%), margárico (b: 17:0, 2,50%), linoleico (c: 18:2, Δ9,12, 22,11%), oleico (d: 18:1, Δ9, 29,90%) e esteárico (e: 18:0, 8,52%), identificados após análise por CG-EM (Figuras 12S-17S). Os grupos CC13 (143,9 mg), CC15 (167,5 mg) e CC24 (321,0 mg) foram aplicados em colunas cromatográficas de Sephadex LH-20, utilizando hexano/CH2Cl2 (1:4). Os grupos CC13 e CC15 forneceram o composto 18 (44 mg) e a mistura M2 (4+7+8+9+11; 17,7 mg), respectivamente, enquanto CC24 resultou na mistura M3 (5+6+12+13+14+15; 115,0 mg) e no composto 10 (25,9 mg). O grupo CC50 (98,0 mg) também foi submetido a cromatografia em coluna de Sephadex LH-20, utilizando hexano/CH2Cl2 (1:4), seguido de filtraçao em gel de sílica com CHCl3, conduzindo à mistura M4 (16+17; 5,4 mg) e ao composto 19 (5,7 mg). O grupo CC72 (100,7 mg), depois de submetido a cromatografia em coluna de Sephadex LH-20, utilizando hexano/CH2Cl2 (1:4) forneceu o composto 20 (46 mg). Chelidonato de metila (19). Sólido amorfo laranja. PF: >200 °C (decomposiçao). RMN de 1H e 13C (400 e 100 MHz, respectivamente, em CDCl3): ver Tabela 1.
Avaliaçao da atividade antileishmania As formas promastigotas de Leishmaniamajor em fase logarítimica de crescimento foram semeadas em placas de cultivo celular com 96 poços (1 x 106 leishmania por poço), contendo meio Schneider's suplementado. O extrato EtOH, fraçoes CHCl3, AcOEt e MeOH e os compostos 19 e 20 foram adicionados aos poços em diluiçoes seriadas de 800 a 6,25 µg mL-1. As placas foram incubadas em estufa de demanda biológica (BOD) à temperatura de 26 °C e, após 48 h, os parasitas foram corados com resazurina (1 mmol L-1) e feita a leitura em espectofotômetro para obtençao da densidade ótica a 550 nm. O controle positivo consistiu de 2 µg mL-1 de anfotericina B diluída em meio Schneider's a 0,2% de DMSO e considerado como 100% de viabilidade das leishmanias.14
RESULTADOS E DISCUSSAO O extrato EtOH do caule de T. hispidula após suspensao em MeOH formou um precipitado identificado como D-(+)-manitol (1).15 O fracionamento cromatográfico do sobrenadante do extrato EtOH forneceu as fraçoes hexânica (50 mg; 0,15%), CHCl3 (2,8 g; 7,70%), AcOEt (3,6 g; 9,90%) e MeOH (26,6 g; 72,90%). A fraçao CHCl3, depois de submetida a procedimentos cromatográficos clássicos, resultou no isolamento e identificaçao da lupenona (2),16 ácido acetiloleanólico (10),17 lapachol (18),18 chelidonato de metila (19), morindolídeo (20)19 e quatro misturas (M1-M4) de isoprenoides. A mistura M1 é constituída por triterpenoides e esteroides esterificados com ácidos graxos, entre os quais, o palmitato, margarato, linoleato, oleato e estearato de multiflorenila (3a-3e), lupeila (4a-4e), sitosterila (5a-5e) e estigmasterila (6a-6e).20,21 A mistura M2 é composta pelos triterpernoides pentacíclicos lupeol (4), taraxerol (7), germanicol (8), β-amirina (9)20 e o diterpenoide E-fitol (11).22 A mistura M3 (Figura 20S) é formada pelos esteroides 3β-OH sitosterol (5, 47,31%), estigmasterol (6, 25,15%), campesterol (12, 17,96%), campestanol (13, 1,17%), Δ22-stigmastenol (14, 2,44%), e sitostanol (15, 3,76%)21 e a mistura M4 contém 7-cetositosterol (16) e 7-cetoestigmasterol (17).23 As estruturas dos compostos 1-11 e 16-20 foram identificadas pela análise dos espectros de RMN de 1H e 13C e comparaçao com dados da literatura. Os esteroides 12-15 e os ésteres metílicos dos ácidos graxos (a-e) foram identificados por comparaçao dos espectros de massas obtidos com os da biblioteca Wiley229. As estruturas dos compostos identificados sao mostradas na Figura 1.
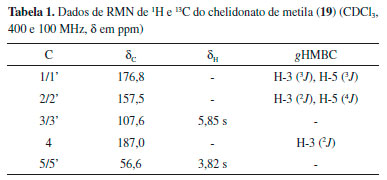
Nao foram encontrados na literatura os dados de RMN para o composto 19. Seu espectro de RMN de 1H (Figura 33S) apresentou somente dois simpletos em δ 5,85 (H3/3') e 3,82 (H-5/5') com integraçao para um e três hidrogênios, respectivamente, sendo este último característico de grupo metoxila. O espectro de RMN de 13C (Figura 34S) mostrou cinco sinais, sugerindo uma estrutura simétrica. Dois sinais em δ 187,0 (C-4) e 176,8 (C-1/1') sao de carbonilas, um em δ 157,5 (C-2/2') é de carbono sp2 nao hidrogenado ligado a oxigênio, um em δ 107,6 (C-3/3') de carbono metínico sp2 e um em δ 56,2 (C-5/5') referente a metoxila. A análise do mapa de contornos gHMBC (Tabela 1 e Figura 36S) mostrou correlaçoes de H-3/3' (δ 5,85) com C-4 (δ 187,0), C-2/2' (δ 157,5) e C-1/1' (δ 176,8) e de H-5/5' (δ 3,82) com C-1/1' (δ 176,8) e C-2/2' (δ 157,5). A análise dos dados de RMN permitiram identificar o chelidonato de metila (19). Este composto é o éster metílico do ácido chelidônico, uma γ-pirona já relatada na família Rubiaceae.4,24 O composto 19 possui atividade anti-alérgica e foi relatado pela primeira vez de fonte natural em Senna spectabilis (Leguminosae).25 Com exceçao do D-(+)-manitol (1), β-amirina (9), sitosterol (5) e estigmasterol (6), todos os demais compostos estao sendo relatados pela primeira fez no gênero Tocoyena. O palmitato e estearato de multiflorenila (3a e 3e), margarato, linoleato, oleato e estearato de lupeila (4b-4e), margarato, oleato e estearato de sitosterila (5b, 5d e 5e), oleato e estearato de estigmasterila (6d-6e) e chelidonato de metila (19) estao sendo relatados pela primeira vez na família Rubiaceae. O composto 20 é um 11-noriridoide, resultante da perda de C-11. Os derivados de 11-noriridoide-1,3-olídeo sao raramente encontrados de fontes naturais, entretanto, foi relatado em Morinda officinalis (Rubiaceae).26 Atividade antileishmania A leishmaniose é uma doença tropical negligenciada, causada por protozóarios do gênero Leishmania, os quais se apresentam nas formas promastigota (extracelular) e amastigota (intracelular). Clinicamente, a leishmaniose apresenta-se nas formas cutânea e mucocutânea resultando em lesoes superficiais e, na forma visceral ataca os orgâos internos podendo levar a óbito.27 A ausência de vacinas e a toxicidade dos medicamentos atualmente usados para tratar a leishmaniose impulsiona a busca por novas substâncias ativas provenientes de plantas.27 Dessa forma, considerando a ocorrência de atividade antileishmania em plantas da família Rubiaceae,6 o extrato, fraçoes e os compostos 19 e 20 de T. hipidula foram investigados frente a formas prosmatigostas de Leishmania major. A Tabela 2 mostra que o extrato EtOH, as fraçoes CHCl3, AcOEt e MeOH e os compostos 19 e 20 inibiram o crescimento de L. major. As fraçoes CHCl3 (CI50=26,25 µg mL-1) e AcOEt (CI50=29,77 µg mL-1) mostraram-se mais ativas que a fraçao MeOH (CI50=247,34 µg mL-1) e o extrato EtOH (CI50=105,19 µg mL-1), evidenciando que o fracionamento em coluna cromatográfica filtrante concentrou a atividade antileishmania nas fraçoes CHCl3 e AcOEt e que a espécie possui compostos ativos com polaridades diferentes.
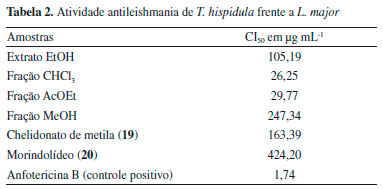
A atividade antileishmania da fraçao CHCl3 pode ser atribuída em parte ao chelidonato de metila (19) mas, sobretudo, a outros compostos isolados desta fraçao que já possuem atividade antileishmania descrita na literatura, como o lapachol (CI50=5,2±0,7 µg mL-1),28 ácido acetiloleanólico (CI50=5,0±0,1 µM),29 lupeol (CI50=39,06 µg mL-1)30 e mistura de sitosterol e estigmasterol (CI50=70±0 µg mL-1),31 os quais foram testados frente a L. amazonensis.
CONCLUSAO O estudo fitoquímico da fraçao CHCl3 do extrato EtOH do caule de T. hispidula conduziu ao isolamento de seis compostos puros e quatro misturas, com predominância de triterpenoides e esteroides. Nos ensaios de atividade antileishmania frente a promastigotas de L. major as fraçoes CHCl3 e AcOEt mostraram-se mais ativas que o extrato EtOH, fraçao MeOH, chelidonato de metila (19) e morindolídeo (20). Os resultados obtidos contribuem para o conhecimento da composiçao química do extrato EtOH do caule de T. hispidula e demonstra o potencial antileishmania da espécie. MATERIAL SUPLEMENTAR Espectros de RMN de 1H e 13C, infravermelho (IV), cromatogramas e espectros de massas dos compostos estao disponíveis em http://quimicanova.sbq.org.br, na forma de arquivo PDF, com acesso livre.
AGRADECIMENTOS Os autores agradecem à Capes, ao CNPq e ao CNPq/INCTBioNat (465637/2014-0) pelo apoio financeiro e bolsas de E. A. Sousa e M. H. Chaves (302639/2015-2). Ao LAUREMN/UFPI pelos espectros de RMN e à Dra. R. R. S. Farias pela coleta e identificaçao do material vegetal.
REFERENCIAS 1. Delprete, P. G.; Jardim, J. G.; Rodriguésia 2012, 63, 101. 2. Barbosa, M. R.; Zappi, D.; Taylor, C.; Cabral, E.; Jardim, J. G.; Pereira, M. S.; Calió, M. F.; Pessoa, M. C. R.; Salas, R.; Souza, E. B.; Di Maio, F. R.; Macias, L.; Anunciaçao, E. A.; Germano Filho, P.; Oliveira, J. A.; Bruniera, C. P.; Gomes, M.; De Toni, K.; Firens, M.; 2015 Rubiaceae in Lista de Espécies da Flora do Brasil. Jardim Botânico do Rio de Janeiro. Disponível em: http://floradobrasil.jbrj.gov.br/jabot/floradobrasil/FB210, acessado em novembro 2018. 3. Bolzani, V. S.; Young, M. C. M.; Furlan, M.; Cavalheiro, A. J.; Araújo, A. R.; Silva, D. H. S.; Lopes, M. N.; Recent Res. Dev. Phytochem. 2001, 5, 19. 4. Martins, D.; Nunez, C. V.; Molecules 2015, 20, 13422. 5. Haudecoeura, R.; Peuchmaura, M.; Pérèsa, B.; Rome, M.; Taïwe, G. S.; Boumendjela, A.; Boucherle, B.; J. Ethnopharmacol. 2018, 212, 106; Taika, B. B.; Bouckandou, M.; Souza, A.; Bouroboub, H. P. B.; MacKenzie, L. S.; Lione, L.; J. Ethnopharmacol. 2018, 216, 203; Assi, R. A.; Darwis, Y.; Abdulbaqi, I. M.; khan, L. V.; Vuanghao, L.; Laghari, M. H.; Arabian J. Chem. 2017, 10, 691. 6. Rocha, L. G.; Almeida, J. R. G. S.; Macêdo, R. O.; Barbosa-Filho, J. M.; Phytomedicine 2015, 12, 514; Moreira, V. F.; Vieira, I. J. C.; Braz-Filho, R.; Am. J. Plant Sci. 2015, 6, 2612; Kato, L.; Oliveira, C. M. A.; Faria, E. O.; Ribeiro, L. C.; Carvalho, B. G.; Silva, C. C.; Schuquel, I. T. A.; Santin, S. M. O.; Nakamura, C. V.; Britta, E. A.; Miranda, N.; Iglesias, A. H.; Delprete, P. G.; J. Braz. Chem. Soc. 2012, 23, 355; Baldé, E. S.; Megalizzi, V.; Traoré, M. S.; Cos, P.; Maes, L.; Decaestecker, C.; Pieters, L.; Baldé, A. M.; J. Ethnopharmacol. 2010, 130, 529; Ahua, K. M.; Ioset, J.-R.; Ioset, K. N.; Diallo, D.; Mauel, J.; Hostettmann. K.; J. Ethnopharmacol. 2007, 110, 99. 7. Oliveira, J. A.; 2015. Tocoyena in Lista de espécies da Flora do Brasil. Jardim Botânico do Rio de Janeiro. Disponível em: http://floradobrasil.jbrj.gov.br/jabot/floradobrasil/FB14335, acessado em novembro 2018. 8. Poser, G. L. V.; Seibt, L. T.; Biochem. Syst. Ecol. 1998, 26, 669. 9. Bolzani, V. S.; Izumisawa, C. M.; Young, M. C. M.; Trevisan, L. M. V.; Kingston, D. G. I.; Phytochemistry 1997, 46, 305. 10. Hamerski, L.; Carbonezi, C. A.; Cavalheiro, A. J.; Bolzani, V. S.; Young, M. C. M.; Quim. Nova 2005, 28, 601. Bolzani, V. S.; Trevisan, L. M. V.; Izumisawa, C. M.; Young, M. C. M.; J. Braz. Chem. Soc. 1996, 7, 157; Santos, W. P.; Santos, H. S.; Bandeira, P. N.; Pessoa, O. D. L.; Silveira, E. R.; Braz-Filho, R.; Albuquerque, M. R. J. R.; Resumos da 34º Reuniao Anual da Sociedade Brasileira de Química, Florianópolis, Brasil, 2011; Rocha, M. O.; Dissertaçao de Mestrado, Universidade Federal de Alagoas, Brasil, 2009. 11. Cesário, F. R. A. S.; Albuquerque, T. R.; Lacerda, G. M.; Oliveira, M. R. C.; Silva, B. A. F.; Rodrigues, L. B.; Martins, A. O. B. P. B.; Almeida, J. R. G. S.; Vale, M. L.; Coutinho, H. D. M.; Menezes, I. R. A.; Saudi J. Biol. Sci. (2018), doi:10.1016/j.sjbs.2018.01.008; Cesário, F. R. A. S.; Albuquerque, T. R.; Lacerda, G. M.; Oliveira, M. R. C.; Rodrigues, L. B.; Martins, A. O. B. P. B.; Boligon, A. A.; Quintans-Júnior, L. J. Q.; Araújo, A. A. S.; Vale, M. L.; Coutinho, H. D. M.; Menezes, I. R. A.; Biomed. Pharmacother. 2018, 97, 321; Barros, G. S. G.; Matos, F. J. A.; Vieira, J. E. V.; Sousa, M. P.; Medeiros, M. C.; J. Pharm. Pharmacol. 1970, 22, 116; Cesário, F. R. A. S.; Albuquerque, T. R.; Silva, B. A. F.; Lacerda, G. M.; Rodrigues, L. B.; Martins, A. O. B. P. B.; Quintans-Júnior, L. J.; Almeida, J. R. G. S.; Vale, M. L.; Coutinho, H. D. M.; Menezes, I. R. A.; Food Chem. Toxicol. 2018, 112, 355; Ribeiro, D. S. F.; Freire, J. M. O.; Teixeira, A. H.; Val, D. R.; Freitas, A. R.; Gomes, F. I. F.; Silva, A. A. R.; Bandeira, P. N.; Santos, H. S.; Santos, W. P.; Avila, F. N.; Pereira, K. M. A.; Goes, P.; Pinto, V. P. T.; Cristino-Filho, G.; Albuquerque, M. R. J. R.; Chaves, H. V.; Bezerra, M. M.; Biomed. Pharmacother. 2018, 98, 863. DOI: http://dx.doi.org/10.1016/j.sjbs.2018.01.008 12. Silva, M. P.; Dissertaçao de Mestrado, Universidade Federal do Piauí, Brasil, 2010; Oliveira, L. S. D.; Soares, S. M. N. A.; Soares, F. A. R.; Barros, R. F. M.; Revista Brasileira de Biociências 2007, 5, 372. 13. Silva, H. R.; Silva, C. C. M.; Caland-Neto, L. B; Lopes, J. A. D.; Citó, A. M. G. L.; Chaves, M. H.; Quim. Nova 2007, 30, 1877. 14. Valadares, D. G.; Duarte, M. C.; Oliveira, J. S.; Chávez-Fumagalli, M. A.; Martins, V. T.; Costa, L. E.; Leite, J. P. V.; Santoro, M. M.; Régis, W. C. B.; Tavares, C. A. P.; Coelho, E. A. F.; Parasitol. Int. 2011, 60, 357; Soares, D. C.; Pereira, C. G.; Meireles, M. A. A.; Saraiva, E. M.; Parasitol. Int. 2007, 56, 135. 15. Paula, V. F.; Barbosa, L. C. A; Piló-Veloso, D.; Demuner, A. J.; Howarth, O.; Ecletica Quim. 1998, 23, 45. 16. Olea, R. S. G.; Roque, N. F.; Quim. Nova 1990, 13, 278. 17. Jo, Y.; Suh, J.; Shin, M. H.; Jung, J. H.; Im, K. S.; Arch. Pharmacal Res. 2005, 28, 885. 18. Moreira, R. Y. O.; Arruda, M. S. P.; Arruda, A. C.; Santos, L. S.; Müller, A. H.; Guilhon, G. M. S. P.; Santos, A. S.; Terezo, E.; Rev. Bras. Farmacogn. 2006, 16, 392. 19. Yoshikawa, M.; Yamaguchi, S.; Nishisaka, H.; Yamahara, J.; Murakami, N.; Chem. Pharm. Bull. 1995, 43, 1462. 20. Mahato, S. B.; Kundu, A. P.; Phytochemistry 1994, 37, 1517. 21. De-Eknamkul, W.; Potduang, B.; Phytochemistry 2003, 62, 389. 22. Rahman, A.; Ahmad, V. U. 13C-NMR of Natural Products: Diterpenes. Plenum Press: New York, 1992. 23. Wang, Q.-Y.; Cui, G.-X.; Wu, J.-C.; Chen, Y.-G.; Chem. Nat. Compd. 2015, 51, 1196; Li, R.-J.; Guo, D.-X.; Lou, H.-X.; Chin. J. Nat. Med. 2013,11, 74. 24. Shen, Z.-W.; Fisinger, U.; Poulev, A.; Eisenreich, W.; Werner, I.; Pleiner, E.; Bacher, A.; Zenk, M. H.; Phytochemistry 2001, 57, 33. 25. Mallaiah, B. V.; Kumar, K. A.; Sarma, P. N.; Srimannarayana, G.; Curr. Sci. 1984, 53, 33. 26. Ban, N. K.; Giang, V. H.; Linh, T. M.; Lien, L. Q.; Ngoc, N. T.; Thao, D. T.; Nam, N. H.; Cuong, N. X.; Kiem, P. V.; Minh, C. V.; Phytochem. Lett. 2013, 6, 267. 27. Cock, I. E.; Selesho, M. I.; Vuuren, S. F. V.; J. Etnopharmacol. 2018, 220, 250. 28. Lima, N. M. F.; Correia, C. S.; Leon, L. L.; Machado, G. M. C.; Madeira, M. F.; Santana, A. E. G.; Goulart, M. O. F.; Mem. Inst. Oswaldo Cruz 2004, 99, 757. 29. Gnoatto, S. C. B.; Vechia, L. D.; Lencina, C. L.; Dassonville-Klimpt, A.; Nascimento, S.; Mossalayi, D.; Guillon, J.; Gosmann, G.; Sonnet, P.; J. Enzyme Inhib. Med. Chem. 2008, 23, 604. 30. Souza, A. C.; Alves, M. M. M.; Brito, L. M.; Oliveira, L. G. C.; Sobrinho-Júnior, E. P. C.; Costa, I. C. G.; Freitas, S. D. L.; Rodrigues, K. A. F.; Chaves, M. H.; Arcanjo, D. D. R.; Carvalho, F. A. A.; J. Evidence-Based Complementary Altern. Med. 2017, 2017, 1. 31. Silva, A. A. S.; Morais, S. M.; Falcao, M. J. C.; Vieira, I. G. P.; Ribeiro, L. M.; Viana, S. M.; Teixeira, M. J.; Barreto, F. S.; Carvalho, C. A.; Cardoso, R. P. A.; Andrade-Junior, H. F.; Phytomedicine 2014, 21, 1419. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access