Artigo
|
|
| Um estudo cinético sobre a influência de mediadores fenólicos na descoloração de diferentes corantes por sistemas fenton A kinetic study about the influence of phenolic mediators in the decolorization of different dyes by fenton systems |
|
Cássia Sidney SantanaI; Camila Cristina Vieira VellosoI; André AguiarII,*
I. Universidade Federal de São João del-Rei, Campus Alto Paraopeba, 36420-000 Ouro Branco - MG, Brasil Recebido em: 31/07/2018 The present work evaluated the influence of phenolic mediators (five dihydroxybenzenes and gallic acid) on the decolorization kinetics of phenol red, chromotrope 2R, and methylene blue by Fenton systems. The reactions were performed with H2O2, iron salts as catalysts, and the absence or presence of phenolic mediators. Based on the decolorization data from previous study of our group, the 1st and 2nd order kinetic models were analyzed, as well as the alternative BMG model. It was found that the mediators accelerated the reactions, based in 1st and 2nd order kinetic models. Reactions containing Fe2+ fitted better to the BMG model, while reactions containing Fe3+ fitted better to the 2nd order kinetic model, independent of mediators. Based on the three evaluated kinetic models, pro-oxidant properties were observed for the mediators in Fenton systems. INTRODUÇAO Devido à limitaçao de técnicas convencionais para remoçao ou degradaçao de poluentes orgânicos complexos como os corantes, presentes comumente em efluentes têxteis, têm-se buscado novas alternativas. Nos últimos anos têm-se destacado os processos oxidativos avançados (POAs), principalmente aqueles baseados na reaçao de Fenton para degradaçao de corantes.1-3 A reaçao de Fenton consiste na degradaçao catalítica de peróxido de hidrogênio por íons ferrosos com a consequente formaçao in situ de radicais hidroxila (HO•; Eq. 1). Esses radicais possuem alto potencial padrao de reduçao (Eº = 2,80 V), capazes de oxidar diferentes poluentes orgânicos a moléculas mais simples, inclusive convertê-los em CO2, H2O e íons inorgânicos. Essa reaçao é mais conhecida como reaçao de Fenton clássica. Os íons Fe3+ também podem ser utilizados em substituiçao ao Fe2+, pois os primeiros sao mais abundantes, tendo-se a reaçao tipo Fenton (Eq. 2). Com base nas constantes cinéticas de ambas, a velocidade é menor na presença do Fe3+, além de gerar somente o radical hidroperoxila (HO2 •), o qual possui potencial padrao de reduçao inferior ao HO•.4-6 Apesar de ser muito lenta, essa segunda reaçao é importante para reduzir Fe3+ a Fe2+ para reagir depois com H2O2 (Eq. 1). Na ausência de um substrato orgânico, o consumo de HO• envolve uma série de reaçoes complexas concomitantemente (Eq. 3-6).6 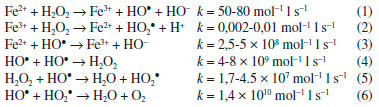 Uma forma de aumentar a geraçao de HO•em sistemas Fenton e torná-la duradoura, independente do estado inicial de oxidaçao dos íons de ferro e da regeneraçao lenta de Fe2+ pela reaçao tipo Fenton, consiste na adiçao de mediadores fenólicos redutores. Diferentes compostos que reduzem rápida e continuamente Fe3+ a Fe2+ têm sido estudados, sendo eles sintéticos ou de origem natural.4 Fenóis derivados de lignina como a vanilina,7,8 o metabólito fúngico ácido 3-hidroxiantranílico9 e o derivado de taninos ácido gálico têm sido avaliados como mediadores fenólicos naturais.10-12 Além deles, o aminoácido cisteína e o ácido ascórbico (nao fenólicos), também têm proporcionado incrementos na degradaçao de corantes e outros poluentes orgânicos por sistemas Fenton.13,14 Por outro lado, compostos sintéticos como os di-hidroxibenzenos têm sido os mais testados, principalmente o catecol.15-17 Irradiaçao também pode promover a regeneraçao de íons Fe2+ para aumentar a produçao de radicais HO•. No entanto, o uso de reatores mais complexos, além do custo de energia elétrica adicional, limita a aplicaçao de sistemas foto-Fenton.5,6 Em estudos anteriores do nosso grupo têm sido observados incrementos na descoloraçao de corantes, pertencentes a diferentes classes, por sistemas Fenton devido à adiçao de diversos mediadores fenólicos redutores de Fe3+.7-9,11,15 Entretanto, é preciso avaliar como esses compostos podem influenciar a velocidade de descoloraçao dos corantes baseado em diferentes modelos cinéticos. Alguns estudos têm-se limitado apenas ao modelo linear de 1ª ordem para verificar o efeito pro-oxidante de mediadores. Percebe-se que esse modelo nao é sempre o mais adequado, pois os valores de coeficientes de correlaçao que descrevem a cinética das reaçoes (r2) em alguns trabalhos sao inferiores a 0,9, o que pode comprometer a análise e a comparaçao de diferentes sistemas reacionais.13,14,18 Com base nessas consideraçoes, o presente trabalho teve como objetivo realizar um estudo cinético baseado nos três modelos lineares mais estudados (1ª ordem, 2ª ordem e BMG) a partir de dados de um trabalho prévio do nosso grupo,15 envolvendo a descoloraçao de corantes de diferentes classes por sistemas Fenton homogêneos (Fe2+/H2O2, Fe3+/H2O2). Os corantes avaliados foram o vermelho de fenol (trifenilmetilênico), cromotrope 2R (azo) e o azul de metileno (tiazina). Os experimentos de descoloraçao foram avaliados na ausência e na presença de cinco di-hidroxibenzenos: os ácidos 2,3-, 2,4-, 2,5-di-hidroxibenzóicos (DHBs) e 3,4-di-hidroxifenilacético (3,4-DHFA), além do catecol. O tri-hidroxibenzeno ácido gálico também foi avaliado como mediador. Pretende-se verificar nesse estudo o efeito pro-oxidante desses compostos fenólicos em sistemas Fenton.
PARTE EXPERIMENTAL Os reagentes utilizados nesse estudo foram de grau analítico e obtidos de diferentes fornecedores: cromotrope 2R e os ácidos 2,3-, 2,4-, 2,5-DHBs e 3,4-DHFA foram obtidos da Sigma-Aldrich (Milwaukee WI, Estados Unidos); catecol da Fluka Chemie (Buchs, Suiça); Fe(NO3)3, ácido gálico, vermelho de fenol e H2O2 (30% m/m) da Vetec Química (Rio de Janeiro, Brasil). Acido sulfúrico e azul de metileno foram obtidos de outros fornecedores, mas também de grau analítico. As soluçoes foram preparadas com o uso de água deionizada e depois armazenadas adequadamente, com exceçao das soluçoes de mediadores fenólicos que eram preparadas e usadas no mesmo dia, enquanto as soluçoes de sais de ferro eram preparadas imediatamente antes do uso, com o intuito de minimizar a alteraçao do estado de oxidaçao desse metal. As estruturas químicas dos cinco di-hidroxibenzenos e do ácido gálico, assim como as dos corantes, estao mostradas na Figura 1.
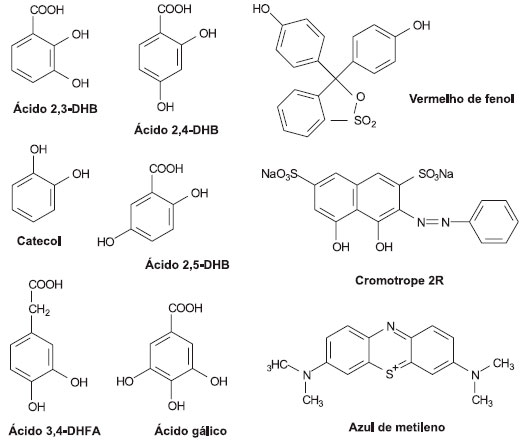 Figura 1. Estrutura química dos mediadores fenólicos e dos três corantes avaliados no presente estudo
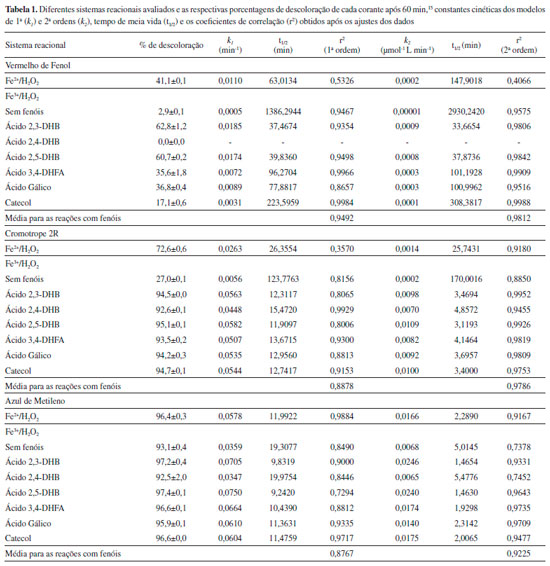
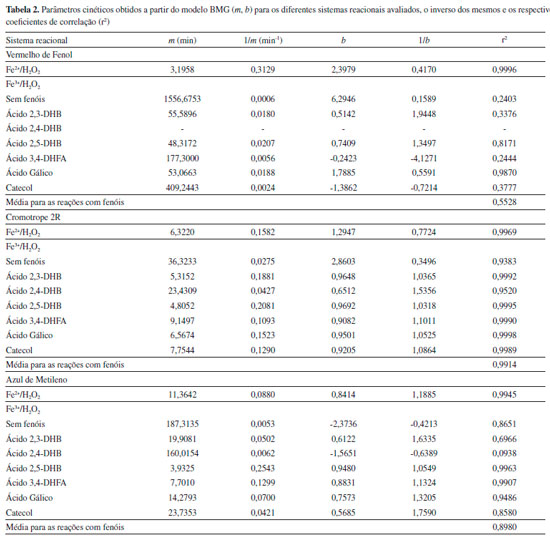
Para avaliar a descoloraçao dos corantes foram realizadas reaçoes em cubetas de quartzo de 3 mL contendo 450 µmol L-1 de H2O2, 1 mmol L-1 de H2SO4 (para ajustar o pH na faixa ideal entre 2,5 e 3,0 para evitar precipitaçao de ferro - medido com o auxílio de um pHmetro), 30 µmol L-1 de corante e 30 µmol L-1 de Fe(NO3)3 ou FeSO4 para iniciar os tratamentos baseados nas reaçoes tipo Fenton ou Fenton clássica, respectivamente. Quando realizados os experimentos na presença de mediadores fenólicos nas reaçoes tipo Fenton, soluçoes contendo os mesmos foram adicionadas ao meio reacional para uma concentraçao final de 10 µmol L-1. Nenhum dos reagentes foi adicionado ao longo do tempo reacional. O volume final para cada reaçao correspondeu a 2 mL. Leituras de absorbância foram realizadas no comprimento de onda máximo característico de cada corante (435, 513 e 665 nm, para o vermelho de fenol, cromotrope 2R e azul de metileno, respectivamente) por meio de um espectrofotômetro Libra S50 (Biochrom). A descoloraçao dos corantes foi monitorada após 5, 10, 20, 40 e 60 min. Preparou-se o branco isento de corantes e sais de ferro. Os ensaios foram realizados em duplicata, ao abrigo da luz e à temperatura ambiente. Mais detalhes das condiçoes experimentais estao reportados em Barreto et al.15 As porcentagens de descoloraçao dos corantes foram determinadas conforme Equaçao 7: 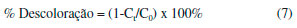 sendo C0 e Ct as concentraçoes inicial e no tempo t do corante, respectivamente. As concentraçoes residuais dos corantes foram determinadas com o auxílio de curvas de calibraçao preparadas na presença de 1 mmol L-1 de H2SO4, para evitar alteraçoes no comprimento de onda máximo de cada corante. Com o intuito de se avaliar a influência dos mediadores fenólicos nas reaçoes de descoloraçao, realizou-se um estudo cinético a partir dos modelos de 1ª e 2ª ordens conforme Equaçoes 8 e 9, respectivamente,19 além do modelo desenvolvido por Behnajady, Modirshahla e Ghanbary - modelo BMG,20 conforme Equaçao 10: 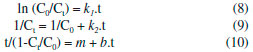 sendo k1 e k2 as constantes cinéticas obtidas para os modelos de 1ª e 2ª ordens. Os valores de tempo de meia vida (t1/2) também foram calculados para os dois modelos. A partir das duas constantes características do modelo BMG, m e b, pôde-se calcular seus inversos para estimar a velocidade inicial (1/m) e a capacidade oxidativa (1/b) das reaçoes, respectivamente.20 As unidades de todas as constantes estao descritas nas Tabelas 1 e 2, exceto b que é adimensional.
RESULTADOS E DISCUSSAO Curvas contendo alguns dos dados de descoloraçao sao mostradas nas Figuras 2 e 3 para os três diferentes modelos cinéticos testados. Baseado no modelo de 1ª ordem, a Figura 2a mostra os dados de descoloraçao do vermelho de fenol por reaçao tipo Fenton na ausência e na presença de três dos mediadores fenólicos avaliados. A presença desses mediadores aumentou a inclinaçao das curvas, indicando aumento nos valores de k1 e consequentemente na velocidade de descoloraçao. O ácido 2,5-DHB foi o mais efetivo em aumentar a inclinaçao, seguido pelo ácido 3,4-DHFA, enquanto o catecol foi o menos efetivo entre os três mediadores. Da mesma forma, a Figura 2b apresenta as curvas de descoloraçao do mesmo corante por Fe3+/H2O2 com base no modelo de 2ª ordem, para as reaçoes na ausência e na presença de três mediadores. Nesse caso, também sao observados aumentos na inclinaçao das curvas, ou seja, aumentos de k2, com destaque para os ácidos 2,3- e 2,5-DHBs, sendo que ambos apresentaram comportamentos bastante similares. O ácido gálico promoveu uma menor inclinaçao em comparaçao aos dois isômeros mencionados.
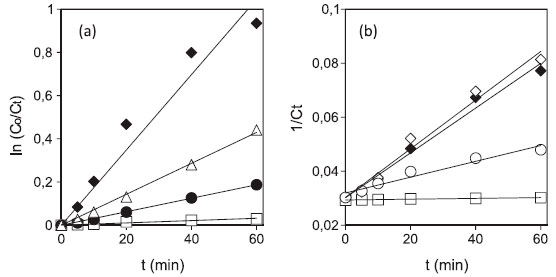 Figura 2. Curvas obtidas para a descoloraçao do corante vermelho de fenol a partir do modelo de 1a ordem (a) por: Fe3+/H2O2 (□), Fe3+/H2O2/catecol (•), Fe3+/H2O2/ácido 3,4-DHFA (Δ) e Fe3+/H2O2/ácido 2,5-DHB (♦) e; a partir do modelo de 2a ordem (b) por: Fe3+/H2O2 (□), Fe3+/H2O2/ácido gálico (○), Fe3+/ H2O2/ácido 2,5-DHB (♦) e Fe3+/H2O2/ácido 2,3-DHB (◊). [H2O2] = 450 μmol L-1; [corante] = 30 μmol L-1; [mediador fenólico] = 10 μmol L-1; pH = 2,5-3,0
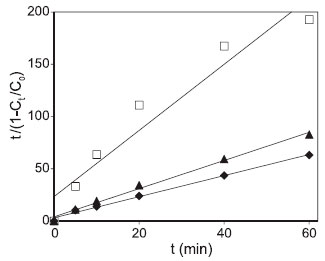 Figura 3. Curvas obtidas para o modelo BMG a partir de dados de descoloraçao do corante cromotrope 2R por: Fe3+/H2O2/ácido 2,5-DHB (♦), Fe2+/ H2O2 (▲) e Fe3+/H2O2 (□)
Os valores de k, r2 e t1/2 obtidos a partir dos modelos de 1ª e 2ªordens estao mostrados na Tabela 1 para os três corantes avaliados. Os valores médios de r2 foram calculados, pois eles podem indicar qual é o modelo cinético mais apropriado para um determinado conjunto de reaçoes.21,22 Para o corante vermelho de fenol, a reaçao Fe3+/H2O2 foi descrita pelos modelos de 1ª e 2ª ordens, enquanto o oposto foi observado para Fe2+/H2O2 (valores de r2 inferiores a 0,54). As reaçoes Fe3+/H2O2/mediadores fenólicos também foram bem descritas pelo modelo de 1ªordem, mas melhor descritas pelo de 2ª ordem baseado nos valores médios de r2. Os mediadores aceleraram a descoloraçao desse corante com base nos aumentos de k1 e k2. Como nao houve descoloraçao do vermelho de fenol por Fe3+/H2O2 na presença do ácido 2,4-DHB, nao foi possível fazer um estudo cinético dessa reaçao. Esse fenol é o único que nao possui propriedades redutoras dentre os seis estudados. Seus isômeros com propriedades redutoras, os ácidos 2,3- e 2,5-DHBs, foram os mais efetivos com base nos maiores valores de k1 , k2 e nas porcentagens de descoloraçao após 60 min. Para os valores de t1/2, verificou-se reduçao de 22 vezes nesse parâmetro para Fe2+/H2O2 em relaçao à reaçao Fe3+/H2O2. Esses resultados sao esperados, pois a reaçao de Fenton gera diretamente radicais HO• e em maior quantidade em comparaçao à reaçao tipo Fenton, a qual depende da reduçao lenta de Fe3+ por H2O2.4,5 A utilizaçao dos mediadores, exceto o ácido 2,4-DHB, reduziu cerca de 90% no t1/2 ao comparar com a reaçao na ausência deles (Fe3+/H2O2). Importante mencionar também que as reaçoes Fe3+/H2O2 na presença dos ácidos 2,3- e 2,5-DHBs podem ser bem mais efetivas que Fe2+/H2O2 para descolorir o vermelho de fenol, de acordo com os parâmetros cinéticos calculados. Considerando os dados de descoloraçao do corante cromotrope 2R, os modelos de 1ª e 2ª ordens apresentaram valores de r2 inferiores a 0,9 para Fe3+/H2O2, enquanto o de 2ª ordem foi adequado para Fe2+/H2O2. Os valores de k1 e k2 para Fe3+/H2O2/mediadores fenólicos foram superiores, inclusive ao comparar com a reaçao de Fenton clássica, e promoveram maior descoloraçao do corante. O ácido 2,5-DHB também foi o mais efetivo para descolorir esse corante, pois na presença dele foram observados maiores valores de k. Menores valores de t1/2 foram observados para Fe2+/H2O2 em relaçao ao Fe3+/H2O2 também para esse corante. Na presença de mediadores o t1/2 foi aproximadamente 9 vezes menor para o modelo de 1ª ordem e 43 vezes menor para o modelo de 2ª ordem em relaçao à reaçao sem mediadores. Ao comparar com a reaçao de Fenton clássica, as reaçoes Fe3+/H2O2/mediadores fenólicos também resultaram consideravelmente em menores t1/2, baseando-se nesses dois modelos cinéticos. A reaçao com o ácido 2,4-DHB permitiu aumentar os valores de k1 e k2, assim como diminuir o t1/2 somente para o corante cromotrope 2R. Por apresentar seus grupos hidroxila meta orientados (um grupo OH em relaçao ao outro no anel aromático), esse composto nao reduz Fe3+. Contrariamente, os outros mediadores possuem propriedades redutoras, pois seus grupos hidroxila estao orientados nas posiçoes orto ou para, podendo reduzir Fe3+ e serem oxidados em suas respectivas quinonas.23 Todavia, o ácido 2,4-DHB pode ser hidroxilado por radicais HO• durante os ensaios, sendo convertido em compostos para- ou orto-di-hidroxiaromáticos com propriedades redutoras.11,15 Em um estudo anterior, Chen et al. observaram que o ácido salicílico (2-hidroxibenzóico) apresentou propriedades pro-oxidantes ao ser hidroxilado durante a descoloraçao do corante verde de malaquita por Fe3+/H2O2.24 Para o azul de metileno, a reaçao Fe2+/H2O2 se adequou muito bem ao modelo de 1ª ordem, corroborando a literatura.25-27 Os sistemas reacionais Fe3+/H2O2/mediadores fenólicos redutores foram melhor descritos pelo modelo de 2ª ordem, enquanto o valor médio de r2 para 1ª ordem foi inferior a 0,9. Os valores de k1 e k2 tiveram incrementos na presença dos mediadores. O modelo de 2ª ordem nao foi apropriado para as reaçoes Fe3+/H2O2 e Fe3+/H2O2/ácido 2,4-DHB (r² inferior a 0,8). Nas reaçoes contendo os mediadores redutores, para ambos os modelos, os tempos de meia vida apresentaram valores próximos ao da reaçao Fe2+/H2O2. Os menores valores de t1/2 foram observados para as reaçoes contendo os ácidos 2,3- e 2,5-DHBs. A presença do ácido 2,4-DHB praticamente nao afetou de forma significativa os valores de k1, k2 e t1/2. Entretanto, a descoloraçao desse corante por todas as reaçoes atingiu valores superiores a 90%, inclusive na presença do ácido 2,4-DHB. Esses aspectos podem ser devido à alta suscetibilidade desse corante ao ataque por radicais HO•,7 dificultando a diferenciaçao das reaçoes em funçao da porcentagem de descoloraçao após 60 min. Porém, com base nesses dois modelos cinéticos, foi possível verificar de forma mais clara o efeito pro-oxidante de compostos redutores de Fe3+ na descoloraçao do azul de metileno. Quanto ao terceiro modelo avaliado no presente trabalho, BMG, sua sigla foi criada em funçao das iniciais dos três autores que o utilizaram pela primeira vez em reaçoes para descolorir um corante por reaçao de Fenton.20 A tangente da curva de decréscimo em um determinado tempo para o modelo BMG pode ser obtida ao derivar a Equaçao 10, resultando na Equaçao 11: 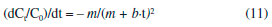 Dessa forma, quanto maior for 1/m (na condiçao em que t se aproxima de 0), mais rápida será a razao de decréscimo do corante. Sendo assim, 1/m indica a velocidade inicial de descoloraçao do corante. Quando o tempo for alto e tender ao infinito, o inverso de b (1/b) indica a fraçao máxima teórica de remoçao, a qual equivale à capacidade máxima de oxidaçao do sistema ao final da reaçao. A Figura 3 mostra as curvas obtidas a partir do modelo BMG para a descoloraçao do cromotrope 2R pelos sistemas Fe2+/H2O2, Fe3+/H2O2 e Fe3+/H2O2/ácido 2,5-DHB. A última reaçao apresentou maior capacidade oxidativa devido a menor inclinaçao da curva, demonstrando o efeito pro-oxidante do ácido 2,5-DHB. Também é possível observar uma menor inclinaçao da curva referente à reaçao Fe2+/H2O2 em relaçao à Fe3+/H2O2, pois a primeira gera radicais HO• diretamente. Os dados extraídos desse modelo, assim como os coeficientes de correlaçao das curvas que descrevem a cinética de cada reaçao estao mostrados na Tabela 2. Valores de r2 acima de 0,99 revelam que o modelo BMG representa bem os dados experimentais para os três corantes descoloridos por Fe2+/H2O2. Anteriormente, a descoloraçao de diferentes corantes do tipo azo por Fe2+/H2O2 também se adequou bem a esse modelo,20,22,28 além de corantes de outras classes como a rodamina B e o próprio azul de metileno.3 Para a descoloraçao do corante vermelho de fenol na presença dos sistemas reacionais com mediadores, somente a reaçao com o ácido gálico foi bem descrita pelo modelo BMG, sendo esse mais apropriado que os outros modelos convencionais para essa reaçao. Ao comparar as reaçoes Fe2+/H2O2 e Fe3+/H2O2/ácido gálico, a segunda apresentou maior capacidade oxidativa, mas menor velocidade inicial. Valores negativos de b foram observados para duas das reaçoes com mediadores, indicando a falta de ajuste desse modelo. Para Fe3+/H2O2, apenas a descoloraçao do cromotrope 2R foi descrita por esse modelo cinético (r2 maior que 0,9). Os inversos de m e b aumentaram na presença dos mediadores, ou seja, eles aumentaram a velocidade inicial de reaçao, assim como a capacidade oxidativa, respectivamente. Ao comparar com Fe2+/H2O2, os sistemas reacionais Fe3+/H2O2/mediadores ainda apresentaram maior capacidade oxidativa, enquanto a velocidade inicial foi maior apenas para as reaçoes na presença dos ácidos 2,3- ou 2,5-DHBs. Apesar de a reaçao com o ácido 2,4-DHB apresentar uma baixa velocidade inicial, foi observada uma alta capacidade oxidativa para a mesma para descolorir o cromotrope 2R. Para o azul de metileno, o modelo BMG foi o mais adequado para Fe2+/H2O2. Para as reaçoes que descoloriram menos o corante, Fe3+/H2O2 e Fe3+/H2O2/ácido 2,4-DHB, foram observados valores negativos de b, indicando a falta de ajuste desse modelo. Ao comparar os quatro sistemas reacionais com r2 maior que 0,94 para o modelo BMG, a velocidade inicial de descoloraçao foi maior para aqueles contendo mediadores. No entanto, ao contrário dos ácidos 2,5-DHB e 3,4-DHFA, a reaçao contendo o ácido gálico apresentou menor velocidade inicial ao comparar com a reaçao de Fenton clássica. O ácido gálico foi o único dos mediadores em que todas as reaçoes na sua presença se adequaram bem ao modelo BMG, inclusive para a descoloraçao do alaranjado de metila em um estudo previamente publicado.22 O azul de metileno é um dos corantes mais usados como alvo em estudos de degradaçao de poluentes orgânicos. Esse é o primeiro estudo que faz uma análise comparativa de modelos cinéticos para degradaçao oxidativa desse corante por sistemas Fenton. Apesar de vários trabalhos publicados usarem o modelo de 1ª ordem, o presente estudo observou que o modelo BMG foi o mais adequado para descolorir esse corante por reaçao de Fenton clássica (Fe2+/H2O2). Essa reaçao se adequou melhor também ao modelo BMG para os outros dois corantes. Com base nos modelos cinéticos de 1ª e 2ª ordens, os mediadores fenólicos aumentaram as constantes de velocidade de reaçao provavelmente ao promover a reduçao rápida e contínua de Fe3+ a Fe2+ para gerar mais radicais HO•.4 Os ácidos 2,3- e 2,5-DHBs foram os mais efetivos mediadores em descolorir esses corantes. O efeito pro-oxidante desses dois compostos foi mais evidente com o vermelho de fenol, pois esse corante foi o menos suscetível à descoloraçao. A reaçao Fe2+/H2O2 se adequou bem melhor ao modelo BMG para os três corantes, enquanto a descoloraçao do azul de metileno também se adequou muito bem ao modelo de 1ª ordem. Por outro lado, reaçoes na presença de mediadores se adequaram bem aos três modelos propostos, mas com exceçao do modelo BMG para a descoloraçao do vermelho de fenol (r2 médio bem inferior a 0,9). A adequaçao para mais de um modelo cinético também é comum na literatura. A Tabela 3 apresenta alguns modelos estudados para descoloraçao por sistemas Fenton dos mesmos corantes utilizados no presente estudo, além da descoloraçao de outros corantes por testar mais de um tipo de modelo cinético. Assim como há trabalhos que fizeram o uso apenas do modelo de 1ª ordem, a revisao de Nidheesh et al. destaca que esse é geralmente o escolhido.6 Entretanto, os coeficientes de correlaçao das curvas que descrevem a cinética de algumas reaçoes contendo mediadores para esse modelo sao inferiores a 0,9.13,14,18 Ao analisar três modelos na descoloraçao de alaranjado de metila por Fe2+/H2O2, Youssef et al. verificaram que nenhum deles apresentou um coeficiente de correlaçao superior a 0,9.29 É importante que seja feita uma análise baseada em diferentes modelos para a determinaçao dos parâmetros cinéticos, com vistas à obtençao da configuraçao mais adequada de um reator para degradaçao de um determinado poluente orgânico por sistemas Fenton. Adicionalmente, vale destacar os dados apresentados pelo grupo de Xu et al. ao estudar diferentes dosagens de reagentes, catalisadores e corantes.30-32 Eles observaram que o modelo cinético mais adequado pode variar de um sistema reacional para o outro, assim como foi verificado nos resultados do presente estudo.
Apesar de o presente trabalho avaliar o efeito de mediadores fenólicos com propriedades redutoras (exceto o ácido 2,4-DHB), os corantes e outros poluentes orgânicos utilizados como alvos podem ser convertidos por radicais HO• em intermediários redutores ao longo do tempo reacional, independente da adiçao de fenóis. A degradaçao de fenol, 4-clorofenol e 4-nitrofenol por Fe3+/H2O2 foi acompanhada pela geraçao de intermediários di-hidroxilados redutores.36 Por outro lado, em um estudo recente envolvendo diferentes sistemas Fenton, a degradaçao de fenol foi incrementada com a adiçao de catecol e hidroquinona (1,4-di-hidroxibenzeno), mesmo esses dois tendo sido gerados a partir da hidroxilaçao da molécula alvo durante as reaçoes.17 Por ser um corante muito estudado, produtos de degradaçao por radicais HO• do azul de metileno sao frequentemente reportados,26,37 os quais podem apresentar propriedades redutoras. Embora ele nao possua nenhum grupo OH fenólico, em um estudo anterior do nosso grupo, a presença do azul de metileno aumentou a descoloraçao do azocorante Pardo Bismarck Y.11 Sugeriu-se que o azul de metileno possa ter sido convertido em intermediários fenólicos redutores. Para os outros corantes, essa observaçao também pode ser válida. Com exceçao do ácido 2,4-DHB, o qual foi o menos efetivo mediador por nao possuir propriedades redutoras, nao foi possível correlacionar a estrutura química dos outros fenóis com suas propriedades pro-oxidantes. Por exemplo, as reaçoes na presença dos compostos redutores contendo grupo carboxila apresentaram maiores valores de k em comparaçao ao catecol para descolorir o vermelho de fenol. No entanto, o catecol foi um dos mais efetivos mediadores para descolorir os outros dois corantes. Mesmo o ácido gálico possuindo três hidroxilas fenólicas vicinais, grupo funcional envolvido na reduçao de Fe3+,4 os ácidos 2,3- e 2,5-DHBs foram os mais efetivos. É muito importante mencionar que a adiçao de mediadores fenólicos em sistemas Fenton nao é algo simples para o tratamento de efluentes reais, pois o custo desses compostos tornaria esse propósito inviável. Uma alternativa promissora para obtê-los seria utilizar soluçoes contendo-os e que sejam de fácil disponibilidade. Extratos aquosos de madeira,38 assim como um efluente real contendo compostos similares,10 incrementaram a degradaçao de diferentes poluentes orgânicos em sistemas Fenton. Além disso, a toxicidade e a biodegradabilidade desses compostos devem também ser consideradas, caso o efluente tratado seja disposto em corpos receptores e que ainda contenha parte desses fenóis que foram adicionados. Nesse sentido, cabe mencionar que ao reagir com Fe3+, eles sao degradados e até mesmo mineralizados,23 sendo isso algo desejável para aplicaçao real.
CONCLUSOES Ao comparar os presentes resultados com vários estudos da literatura, o modelo cinético BMG é o que melhor descreve a reaçao de Fenton clássica para descolorir corantes de diferentes classes. Por outro lado, as reaçoes contendo Fe3+ se adequaram melhor ao modelo de 2ª ordem de forma geral, sendo que na presença dos mediadores fenólicos foram observados incrementos nos valores de k2 e como consequência a diminuiçao nos valores de t1/2. Esses aspectos demonstram que os mediadores aceleraram as reaçoes de descoloraçao dos três corantes estudados, com exceçao do único mediador nao redutor, o ácido 2,4-DHB. Esse último apenas apresentou propriedades pro-oxidantes na descoloraçao do cromotrope 2R. Ainda com base no modelo BMG, a presença dos mediadores fenólicos permitiu incrementos na capacidade oxidativa, assim como na velocidade inicial de descoloraçao, principalmente para o cromotrope 2R, corante cuja descoloraçao foi a que melhor se ajustou a esse modelo, independente do estado inicial de oxidaçao do ferro nos ensaios. Com isso, os três modelos cinéticos permitiram verificar propriedades pro-oxidantes dos mediadores fenólicos. Pode-se corroborar com a literatura que a descoloraçao oxidativa de corantes por sistemas Fenton pode ser representada por diferentes modelos, sendo influenciada pelo tipo de catalisador, presença ou nao de mediador fenólico, assim como da estrutura química do corante alvo.
AGRADECIMENTOS Os autores agradecem à FAPEMIG (processos APQ-01585-11 e APQ-01898-17) e ao CNPq pelos auxílios financeiros.
REFERENCIAS 1. Souza, C. R. L.; Peralta-Zamora, P.; Quim. Nova 2005, 28, 226. 2. Oliveira, L. C. A.; Fabris, J. D.; Pereira, M. C.; Quim. Nova 2013, 36, 123. 3. Paulino, T. R. S.; Araújo, R. S.; Salgado, B. C. B.; Eng. Sanit. Ambient. 2015, 20, 347. 4. Aguiar, A.; Ferraz, A.; Contreras, D.; Rodríguez, J.; Quim. Nova 2007, 30, 623. 5. Nogueira, R. F. P.; Trovó, A. G.; Silva, M. R. A. D.; Villa, R. D.; Oliveira, M. C. D.; Quim. Nova 2007, 30, 400. 6. Nidheesh, P. V.; Gandhimathi, R.; Ramesh, S. T.; Environ. Sci. Pollut. Res. 2013, 20, 2099. 7. Santana, C. S.; Aguiar, A.; Water Air Soil Pollut. 2016, 227, 48. 8. Souza, J. L., Aguiar, A.; Rev. Virtual Quim. 2017, 9, 1525. 9. Santana, C. S.; Aguiar, A.; Int. Biodet. Biodegr. 2015, 104, 1. 10. Papoutsakis, S.; Pulgarin, C.; Oller, I.; Sánchez-Moreno, R.; Malato, S.; Chem. Eng. J. 2016, 304, 890. 11. Sousa, J. L.; Aguiar, A.; Environ. Sci. Pollut. Res. 2017, 24, 26734. 12. Christoforidis, K. C.; Vasiliadou, I. A; Louloudi, M.; Deligiannakis, Y.; J. Chem. Technol. Biotechnol. 2018, 93, 1601. 13. Hou, X.; Huang, X.; Ai, Z.; Zhao, J.; Zhang, L.; J. Hazard. Mater. 2016, 310, 170. 14. Li, T.; Zhao, Z.; Wang, Q.; Xie, P.; Ma, J.; Water Res. 2016, 105, 479. 15. Barreto, F.; Santana, C. S.; Aguiar, A.; Desalin. Water Treat. 2016, 57, 431. 16. Friedrich, L. C.; Zanta, C. L. P. S.; Machulek Jr, A.; Quina, F. H.; Quim. Nova 2017, 40, 769. 17. Silva, B. C.; Nogueira, R. F. P.; J. Braz. Chem. Soc. 2016, 27, 1195. 18. Subramanian, G.; Madras, G.; Chem. Commun. 2017, 53, 1136. 19. Levenspiel, O.; Engenharia das Reaçoes Químicas, Edgard Blücher: Sao Paulo, 2000. 20. Behnajady, M. A.; Modirshahla, N.; Ghanbary, F.; J. Hazard. Mater. 2007, 148, 98. 21. Emami, F.; Tehrani-Bagha, A. R.; Gharanjig, K.; Menger, F.M.; Desalination 2010, 257, 124. 22. Santana, C. S.; Velloso, C. C. V.; Aguiar, A.; XXII Congresso Brasileiro de Engenharia Química, Sao Paulo, Brasil, 2018. 23. Pracht, J.; Boenigk, J.; Isenbeck-Schoter, M.; Keppler, F.; Scholer, H. F.; Chemosphere 2001, 44, 613. 24. Chen, F.; Ma, W. H.; He, J. J.; Zhao, J. C.; J. Phys. Chem. A 2002, 106, 9485. 25. Melgoza, D.; Hernandez-Ramirez, A.; Peralta-Hernandez, J. M.; Photochem. Photobiol. Sci. 2009, 8, 596. 26. Wang, Q.; Tian, S.; Ning, P.; Ind. Eng. Chem. Res. 2014, 53, 643. 27. Gao, M.; Zhang, D.; Li, W.; Chang, J.; Lin, Q.; Xu, D.; Ma, H.; J Taiwan Inst. Chem. Eng. 2016, 67, 355. 28. Ertugay N.; Acar, F. N.; Arabian J. Chem. 2013, 10, S1158. 29. Youssef, N. A.; Shaban, S. A.; Ibrahim, F. A.; Mahmoud, A. S.; Egypt. J. Pet. 2016, 25, 317. 30. Xu, H. Y.; Liu, W. C.; Qi, S. Y.; Li, Y.; Zhao, Y.; Li, J. W.; J. Serb. Chem. Soc. 2014, 79, 361. 31. Xu, H. Y.; Shi, T. N.; Wu, L. C.; Qi, S. Y.; Water Air Soil Pollut. 2013, 224, 1740. 32. Xu, H. Y.; Wang, Y.; Shi, T. N.; Zhao, H.; Tan, Q.; Zhao, B. C.; He, X. L.; Qi, S. Y.; Front. Mater. Sci. 2018, 12, 34. 33. Almeida, L. C.; Garcia-Segura, S.; Arias, C.; Bocchi, N.; Brillas, E.; Chemosphere 2012, 89, 751. 34. Almeida, L. C.; Silva, B. F.; Zanoni, M. V. B.; J. Eletroanal. Chem. 2014, 734, 43. 35. Ou, X.; Wang, C.; Zhang, F.; Sun, H.; Wuyunna; Desalin. Water Treat. 2013, 51, 2536. 36. Du, Y.; Zhou, M.; Lei, L.; J. Hazard Mater. 2006, B136, 859. 37. Oliveira, L. C. A.; Gonçalves, M.; Guerreiro, M. C.; Ramalho, T. C.; Fabris, J. D.; Pereira, M. C.; Sapag, K.; Appl. Catal. A Gen. 2007, 316, 117. 38. Aguiar, A.; Ferraz, A.; Int. Biodet. Biodegr. 2012, 74, 61. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access