Educação
|
|
| La periodicidad de los elementos y el desempeño de los materiales: un complemento para la comprensión de la tabla periódica The periodicity of chemical elements and the materials performance: a complement for the comprehension of the periodic table |
|
Virginia E. Noval; José G. Carriazo*
Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia, Ciudad Universitaria, carrera 30 No. 45-03, Bogotá, Colombia Recebido em: 17/09/2018 *e-mail: jcarriazog@unal.edu.co The United Nations (UN) has proclaimed 2019 as the International Year of the Periodic Table of Chemical Elements (IYPT 2019). For that reason, it is considered pertinent to highlight the importance of the periodic system in the scientific and technological development of the chemistry; therefore, a discussion of some applications of the periodicity of the elements for designing new materials is carried out. In this work, some periodic trends of both molecules and complex structures of materials are discussed, by selecting different cases of the chemical periodicity applied to improve and design steels with higher wear resistance, prepare refractory materials and synthesize chalcogenides glasses, among others. Finally, the proposed subjects and the regularities argued in this work are considered complementary contexts of exceptional interest to motivate the meaningful learning of the periodic table taking into account the current scientific and technological researches. INTRODUCCION El año 2019 fue proclamado por la Organización de las Naciones Unidas (ONU) como "año internacional de la tabla periódica".1 A lo largo de la historia, la tabla periódica ha sido una herramienta ampliamente utilizada en el contexto científico, especialmente en los campos de la química y la física, en donde actualmente se enfrentan desafíos globales relacionados con salud, ciencia e ingeniería de materiales, agricultura, industria y desarrollo energético y ambiental sostenibles. Desde sus inicios, el desarrollo de la tabla periódica motivó el trabajo de científicos para esclarecer la estructura interna de los átomos y encontrar la base de la periodicidad química.2 Muchas investigaciones, como el descubrimiento de los rayos X, del electrón y la naturaleza eléctrica de la materia, de la radiactividad, los conceptos de número atómico, el modelo nuclear del átomo y las contribuciones cuánticas de principios del siglo XX, han permitido conocer a fondo los fundamentos para la organización de la tabla periódica, dando lugar a predicciones lógicas de las variaciones en las propiedades de los elementos químicos.3 De esta manera, la concepción moderna de la ley periódica, cuyas bases fueron elucidadas por Henry Moseley en 1913, permite abordar la interpretación apropiada y el uso de la tabla periódica, siendo ésta una herramienta esencial en todos los niveles de educación en química. Sin embargo, entender las regularidades del sistema periódico implica la comprensión de una gran variedad de conceptos que explican las características físicas, la reactividad y en general el desempeño fisicoquímico de los elementos, facilitando la aplicación de éstos a nivel tecnológico y científico en el diseño de nuevos materiales (química de materiales). En la última década se han desarrollado varias propuestas didácticas y pedagógicas relacionadas con la enseñanza de la tabla periódica.3-8 De igual manera, a lo largo de los siglos XX y XXI se han publicado muchos trabajos sobre la historia del sistema periódico, con diversos enfoques filosóficos, históricos, epistemológicos y científicos.9-12 En este panorama, se evidencia de forma marcada el desarrollo del concepto de periodicidad química para explicar la organización de los elementos de acuerdo con la ley periódica. Este enfoque es comúnmente abordado en las aulas de clase y en un gran número de textos de educación básica y universitaria; sin embargo, es pertinente mencionar y discutir los alcances de la periodicidad química más allá del contexto de elementos químicos, es decir, a nivel molecular y en general de los materiales. En las últimas décadas, la evaluación de la periodicidad química a nivel molecular, explicada a partir de la periodicidad de los elementos ha cobrado importancia. Por ejemplo, Kong13 propuso una tabla periódica de moléculas diatómicas basadas en tendencias periódicas evidenciadas a nivel molecular; mientras que Barrow et al.14 evaluaron tendencias periódicas en moléculas triatómicas, útiles en la caracterización de nuevas especies químicas. De otro lado, también se ha analizado la formación de vidrios,15 la optimización de materiales refractarios y la resistencia al desgaste de materiales policristalinos y del acero,16-18 teniendo en cuenta aspectos generales de la ley periódica. En este sentido, en el año internacional de la tabla periódica es pertinente resaltar su importancia en el desarrollo de la química, discutiendo los alcances, interpretaciones y aplicaciones del sistema periódico en el diseño de nuevos materiales. La Ciencia de Materiales es un campo interdisciplinario relativamente nuevo, que ofrece diferentes perspectivas de aplicación de la química y que en los últimos años se ha vinculado al currículo de numerosos programas de ciencia y de ingeniería.19 El objetivo del presente trabajo es discutir brevemente algunos estudios que explican la incidencia de la periodicidad de los elementos químicos en el desempeño de materiales de interés, para trasladar estas temáticas a las aulas de clase como complemento a la enseñanza de conceptos relacionados con la tabla periódica.
ASPECTOS HISTORICOS DE LA PERIODICIDAD QUIMICA A nivel teórico y práctico, la tabla periódica puede ser el ejemplo más exitoso de investigación en la historia de la ciencia;20 su organización se fundamenta en la Ley Periódica, cuya reformulación ha ido de la mano con el desarrollo de la química y de la física. Las primeras evidencias de la periodicidad química se remontan a la primera mitad del siglo XIX y se atribuyen a Johann Wolfgang Döbereiner, Alexandre Beguyer de Chancourtois y John Newlands al explicar tendencias en los elementos mediante las triadas,10,21 el tornillo telúrico y la llamada ley de octavas,9,12,22 respectivamente. No obstante, las contribuciones más destacadas relacionadas con la periodicidad química se atribuyen a Lothar Meyer y Dimitri Mendeleev. En su trabajo, Meyer evidenció tendencias periódicas al representar el volumen atómico como una función del peso atómico. Por otro lado, con el fin de obtener una clasificación, Mendeleev utilizó los pesos atómicos como fundamento para organizar los elementos químicos en una tabla. De esta manera, ciertos patrones en las propiedades físicas y químicas de varias familias de elementos ligeros se hicieron evidentes,23 dando paso al establecimiento de la ley periódica (antigua) entendida como "las propiedades de los elementos químicos son una función periódica de sus pesos atómicos". Con este trabajo, Mendeleev obtuvo mayor aceptación científica (en comparación con los otros contribuyentes), al predecir audazmente la existencia de elementos cuyas propiedades dedujo de su posición en la tabla. Sin embargo, a principios del siglo XX los trabajos de H. G. Moseley permiten establecer claramente la ley periódica actual en función de los números atómicos,24 sobre la cual diversas contribuciones, como las de Van den Broek, Bohr, Pauli, Madelung y Klechkovskii, cuyas definiciones son discutidas por Imyanitov,25 complementan y consolidan el alcance moderno de la periodicidad química. Con ello se describe la periodicidad de los elementos y sus compuestos, como una consecuencia de la configuración electrónica de los átomos, es decir, del llenado de orbitales atómicos.26 Al interior del sistema periódico existen criterios complejos de organización y otras tendencias relacionadas con los efectos diagonales, la periodicidad secundaria, la relación de movimiento del caballo y las anomalías de primer miembro,27 las cuales deben ser abordadas a profundidad en contextos académicos universitarios para entender de mejor manera la utilidad de la tabla periódica en la compresión de la reactividad de las sustancias y la síntesis de nuevos materiales. Vale la pena resaltar la sugerencia de Imyanitov25 para interpretar la periodicidad de los elementos, esquematizada en la Figura 1: "Se observan regularidades periódicas claras al considerar las propiedades de los elementos y sus compuestos en bloques separados y dependiendo del número total de electrones s en átomos del bloque s, electrones p en átomos el bloque p, electrones d en el bloque d y electrones f en el bloque f".
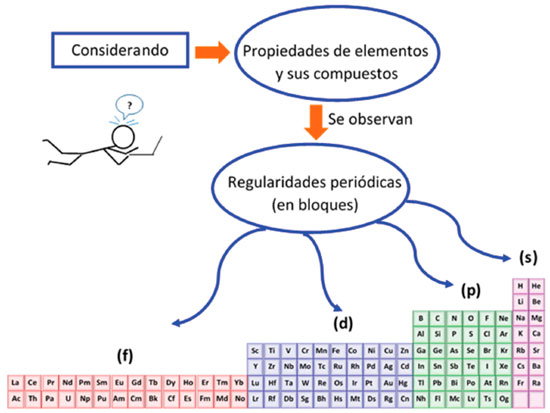 Figura 1. Esquema de la periodicidad de los elementos y sus compuestos, interpretada en bloques separados.8,25
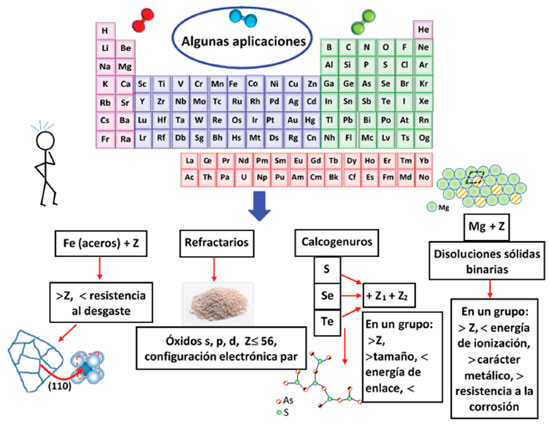
DE LA PERIODICIDAD DE LOS ELEMENTOS A LA PERIODICIDAD DE LOS MATERIALES Las propiedades de compuestos y de materiales dependen de los elementos que los componen. Esta tendencia se explica por el comportamiento electrónico de los átomos, que según lo descrito anteriormente, establece los fundamentos de la ley periódica. El enfoque desarrollado a continuación describe cómo las características particulares de ciertos materiales se asocian a aspectos generales del comportamiento periódico de los elementos constituyentes. Un estudio profundo de la periodicidad molecular, planteado por Kong,13 establece criterios para la estructuración de una tabla periódica de moléculas diatómicas, clasificadas según su configuración electrónica. El enfoque propuesto por dicho autor, se fundamenta en la teoría de orbitales moleculares y se aplica a moléculas covalentes de manera exclusiva, no para especies iónicas o cristales. En concordancia con los parámetros de organización de dicha tabla, las estructuras electrónicas y propiedades de las moléculas diatómicas son funciones periódicas del número molecular N, donde N es un número natural que indica la posición de la molécula en la tabla. De igual manera, algunas propiedades (como la energía de disociación, fuerza de enlace, primera energía de ionización, la multiplicidad del estado fundamental, los orbitales frontera, entre otras) relacionadas con los electrones de valencia de estas moléculas varían periódicamente con el número molecular N. Otras evidencias establecen que, las propiedades periódicas moleculares no sólo dependen del número de electrones de valencia, sino también del tamaño molecular, definido a groso modo como la suma de los períodos (en la tabla periódica de elementos) en los cuales se ubican los átomos constituyentes de la molécula.28 En este sentido, Kong y Wu28 y Barrow et al.14 han desarrollado estudios complementarios en esta área, ampliando la descripción computacional de más tendencias periódicas en moléculas triatómicas, cuyos trabajos apuntan a la identificación y caracterización de clusters, nanopartículas y especies químicas desconocidas, que puedan explicar la naturaleza del cosmos.14,28 En las últimas décadas se ha evidenciado la discusión de algunas tendencias periódicas en materiales sólidos, con el objetivo de optimizar el desempeño de los materiales, mediante su modificación a nivel estructural. En la Figura 2 se representan esquemáticamente las aplicaciones de estas tendencias, discutidas a continuación. Por ejemplo, la resistencia al desgaste en el acero fue analizada mediante la compatibilidad de algunos elementos químicos (desde Hidrogeno, Z=1, hasta kriptón, Z=36) en sus límites de grano (evaluados en la superficie (110) de una red cubica centrada en el cuerpo, típica del acero a temperatura ambiente).18 Para ello, se determinó teóricamente las energías de enlace (compatibilidad) entre los elementos evaluados y el hierro. Los resultados confirmaron que la disminución de la energía de enlace a lo largo de los grupos en la tabla periódica, es decir con el aumento del número atómico de los elementos evaluados, ocasiona una disminución en la fuerza de unión de los granos y por tanto la reducción de la resistencia al desgaste en el acero. Estudios complementarios, desarrollados por Migal et al.29 amplían el enfoque químico-cuántico de las interacciones atómicas en los límites de grano con más elementos (hasta el período cinco, desde hidrógeno Z=1 hasta xenón Z=54), encontrando nuevamente que la energía de enlace entre el hierro y estos elementos depende de los números atómicos. La disminución en la resistencia mecánica del acero se debe a la presencia de ciertos átomos en los límites de grano, cuya energía de enlace con el hierro es mucho más baja que la energía de unión Fe-Fe. Si esos átomos se depositan en el área de contacto de dos granos en la capa superficial, su débil enlace con el hierro es el factor esencial que afecta la resistencia al desgaste de la superficie.29
Otros cálculos sobre procesos de fortalecimiento de los límites de grano se comparan con datos experimentales conocidos y se confirman con investigaciones realizadas utilizando las técnicas espectroscópicas de Auger y XPS.17 De esta manera, la compatibilidad de algunos elementos con el hierro (en los límites de grano) y su influencia en el endurecimiento (o ablandamiento) del acero, se relaciona con la ley periódica. Esta dependencia puede ser la base teórica para predecir propiedades de resistencia al desgaste en materiales policristalinos basados en diversas aleaciones de elementos. Por otra parte, con respecto a la optimización de materiales refractarios, Khoroshavin y Shcherbatskii16 describen tratamientos para la producción de estos materiales basados en la "tecnología refractaria electrónica", cuyos conceptos básicos, de acuerdo a sus descripciones, se establecen en la "ley fundamental de la ciencia de los materiales", la ley periódica.16 Esta tecnología se centra en el control de electrones (control de las capas electrónicas en los materiales de partida), durante procesos electroquímicos, termoquímicos y electrotermoquímicos para modificar las propiedades de elementos y compuestos que conforman los materiales refractarios, con el fin de proporcionar mayor resistencia al desgaste durante su vida útil. Varias tendencias, basadas en la ley periódica, son evidenciadas y discutidas en detalle por dichos autores en el contexto de esta tecnología. Por ejemplo, se ha identificado que cerámicos refractarios de alta resistencia al desgaste se preparan mejor utilizando óxidos de elementos pares (configuración electrónica externa finalizada en número par), mientras que los óxidos de elementos impares (configuración electrónica externa finalizada en número impar) se usan mejor como aditivos. De igual manera, los óxidos de elementos s, p y d, hasta el elemento bario (Z= 56), son los más adecuados para producir materiales refractarios.16 De otro lado, los vidrios calcogenuros son sistemas binarios o ternarios amorfos de aleaciones de calcógenos con otros elementos. Como materiales funcionales tienen aplicaciones tecnológicas en imágenes térmicas, visión nocturna, sistemas de liberación de energía láser, detección química, óptica no lineal y microscopía de campo cercano.30 Minaev y Timoshenkov15 describen en detalle cómo la síntesis de estos vidrios calcogenuros se ve influenciada por la periodicidad química e identifican que estos sistemas (aleaciones amorfas) de calcogenuros binarios o ternarios, en general, pueden formarse con todos los elementos de la tabla periódica, excluyendo aquellos pertenecientes a los grupos 2 y 18 y a los períodos primero y séptimo (con algunas excepciones para los sistemas ternarios). En términos de periodicidad, se ha evidenciado claramente que la capacidad de los elementos de los grupos 13, 14, 15 y 16 para formar vidrios calcogenuros (binarios o ternarios) disminuye con el aumento del número atómico a lo largo de dichos grupos, lo que se explica con el incremento del carácter metálico del segundo o tercer elemento incorporado en la aleación y con la consecuente disminución de la energía del enlace químico formado.15 También se ha observado la inversión de dicha tendencia para el caso individual de algunos elementos, lo cual se considera como una manifestación de la periodicidad secundaria en la tabla periódica. Lo anterior es fundamental para el diseño de nuevos materiales amorfos calcogenuros con propiedades físico-químicas mejoradas, que optimicen su desempeño y potencialicen sus aplicaciones. Otro caso importante de la influencia de la periodicidad de los elementos en las propiedades de los materiales lo constituyen los sistemas binarios metálicos (disoluciones sólidas) de magnesio con diferentes elementos de la tabla periódica.31 Dichas aleaciones son de baja densidad y potencial aplicación en la industria aeroespacial. La resistencia a la corrosión de estas aleaciones de magnesio varía regularmente según la posición, en la tabla periódica, del elemento adicionado (aleante), mostrando mayor resistencia a la corrosión con el aumento en el número atómico, la electropositividad (carácter metálico) y solubilidad del elemento adicionado (soluto). Esta tendencia es el resultado de factores electroquímicos, de volumen (tamaño) y de valencia causados con la incorporación del elemento disuelto y permite la predicción de nuevas aleaciones de magnesio con desempeños superiores.31 Evidentemente, la capacidad para formar dichas disoluciones y los efectos mencionados están estrechamente relacionados con las reglas de Hume-Rothery.32 Estas reglas, en general, permiten predecir de manera cualitativa los niveles de solubilidad (substitucional) de elementos tanto en la formación de aleaciones como en la formación de otras estructuras cristalinas como óxidos, sales y demás redes complejas substituidas. Según las reglas de Hume-Rhothery, la diferencia entre los radios de los átomos (o iones) del disolvente (o estructura matriz) y los átomos (o iones) del soluto debe ser menor al 15% para que se favorezca la formación de la solución sólida, es decir para que ocurra la substitución isomórfica. En la medida en que dicha diferencia es menor, la solubilidad tiende a ser máxima. Como reglas adicionales, la electronegatividad y el número de oxidación del soluto deben ser similares a los del disolvente, lo cual favorece la substitución. La similitud entre las estructuras cristalinas del soluto y del disolvente también favorece la formación de la solución sólida substitucional. Si la diferencia de electronegatividades es considerable, entonces las especies involucradas tienden a formar un compuesto y no una solución sólida; y si existe demasiada diferencia entre los números de oxidación, entonces se genera un desbalance electrostático que llega a ocasionar un número elevado de defectos cristalinos (como por ejemplo vacantes, lo cual implica valencias insaturadas en el disolvente) que compromete la estabilidad de la disolución sólida. La regla principal, relativa a la diferencia de tamaños entre el soluto y el disolvente, proviene del hecho de que si dicha diferencia es mayor al 15% entonces la distorsión de la red cristalina es muy alta, lo que hace inestable la estructura cristalina y poco probable la formación de la substitución isomórfica. De acuerdo a los resultados hallados por Mukhina,31 la resistencia a la corrosión de las aleaciones de magnesio se ve mejorada con la adición de elementos como Zr, Mn, Ti, Cd, Nd, Sn, Pb, Ga y Sm en cantidades de 0.5 - 5.0% (p/p), mientras que la adición de Cu, Ag, Si, Bi y Sb en el mismo intervalo de concentración ocasiona la disminución de la resistencia a la corrosión de dichas aleaciones. Otras evidencias relacionadas con la periodicidad de materiales que involucran la incorporación de ligantes y la formación de compuestos de coordinación, se asocian con la variación periódica de algunas propiedades de cationes. Los trabajos de Imyanitov33 muestran algunas tendencias periódicas en cationes divalentes y permiten proponer un esquema de tabla periódica de dichos cationes. Este autor establece que, la energía de ionización de estas especies depende del número total de electrones p en el bloque p, electrones d en el bloque d y electrones f en el bloque f, lo cual tiene influencia en las propiedades de sustituyentes y compuestos de cationes divalentes. Vale la pena resaltar que los complejos de cationes divalentes del bloque d son parte esencial en la química de coordinación. De esta manera, algunos materiales cuyas unidades son compuestos de coordinación presentan tendencias específicas dependiendo del tipo de centro metálico y de la posición de éste en la tabla periódica. Algunos ejemplos son, 1) la tendencia periódica encontrada en los cationes de Ni, Co, Fe (primera serie de transición) mediante el alargamiento del enlace metal-carbono y la reducción del enlace metal-oxígeno (desde Ni a Fe) formados entre el catión metálico y el grupo carbonilo (C=O) de la fracción cetónica del ligante 2,2'-bis(difenilfosfino)-benzofenona.34 Dicha tendencia es consecuencia de las diferencias de electronegatividad entre los metales mencionados y sus variaciones en la densidad electrónica, ya que el grupo C=O actúa como un ligante aceptor ϖ estabilizando los números de oxidación más bajos en los cationes. 2) Los cambios en la polaridad y la fuerza del enlace donante-aceptor entre los dos metales M1 y M2, en compuestos organometálicos dinucleares del tipo CpM1-M2Cl3 (M1, M2 = B, Al, Ga, In; Cp = η5-C5H5), en los cuales dichos cambios son dependientes del tamaño atómico de M1 y M2.35 Para compuestos homonucleares de este tipo, la polaridad de dicho enlace M-M se incrementa con el aumento de número atómico de metal M, es decir al bajar en el grupo 13 (B, Al, Ga, In) de la tabla periódica. En los compuestos heteronucleares de este tipo, la polaridad del enlace M1-M2 (manteniendo fijo el átomo M1) también se incrementa con el aumento en tamaño atómico del metal M2 (B, Al, Ga, In).35 Las tendencias observadas en los materiales descritos en los casos 1 y 2 se relejan en sus aplicaciones como catalizadores de metales de transición, en donde su desempeño catalítico sobre sustratos específicos es fuertemente influenciado por el comportamiento periódico de los metales o cationes metálicos involucrados. Con las descripciones anteriores, se contextualiza brevemente la relación existente entre la estructura electrónica de los elementos y las propiedades de diferentes materiales. Se considera importante describir este panorama en los entornos educativos pertinentes, con la finalidad de articular los conceptos propios de la periodicidad química con sus aplicaciones y la manera en que éstas contribuyen en la optimización de procesos tecnológicos e industriales, como se indicó en la presente discusión. Estas contribuciones científicas claramente revelan tendencias periódicas a nivel de varios tipos de materiales y la forma en que dichas tendencias se ven influenciadas por la organización electrónica de los átomos en la tabla periódica (posición en los bloques s, p, d, o f), es decir, por la ley periódica. Desde el punto de vista pedagógico, la inclusión de este tipo de casos permite la consolidación de un enfoque de aprendizaje particularmente significativo y basado en CTS (Ciencia, Tecnología y Sociedad) íntimamente integrado con la Ciencia de Materiales,19,36 en donde se discutan y se apliquen los conceptos de periodicidad química más allá de las propiedades individuales de los elementos. De esta manera, la discusión del desempeño de algunos materiales en función de la periodicidad de los elementos que los componen, constituye un enfoque complementario muy atractivo para la enseñanza de la tabla periódica. A nivel universitario, es imprescindible incluirlo en la red de conceptos (composición, estructura, propiedades, desempeño, síntesis y procesamiento de los materiales) que conforman el currículo de las asignaturas Ciencia de Materiales o Química de Materiales, de tal manera que los contenidos se fortalezcan y provean significado científico y tecnológico a los estudiantes, como lo explican Carriazo et al.19
CONCLUSION La periodicidad química constituye un eje temático fundamental en la modificación de estructuras sólidas y en el diseño de nuevos materiales con propiedades mejoradas y desempeño optimizado. Las regularidades periódicas observadas en materiales de interés y discutidas en el presente trabajo son consecuencia de la periodicidad individual de los elementos químicos (electronegatividad, carácter metálico, tamaño atómico, configuración electrónica, etc.), cuya interacción modifica las propiedades finales de enlace, las propiedades oxidorreductivas y en general de la estructura del material, y en consecuencia su desempeño en determinadas funciones. Se destaca la periodicidad en materiales como complemento en la comprensión de la tabla periódica y se considera pertinente abordar los núcleos temáticos relacionados con la periodicidad molecular y su influencia en la formación de clusters y nanopartículas, la influencia de la variación del número atómico de elementos adicionados en los límites de granos de los aceros (por ejemplo, resistencia al desgaste y resistencia mecánica), el efecto de la periodicidad en materiales refractarios (tecnología refractaria electrónica), en la formación de vidrios calcogenuros, en la preparación de aleaciones binarias de magnesio resistentes a la corrosión y en algunos materiales basados en compuestos de coordinación. En todos los casos es recomendable resaltar las diferentes aplicaciones que motivan las investigaciones sobre periodicidad en materiales.
AGRADECIMIENTOS Los autores ofrecen sus agradecimientos a la Universidad Nacional de Colombia, sede Bogotá, por el apoyo logístico durante la elaboración de este trabajo.
REFERENCIAS 1. IUPAC: The United Nations proclaims the international year of the periodic table of chemical elements, press release 20 December 2017, disponible en https://iupac.org/united-nations-proclaims-international-year-periodic-table-chemical-elements/, acedido em diciembre 2018. 2. Linares, R.; Izquierdo, M.; Tecné, Episteme y Didaxis2007, 21, 7. 3. Hoffman, A.; Hennessy, M.; J. Chem. Educ. 2018, 95, 281. 4. Cacciatore, K. I.; Amado, J.; Evans, J.; J. Chem. Educ. 2008, 85, 251. 5. De Araujo, M.; Quim. Nova 2013, 36, 474. 6. Selco, J.; Bruno, M.; Chan, S.; J. Chem. Educ. 2013, 90, 995. 7. Olivares, C.; Merino, C.; Quiroz, W.; Procedia - Social and Behavioral Sciences 2014, 116, 1955. 8. Kurushkin, M.; J. Chem. Educ. 2017, 94, 976. 9. Rich, R. L.; Laing, M.; Educ. Quim. 2011, 22, 162. 10. Labarca, M; Zambon, A.; Educ. Quim. 2013, 24, 63. 11. Scerri, E. R.; Educ. Quim. 2013, 24, 278. 12. Gordin, M. D.; Ambix 2018, 65, 30. 13. Kong, F.; J. Mol. Struct. 1982, 90, 17. 14. Barrow, J.; Caviness, K.; Hefferlin, R.; Nash, D.; Int. J. Quantum Chem. 2016, 116, 1071. 15. Minaev, V. S.; Timoshenkov, In Semiconducting Chalcogenide Glass I; Fairman, R., Ushkov, B., eds.; Elsevier B.V.: London, 2004, chap. 1. 16. Khoroshavin, I. B.; Shcherbatskii, V. B.; Refract. Ind. Ceram. 2005, 46, 75. 17. Parinov, I. A.; Advanced Nano- and Piezoelectric Materials and their Applications, Nova Science Publishers, Inc: New York, 2014. 18. Kolesnikova, V.; Migalb, Y.; Kolesnikova, I.; Novikov, S.; Journal of Friction and Wear 2015, 36, 1. 19. Carriazo, J. G.; Saavedra, M. J.; Molina, M. F.; Educ. Quim. 2017, 28, 107. 20. Weinstein, M.; Found. Chem. 2016, 18, 195. 21. Scerri, E. R.; J. Chem. Educ. 2008, 85, 585. 22. Marchese, F. T.; 12th International Conference Information Visualisation, Londres, Inglaterra, 2008. 23. Babaev, E. V.; Mendeleev Commun. 2009, 19, 1. 24. Carriazo, J. G.; Molina, M. F.; Teheran, P.; Tecné, Episteme y Didaxis 2007, Número Extra, 1. 25. Imyanitov, N. S.; Russ. J. Inorg. Chem. 2011, 56, 2183. 26. Raos, N.; Kem. Ind. 2016, 65, 625. 27. Scerri, E. R.; The Periodic Table. Its Story and Its Significance, Oxford University Press: New York, 2007. 28. Kong, F.; Wu, W.; Sci China Chem. 2012, 55, 618. 29. Migal, Y. F.; Kolesnikov, V. I.; Kolesnikov, I. V.; Comput. Mater. Sci. 2016, 111, 503. 30. Karmakar, B.; Functional glasses and glass-ceramic: processing properties and applications,1st ed., Elsevier Inc: Oxford, 2017. 31. Mukhina, I.; Met. Sci. Heat Treat. 2014, 56, 387. 32. Zhang, Y. M.; Yang, S.; Evans, J. R. G.; Acta Mater. 2008, 56, 1094. 33. Imyanitov, N. S.; Found. Chem. 2014, 16, 235. 34. Verhoeven, D. G. A.; van Wiggen, M. A. C.; Kwakernaak, J.; Lutz, M.; Klein Gebbink, R. J. M.; Moret, M.-E.; Chem. - Eur. J. 2018, 24, 5163. 35. Dang, Y; Meng, L.; Qin, M; Li, Q.; Li, X.; J. Mol. Model. 2018, 24, 1. 36. Carriazo, J. G.; Quim. Nova 2011, 34, 1085. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access