Revisão
|
|
| Laser induced-breakdown spectroscopy (LIBS): histórico, fundamentos, aplicações e potencialidades Laser induced-breakdown spectroscopy (LIBS): history, fundamentals, applications and potentialities |
|
Vinicius C. Costa; Amanda S. Augusto; Jeyne P. Castro; Raquel C. Machado; Daniel F. Andrade; Diego V. Babos; Marco A. Sperança; Raimundo R. Gamela; Edenir R. Pereira-Filho*
Departamento de Química, Universidade Federal de São Carlos, 13565-905 São Carlos - SP, Brasil
Recebido em 08/10/2018 *e-mail: erpf@ufscar.br This review attempts to present a broad view of the technique laser-induced breakdown spectroscopy (LIBS), since its origin, fundamentals, sample preparation strategies, use of chemometric tools for data processing, the advantages and limitations with regard to qualitative and quantitative analysis, aplications and future trends as an analytical technique that is in consolidation in analytical chemistry. LIBS is a rapid and versatile, which is able of providing qualitative and quantitative analytical information for practically any sample, in a virtually non-destructive way, without any substantial sample preparation. The instrumentation is simple, robust, compact, and enables remote analysis. The advancement of the LIBS applications in the areas of agriculture, environmental, food, biological/pharmaceutical, forensic, metallurgy and electronic waste were discussed in detail in this review. We consider that this review will be an important tool concerning dissemination of the LIBS, mainly for audience of undergraduate courses, and disciplines related to instrumental analysis. INTRODUÇAO A Química Analítica tem mostrado, nas últimas 5 décadas, uma grande capacidade de desenvolvimento e apresentaçao de respostas para diversos questionamentos da humanidade.1,2 Essas questoes envolvem aspectos de saúde pública, ambientais e econômicos. Em 2017, as 20 maiores empresas fabricantes de equipamentos analíticos comercializaram 26 bilhoes de dólares americanos.3 Esses números atestam o aspecto estratégico da química analítica, em que a obtençao de dados precisos e exatos transcendem a bancada do laboratório e têm peso considerável na tomada de decisoes econômicas e sociais. Somente no Brasil, a área de química analítica representa cerca de 3% das publicaçoes mundiais em revistas científicas representativas da área.4 Dessa forma, é recorrente a apresentaçao de técnicas analíticas cada vez mais sensíveis e voltadas para o equacionamento de questoes essenciais do nosso dia a dia. Nesse sentido, a espectrometria de emissao óptica com plasma induzido por laser (laser-induced breakdown spectroscopy, LIBS) reflete grande parte desse desenvolvimento, pois unifica alguns aspectos desejados por todo profissional da área de química analítica: simplicidade, elevada frequência analítica, caráter multielementar, reduzida manipulaçao das amostras e obtençao de dados precisos e exatos. Além disso, apresenta praticamente caráter nao-destrutivo, porque somente uma porçao muito pequena da amostra sofre o processo de ablaçao (cerca de nanogramas a microgramas).5 Todas essas vantagens somadas com a simplicidade da instrumentaçao fazem com que a LIBS seja uma das técnicas mais versáteis já desenvolvidas. O crescente interesse pelo uso da LIBS pode ser visto através do número de trabalhos que vêm sendo publicados ao longo dos últimos 30 anos, como mostrado na Figura 1. De acordo com a base de dados da Web of Science, durante esse período cerca de 4500 trabalhos foram publicados e os últimos 11 anos (2008-2018) respondem por cerca de 78% do total das publicaçoes. Esses dados exemplificam a "onda" de interesse pela LIBS, sendo possível encontrar atualmente uma ampla variedade de trabalhos propondo inovaçoes e melhorias. Assim, o objetivo dessa revisao é apresentar ao leitor uma visao geral sobre a LIBS, com discussoes relacionadas com (i) panorama histórico; (ii) o estado da arte; (iii) as estratégias de preparo de amostras; (iv) o uso da quimiometria no tratamento de dados; (v) as vantagens e limitaçoes no que diz respeito a análises qualitativas e quantitativas; (vi) e as suas aplicaçoes em diversos campos de atuaçao, desde aqueles relacionados com agricultura até aquelas de caráter tecnológico.
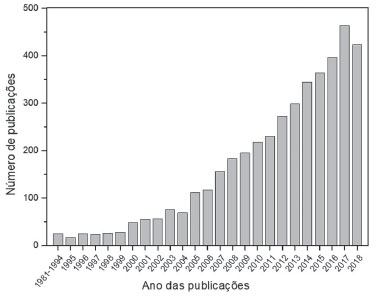 Figura 1. Número de publicaçoes envolvendo LIBS
LIBS: O INICIO Os fundamentos da técnica LIBS deram-se no início do século XX, quando Albert Einstein lançou, em 1917, os fundamentos teóricos sobre a emissao estimulada.6 Em 1958, Charles Townes e seu colaborador Arthur Schawlow discutiram algumas possibilidades de criar o que eles chamaram de microwave amplification by stimulated emission of radiation (MASER), em um artigo que se tornou clássico na física de lasers e é considerado o marco para o desenvolvimento do primeiro laser.1 Contudo, foi somente em 1960 que o engenheiro norte americano Theodore Maiman produziu o primeiro dispositivo de laser com uma montagem simples, feito de um bastao de rubi colocado no centro de uma lâmpada de flash. Ambos os lados do bastao foram cobertos cuidadosamente com camadas de prata, no qual um dos lados era semi-transparente, permitindo a passagem da radiaçao.8 Um ano depois, em 1961, Javan et al.9 desenvolveram o primeiro laser a gás, constituído por uma mistura de hélio e neônio a baixa pressao. No mesmo período foram desenvolvidos diversos lasers de estado sólido, como o Y3Al5O12 (YAlG), Y3Ga5O12 (YGaG), Gd3Ga5O12 (GdGaG) com propriedades desejáveis no material receptor do laser. No entanto, a configuraçao que resultou os melhores resultados foi aquela dopada com íon neodímio (Nd3+) em seu interior, imerso em uma soluçao de granada de ítrio-alumínio (YAG, Y3Al5O12) conhecido por Nd:YAG.10 Esse tipo de configuraçao apresenta características que os diferenciam das demais, pois sao estáveis, resistentes, opticamente isotrópicos e com menor oscilaçao do laser. O laser de Nd:YAG evoluiu e vem sendo amplamente usado para iniciar o plasma. Apesar do uso de lasers nos anos 1960, estes ainda nao eram utilizados como fontes de ablaçao. Dois anos depois de Maiman demonstrar o funcionamento do laser de rubi, esse mesmo laser foi utilizado por Brech e Cross11 para produzir vapores na superfície de materiais metálicos e nao metálicos. Esses vapores eram excitados por uma fonte de energia auxiliar a fim de formar um microplasma com objetivo de detectar o espectro de emissao. Em 1963, Debras-Guedon e Liodec12 publicaram o primeiro uso analítico de laser para análise espectrofotométrica de superfícies. Já Maker et al.13 mencionaram a primeira observaçao de ablaçao induzida opticamente em um gás, e Runge et al.14 relataram o uso de um laser de rubi para produzir a excitaçao direta de centelhas nos metais. Apenas em 1965, o primeiro modelo de laser induzido por gás foi proposto por Zel'dovich e Raizer.15 Entre os anos de 1964 e 1967, foram fabricados os primeiros instrumentos comerciais por Jarrell-Ash (Estados Unidos da América) e Carl Zeiss (Alemanha). Estes instrumentos empregavam a energia do pulso do laser apenas para ablaçao enquanto a excitaçao era feita por um arco elétrico. No entanto, estes equipamentos tiveram pouco tempo de utilizaçao, pois apresentavam baixa precisao e exatidao quando comparados com a espectroscopia de centelha convencional que apresentava temperatura suficiente para causar a emissao de muitos elementos da tabela periódica, permitindo análises semi-quantitativas e qualitativas.16 Desde o desenvolvimento da LIBS, diversas pesquisas foram realizadas a fim de melhorar o desempenho da técnica. Em 1966, Young et al.17 descreveram as características de centelha de ar induzido por laser. No início dos anos 70, após quase 10 anos de estudos acerca dos fenômenos físicos envolvidos na formaçao de plasmas induzidos por laser, os primeiros equipamentos comerciais explorando a técnica LIBS foram disponibilizados no mercado pelas empresas Jarrell-Ash Corporation e VEB Carl Zeiss. Após uma fase inicial de euforia, o interesse pela técnica LIBS entrou em declínio devido ao alto custo da instrumentaçao e baixíssimo desempenho analítico, em comparaçao às técnicas convencionais de espectrometria atômica. Durante os anos de 1960 e 1980, parte das pesquisas sobre plasmas e lasers e suas aplicaçoes tiveram origem na Rússia e posteriormente foram abordadas em um livro clássico de Raizer, "Laser-induced Discharge Phenomena", publicado em inglês em 1977.7 No início dos anos 1980, o interesse pela utilizaçao da LIBS renasceu com o desenvolvimento de lasers mais compactos, robustos e de menor custo, bem como detectores mais sensíveis, com melhor resoluçao espectral e temporal, e melhor discriminaçao entre o espectro de emissao e o de fundo causado pelo continuum de emissao do plasma. O avanço tecnológico nos componentes ópticos e eletrônicos possibilitou o desenvolvimento e miniaturizaçao de diferentes tipos de lasers, surgindo a possibilidade da aplicaçao em análises diretas em praticamente qualquer tipo de amostras. Ademais, com o seu renovado caráter de portabilidade, possibilitou o desenvolvimento de procedimentos de análises in situ. Assim, o interesse na utilizaçao desta técnica tem aumentado com grandes avanços e potencialidades para análise de amostras sólidas.7,18-20 Além disso, a possibilidade de acoplamento com outras técnicas analíticas também contribui para despertar o interesse pelos processos de ablaçao por laser. A ablaçao por laser como uma técnica de amostragem acoplada a técnicas analíticas estabelecidas, tais como espectrometria de emissao óptica com plasma indutivamente acoplado (ICP OES)21 e espectrometria de massas com plasma indutivamente acoplado (ICP-MS),22 aprimorou a capacidade analítica para análise de amostras sólidas, minimizando o tempo de análise, reduzindo a exposiçao a produtos químicos perigosos e resíduos, e tornou-se uma alternativa aos métodos de digestao ácida para análise química. Além disso, sistemas laser ablation (LA)-LIBS têm sido recentemente desenvolvidos, permitem novas possibilidades de mediçao e realizam análises por LIBS enquanto simultaneamente transportam partículas abladas para um instrumento ICP-MS, por exemplo.23,24
FUNDAMENTOS DA LIBS Instrumentaçao A LIBS baseia-se na espectrometria de emissao óptica e consiste em uma fonte de laser que, com o auxílio de lentes focalizadoras, emite pulsos de alta energia diretamente na amostra. Essa amostra pode ser sólida, líquida ou gasosa. Após a incidência do pulso de laser, que pode apresentar uma duraçao de nano, pico ou femto segundos, a amostra passa pelos processos de aquecimento, derretimento (amostras sólidas) e vaporizaçao em um curto intervalo de tempo. A energia do pulso de laser produz um plasma em altas temperaturas (da ordem de 10.000-20.000 K). O material vaporizado (átomos, íons e moléculas) é excitado para um nível de maior energia e ao retornar ao de menor energia (emissao espontânea), emite radiaçao específica em comprimento de onda para cada elemento.25-27 A Figura 2 apresenta um esquema típico de um sistema LIBS, no qual os principais componentes sao: (1) fonte de energia; (2) lentes para focalizar o pulso de laser na superfície da amostra; (3) suporte da amostra que pode ser montada em uma câmara de ablaçao; (4) fibra óptica responsável pela coleta da radiaçao oriunda do plasma; (5) sistema de detecçao (espectrômetro/detector) e (6) computador para controle preciso dos eventos temporais, como: disparo do pulso do laser e registro do espectro.
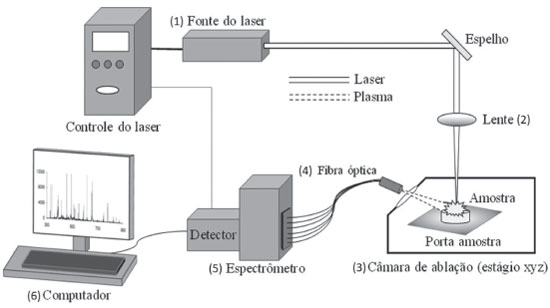 Figura 2. Configuraçao instrumental típica de um equipamento LIBS
Os componentes básicos do sistema LIBS sao similares para as diferentes instrumentaçoes existentes, no entanto, a configuraçao do sistema pode mudar conforme a aplicaçao desejada. Nestes casos, podem ser adaptados diferentes tipos de laser (ou diferentes comprimentos de onda), detectores, espectrômetros e arranjos ópticos. As diferentes configuraçoes podem conferir a LIBS características diversas, como potência do pulso do laser, sensibilidade, peso, tamanho e portabilidade. Exemplos e detalhes sobre as diferentes configuraçoes de cada componente serao abordados nos tópicos a seguir.26,27 Fontes de laser A fonte de laser é responsável por todos os processos de absorçao, emissao espontânea e emissao estimulada, necessários para que ocorra a produçao do feixe de laser. A radiaçao laser é gerada por decaimento energético de uma espécie excitada e emitida por um processo chamado light amplification by stimulated emission of radiation (LASER). Devido ao processo de emissao estimulada, fótons duplicados sao produzidos e dessa forma a radiaçao laser apresenta características como: alta intensidade, direcionalidade, monocromatissidade e coerência.28 Esses sistemas sao compostos basicamente por três componentes: meio ativo, dispositivo para bombeamento de energia e um ressonador óptico (arranjo de espelhos que fornece a amplificaçao da luz do laser). O meio ativo é onde ocorrerá todo o processo de inversao populacional, parte da energia recebida será absorvida por íons dopados no material de laser, tais como íons de Nd3+ em um cristal de YAG (granada de alumínio e ítrio). O sistema de bombeamento de energia (Ex., flashlamps, descarga de gás ou outros lasers) é responsável por fornecer energia para o meio ativo e dar início ao processo de inversao da populaçao, ou seja, mais elétrons no estado excitado do que no fundamental.26,27 O meio ativo pode ser constituído de uma variedade de materiais que conferem os diferentes tipos de lasers existentes:
O comprimento de onda do laser depende do meio ativo e das transiçoes de níveis de energia do meio ativo. É possível gerar pulsos de laser de curta duraçao com comprimentos de onda variando do ultravioleta ao infravermelho, podendo chegar à ordem de milhoes de Watts de potência.26,27 Dentre os tipos de laser citados anteriormente, os lasers de Nd:YAG (1064 nm) sao os mais utilizados nas aplicaçoes em LIBS, principalmente porque fornecem uma fonte de pulsos de laser de alta densidade e potência focalizada, confiável, compacta e de fácil operaçao.29 Existem três tipos de regimes de duraçao do laser: nano, pico e femto segundos. Os sistemas de lasers de nano segundos sao produzidos através da excitaçao de um meio ativo, por exemplo, Nd:YAG. O mesmo processo de excitaçao ocorre para os sistemas de lasers de pico e femto segundos, porém nesses casos a adiçao de um sistema de amplificaçao é utilizado, e o mais comumente aplicado é o chirped pulse amplification (CPA).30 O grande diferencial desses três tipos de lasers é em relaçao ao processo de ablaçao. A duraçao do pulso (características temporais do laser) influencia na interaçao do feixe de laser com o objeto analisado.26-29 Essas diferenças sao notadamente encontradas quando se trata de processos de ablaçao de sólidos. Durante a interaçao do laser com a amostra, ocorre a absorçao da energia incidente do laser através do mecanismo de inversao Bremsstrahlung, envolvendo os fótons que sao emitidos por elétrons acelerados ou desacelerados em colisoes.25,31 Essa energia absorvida envolve a termalizaçao dentro do subsistema de elétrons, transferência de energia para o meio e perda de energia devido ao transporte de calor de elétrons para o alvo (amostra). Em um laser de femto segundos, o tempo de duraçao do pulso é menor que o tempo de resfriamento de elétrons, nesse caso o processo de ablaçao pode ser considerado como uma transiçao direta do sólido para o plasma. Durante esse processo, a conduçao térmica pode ser negligenciada fazendo com que esse tipo de pulso de laser permita uma alta precisao e processo de ablaçao livre de recombinaçao entre os analitos ablados. No laser de pico segundos, ocorre a conduçao de calor por elétrons e a formaçao de uma zona de amostra "derretida" ao redor do ponto ablado, fazendo com que a precisao desse processo seja menor. Para os lasers de nano segundos, a longa duraçao faz com que ocorra a criaçao de uma grande porçao de material "derretido". Nesse caso, parte da evaporaçao e formaçao do plasma acaba sendo referente a esse material, reduzindo consideravelmente a precisao. Resumidamente, três características definem os regimes de duraçao do laser: tempo de resfriamento dos elétrons, de aquecimento do meio e duraçao do pulso de laser.32-34 O melhor sistema e regime de duraçao do laser deve ser avaliado e escolhido de acordo com a aplicaçao desejada pelo analista. Componentes ópticos Além do laser, como fonte de energia para ablaçao/excitaçao, e do sistema de difraçao dos comprimentos de onda e detecçao do plasma emitido, os componentes ópticos também sao necessários principalmente para focalizar o pulso de laser, coletar e conduzir a radiaçao do plasma através de um cabo de fibra óptica até o espectrômetro e posteriormente ao detector.26 Em LIBS, o feixe de laser pode ser focalizado utilizando lentes ou espelhos que ajudam no direcionamento até a superfície da amostra. A configuraçao mais simples e comum é a amostra posicionada perpendicularmente à fonte do laser,25 e os ajustes do sistema óptico auxiliam desde a focalizaçao do laser, aquisiçao da radiaçao do plasma, até os dispositivos de seleçao de comprimentos de onda (Figura 2). Os sistemas mais sofisticados empregam múltiplas lentes, combinadas a espelhos e fibra óptica, em situaçoes que requerem excelente foco, focalizaçao do laser a longa distância, ou menor diâmetro do pulso de laser (maior densidade eletrônica por pulso).27 Existe uma ampla variedade de tipos de lentes, no entanto, todas podem ser incluídas em duas classes gerais de acordo com o efeito que causam em um feixe de luz paralelo: (1) lentes convergentes (ou positivas, convexas) e (2) divergentes (ou negativas, côncavas). As lentes possuem diferentes parâmetros que sao relevantes, tais como distância focal, diâmetro e o material. A distância focal é o parâmetro mais importante na descriçao de uma lente, isto é, a distância do ponto focal no qual os raios de luz estao paralelos e passam através de um lado da lente até o ponto onde sao reunidos no outro lado da lente.35 Para análises in situ, as lentes tipicamente utilizadas possuem distâncias focais de 50 a 150 mm e diâmetros que variam entre 25 a 50 mm. O material da lente depende do comprimento de onda do laser. Para comprimentos de onda na regiao do visível ao infravermelho próximo, sao utilizadas lentes de vidro borossilicato (BK7); em regioes do espectro abaixo de 340 nm as lentes de quartzo sao as mais indicadas; para comprimentos de onda na regiao do infravermelho distante, os materiais empregados sao o seleneto de zinco, germânio e cloreto de sódio.26,28,35 Os cabos de fibra óptica sao utilizados para facilitar a coleta da radiaçao do plasma quando o sistema de detecçao nao pode ser posicionado próximo à amostra. Quando a LIBS é empregada para a análise em ambientes perigosos ou "agressivos", geralmente o espectrômetro é posicionado a alguns metros de distância do objeto de medida. O uso da fibra óptica como um guia óptico da luz do plasma até o espectrômetro permite a análise de objetos em altas temperaturas. Essa é uma vantagem significativa e de especial interesse na metalurgia em ambiente industrial para análise de ligas metálicas em altas temperaturas no processo de produçao.30 Para usar a fibra óptica é preciso ter uma lente focalizando a luz até o cabo de coleta ou diretamente posicionada e apontada para a superfície da amostra. A combinaçao da lente e fibra óptica aumenta a sensibilidade da coleta da radiaçao ao alinhamento do sistema óptico.26,28,35 Sistema de detecçao O sistema de detecçao espectral é responsável por coletar, resolver e medir a emissao atômica do plasma formado na amostra. Usualmente, o sistema de detecçao consiste no seletor de comprimento de onda (monocromador ou uma grade de difraçao) e um detector óptico. Devido à alta complexidade dos espectros obtidos por LIBS, em que sao obtidas uma infinidade de múltiplas linhas de emissao muito próximas umas das outras, o sistema de detecçao deve conter um espectrômetro associado a um detector apropriado que forneça uma medida rápida em um baixo tempo de aquisiçao de dados.28 O espectrômetro é um compartimento onde se encontram os componentes ópticos, tais como janela de entrada da radiaçao, espelhos, redes de difraçao e janela de saída. O espectrômetro dispersa a radiaçao emitida do plasma induzido pelo laser para obter o espectro em termos de intensidade em funçao do comprimento de onda. Esse sistema deve ter a capacidade de cobrir a maior extensao de comprimentos de onda simultaneamente e, ao mesmo tempo, ter uma alta resoluçao espectral (0,003-0,1 nm) para evitar interferências.28,30 Para isso, diferentes formas de montagem têm sido desenvolvidas e empregadas, e os espectrômetros mais comuns sao: (a) Czerny-Turner, (b) Paschen-Runge e (c) echelle.26,36 Em LIBS, a tecnologia echelle é a mais utilizada desde o final dos anos 1990, quando as primeiras aplicaçoes foram reportadas.37,38 Esse sistema é compacto, abrange uma ampla faixa de comprimentos de onda (a partir de 200 a 1000 nm) e possui alta resoluçao espectral (λ/Δλ até maior que 10.000).28 Os detectores sao dispositivos que convertem o sinal óptico gerado pelo espectrômetro em um sinal elétrico, que possa ser registrado e processado pelo computador. O detector deve ter uma alta eficiência de detecçao com um máximo de sensibilidade para todo o espectro obtido. Vários tipos de detectores sao utilizados para registrar a radiaçao espectral dispersada. Dentre os mais usados estao os tubos fotomultiplicadores (PMT, photomultiplier tube), matriz de fotodiodos (PDA, photodiode array), intensified PDA (IPDA), charge-coupled device (CCD) e intensified CCD (ICCD).28 Quando um CCD ou ICCD é acoplado a espectrômetros echelle, um sistema de detecçao robusto para medir linhas de emissao em LIBS é montado. Essa configuraçao tem sido muito empregada e permite a cobertura de uma ampla faixa espectral (165 a 1000 nm), alta resoluçao que permite evitar interferências espectrais em matrizes complexas e análises multielementares com alta sensibilidade. A combinaçao de um espectrômetro Paschen-Runge com tubos fotomultiplicadores pode ser uma alternativa menos dispendiosa aos sistemas convencionais ou sistemas de espectrômetros echelle acoplados a um ICCD. Para análises com ambos os sistemas, os espectrômetros Paschen-Runge/PMT e echelle/ICCD mostram desempenhos semelhantes em termos de limite de detecçao (LOD) e análise multielementar de um pequeno número de elementos (<10). A escolha da configuraçao óptica ideal para LIBS dependerá de vários fatores incluindo o número de elementos e comprimentos de onda a serem monitorados, a faixa de concentraçao dos analitos e a sensibilidade desejada.26,28,36
PREPARO DE AMOSTRAS Uma das características mais atrativas da LIBS é a possibilidade da análise direta com o mínimo ou nenhum preparo de amostras.39,40 Apesar da possibilidade de análise de amostras nas formas líquida e gasosa, é na forma sólida que majoritariamente as amostras sao analisadas. Neste tópico, apresentaremos as principais estratégias de preparo para amostras sólida, líquida e gasosa. Comumente, as amostras sólidas podem ser analisas de forma direta, tanto in natura41 como na forma de pastilhas preparadas a partir do material moído e/ou triturado.40 Para amostras sólidas que apresentam homogeneidade apropriada, é possível dispensar a etapa de preparo, como é o caso de amostras de vidro,42 ligas metálicas,43 polímeros,44 fósseis45 e ligas ortopédicas.46 Cabe informar que a homogeneidade das amostras referidas sao provenientes da constituiçao original das mesmas, e por isso a etapa de preparo é dispensada. Para amostras sólidas heterogêneas, recomenda-se uma etapa de moagem a fim de diminuir o tamanho de partículas. Essa etapa é importante, visto que tem como objetivo reduzir a heterogeneidade das amostras, proporcionando a análise das mesmas com alta reprodutibilidade. Após essa etapa, agora com as amostras homogêneas na forma de pó, recomenda-se a prensagem das mesmas para obtençao de pastilhas.40 Em relaçao à massa da amostra usada para o preparo das pastilhas, fatores como o diâmetro, espessura requerida e a densidade do material devem ser avaliados. Por exemplo, para pastilhas de suplemento mineral para bovinos, com 12 mm de diâmetro e 3 mm de espessura sao necessárias 500 mg de amostra.47 No preparo das pastilhas, deve-se certificar que as mesmas sejam coesas e resistentes para suportar a onda de choque formada durante a expansao do plasma induzido por laser. A coesao e resistência das pastilhas estao diretamente ligadas à distribuiçao do tamanho das partículas. No caso de pastilhas de amostras vegetais, recomenda-se que as partículas sejam menores que 100 µm. De forma geral, as pastilhas preparadas com partículas menores sao mais resistentes, e isso reflete diretamente na precisao das medidas, pois quanto mais compacta e mecanicamente resistente, mais reprodutível será a interaçao entre o laser e a amostra.40 Nessa perspectiva, Costa et al.48 usaram a estratégia referida em amostras de moluscos bivalves liofilizadas e posteriormente moídas para diminuiçao do tamanho das partículas. A massa de amostra usada pelos autores foi relativamente pequena (250 mg), e as pastilhas apresentaram boa resistência mecânica, nao apresentando sinais de fratura ao redor da cratera. Nesse trabalho, foi aplicada uma energia do pulso de laser de 40 mJ e a área do pulso de 50 µm, resultando em uma fluência de 2037 J cm-2 com um laser de Nd:YAG de 1064 nm. Apesar da estratégia do uso de pastilhas ser muito simples, em alguns casos, nao é possível produzir pastilhas para algumas amostras que estejam na forma de pó. Assim, recomenda-se utilizar um material aglutinante (binder) para minimizar as diferenças na porosidade, garantindo maior resistência e eficiência na interaçao laser-amostra.40 Alguns tipos de aglutinantes têm sido utilizados para o preparo de pastilhas, por exemplo, celulose microcristalina,49 ácido bórico,50 e KBr.51 A proporçao em massa de aglutinante/amostra no preparo das pastilhas pode variar entre 10 e 50%, e essa variaçao depende de fatores como propriedades da amostra e da resistência mecânica das pastilhas.40 No trabalho proposto por Peruchi et al.52 os autores analisaram farinha de trigo, no entanto, as pastilhas nao apresentavam boa coesao, sendo necessário o uso de um aglutinante. Os autores testaram três tipos de aglutinantes em três diferentes proporçoes, e os melhores resultados foram obtidos com 30% m m-1 de celulose. Em alguns casos, materiais utilizados como aglutinantes (Ex., celulose), podem ter outra finalidade. Nesse sentido, Augusto et al.49 propuseram um preparo de amostras de leite em pó utilizando celulose microcristalina como branco analítico. Além disso, foram preparadas misturas celulose-leite em diferentes proporçoes. Essas misturas foram pastilhadas e analisadas diretamente por LIBS. Uma das desvantagens do uso de pastilhas em análise por LIBS é que nao é possível realizar um mapeamento químico ao longo de uma amostra, pois, nesse caso, a distribuiçao original dos elementos nao é mais a mesma. O objetivo do mapeamento químico geralmente é identificar a posiçao original dos elementos estudados ao longo de uma amostra, sem nenhum preparo; dessa forma, qualquer preparo, como a moagem e posterior adiçao de aglutinante para formaçao de pastilhas, nao preservará as informaçoes originais da composiçao e localizaçao dos elementos na amostra.45,53 Outra estratégia de preparo de amostras sólidas é a transferência de uma pequena quantidade da amostra em pó para uma fita adesiva. Essa estratégia é recomendada quando a quantidade de amostra nao é suficiente para a confecçao da pastilha. Usando esse procedimento, Silva et al.54 desenvolveram um método rápido para identificaçao de resíduos de disparo de arma de fogo, compostos por Pb proveniente do iniciador, Ba proveniente do oxidante e Sb proveniente do combustível. Diversos voluntários foram selecionados para efetuarem disparos. Após esse processo, os autores coletaram o material com fita adesiva na mao dos voluntários. As fitas adesivas contendo as partículas provenientes dos disparos foram levadas diretamente para análise em LIBS. A partir dos elementos característicos da pólvora, foram propostos modelos de classificaçao usando o soft independent modeling of class analogies (SIMCA), para a identificaçao de suspeitos de disparo com armas de fogo. Para o preparo de amostras líquidas, alguns problemas adicionais podem surgir.55 A interaçao laser-amostra é afetada, pois parte da energia do laser é dissipada, espalhando a amostra (splashing). Em consequência, a reprodutibilidade e repetibilidade das análises sao drasticamente deterioradas. Além disso, a temperatura do plasma é comprometida (menor temperatura), dificultando a excitaçao/atomizaçao das espécies presentes na amostra. A fim de contornar essas características indesejáveis, algumas estratégias de preparo têm sido propostas e geralmente envolvem a transformaçao da matriz líquida em um sólido. As estratégias mais comuns consistem no simples congelamento de amostras aquosas e posterior análise do sólido resultante.56 Em trabalho proposto por Lee et al.57 os autores utilizaram uma bomba peristáltica para produzir um "jato" da amostra, no qual o pulso de laser foi irradiado diretamente. Outras estratégias envolvem a transferência da amostra líquida para substratos nao permeáveis como grafite58 e placa de metal,59 ou para substratos permeáveis como o papel filtro.60 Nesses casos, a amostra líquida é depositada nesses substratos e, após secagem do material o substrato é analisado. Dessa forma, os problemas inerentes às análises de líquidos sao minimizados, e o processo de análise ocorre de forma análoga às amostras sólidas. Recentemente Terán et al.61 propuseram um método de determinaçao de Pb em água. Para isso, os autores utilizaram argila funcionalizada para adsorçao do Pb. Posteriormente, essa argila foi prensada para obtençao de pastilhas que foram analisadas diretamente pela LIBS. Já Papai et al.62 propuseram um método para extraçao de íons de cobre em soluçao aquosa em parafina. Para tanto, após a adiçao de alguns reagentes a 10 mL de soluçao aquosa contendo cobre, 700 µL de parafina derretida foi adicionada à soluçao e, após homogeneizaçao em vortex, 600 µL dessa parafina foi extraída e posicionada em um suporte de acrílico para secagem e posterior análise direta em LIBS. Outra estratégia consiste em misturar a amostra líquida com uma soluçao polimérica de álcool polivinílico (PVA), obtendo-se um filme fino e homogêneo.63 Essa estratégia foi aprimorada e utilizada para análise de fertilizantes líquidos64 e protetores solares.65 A estratégia supracitada envolve a mistura da amostra com uma soluçao de PVA 10% m v-1 e essa mistura é posteriormente submetida a um processo de secagem, sendo obtido filmes poliméricos finos com a amostra encapsulada. Além disso, o processo potencializa a homogeneizaçao das amostras, bem como a avaliaçao de adiçao dos elementos Bi, Sc e Y como padroes internos líquidos. Nesse caso, os padroes internos foram adicionados juntamente na mistura com a amostra e a soluçao de PVA, a fim de se obter uma concentraçao e, consequentemente, um sinal analítico constante após as análises, possibilitando o uso dessas linhas para normalizaçao. Amostras gasosas também podem ser analisadas por LIBS, todavia, a principal limitaçao é a configuraçao instrumental do sistema. Hohreiter e Hahn66 analisaram espécies contendo carbono, tais como CO, CO2 e CH4, em que esses gases eram inseridos em uma câmara e analisados por um sistema LIBS. Sturm & Noll67 obtiveram sinais de emissao de C, H, O e N em misturas de ar, CO2, N2 e C3H8 em um sistema LIBS equipado com uma câmara de Al previamente evacuada com auxílio de bomba de vácuo. Diante do exposto é possível concluir que a etapa de preparo de amostra para análise por LIBS é crítica. Deve-se ter muito cuidado nesse aspecto, pois um preparo inadequado pode refletir diretamente na qualidade dos resultados. Para outras informaçoes e mais detalhes sobre o preparo de amostras por LIBS, sugere-se a leitura do artigo de revisao "Sample treatment and preparation for laser-induced breakdown spectroscopy"39 e do livro "Métodos de preparo de amostras para análise elementar".40
LIBS E QUIMIOMETRIA Na química analítica, o termo "quimiometria" foi introduzido por Svante Wold em 1971, para descrever o uso de modelos matemáticos e princípios estatísticos. Atualmente, a quimiometria é definida como uma ciência que emprega uma abordagem multidisciplinar, que inclui também matemática e estatística, e vem se tornando indispensável para pesquisadores modernos de química analítica.68,69 O principal objetivo da quimiometria é converter uma grande quantidade de dados em informaçoes significantes e úteis. Inúmeros algoritmos computacionais e estatísticos sao aplicados para a realizaçao dessa tarefa. A seleçao de uma ferramenta quimiométrica dependerá da aplicaçao analítica desejada.70 Em se tratando de análise por LIBS, o uso da quimiometria é praticamente indispensável devido à grande quantidade de dados. A Figura 3 mostra o quanto o uso da LIBS associada a ferramentas quimiométricas vem crescendo ao longo dos anos. De acordo com a base de dados da Web of Science, desde 2001 foram publicados cerca de 375 artigos científicos que utilizaram algum tipo de ferramenta quimiométrica, e desde 2011 esse número vêm crescendo significativamente.
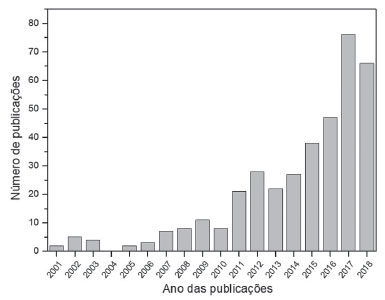 Figura 3. Número de publicaçoes envolvendo LIBS e quimiometria
Os espectros LIBS sao muito complexos, devido a alguns fatores relacionados ao ruído do sinal, como: flutuaçoes da energia do laser, taxa de ablaçao, acoplamento laser-plasma e as características do plasma, sendo caracterizados pelo desvio padrao relacionado ao sinal. Essa complexidade, impossibilita uma aplicaçao mais ampla da LIBS no campo da química analítica, pois pode afetar as características espectrais (linhas espectrais e emissao contínua). Outro aspecto importante é a homogeneidade ou heterogeneidade do material e a distribuiçao do analito na matriz da amostra, podendo ser contornado através da área de amostragem. Assim, sao necessárias melhorias na precisao das análises qualitativas e quantitativas, reduzindo obstáculos na obtençao de máxima informaçao útil dos dados. Nessa perspectiva, é notório o sucesso da combinaçao da LIBS com o uso de ferramentas quimiométricas, as quais auxiliam no melhor entendimento dos dados espectrais.68,71 Antes de aplicar alguma ferramenta quimiométrica nos dados LIBS, é recomendado o pré-processamento dos mesmos. Devido à complexidade das interaçoes laser-amostra e laser-plasma e à sensibilidade do plasma frente às características físicas e químicas das amostras, a normalizaçao dos dados é de grande importância, pois minimiza variaçoes indesejadas evitando problemas em análises futuras. Assim, os valores de cada uma das variáveis de uma dada amostra i sao divididos por um fator de normalizaçao.71,72 Há vários tipos de normalizaçoes que podem ser empregadas para esse propósito, como: normalizaçao pela área total do espectro, pelo sinal que apresenta maior intensidade, pela norma euclidiana do sinal, por padronizaçao interna, entre outras. Além da normalizaçao dos dados, há outros tipos de pré-processamentos empregados nos dados LIBS, a saber: centrar os dados na média para casos em que é utilizado todo o perfil espectral e o autoescalamento para situaçoes em que sao empregadas a área ou a altura do sinal (dados discretos). Ambos sao muito usados na análise exploratória de dados, proposiçao de modelos de classificaçao e de calibraçao.73,74 A quimiometria pode ser dividida em quatro grandes vertentes: (i) planejamento fatorial e metodologia de superfície de respostas; (ii) análise exploratória de dados químicos; (iii) modelos de classificaçao; e (iv) calibraçao multivariada.75-79 Todas as vertentes referidas sao amplamente empregadas no desenvolvimento de métodos analíticos por LIBS. Em análises por LIBS, é fundamental otimizar os parâmetros instrumentais, tais como: energia do pulso do laser, tempo de atraso (delay time) e área do pulso (spot size). Esses parâmetros comumente sao otimizados através de planejamento experimental a fim de obter uma condiçao ótima ou de compromisso.80-84 Em trabalho proposto por Castro e Pereira-Filho,43 a LIBS foi usada para análise direta de ligas metálicas, e as condiçoes instrumentais (energia do pulso do laser, tempo de atraso e área do pulso) foram otimizadas utilizando planejamento do tipo Doehlert. No trabalho proposto por Andrade e Pereira-Filho,85 a LIBS foi empregada para análise direta de fertilizantes. As variáveis instrumentais foram avaliadas com o uso de planejamento fatorial fracionário 24-1. Nesse caso, nao foi possível obter uma condiçao experimental satisfatória para todos os analitos simultaneamente, assim, uma segunda etapa empregando um planejamento composto central foi usada, a fim de obter uma condiçao instrumental de compromisso. Os métodos supervisionados de reconhecimento de padroes, usando as ferramentas quimiométricas SIMCA, partial least squares discriminant analysis (PLS DA), k-nearest neighbor (KNN), e linear discriminant analysis (LDA), sao amplamente empregados em LIBS.68 A utilizaçao dessas ferramentas sao indispensáveis quando o objetivo é usar as informaçoes espectrais para proposiçao de modelos de classificaçao. As ferramentas referidas foram empregadas com sucesso na proposiçao de modelos de classificaçao para amostras de ligas metálicas,43 polímeros,44 couros,86 cosméticos,87 pinturas pré-histórica,88 forense,89 rochas vulcânicas90 entre outros.91-93 Os métodos nao supervisionados de reconhecimento de padroes, como a principal component analysis (PCA) e hierarchical cluster analysis (HCA) também sao empregados. Normalmente, o primeiro passo para interpretaçao dos dados LIBS para um grande conjunto de amostras é a aplicaçao da PCA.94-100 Outra abordagem quimiométrica muito empregada em análise por LIBS é o uso da calibraçao multivariada. Dentre as principais ferramentas de calibraçao multivariada aplicadas estao a partial least squares (PLS),101 multiple linear regression (MLR),65 artificial neural networks (ANN)102 entre outras.68,103,104 Como pode ser observado, é ampla a aplicaçao da quimiometria nos dados espectrais da técnica LIBS. Apesar de extrair e maximizar informaçoes úteis e melhorar a precisao das análises qualitativas e quantitativas, o universo quimiométrico aplicado a LIBS exige ainda uma maior exploraçao e pesquisa, visando à melhoria do desempenho da técnica em vários campos de aplicaçao.
ABORDAGENS PARA ANALISE QUALITATIVA E QUANTITATIVA A LIBS é uma técnica analítica muito utilizada para análises qualitativas e quantitativas, tendo sido observado um expressivo crescimento nos últimos anos. A Tabela 1 mostra uma variedade de amostras que já foram objeto de estudo por meio da LIBS. Para fins de análise qualitativa, a LIBS é estabelecida e muito utilizada para identificaçao de elementos químicos. Contudo, para análise quantitativa, requer esforço considerável face às dificuldades para preparaçao e obtençao de padroes de calibraçao e a inexistência de materiais de referência com propriedades certificadas para massas de amostra da ordem de µg.
Outro fator importante que pode contribuir na qualidade dos resultados quantitativos está no tratamento adequado dos dados obtidos, desde a estratégia de correçao de linha de base (quando necessária), seleçao da linha de emissao do analito, tipo de estratégia de calibraçao (uni ou multivariada) para o modelo de calibraçao, entre outros.114 Além disso, a LIBS é susceptível a severos efeitos de matriz, o que interfere nos resultados quantitativos.26 A seguir, apresentaremos as potencialidades da LIBS em análise qualitativa e os avanços em análise quantitativa. Os espectros LIBS fornecem informaçoes importantes sobre elementos e/ou moléculas, e podem ser utilizados para análise qualitativa a fim de estabelecer impressoes digitais (fingerprinting) de uma determinada amostra. Outra possibilidade para fins de análise qualitativa é o uso do mapeamento hiperespectral, que é uma ferramenta que fornece um mapa multielementar da superfície ou do interior de uma determinada amostra. O mapeamento hiperespectral pode ser obtido através dos mapas de escores provenientes de uma PCA,53 ou mapeando os valores de intensidade de emissao obtidos a partir da ablaçao de pontos específicos na amostra.115 As imagens hiperespectrais podem ser empregadas para avaliar a localizaçao e distribuiçao espacial de nutrientes em material vegetal,116 macronutrientes em alimentos,117 elementos perigosos, preciosos e estratégicos em lixo eletrônico,118 análises de fósseis e coprólitos,45 materiais arqueológicos119 e a discriminaçao entre pele humana saudável e com câncer.108 Outra interessante abordagem qualitativa dos espectros LIBS é na identificaçao e proposiçao de modelos de classificaçao, empregando diferentes ferramentas quimiométricas. Senesi et al.120 identificaram e classificaram amostras de meteoritos utilizando os espectros obtidos de um equipamento LIBS portátil, usando algoritmo de inferência baseado em lógica fuzzy. Recentemente, Delgado et al.105 propuseram um método de discriminaçao de três isômeros de dinitrotolueno (2,3-, 2,4- e 2,6), empregando a discriminant function analysis (DFA) associada aos espectros LIBS. Inúmeras possibilidades de análise qualitativa sao possíveis empregando os espectros multielementares obtidos pela LIBS, de forma rápida (segundos) e fácil, o que a torna uma atraente técnica de caracterizaçao elementar. Na análise direta empregando a LIBS, uma porçao da amostra é analisada integralmente, assim a matriz da amostra pode influenciar no fenômeno de emissao atômica/iônica/molecular e, consequentemente, no sinal analítico obtido. Desse modo, uma das principais dificuldades relacionadas à determinaçao quantitativa por LIBS está associada aos efeitos de matriz. Nesse sentido, diversas estratégias de calibraçao que visam à análise quantitativa e minimizaçao de efeitos de matriz em LIBS têm sido propostas. Dentre as principais estratégias de calibraçao estao: (i) compatibilizaçao de matriz;49 (ii) adiçao de padrao;121 (iii) padronizaçao interna;122 (iv) calibration-free (CF);123 (v) one-point calibration (OPC);124 (vi) multi-energy calibration (MEC);47 e (vii) calibraçao multivariada usando PLS,125 MLR,126 PCR127 e ANN.128 Dentre as estratégias de calibraçao supracitadas, a compatibilizaçao de matriz, provavelmente, é a mais empregada. Para essa estratégia, um conjunto de amostras com concentraçoes determinadas por uma técnica de referência, ou materiais de referência certificados (MRC) sao utilizados como padroes sólidos de calibraçao. Uma das principais vantagens é que os efeitos de matriz podem ser minimizados quando as propriedades físicas dos padroes de calibraçao sao semelhantes às características das amostras. Apesar de suas vantagens, a obtençao de valores de referência para alguns analitos por outras técnicas pode ser difícil em alguns casos (por exemplo, para amostras de difíceis decomposiçoes como o vidro) e quando há um pequeno conjunto de amostras ou MRC.85,129-132 A calibraçao por adiçoes de padrao é uma alternativa eficaz para minimizar as principais limitaçoes associadas com LIBS. Nessa estratégia, uma quantidade constante de amostra é adicionada ao branco analítico e em todos os padroes de calibraçao, garantindo que as amostras e padroes estejam submetidos às mesmas interaçoes físico-químicas com o laser durante a formaçao do plasma, minimizando assim possíveis efeitos de matriz. As limitaçoes desta abordagem incluem sua incapacidade de corrigir interferências espectrais e a exigência de grandes quantidades de amostra. Além disso, a calibraçao por adiçoes de padrao pode levar a uma baixa frequência analítica, pois uma curva de calibraçao com alguns padroes de calibraçao (geralmente cinco padroes) deve ser preparada para cada amostra individualmente.121,133 A padronizaçao interna é uma alternativa de calibraçao para minimizar as flutuaçoes do sinal analítico, devido às condiçoes instrumentais operacionais, aos erros de amostragem e, em um menor grau, aos efeitos de matriz.134-136 Bons resultados têm sido obtidos com esta estratégia de calibraçao para análise de amostras geológicas e alimentícias complexas. No entanto, a escolha de um elemento como padrao interno apropriado nao é tarefa fácil, uma vez que o padrao interno deve sofrer os processos temporais do plasma semelhantes aos dos analitos e possuir propriedades físico-químicas semelhantes, o que geralmente é desafiador em LIBS.137Além disso, a concentraçao do padrao interno deve estar constante em todas as amostras e padroes analisados, para que a normalizaçao do sinal seja efetiva. A CF utiliza as intensidades das linhas de emissao e algumas propriedades do plasma, por exemplo, densidade eletrônica do plasma e temperatura, que sao calculadas a partir da distribuiçao de Boltzmann, para determinar a concentraçao do analito na amostra. Nesse caso, apenas um algoritmo CF é necessário, sem necessidade de uma curva de calibraçao ou padroes para a compatibilizaçao de matriz.138,139 Para que esta estratégia seja empregada é necessário que haja equilíbrio local termodinâmico no plasma gerado na análise das amostras. A OPC é uma variaçao do algoritmo CF, que foi proposta para superar a relativa falta de informaçao sobre alguns parâmetros de transiçao espectral, bem como compensar parcialmente os efeitos de auto-absorçao.124 Considerando todos os parâmetros envolvidos na CF e a complexidade de algumas matrizes, o método é preciso em análises envolvendo amostras fisicamente e quimicamente homogêneas, como ligas metálicas.140,141 Recentemente, Babos et al.47 empregaram MEC para a determinaçao de Ca, Cu, Fe, Mn e Zn por LIBS, em amostras de suplementos minerais para bovinos. A MEC utiliza apenas dois padroes de calibraçao, para cada amostra, e vários comprimentos de onda de emissao do analito com diferentes sensibilidades para determinar a sua concentraçao na amostra. Ambos padroes de calibraçao sao preparados usando a mesma quantidade de amostra, o que contribui para minimizar eficientemente os efeitos de matriz. O padrao 1 é composto por 50% m m-1 de amostra e 50% m m-1 de um branco apropriado, enquanto o padrao 2 é composto por 50% m m-1 de amostra e 50% m m-1 de um padrao de referência contendo os analitos. Para determinar a concentraçao do analito na amostra é utilizado o coeficiente angular do modelo linear obtido ao preparar um gráfico onde no eixo x estao as intensidades obtidas do padrao 2 (amostra + padrao) e no eixo y, as intensidades obtidas do padrao 1 (amostra + branco), e é considerada a concentraçao do analito adicionado no padrao 2. Além desse trabalho, essa estratégia foi empregada com sucesso na determinaçao de Ca, K e Mg em suplementos dietéticos142 e na determinaçao de Ni e Cr em minérios níquel-ferrosos.80 Algumas limitaçoes desse método estao relacionadas à dificuldade da escolha de um branco apropriado e à homogeneizaçao dos padroes. As estratégias de calibraçao multivariadas também proporcionam determinaçoes com satisfatória exatidao e precisao. Algumas limitaçoes intrínsecas de cada método multivariado devem ser conhecidas para que conclusoes errôneas nao sejam obtidas na calibraçao do método. A Figura 4 apresenta resumidamente as vantagens e limitaçoes das principais estratégias de calibraçao (univariada e multivariada) empregadas em LIBS, já mencionadas anteriormente. As possibilidades de calibraçao para a análise quantitativa por LIBS sao diversas, contudo, a melhor calibraçao será aquela que possibilitar determinaçoes com exatidao e precisao satisfatórias, ou seja, que minimizam os efeitos de matriz na determinaçao do analito. A escolha da estratégia de calibraçao empregada no método analítico que será desenvolvido dependerá das propriedades intrínsecas da amostra analisada e do conhecimento das vantagens e limitaçoes inerentes a cada estratégia.
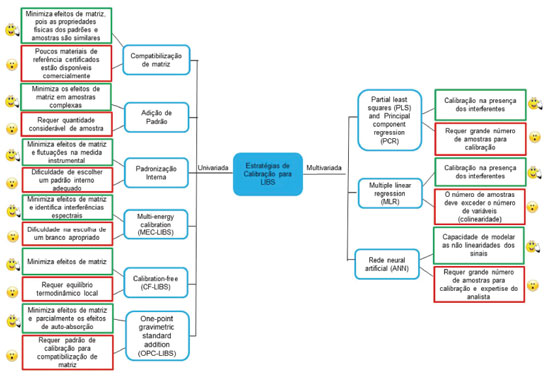 Figura 4. Vantagens e limitaçoes das principais estratégias de calibraçao univariada e multivariada para análise quantitativa por LIBS
APLICAÇOES A LIBS é uma técnica analítica que vem sendo amplamente empregada para fins qualitativos e quantitativos em uma infinidade de matrizes de interesse nos mais diferentes campos de atuaçao. Esse crescimento está atrelado às características atraentes da técnica, como a possibilidade de análise direta com mínimo ou nenhum preparo da amostra, a possibilidade de análise in situ, e a sua capacidade multielementar. As aplicaçoes da LIBS podem ser notadas a partir das publicaçoes de artigos de revisao em áreas específicas como: agri-cultura,143 alimentos,144 ambiental,145 biológicas,146 farmacêuticas,147 forense,148 metalúrgica149 e resíduos eletrônicos.5 Assim, as áreas de atuaçao referidas serao abordadas e os mais recentes avanços da LIBS para análise de diversas amostras serao apresentados. Os tópicos a seguir serao organizados a partir das áreas de aplicaçao com foco em amostras específicas, a saber: agricultura (plantas, fertilizantes e solos), ambiental (água e solos), alimentícia (aspectos nutricionais, segurança alimentar e adulteraçoes), farmacêutica (medicamentos e matéria prima) e biológica (sangue, tecido, cabelo e outros), forense (identificaçao de resíduos variados e falsificaçao), resíduo eletrônico (polímeros e printed circuit board (PCB)) e metalurgia (escórias, ligas e aços). A Tabela 2 apresenta um esboço geral acerca das aplicaçoes que serao discutidas nos tópicos subsequentes.
Agricultura O interesse da LIBS no amplo campo das ciências agrícolas reside principalmente em sua versatilidade e seu potencial para análises in situ. As aplicaçoes nesse campo de atuaçao estao entre as mais desafiadoras e concentram-se nas análises de plantas, fertilizantes e solos.88,96 Esses desafios se devem basicamente à ampla variedade de amostras e sua complexidade, que refletirá na extensao da interaçao entre laser-amostra, bem como às condiçoes adversas de trabalho.26,170 A seguir, apresentaremos uma revisao sobre os avanços da LIBS para análise de plantas, fertilizantes e solos. Para fins de análise quantitativa de macro/micronutrientes e contaminantes em plantas, diversos trabalhos já foram publicados, demonstrando as potencialidades da LIBS para esse fim.171-178 O grupo do Prof. Krug do Centro de Energia Nuclear na Agricultura (CENA, Piracicaba - SP) tem se destacado nesse aspecto, e já foram publicadas duas revisoes interessantes sobre a aplicaçao da LIBS para análise de plantas, com enfoque em preparo de amostras e estratégias de calibraçao.122,179 Além da determinaçao elementar, a LIBS também apresenta grande potencialidade na proposiçao de modelos de classificaçao visando à identificaçao de plantas infectadas. Nessa perspectiva, Pereira et al.180 propuseram um método para a classificaçao de folhas de laranjeira infectadas por citrus greening, baseado nos espectros de emissao obtidos. O modelo proposto foi promissor para a prediçao das plantas infectadas. Ainda nessa perspectiva, Ranulfi et al.181 empregaram a LIBS na identificaçao de plantas cítricas, sadias e infectadas com a doença bacteriana huanglongbinh. Os autores observaram que a partir do perfil nutricional é possível propor modelos de classificaçao para distinguir plantas sadias das doentes. Em outro trabalho, Ranulfi et al.182 usaram a LIBS para discriminar plantas de soja sadias e infectadas com a doença conhecida como "haste verde e retençao foliar". A partir da constituiçao elementar, os autores concluíram que as plantas sadias apresentavam maiores concentraçoes de Ca e Mg, já as plantas doentes maiores concentraçoes de K. Os resultados obtidos demonstram a aplicabilidade da LIBS como uma ferramenta de diagnóstico precoce. Outra aplicaçao no campo da análise de plantas por LIBS é o mapeamento químico. O grupo Kaiser's, da República Tcheca, tem se destacado nesse campo de atuaçao.146,183 Nessa perspectiva, Krystofova et al.184 realizaram um mapeamento químico, a fim de verificar a distribuiçao espacial de Mg e Pb em folhas de milho, alface e girassol. Nessa mesma abordagem, Guerra et al.185 obtiveram mapas químicos de B, Ca, Fe, Mg, Mn, P e Si em fragmentos de folhas secas de cana-de-açúcar por LIBS. O mapeamento químico de plantas pode fornecer informaçoes úteis sobre o diagnóstico nutricional, ou sobre a bioacumulaçao de possíveis contaminantes em regioes específicas das plantas, como nos frutos e folhas comestíveis. Apesar das potencialidades da LIBS para realizaçao de mapeamento químico, o número de aplicaçoes em plantas ainda é limitado, principalmente pela sensibilidade relativamente baixa da técnica.122 A LIBS também tem sido empregada com sucesso para a determinaçao de nutrientes e contaminantes em fertilizantes.186-188 Nessa abordagem, Morais et al.138 determinaram Ca em fertilizantes, e avaliaram o uso do Na como padrao interno. Em outro trabalho, Morais et al.189 determinaram K em fertilizantes e avaliaram o uso da adiçao sais de elementos facilmente ionizáveis, afim de melhorar a sensibilidade da LIBS, e os resultados foram muito promissores. Já Vieira et al.110 desenvolveram um método para determinaçao de P em fertilizantes. Os autores utilizaram um sistema de descarga elétrica acoplada a um LIBS de baixa energia do pulso (50 mJ), a fim de melhorar a sensibilidade. Os resultados apresentados pelos autores mostraram que essa abordagem é muito consistente e promissora. Andrade e Pereira-Filho85 determinaram nutrientes (B, Cu, Ca, Mg, Mn, Na e Zn) e contaminantes (Cd, Cr e Pb) em fertilizantes sólidos. Nesse trabalho, as concentraçoes de Pb encontradas foram alarmantes, variando de 0,1 a 1 (% m/m). Os resultados apresentados indicam que a LIBS é uma ferramenta viável para determinar nutrientes e contaminantes em fertilizantes, e pode ser empregada na análise de rotina. A aplicaçao da LIBS para análise de fertilizantes está restrita aos fertilizantes sólidos, que sao os mais empregados na agricultura. Contudo, o uso dos fertilizantes líquidos tem ganhado destaque nos últimos anos, uma vez que os mesmos podem ser aplicados diretamente nas folhas das plantas e proporcionam maior disponibilidade de nutrientes e eficiência de fertilizaçao em curto prazo. No entanto, como já discutido na seçao sobre preparo de amostras, a análise de líquidos por LIBS ainda é um desafio a ser superado. Nesse sentindo, Andrade et al.64 propuseram um novo método de preparo de amostras para análise de fertilizantes líquidos (suspensao) em LIBS. As amostras de suspensao de fertilizantes foram misturadas com PVA 10% m/v e mantidas por aproximadamente 2 h a 50°C, resultando em um fino filme polímerico com a suspensao líquida imobilizada. Posteriormente, esse filme polimérico foi introduzido na câmara de ablaçao da LIBS e analisado. Os resultados apresentados pelos autores demonstraram que o procedimento proposto de preparo de amostras líquidas possui um alto potencial para o desenvolvimento e implementaçao de métodos para determinaçao de Cu, K, Mg, Mn e Zn em suspensoes de fertilizante e em outras amostras de difícil mineralizaçao. Outra aplicaçao da LIBS contempla a análise de solos e algumas revisoes sobre esse tema demonstram a potencialidade da técnica nesse campo.120,190,191 A seguir, apresentaremos as principais demandas das ciências agrícolas para análise de solos usando LIBS. Nessa perspectiva, a LIBS vem sendo amplamente empregada para a determinaçao quantitativa de macro e micronutrientes.192-197 Além da determinaçao de macro e micronutrientes, a LIBS tem sido utilizada para outros fins em análise de solos. Nesse sentido, Pontes et al.198 usaram a LIBS, associada a ferramentas quimiométricas (modelos de classificaçao), para classificar diferentes tipos de solos (argissolo, latossolo e nitossolo) brasileiros. O método proposto foi aplicado com sucesso e a taxa de acerto para os modelos foi de 90%. Já Nicolodelli et al.199 determinaram o teor de carbono em amostras de solos da regiao amazônica e de mata atlântica. Ainda nessa perspectiva, Ferreira et al.200 usaram a LIBS para avaliar o grau de humificaçao de matéria orgânica no solo. Em outro trabalho, Ferreira et al.201 propuseram um método para determinar o pH de solos. Os resultados alcançados foram promissores e estavam em concordância com aqueles obtidos pelo método de referência usando potenciometria. Por outro lado, Villas-Boas et al.202 expandiram a aplicaçao da LIBS para análise da textura de solo. Modelos de calibraçao foram propostos para estimar a proporçao de areia, silte e argila em amostras de solo de composiçao variada. Os resultados foram promissores e a incerteza apresentada pelo método proposto foi semelhante à incerteza do método de referência. Em trabalho proposto por Tadini et al.203 a LIBS foi empregada para avaliaçao das fraçoes de ácido húmico e ácido fúlvico em solos da Amazônia. Os resultados mostraram que a fraçao de ácido fúlvico foi associada com altas quantidades de Al nos solos, enquanto a fraçao de ácido húmico foi mais seletiva em relaçao ao Fe. Alimentos Nós últimos anos, a LIBS tem se consolidado como uma ferramenta valiosa para análise de amostras alimentícias.204 De acordo Sezer et al.144 as aplicaçoes da LIBS em ciências de alimentos estao centradas principalmente na avaliaçao dos aspectos nutricionais (macro e microelementos), toxicológicos (contaminantes) e de adulteraçao. Ainda segundo Sezer et al.144 do total das publicaçoes envolvendo LIBS e alimentos, os aspectos nutricionais, toxicológicos e de adulteraçao respondem por cerca de 62%, 31% e 8% respectivamente. Nesse sentido, apresentaremos algumas das mais recentes contribuiçoes da LIBS em ciência de alimentos, com ênfase nos aspectos anteriormente mencionados. A LIBS tem se revelado como uma técnica versátil para análise elementar de diferentes tipos de amostras alimentícias, tais como chá,81 carne,132 arroz,205 café,206 grao de bico,207 farinhas sem glúten208 e farinha de mandioca.209 Diversos trabalhos usaram a LIBS para a avaliaçao dos aspectos nutricionais, a partir da determinaçao de macro e microelementos essenciais.81,132,205,208-210 Nesse sentido, Ferreira et al.211 determinaram Ca em amostras de cereais matinais. Peruchi et al.52 analisaram amostras de farinhas de trigo pastilhadas para a determinaçao de Ca, Cu, Fe, K, Mg, Mn, P, S e Zn utilizando LIBS e espectrometria de fluorescência de raios X por energia dispersiva. Em outro estudo, Bilge et al.212 determinaram Na em biscoitos e diferentes tipos de paes. Já Singh et al.213 determinaram Ca, K, Mg e Na presentes nos graos de sementes de abóbora, melancia e melao. Recentemente, Zivkovic et al.214 determinaram Ba e Mn em amostra de chá de hortela. Como estratégia de calibraçao, os autores usaram o método de adiçao de padrao e os resultados estavam em concordância com o método de referência por ICP OES. Além da determinaçao elementar, a LIBS também é uma poderosa ferramenta para avaliar outros componentes nutricionais como, proteínas, gorduras saturadas, carboidratos e teor de cinzas.144,204 Kongbanga et al.215 monitoraram o sinal de emissao da banda de C2. emitida por diferentes óleos vegetais e propuseram um método para determinaçao quantitativa de ácidos graxos saturados. Sezer et al.216 desenvolveram um método para análise de proteínas nitrogenadas em amostras de farinhas de trigo. O teor de nitrogênio foi correlacionado com o teor de proteína na farinha de trigo, e a análise elementar foi usada para determinar seus compostos orgânicos. Em outro estudo, Bilge et al.217 focaram na análise de cinzas em farinha de trigo. O teor de cinza é um parâmetro de qualidade importante em termos de rotulagem nutricional, bem como nas propriedades de processamento de vários produtos de cereais. Além da composiçao nutricional, a detecçao de contaminantes (elementos tóxicos e agentes biológicos) é uma questao importante na indústria de alimentos.144,204 Apesar dos vários atrativos da LIBS, os altos LOD podem limitar sua aplicaçao nesse campo. Alguns trabalhos têm usado a LIBS para detecçao de metais tóxicos em alimentos, mas geralmente as concentraçoes estao no nível de mg kg-1. Nesse sentido, Lin et al.218 avaliaram a concentraçao de Pb (mg kg-1) e, m amostras de laranja empregando LIBS e calibraçao multivariada. Já Ponce et al.219 determinaram Pb (mg kg-1) em amostras de peixes, particularmente na tilápia do Nilo (Oreochromis niloticus), e Yao et al.220 determinaram Cd (mg kg-1) em amostra de vegetais. Contudo, as aplicaçoes da LIBS nao estao restritas apenas a sua capacidade de determinaçao elementar, e vários autores têm explorado as demais potencialidades da técnica para monitorar outros contaminantes em amostras alimentícias. Nesse sentido, Multari et al.221 detectaram contaminantes biológicos (Escherichia coli e Salmonella entérica) em vários produtos como casca de ovo, leite, carne e alface. Em outro trabalho, os autores caracterizaram o leite proveniente de vacas infectadas com mastite, avaliando apenas as bandas de emissao de CN e C2 do espectro LIBS. Além de elementos tóxicos e agentes biológicos, outro contaminante comum em amostras alimentícias é o resíduo de agrotóxicos. Nesse contexto, Kim et al.222 discriminaram amostras de arroz e espinafre contaminadas com pesticidas, enquanto Ma e Dong223 investigaram a potencial aplicaçao da LIBS para a detecçao de resíduos do inseticida clorpirifós em cascas de maça. Huiqin et al.224 desenvolveram um modelo de calibraçao para detecçao de resíduos de fungicidas cúpricos em casca de laranja. As aplicaçoes da LIBS em análise de alimentos sao amplas e a versatilidade da técnica permite sua aplicaçao no campo das adulteraçoes. A avaliaçao de adulterantes em amostras alimentícias é uma grande preocupaçao para agências reguladoras, órgaos governamentais, consumidores e fabricantes.144,204 Nesse cenário, a LIBS se encaixa satisfatoriamente devido a sua alta frequência analítica e possibilidade de análise direta. Uns dos principais alimentos alvos de adulteraçao sao os produtos cárneos. Para esse fim, Bilge et al.225 determinaram a taxa de adulteraçao nas misturas de carne de porco, de frango e de vaca. Para determinar a adulteraçao de miudezas em carne bovina, Casado-Gavalda et al.226 usaram a LIBS para análise quantitativa do teor de Cu em amostras de carne processada, enriquecida com fígado bovino. Dixit et al.227 detectaram adulteraçao de carne bovina com rim de boi. Os produtos derivados do leite também sao alvos de adulteraçoes, principalmente pela sua importância econômica. Bilge et al.212 avaliaram quantitativamente a adulteraçao de soro em pó em leite em pó, usando LIBS associada a ferramentas quimiométricas. Moncayo et al.128 detectaram a presença de melamina no leite. A adulteraçao também é um problema que acomete a indústria de óleos vegetais. Para este fim, Caceres et al.228 usando LIBS combinada com ANN, propuseram um método para identificaçao, controle de qualidade, rastreabilidade e detecçao de adulteraçao em azeites extra virgem. A LIBS também foi empregada para avaliar a adulteraçao de açafrao com alguns adulterantes como cártamo, cravo-de-defunto e cúrcuma. As aplicaçoes da LIBS na análise de alimentos extrapolaram suas aplicaçoes para além das características acima mencionadas, e vêm sendo utilizadas para avaliaçao da origem geográfica de produtos alimentícios. Nesse seguimento, Moncayo et al.229 usaram a LIBS em combinaçao com a quimiometria para classificar amostras de vinhos tintos com base em sua origem geográfica. Ambiental Nos últimos anos, aproximadamente 15% das publicaçoes com LIBS foram destinadas à análise de amostras ambientais. Grande parte dessas publicaçoes estao voltadas para a determinaçao de contaminantes em água e solos.148,230 No que se refere à análise de água (amostras líquidas) por LIBS, as dificuldades sao potencializadas, como já discutido na seçao "preparo de amostras". No trabalho proposto por Sobral et al.56 um método para determinaçao de Hg, Cd e Pb em águas contaminadas foi proposto com sucesso. Os LOD obtidos para as amostras analisadas na forma líquida foram de 21, 7, e 12 mg L-1; em comparaçao aos LOD para amostras analisadas na forma sólida (os autores converteram a amostra líquida para sólida), estes foram de 4, 2 e 1 mg L-1, respectivamente. Os altos valores de LOD apresentados pela LIBS limitam a sua aplicaçao na determinaçao de contaminantes em amostras de água, impossibilitando o desenvolvimento de métodos sensíveis que atendam às exigências dos órgaos reguladores. A fim de contornar essa limitaçao, alguns trabalhos têm utilizado com sucesso métodos de pré-concentraçao. Em um trabalho recente, proposto por Carvalho et al.231 a pré-concentraçao foi usada para separar espécies de Cr (III) e Cr (VI). A estratégia foi aplicada em amostras de água de abastecimento público e os LOD obtidos estavam abaixo do estabelecido pelo Conselho Nacional do Meio Ambiente (CONAMA), que sao de 1 mg L-1 para Cr (III) e 0,1 mg L-1 para Cr (VI). Nessa mesma abordagem, Ruiz et al.232 usaram a extraçao em fase sólida para a pré-concentraçao simultânea de Cd, Cr, Mn, Ni, Pb e Zn em amostras de água. Os autores usaram o grafeno como material adsorvente e o método proposto foi aplicado com sucesso. Além disso, os valores de LOD mostraram-se adequados atendendo às exigências dos órgaos reguladores. Diante do exposto, é possível observar que as estratégias de pré-concentraçao podem ser uma alternativa viável para a análise de amostras ambientais por LIBS. Além disso, essa estratégia elimina possíveis efeitos de matriz, o que é muito atraente em determinaçoes por LIBS. Para determinaçao de contaminantes em solos, a LIBS vem sendo utilizada com bastante êxito, contudo, as concentraçoes normalmente estao na faixa de mg kg-1. Nesse sentido, Sirven et al.233 determinaram Cr em solos contaminados e as concentraçoes encontradas estavam entre 62 e 560 mg kg-1. Santos et al.50 desenvolveram um método para determinaçao de Cd na faixa de mg kg-1 em amostras de solos. Em trabalho proposto por Pandhija et al.234 a CF-LIBS foi utilizada como estratégia de calibraçao para determinaçao de Cd, Co, Pb, Zn e Cr em amostras de solos da India. Mukhono et al.235 exploraram as ferramentas quimiométricas para reduzir complexidade dos espectros LIBS, visando à determinaçao Cr e Pb em amostras de solos. Como estratégia de calibraçao, as ANN e PLS foram empregadas com sucesso. Recentemente, Zaytsev et al.236 avaliaram diferentes estratégias de calibraçao (univariada e multivariada) para posterior determinaçao de Pb. Segundo os autores, houve uma boa concordância entre os valores de concentraçao previstos pela LIBS e pela técnica de referência ICP OES. Além disso, o método proposto apresentou LOD da ordem de 13 mg kg1 e mostrou-se adequado para determinaçao de Pb em solos. Em trabalho proposto por Yi et al.237 foi realizada a determinaçao de Cd e Pb em solos. Nesse trabalho, foi proposto um método simples de pré-tratamento de amostras denominado transformaçao sólido-líquido-sólido. Por este método, metais potencialmente tóxicos disponíveis foram extraídos do solo através de extraçao ultrassônica e, em seguida, depositados em uma lâmina de vidro. Utilizando este método de transformaçao sólido-líquido-sólido, os elementos de Cd e Pb disponíveis no solo foram detectados com sucesso. Biológicas e farmacêuticas A versatilidade da LIBS amplia sua aplicaçao no campo das ciências biológicas e farmacêuticas. A combinaçao entre LIBS e ciências biológicas tem sido comumente chamada pela comunidade científica de bio-LIBS.148 As aplicaçoes biológicas em LIBS sao principalmente de natureza qualitativa, mas também ocorrem análises quantitativas. A aplicaçao da bio-LIBS estende-se a uma ampla variedade de amostras como, sangue,158cabelo,238 unhas,239 fígado de pacientes com mal de Wilson,240 urina,241 e dentes.242 O grande potencial da LIBS nesse campo é que nao é necessário nenhum conhecimento prévio sobre as sequências de ácido nucléico ou anticorpos contra antígenos bacterianos conhecidos, em contraste com as técnicas de diagnóstico clínico estabelecidas. Além disso, pouca ou nenhuma preparaçao de amostra é necessária.148 Nesse sentido, Gaudiuso et al.243 usaram a bio-LIBS para identificaçao de câncer de pele (melanoma) utilizando amostras de sangue provenientes de camundongos saudáveis e doentes. Os autores adquiriram os espectros usando um instrumento LIBS com laser de femto segundos. As intensidades de emissao obtidas para ambas as amostras de sangue foram submetidas a diferentes substratos e testadas com métodos de classificaçao. A combinaçao entre o substrato e o modelo de classificaçao mais adequado permitiu aos autores discriminar, com até 96 % de exatidao, as amostras de sangue dos camundongos saudáveis e doentes. O campo de atuaçao da bio-LIBS ampliou-se para a identificaçao de patógenos, como bactérias e vírus. Uma das principais vantagens no uso da bio-LIBS para identificaçao de patógenos é que os espectros de emissao obtidos nao sofrem alteraçoes com o passar do tempo, diferentemente das culturas bacterianas e virais.148 Nos trabalhos de Putnam et al.244 e Manzoor et al.245 a bio-LIBS foi usada com sucesso para identificar bactérias patógenas e nao patógenas, além de cepas resistentes à drogas, como a Staphylococcus aureus e outras cepas que causam infecçoes hospitalares. Entretanto, os autores nao dao detalhes sobre a especificidade dos métodos propostos, pois a mesma linha de emissao pode ser associada ao patógeno e também aos constituintes da amostra. A bio-LIBS também vem sendo usada para identificaçao de infecçoes provenientes de fungos, como a Candidíase. Nesse sentido, Manzoor et al.246 propuseram um método para discriminar diferentes espécies de Candida a partir de uma variedade de cepas utilizando LIBS em combinaçao com ANN. Dessa forma, foi possível identificar e discriminar com sucesso 21 variedades de cepas, sem falsos positivos ou falsos negativos. Em trabalho proposto por Almessiere et al.157 um novo método para a identificaçao de pessoas com deficiência de vitamina D foi desenvolvido e apresentou boa exatidao. Unhas de pacientes previamente identificados com a deficiência foram analisadas por LIBS. A partir das linhas de emissao, foi possível obter uma correlaçao entre a deficiência de vitamina D e a intensidade de alguns elementos. As linhas de K apresentaram alta correlaçao com a deficiência de vitamina D. Já o Ca e Mg mostraram baixa correlaçao com a deficiência de vitamina D. Uma outra aplicaçao biológica da LIBS muito relevante foi reportada por Davari et al.247 na qual os autores desenvolveram um método analítico para a análise in vitro de células intersticiais valvares (VICs), visando à determinaçao de Ca nos diferentes estágios de sua deposiçao na artéria aorta (doença conhecida como calcificaçao da aorta). Os autores observaram uma excelente correlaçao entre os resultados obtidos a partir de um ensaio bioquímico e aqueles do método proposto. A LIBS também é aplicada para a análise de fármacos, bem como de sua matéria-prima. Nesse sentido, Anzano et al.248 desenvolveram dois métodos rápidos para identificaçao e caracterizaçao de diferentes analgésicos em comprimidos, com excelente correlaçao entre os espectros obtidos para os comprimidos e os espectros de referência provenientes de uma biblioteca de espectros, e também a partir da calibraçao realizada por meio das razoes C:C2:H:N:O, cujos sinais foram obtidos pela ablaçao de uma variedade de comprimidos. Já Myakalwar et al.161 e Tiwari et al.249 utilizaram a LIBS em combinaçao com ferramentas quimiométricas para a identificaçao e classificaçao de comprimidos, visando ao aumento da velocidade no processo de controle de qualidade das indústrias farmacêuticas. Em trabalho proposto por Carvalho et al.159 as concentraçoes de macro (Ca, Mg e P) e microelementos (Cu, Fe, Mn e Zn) foram determinadas em comprimidos farmacêuticos. Os valores previstos pela LIBS estavam em concordância com aqueles obtidos pela técnica de referência usando ICP OES. Dubey et al.250 utilizaram a LIBS na proposiçao de um método para análise de diferentes revestimentos de comprimidos. A LIBS também foi explorada com sucesso para análise de amostras líquidas farmacêuticas, no qual os autores associaram a microextraçao líquido-líquido dispersiva (DLLME) para a determinaçao de V e Mo com a obtençao de sinais pela LIBS. Os autores reportaram uma melhora significativa da sensibilidade e diminuiçao dos efeitos de matriz.160 Forense A rapidez da análise, manutençao da integridade da amostra e a capacidade de fornecimento de informaçoes espectrais com a finalidade de classificaçao e/ou identificaçao sao características atraentes da LIBS. Assim, a ampliaçao das suas aplicaçoes para análise de amostras forense é uma questao natural. Amostras de caráter forense sao comumente oriundas de investigaçoes de fraudes, de esforços antiterrorismo ou de atividades após grandes desastres.148 Utilizando todas as vantagens proporcionadas pela LIBS, Cahoon et al.251 realizaram a caracterizaçao de fragmentos de vidros provenientes de cenas de crime, de modo que, nesse caso, os autores comprovaram que a irradiância do laser de 266 nm é a mais adequada para promover o acoplamento laser-amostra. Nos trabalhos propostos por Lucia e Gottfried163 e Gottfried,252 foram desenvolvidos métodos para a detecçao e classificaçao de explosivos. A LIBS também foi empregada com sucesso durante investigaçoes forenses para a discriminaçao de diferentes tipos de papel e tinta usados em impressoes digitais,253 de tintas usadas para escrita.254 Além disso, também foi usada para diferenciar papéis e tintas de canetas de acordo com sua composiçao química255 e para identificaçao da origem de charutos artesanais.256 A LIBS também foi aplicada para avaliar a veracidade de documentos de identificaçao, como passaportes e identidades.257 Recentemente, Yang e Yoh258 usaram a LIBS para análise de impressoes digitais sobrepostas, visando à sua separaçao e classificaçao utilizando ferramentas quimiométricas. Nesse estudo, os autores obtiveram os espectros referentes à composiçao química das impressoes digitais de indivíduos em cenas de crime e, após classificaçao, conseguiram reconstruir essas impressoes digitais utilizando análise estatística multivariada para estimar a sequência de tempo na qual uma impressao digital foi marcada. Em outro trabalho, Yang e Yoh90 também reconstruíram impressoes digitais de indivíduos em cenas de crime a partir de impressoes digitais sobrepostas, empregando os espectros obtidos por LIBS e ferramentas quimométricas. Marín-Roldan et al.107 analisaram tecidos e músculos humanos para discriminar indivíduos post-mortem, bem como o intervalo post-mortem dos mesmos em cenas de crimes e desastres naturais. E em outra abordagem, a partir de fragmentos de dentes e ossos humanos, Moncayo et al.259 desenvolveram um método analítico simples, rápido e nao destrutivo, combinando LIBS e quimiometria para discriminar e classificar restos cadavéricos de vítimas de desastres. A possibilidade de análise in situ e a obtençao do perfil de profundidade de uma amostra foram características importantes no desenvolvimento de um método descrito por Choi e Yoh260 para a obtençao de informaçoes químicas em resíduos de combustao por LIBS, após um incêndio premeditado. Os autores concluíram que os espectros obtidos a partir dos resíduos do incêndio e a espessura da camada de carbono das amostras queimadas trazem informaçoes químicas que podem auxiliar investigaçoes relacionadas a incêndios criminosos. Em outra abordagem, Bhatt et al.261 analisaram material nuclear e radiológico, visando a contribuir com o monitoramento e a segurança destes. Os autores conseguiram determinar a concentraçao de urânio em minérios e o uso da PCA possibilitou a classificaçao das amostras quanto a sua origem mineralógica. Uma outra aplicaçao relevante da LIBS na área forense foi chamada de iForenLIBS, tecnologia desenvolvida por Doña-Fernández et al.262 para analisar in situ partículas de resíduos de disparos que sao projetadas aleatoriamente na cena do crime, a partir da determinaçao simultânea de Pb, Ba e Sb, com aquisiçao dos resultados em tempo real. Metalurgia A LIBS é uma ferramenta atrativa para a análise de produtos advindos da indústria metalúrgica, e vem se tornando uma técnica promissora devido as suas características peculiares.43,149 Nesse contexto, as ferramentas quimiométricas têm ganhado destaque junto aos métodos analíticos desenvolvidos para análise de ligas metálicas e demais amostras relacionadas ao setor metalúrgico por LIBS. Dentre as principais amostras analisadas por LIBS estao as escórias, ligas e aços. Nesse sentido, Zhang et al.263 determinaram Al, Ca, Mg, Si e Ti em amostras de escória de minério usando LIBS e calibraçao multivariada. Na mesma perspectiva, Ahamer et al.264 determinaram diferentes óxidos em amostras de escória obtidas a partir da indústria de aço utilizando modelos de calibraçao multivariada e CF-LIBS. Kolmhofer et al.164 também analisaram escórias provenientes da produçao de aço empregando CF-LIBS e reportaram que a combinaçao entre a LIBS e essa estratégia de calibraçao é promissora, ressaltando a adequabilidade desse método para análise de amostras complexas. Nas indústrias de ferro e aço, o monitoramento da composiçao elementar em amostras de aço é importante para assegurar a qualidade na produçao, por isso o uso da LIBS foi uma alternativa adequada no desenvolvimento de um método analítico para análise in situ de amostras de aço fundido para determinaçao de Cr, Mn, Ni, Si e V usando modelos PLS.265 Além dos constituintes inorgânicos comumente determinados em aço, a LIBS também apresenta potencial para a determinaçao de elementos nao metálicos, como o S e P.266 Lin et al.267 propuseram dois métodos para classificaçao de aço usando LIBS e ferramentas quimiométricas: no primeiro, os autores empregaram PLS e, no segundo, support vector machine (SVM). Além disso, os autores utilizaram o algoritmo SVM de least squares (LSSVM) para melhorar a identificaçao das classes de aço, conferindo posteriormente identificaçao com 100 % de acerto quando a combinaçao LIBS e LSSVM foi empregada para identificaçao de amostras de aço de composiçao similar. Castro e Pereira-Filho43 propuseram a análise direta de ligas metálicas e aço empregando modelos de regressao univariada e multivariada para a determinaçao de Al, Cr, Cu, Fe, Mn, Mo, Ni, Ti, V e Zn, e a proposiçao de modelos de classificaçao para a discriminaçao das amostras. Ligas de alumínio,165 aço,266 aço de liga leve,268 ligas de Ge/Si269 também foram analisadas diretamente por LIBS para a quantificaçao de constituintes inorgânicos. He et al.270 empregaram a LIBS e um laser-ablation spark-induced breakdown spectroscopy (LA-SIBS), ambos com laser de femto segundos, para determinaçao de Cr, Mn, Mg e Cu em ligas de alumínio. Nesse método, os autores conseguiram melhorar significativamente a precisao dos resultados e a alta frequência de amostragem. Em todos esses trabalhos reportados, a LIBS foi efetiva para a quantificaçao dos analitos, de forma direta, rápida e sem interferências (espectrais ou de matriz), o que sao aspectos importantes a serem considerados pelo setor metalúrgico, visando a um controle de qualidade eficiente e rápido (em tempo real) dos seus produtos. Resíduos eletrônicos Os resíduos de equipamentos elétrico e eletrônico (REEE) sao compostos basicamente por ferro/aço, polímeros, retardantes de chama (FR), metais nao ferrosos, vidro e PCB.271-273 Dentre os componentes do REEE mencionados, os polímeros e as PCB respondem por cerca de 21 e 4% da fraçao total, respectivamente.274-276 Esses materiais sao reaproveitáveis, e nesse sentido, existem vários trabalhos na literatura que usam a LIBS como ferramenta para análise preliminar de REEE, visando à destinaçao adequada desses materiais. Contudo, essas análises estao restritas majoritariamente aos polímeros e em alguns casos têm sido aplicadas às PCB. Essa discrepância, pode ser observada em termos de números de trabalhos publicados com o tema. De acordo com a base de dados da Web of Science, desde 1998, quando se deram as primeiras publicaçoes com o tema, cerca de 75 trabalhos já foram publicados. Deste montante, os polímeros respondem por 90% das publicaçoes e as PCB por 10%. Essa temática tem despertado o interesse de grupos de pesquisa e recentemente foi publicada a primeira revisao com tema.5 Neste tópico nós apresentaremos as principais contribuiçoes e os mais recentes avanços da LIBS na análise direta de REEE, visando ao desenvolvimento de métodos analíticos rápidos e confiáveis que contribuam para o reaproveitamento desses materiais, com ênfase nos polímeros. A identificaçao e classificaçao de materiais poliméricos por LIBS é uma tarefa desafiadora, devido a alguns fatores como: (i) composiçao química similar; (ii) os FR podem ser adicionados em diferentes concentraçoes; (iii) em alguns casos os polímeros sao misturados para formarem as blendas; (iv) a grande variedade de polímeros encontradas no REEE (até 15 tipos diferentes), sendo os mais comuns, o acrinolitrila-butadieno-estireno (ABS), poliestireno (PS), polietileno (PE), policarbonato (PC), poliamida (PA), polipropileno (PP) e as blendas constituídas por PC/ABS.5,277 Alguns grupos de pesquisa têm contornado esses desafios usando ferramentas quimiométricas para a interpretaçao dos dados, e os resultados têm sido promissores. Muitos trabalhos têm demonstrado que é possível usar todo o espectro LIBS associado às ferramentas quimiométricas, a fim de identificar e classificar diferentes polímeros.5 Um dos primeiros trabalhos na análise de polímeros por LIBS foi proposto por Sattman et al.278 Nesse trabalho, os autores combinaram as ANN com os espectros LIB S para discriminar com exatidao PP, PE, polietileno tereftalato (PET) e o policloreto de polivinila (PVC). Em trabalho proposto por Anzano et al.279 cinco tipos de polímeros foram discriminados usando apenas a correlaçao entre os espectros LIBS. Nesse sentido, Lasheras et al.280 usaram o espectro LIBS associado ao methods of normalized coordinates (MNC) para a identificaçao de 11 polímeros de diferentes composiçoes químicas. Já Unnikrishnan et al.281 usaram diferentes regioes dos espectros LIBS associadas a PCA para classificar quatro diferentes tipos de polímeros. Aquino e Pereira-Filho282 analisaram polímeros provenientes de carcaça de celular e usaram as ferramentas quimiométricas SIMCA, KNN e PLS-DA para propor modelos de classificaçao, a fim de identificar as amostras a partir do fabricante e país de origem. No entanto, em alguns casos, os polímeros nao podem ser identificados diretamente apenas observando o espectro original da LIBS. Assim, sao necessárias informaçoes sobre a emissao de bandas moleculares e a razao das mesmas com linhas de emissao de um dado elemento da constituiçao original do polímero. Essa estratégia foi proposta inicialmente por Anzano et al., para identificaçao qualitativa PET, PS e PVC, e posteriormente foi aprimorada por outros grupos de pesquisas.283-285 De acordo Grégoire et al.286 é possível distinguir os polímeros aromáticos (PS e PC) dos polímeros alifáticos (PE, PP e PA), usando somente as linhas e banda de emissao (C2, CN, H, C, N e O), e as razoes entre linhas de emissao e banda molecular (H/C2, H/C and O/N). Em trabalho proposto por Costa et al.44 diferentes razoes entre linhas de emissao e bandas moleculares (C/H, C/C2, C/N, C/O, H/C2, H/N, H/O, C2/N, C2/O e O/N) foram usadas para identificar seis polímeros (ABS, PS, PC, PE, PP e PA). Modelos de classificaçao KNN e SIMCA foram usados para classificaçao. Ambos os modelos apresentaram resultados satisfatórios, com exatidao de 98% e 92% para o KNN e SIMCA, respectivamente. Adicionalmente, 15 amostras de polímeros desconhecidas foram analisadas pelos modelos propostos e pela técnica de referência differential scanning calorimetry (DSC), e os resultados apresentados pelos modelos SIMCA e KNN estavam coerentes com aqueles obtidos pelo DSC. Um estudo recente ampliou as potencialidades da LIBS, para além da identificaçao e classificaçao de polímeros. Em trabalho proposto por Costa et al.287 um novo método de análise direta por LIBS, para quantificaçao de PC e ABS em suas blendas (PC/ABS), foi aplicado com sucesso. Inicialmente, foram construídos modelos de calibraçao multivariada usando PLS. Os modelos PLS foram obtidos a partir de um conjunto de 11 padroes com diferentes concentraçoes de PC/ABS (m/m%). O método proposto foi aplicado em 33 amostras de PC/ABS provenientes de diferentes equipamentos eletrônicos. Adicionalmente, as amostras também foram analisadas por técnica de referência usando a DSC e os resultados apresentados corroboraram aqueles previstos pelos modelos PLS. A fim de avaliar a robustez dos modelos, amostras de PE, PP e PS também foram analisadas. O objetivo foi avaliar se os modelos eram sensíveis para descriminar outras amostras que nao fossem PC/ABS. Os modelos PLS previram valores inconsistentes variando de -19 a 171 m/m%. Assim, os modelos propostos mostraram-se robustos e eficientes. Além da identificaçao de polímeros e da quantificaçao de constituintes em blendas poliméricas, alguns trabalhos têm usado a LIBS para determinar FR principalmente a base de Sb. Nesse sentido, Aquino et al.129 propuseram um novo método para determinaçao de Sb em blendas de PC/ABS. Como estratégia de calibraçao, os autores usaram a adiçao de padrao, na qual o Sb foi incorporado nos padroes de PC/ABS. A faixa de concentraçao do Sb encontrada nas amostras variou de 0,15 a 0,68% m/m. Testes de adiçao de padrao foram realizados e as recuperaçoes variaram de 63 a 83%. Recentemente, Lazic et al.288 usaram LIBS para determinar Sb em diversos materiais plásticos. Como estratégia de calibraçao foi adotada a compatibilizaçao de matriz e um conjunto de amostras com concentraçoes conhecidas. A faixa de concentraçao encontrada nas amostras variou entre 0,14 a 6,5 % m/m. Como informado anteriormente, a LIBS também é usada para análise de PCB e alguns trabalhos têm sido desenvolvidos nesse sentido. Recentemente, Sperança et al.169 usaram a LIBS para analisar diretamente as máscaras de solda tipicamente comercializadas para produçao caseira de PCB. Carvalho et al.53 propuseram uma estratégia combinando LIBS e PCA para investigar a distribuiçao de 18 metais nas PCB provenientes de celular usando imagens hiperespectrais. Esse campo LIBS e PCB ainda é pouco explorado, no entanto a LIBS já tem se mostrado como uma poderosa ferramenta para rápida inspeçao química nesses tipos de amostras.
PERSPECTIVAS FUTURAS E CONCLUSAO A LIBS tem se desenvolvido rapidamente nos últimos anos e está se consolidando entre as técnicas modernas de espectrometria atômica. As referências bibliográficas citadas nesta revisao permitem observar os diversos campos de aplicaçao da técnica. Vale ressaltar que as aplicaçoes da LIBS nao estao restritas apenas às que foram apresentadas nesta revisao, e outras áreas como o patrimônio cultural,289 geoquímica,290 estudos de materiais nao terrestres291 e arqueologia292 têm sido alvo de aplicaçoes da LIBS. Ainda há diversos pontos específicos que devem ser aprimorados, principalmente no que diz respeito ao aumento da sensibilidade. Nesse sentido, já existem diversas propostas principalmente empregando estratégias de pré-concentraçao, e também destacamos a utilizaçao de nanopartículas para o aumento da sensibilidade em LIBS, cuja primeira revisao foi publicada em 2018 por Dell'Aglio et al.293 Em relaçao às análises quantitativas, diversos avanços podem ser notados, principalmente no desenvolvimento de novas estratégias de calibraçao menos susceptíveis aos efeitos de matriz. Como já destacado neste texto, umas das características muito atraentes da LIBS é a possibilidade de analise in situ e, com esse objetivo, nos últimos anos diversas propostas de equipamentos portáteis foram desenvolvidas com sucesso, mostrando que o futuro da técnica caminha para a expansao das análises in situ. Além disso, já existem novas tecnologias para desenvolvimentos de sistema em linhas em processos industriais principalmente para análise de materiais recicláveis e plásticos.294 A combinaçao da LIBS com outras técnicas analíticas pode trazer resultados que se complementam, permitindo a obtençao de informaçoes mais precisas e exatas. Também é possível notar que a LIBS e a quimiometria caminham cada vez mais juntas, e a tendência para os próximos anos é que as ferramentas quimiométricas consolidem-se entre os grupos de pesquisa que utilizam a LIBS. Por fim, esperamos que essa revisao sirva de material base para os interessados na análise direta de amostras sólidas por LIBS. Além disso, acreditamos que esse material será útil para introduzir conceitos de LIBS em cursos de graduaçao, apresentando as potencialidades da técnica. Nos cursos de graduaçao esses conceitos poderiam ser apresentados em disciplinas de análise instrumental.
AGRADECIMENTOS Os autores agradecem à Fundaçao de Amparo à Pesquisa do Estado de Sao Paulo (FAPESP, bolsas 2014/11415-0, 2016/01513-0, 2016/17304-0 e 2016/17221-8), Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq, 401074/2014-5, 305637/2015-0, 141311/2017-7, 150517/2017-0 e 160152/2015-1), ao Programa Nacional de Bolsas de Pós-Doutorado (PNPD) e a Coordenaçao de Aperfeiçoamento de Pessoal de Nível Superior - Brasil (CAPES) - Código de Financiamento 001.
REFERENCIAS 1. Zagatto, E. A. G.; Sá, S. M. O.; J. Braz. Chem. Soc. 2003, 14, 153. 2. Rocha, F. R. P.; Pereira-Filho, E. R.; Nóbrega, J. A.; J. Braz. Chem. Soc. 2009, 20, 1759. 3. Reisch, M. S.; Chem. Eng. News 2018, 26, 20. 4. Nascentes, C. C.; Korn, M. G. A.; Zanoni, M. V. B.; Quim. Nova 2017, 6, 643. 5. Costa, V. C.; Castro, J. P.; Andrade, D. F.; Babos, D. V.; Garcia, J. A.; Sperança, M. A.; Catelani, T. A.; Pereira-Filho, E. R.; Trends Analyt. Chem. 2018, 108, 65. 6. Einstein, A.; Phys. Z. 1917, 18, 121. 7. Cremers, D. A.; Radziemski, L. J.; Handbook of Laser-Induced Breakdown Spectroscopy. Ed. John Wiley & Sons Ltd: Chichester, 2006. 302p. 8. Maiman, T. H.; Nature, 1960, 187, 493. 9. Javan, A.; Bennett, W. R.; Herriott, D. R.; Phys. Rev. Lett. 1961, 6, 106. 10. Geusic, J. E.; Marcos, H. M.; Van Uitert, L. G.; Phys. Lett. 1964, 4, 182. 11. Brech, F.; Cross, L.; Appl. Spectrosc. 1962, 16, 59. 12. Debras-Guedon, J.; Liodec, N.; C. R. Acad. Sci. 1963, 257, 3336. 13. Maker, P. D.; Terhune, R. W.; Savage, C. M.; Proceedings of Third International Conference on Quantum Electronics, Paris, France, 1964. 14. Runge, E. R.; Minck, R. W.; Bryan, F. R.; Spectrochim. Acta, Part B 1964, 20, 733. 15. Zel’dovich, Y. B.; Raizer, Y. P.; Soviet Physics 1965, 20, 772. 16. Moenke, H.; Moenke-Blankenburg, L.; Laser MicroSpectrochemical Analysis, Crane, Russak & Co: New York, 1973, cap. 2. 17. Young, M.; Hercher, M.; Yu, C. Y.; Appl. Phys. 1966, 37, 4938. 18. Radziemski, L. J.; Spectrochim. Acta, Part B 2002, 57, 1109. 19. Radziemski, L. J.; Loree, T. R.; Cremers, D. A.; Hoffman, N. M.; Anal. Chem. 1983, 55, 1246. 20. Baudelet, M.; Smith, B. W.; J. Anal. At. Spectrom. 2013, 28, 624. 21. Moenke-Blankenburg, L.; Schumann, T.; Nolte, J.; J. Anal. At. Spectrom. 1994, 9, 1059. 22. Russo, R. E.; Mao, X. L.; Liu, H. C.; Gonzalez, J.; Mao, S. S.; Talanta 2002, 57, 425. 23. Dong, M; Oropeza, D.; Chirinos, J.; Gonzalez, J. J.; Lu, J.; Mao, X.; Russo, R. E.; Spectrochim. Acta, Part B 2015, 109, 44. 24. Bonta, M.; Gonzalez, J. J.; Quarles Jr, C. D., Russo, R. R.; Hegedus, B.; Limbeck, A.; J. Anal. At. Spectrom. 2016, 31, 252. 25. Pasquini, C.; Cortez, J.; Silva, L. M. C.; Gonzaga, F. B.; J. Braz. Chem. Soc. 2007, 18, 463. 26. Cremers, D. A.; Radziemski, L. J.; Handbook of Laser-Induced Breakdown Spectroscopy, 2nd ed., 2013. 27. Noll, R.; Laser-Induced Breakdown Spectroscopy. Fundamentals and Applications, Springer: Aachen, 2012. 28. Musazzi, S., Perini, U.; Laser-Induced Breakdown Spectroscopy theory and applications, Springer Verlag: Berlin-Heidelberg, 2014, 565 p. 29. Holler, J.; Skoog, D. A.; Crouch, S. R.; Princípios de Análise Instrumental, 6ª ed., Ed. Bookman: Porto Alegre, 2009. 30. Singh, J.; Thakur, S. N.; Laser-Induced Breakdown Spectroscopy, Elsevier: Germany, 2007. 31. Svelto, O.; Principles of Lasers, 5th ed., Springer: New York, 2010. 32. Demtröder, W; Laser Spectroscopy. Vol. 1: Basic Principles, 4th ed., Ed. Springer: Berlim, 2008, 235p. 33. Chichkov, B. N.; Momma, C.; Nolte, S.; Von Alvensleben, F.; Tunnermann. A.; Appl. Phys. A. Mater. Sci. Process. 1996, 63, 109. 34. Labutin, T. A.; Ledned, V. N.; Ilyin, A. A.; Popov, A. M.; J. Anal. At. Spectrom., 2016, 31, 90. 35. Telle, H. H.; Ureña, A. G.; Donovan, R. J.; Laser chemistry: spectroscopy, dynamics and applications, John Wiley & Sons Ltd: Chichester, 2007, 156p. 36. Miziolek, A. W.; Palleschi, V.; Schechter, I.; Laser-Induced Breakdown Spectroscopy (LIBS): Fundamentals and Applications, Cambridge University Press: New York, 2006. 37. Bauer, H. E.; Leis, F.; Niemax, K.; Spectrochim. Acta, Part B 1998, 53, 1815. 38. Haisch, C.; Panne, U.; Niessner, R.; Spectrochim. Acta, Part B 1998, 53, 1657. 39. Jantzi, S. C.; Motto-Ros, V.; Trichard, F.; Markushin, Y.; Melikechi, N.; De Giacomo, A.; Spectrochim. Acta, Part B 2016, 115, 52. 40. Krug, F. J.; Rocha, F. R. P.; Métodos de preparo de amostras. Fundamentos sobre o preparo de amostras orgânicas e inorgânicas para análise elementar, EditSBQ: Sao Paulo, 2016. 41. Jull, H.; Kunnemeyer, R.; Schaare, P.; Precision Agriculture 2018, 19, 823. 42. Cahoon, E. M.; Almirall, J. R.; Appl. Opt. 2010, 49, 49. 43. Castro, J. P; Pereira-Filho, E. R.; J. Anal. At. Spectrom. 2016, 31, 2005. 44. Costa, V. C.; Aquino, F. W. B.; Paranhos, C. M.; Pereira-Filho, E. R.; Polym. Test. 2017, 59, 390. 45. Sperança, M. A.; Aquino, F. W. B.; Fernandes, M. A.; Lopez-Castillo, A.; Carneiro, R. L.; Pereira-Filho, E. R.; Geostand. Geoanal. Res. 2016, 41, 273. 46. Figueiredo, C. M.; Castro, J. P.; Sperança, M. A.; Fialho, L. L.; Nóbrega, J. A.; Pereira-Filho, E. R.; J. Braz. Chem. Soc. 2018, 29, 680. 47. Babos, D. V.; Virgilio, A.; Costa, V. C.; Donati, G. L.; Pereira-Filho, E. R.; J. Anal. At. Spectrom. 2018, 33, 1753. 48. Costa, V. C.; Amorim, F. A. C.; Babos, D. V.; Pereira-Filho, E. R.; Food Chem. 2019, 273, 91. 49. Augusto, A. S.; Barsanelli, P. L.; Pereira, F. M. V.; Pereira-Filho, E. R.; Food Res. Int. 2017, 94, 72. 50. Santos, Jr. D.; Nunes, L. C.; Trevizan, L. C.; Godoi, Q.; Leme, F. O.; Braga, J. W. B.; Krug, F. J.; Spectrochim. Acta, Part B 2009, 64, 1073. 51. Gondal, M. A.; Hussain, T.; Yarnani, Z. H.; Baig, M. A.; Talanta 2007, 72, 642. 52. Peruchi, L. C.; Nunes, L. C.; Carvalho, G. G. A.; Guerra, M. B. B.; Almeida, E.; Rufini, I. A.; Santos, D.; Krug, F. J.; Spectrochim. Acta, Part B 2014, 100, 129. 53. Carvalho, R. R. V.; Coelho, J. A. O.; Santos, J. M.; Aquino, F. W. B.; Carneiro, R. L.; Pereira-Filho, E. R.; Talanta 2015, 134, 278. 54. Silva, M. J.; Cortez, J.; Pasquini, C.; Honorato, R. S.; Paim, A. P. S.; Pimentel, M. F.; J. Braz. Chem. Soc. 2009, 20, 1887. 55. Harun, H. A.; Zainal, R.; J. Nonlinear Opt. Phys. Mater. 2018, 27, 1850023. 56. Sobral, H.; Sanginés, R.; Trujillo-Vázquez, A.; Spectrochim. Acta, Part B 2012, 78, 62. 57. Lee, D. H.; Han, S. C.; Kim, T. H.; Yun, J. I.; Anal. Chem. 2011, 83, 9456. 58. Sarkar, A.; Aggarwal, S. K.; Alamelu, D.; Anal. Methods. 2010, 2, 32. 59. Yang, X.; Hao, Z.; Li, C.; Li, J.; Yi, R.; Shen, M.; Li, K.; Guo, L.; Li, X.; Lu, Y.; Opt. Express 2016, 24, 13410.60. Yaroshchyk, P.; Morrison, R. J.; Body, D.; Chadwick, B. L.; Spectrochim. Acta, Part B 2005, 60, 986. 61. Terán, E.J; Montes, M. L.; Rodríguez, C.; Martino, L.; Quiroga, M.; Landa, R.; Torres Sánchez, R. M.; Días Pace, D. M.; Microchem. J. 2019, 144, 159. 62. Papai, R.; Sato, R. H.; Nunes, L. H.; Krug, F. J.; Gaubeur, I.; Anal. Chem. 2017, 89, 2807. 63. Lin, Q.; Han, X.; Wang, J.; Wei, Z.; Liu, K.; Duan, Y.; J. Anal. At. Spectrom. 2016, 31, 1622. 64. Andrade, D. F.; Sperança, M. A.; Pereira-Filho, E. R.; Anal. Methods 2017, 9, 5156. 65. Sperança, M. A.; Andrade, D. F.; Castro, J. P.; Pereira-Filho, E. R.; Opt Laser Technol. 2019, 109, 648. 66. Hohreiter, V.; Hahn, D. W.; Anal. Chem. 2005, 77, 1118. 67. Sturm, V.; Noll, R.; Appl. Opt. 2003, 42, 6221. 68. Zhang, T.; Tang, H.; Li, H.; J. Chemom. 2018, 11, 2983. 69. Novaes, C. G.; Yamaki, R. T.; De Paula, V. F.; Júnior, B. B. N.; Barreto, J. A.; Valasques, G. S.; Bezerra, M. A.; Rev. Virtual Quim. 2017, 9, 1184. 70. Moncayo, S.; Manzoor, S.; Navarro-Villoslada, F.; Caceres, J. O.; Chemom. Intell. Lab. Syst. 2015, 146, 354. 71. Tognoni, E.; Cristoforetti, G.; Opt. Laser Technol. 2016, 79, 164. 72. Porizka, P.; Klus, J.; Hrdlicka, A.; Vrábel, J.; Skarková, P.; Prochazka, D.; Novotny, J.; Novotny, K.; Kaiser, J.; J. Anal. At. Spectrom. 2017, 32, 277. 73. Bro, R.; Smilde, A. K.; Anal. Methods. 2014, 6, 2812. 74. Porizka, P.; Klus, J.; Képes, E.; Prochazka, D.; Hahn, D. W.; Kaiser, J.; Spectrochim. Acta, Part B 2018, 148, 65. 75. Bezerra, M. A.; Ferreira, S. L. C.; Novaes, C. G.; Santos, A. M. P.; Valasques, G. S.; Cerqueira, U. M. F. M.; Alves, J. P. S.; Talanta 2019, 194, 941. 76. Pereira, F. M. V.; Pereira-Filho, E. R.; Quim. Nova 2018, 41, 1061. 77. Novaes, C. G.; Yamaki, R. T.; Nascimento, Jr. B. B.; Barreto, J. A.; Valasques, G. S.; Bezerra, M. A.; Rev. Virtual Quim. 2018, 10, 393. 78. Passari, L. M. Z. G.; Soares, P. K.; Bruns, R. R.; Quim. Nova 2011, 34, 888. 79. Pimentel, M. F.; Barros-Neto, B.; Quim. Nova 1996, 19, 268. 80. Fortunato, F. M.; Catelani, T. A.; Alfonso, M. S. P.; Pereira-Filho, E. R.; Anal. Sci. 2018. doi: 10.2116/analsci.18P286 81. Andrade, D. F.; Pereira-Filho, E. R.; Konieczynski, P.; J. Braz. Chem. Soc. 2017, 28, 838. 82. Nunes, L. C.; Da Silva, G. A.; Trevizan, L. C.; Santos Jr, D.; Poppi, R. J.; Krug, J. F.; Spectrochim. Acta, Part B 2009, 64, 565. 83. Nunes, L. C.; Braga, J. W. B.; Trevizan, L. C.; Souza, P. F.; Carvalho, G. G. A.; Santos Jr, D.; Poppi, R. J.; Krug, F. J.; J. Anal. At. Spectrom. 2010, 25, 1453. 84. Ferreira, E. C.; Anzano, J. M.; Milori, D. M. B. P.; Ferreira, E. J.; Lasheras, R. J.; Bonilla, B.; Montullibor, B.; Casas, J.; Martin-Neto, L.; Appl. Spectrosc. 2009, 63, 1081. 85. Andrade, D. F.; Pereira-Filho, E. R.; J. Agric. Food. Chem. 2016, 64, 7890. 86. Neiva, A. M.; Chagas, M. A. J.; Mello, M. A.; Esteves, S. N.; Pereira-Filho, E. R.; RSC Adv. 2016, 6, 104827. 87. Augusto, A. S.; Batista, E. F.; Pereira-Filho, E. R.; Anal. Methods 2016, 8, 5851. 88. Borba, F. S. L.; Cortez, J.; Asfora, V. K.; Pasquini, C.; Pimentel, M. F.; Pessise, A. M.; Khoury, H. J.; J. Braz. Chem. Soc. 2012, 23, 958. 89. Yang, J. H.; Yoh, J. J.; Appl. Spectrosc. 2018, 72, 1047. 90. Harmon, R. S.; Russo, R. E.; Hark, R. R.; Spectrochim. Acta, Part B 2013, 87, 11. 91. Guedes, W. N.; Pereira, F. M. V.; Microchem. J. 2018, 143, 331. 92. Chen, X.; Li, X.; Yu, X.; Chen, D.; Liu, A.; Spectrochim. Acta, Part B 2018, 139, 63. 93. Li, X.; Yang, S.; Fan, R.; Yu, X.; Chen, D.; Opt. Laser Technol. 2018, 102, 233. 94. Neiva, A. M.; Sperança, M. A.; Costa, V. C.; Chagas, M. A. J.; Pereira-Filho, E. R.; Environ. Monit. Assess. 2018, 190, 618. 95. Andrade, D. F.; Guedes, W. N.; Pereira, F. M. V.; Microchem. J. 2018, 137, 443. 96. Santos, M. C.; Dai, C.; Pereira, F. M. V.; J. Appl. Spectrosc. 2018, 85, 543. 97. Peña-Icart, M.; Pomares-Alfonso, M. S.; Aquino, F. W. B.; Alonso-Hernandez, C.; Bolaños-Alvarez, Y.; Pereira-Filho, E. R.; Anal. Methods 2017, 9, 3713. 98. Senesi, G. S.; Romano, R. A.; Marangoni, B. S.; Nicolodelli, G.; Villas-Boas, P. R.; Benites, V. M.; Milori, D. M. B. P.; J. Appl. Spectrosc. 2017, 84, 923. 99. Zhang, T.; Chunhua, Y.; Qi, J.; Tang, H.; Li, H.; J. Anal. At. Spectrom. 2017, 32, 1960. 100. Moncayo, S.; Duponchel, L.; Mousavipak, N.; Panczer, G.; Trichard, F.; Bousquet, B.; Pelascini, F.; Motto-Ros, V.; J. Anal. At. Spectrom. 2018, 33, 210. 101. Goméz-Nubla, L.; Aramendia, J.; De Vallejuelo, S. F-O.; Madariaga, J. M.; Microchem. J. 2018, 137, 392. 102. Safi, A.; Campanella, B.; Grifoni, E.; Legnaioli, S.; Lorenzetti, G.; Pagnotta, S.; Poggialini, F.; Ripoll-Seguer, L.; Hidalgo, M.; Palleschi, V.; Spectrochim. Acta, Part B 2018, 144, 46. 103. Romera, J. P. R.; Barsanelli, P. L.; Pereira, F. M. V.; Fuel 2016, 15, 473. 104. Braga, J. W. B.; Trevizan, L. C.; Nunes, L. C.; Rufini, I. A.; Santos Jr, D.; Krug, F. J.; Spectrochim. Acta, Part B 2010, 25, 1453. 105. Delgado, T.; Vadillo, J. M.; Laserna, J. J.; J. Anal. At. Spectrom. 2018, 33, 1469. 106. Aras, N.; Yalçin, S.; J. Anal. At. Spectrom. 2014, 29, 545. 107. Marin-Roldan, A.; Manzoor, S.; Moncayo, S.; Navarro-Villoslada, F.; Izquierdo-Hornillos, R. C.; Caceres, J. O.; Spectrochim. Acta, Part B 2013, 88, 186. 108. Moncayo, S.; Trichard, F.; Busser, B.; Sabatier-Vincent, M.; Pelascini, F.; Pinel, N.; Templier, I.; Charles, J.; Sancey, L.; Motto-Ros, V.; Spectrochim. Acta, Part B 2017, 133, 40. 109. Silva, T. V.; Hubinger, S. Z.; Neto, J. A. G.; Milori, D. M. B. P.; Ferreira, E. J.; Ferreira, E.C; Spectrochim. Acta, Part B 2017, 135, 29. 110. Vieira, A. L.; Silva, T. V.; Sousa, F. S. I.; Senesi, G. S.; Santos, Jr. D.; Ferreira, E. C.; Neto, J. A. G.; Microchem. J. 2018, 139, 322. 111. Millar, S.; Gottlieb, C.; Günther, T.; Sankat, N.; Wilsch,G.; Kruschwitz, S.; Spectrochim. Acta, Part B 2018, 147, 1. 112. Zhu, Z.; Li, J.; Guo, Y.; Cheng, X.; Tang, Y.; Guo, L.; Li, X.; Lu, Y.; Zeng, X.; J. Anal. At. Spectrom. 2018, 33, 205. 113. Yao, M.; Yang, H.; Huang, L.; Chen, T.; Rao, G.; Liu, M.; Appl. Opt. 2017, 56, 4070. 114. Motto-Ros, V.; Syvilay, D.; Bassel, L.; Negre, E.; Trichard, F.; Pelaschini, F.; El Haddad, J.; Harhira, A.; Moncoyo, S.; Picard, J.; Devismes, D.; Bouquest, B.; Spectrochim. Acta, Part B 2018, 140, 56. 115. Cabalín, M.; Mateo, M. P.; Laserna J. J.; Surf. Interface Anal 2003, 35, 263. 116. Ohta, T.; Ito, M.; Kotani, T.; Hattori, T.; Appl. Spectrosc. 2009, 63, 555. 117. Dixit, Y.; Casado-Gavalda, M. P.; Cama-Moncunill, R.; Cama-Moncunill, X.; Markiewicz Keszycka, M.; Jacoby, F.; Cullen, P. J.; Sullivan, C.; J. Food Eng. 2018, 216, 120. 118. Castro, J. P; Pereira-Filho, E. R.; Talanta 2018, 189, 205. 119. Syta, O.; Wagner, B.; Bulska, E.; Zielińska, D.; Żukowska, G. Z.; Gonzalez, J.; Russo, R.; Talanta 2018, 179, 784. 120. Senesi, G.S; Martin-Neto, L.; Villas-Boas, P. R.; Nicolodelli, G.; Milori, D. M. B. P.; J. Soils Sediments 2018, 18, 1292. 121. Yi, R. X.; Guo, L. B.; Zou, X. H.; Li, J. M.; Hao, Z. Q.; Yang, X. Y.; Li, X. Y.; Zeng, X. Y.; Lu, Y. F.; Opt. Express 2016, 24, 10233. 122. Carvalho, G. G. A.; Guerra, M. B. B.; Adame, A.; Nomura, C. S.; Oliveira, P. V.; Carvalho, H. W. P.; Santos Jr, D.; Nunes, L. C.; Krug, F. J.; J. Anal. At. Spectrom. 2018, 33, 919. 123. Gornushkin, I. B.; Völker, T.; Kazakov, A. Y.; Spectrochim. Acta, Part B 2018, 147, 149. 124. Cavalcanti, G. H.; Teixeira, D. V.; Legnaioli, S.; Lorenzetti, G.; Pardini, L.; Palleschi, V.; Spectrochim. Acta, Part B 2013, 87, 51. 125. Sezer, B.; Durna, S.; Bilge, G.; Berkkan, A.; Yetisemiyen, A.; Boyaci, I. H.; Int. Dairy J. 2018, 81, 1. 126. Hernández-García, R.; Villanueva-Tagle, M. E.; Calderón-Piñar, F.; Durruthy- Rodríguez, M. D.; Aquino, F. W. B.; Pereira-Filho, E. R.; Pomares-Alfonso, M. S.; Microchem. J. 2017, 130, 21. 127. Takahashi, T.; Thornton, B.; Spectrochim. Acta, Part B 2017, 138, 31. 128. Moncayo, S.; Manzoor, S.; Rosales, J.; Anzano, J.; Caceres, J.; Food Chem. 2017, 232, 322. 129. Aquino, F. W. B.; Paranhos, C. M.; Pereira-Filho, E. R.; J. Anal. At. Spectrom. 2016, 31, 1228. 130. Carvalho, G. G. A.; Moros, J.; Santos Jr., D.; Krug, F. J.; Laserna, J. J.; Anal. Chim. Acta 2015, 876, 26. 131. Austria Jr, E. S.; Fuentes, E. M.; Nuesca, G. M.; Lamorena, R. B.; Spectrochim. Acta, Part B 2017, 136, 1. 132. Leme, F. O.; Silvestre, D. M.; Nascimento, A. N.; Nomura, C. S.; J. Anal. At. Spectrom. 2018, 33, 1322. 133. Shirvani-Mahdavi, H.; Shafiee, P.; Meas. Sci. Technol. 2016, 27, 125502. 134. Yao, S.; Xu, J.; Baj, K.; Lu, J.; Plasma Sci. Technol. 2015, 938. 135. Morais, C. P.; Barros, A. I.; Santos Jr, D.; Ribeiro, C. A.; Crespi, M. S.; Senesi, G. S.; Gomes Neto, J. A.; Ferreira, E. C.; Microchem. J. 2017, 134, 370. 136. Sperança, M. A.; Pomares-Afonso, Pereira-Filho, E. R.; Anal. Methods 2018, 10, 533. 137. Carvalho, A. A. C.; Leme, F. O.; Luz, M. S.; Oliveira, P. V.; Nomura, C. S.; J. Anal. At. Spectrom. 2018, 33, 1243. 138. Ciucci, A.; Corsi, M.; Palleschi, V.; Rastelli, S.; Salvetti, A.; Tognoni, E.; Appl. Spectrosc. 1999, 53, 960. 139. Tognoni, E.; Cristoforetti, G.; Legnaioli, S.; Palleschi, V.; Spectrochim. Acta, Part B 2010, 65, 1. 140. Davari, S. A.; Hu, S.; Mukherjee, D.; Talanta 2017, 164, 330. 141. Suchonová, M.; Kristof, J.; Pribula, M.; Veis, M., Tabarés, F. L.; Veis, P.; Fusion Eng. Des. 2017, 117, 175. 142. Augusto, A. S.; Castro, J. P.; Sperança, M. A.; Pereira-Filho, E. R.; J. Braz. Chem. Soc. 2019, 30, 804. 143. Peng, J.; Liu, F.; Zhou, F.; Song, K.; Zhang, C.; Ye, L.; He, Y.; TrAC - Trends Anal. Chem. 2016, 85, 260. 144. Sezer, B.; Bilge, G.; Boyaci, I. H.; TrAC - Trends Anal. Chem. 2017, 97, 345. 145. Yu, X.; Li, Y.; Gu, Yang.; Bao, J.; Yang, H.; Sun, L.; Environ. Monit. Assess., 2014, 186, 8969. 146. Kaiser, J.; Novotny, K.; Martin, M. Z.; Hrdlicka, A.; Malina, R.; Hartl, M.; Adam, V.; Kizek, R.; Surf. Sci. Rep. 2012, 67, 233. 147. Busser, B.; Moncayo, S.; Coll, J. L.; Sancey, L.; Motto-Ros, V.; Coord. Chem. Rev. 2018, 358, 70. 148. Galbács, G.; Anal. Bioanal. Chem. 2015, 407, 7537. 149. Noll, R.; Fricke-Begemann, C.; Connemann, S.; Meinhardt, C.; Sturm, V.; J. Anal. At. Spectrom., 2018, 33, 945. 150. Nicolodelli, G.; Senesi, G. S.; Perazzoli, I. L. O.; Marangoni, B. S.; Benites, V. M.; Milori, D. M. B. P.; Sci. Total Environ., 2016, 565, 1116. 151. Tadini, A. M.; Nicolodelli, G.; Senesi, G. S.; Ishida, D. A.; Montes, C. R.; Lucas, Y.; Mounier, S.; Guimaraes, F. E. G.; Milori, D. M. B. P.; Sci. Total Environ. 2018, 613-614, 160. 152. Gondal, M. A.; Habibullah,Y. B.; Baig, U.; Oloore, L. E.; Talanta 2016, 152, 341. 153. Yang, P.; Zhou, R.; Zhang, W.; Yi, R.; Tang, S.; Guo, L.; Hao, Z.; Li, X.; Lu, Y.; Zeng, X.; Food Chem. 2019, 272, 323. 154. Temiz, H. T.; Sezer, B.; Berkkan, A.; Tamer, U.; Boyaci, I. H.; J. Food Compost. Anal. 2018, 67, 48. 155. Gaubeur, I.; Aguirre, M. A.; Kovachev, N.; Hidalgo, M.; Canals, A.; J. Anal. At. Spectrom. 2015, 30, 25. 156. Akhtar, M.; Jabbar, A.; Mehmood, S.; Ahmeda, N.; Ahmeda, R.; Baiga, M. A.; Spectrochim. Acta, Part B 2018, 148, 143. 157. Almessiere, M. A.; Altuwiriqi, R.; Gondal, M. A.; AlDakheel, R. K.; Alotai, H. F.; Talanta 2018, 185, 61. 158. Chen, X.; Li, X. H.; Yang, S. B.; Yu, X.; Liu, A. C.; Biomed. Opt. Express 2018, 9, 1057. 159. Carvalho, G. G. A.; Nunes, L. C.; Souza, P. F.; Krug, F. J.; Alegre, T. C.; Santos, D.; J. Anal. At. Spectrom. 2010, 25, 803. 160. Jesus, A. M. D.; Aguirre, M. A.; Hidalgo, M.; Canals, A.; Pereira, E. R.; J. Anal. At. Spectrom. 2014, 29, 1813. 161. Myakalwar, A. K.; Sreedhar, S.; Barman, I.; Dingari, N. C.; Rao, S. V.; Kiran, P. P.; Tewari, S. P.; Kumar, G. M.; Talanta 2011, 87, 53. 162. Abdel-Salam, Z.; Abdelghany, S.; Harith, M. A.; Food Anal. Methods 2017, 10, 2422. 163. Lucia, F. C.; Gottfried, J. L.; Appl. Opt. 2012, 51, B83. 164. Kolmhofer, P. J.; Eschlbock-Fuchs, S.; Huber, N.; Rossler, R.; Heitz, J.; Pedarnig, J. D.; Spectrochim. Acta, Part B 2015, 106, 67. 165. Aragon, C.; Aguilera, J. A.; Anal. Chim. Acta 2018, 1009, 12. 166. Luna, A. S.; Gonzaga, F. B.; Rocha, W. F. C.; Lima, I. C. A.; Spectrom. Acta, Part B 2018, 139, 20. 167. Godoi, Q.; Santos Jr, D.; Nunes, L. C.; Leme, F. O.; Rufini, I. A.; Agnelli, J. A. M.; Trevizan, L. C.; Krug, F. J.; Spectrochim. Acta, Part B 2009, 64, 573. 168. Lazic, V.; Filella, M.; Turner, A.; J. Anal. At. Spectrom. 2018, 33, 1917. 169. Sperança, M. A.; Virgílio, A.; Pereira-Filho, E. R.; Aquino, F. W. B.; Appl. Spectrosc. 2018, 72, 1205. 170. Nicolodelli, G.; Senesi, G. S.; Ranulfi, A. C.; Marangoni, B. S.; Watanabe, A.; Benites, V. M.; Oliveira, P. P. A.; Villas-Boas, P.; Milori, D. M. B. P.; Microchem. J. 2017, 133, 272. 171. Trevizan, L. C.; Santos Jr, D.; Samad, R. E.; Vieira Jr, N. D.; Nomura, C. S.; Nunes, L. C.; Rufini, I. A.; Krug, F. J.; Spectrochim. Acta, Part B 2008, 63, 1151. 172. Trevizan, L. C.; Santos Jr, D.; Samad, R. E.; Vieira Jr, N. D.; Nomura, C. S.; Nunes, L. C.; Rufini, I. A.; Krug, F. J.; Spectrochim. Acta, Part B 2009, 64, 639. 173. Carvalho, G. G. A.; Santos Jr. D.; Nunes, L. C.; Gomes, M. S.; Leme, F. O.; Krug, F. J.; Spectrochim. Acta, Part B 2012, 74-75, 162. 174. Gomes, M. S.; Carvalho, G. G. A.; Santos Jr, D.; Krug, F. J.; Spectrochim. Acta, Part B 2013, 86, 137. 175. Souza, P. F.; Santos Jr, D.; Carvalho, G. G. A.; Nunes, L. C.; Gomes, M. S.; Guerra, M. B. B.; Krug, F. J.; Spectrochim. Acta, Part B 2013, 83-84, 61. 176. Carvalho, G. G. A.; Santos Jr. D.; Gomes, M. S.; Nunes, L. C.; Guerra, M. B. B.; Krug, F. J.; Spectrochim. Acta, Part B 2015, 105, 130. 177. Silvestre, D. M.; Barbosa, F. M.; Aguiar, B. T.; Leme, F. O.; Nomura, C. S.; Anal. Chem. Res. 2015, 5, 28. 178. Shukla, P.; Kumar, R.; Raib, A. K.; J. Appl. Spectrosc. 2016, 83, 872. 179. Santos, D.; Nunes, L. C.; Carvalho, G. G. A.; Gomes, M. S.; Souza, P. F.; Leme, F. O.; Santos, L. G. C.; Krug, F. J.; Spectrochim. Acta, Part B 2012, 71-72, 3. 180. Pereira, F. M. V.; Milori, D. M. B. P.; Venâncio, A. L.; Russo, M. S. T.; Martins, P. K.; Freitas-Astúa, J.; Talanta 2010, 15, 351. 181. Ranulfi, A. C.; Romano, R. A.; Magalhaes, A. B.; Ferreira, E. J.; Villas- Boas, P. R.; Milori, D. M. B. P.; Appl. Spectrosc. 2017, 71, 1471. 182. Ranulfi, A. C.; Senesi, G. S.; Caetano, J. B.; Meyer, M. C.; Magalhaes, A. B.; Vilas-Boas, P. R.; Milori, D. M. B. P.; Microchem. J. 2018, 141, 118. 183. Krajcarova, L.; Novotny, K.; Kummerova M.; Dubova, J.; Gloser, V.; Kaiser, J. Talanta 2017, 173, 28. 184. Krystofova, O.; Shestivska, V.; Galiova, M.; Novotny, K.; Kaiser, J.; Zehnalek, J.; Babula, P.; Opatrilova, R.; Adam, V.; Kizek, R.; Sensors 2009, 9, 5040. 185. Guerra, M. B. B.; Adame, A.; Almeida, E.; Carvalho, G. G. A.; Brasil, M. A. S.; Santos Jr, D.; Krug, F. J.; J. Anal. At. Spectrom. 2015, 30, 1646. 186. Nunes, L. C.; Carvalho, G. G. A.; Santos Jr, D.; Krug, F. J.; Spectrochim. Acta, Part B 2014, 97, 42. 187. Marangoni, B. S.; Silva, K. S. G.; Nicolodelli, G.; Senesi, G. S.; Cabral, J. S.; Villas-Boas, P. R.; Texeira, C. S. S.; Nogueira, A. R. A.; Benites, V. M.; Milori, D. M. B. P.; Anal. Methods 2016, 8, 78. 188. Sha, W.; Niu, P.; Zhen, C.; Lu, C.; Jiang, Y.; J. Appl. Spectrosc. 2018, 85, 653. 189. Morais, C. P.; Barros, A. I.; Bechlin, M. A.; Silva, T. V.; Santos Jr, D.; Senesi, G. S.; Crespi. M. S.; Ribeiro, C. A.; Neto, J. A. G.; Ferreira, E. C.; Talanta 2018, 188, 199. 190. Burakov, V. S.; Raikov, S. N.; Tarasenko, N. V.; Belkov, M. V.; Kiris, V. V.; J. Appl. Spectrosc. 2010, 77, 595. 191. Senesi, G. S.; Senesi, N.; Anal. Chim. Acta 2016, 938, 7. 192. Ferreira, E. C.; Milori, D. M. B. P.; Ferreira, E. J.; Silva, R. M.; Martin-Neto, L.; Spectrochim. Acta, Part B 2008, 63, 1216. 193. Ferreira, E. C.; Milori, D. M. B. P.; Ferreira, E. J.; Santos, L. M.; Martin-Neto, L.; Nogueira, A. R. A.; Talanta 2011, 85, 435. 194. El Haddad, J.; Villot-Kadri, M.; Ismaël, A.; Gallou, G.; Michel, K.; Bruyère, D.; Laperche, V.; Canioni, L.; Bousquet. B.; Spectrochim. Acta, Part B 2013, 79-80, 51. 195. Popov, A. M.; Zaytsev, S. M.; Seliverstov, I. V.; Zakuskin, A. S.; Labutin, T. A.; Spectrochim. Acta, Part B 2018, 148, 205. 196. Rühlmann, M.; Büchele, D.; Ostermann, M.; Bald, I.; Schmid, T.; Spectrochim. Acta, Part B 2018, 146, 115. 197. Zhang, G.; Song, H.; Liu, Y.; Zhao, Z.; Li, S.; Ren, Z.; Optik 2018, 165, 87. 198. Pontes, M.; Cortez, J.; Galvao, R.; Pasquini, C.; Araújo, M.; Coelho, R.; Chiba, M.; Abreu, M.; Madari, B.; Anal. Chim. Acta 2009, 642, 12. 199. Nicolodelli, G.; Marangoni, B. S.; Cabral, J. S.; Villas-Boas, P. R.; Senesi, G. S.; Santos, C. H.; Romano, R. A.; Segnini, A.; Lucas, Y.; Montes, C. R.; Milori, D. M. B. P.; Appl. Opt. 2014, 53, 2170. 200. Ferreira, E. C.; Ferreira, E. J.; Villas-Boas, P. R.; Senesi, G. S.; Carvalho, C. M.; Romano. R. A.; Martin-Neto. L.; Milori, D. M. B. P.; Spectrochim. Acta, Part B 2014, 99, 76. 201. Ferreira, E. C.; Neto, J. A. G.; Milori, D. M.; Ferreira, E. J.; Anzano, J. M.; Spectrochim. Acta, Part B 2015, 110, 96. 202. Villas-Boas, P. R.; Romano, R. A.; Franco, M. A. M.; Ferreira, E. C.; Ferreira, E. J.; Crestana, S.; Milori, D. M. B. P.; Geoderma 2016, 263, 195. 203. Tadini, A. M.; Nicolodelli, G.; Marangoni, B. S.; Mounier, S.; Montese, C. R.; Milori, D. M. B. P.; Microchem. J. 2019, 144, 454. 204. Markiewicz-Keszycka, M.; Cama-Moncunill, X.; Casado-Gavalda, M. P.; Dixit, Y.; Cama-Moncunill, R.; Cullen, P. J.; Sullivan, C.; Trends Food Sci. Technol. 2017, 65, 80. 205. Yang, P.; Zhu, Y.; Yang, X.; Li, J.; Tang, S.; Hao, Z.; Guo, L.; Li, X.; Zeng, X.; Lu, Y.; J. Cereal Sci. 2018, 80, 111. 206. Silva, T. V.; Milori, D. M. B. P.; Neto, J. A. G.; Ferreira, E. J.; Ferreira, E. C.; Food Chem. 2019, 278, 223. 207. Sezer, B.; Berkkan, G. B. A.; Aysel, G. B.; Tamer, U.; Boyaci, I. H.; Food Chem. 2018, 240, 84. 208. Markiewicz-Keszycka, M.; Casado-Gavalda, M. P.; Cama-Moncunill, X.; Cama-Moncunill, R.; Dixit, Y.; Cullen, P. J.; Sullivan, C.; Food Chem. 2018, 244, 324. 209. Costa, V. C.; Babos, D. V.; Aquino, F. W. B.; Virgílio, A.; Amorim, F. A. C.; Pereira-Filho, E. R.; Food Anal. Methods 2018, 11, 1886. 210. Wang, J.; Shi, M.; Zheng, P.; Xue, S.; Peng, R.; J. Appl. Spectrosc. 2018, 85, 190. 211. Ferreira, E. C.; Menezes, E. A.; Matos, W. O.; Milori, D. M. Nogueira, A. R. A.; Martin-Neto, L. Food Control 2010, 21, 1327. 212. Bilge, G.; Boyaci, I. H.; Eseller, K. E.; Tamer, U.; Çakir, S.; Food Chem. 2015, 181, 186. 213. Singh, J.; Kumar, R.; Awasthi, S.; Singh, V.; Rai, A. L.; Food Chem. 2017, 221, 1778. 214. Zivkovic, S.; Savovic, J.; Kuzmanovic, M.; Petrovic, J.; Momcilovic, M.; Microchem. J. 2018, 137, 410. 215. Kongbonga, Y. G. M.; Ghalila, H.; Onana, M. B.; Lakhdar, Z. B.; Food Chem. 2014, 147, 327. 216. Sezer, B.; Bilge, G.; Boyaci, I. H.; J. Agric. Food Chem. 2016, 64, 9459. 217. Bilge, G.; Sezer, B.; Eseller, K. E.; Berberoglu, H.; Koksel, H.; Boyaci, I. H.; Spectrochim. Acta, Part B 2016, 124, 74. 218. Lin, H.; Mingyin, Y.; Jinlong, L.; Muhua, L.; Xiuwen, H.; J. Appl. Spectrosc. 2014, 80, 957. 219. Ponce, L.; Flores, T.; Alvira, F.; Bilmes, G.; Sosa-Saldana, M.; Appl. Opt. 2016, 55, 254. 220. Yao, S.; Zhao, J.; Xu, J.; Lu, Z.; Lu, J.; J. Anal. At. Spectrom. 2017, 32, 766. 221. Multari, R. A.; Cremers, D. A.; Dupre, J. A. M.; Gustafson, J. E.; J. Agric. Food Chem. 2013, 61, 8687. 222. Kim, G.; Kwak, J.; Choi, J.; Park, K.; J. Agric. Food Chem. 2012, 60, 718. 223. Ma, F.; Dong, D.; Food Anal. Methods 2014, 7, 1858. 224. Huiqin, H.; Lin, H.; Muhua, L.; Tianbing, C.; Ping, Y.; Mingyin, Y.; Plasma Sci. Technol. 2015, 17, 711. 225. Bilge, G.; Velioglu, H. M.; Sezer, B.; Eseller, K. E.; Boyaci, I. H.; Meat Sci. 2016, 119, 118. 226. Casado-Gavalda, M. P.; Dixit, Y.; Geulen, D.; Cama-Moncunill, R.; Cama-Moncunill, X.; Markiewicz-Keszycka, M.; Cullen, P. J.; Sullivan, C.; Talanta 2017, 169, 123. 227. Dixit, Y.; Casado-Gavalda, M.; Cama-Moncunnil, R.; Cama-Moncunnill, X.; Markiewicz-Keszycka, M.; Cullen, P.; Sullivan, C.; Anal. Methods 2017, 9, 3314. 228. Cáceres, J. O.; Moncayo, S.; Rosales, J. D.; Villena, F. J. M.; Alvira, F. C.; Bilmes, G. M.; Appl. Spectrosc. 2013, 67, 1064. 229. Moncayo, S.; Rosales, J. D.; Izquierdo-Hornillos, R.; Anzano, J.; Cácere, J. O.; Talanta 2016, 158, 185. 230. Peña-Icart, M.; Pereira-Filho, E. R.; Filaho, L. L.; Nóbrega, J. A.; Alonso-Hernandez, C.; Bolanos-Alvarez, Y.; Pomares-Alfonso, M. S.; Chemosphere 2017, 168, 1267. 231. Carvalho, A. A. C.; Silvestre, D. M.; Leme, F. O.; Naozuka, J.; Intima, D. P.; Nomura, C. S.; Microchem. J. (2018), doi: 10.1016/j. microc.2018.08.031. 232. Ruiz, F. J.; Ripoll, L.; Hidalgo, M.; Canals, A.; Talanta 2018, 191, 162. 233. Sirven, J. B.; Bousquet, B.; Sarger, L.; Anal. Chem. 2006, 78, 1462. 234. Pandhija, S.; Rai, N. K.; Rai, A. K.; Thakur, S. N.; Appl. Phys. B. 2010, 98, 23. 235. Mukhono, P. M.; Angeyo, K. H.; Dehayem-Kamadjeu, A.; Kaduki, K. A.; Spectrochim. Acta, Part B 2013, 8, 81. 236. Zaytsev, S. M.; Krylov, I. N.; Popov, A. M.; Zorov, N. B.; Labutin, T. A.; Spectrochim. Acta, Part B 2018, 140, 65. 237. Yi, R.; Yang, X.; Zhou, R.; Li, J.; Yu, H.; Hao, Z.; Guo, L.; Li, X.; Lu, Y.; Zeng, X.; Anal. Chem. 2018, 90, 7080. 238. Emara, E. M.; Imam, H; Hassan, M.; Elnaby, S. H.; Talanta 2013, 117, 183. 239. Rusak, D. A.; Zeleniak, A. E.; Obuhosky, J. L.; Holdren, S. M.; Noldy, C. A.; Talanta 2013, 117, 55. 240. Grolmusova, Z.; Hornackova, M.; Plavcan, J.; Kopani, M.; Babal, P.; Veis, P.; Eur. Phys. J. Appl. Phys. 2013, 63, 20801. 241. Metzinger, A.; Kovács-Széles, E.; Almási, I.; Galbács, G.; Appl Spectrosc. 2014, 68, 789. 242. Bello, L. T.; Ana, P. A.; Santos, D.; Krug, F. J.; Zezell, D. M.; Vieira, N. D.; Samad, R. E.; Appl. Spectrosc. 2017, 71, 659. 243. Gaudiuso, R.; Ewusi-Annan, E.; Melikechi, N.; Sun, X.; Liu, B.; Campesato, L.; Merghoub, T.; Spectrochim. Acta, Part B 2018, 146, 106. 244. Putnam, R. A.; Mohaidat Q. I.; Daabous, A.; Rehse, S. J.; Spectrochim. Acta, Part B 2013, 87,161. 245. Manzoor, S.; Moncayo, S.; Navarro-Villoslada, F.; Ayala, J. A.; Izquierdo-Hornillos, R.; Villena, F. J. M.; Caceres, J. O.; Talanta 2013, 121, 65. 246. Manzoor, S.; Ugena, L.; Tornero-Lópes, J.; Martín, H.; Molina, M.; Camacho, J. J.; Cáceres, J. O.; Talanta 2016, 155, 101. 247. Davari, S. A.; Masjedi, S.; Ferdous, Z.; Mukherjee, D. J.; Biophotonics 2018, 11, 1. 248. Anzano, J.; Bonilla, B.; Montull-Ibor, B.; Casas-González, J.; Med. Chem. Res. 2009, 18, 656. 249. Tiwari, P. K.; Awasthi, S.; Kumar, R.; Anand, R. K.; Rai, P. K.; Rai, A. K.; Laser Med. Sci. 2018, 33, 263. 250. Dubey, A.; Keyvan, G.; Hsia, R.; Saranteas, K.; Brone, D.; Misra, T.; Muzzio, F. J.; J. Pharm. Innov. 2011, 6, 77. 251. Cahoon, E. M.; Almirall, J. R.; Appl. Opt. 2010, 49, C49. 252. Gottfried, J. L.; Appl. Opt. 2013, 52, B10. 253. Metzinger, A.; Rajkó, R.; Galbács, G.; Spectrochim Acta, Part B 2014, 94-95, 48. 254. Kula, A.; Wietecha-Posluszny, R.; Pasionek, K.; Krol, M.; Wozniakiewicz, M.; Koscielniak, P.; Sci Justice 2014, 54, 118. 255. Lennard, C.; El-Deftar, M. M.; Robertson, J.; Forensic. Sci. Int. 2015, 254, 68. 256. Alvira, F. C.; Bilmes, G. M.; Flores, T.; Ponce, L.; App. Spectrosc. 2015, 69, 1205. 257. Krol, M.; Kowalska, D.; Koscielniak, P.; Anal. Lett. 2018, 51, 1592. 258. Yang, J. H.; Yoh, J. J.; Microchem. J. 2018, 139, 386. 259. Moncayo, S.; Manzoor, S.; Ugidos, T.; Navarro-Villoslada, F.; Caceres, J. O.; Spectrochim. Acta, Part B 2014, 101, 21. 260. Choi, S.; Yoh, J. J.; Spectrochim. Acta, Part B 2017, 134, 75. 261. Bhatt, B.; Angeyo, K. H.; Dehayem-Kamadjeu, A.; Anal. Methods 2018, 10, 791. 262. Doña-Fernández, A.; Andres-Gimeno, I.; Santiago-Toribio, P.; Valtuille- Fernández, E.; Aller-Sanchez, F.; Heras-González, A.; Forensic. Sci. Int. 2018, 292, 167. 263. Zhang, T. L.; Wu, S.; Dong, J.; Wei, J.; Wang, K.; Tang, H.; Yang, X.; Li, H.; J. Anal. At. Spectrom. 2015, 30, 368. 264. Ahamer, C. M.; Eschlbock-Fuchs, S.; Kolmhofer, P. J.; Rossler, R.; Huber, N.; Pedarnig, J. D.; Spectrochim. Acta, Part B 2016, 122, 157. 265. Sun, L.; Yu, H.; Cong, Z.; Xin, Y.; Li, Y.; Qi, L.; Spectrom. Acta, Part B 2015, 112, 40. 266. Wu, S.; Zhang, T. L.; Tang, H. S.; Wang, K.; Yang, X. F.; Li, H.; Anal. Methods 2015, 7, 2425. 267. Lin, J.; Lin, X.; Guo, L.; Guo, Y.; Tang, Y.; Chu, Y.; Tang, S.; Che, C.; J. Anal. At. Spectrom. 2018, 33,1545. 268. Luo, D.; Liu, Y.; Li, X. Y.; Zhao, Z. Y.; Wang, S. G.; Zhang, Y.; Plasma Sci. Technol. 2018, 20, 075504. 269. Shakeel, H.; Haq, S. U.; Abbas, Q.; Nadeem, A.; Palleschi, V.; Spectrochim. Acta, Part B 2018, 146, 101. 270. He, X.; Chen, B.; Chen, Y.; Li, R.; Wang, F.; J. Anal. At. Spectrom. 2018, 33, 2203. 271. Ignatyev, I. A.; Thielemans, W.; Vander Beke, B.; Chem. Sus. Chem. 2014, 7, 1579. 272. Morgan, A. B.; Gilman, J. W.; Fire Mater. 2013, 37, 259. 273. Afonso, J. C.; Rev. Virtual Quim. 2018, 10, Aceito para publicaçao. 274. Cadore, S.; Matoso, E.; Santos, M. C.; Quim. Nova 2008, 31, 1533. 275. Gerbase, A. E.; Oliveira, C. R.; Quim. Nova 2012, 38, 1486. 276. Henrique, S. S.; Moura, F. P.; Correa, R. S.; Afonso, J. C.; Quim. Nova 2013, 36, 570. 277. Liu, K.; Tian, D.; Li, C.; Li, Y.; Yang, G.; Ding, Y.; TrAC - Trends Anal. Chem. (2018), doi:10.1016/j.trac.2018.11.025 278. Sattmann, R.; Monch, H.; Krause, H.; Noll, R.; Couris, S.; Hatzipostolou, A.; Mavromanolakis, A.; Fotakis, C.; Larrauri, E.; Miguel, R.; Appl. Spectrosc. 1998, 52, 456. 279. Anzano, J.; Casanova, M. E.; Bermudez, M. S.; Lasheras, R. J.; Polym. Test. 2006, 25, 623. 280. Lasheras, R. J.; Bello-Galvez, C.; Anzano, J.; Polym. Test. 2010, 29, 1057. 281. Unnikrishnan, V. K.; Choudhari, K. S.; Kulkarni, S. D.; Nayak, R.; Kartha, V. B.; Santhosh, C.; RSC Adv. 2013, 3, 25872. 282. Aquino, F. W. B.; Pereira-Filho, E. R.; Talanta 2015 ,134, 65. 283. Anzano, J.; Bonilla, B.; Montull-Ibor, B.; Casas-Gonzalez, J.; J. Appl. Polym. Sci. 2011, 121, 2710. 284. Banaee, M.; Tavassoli, S. H.; Polym. Test. 2012, 31, 759. 285. Barbier, S.; Perrier, S.; Freyermuth, P.; Perrin, D.; Gallard, B.; Gilon, N.; Spectrochim. Acta, Part B 2013, 88, 167. 286. Grégoire, S.; Boudinet, M.; Pelascini, F.; Surma, F.; Detalle, V.; Holl, Y.; Anal. Bioanal. Chem. 2011, 400, 3331. 287. Costa, V. C.; Aquino, F. W. B.; Paranhos, C. M.; Pereira-Filho, E. R.; Waste Manage. 2017, 70, 212. 288. Lazic, V.; Filella, M.; Turner, A.; J. Anal. At. Spectrom. 2018, 33, 1917. 289. Madariaga, J. M.; Anal. Methods 2015, 7, 4848. 290. Harmon, R. S.; Russo, R. E.; Hark, R. R.; Spectrochim. Acta, Part B 2013, 87, 11. 291. Aramendia, J.; Gomez-Nubla, L.; Castro, K.; Vallejuelo, F. O. G.; Arana, G.; Maguregui, M.; Baonza, V. G.; Medina, J.; Rull, F.; Madariaga. J. M.; TrAC - Trends Anal. Chem. 2018, 98, 36. 292. Botto, A.; Campanella, B.; Legnaioli, S.; Lezzerini, M.; Lorenzetti, G.; Pagnotta, S.; Poggialini, F.; Palleschi, V.; J. Anal. At. Spectrom. (2019), doi:10.1039 / C8JA00319J. 293. Dell’Aglio, M.; Alrifai, R.; Giacomo, A.; Spectrochim. Acta, Part B 2018, 148, 105. 294. Godoy, Q.; Leme, F. O.; Trevisan, L. C.; Pereira-Filho, E. R.; Rufini, I. A.; Santos, D.; Krug, F. J.; Spectrochim. Acta, Part B 2011, 66, 138. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access