Artigo
|
|
| Síntese e avaliação das atividades fotoprotetora, citotóxica e antiviral contra o Zika Vírus de derivados triazólicos da benzofenona Synthesis and evaluation of the photoprotective, cytotoxic and antiviral activity of benzophenone derivatives containing 1,2,3-triazolic portions |
|
Angela M. A. LimaI; Róbson R. TeixeiraI,*; Bianca F. da SilvaI; Raoni P. SiqueiraII; Italo E. P. da SilvaIII; Edjon G. SantosIII; Maria Cecília FernandesI; Victor Hugo Sousa GonçalvesII; Gustavo C. BressanII; Tiago Antonio de Oliveira MendesII; Sérgio O. de PaulaIII; Adílson Vidal CostaIV; Marcelo H. dos SantosI
I. Departamento de Química, Universidade Federal de Viçosa, 36570-900 Viçosa - MG, Brasil Recebido em 01/10/2018 *e-mail: robsonr.teixeira@ufv.br The benzophenones are synthetic and natural compounds presenting a variety of activities, including photoprotective, cytotoxic and antiviral. It is herein described the preparation of a series of twenty-seven benzophenone derivatives bearing 1,2,3-triazole functionalities and the evaluation of their photoprotective, cytotoxic and antiviral on Zika Virus (ZIKV) activities. The compounds were prepared in three steps, namely reduction of benzophenone, alkylation of diphenylmethanol and CuAAC reactions. The in vitro evaluation of the photoprotective activity revealed that the most active derivative 4-((benzhydryloxy)methyl)-1-(4-nitrobenzyl)-1H-1,2,3-triazole (4k) displayed UVB sun protection factor equal to 6,9±0,53, which make this compound a possible candidate to be used in formulations for photoprotective applications. In terms of cytotoxicity, the compounds were evaluated against MDA-MB-231 and B16F10 cell lines. It was observed that the compounds were more active against MDA-MB-231 cells and three of them were capable of reducing cell viability by approximately 55% at 100 µmol L-1. In the antiviral screening against ZIKV, compound 4-(3-benzhydryloxy)propyl)-1-(3-methylbenzyl)-1H-1,2,3-triazole (5j) was the most effective in mantaining Vero cell viability. INTRODUÇAO As benzofenonas sao uma classe de substâncias de origem natural e sintética que apresentam considerável variabilidade estrutural, além de possuírem diversas aplicaçoes e atividades biológicas.1-3 Dentre as diversas atividades associadas às benzofenonas, uma bem documentada é a açao fotoprotetora. A exposiçao aos raios solares por tempo prolongado e sem proteçao adequada resulta em diversos efeitos nocivos à saúde, como sensibilidade a luz, manchas, envelhecimento cutâneo, eritema (vermelhidao na pele), despigmentaçao cutânea e câncer de pele, sendo este último considerado mundialmente uma das causas mais relevantes de mortalidade.4,5 O Brasil é considerado um dos países de maior incidência de casos envolvendo câncer de pele. Segundo estimativas apontadas pelo Instituto Nacional do Câncer (INCA), o câncer de pele representa 26% dos tumores malignos identificados e leva a óbito aproximadamente 10% dos pacientes.6-9 Neste sentido, para prevenir ou diminuir os riscos de câncer cutâneo e demais doenças associadas à exposiçao excessiva aos raios ultra-violeta (UV), a utilizaçao de protetores solares é de fundamental importância.10 Os filtros orgânicos presentes nos protetores solares sao constituídos por substâncias químicas, cujas estruturas sao compostas essencialmente por anéis aromáticos conectados a um grupo carbonila. Geralmente, essa classe de compostos apresenta um grupo doador ou retirador de elétrons na posiçao orto ou para do anel aromático.11,12 Essas substâncias fotoprotetoras têm por objetivo diminuir os efeitos deletérios causados pelos raios UV por meio da absorçao dos raios incidentes, ou seja, radiaçao com energias maiores, e transformando-as posteriormente em radiaçoes com energias menores e nao prejudiciais aos seres humanos.13,14 A eficiência desses filtros é medida em funçao da sua capacidade em absorver a energia radiante. A combinaçao de diferentes filtros UVA e UVB, de amplo espectro de absorçao em formulaçoes, é uma alternativa para melhorar a eficiência destes e garantir uma maior proteçao à pele.15 Com a disseminaçao do conhecimento acerca dos danos provocados pela radiaçao ultravioleta, a produçao e utilizaçao de filtros solares aumentaram exponencialmente ao longo dos anos, representando uma medida eficaz de prevençao ou diminuiçao dos efeitos prejudiciais causados pelos raios UV. Em virtude disso, diversos filtros orgânicos foram desenvolvidos e comercializados nos últimos tempos.8,16 Entretanto, há relatos de problemas relacionados ao uso dos protetores solares. Por exemplo, a benzofenona-3, embora forneça boa açao fotoprotetora contra os raios UVA e UVB, tem seu uso restrito no mercado devido aos efeitos colaterais (irritaçao na pele e olhos) induzidos após o uso da mesma.17 Assim, a busca por novos compostos orgânicos com propriedades fotoprotetoras e que nao apresentem problemas relacionados à sua utilizaçao é de potencial interesse. Duas outras importantes atividades apresentadas pela classe das benzofenonas sao antiviral e citotóxica. A grande maioria dos estudos a respeito da atividade antiviral de benzofenonas envolveu sua açao anti-HIV.3 Com respeito à citotoxicidade, os compostos pertencentes a essa classe têm sido avaliados contra uma grande variedade de linhagens celulares e com resultados variados com respeito à eficácia destes.3 Dentro desse contexto, considerando-se a atividade fotoprotetora descrita para derivados da benzofenona e visando obter novas substâncias que possam ser utilizadas como possíveis filtros orgânicos em protetores solares, que sejam mais eficientes ao proteger a pele exposta contra os raios UV e que apresentem mínimos efeitos adversos, descreve-se neste artigo a síntese e a avaliaçao in vitro da atividade fotoprotetora de derivados da benzofenona contendo o núcleo 1,2,3-triazólico. Em vista do interesse do nosso grupo de pesquisa com respeito ao efeito contra linhagens de células cancerígenas e atividade antiviral de compostos orgânicos,18-21 e levando-se em conta relatos de atividades citotóxica e antiviral tanto de compostos triazólicos22 quanto de benzofenonas, descreve-se ainda neste trabalho os resultados da avaliaçao das atividades dos derivados triazólicos da benzofenona contra duas linhagens de células cancerígenas (MDA-MB-231 e B16F10) bem como contra o Zika Vírus.
PARTE EXPERIMENTAL Síntese Generalidades Foram utilizados reagentes de grau P.A. para a síntese dos compostos. Benzofenona, boroidreto de sódio (NaBH4), brometo de tetrabutilamônio ((Bu)4NBr), brometo de propargila (3-bromoprop-1-ino), pent-4-in-1-ol, brometo de benzila, brometo de 3-metilbenzila, brometo de 4-metilbenzila, brometo de 2-bromobenzila, álcool 4-fluorobenzílico, álcool 4-clorobenzílico, álcool 4-bromobenzílico, álcool 4-iodobenzílico, álcool 4-nitrobenzílico, álcool 4-metoxibenzílico, álcool 4-trifluorometoxibenzílico, álcool 4-trifluorobenzílico, álcool 4-isopropilbenzílico, sulfato de cobre pentaidratado e ascorbato de sódio, foram adquiridas comercialmente da Sigma Aldrich (St. Louis, MO, Estados Unidos) e utilizados sem prévia purificaçao. Diclorometano, álcool etílico, acetato de etila, hexano, éter etílico, cloreto de sódio, hidróxido de sódio, carbonato de sódio, tolueno e ácido clorídrico foram adquiridos da Vetec (Rio de Janeiro, Brasil). As análises por cromatografia em camada delgada (CCD) foram realizadas utilizando-se placas cromatográficas de sílica-gel impregnadas sobre alumínio. Após eluiçao, as placas de CCD foram observadas sob luz ultravioleta (λ = 254 nm) e reveladas com soluçao de permanganato de potássio (3 g de KMnO4, 20 g de K2CO3, 5 mL de NaOH 5% m/v, 300 mL de água). As separaçoes em coluna cromatográfica foram realizadas usando sílica-gel (70-230 mesh) como fase estacionária. Os solventes utilizados como eluentes foram usados sem prévia purificaçao. Os espectros no infravermelho (IV) foram obtidos empregando-se a técnica da reflectância total atenuada (ATR) em equipamento Varian 660 com acessório GladiATr. Os espectros de ressonância magnética nuclear de hidrogênio (RMN de 1H, 300 MHz) e de carbono (RMN de 13C, 75 MHz) foram obtidos em um espectrômetro VARIAN MERCURY 300. Foram utilizados como solvente o clorofórmio (CDCl3) deuterado. As temperaturas de fusao foram determinadas em aparelho MQAPF-302 e nao foram corrigidas. As leituras das absorbâncias na faixa de comprimento de onda 290-320 nm foram realizadas em um espectrofotômetro (leitor de Elisa) Multiskan Go. Preparaçao do difenilmetanol (1) A um balao de fundo redondo de 100 mL, contendo uma barra de agitaçao magnética, foram adicionados a benzofenona (3,00 g; 16,4 mmol) e 30,0 mL de etanol. A mistura resultante foi mantida sob agitaçao por 30 minutos. Em seguida, foram adicionados a essa mistura 15,0 mL de soluçao de NaBH4 (0,685 g; 18,1 mmol) em etanol gota a gota. Após a adiçao, a mistura foi mantida sob agitaçao por mais 40 minutos a temperatura ambiente. Decorrido este período, a análise da mistura por CCD mostrou que a benzofenona havia sido completamente consumida. A mistura reagente foi, entao, transferida para um béquer, mantido em banho de gelo, contendo 40,0 mL de água e 9,00 mL de HCl concentrado, resultando na formaçao de um precipitado branco. O precipitado foi filtrado a vácuo e lavado com água gelada (3 x 20,0 mL). O sólido branco obtido, difenilmetanol (1), nao foi submetido a nenhum processo subsequente de purificaçao. O composto 1 foi obtido em 92% de rendimento (2,78 g; 15,1 mmol). CCD: Rf = 0,36 (hexano-acetato de etila 8:1 v/v). Tf = 62,8-63,4 °C. IV (ATR) -νmax/cm-1: 3323, 3084, 3059, 3025, 2886, 3025, 1959, 1894, 1805, 1666, 1596, 1453, 1445, 1393, 1346, 1266, 1180, 1171, 1032, 1017, 751, 733, 694, 651, 600, 540. RMN de 1H (300 MHz, CDCl3) δ: 5,84 (s, 1H); 7,26-7,41 (m, 10H). RMN de 13C (75 MHz, CDCl3) δ: 76,2; 126,5; 127,5; 128,5; 143,8. Preparaçao do prop-2-in-1-ilóxi difenilmetano (2) A um balao de fundo redondo de 50 mL, contendo uma barra de agitaçao magnética, foram adicionados o difenilmetanol (1) (1,00 g; 5,43 mmol), o brometo de tetrabutilamônio (0,175 g; 0,542 mmol), 10,0 mL de soluçao aquosa de NaOH 35% m/v e 12,0 mL de tolueno. A mistura resultante foi resfriada em banho de gelo e mantida sob agitaçao magnética por 1 hora. Em seguida, foram adicionados a essa mistura 1,50 mL (16,3 mmol) de brometo de propargila. Após a adiçao, a mistura de reaçao foi mantida sob agitaçao por mais 2 horas à temperatura ambiente. Decorrido esse período, o volume da reaçao foi reduzido em evaporador rotativo. Posteriormente, adicionou-se soluçao saturada de cloreto de sódio à mistura que, entao, foi transferida para um funil de separaçao e a fase aquosa foi extraída com éter etílico (3 x 20,0 mL). Os extratos orgânicos foram reunidos e a fase orgânica resultante foi seca com sulfato de sódio anidro, filtrada e concentrada sob pressao reduzida. O material resultante foi purificado por cromatografia em coluna de sílica-gel utilizando-se como eluente hexano-acetato de etila (8:1 v/v). O composto 2 foi obtido como um óleo incolor em 78% de rendimento (0,941 g; 4,23 mmol). CCD: Rf = 0,70 (hexano-acetato de etila 8:1 v/v). IV (ATR) Preparaçao do pent-4-in-ilóxi difenilmetano (3) O alquino 3 foi sintetizado a partir do pent-4-in-1-ilmetanosulfonato,19 utilizando um procedimento semelhante ao descrito para o composto 2. Porém, a mistura reagente foi mantida sob agitaçao magnética à temperatura de 50 °C por um período de 24 horas. O composto 3 foi obtido como um óleo incolor em 65% de rendimento (0,616 g; 2,46 mmol). CCD Rf = 0,79 (hexano-acetato de etila 8:1 v/v). IV (ATR) Procedimento geral para a obtençao dos derivados 1,2,3-triazólicos da benzofenona 4a-4n A um balao de fundo redondo de 25 mL, contendo uma barra de agitaçao magnética, foram adicionados a azida (1,10 equivalente), o alquino 2 (1,00 equivalente), ascorbato de sódio (0,400 equivalente), 2,00 mL de água destilada e 2,00 mL de diclorometano. Em seguida, foi adicionado o CuSO4·5H2O (0,200 equivalente). A mistura de reaçao permaneceu sob agitaçao por 2 horas à temperatura ambiente. Após o término da reaçao (determinado via análise por CCD) a mistura resultante foi lavada com soluçao saturada de Na2CO3 e a fase aquosa extraída com diclorometano (3 x 20 mL). Os extratos orgânicos foram reunidos e a fase orgânica foi seca com sulfato de sódio anidro, filtrada e concentrada sob pressao reduzida. O material resultante foi purificado por cromatografia em coluna de sílica-gel utilizando-se como eluente uma mistura de hexano-acetato de etila-diclorometano (3:1:3 v/v). Os derivados 1,2,3-triazólicos da benzofenona 4a-4n foram obtidos com rendimentos variando de 42%-88%. As informaçoes pertinentes às reaçoes envolvidas na preparaçao dos compostos 4a-4n e os dados que suportam as estruturas destes se encontram descritas a seguir. 4-(metilbenzidrilóxi)-1-(benzil)-1H-1,2,3-triazol (4a) Sólido branco obtido em 83% de rendimento (0,200 g, 0,563 mmol) a partir de 0,100 g (0,750 mmol) de benzilazida, 0,0540 g (0,272 mmol) de ascorbato de sódio, 0,151 g (0,680 mmol) do alquino 2 e 0,0340 g (0,136 mmol) de CuSO4·5H2O. CCD Rf = 0,61 (hexano-acetato de etila-diclorometano 3:1:3 v/v). Tf: 68,9-70,6 °C. IV (ATR) 4-(metilbenzidrilóxi)-1-(4-bromobenzil)-1H-1,2,3-triazol (4b) Sólido branco obtido em 78% de rendimento (0,179 g; 0,412 mmol) a partir de 0,123 g (0,579 mmol) de 4-bromobenzilazida, 0,0410 g (0,210 mmol) de ascorbato de sódio, 0,122 g (0,526 mmol) do alquino 2 e 0,0260 g (0,105 mmol) de CuSO4·5H2O. CCD Rf = 0,46 (hexano-acetato de etila-diclorometano 3:1:3 v/v). Tf: 98,7-99,1 °C. IV (ATR) 4-(metilbenzidrilóxi)-1-(4-fluorobenzil)-1H-1,2,3-triazol (4c) Sólido branco obtido em 82% de rendimento (0,138 g; 0,370 mmol) a partir de 0,075 g (0,495 mmol) de 4-fluorobenzilazida, 0,035 g (0,180 mmol) de ascorbato de sódio, 0,100 g (0,450 mmol) do alquino 2 e 0,022 g (0,090 mmol) de CuSO4·5H2O. CCD Rf = 0,64 (hexano-acetato de etila-diclorometano 3:1:3 v/v). Tf: 74,7-75,4 °C. IV (ATR) 4-(metilbenzidrilóxi)-1-(4-clorobenzil)-1H-1,2,3-triazol (4d) Sólido branco obtido em 79% de rendimento (0,139 g; 0,356 mmol) a partir de 0,0830 g (0,495 mmol) de 4-clorobenzilazida, 0,0350 g (0,180 mmol) de ascorbato de sódio, 0,100 g (0,450 mmol) do alquino 2 e 0,0220 g (0,0900 mmol) de CuSO4·5H2O. CCD Rf = 0,63 (hexano-acetato de etila-diclorometano 3:1:3 v/v). Tf: 94,4-95,2 °C. IV (ATR) 4-(metilbenzidrilóxi)-1-(4-trifluorometilbenzil)-1H-1,2,3-triazol (4e) Sólido branco obtido em 68% de rendimento (0,150 g; 0,354 mmol) a partir de 0,115 g (0,574 mmol) de 4-trifluorobenzilazida, 0,0410 g (0,209 mmol) de ascorbato de sódio, 0,116 g (0,522 mmol) do alquino 2 e 0,0260 g (0,104 mmol) de CuSO4·5H2O. CCD Rf = 0,46 (hexano-acetato de etila-diclorometano 3:1:3 v/v). Tf: 117,0-117,8 °C. IV (ATR) 4-(metilbenzidrilóxi)-1-(2-bromobenzil)-1H-1,2,3-triazol (4f) Sólido branco obtido em 65% de rendimento (0,162 g; 0,373 mmol) a partir de 0,133 g (0,628 mmol) de 2-bromobenzilazida, 0,0450 g (0,228 mmol) de ascorbato de sódio, 0,127 g (0,571 mmol) do alquino 2 e 0,028 g (0,114 mmol) de CuSO4·5H2O. CCD Rf = 0,61 (hexano-acetato de etila-diclorometano 3:1:3 v/v). Tf: 88,1-89,0 °C. IV (ATR) 4-(metilbenzidrilóxi)-1-(4-iodobenzil)-1H-1,2,3-triazol (4g) Sólido branco obtido em 66% de rendimento (0,228 g; 0,473 mmol) a partir de 0,205 g (0,792 mmol) de 4-iodobenzilazida, 0,0570 g (0,288 mmol) de ascorbato de sódio, 0,160 g (0,720 mmol) do alquino 2 e 0,0360 g (0,144 mmol) de CuSO4·5H2O. CCD Rf = 0,67 (hexano-acetato de etila-diclorometano 3:1:3 v/v). Tf: 111,2-112,8 ºC. IV (ATR) 4-(metilbenzidrilóxi)-1-(4-isopropilbenzil)-1H-1,2,3-triazol (4h) Sólido branco obtido em 79% de rendimento (0,212 g; 0,533 mmol) a partir de 0,130 g (0,742 mmol) de 4-isopropilbenzilazida, 0,0530 g (0,270 mmol) de ascorbato de sódio, 0,150 g (0,675 mmol) do alquino 2 e 0,0340 g (0,136 mmol) de CuSO4·5H2O. CCD Rf = 0,73 (hexano-acetato de etila-diclorometano 3:1:3 v/v). Tf: 88,1-89,4 oC. IV (ATR) 4-(metilbenzidrilóxi)-1-(4-metoxibenzil)-1H-1,2,3-triazol (4i) Sólido branco obtido em 74% de rendimento (0,193 g; 0,500 mmol) a partir de 0,121 g (0,741 mmol) de 4-metoxibenzilazida, 0,0530 g (0,270 mmol) de ascorbato de sódio, 0,150 g (0,675 mmol) do alquino 2 e 0,0340 g (0,136 mmol) de CuSO4·5H2O. CCD Rf = 0,69 (hexano-acetato de etila-diclorometano 3:1:3 v/v). Tf: 84,7-85,5 °C. IV (ATR) 4-(metilbenzidrilóxi)-1-(3-metilbenzil)-1H-1,2,3-triazol (4j) Sólido branco obtido em 42% de rendimento 0,106 g (0,287 mmol) a partir de 0,110 g (0,750 mmol) de 3-metilbenzilazida, 0,0530 g (0,270 mmol) de ascorbato de sódio, 0,150 g (0,675 mmol) do alquino 2 e 0,0340 g (0,136 mmol) de CuSO4·5H2O. CCD Rf = 0,51 (hexano-acetato de etila-diclorometano 3:1:3 v/v). Tf: 106,3-106,6 °C. IV (ATR) 4-(metilbenzidrilóxi)-1-(4-nitrobenzil)-1H-1,2,3-triazol (4k) Sólido amarelo obtido em 84% de rendimento (0,226 g; 0,564 mmol) a partir de 0,132 g (0,741 mmol) de 4-nitrobenzilazida, 0,0530 g (0,270 mmol) de ascorbato de sódio, 0,150 g (0,675 mmol) do alquino 2 e 0,0340 g (0,136 mmol) de CuSO4·5H2O. CCD Rf = 0,38 (hexano-acetato de etila-diclorometano 3:1:3 v/v). Tf: 104,5-106,3 °C. IV (ATR) 4-(metilbenzidrilóxi)-1-(4-metilbenzil)-1H-1,2,3-triazol (4l) Sólido branco obtido em 88% de rendimento (0,196 g; 0,530 mmol) a partir de 0,940 g (0,710 mmol) de 4-metilbenzilazida, 0,0500 g (0,250 mmol) de ascorbato de sódio, 0,140 g (0,630 mmol) do alquino 2 e 0,0320 g (0,130 mmol) de CuSO4·5H2O. CCD Rf = 0,71 (hexano-acetato de etila-diclorometano 3:1:3 v/v). Tf: 76,0-77,8 °C. IV (ATR) 4-(metilbenzidrilóxi)-1-(4-trifluorometoxibenzil)-1H-1,2,3-triazol (4m) Sólido branco obtido em 72% de rendimento (0,071 g; 0,161 mmol) a partir de 0,054 g (0,248 mmol) de 4-trifluorometoxibenzilazida, 0,0180 g (0,0910 mmol) de ascorbato de sódio, 0,0500 g (0,225 mmol) do alquino 2 e 0,0120 g (0,0480 mmol) de CuSO4·5H2O. CCD Rf = 0,65 (hexano-acetato de etila-diclorometano 3:1:3 v/v). Tf: 90-90,6 °C. IV (ATR) 4-(metilbenzidrilóxi)-1-(2-nitro-4-(trifluorometilfenil)-1H-1,2,3-triazol (4n) Sólido amarelo obtido em 54% de rendimento (0,144 g; 0,316 mmol) a partir de 0,150 g (0,642 mmol) de 2-nitro-4-trifluorometilfenilazida, 0,046 g (0,233 mmol) de ascorbato de sódio, 0,130 g (0,584 mmol) do alquino 2 e 0,029 g (0,116 mmol) de CuSO4·5H2O. CCD Rf = 0,66 (hexano-acetato de etila-diclorometano 3:1:3 v/v). Tf: 149,2-150,6 °C. IV (ATR) Procedimento geral para a obtençao dos derivados 1.2.3-triazólicos da benzofenona 5a-5m Para a síntese dos compostos triazólicos 5a-5m, foi empregado procedimento similar ao descrito para os derivados 4a-4n. Entretanto, foi utilizado como alquino terminal o pent-4-in-ilóxi difenilmetano (3) e o tempo de reaçao foi de 4 horas. As informaçoes pertinentes às reaçoes envolvidas na preparaçao dos compostos 5a-5m e os dados que suportam as estruturas destes estao descritos a seguir. 4-(3-propilbenzidrilóxi)-1-benzil-1H-1,2,3-triazol (5a) Sólido branco obtido em 70% de rendimento (0,100 g; 0,260 mmol) a partir de 0,077 g (0,580 mmol) de benzilazida, 0,042 g (0,212 mmol) de ascorbato de sódio, 0,132 g (0,527 mmol) do alquino 3 e 0,026 g (0,108 mmol) de CuSO4·5H2O. CCD Rf = 0,52 (hexano-acetato de etila-diclorometano 3:1:3 v/v). Tf: 83,4-84,1 °C. IV (ATR) 4-(3-propilbenzidrilóxi)-1-(4-bromobenzyl)-1H-1,2,3-triazol (5b) Sólido branco obtido em 42% de rendimento (0,116 g; 0,250 mmol) a partir de 0,139 g (0,659 mmol) de 4-bromobenzilazida, 0,047 g (0,239 mmol) de ascorbato de sódio, 0,150 g (0,599 mmol) do alquino 3 e 0,030 g (0,119 mmol) de CuSO4·5H2O. CCD Rf = 0,58 (hexano-acetato de etila-diclorometano 3:1:3 v/v). Tf: 94,6-95,2 °C. IV (ATR) 4-(3-propilbenzidrilóxi)-1-(4-fluorobenzil)-1H-1,2,3-triazol (5c) Sólido branco obtido em 49% de rendimento (0,103 g; 0,256 mmol) a partir de 0,086 g (0,571 mmol) de 4-fluorobenzilazida, 0,041 g (0,208 mmol) de ascorbato de sódio, 0,130 g (0,519 mmol) do alquino 3 e 0,026 g (0,104 mmol) de CuSO4·5H2O. CCD Rf = 0,51 (hexano-acetato de etila-diclorometano 3:1:3 v/v). Tf: 69,4-70,1 °C. IV (ATR) 4-(3-propilbenzidrilóxi)-1-(4-clorobenzil)-1H-1,2,3-triazol (5d) Sólido branco obtido em 70% de rendimento (0,165 g; 0,423 mmol) a partir de 0,111 g (0,667 mmol) de 4-clorobenzilazida, 0,048 g (0,243 mmol) de ascorbato de sódio, 0,152 g (0,607 mmol) do alquino 3 e 0,030 g (0,121 mmol) de CuSO4·5H2O. CCD Rf = 0,28 (hexano-acetato de etila-diclorometano 3:1:3 v/v). Tf: 92,6-93,3 °C. IV (ATR) 4-(3-propilbenzidrilóxi)-1-(4-trifluorometilbenzil)-1H-1,2,3-triazol (5e) Sólido branco obtido em 37% de rendimento (0,087 g; 0,192 mmol) a partir de 0,114 g (0,570 mmol) de 4-trifluorobenzilazida, 0,041 g (0,208 mmol) de ascorbato de sódio, 0,130 g (0,519 mmol) do alquino 3 e 0,026 g (0,104 mmol) de CuSO4·5H2O. CCD Rf = 0,30 (hexano-acetato de etila-diclorometano 3:1:3 v/v). Tf: 64,6-65,2 °C. IV (ATR) 4-(3-propilbenzidrilóxi)-1-(2-bromobenzil)-1H-1,2,3-triazol (5f) Oleo incolor obtido em 55,6% de rendimento (0,128 g; 0,276 mmol) a partir de 0,116 g (0,549 mmol) de 2-bromobenzilazida, 0,040 g (0,200 mmol) de ascorbato de sódio, 0,125 g (0,499 mmol) do alquino 3 e 0,025 g (0,100 mmol) de CuSO4·5H2O. CCD Rf = 0,52 (hexano-acetato de etila-diclorometano 3:1:3 v/v). IV (ATR) 4-(3-propilbenzidrilóxi)-1-(4-iodobenzil)-1H-1,2,3-triazol (5g) Sólido branco obtido em 56% de rendimento (0,090 g; 0,176 mmol) a partir de 0,089 g (0,347 mmol) de 4-iodobenzilazida, 0,021 g (0,126 mmol) de ascorbato de sódio, 0,079 g (0,315 mmol) do alquino 3 e 0,0157 g (0,063 mmol) de CuSO4·5H2O. CCD Rf = 0,50 (hexano-acetato de etila-diclorometano 3:1:3 v/v). Tf: 101,2-101,6 °C. IV (ATR) 4-(3-propilbenzidrilóxi)-1-(4-isopropilbenzil)-1H-1,2,3-triazol (5h) Sólido branco obtido em 61% de rendimento (0,120 g; 0,282 mmol) a partir de 0,089 g (0,510 mmol) de 4-isopropilbenzilazida, 0,0365 g (0,185 mmol) de ascorbato de sódio, 0,116 g (0,463 mmol) do alquino 3 e 0,023 g (0,093 mmol) de CuSO4·5H2O. CCD Rf = 0,54 (hexano-acetato de etila-diclorometano 3:1:3 v/v). Tf: 77,7-77,5 °C. IV (ATR) 4-(3-propilbenzidrilóxi)-1-(4-metoxibenzil)-1H-1,2,3-triazol (5i) Sólido branco obtido em 57% de rendimento (0,142 g; 0,343 mmol) a partir de 0,107 g (0,658 mmol) de 4-metoxibenzilazida, 0,047 g (0,239 mmol) de ascorbato de sódio, 0,150 g (0,599 mmol) do alquino 3 e 0,029 g (0,119 mmol) de CuSO4·5H2O. CCD Rf = 0,41 (hexano-acetato de etila-diclorometano 3:1:3 v/v). Tf: 83,6-84,3 °C. IV (ATR) Nao foi possível observar no espectro de RMN de 13C o sinal do carbono aromático ligado ao carbono metileno, pois devido à baixa intensidade do sinal, o mesmo possivelmente se encontra na regiao do ruído do equipamento. 4-(3-(propilbenzidrilóxi)-1-(3-metilbenzil)-1H-1,2,3-triazol (5j) Sólido branco obtido em 52% de rendimento (0,100 g; 0,251 mmol) a partir de 0,090 g (0,616 mmol) de 3-metilbenzilazida, 0,044 g (0,224 mmol) de ascorbato de sódio, 0,120 g (0,480 mmol) do alquino 3 e 0,028 g (0,112 mmol) de CuSO4·5H2O. CCD Rf = 0,50 (hexano-acetato de etila-diclorometano 3:1:3 v/v). Tf: 57,9-58,8 °C. IV (ATR) 4-(3-propilbenzidrilóxi)-1-(4-metilbenzil)-1H-1,2,3-triazol (5k) Sólido branco obtido em 77% de rendimento (0,135 g; 0,339 mmol) a partir de 0,071 g (0,487 mmol) de 3-metilbenzilazida, 0,035 g (0,177 mmol) de ascorbato de sódio, 0,111 g (0,443 mmol) do alquino 3 e 0,022 g (0,088 mmol) de CuSO4·5H2O. CCD Rf = 0,51 (hexano-acetato de etila-diclorometano 3:1:3 v/v). Tf: 102,2-103,0 °C. IV (ATR) 4-(propilbenzidrilóxi)-1-(4-trifluorometoxibenzil)-1H-1,2,3-triazol (5l) Sólido branco obtido em 59% de rendimento (0,132 g; 0,282 mmol) a partir de 0,114 g (0,527 mmol) de 4-trifluorometoxibenzilazida, 0,037 g (0,191 mmol) de ascorbato de sódio, 0,120 g (0,479 mmol) do alquino 3 e 0,024 g (0,096 mmol) de CuSO4·5H2O. CCD Rf = 0,48 (hexano-acetato de etila-diclorometano 3:1:3 v/v). Tf: 76,3-77,5 °C. IV (ATR) 4-(3-propilbenzidrilóxi)-1-(2-nitro-4-trifluorometilfenil)-1H-1,2,3-triazol (5m) Sólido amarelo obtido em 70% de rendimento (0,135 g; 0,279 mmol) a partir de 0,101 g (0,439 mmol) de 2-nitro-4-triflu-orometilfenilazida, 0,031 g (0,160 mmol) de ascorbato de sódio, 0,100 g (0,399 mmol) do alquino 3 e 0,020 g (0,080 mmol) de CuSO4·5H2O. CCD Rf = 0,52 (hexano-acetato de etila-diclorometano 3:1:3 v/v). Tf: 96,0-97,0 °C. IV (ATR) Avaliaçao da atividade fotoprotetora A atividade fotoprotetora dos compostos 4a-4n e 5a-5m foi avaliada segundo metodologia desenvolvida por Mansur e colaboradores,23 utilizando-se espectroscopia no ultravioleta. Determinou-se ainda a atividade fotoprotetora do padrao comercial benzofenona-3. A eficiência dos compostos foi determinada em funçao de seu fator de proteçao solar (FPS). Inicialmente as soluçoes foram diluídas em etanol até atingir a concentraçao final de 3,0 x 10-4 mol L-1. Cada análise foi realizada em triplicata e as médias das repetiçoes (absorbâncias) foram determinadas na faixa de interesse no espectrofotômetro (290-320 nm), com intervalos de 5 nm. Foi utilizado o álcool etílico 96% v/v como branco. Por fim, foi calculado o fator de proteçao solar de cada composto. Para realizaçao desses cálculos foi necessário medir as absorbâncias das soluçoes preparadas em diferentes comprimentos de onda (290, 295, 300, 305, 310, 315, e 320) e posteriormente o fator de proteçao solar (FPS) foi calculado utilizando-se a equaçao mostrada a seguir.12 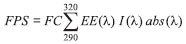 sendo: FC = Fator de correçao (igual a 10); EE (λ) = Efeito eritematogênico da radiaçao de comprimento de onda (λ); I (λ) = Intensidade da luz solar no comprimento de onda; abs (λ) = Absorbância da soluçao do filtro solar no comprimento de onda (λ). Os valores de EE (λ) x I (λ), apresentados na Tabela 1, foram previamente calculados por Sayre e colaboradores.24
Cumpre ressaltar que segundo a RDC nº 30 de 1 de junho de 2012 os métodos preconizados para a determinaçao do (FPS) sao métodos in vivo. Porém, na fase de desenvolvimento da formulaçao de fotoprotetores, pode-se utilizar métodos in vitro para avaliar o FPS.25,26 Cultivo celular e avaliaçao da atividade citotóxica dos compostos 4a-4n e 5a-5m As linhagens celulares utilizadas para avaliaçao da citotoxicidade foram MDA-MB-231 (adenocarcinoma de mama) e B16F10 (melanoma metastático murino). A linhagem MDA-MB-231 foi gentilmente cedida pela Dra. Sandra Martha Gomes Dias (Laboratório Nacional de Biociências, Campinas, Sao Paulo, Brasil) e a linhagem B16F10 foi gentilmente cedida pela Dra. Anésia Aparecida dos Santos (Departamento de Biologia Geral, Universidade Federal de Viçosa, Minas Gerais, Brasil). Para o cultivo utilizou-se meio RPMI 1640 (Roswell Park Memorial Institute Medium, Sigma) pH 7,2 suplementado com 100 U mL-1 de penicilina (Sigma), 100 µg mL-1 de estreptomicina (Sigma) e 10% v/v de soro fetal bovino (SFB, LGC Bio). As células foram crescidas em suspensao utilizando garrafas de 75, 150 e 300 cm2, mantidas em atmosfera com 95% de umidade e 5% de CO2. Para avaliaçao da atividade citotóxica dos compostos, as células foram contadas em câmaras de neubauer, ressuspendidas em meio RPMI 1640 (10% v/v SFB, 100 U mL-1 de penicilina e 100 µg mL-1 de estreptomicina) e incubadas em placa de 96 poços de fundo chato, na densidade de 10.000 células/poço (B16F10) e 25.000 células/poço (MDA-MB-231), mantidas por 24 horas a 37 °C e 5% de CO2 para adaptaçao das células. Os compostos foram avaliados nas concentraçoes de 50 e 100 µmol L-1 por 48 horas de incubaçao a 37 °C e 5% de CO2. Como veículo foi utilizado o dimetilsulfóxido (DMSO) na concentraçao 0,4% v/v. Para verificaçao do efeito citotóxico, foi adicionado a cada poço 10 µL do reagente MTT (3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide, Sigma) na concentraçao 5 mg mL-1 e incubou-se novamente a 37 °C por 4 horas. Posteriormente, o sobrenadante foi removido, o formazan foi ressuspendido em 100 µL de DMSO e a leitura de absorbância no comprimento de onda de 540 nm foi realizada em leitora automática de microplacas (Biotek Sinergy HT). Para os cálculos da viabilidade e preparo dos gráficos utilizaram-se os programas Microsoft Excel e Prism5. Avaliaçao da atividade antiviral
Vírus Zika (ZIKV), cepa ZIKV/H.sapiens/Brazil/PE243/2015, foram replicados em células C6/36 (ATCC® CRL-1660TM) em meio L-15 (Leibovitz's L-15) suplementado com 2% de Soro Fetal Bovino (SFB) e posteriormente estocados. Para os ensaios de citotoxicidade e titulaçao viral foram utilizadas células Vero (ATCC® CCL-81TM), mantidas em meio DMEM (Dulbecco's Modified Eagle' Medium) suplementado com SFB a 37 °C e atmosfera de 5% de CO2. Avaliaçao da citotoxicidade contra células Vero O método de avaliaçao da viabilidade celular por MTT [brometo de 3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazólio) InvitrogenTM] foi utilizado para determinar a citotoxicidade dos compostos frente às células Vero. Placas de 96 poços foram semeadas com 5x103 células Vero por poço e incubadas até confluência. As células foram entao expostas por 24 horas a diferentes concentraçoes dos compostos partindo de 1000 µmol L-1 até 1 µmol L-1. Após esse período, o meio com os compostos foi substituído por DMEM contendo MTT em uma diluiçao final de 0,5 mg mL-1 e incubado novamente por 4 horas a 37 °C. O sobrenadante entao foi substituído por 100 µL/poço de dimetilsulfóxido e após breve agitaçao, a absorbância foi medida em 540 nm e os resultados expressos por uma regressao nao linear, na qual o controle negativo (células sem presença de composto sob avaliaçao) foi considerado como 100% de viabilidade. Triagem antiviral A triagem antiviral dos compostos foi feita utilizando como base o valor de CC50 de cada composto obtido do ensaio de citotoxicidade. Após confluência de aproximadamente 80% das células Vero em placas de 96 poços, o Zika Vírus (ZIKV) foi previamente incubado por 1 hora a 37 °C com o composto a ser testado, adicionado na monocamada de células e incubado por mais 90 minutos. Decorrido esse período, o conteúdo dos poços foi substituído por DMEM e as placas incubadas por até 7 dias a 37 °C e 5% CO2. O controle negativo (células nao infectadas com o vírus) foi considerado como 100% de viabilidade e o controle positivo (células infectadas com ZIKV) como 0%. A viabilidade celular foi avaliada pelo método MTT. Prediçao de características farmacocinéticas e toxicidade dos derivados triazólicos da benzofenona 4a-4n e 5a-5m A prediçao das características farmacocinéticas e de toxicidade sistêmica foi realizada por análises computacionais utilizando três diferentes programas. O programa Marvin Sketch versao 16.6.20.0 (http://www.chemaxon.com/products/marvin/marvinsketch/) foi utilizado para prediçao do coeficiente de partiçao (LogP) e o coeficiente foi calculado utilizando o método Consensus e concentraçoes padroes de íons cloro, potássio e sódio de 0,1 mol L-1. A probabilidade de absorçao intestinal e atravessar a barreira hematoencefálica de humanos, bem como a toxicidade aguda para ratos foram preditos utilizando o website admetSAR versao 2.0 (http://lmmd.ecust.edu.cn/admetsar1/home/). A probabilidade de induzir toxicidade cutânea por sensibilizaçao foi predita pelo website Pred-skin versao 2.0 (http://labmol.com.br/predskin/) e ambos os valores dos parâmetros Human skin sensitization e Murine local lymph node assay (LLNA) Multiclass Pred foram recuperados.
RESULTADOS E DISCUSSAO Síntese dos derivados da benzofenona contendo núcleo 1,2,3-triazólico Os compostos triazólicos derivados da benzofenona foram preparados em três etapas como apresentado no Esquema 1.
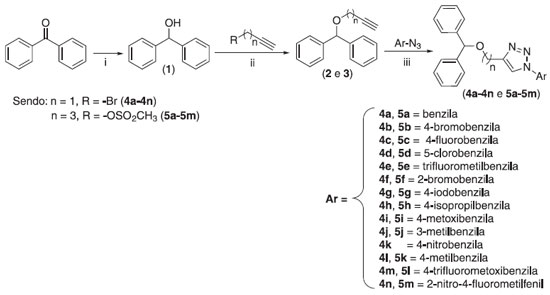 Esquema 1. Preparaçao dos compostos triazólicos derivados da benzofenona. Reagentes e condiçoes: (i) NaBH4/EtOH, (ii) (Bu)4NBr, 35% aq. NaOH, tolueno, (iii) Ascorbato de sódio, CH2Cl2, H2O, CuSO4∙5H2O, t.a.
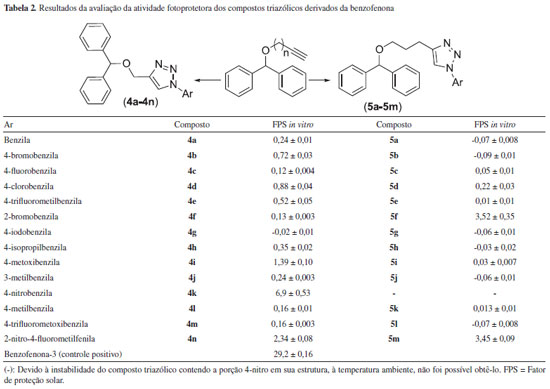
A primeira etapa envolveu a reaçao de reduçao da benzofenona disponível comercialmente com o boroidreto de sódio (NaBH4) em etanol, resultando na obtençao do difenilmetanol (1). Uma vez sintetizado, o difenilmetanol foi tratado com brometo de propargila e soluçao aquosa de NaOH, na presença do catalisador de transferência de fase brometo de tetrabutilamônio (Bu)4NBr), resultando, via substituiçao nucleofílica bimolecular, na formaçao do alquino terminal 2 com 78% de rendimento. De forma análoga ao composto 2, o alquino 3 foi preparado em 65% de rendimento, via reaçao de substituiçao nucleofílica bimolecular entre o difenilmetanol e o pent-4-in-1-ilmetanosulfonato. Este último por sua vez, foi sintetizado a partir do álcool pent-4-in-1-ol.27 Na última etapa da rota sintética, os derivados da benzofenona contendo núcleos triazólicos 4a-4n foram obtidos empregando-se condiçoes reacionais brandas e com rendimentos variando de 42%-88%, via reaçoes "click" catalisadas por cobre(I) entre o alquino 2 e diferentes azidas orgânicas.28 As azidas empregadas na síntese dos derivados triazólicos foram preparadas de forma similar ao descrito na literatura.29 Com o intuito de avaliar a influência do tamanho da cadeia carbônica nas atividades biológicas dos compostos, outra série de derivados da benzofenona contendo o núcleo 1,2,3-triazólico 5a-5m foi obtida de forma semelhante à síntese dos compostos triazólicos discutidos anteriormente (Esquema 1), com rendimentos variando entre 37%-77%. Descriçao dos resultados dos ensaios de avaliaçao da atividade fotoprotetora Os compostos 4a-4n e 5a-5m assim como o controle positivo Benzofenona-3 foram submetidos a testes para a avaliaçao de suas atividades fotoprotetoras aplicando-se a metodologia descrita por Mansur e colaboradores.23 Esse método além de ser considerado simples, preciso e rápido na obtençao de resultados, é muito empregado a fim de facilitar as determinaçoes dos FPS in vitro e eliminar os riscos para a saúde dos seres humanos.23,30 Na Tabela 2, estao descritos os valores de FPS obtidos para os derivados da benzofenona 4a-4n e 5a-5m na faixa do UVB (290-320 nm).
Conforme apresentado na Tabela 2, dentre os derivados da benzofenona sintetizados somente o composto 4k, que apresenta um grupo 4-nitrobenzila ligado à porçao triazólica, foi aquele que apresentou o maior efeito fotoprotetor, com FPS-UVB de 6,9 ± 0,53 na concentraçao de 3,0 x 10-4 mol L-1. Esse valor é inferior ao do padrao Benzofenona-3, utilizado como controle positivo, cujo FPS foi igual a 29,2 ± 0,16. Os demais compostos triazólicos apresentaram um FPS inferior a 3,45. De acordo com a resoluçao - RDC N° 30, aprovada em 1° de junho de 2012,25 um produto para ser considerado adequado para uso e comercializado como protetor solar deve apresentar um fator de proteçao igual ou superior a 6 (Tabela 3).
Conforme descrito anteriormente, o valor do FPS in vitro calculado para a substância 4k foi de 6,9 ± 0,53. Considerando-se esta informaçao, pode-se dizer que esta substância atende ao que é preconizado pela ANVISA com respeito aos protetores solares, podendo ser considerado um composto para assegurar a proteçao dos indivíduos com foto tipos menos sensíveis às queimaduras solares. Avaliaçao da atividade citotóxica Os compostos triazólicos derivados da benzofenona sintetizados foram avaliados em relaçao aos seus efeitos citotóxicos contra as linhagens tumorais MDA-MB-231 (adenocarcinoma de mama) e B16F10 (melanoma metastático murino). Conforme mostrado na Figura 1A, na concentraçao 100 µmol L-1, os compostos que apresentaram maior atividade citotóxica contra a linhagem MDA-MB-231 foram 4b, 4d e 5h, os quais reduziram a viabilidade celular em 56,3, 53,7 e 54,4%, respectivamente, podendo ser considerados moderadamente citotóxicos por indicarem IC50 < 100 µmol L-1. Nessa mesma concentraçao, os compostos 4e, 4g, 5e e 5l também indicaram efeito citotóxico significativo, uma vez que reduziram a viabilidade celular em pelo menos 30%, resultado similar ao observado para o flavonoide morina, o qual possui atividade antimetastática sobre células MDA-MB-231.31 Por sua vez, na concentraçao 50 µmol L-1, os compostos 4b, 4d, 4e, 5e, 5h e 5l também foram capazes de reduzir a viabilidade celular em pelo menos 30% (Figura 1B), confirmando assim o potencial citotóxico destas substâncias sobre a linhagem de adenocarcinoma de mama.
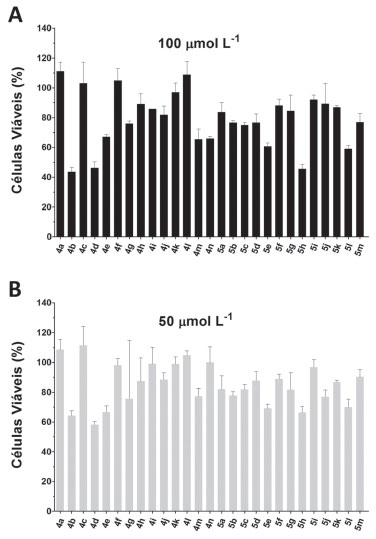 Figura 1. Efeito dos compostos triazólicos derivados da benzofenona sobre a viabilidade (%) da linhagem celular MDA-MB-231 após 48 horas de exposiçao aos compostos. É possível inferir a partir dos resultados obtidos que os compostos 4b, 4e e 5h apresentam IC50 < 100 μmol L-1. Os dados estao apresentados como média ± desvio padrao
Em relaçao ao efeito citotóxico sobre a linhagem de melanoma metastático B16F10, a qual é sabidamente mais resistente ao tratamento quimioterápico em geral,32 apenas os compostos 5b, 5c, 5j e 5l apresentaram atividade citotóxica na concentraçao 100 µmol L-1, reduzindo a viabilidade celular em aproximadamente 20% (dados nao mostrados). Avaliaçao da atividade antiviral Citotoxicidade dos derivados triazólicos frente às células Vero A avaliaçao do efeito citotóxico frente às células Vero dos compostos sintetizados revelou que apenas 4d apresentou citotoxicidade inferior a 100 µmol L-1. Os demais compostos, conforme apresentado na Tabela 4, apresentaram baixa toxidade frente às células Vero. Os valores de citotoxicidade sao representados por CC50 e correspondem a concentraçao que resulta na morte de 50% das células expostas a concentraçoes crescentes do composto.

Triagem antiviral Conforme pode ser observado na Figura 2, os compostos 5j e 5h foram os mais eficientes em termos de manutençao da viabilidade celular (aproximadamente 43% e 32%, respectivamente). É importante destacar que alguns compostos nao puderam ser avaliados devido a problemas de precipitaçao durante a conduçao dos ensaios de avaliaçao de atividade antiviral.
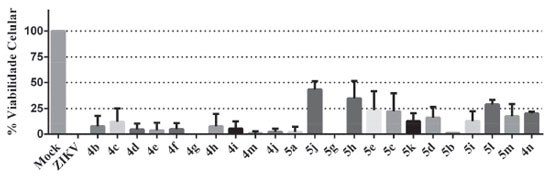
Figura 2. Triagem Antiviral contra ZIKV. Como controle negativo, células foram infectadas com MOI 1 do vírus (ZIKV) e consideradas como 0% de viabilidade celular. (Mock) células nao infectadas, controle positivo. A viabilidade celular foi avaliada pelo método MTT. Os compostos nao mostrados no gráfico sofreram precipitaçao durante os bioensaios e nao foram avaliados
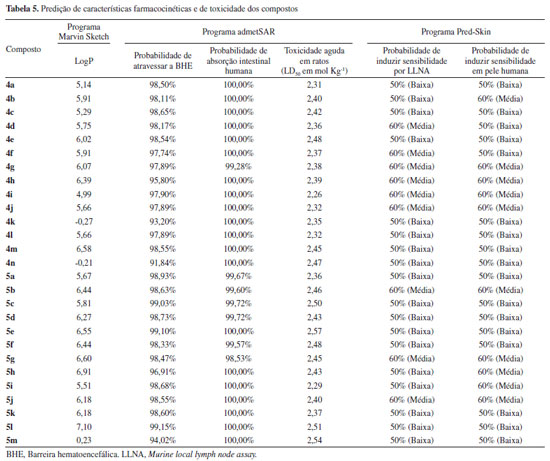
Para ser utilizado em ensaios subsequentes em avaliaçoes de compostos como antivirais, é desejável uma manutençao mínima de 50% da viabilidade celular. Nesse contexto, nenhum dos compostos analisados foi elegível para ser empregado em ensaios subsequentes. Prediçao das características farmacocinéticas e de toxicidade dos compostos 4a-4n e 5a-5m As características farmacocinéticas e de toxicidadein vivoforam preditas utilizando três diferentes programas e estao resumidas na Tabela 5. O coeficiente de partiçao (LogP) predito pelo programa Marvin Sketch indica que a maioria dos compostos possuem baixa polaridade e sao compatíveis com a alta probabilidade de absorçao intestinal e capacidade de atravessar a barreira hematoencefálica. Essas características sao importantes para moléculas que serao utilizadas para tratamento sistêmico de câncer e doenças virais como infecçao por Zika. A capacidade de induzir sensibilidade na pele variou de baixa a média, com nenhum dos derivados apresentando elevado potencial de toxicidade cutânea. Entre os compostos com menor potencial de induzir toxicidade por sensibilidade na pele está o composto 4k, que apresentou maior poder fotoprotetor. Apesar de possuir bom potencial de absorçao, a toxicidade aguda para ratos variou de 2,31 a 2,57 mol L-1e deve ser experimentalmente testada antes dos experimentosin vivo.
CONCLUSAO A síntese de vinte e sete derivados triazólicos da benzofenona (compostos 4a-4n e 5a-5m) foi possível empregando-se reaçoes de reduçao, alquilaçao e reaçoes "click" (reaçoes CuAAC). Os ensaios de avaliaçao da atividade fotoprotetora destes compostos demonstraram que a substância 4k apresentou açao fotoprotetora in vitro, resultando em FPS de aproximadamente 7, enquanto que os demais compostos apresentaram um FPS inferior a 3,5, sendo estes, por tanto, considerados inativos. Diante desses resultados, conclui-se que o derivado da benzofenona 4k embora apresente um fator de proteçao inferior ao controle positivo benzofenona-3, ele ainda se apresenta superior ao desejável e estabelecido como mínimo aceito pela legislaçao brasileira. Sugere-se que essa substância pode ser empregada em combinaçao com outros filtros orgânicos, como um possível candidato em formulaçoes fotoprotetoras para aumentar a proteçao contra os raios UVB. Além disso, a otimizaçao de sua estrutura poderá resultar futuramente no desenvolvimento de uma substância eficaz para aplicaçoes como filtro solar. Mesmo nao apresentando resultados de manutençao da viabilidade celular igual ou superior a 50% como desejável, os compostos 5j e 5h ainda assim apresentam resultados significativos com respeito ao ensaio contra o ZIKV. Já os compostos 4b, 4d e 5h foram capazes de significativamente inibir a viabilidade de linhagem de câncer de mama humano e terao seus mecanismos de açao investigados. Os compostos também apresentam alto potencial de ser absorvidos pelo intestino humano e baixa capacidade de induzir sensibilidade na pele, vias de administraçao de interesse para tratamento antiviral, anticâncer e fotoprotetora, respectivamente. Porém, a toxicidade oral dos compostos deve ser investigada em futuros experimentos, uma vez que a LD50 predita para camundongo ficou abaixo de 3 mol kg-1.
MATERIAL SUPLEMENTAR Todos os dados espectroscópicos utilizados neste trabalho estao disponíveis emhttp://quimicanova.sbq.org.br, na forma de arquivo PDF, com acesso livre.
AGRADECIMENTOS A Fundaçao de Amparo à Pesquisa do Estado de Minas Gerais (FAPEMIG) pelo apoio financeiro (CEX- APQ-02432-14; CEX - APQ-03245-15). A Coordenaçao de Aperfeiçoamento de Pessoal (CAPES) pela concessao de bolsa de estudos à Angela Maria Almeida Lima.
REFERENCIAS 1. Cuesta-Rubio, O.; Piccinelli, A. L.; Rastrelli, L. In Studies in Natural Products Chemistry, Vol. 32; Rahman, A.-ur., ed.; Elsevier: Amsterdan, 2005, p. 671. 2. Baggett. S.; Mazzola, E. P.; Kennelly, E. J. In Studies in Natural Products Chemistry, Vol. 32; Rahman, A.-ur., ed.; Elsevier: Amsterdan, 2005, p. 721. 3. Lima, A. M. A.; Teixeira, R. R. In Frontiers in Natural Product Chemistry, Vol. 3; Rahman, A.-ur., ed.; Bentham Science Publishers: Sharjah, 2017, p. 293. 4. De Paula, L. R.; Parussulo, A. L. A.; Araki, K.; Toma, H. E.; J. Pharm. Sci. 2012, 101, 726. 5. Nascimento, L. F.; Santos, E. P.; Aguiar, A. P.; Rev. Virtual Quim. 2014, 6, 190. 6. Santos, E. P.; Freitas, Z. M.; Souza, K. R.; Garcia, S.; Int. J. Cosmet. Sci. 1999, 21, 1. 7. Araújo, C. R. M.; Santos, V. L. A., ; Guimaraes, D. G.; Oliveira-Junior, R. G.; Almeida, J. R. G. S.; Gonsalves, A. A.; Rev. Virtual Quim. 2014, 6, 1702. 8. Lopes, F. M.; Da Cruz, R. O.; Batista, K. A.; Ensaios e Ciência: Ciências Biológicas, Agrárias e da Saúde 2012, 16, 183. 9. Estimativa 2018: incidência de câncer no Brasil/Instituto Nacional de Câncer José Alencar Gomes da Silva, Coordenaçao de Prevençao e Vigilância. - Rio de Janeiro: INCA, 2017, 128 p. 10. Borghetti, G. S.; Knorst, M. T.; Rev. Bras. Cienc. Farm. 2006, 42, 531. 11. Balogh, T. S.; Pedriali, C. A.; Baby, A. R.; Velasco, M. V. R.; Kaneko, T. M.; An. Bras. Dermatol. 2011, 86, 732. 12. Cabral, L. D. S.; Pereira, S. O.; Partata, A. K.; Rev. Cient. ITPAC 2011, 4. 13. Flor, J.; Davolos, M. R.; Correa, M. A.; Quim. Nova 2007, 30, 153. 14. Figueiredo, S. A.; Dissertaçao de Mestrado, Universidade de Sao Paulo, Brasil, 2013. 15. Ribeiro, R. P.; Do Santos, V. M.; De Medeiros, B. C.; Silva, V. A.; Volpato, N. M.; Garcia, S.; Infarma 2004, 16, 85. 16. Dutra, E. A.; Dissertaçao de Mestrado, Universidade de Sao Paulo, 2000. 17.https://www.cdc.gov/biomonitoring/Benzophenone-3_FactSheet.html, acesso em Maio 2019. 18. Teixeira, R. R.; Bressan, G. C.; Pereira, W. L.; Ferreira, J. G; de Oliveira, F. M.; Thomaz, D. C.; Molecules 2013, 18, 1881. 19. da Silva Maia, A. F.; Siqueira, R. P.; de Oliveira, F. M.; Ferreira, J. G.; da Silva, S. F.; Caiuby, C. A. D.; de Oliveira, L. L.; de Paula, S. O.; Souza, R. A. C.; Guilardi, S.; Bressan, G. C.; Teixeira, R. R.; Bioorg. Med. Chem. Lett. 2016, 26, 2810. 20. Siqueira, R. P.; de Andrade Barros, M. V.; Barbosa, E. A. A.; Onofre, T. S.; Gonçalves, V. H. S.; Pereira, H. S.; Júnior, A. S.; de Oliveira, L. L.; Almeida, M. R.; Fietto, J. L. R.; Teixeira. R. R.; Bressan, G. C.; Eur. J. Med. Chem. 2017, 134, 97. 21. Oliveira, A. F. C. S.; de Souza, A. P. M.; de Oliveira, A. S.; da Silva, M. L.; de Oliveira, F. M.; Santos, E. G.; da Silva, I. E. P.; Ferreira, R. F.; Villela, F. S.; Martins, F. T.; Leal, D. H. S.; Vaz, B. G.; Teixeira, de Paula, S. O.; Eur. J. Med. Chem. 2018, 149, 98. 22. Dheer, D.; Singh, V.; Shankar, R.; Bioorg. Chem. 2017, 71, 30. 23. Mansur, J. S.; Breder, M. N. R.; Mansur, M. C. D.; Azulay, R. D.; An. Bras. Dermatol. 1986, 61, 167. 24. Sayre, R. M.; Agin, P. P.; Levee, G. J.; Marlowe, E.; Photochem. Photobiol. 1979, 29, 559. 25.http://bvsms.saude.gov.br/bvs, acesso em Maio de 2019. 26. Gonçalves, M. C.; Rossoni Junior, J. V.; Rabelo, A. C. S.; Costa, D. C.; Cazati, T.; Taylor, J. G.; dos Santos, V. M. R.; Rev. Virtual Quim. 2018, 10, 600. 27. Teixeira, R. R.; Gazolla, P. A. R.; Da Silva, A. M.; Borsodi, M. P. G.; Bergmann, B. R.; Ferreira, R. S.; Vaz, B. G.; Vasconcelos, G. A.; Lima, W. P.; Eur. J. Med. Chem. 2018, 146, 274. 28. Mose, J. E.; Moorhouse, A. D.; Chem. Soc. Rev. 2007, 36, 1249. 29. Borgati, T, F.; Alves, R. B.; Teixeira, R. R.; De Freitas, R. P.; Perdigao, T. G.; Da Silva, S. F.; dos Santos, A. A.; Bastidas, J. O.; J. Braz. Chem. Soc. 2013, 24, 953. 30. Alves, L. M.; Aegerter, M. A.; Hata, K.; An. Bras. Dermatol. 1991, 66, 313. 31. Jin, H.; Lee, W. S.; Eun, S. Y.; Jung, H. J.; Park, H.-S.; Kim, G.; Choi, Y. H.; Ryu, C. H.; Jung, J. M.; Hong, S. C.; Shin, S. C.; Kim, H. J.; Int. J. Oncology 2014, 45, 1629. 32. Anvekar, R. A.; Asciolla, J. J.; Lopez-Rivera, E.; Floros, K. V.; Izadmehr, S.; Elkholi, R.; Belbin, G.; Sikora, A. G.; Chipuk, J. E.; Cell Death Dis. 2012, 3, e420. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access






 max/cm-1: 3279, 3062, 3024, 2954, 2915, 2875, 2113, 2038, 1978, 1886, 1822, 1760, 1662, 1596, 1491, 1452, 1363, 1348, 1265, 1184, 1092, 1065, 1021, 959, 911, 745, 696, 635, 578, 525. RMN de 1H (300 MHz, CDCl3) δ: 2,49 (s, 1H); 4,18 (s, 1H); 5,71 (s, 2H); 7,41-7,29 (m, 10H). RMN de 13C (75 MHz, CDCl3) δ: 55,8; 74,6; 79,7; 81,6 127,3; 127,7; 128,4; 141,1.
max/cm-1: 3279, 3062, 3024, 2954, 2915, 2875, 2113, 2038, 1978, 1886, 1822, 1760, 1662, 1596, 1491, 1452, 1363, 1348, 1265, 1184, 1092, 1065, 1021, 959, 911, 745, 696, 635, 578, 525. RMN de 1H (300 MHz, CDCl3) δ: 2,49 (s, 1H); 4,18 (s, 1H); 5,71 (s, 2H); 7,41-7,29 (m, 10H). RMN de 13C (75 MHz, CDCl3) δ: 55,8; 74,6; 79,7; 81,6 127,3; 127,7; 128,4; 141,1.