Artigo
|
|
| Otimização das condições fermentativas de Pichia membranifaciens para produção de etanol de segunda geração Optimization of fermentative conditions of Pichia membranifaciens for second generation etanol production |
|
Natália N. Ribeiro*,#; Lidyane A. Freita#; Letícia F. Tralli#; Aline F. Silva#; Cristhyane M. Freita#; Franciele Q. Mendes#; Vitor Teixeira#; Calisto N. S. Junior#; Márcia J. R. Mutton#
Departamento de Tecnologia, Faculdade de Ciências Agrárias e Veterinárias, Universidade Estadual Paulista 14884-900 Jaboticabal – SP, Brasil Recebido em 13/02/2019 *e-mail: nnovaisribeiro@gmail.com Technologies developed in the last decade have made viable the use of lignocellulosic materials for the production of ethanol. However, to improve the fermentative yield some improvements are necessary, among them the search for new microorganisms capable of fermenting sugars with five carbons. Thus, the present research aimed to determine the best pH and temperature for Pichia membranifaciens LJ04 in synthetic medium containing pentose, aiming at the biotechnological production of ethanol from hemicellulosic hydrolysate. The experimental design was completely randomized in Split-Split-Plot, with 3 replicates. The main treatments were pHs (3.5, 4.0 and 4.5), the secondary were temperatures (32 °C, 37 °C and 40 °C) and the tertiary were fermentation periods (0, 6, 12 and 24 hours). It was determined in this study that the ideal conditions were temperature of 32 °C and pH 4.0-4.5. With these conditions there was higher xylose consumption, high ethanol production, low production of secondary compounds and high rates of cell viability during fermentation. INTRODUÇÃO O etanol possui grande importância para a economia brasileira, pois, além de apresentar diversas aplicações industriais, apresenta-se como uma alternativa energética viável para a substituição gradativa do uso do petróleo. Destaca-se que sua aplicação em motores de explosão contribuiu para a ascensão do mercado de combustíveis renováveis e no estabelecimento de indústrias químicas de base sustentadas pelo uso de biomassa de origem agrícola.1 Nas últimas quatro décadas, o Brasil se tornou o segundo maior produtor de etanol através da adoção de estratégias de expansão de produção a partir da cana-de-açúcar, entretanto, esse crescimento não será o suficiente para atender a futura demanda de exportações, necessitando de implementação de outras matérias-primas e tecnologias.2 Visando o aumento do volume de etanol produzido sem que haja a necessidade da expansão de terras cultiváveis, a utilização de biomassas lignocelulósicas para produção deste biocombustível surge como uma atividade promissora. A adoção da utilização do bagaço e palha de cana-de-açúcar poderá suprir a demanda necessária para atender o mercado interno e externo.2 Denominado etanol de 2ª geração, esse biocombustível já possui promissoras tecnologias de tratamento para quebra da estrutura complexa do bagaço (celulose, hemicelulose e lignina)3 que liberam pentoses como D-xilose e L-arabinose; e hexoses como D-glicose, D-manose e D-galactose.4 Após a liberação desses açúcares, as leveduras são capazes de realizar o processo fermentativo. A fermentação é a etapa na qual ocorre a conversão do substrato (mosto) em etanol e outros compostos indesejados por intermédio de reações metabólicas realizadas por microrganismos.5 Entretanto, a levedura Saccharomyces cerevisiae, utilizada nos processos de produção de etanol de 1ª geração, não é capaz de metabolizar açúcares com cinco carbonos.6 Dessa forma, faz-se necessária a busca por microrganismos capazes de realizar a fermentação de pentoses. De acordo com registros da literatura, há um grande número de leveduras que metabolizam xilose, entretanto, somente cerca de 1% delas são capazes de fermentar xilose em etanol,7 dentre essas destaca-se Pichia membranifaciens. Amplamente distribuída na natureza, é considerada um microrganismo de degradação de alimentos e bebidas, sendo encontrada em materiais vegetais, frutas em estado de deterioração e bebidas fermentadas.8 Esse microrganismo também foi identificado como parte da microbiota de processos de fermentação espontânea para produção de licores destilados na China,9,10 produção de vinhos11,12 e fermentação de azeitonas pretas e verdes.13-15 Entretanto, registros referentes a sua utilização em processos fermentativos para a produção de etanol 2G são escassos na literatura. Para que processos com novos microrganismos isolados obtenham alta taxa de rendimento, é necessária a realização de estudos para estabelecer as condições fermentativas que garantam que as leveduras consigam produzir concentrações altas de etanol sem que haja um alto índice de mortalidade das células. Dentre os fatores que afetam diretamente o processo fermentativo, destacam-se pH e temperatura.5 O pH tem grande influência nas fermentações industriais, devido ao controle da contaminação bacteriana e ao seu efeito no crescimento das leveduras, sendo em geral encontrados pHs ideais para leveduras na faixa de 4,5 à 5,0.1 A temperatura é um dos fatores mais importantes da fermentação. O estudo e conhecimento dessa grandeza é de suma importância, pois exerce efeitos no crescimento, viabilidade, metabolismo e fermentação.16 Nesse contexto, para que se obtenha um bom rendimento fermentativo, a escolha do microrganismo deve ser acompanhado por estudo de fatores que interferem sobre as condições ideias de crescimento e de fermentação. Dessa forma, todo o potencial pode ser explorado, possibilitando melhores rendimentos e diminuição de perdas. O presente trabalho teve como objetivo definir o melhor pH e temperatura para Pichia membranifaciens LJ04 em mostos sintéticos com pentoses visando a futura utilização em licores hemicelulósicos.
PARTE EXPERIMENTAL Local do experimento O experimento foi conduzido no Laboratório de Açúcar e do Álcool e Microbiologia das Fermentações, do Departamento de Tecnologia, na Faculdade de Ciências Agrárias e Veterinárias/UNESP, campus de Jaboticabal-SP, em parceria com o Laboratório de Biotecnologia, na Escola de Engenharia de Lorena - EEL/USP, campus de Lorena – SP. Microrganismo A levedura utilizada foi a Pichia membranifaciens cepa LJ4, pertencente ao banco de microrganismos do Laboratório de Microbiologia das Fermentações, do Departamento de Tecnologia, localizado na Faculdade de Ciências Agrárias e Veterinárias/UNESP, campus de Jaboticabal – SP. Preparo do inóculo Para crescimento de massa celular os microrganismos foram inoculados com uma alça de platina em erlenmeyers com 200 mL de meio YPXD (Yeast extract-Peptone-Xylose-Dextrose) contendo 10 g L-1 de extrato de levedura, 20 g L-1 de peptona, 10 g L-1 de xilose e 10 g L-1 de glicose.17 Os frascos foram incubados por 72 h à temperatura de 32 °C sob agitação orbital (0,36 g-force). Ao final desse período o meio de cultura foi centrifugado, descartando-se a fração líquida. A massa celular obtida foi suspendida em salina (NaCl 0,85%) e armazenada à 4 °C. Todos os procedimentos foram repetidos até que se obtivesse quantidade suficiente para realizar os processos fermentativos com concentração celular de 108 células mL-1. Preparo do mosto sintético Para a realização dos ensaios foram diluídos 45 g L-1 de xilose e 25 g L-1 de glicose em água destilada, sendo posteriormente suplementados com sulfato de amônio, fosfato de sódio, sulfato de potássio, sulfato de magnésio, sulfato de manganês e sulfato de zinco. Os reagentes foram adicionados proporcionalmente para obtenção de 0,3 g L-1 de Nitrogênio, 0,3 g L-1 de Fósforo, 0,3 g L-1 de Potássio, 0,05 g L-1 de Magnésio, 0,01 g L-1 de Manganês e 0,01 g L-1 de Zinco nos mostos, valores essenciais para realização da fermentação alcoólica e manutenção das células de levedura.18 Teste de pH e temperatura O delineamento experimental utilizado foi o inteiramente casualizado num esquema de parcelas sub-subdivididas, com 3 repetições. Os tratamentos principais foram caracterizados pelos pHs (3,5, 4,0 e 4,5), os secundários as temperaturas (32 °C, 37 °C e 40 °C) e os terciários aos tempos (0, 6, 12 e 24h). Dessa forma, as condições fermentativas foram controladas e analisadas de acordo com a Figura 1.
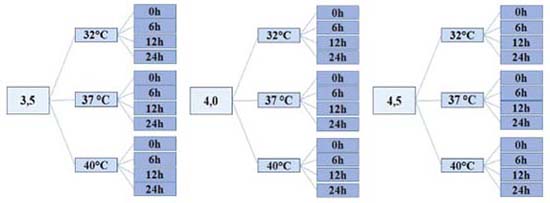 Figura 1. Esquema fatorial para pHs, temperaturas e tempos de fermentação em estudo no delineamento em parcelas sub-subdivididas
Para preparo dos inóculos foram pesados 3 g de massa úmida da levedura Pichia membranifaciens, visando a obtenção da concentração de 108 células mL-1 após a adição do meio sintético. Após o inóculo ser adicionado a Erlenmeyer de 250 mL, ocorreram duas alimentações de 50 mL de mosto a cada 40 minutos para aclimatação da levedura, obtendo-se um volume final de 100 mL. Os frascos foram mantidos em mesa agitadora, com controle da temperatura e controle de rotação (0,36 g-force). Análises microbiológicas Foram determinadas a viabilidade celular, a viabilidade dos brotos e o índice de brotamentos em câmara de Neubauer do inóculo e períodos de fermentação dos ensaios.19 Os cálculos foram realizados através das seguintes fórmulas: 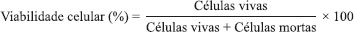 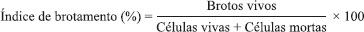 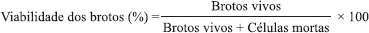 Cromatografia líquida de alta eficiência Amostras retiradas durante o processo fermentativo foram analisadas em cromatógrafo líquido de alta eficiência (CLAE ou HPLC) para determinação das concentrações de glicose, xilose, glicerol, ácido acético e etanol.20 Análise estatística Os dados obtidos no experimento foram submetidos à análise de variância pelo Teste F e de comparação de médias pelo teste de Tukey (P≤0,05) utilizando-se o Software AgroEstat.21
RESULTADOS E DISCUSSÃO As análises dos resultados observados para os parâmetros de viabilidade celular, índice de brotamentos e viabilidade dos brotos, encontram-se na Tabela 1. Os desdobramentos para as interações foram realizados na forma de gráficos e estão apresentados nas Figuras 2 a 4.
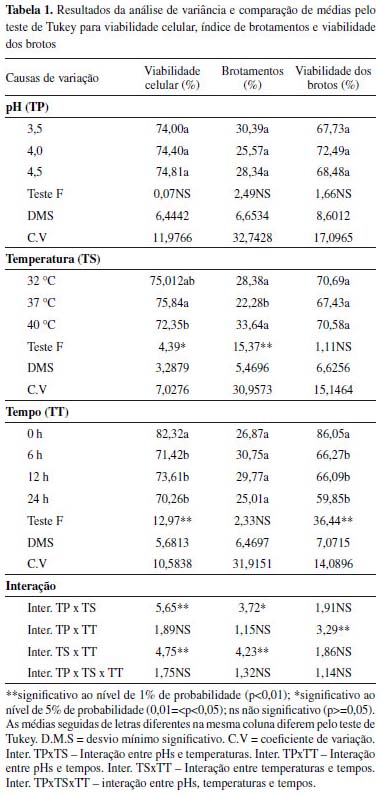
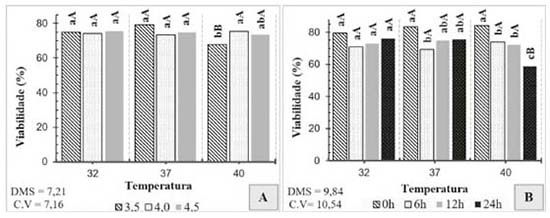 Figura 2. Desdobramento de interações para o parâmetro viabilidade celular. A. Interação entre pH e temperatura; letras minúsculas comparam pHs dentro de cada temperatura e letras maiúsculas comparam temperaturas dentro de cada pH. B. Interação entre temperatura e tempo; letras minúsculas comparam tempos dentro de cada temperatura e letras maiúsculas comparam temperaturas dentro de cada tempo
 Figura 3. Desdobramento de interações para o parâmetro índice de brotamento. A. Interação entre pH e temperatura; letras minúsculas comparam pHs dentro de casa temperatura e letras maiúsculas comparam temperaturas dentro de cada pH. B. Interação entre temperatura e tempo; letras minúsculas comparam tempos dentro de cada temperatura e letras maiúsculas comparam temperaturas dentro de cada tempo
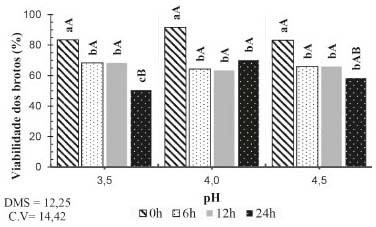 Figura 4. Desdobramento da interação entre pH e tempo para o parâmetro viabilidade dos brotos. Letras minúsculas comparam tempos dentro de cada pH e letras maiúsculas comparam pHs dentro de cada tempo
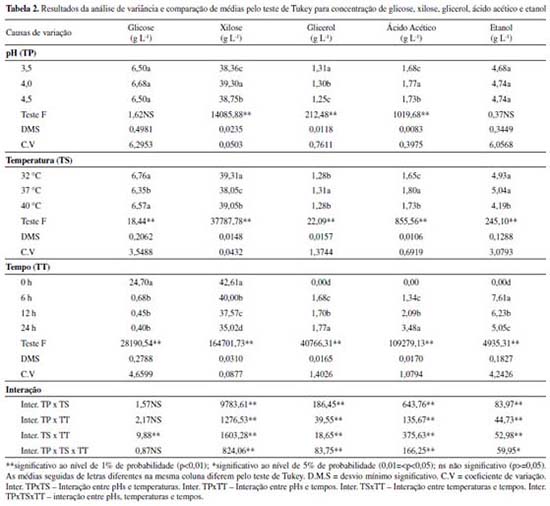
Para a realização de todo e qualquer processo fermentativo é de extrema importância que as células dos microrganismos mantenham sua integridade fisica e realizem a manutenção do número de células. Por esse motivo, é essencial a quantificação do número de células e brotos vivos durante a fermentação. Observa-se que não houve diferenças nos valores encontrados para viabilidade celular, índice de brotamento e viabilidade dos brotos nos três pHs testados (Tabela 1). Entretanto, quando analisadas em conjunto dos outros tratamentos, observa-se que a interação entre pH e temperatura e interação entre pH e tempo mostram-se significativas. Os resultados encontrados para viabilidade celular nos tratamentos controlados às temperaturas de 32 e 37 °C demonstram que a cepa de P. membranifaciens estudada possui estabilidade quando submetida a essas temperaturas nas diferentes faixas de pH estudadas (Figura 2.A). Essa característica é muito importante e altamente desejada em processos fermentativos, uma vez que durante a fermentação é natural que ocorra a redução do pH do mosto através de produtos ácidos excretados pelas leveduras.22 Todos os tratamentos obtiveram decréscimo ao longo do ensaio na viabilidade celular, independentemente da temperatura testada, havendo queda média de 13,20% nas primeiras 6 h (Figura 2.B). Esse comportamento pode ter ocorrido em virtude do processo de adaptação do microrganismo ao meio e a alta concentração de etanol obtida em um curto período de tempo devido a rápida metabolização dos açúcares.23 Nota-se que às 12 h a levedura começou a apresentar aumentos que indicavam sua recuperação, com exceção do tratamento de 40 °C, que continuou sofrendo quedas constantes, obtendo-se ao final uma perda total de 30,05%. A temperatura é um fator importante que interfere diretamente sobre a atividade dos microrganismos. Torija et al. relataram que valores superiores às temperaturas de trabalho das leveduras podem levar as células ao colapso.24 Verificou-se que dentre os tratamentos testados, 40 °C foi a única temperatura que apresentou resultados que indicam o aumento no índice de morte celular da células da levedura. O decréscimo desse parâmetro sob temperaturas elevadas no presente trabalho corroboram com os relatos de Torija et al. e Bonassa et al.,24,25 que verificaram que a viabilidade celular da levedura S. cerevisiae diminui à medida que a temperatura do processo fermentativo aumenta. A temperatura de 32 °C não apresentou diferenças significaivas para viabilidade celular durante às 24 h desse ensaio, demonstrando que P. membranifaciens possui maior estabilidade nessa temperatura. Analisando-se as temperaturas de 32 e 37 °C, observa-se que não houve diferença significativa nos valores de índice de brotamento entre os três pHs avaliados (Figura 3.A). No entanto, o mesmo comportamento não ocorreu no tratamento a 40 °C, que demonstrou proporcionar melhores condições para a reprodução das leveduras sob pH 4,5. Observou-se que na temperatura de 32 °C a levedura obteve maior estabilidade na taxa de brotamento. Por outro lado, os maiores índices foram observados na temperatura de 40 °C até as 12 h, havendo uma diminuição brusca de 41,84% após esse período (Figura 3.B). Temperaturas elevadas na fermentação acarretam em um aumento na atividade metabólica das leveduras e, consequentemente, ocorre o aumento do índice de brotamento.26 Entretanto, elas podem causar danos as células de levedura e provocar um rápido decrescimento do número de células e brotos vivos, conforme observado nesse ensaio. Dentre os fatores químicos, o pH apresenta-se como um dos parâmetros mais relevantes a ser considerado, pois pode influenciar a velocidade da bioconversão dos açúcares em álcool etílico e afetar o crescimento das células. A faixa de pH na qual o crescimento e a produção de etanol ocorre com grande velocidade é estreita.27 Desta forma, para que a utilização desta levedura seja viabilizada, faz-se necessário o estudo desse parâmetro. Observa-se que o pH 3,5 afetou negativamente a viabilidade dos brotos, provocando a redução de 39,28% no período de 24 h em relação ao período inicial (Figura 4). Embora as leveduras sejam acidófilas (ácido-tolerantes), algumas espécies podem apresentar sensibilidade quanto a concentração e ao período de exposição.28 Durante a fermentação é natural que ocorra a redução do pH do mosto através de produtos ácidos excretados pelos microrganismos. Dessa forma, a utilização do pH 3,5 no início do processo fermentativo aumentou a exposição das células a um meio com elevados teores de ácido, tendo como consequência a redução do número de brotos vivos de P. membranifaciens.28 As análises dos resultados observados para concentração de glicose, xilose, glicerol, ácido acético e etanol, encontram-se na Tabela 2. Os desdobramentos para as interações foram realizados na forma de gráficos e estão apresentados nas Figuras 5 a 9.
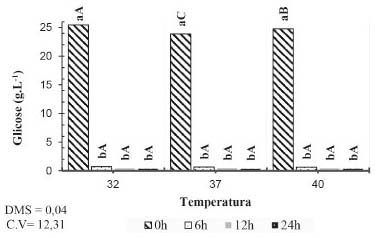 Figura 5. Desdobramento da interação entre temperatura e tempo para o parâmetro concentração de glicose. Letras minúsculas comparam tempos dentro de cada temperatura e letras maiúsculas comparam temperaturas dentro de cada tempo
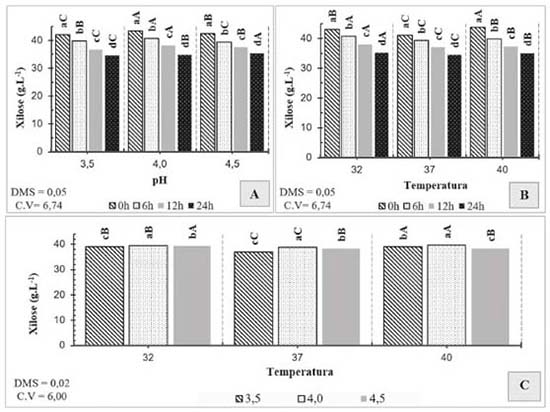 Figura 6. Desdobramento de interações para concentração de xilose. A. Interação entre pH e tempo; letras minúsculas comparam tempos dentro de cada pH e letras maiúsculas comparam pHs dentro de cada tempo. B. Interação entre temperatura e tempo; letras minúsculas comparam tempos dentro de temperatura e letras maiúsculas comparam temperaturas dentro de cada tempo. C. Interação entre pH e temperatura; letras minúsculas comparam pHs dentro de cada temperatura e letras maiúsculas comparam temperaturas dentro de cada pH
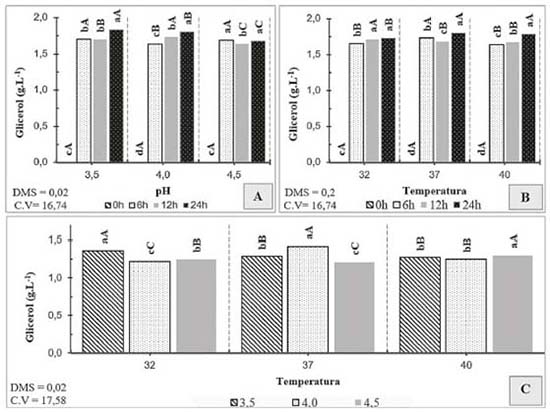 Figura 7. Desdobramento de interações para concentração de glicerol. A. Interação entre pH e tempo; letras minúsculas comparam tempos dentro de cada pH e letras maiúsculas comparam pHs dentro de cada tempo. B. Interação entre temperatura e tempo; letras minúsculas comparam tempos dentro de cada temperatura e letras maiúsculas comparam temperaturas dentro de cada tempo. C. Interação entre pH e temperatura; letras minúsculas comparam pHs dentro de cada temperatura e letras maiúsculas comparam temperaturas dentro de cada pH
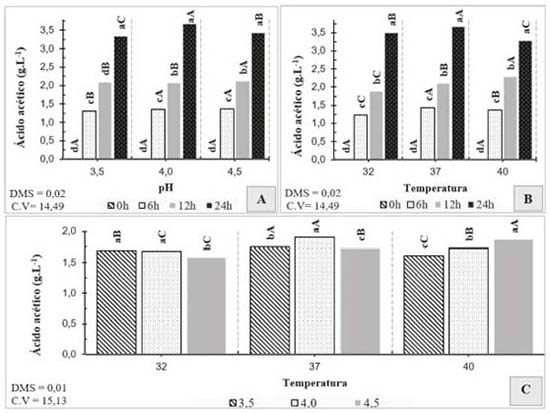 Figura 8. Desdobramento de interações para concentração de ácido acético. A. Interação entre pH e tempo; letras minúsculas comparam tempos dentro de cada pH e letras maiúsculas comparam pHs dentro de cada tempo. B. Interação entre temperatura e tempo; letras minúsculas comparam tempos dentro de cada temperatura e letras maiúsculas comparam temperaturas dentro de cada tempo. C. Interação entre pH e temperatura; letras minúsculas comparam pHs dentro de cada temperatura e letras maiúsculas comparam temperaturas dentro de cada pH
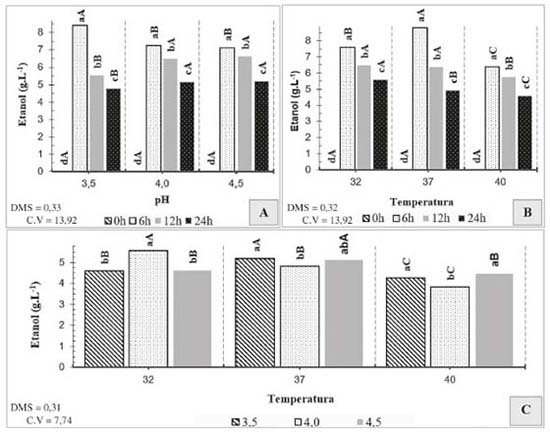 Figura 9. Desdobramento de interações para concentração de etanol. A. Interação entre pH e tempo; letras minúsculas comparam tempos dentro de cada pH e letras maiúsculas comparam pHs dentro de cada tempo. B. Interação entre temperatura e tempo; letras minúsculas comparam tempos dentro de cada temperatura e letras maiúsculas comparam temperaturas dentro de cada tempo. C. Interação entre pH e temperatura; letras minúsculas comparam pHs dentro de cada temperatura e letras maiúsculas comparam temperaturas dentro de cada pH
Observa-se que, para consumo de glicose, a unica interação significativa foi temperatura e tempo. Dessa forma, nota-se que a assimilação de glicose não foi influênciada pelo pHs dos mostos testados, havendo pequenas quantidades residuais desse açúcar após as 24 h de fermentação. Em relação ao consumo de glicose (Figura 5), nota-se que para todas temperaturas testadas houve o consumo médio de cerca de 97% somente nas primeiras 6 h de fermentação. Esse resultado demonstra a facilidade com que a levedura estudada possui para assimilar esse açúcar num intervalo de tempo pequeno, independentemente da temperatura do processo. Verifica-se que no tratamento adequado com pH 4,0 houve o maior consumo de xilose, havendo um decréscimo total de 19,49%, enquanto que para pH 3,5 e 4,5 houve o consumo de apenas 17,59% e 16,34%, respectivamente (Figura 6.A). A temperatura ideal para assimilação de pentoses para as leveduras do gênero Pichia spp pode variar de acordo com a cepa utilizada, entretanto, geralmente são verificadas temperaturas ótimas na faixa de 30 a 32 °C.27 Durante esse ensaio, notou-se que as temperaturas de 32 e 40 °C contribuíram para um maior consumo de xilose, obtendo-se um decréscimo maior que 18% (Figura 6.B). O consumo de xilose realizado pelas leveduras mostra-se mais lento em comparação ao apresentado na glicose, havendo grandes quantidades residuais desta pentose ao término do período de 24 h. A glicose foi praticamente esgotada nas primeiras 6 h de fermentação do licor, mesmo período em que a velocidade de consumo de xilose foi maior. À vista desse resultado, a glicose pode exercer um efeito contrário ao da repressão catabólica para P. membranifaciens, havendo maior consumo de xilose na presença da glicose. Em seus estudos, Freire29 percebeu que a velocidade de assimilação da xilose era maior na presença de glicose, em relação ao consumo apresentado somente na presença de pentose em uma cepa de suas bactérias recombinantes utilizadas para produção de etanol de segunda geração. O glicerol é um osmoregulador metabolizado por leveduras em situações de estresse osmótico. Sua produção está relacionada à espécie do microrganismo, pH, temperatura, fonte de nitrogênio e concentração de oxigênio disponível.30 Apesar de indesejável, a produção de etanol por fermentação alcoólica não ocorre sem que haja a formação de glicerol. Desta forma, deve-se avaliar os parâmetros diretamente relacionados a sua produção para que baixos teores sejam produzidos.31 Avaliando-se a concentração final de glicerol ao término da fermentação, nota-se que os menores teores foram encontrados nos tratamentos realizados com pH 4,5 (Figura 7.A) e temperatura de 32 °C (Figura 7.B) após as 24 h de fermentação. A presença de ácido acético é extremamente indesejável em processos de fermentação alcoólica, uma vez que para sua produção parte do etanol metabolizado pelas leveduras é oxidado.32 Dessa forma, quanto maior a quantidade de ácido acético produzido, menor será o rendimento fermentativo do processo. A maior concentração de ácido acético foi gerada no período de 24 h pelo tratamento com pH 4,0 e 37 °C e a menor no pH 3,5 à 40 °C (Figura 8.A e 8.B). Entretanto, a menor média de produção ocorreu para o pH 4,5 à 32 °C (Figura 8.C). O pico de produção de etanol para todos os tratamentos ocorreu a 6 h de fermentação, havendo perda substanciais em sua concentração após esse período (Figura 9.A e 9.B). Já foram observados em outros experimentos comportamentos similares,23-33 dessa forma, o presente estudo priorizou o tratamento que obteve as menores perdas de etanol ao longo da fermentação. De acordo com a Figura 8.A e 8.B, as maiores concentrações de etanol ao final do presente ensaio foram sob pHs 4,0 e 4,5 e temperatura de 32 °C. Em seus estudos, du Preez, Bosch e Prior relataram que a faixa de pH ótimo para a levedura Pichia stipitis foi de 4,0 à 5,5, apresentando um pico máximo de produtividade de etanol sob pH 4,0.27 Nota-se que quanto maior a temperatura utilizada no processo fermentativo, menor é a concentração de etanol após o término da fermentação. Segundo Lima et al.,34 o aumento da temperatura dos processos pode levar a perdas de etanol por volatização.
CONCLUSÃO Estabeleceu-se neste estudo que as condições ideais para fermentação de pentoses por Pichia membranifaciens foram temperatura de 32 °C e pH 4,0-4,5. Nas condições ideais, houve maior consumo de xilose, maior produção de etanol, baixa produção de compostos secundários e altos índices de viabilidade celular durante a fermentação.
AGRADECIMENTOS Agradecemos à Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) pela concessão de bolsas de estudos, à Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP) pelo financiamento do projeto, ao Programa de Microbiologia Agropecuária da Faculdade de Ciências Agrárias e Veterinárias (FCAV)/Universidade Estadual Paulista (UNESP) e ao Laboratório de Tecnologia do Açúcar e do Álcool por possibilitarem a execução deste trabalho.
REFERÊNCIAS 1. Chieppe Jr., J. B.; Tecnologia e fabricação do álcool, disponível em http://redeetec.mec.gov.br/images/stories/pdf/eixo_prd_industr/tec_acucar_ alcool/161012_tec_fabric_alc.pdf, acessado em junho 2019. 2. Silva, M. R.; Dissertação de Mestrado, Universidade Federal de Juiz de Fora, Brasil, 2017. 3. Ferreira, J.; Revista Conexão Eletrônica 2015, 12, 177. 4. Tomás‐Pejó, E.; Bonander, N.; Olsson, L.; Biofuels, Bioprod. Biorefin. 2014, 8, 626. 5. Sousa, J. L. U.; Monteiro, R. A. B.; FAZU em Revista 2011, 8, 100. 6. Santos, D. S.; Tese de Doutorado, Universidade Federal do Rio de Janeiro, Brasil, 2012. 7. Hahn-Hagerdal, B.; Karhumaa, K.; Fonseca, C.; Spencer-Martins, I.; Gorwa-Grauslund, M. F.; Appl. Microbiol. Biotechnol. 2007, 74, 937. 8. Kurtzman, C. P.; Em The Yeasts: A Taxonomic Study; Kurtzman, C. P., Fell, J. W., Boekhout, T., eds.; Elsevier Science, 2011, cap 57. 9. Wu, Q.; Chen, L.; Xu, Y.; Int. J. Food Microbiol. 2013, 166, 323. 10. You, L.; Wang, S.; Zhou, R.; Hu, X.; Chu, Y.; Wang, T.; J. Inst. Brew. 2016, 122,517. 11. Stefanini, I.; Albanese, D.; Cavazza, A.; Franciosi, E.; Filippo, C.; Donati, C.; Cavalieri, D.; Microb. Biotechnol. 2016, 9, 195. 12. Šuranská, H.; Vránová, D.; Omelková, J.; Vadkertiová, R.; Chem. Pap. 2012, 66, 861. 13. Grounta, A.; Doulgeraki, A. I.; Nychas, G. E.; Panagou, E. Z.; Food Microbiol. 2016, 56, 35. 14. Pereira, E. L.; Ramalhosa, E.; Borges, A.; Pereira, J. A.; Baptista, P.; Food Microbiol. 2015, 46, 582. 15. Benítez-Cabello, A.; Romero-Gil, V.; Rodríguez-Gómez, F.; Garrido-Fernández, A.; Jiménez-Díaz, R.; Arroyo-López, F. N.; Antonie van Leeuwenhoek 2015, 108, 597. 16. Souza, C. S.; Tese de Doutorado, Universidade de São Paulo, Instituto Butantan, Brasil, 2009. 17. Govindaswamy, S.; Vane, L. M.; Bioresour. Technol. 2007, 98, 677. 18. Pavani, C. D.; Roviero, J. P.; Freita, L. A.; Costa, G. H. G.; Mutton, M. J. R.; Ciência & Tecnologia 2013, 5, 1. 19. Lee, S. S.; Robinson, F. M.; Wang, H. Y.; Biotechnol. Bioeng. Symp. 1981, 11, 641. 20. Hernández-Pérez, A. F.; Arruda, P. V.; Felipe, M. G. A.; Braz. J. Microbiol. 2016, 47, 489. 21. Barbosa, J. C.; Maldonado Junior, W.; AgroEstat, Sistema para Análises Estatísticas de Ensaios Agronômicos; Universidade Estadual Paulista Júlio de Mesquita Filho, Faculdade de Ciências Agrárias e Veterinárias, Brasil, 2015. 22. Basso, L. C.; Basso, T. O.; Rocha, S. N. Em Biofuel Production – Recent Developments and Prospects; Bernardes, M. A. S., ed.; InTech, 2011, pp. 85-101. 23. Roviero, J. P.; Tese de Doutorado, Universidade Estadual Paulista “Júlio de Mesquita Filho”, Faculdade de Ciências Agrárias e Veterinárias, Brasil, 2016. 24. Torija, M. J.; Roze`s, N.; Poblet, M.; Guillamo´n, J. M.; Mas, A.; Int. J. Food Microbiol. 2003, 80, 47. 25. Bonassa, G.; Teleken, J. G.; Schneider, L. T.; Oliveira, C. J.; Resumos do 3° Encontro Paranaense de Engenharia e Ciência, Toledo, Brasil, 2013. 26. Mutton, M. J. R.; Tese de livre-docência; Universidade Estadual Paulista “Júlio de Mesquita Filho”, Faculdade de Ciências Agrárias e Veterinárias, 1998. 27. du Preez, J. C.; Bosch, M.; Prior, B. A.; Enzyme Microb. Technol. 1986, 8, 360. 28. Bregagnoli, F. C. R.; Tese de Doutorado, Universidade Estadual Paulista “Júlio de Mesquita Filho”, Faculdade de Ciências Agrárias e Veterinárias, 2006. 39. Freire, R. K. B.; Dissertação de mestrado, Instituto de Ciências Biomédicas, Universidade de São Paulo, 2012. 30. Remize, F.; Salblayrolles, J. M.; Dequin, S.; J. Appl. Microbiol. 2000, 88, 371. 31. Ferrari, F. C. S.; Dissertação de Mestrado, Universidade Estadual Paulista “Júlio de Mesquita Filho”, Faculdade de Ciências Agrárias e Veterinárias, 2013. 32. Aquarone, E.; Borzani, W.; Schmidell ,W.; Lima, U. A.; Biotecnologia Industrial, 1a ed., Edgard Blücher: São Paulo, 2001. 33. Freita, L. A.; Tese de Doutorado, Universidade Estadual Paulista “Júlio de Mesquita Filho”, Faculdade de Ciências Agrárias e Veterinárias, 2017. 34. Lima, U. A, Basso, L. C.; Amorim, H. V. Em Biotecnologia Industrial: Processos Fermentativos e Enzimáticos; Lima, U. A., ed.; Edgard Blücher: São Paulo, 2001, pp. 1-43.
#Programa de Pós-Graduação em Microbiologia Agropecuária |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access