Artigo
|
|
| Desenvolvimento do método de extração sólido-líquido com partição em baixa temperatura para determinação de inseticidas em grãos de milho ozonizados Development of a solid-liquid extraction method with low-temperature partitioning for the determination of insecticides in ozonized maize grain |
|
Romenique da Silva de FreitasI; Maria Eliana Lopes Ribeiro de QueirozII,*; Lêda Rita D'Antonino FaroniI; Fernanda Fernandes HelenoII; Vanessa Vaz de MouraI
IDepartamento de Engenharia Agrícola, Universidade Federal de Viçosa, Campus Viçosa, 36570-000 Viçosa - MG, Brasil Recebido em 02/05/2013 *e-mail: meliana@ufv.br The objective of this study was to optimize and validate a solid-liquid extraction method with low-temperature partitioning (SLE/LTP) for the analysis of pesticides. This method was coupled with gas chromatography (GC/ECD) and used to evaluate the degradation of bifenthrin and pirimiphos-methyl in maize grains on exposure to ozone. The optimized SLE/LTP-GC/ECD method is simple, effective and consumes low quantities of the solvent. It can be routinely used for the determination of bifenthrin and pirimiphos-methyl in maize samples. The use of this method of analysis determined that the levels of the insecticides in maize grains were reduced on exposure of the grains to the ozone gas. The observed reduction in the levels of insecticide was directly proportional to the increase in the concentration of the ozone gas. INTRODUÇÃO Os insetos são responsáveis por consideráveis perdas, tanto qualitativas como econômicas, no setor de armazenamento.1,2 O principal método de controle adotado é o uso de inseticidas, os quais constituem a forma mais simples, rápida e econômica de conter infestações de insetos em produtos armazenados.3 Os compostos mais utilizados são os inseticidas protetores, pertencentes aos grupos químicos piretróides e organofosforados, uma vez que apresentam alta eficácia no controle de pragas e curta persistência no ambiente.4 No Brasil são indicados para o tratamento de grãos de milho armazenados, dentre outros produtos, a bifentrina (Figura 1(A)) e o pirimifós-metílico5 (Figura 1(B)).
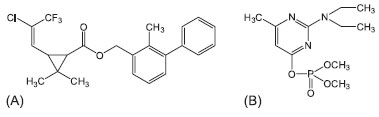
Figura 1. Estruturas químicas: bifentrina (A) e pirimifós-metílico (B)
A bifentrina é um piretróide largamente utilizado para o controle de diversas pragas, em uma ampla gama de culturas, em diversos países;6,7 e também para o controle de pragas residenciais em áreas urbanas como os cupins.8 O organofosforado pirimifós-metílico é também amplamente utilizado para o controle de pragas em todo o mundo. Embora seja comumente utilizado para o tratamento de sementes, grãos e produtos armazenados, é também indicado para o controle de pragas no campo.9 Alguns estudos têm apontado a bifentrina como um dos principais contaminantes em amostras de água e sedimentos coletadas no meio urbano,8,10,11 bem como o pirimifós-metílico como o organofosforado mais persistente em alimentos.9 A falta de estruturas adequadas à armazenagem dos grãos e a falta de mão de obra especializada, aliadas à baixa disponibilidade de técnicas alternativas para o controle das pragas tem gerado o uso abusivo de inseticidas nas unidades armazenadoras. Esta situação tem sido motivo de grande preocupação, haja vista que tem se observado a persistência dos princípios ativos nos grãos e seus subprodutos, na forma de resíduos danosos aos consumidores e ao meio ambiente.12,13 A utilização de ozônio como estratégia para remoção de resíduos de agrotóxicos em alimentos tem sido uma alternativa promissora.14,15 Diante disto, se faz necessário o monitoramento dos níveis de resíduos dos inseticidas presentes em grãos de milho ozonizados destinados à alimentação humana e animal. Os métodos usados para a determinação de resíduos de agrotóxicos em produtos vegetais incluem extração em fase sólida,16,17 microextração em fase sólida,18,19 extração com fluído supercrítico e dispersão de matriz em fase sólida.20 Outra técnica, que vem sendo empregada com sucesso para a extração de agrotóxicos em matrizes sólidas, é a extração sólido-líquido com partição em baixa temperatura (SLE/LTP). Esta técnica apresenta algumas vantagens em relação às técnicas tradicionais, como praticidade, reduzido número de etapas, pequena quantidade de amostra e de solventes orgânicos, além de ser confiável e seletiva.21-23 A SLE/LTP consiste em acrescentar à amostra sólida um solvente extrator, miscível em água, menos denso que a água e que se mantenha líquido a -20 ºC. Posteriormente, a mistura é agitada e levada ao freezer (-20 ºC) por um determinado período de tempo (> 3 h). Nesta etapa, a fase aquosa juntamente com a amostra congelam e os analitos migram para a fase orgânica, a qual é isolada e posteriormente analisada. Este método, mostrou-se eficiente na extração e análise de agrotóxicos em tomate23 e batata,24 entre outras matrizes. No entanto, não há relatos do uso da SLE/LTP para extração de resíduos de agrotóxicos em grãos armazenados. Desta forma, o presente estudo teve como objetivo otimizar e validar o método de extração sólido-líquido com partição em baixa temperatura e determinação por cromatografia gasosa com detecção por captura de elétrons (SLE/LTP-GC/ECD) para análise dos resíduos de bifentrina e pirimifós-metílico em grãos de milho expostos ao ozônio.
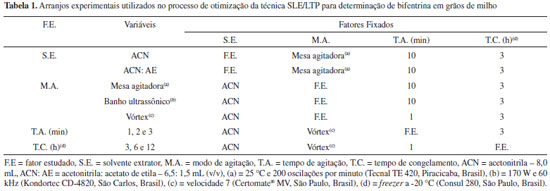
PARTE EXPERIMENTAL Reagentes e soluções Os reagentes utilizados foram acetonitrila (99,5% v/v), acetato de etila (99,5% v/v) e sulfato de sódio anidro (99,0% m/m) adquiridos da Vetec (Rio de Janeiro, Brasil), padrões de bifentrina (92,2% m/m) e pirimifós-metílico (99,5%, m/m) adquiridos da Sigma Aldrich (Steinheim, Alemanha) e parationa-metílica (99,0% m/m) adquirido da Chem Service (West Chester, USA) usado como padrão interno. Soluções estoque, na concetração de 1000 mg L-1, foram preparadas pela solubilização dos padrões da bifentrina, do pirimifós-metílico e da parationa-metílica em acetonitrila. A partir destas soluções foram preparadas soluções de trabalho da bifentrina e da parationa-metílica, na concentração de 10,0 mg L-1, e do pirimifós-metílico na concentração de 400,0 mg L-1. Estas soluções foram armazenadas em freezer à temperatura de aproximadamente -20 ºC. Determinação cromatográfica As análises qualitativas e quantitativas de bifentrina e pirimifós-metílico foram realizadas em um cromatógrafo a gás (Shimadzu GC-17-A, Kyoto, Japão) equipado com detector por captura de elétrons (GC/ECD). Utilizou-se uma coluna cromatográfica capilar do tipo DB-5 (Agilent Technologies, Palo Alto, EUA), com fase estacionária composta de 5% de fenil e 95% de dimetilsiloxano, 30 m de comprimento, 0,25 mm de diâmetro interno e 0,10 µm de espessura de filme. As separações cromatográficas foram monitoradas pelo software GCsolution (Shimadzu, Kyoto, Japão). As temperaturas do injetor e do detector foram mantidas em 280 e 300 ºC, respectivamente. A programação de temperatura do forno da coluna inciou-se em 150 ºC, sendo esta temperatura mantida por 1,0 min, seguida de rampas de aquecimento de 30 ºC min-1 até 210 ºC, 2 ºC min-1 até 220 ºC e 40 ºC min-1 até 290 ºC. A temperatura de 290 ºC foi mantida por 3,0 min. Utilizou-se como gás de arraste o nitrogênio (99,999% - Air Products, São Paulo, Brasil) com um fluxo de 1,0 mL min-1. As injeções foram feitas com divisão de fluxo (split) de 1:5. O volume injetado foi de 1,0 mL e o tempo total de análise foi 12,8 min. A bifentrina e o pirimifós-metílico presentes nas amostras de milho foram identificados pela comparação com os tempos de retenção dos picos de padrões destes inseticidas em acetonitrila. A quantificação foi feita pelo método da padronização interna, utilizando curvas analíticas, preparadas no extrato da matriz isenta dos agrotóxicos (branco da matriz), nas faixas de concentrações compreendidas entre 0,04 e 0,20 mg L-1 para bifentrina e 2,0 a 10,0 mg L-1 para o pirimifós-metílico. Ressalta-se que as curvas construídas no branco visaram eliminar o efeito de matriz. Obtenção e quantificação do ozônio O ozônio foi obtido por meio de um gerador O&L3.ORM (Ozone & Life, São José dos Campos, Brasil), utilizando como insumo gás oxigênio isento de umidade. O oxigênio foi retirado do ar atmosférico com o auxílio de um concentrador de oxigênio OxxiSul, Mark 5 Plus (Ozonebras, Curitiba, Brasil). A maior ou menor concentração do ozônio produzido foi controlada pelo botão dosador do equipamento e pelo fluxo de oxigênio. A concentração do ozônio foi determinada pelo método iodométrico, por titulação indireta, conforme recomendado pela International Ozone Association.25 Preparo das amostras de milho Para otimização e validação do método SLE/LTP-GC/ECD foram utilizados grãos de milho (Zea mays L.) com teor de água de 12% base úmida (b.u.), isentos de inseticidas. A ausência dos inseticidas nas amostras de milho foi confirmada por meio da comparação entre os cromatogramas do branco e de solução-padrão contendo os inseticidas. Tanto o branco como a solução-padrão foram preparados em acetonitrila. Os grãos foram triturados em moinho de facas (Fritsch Pulverisette 14, Oberstein, Alemanha) até a obtenção de um produto com consistência de farinha, tendo as partículas cerca de 40 µm de tamanho. Esta farinha foi armazenada em saco plástico estéril e mantida sob refrigeração (4 ºC) até o momento da execução dos experimentos. Otimização do método SLE/LTP Extração de bifentrina A otimização do método SLE/LTP para determinação de bifentrina em amostras de milho foi adapatada do método utilizado para extração de resíduos de agrotóxicos em frutos de tomate.23 Para fortificação das amostras utilizou-se uma solução de trabalho contendo bifentrina na concentração de 10,0 mg L-1. Amostras de 2,0000 g do milho triturado, pesadas em balança analítica com precisão de 0,0001 g (Sartorius BP 221 S, Goettingen, Alemanha), foram acondicionadas em frascos de vidro transparentes com capacidade para 22,0 mL, fortificadas com 80,0 µL da solução de trabalho e deixadas em repouso por 3 h. Durante este período os frascos foram mantidos abertos, para que houvesse maior interação do inseticida com a amostra e ocorresse a evaporação do solvente. Em seguida, acrescentou-se a cada amostra 4,0 mL de água destilada e realizaram-se os procedimentos de extração. Todos os testes foram conduzidos em triplicatas. Adotou-se o método da otimização univariada, em que um único fator é alterado e analisado separadamente em cada experimento enquanto os demais permanecem constantes. No processo de otimização deste método foram estabelecidas algumas variáveis importantes a serem avaliadas, a fim de se obter os melhores rendimentos com menor tempo de análise. As variáveis avaliadas foram: solvente extrator, modo de agitação, tempo de agitação e tempo de congelamento, as quais se encontram especificadas na Tabela 1.
Após a separação das fases pelo congelamento da fase aquosa com o milho, o extrato orgânico contendo os princípios ativos foi recuperado. Este extrato foi passado através de papel de filtro contendo 2,0 g de sulfato de sódio anidro (99,0% m/m - Vetec, Rio de Janeiro, Brasil), para eliminar a possível presença de água. Ressalta-se que o volume do extrato coletado após a filtração em todas as etapas foi de aproximadamente 6,0 mL. Deste volume foram retirados 1,5 mL, os quais foram colocados em um frasco de vidro transparente com capacidade para 1,8 mL, onde foi acrescentado 15,0 µL do padrão interno. Estas amostras foram mantidas sob refrigeração (4 ºC) até o momento das determinações cromatográficas. Extração de pirimifós-metílico A extração do pirimifós-metílico foi realizada utilizando-se o método SLE/LTP otimizado para extração de bifentrina. Para fortificação das amostras utilizou-se uma solução de trabalho contendo o pirimifós-metílico na concentração de 400,0 mg L-1. O procedimento consistiu em pesar uma massa de 2,0000 g de milho triturado e fortificar com 80 µL da solução de trabalho a 10 mg L-1, no interior de frascos de vidro transparente com capacidade para 22,0 mL. Em seguida acrescentou-se 4,0 mL de água destilada e 8,0 mL de acetonitrila. A mistura obtida foi agitada em vórtex (Certomate® MV, São Paulo, Brasil) durante 1,0 min e mantida em freezer (-20 ºC) por cerca de 3 h. Decorrido este período, a fase aquosa foi coletada e passada através de papel filtro contendo 2,0 g de sulfato de sódio anidro, para eliminar a presença de água no extrato. Após a filtragem, recolheu-se uma alíquota de 1,5 mL do extrato obtido, transferiu-se para um frasco de vidro transparente com capacidade para 1,8 mL e acrescentou-se 15,0 µL do padrão interno. Validação do método SLE/LTP Seletividade A seletividade do método foi avaliada pela comparação dos cromatogramas dos extratos das amostras de milho isentas de bifentrina e pirimifós-metílico (branco) com os cromatogramas dos extratos das amostras de milho fortificadas com cada inseticida. Para obtenção dos extratos as amostras foram submetidas ao método de extração SLE/LTP otimizado. Os cromatogramas foram comparados, verificando a existência ou não de superposição de picos nos tempos de retenção correspondentes aos inseticidas. Linearidade de resposta do método A linearidade foi avaliada pelas curvas analíticas obtidas pela análise dos extratos de amostras de milho fortificadas com bifentrina em concentrações que variaram de 0,30 a 1,20 mg kg-1 (sete pontos em triplicata), e pirimifós-metílico em concentrações variando de 10,0 a 20,0 mg kg-1 (cinco pontos em triplicata). Os dados foram utilizados para construção de curvas analíticas, relacionando as razões das áreas do analito pelo padrão interno com as concentrações mencionadas. A linearidade foi determinada com base no coeficiente de correlação (r) da curva.26 Limite de detecção e limite de quantificação Os limites de detecção (LD) e quantificação (LQ) foram calculados pela relação entre a estimativa do desvio padrão do coeficiente linear e a inclinação da curva analítica. O valor resultante foi multiplicado por 3,3 para se obter o LD e por 10 para se obter o LQ.26 Os parâmetros da curva foram obtidos utilizando-se a função Proj.lin do software Microsoft Office Excel®. Exatidão A exatidão foi avaliada por ensaios de recuperação. Nestes ensaios foram analisadas amostras de milho fortificadas com bifentrina nas concentrações 0,3; 0,6 e 0,9 mg kg-1 (equivalentes a aproximadamente 1, 2 e 3 vezes o limite de quantificação do método). Também foram analisadas amostras de milho fortificadas com pirimifós-metílico em concentrações iguais a 10,0 e 15,0 mg kg-1 (equivalentes a 1 e 1,5 vezes o limite máximo de resíduo estabelecido pela ANVISA).27 Em cada concentração analisada, tanto para bifentrina como para pirimifós-metílico, utilizaram-se seis repetições. Os resultados foram expressos em porcentagem de recuperação. Precisão A precisão foi determinada pelo estudo de repetitividade.28 Amostras de milho fortificadas com cada um dos inseticidas foram submetidas ao processo de extração e análise no mesmo dia. Utilizou-se neste ensaio sete amostras fortificadas com bifentrina na concentração de 0,6 mg kg-1 e sete amostras fortificadas com pirimifós-metílico na concentração de 10,0 mg kg-1. Os resultados foram expressos pelo coeficiente de variação. Aplicação da SLE/LTP para análise da degradação dos inseticidas em grãos de milho expostos ao ozônio O método desenvolvido foi utilizado para avaliar a taxa de degradação dos resíduos de bifentrina e pirimifós-metílico em grãos de milho expostos ao ozônio em diferentes concentrações. Grãos de milho com teor de água de 12% b.u. foram pulverizados com uma calda inseticida contendo bifentrina na concentração de 0,4 mg kg-1. Outra amostra destes grãos foi pulverizada com uma calda contendo pirimifós-metílico na concentração de 12 mg kg-1. As caldas foram preparadas a partir da diluição dos produtos comerciais, Prostore 25 CE® (bifentrina) na dose recomendada pelo fabricante (16 mL t-1) e Actellic 500 CE® (pirimifós-metílico) na dose de 1,5 vezes a dose recomendada pelo fabricante (24 mL t-1), em 1,0 L de água. A adoção de uma dose maior que a recomendada comercialmente para o Actellic 500 CE se deu em função da concentração de pirimifós-metilico (8,0 mg kg-1) proporcionada por esta dose estar muito próxima ao MRL estabelecido pelo Codex Alimentarius (7,0 mg kg-1) e abaixo do MRL estabelecido pela ANVISA (10,0 mg kg-1). A calda foi aplicada nos grãos espalhados sobre lona plástica utilizando-se um pulverizador manual. Em seguida, os grãos foram homogeneizados com auxilio de um rodo e deixados em repouso por cerca de 3 h. Após esse período os grãos foram divididos em amostras de 1,0 kg, as quais foram acondicionadas em sacos plásticos e mantidas sob refrigeração até o momento da ozonização. Os grãos tratados com bifentrina foram fumigados com o ozônio nas concentrações de 0,0; 1,1; 2,1; 3,2 e 4,3 mg L-1. Os grãos contendo pirimifós-metílico foram ozonizados nas concentrações de 0,0; 0,2; 0,4; 0,6 e 0,9 mg L-1. O gás foi aplicado em fluxo contínuo de 1,0 L min-1, durante 1 h. A fumigação dos grãos foi feita no interior de recipientes cilíndricos de PVC (0,20 x 0,25 m) dotados de conexões na parte inferior e superior para entrada e saída do ozônio, respectivamente. Em cada câmara foi instalada uma tela metálica, a 10 cm do fundo, para sustentação dos grãos e formação de um plenum, para melhor distribuição do gás. Os ensaios foram conduzidos com temperatura controlada de 25±2 ºC. Após a exposição ao ozônio as amostras de milho foram homogeneizadas, separadamente, em homogeneizador tipo Boerner. Em seguida, foram trituradas e submetidas à extração do analito, utilizando-se o método SLE/LTP otimizado e validado, sendo os extratos analisados por GC/ECD. O delineamento utilizado foi o inteiramente casualizado com três repetições para cada concentração do ozônio. Análise estatística Os dados obtidos foram submetidos à análise de variância. Os valores médios dos parâmetros otimizados foram comparadas pelo teste de Tukey a 5% de probabilidade utilizando o software SAS (SAS Institute, Cary). Os resultados obtidos nos ensaios de avaliação das taxas de degradação dos inseticidas, nos grãos de milho, pelo ozônio foram submetidos a ajustes de regressão utilizando o software Sigma Plot (SPSS, Chicago).
RESULTADOS E DISCUSSÃO Otimização do método SLE/LTP Extração de bifentrina As porcentagens de recuperação do inseticida bifentrina não variaram significativamente entre os tipos de solventes extratores (F1;2=0,29 e P=0,64), sendo 48±3% para a acetonitrila e 46±3% para a mistura acetonitrila: acetato de etila (Tabela 2). Na escolha do solvente que melhor se adequa ao método SLE/LTP alguns aspectos devem ser considerados, tais como eficiência de extração e compatibilidade com a técnica cromatográfica. A adição de acetato de etila à acetonitrila é feita com o intuito de reduzir a polaridade da solução extratora, e assim, favorecer a extração de compostos menos polares ou hidrofóbicos como os piretróides.29-31 No entanto, esta mistura não favoreceu a extração de bifentrina nas amostras de milho. Desta forma, optou-se por desenvolver o método com a acetonitrila, uma vez que descarta a necessidade da mistura de solventes e, consequentemente, simplifica o procedimento de extração. Aliado a isto, a acetonitrila é miscível em água e apresenta baixo ponto de fusão (-45 ºC),32,33 propriedades essenciais ao desenvolvimento do método SLE/LTP.
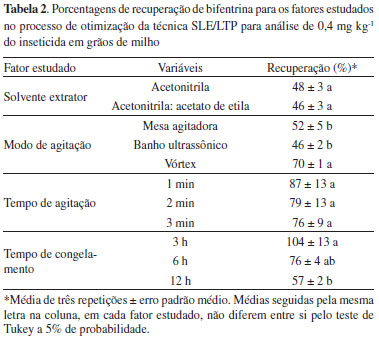
No que diz respeito ao modo de agitação, verificou-se que as porcentagens de recuperação variaram significativamente entre os procedimentos testados (F2;3=17,21 e P=0,02). Nesta etapa da otimização constatou-se que a porcentagem de recuperação obtida com a agitação em vórtex (70±1%) foi significativamente maior que as porcentagens de recuperação obtidas com a agitação em mesa agitadora (52±5%) e banho ultrassônico (46±2%) (Tabela 2). A etapa de agitação das amostras ou homogeneização é um dos fatores mais relevantes no processo de otimização de uma técnica, uma vez que é nesta etapa que ocorre maior interação entre os solventes extratores e os analitos que estão sendo extraídos. O modo de agitação ideal é aquele que proporciona melhor precisão, altos rendimentos de extração, melhor frequência analítica e praticidade.33 A agitação em vórtex atendeu a estes requisitos, sendo eleito o modo de agitação que melhor se adequa ao desenvolvimento da técnica SLE/LTP para extração de bifentrina em amostras de milho. As porcentagens de recuperação de bifentrina, também, não variaram significativamente entre os tempos de agitação avaliados (F2;9=0,60 e P=0,57). As porcentagens de recuperação para os tempos de 1, 2 e 3 min de agitação foram 87±13; 79±13 e 76±9%, respectivamente (Tabela 2). Estes resultados sugerem que no tempo mínimo de agitação em vórtex (1 min) já tenha ocorrido a máxima interação entre o analito (bifentrina) e o solvente extrator (acetonitrila). Com isto, o aumento no tempo de agitação não contribui para o aumento na porcentagem de recuperação do método proposto. Tal fato motivou a escolha do tempo de agitação de 1 min para compor o método SLE/LTP. Aliado a isto, a adoção do menor tempo de agitação contribuiu para a redução no tempo de preparo das amostras. Com relação ao tempo de congelamento, observou-se que as porcentagens de recuperação de bifentrina variaram significativamente entre os tempos testados (F2;9=687 e P=0,02). A porcentagem média de recuperação obtida no tempo de congelamento de 3 h (104±13%) foi superior às porcentagens de recuperação nos tempos de 6 (76±4%) e 12 h (57±2%) (Tabela 2). Observou-se que nos tempos de 6 e 12 h houve a formação de pequenos cristais do solvente orgânico juntamente com a fase aquosa. Com isto, parte do analito pode ter ficado retido na interface, explicando as menores porcentages de recuperação. Desta forma, escolheu-se o tempo de congelamento de 3 h para o desenvolvimento do método SLE/LTP. A escolha deste tempo de congelamento é vantojosa porque, além de promover elevada porcentagem de recuperação, contribui para a redução no tempo de preparo das amostras e extração do analito. Método SLE/LTP otimizado O método otimizado consiste em acrescentar a uma amostra de 2,0000 g de milho, fortificada com a bifentrina, um volume de 4,0 mL de água e 8,0 mL de acetonitrila. Essa mistura é homogeneizada em vórtex durante 1 min, e levada ao freezer (-20 ºC) por 3 h. Passado este período, o extrato é filtrado em papel de filtro contendo 2,0 g de sulfato de sódio anidro. O volume recuperado é coletado e analisado por GC/ECD. A porcentagem de recuperação obtida ao final do processo foi de 104%. Extração de pirimifós-metílico O método desenvolvido para bifentrina foi empregado para extração e análise de pirimifós-metílico por GC/ECD obtendo porcentagens de recuperação na faixa de 98 a 106%, não sendo necessária a otimização do método para extração e análise deste inseticida. Vale destacar que o método SLE/LTP-GC/ECD é simples, eficaz e com baixo consumo de solvente. Além disso não necessita de etapas de evaporação e troca de solvente, o que consequentemente reduz os riscos de contaminação, perdas de amostras e custos. Com isto, o método pode ser aplicado em análises de rotina para determinação de bifentrina e pirimifós-metílico em amostras de milho. Validação do método SLE/LTP Seletividade Avaliar a seletividade consiste em avaliar a capacidade do método em separar o analito de outros componentes presentes na amostra.26,34 Nota-se que os extratos das amostras de milho não apresentaram interferentes no mesmo tempo de retenção dos compostos analisados (Figura 2). Desta forma, o método otimizado é seletivo tanto para a bifentrina como para o pirimifós-metílico.
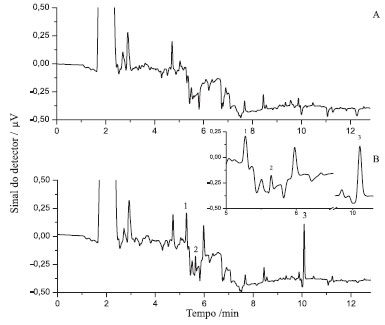
Figura 2. Cromatogramas de extrato de milho isento de bifentrina e pirimifós-metílico (branco) (A); e extrato de milho contendo os inseticidas fortificados nas concentrações: bifentrina = 0,3 mg kg-1 e pirimifós-metílico = 10 mg kg-1 (B). (1) padrão interno: tR = 5,2 min; (2) pirimifós-metílico: tR = 5,7 min e (3) bifentrina: tR = 10,1 min
Linearidade de resposta do método As equações ajustadas para bifentrina (ŷ = 0,17 + 1,22x) e pirimifós metílico (ŷ = -1,08 + 0,12x) geraram coeficiente de correlação (r) com valor igual a 0,99. As recomendações da ANVISA27 determinam que o valor mínimo de r seja 0,99. No entanto, o INMETRO28 determina que valores de r acima de 0,90 indicam a linearidade do método. Desta forma, o valor de r obtido para a extração de bifentrina e pirimifós-metílico assegura que o método desenvolvido é linear para ambos os inseticidas, dentro das faixas de concentrações estudadas. Essas curvas foram empregadas para derminar os limites de detecção e quantificação do método, os quais foram incluídos nas curvas de trabalho utilizadas para quantificação dos agrotóxicos. Limite de detecção e limite de quantificação Os limites de detecção (LD) e quantificação (LQ) obtidos para a bifentrina foram 0,09 e 0,29 mg kg-1, respectivamente. Esses valores estão acima do MRL que é de 0,05 mg kg-1 para a bifentrina segundo o Codex Alimentarius. Portanto, será possível detectar se ocorreu a degradação da bifentrina no milho ozonizado até valores próximos ao MRL. Para o pirimifós-metílico os LD e LQ foram 1,05 e 3,19 mg kg-1, respectivamente. Esses valores estão abaixo do MRL, que é de 7 mg kg-1, segundo o Codex Alimentarius, o que permitirá avaliar a degradação desse princípio ativo até valores inferiores ao MRL. Exatidão As porcentagens médias de recuperação para bifentrina e pirimifós-metílico foram iguais a 100 e 102%, respectivamente. As concentrações obtidas pela análise dos extratos variaram de 0,22 a 0,94 mg kg-1 para bifentrina e de 9,58 a 16,66 mg kg-1 para o pirimifós-metílico. Os coeficientes de variação obtidos foram 4% para bifentrina e 3% para pirimifós-metílico. Para análise de resíduos de agrotóxicos o procedimento analítico aplicado deve ser capaz de recuperar, em cada nível de fortificação, de 70 a 120% do princípio ativo analisado.26 Uma vez que os valores obtidos atendem a este requisito, pode-se afirmar que o método desenvolvido é exato para extração e análise de bifentrina e pirimifós-metílico em amostras de milho. Precisão As concentrações obtidas após a análise dos extratos fortificados com bifentrina na concentração de 0,6 mg kg-1 variaram de 0,7 a 0,8 mg kg-1, apresentando coeficiente de variação igual a 9%. Não obstante, as concentrações obtidas após a análise dos extratos fortificados com pirimifós-metílico na concentração de 10,0 mg kg-1 variaram de 9,6 a 10,2 mg kg-1. Esta variação fornece um coeficiente de variação igual a 2%. A precisão é usada para avaliar a dispersão de resultados entre ensaios independentes, retidos de uma mesma amostra, amostras semelhantes ou padrões, em condições definidas.28 Em métodos de análise de traços ou impurezas são aceitos coeficientes de variação de até 20%.26,35 Desta forma, a técnica SLE/LTP é considerada precisa, sendo adequada à análise de bifentrina e pirimifós-metílico em amostras de milho. Outros métodos descritos na literatura para determinação de bifentrina36 e pirimifós-metílico37 em milho apresentam limites de detecção inferiores aos encontrados neste trabalho, 0,008 mg kg-1 (GC/MS) e 0,021 mg kg-1 (GC/FPD) respectivamente. Entretanto, são métodos mais trabalhosos, que requerem hifenação de técnicas (Quechers e extração líquido-líquido dispersiva, DLLME)36 para pré concentração, e/ou que requerem etapas de clean up37 (extração com fluído supercrítico e extração em fase sólida) para reduzir a extração de coextrativos. Consequentemente, apresentam porcentagens de recuperação menores36,37 e coeficientes de variação maiores aos apresentados neste trabalho.37 Aplicação do método SLE/LTP para análise da degradação dos inseticidas em grãos de milho expostos ao ozônio Os níveis de resíduos nos grãos de milho variaram significativamente em função das concentrações de ozônio usadas na fumigação, tanto para bifentrina (F4;10=54,99 e P<0,0001) como para pirimifós-metílico (F4;10=243,00 e P<0,0001). A concentração de bifentrina e de pirimifós-metílico reduziu com o aumento da concentração do ozônio (Tabela 3). A fumigação dos grãos com ozônio foi eficiente para remoção dos dois agrotóxicos. A concentração de ozônio capaz de remover os resíduos de pirimifós-metílico a níveis menores que o limite de detecção do método foi de 0,6 mg L-1. A concetração de ozônio necessária para a remoção da bifentrina abaixo do limite de detecção do método foi 3,5 vezes maior (2,1 mg L-1). Verificou-se que os níveis de bifentrina reduziram de 0,4 para valores abaixo do LD, correspondendo a uma taxa de degradação superior a 75%. Já os níveis de pirimifós-metílico reduziram de 8,8 para valores abaixo do LD, atingindo uma taxa de degradação superior a 88% (Tabela 3).
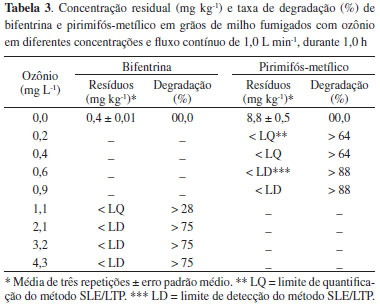
Estes resultados se devem ao elevado potencial oxidativo do ozônio, o qual tem sido relatado em diversos estudos como altamente eficiente na degradação de resíduos de agrotóxicos, em diferentes produtos.14,15,38-40 O ozônio possui grande afinidade com estruturas moleculares compostas por duplas ligações.41,42 A estrutura molecular tanto da bifentrina como do pirimifós-metílico é composta por um grande número de ligações deste tipo, o que favorece o processo de quebra das moléculas e consequentemente a degradação pelo ozônio. Os resultados demonstram que o processo de degradação do pesticida se intensifica à medida que se aumenta a concentração do gás. A este respeito, relata-se que o aumento na concentração do ozônio pode promover aumento na eficiência do processo de degradação de resíduos de agrotóxicos. 41,43 Isso ocorre devido ao aumento no número de moléculas do O3 e/ou radicais livres (O• - produzidos pela quebra da molécula O3) disponíveis no meio, os quais interagem com as moléculas dos agrotóxicos e ocasionam sua quebra.42
CONCLUSÕES O método SLE/LTP-GC/ECD desenvolvido é simples, consome pouco solvente e é eficiente para a extração de bifentrina e pirimifós-metílico em grãos de milho. O método apresentou limites de detecção e quantificação abaixo do limite máximo de resíduos (MRL) estabelecidos pelo Codex Alimentarius, para o pirimifós-metílico. Entretanto, para a bifentrina o limite de detecção está aproximadamente duas vezes maior que o MRL estabelecido. O método SLE/LTP-GC/ECD otimizado e validado foi empregado para avaliar a taxa de degradação dos resíduos de bifentrina e pirimifós-metílico em grãos de milho expostos ao ozônio. O ozônio foi eficiente para degradar esses princípios ativos até valores próximos aos seus limites de detecção. Observou-se que a eficiência da degradação aumentou com o incremento na concentração do ozônio. Estudos posteriores deverão ser realizados com o objetivo de identificar o grau de mineralização e os possíveis produtos de degradação.
AGRADECIMENTOS Ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) e à Fundação de Amparo à Pesquisa do Estado de Minas Gerais (FAPEMIG) pelo apoio financeiro.
REFERÊNCIAS 1. Faroni, L. R. A.; Silva, J. S.; Em Secagem e Armazenagem de Produtos Agrícolas; Silva, J. S., ed.; Aprenda Fácil: Viçosa, 2008, cap. 15. 2. Silva, G. N.; Faroni, L. R. A.; Sousa, A. H.; Freitas, R. S.; J. Stored Prod. Res. 2012, 48, 111. 3. White, N. D. G.; Leesch, J. G.; Em Integrated Management of Insects in Stored Products; Subramanyam, B.; Hagstrum, D. W., eds.; Marcel Dekker: New York, 1996, cap. 7. 4. Oviedo, M. T. P.; Toledo, M. C. F.; Vicente, E.; Pesticidas: Revista de Ecotoxicologia e Meio Ambiente 2003, 13, 9. 5. http://www.agricultura.gov.br, acessada em Janeiro 2013. 6. Liu, J.; Yang, Y.; Yang, Y.; Zhang, Y.; Liu, W.; Toxicology 2011, 282, 47. 7. Wang, C.; Chen, F.; Zhang, Q.; Fang, Z.; J. Environ. Sci. 2009, 21, 1710. 8. Chen, S.; Luo, J.; Hu, M.; Geng, P.; Zhang, Y.; PLoS One 2012, 7, e30862. 9. Uygun, U.; Senoz, B.; Koksel, H.; Food Chem. 2008, 109, 355. 10. Weston, D. P.; Asbell, A. M.; Hecht, S. A.; Scholz, N. L.; Lydy, M. J.; Environ. Pollut. 2011, 159, 3051. 11. Hintzen, E. P.; Lydy, M. J.; Belden, J. B.; Environ. Pollut. 2009, 157, 110. 12. Trevizan, L. R. P.; Baptista, G. C.; Sci. Agric. 2000, 57, 199. 13. Coutinho, C. F. B.; Tanimoto, S. T.; Galli, A.; Garbellini, G. S.; Takayama, M.; Amaral, R. B.; Mazo, L. H.; Avaca, L. A.; Machado, S. A. S.; Pesticidas: Revista de Ecotoxicologia e Meio Ambiente 2005, 15, 65. 14. Wu, J.; Luan, T.; Lan, C.; Lo, T. W. H.; Chan, G. Y. S.; Food Control 2007, 18, 466. 15. Ikeura, H.; Kobayashi, F.; Tamaki, M.; J. Hazard. Mater. 2011, 186, 956. 16. Sharif, Z.; Man, Y. B. C.; Hamid, N. S. A.; Keat, C. C.; J. Chromatogr. A 2006, 1127, 254. 17. Abhilash, P. C.; Jamil, S.; Singh, N.; J. Chromatogr. A 2007, 1176, 43. 18. Sanusi, A.; Guillet, V.; Montury, M.; J. Chromatogr. A 2004, 1046, 35. 19. Vázquez, P. P.; Mughari, A. R.; Galera, M. M.; Anal. Chim. Acta 2008, 607, 74. 20. Ahamed, F. E.; Trends Anal. Chem. 2001, 20, 649. 21. Goulart, S. M.; Alves, R. D.; Neves, A. A.; Queiroz, J. H.; Assis, T. C.; Queiroz, M. E. L. R.; Anal. Chim. Acta 2010, 671, 41. 22. Goulart, S. M.; Alves, R. D.; Paula, W. X.; Queiroz, J. H.; Neves, A. A.; Queiroz, M. E. L. R.; J. Braz. Chem. Soc. 2012, 23, 1154. 23. Pinho, G. P.; Silvério, F. O.; Neves, A. A.; Queiroz, M. E. L. R.; Starling, M. A. V. M.; Quim. Nova 2010, 33, 909. 24. Dardengo, R. P.; Goulart, S. M.; Neves, A. A.; Reis, C.; Zambolim, L.; Queiroz, M. E. L. R.; Braz. J. Anal. Chem. 2011, 3, 136. 25. APHA; AWWA; WEF, Standard methods for the examination of water and wastewater, 21st ed. Public Health Association: Washington, 2005. 26. Ribani, M.; Bottoli, C. B. G.; Collins, C. H.; Jardim, I. C. S. F.; Melo, L. F. C.; Quim. Nova 2004, 27, 771. 27. http://portal.anvisa.gov.br, acessada em Dezembro 2012. 28. http://www.inmetro.gov.br/Sidoq/Arquivos/...-8_03.pdf, acessada em Dezembro 2012. 29. Marthe, D. B.; Bittencourt, L. M.; Queiroz, M. E. L. R.; Neves, A. A.; Quim. Nova 2010, 33, 1389. 30. Silvério, F. O.; Silva, J. G. S.; Aguiar, M. C. S.; Cacique, A. P.; Pinho, G. P.; Quim. Nova 2012, 35, 2052. 31. Vieira, H. P.; Neves, A. A.; Queiroz, M. E. L. R.; Quim. Nova 2007, 30, 535. 32. Maštovská, K.; Lehotay, S. J.; J. Chromatogr. A 2004, 1040, 259. 33. Prestes, O. D.; Friggi, C. A.; Adaime, M. B.; Zanella, R.; Quim. Nova 2009, 32, 1620. 34. Paschoal, J. A. R.; Rath, S.; Airoldi, F. P. S.; Reyes, F. G. R.; Quim. Nova 2008, 31, 1190. 35. Huber, L.; LC-GC Int. 1998, 11, 96. 36. Cunha, S. C.; Fernandes, J. O.; J. Chromatogr. A 2011, 1218, 7748. 37. Norman, K. N. T.; Panton, S. H. W.; J. Chromatogr. A 2001, 907, 247. 38. Hwang, E-S.; Cash, J. N.; Zabik, M. J.; J. Agri. Food Chem. 2001, 49, 3127. 39. Lin, L.; Xie, M.; Liang, Y.; He, Y.; Chan, G. Y. S.; Luan, T.; Food Control 2012, 28, 374. 40. Wu, J.; Lan, C.; Chan, G. Y. S.; Chemosphere 2009, 76, 1308. 41. Miao, H-F.; Qin, F.; Tao, G-J.; Tao, W-Y.; Ruan, W-Q.; Chemosphere 2010, 79, 355. 42. Von Gunten, U.; Water Res. 2003, 37, 1443. 43. Qiang, Z.; Liu, C.; Dong, B.; Zhang, Y.; Chemosphere 2010, 78, 517. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access