Artigo
|
|
| Complexos de platina(II) conjugado e análogo a O-glicosídeos: síntese, caracterização estrutural e atividade antitumoral Platinum(II) complexes conjugated and analogous to O-glycosides: synthesis, structural characterization and antitumor activity |
|
Lidiane M. A. de LimaI; Mirelly D. F. SantosI; Leonardo S. AlbuquerqueI; Mônica F. BelianI,*; Wagner E. SilvaI; João R. F. FilhoI; Jandyson M. SantosI; Jaciana S. AguiarII; Teresinha G. da SilvaII
I. Departamento de Química, Universidade Federal Rural de Pernambuco, 52171-900 Recife - PE, Brasil Recebido em 03/02/2020 *e-mail: mfbelian@gmail.com The synthesis, characterization, cytotoxicity and antitumor activity of platinum(II) complexes coordinated to O-glycoside and analogous is reported. Through the acute toxicity tests, it was possible to fit the complexes into categories according to the OECD protocol. The cis-[PtCl2(C6H14S2O2)-κ2S] complex was classified in category 3 and the cis-[PtCl2(C26H38O12S2)-κ2S] complex was classified in category 4. This result demonstrates the lower toxicity achieved by the glycoside in comparison with its analogous system. Evaluations of tumor masses extracted from mice inoculated with Ehrlich carcinoma demonstrated percent inhibition similar to cisplatin and synthesized platinum complexes. Cisplatin showed 59% inhibition, while cis-[PtCl2(C6H14S2O2)-κ2S] and cis-[PtCl2(C26H38O12S2)-κ2S] complexes presented 57% and 59%, respectively. Although the glycosidic compounds exhibit tumor activity, reported in the literature, the presence of platinum ion was shown to be determinant for antitumor action according with the compounds tested, since the glycosidic ligand presented tumor inhibition of only 38%, with a similar antitumor activity in relation to cisplatin. INTRODUÇÃO O estudo dos fármacos antitumorais baseados em platina teve início no advento da cisplatina em 1969. A descoberta serendipiosa de Rosenberg Barnett da atividade antimitótica da cis-diclorodiaminoplatina(II) ou cis-[PtCl2(NH3)2] (cisplatina ou CDDP), representa um período notável para a química inorgânica, a fim de promover sua interdisciplinaridade com as ciências da vida.1-3 Esse último ponto, combinado à árdua busca por novos agentes quimioterápicos, capazes de resolver o problema do câncer, receberam um apoio financeiro maciço, permitindo o grande começo de colaborações entre diferentes áreas do conhecimento, elevando a compreensão científica sobre a relação entre câncer e compostos de coordenação platínicos.4 Anualmente, os complexos de platina vêm contribuindo para o aumento de produções científicas em todo mundo, embora um número reduzido de complexos esteja de fato disponível no mercado farmacêutico. Isso não significa que esses compostos candidatos desfigurem a busca por novos agentes antineoplásicos, uma vez que problemas como efeitos colaterais e aparecimento de linhas de células tumorais resistentes não são totalmente resolvidos. Na Figura 1 são apresentadas as estruturas dos principais agentes antineoplásicos comerciais com destaque para o perfil toxicológico apresentado por cada complexo platínico.
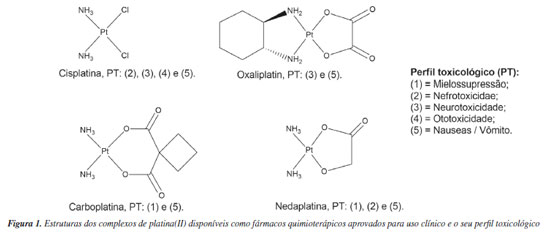 Figura 1. Estruturas dos complexos de platina(II) disponíveis como fármacos quimioterápicos aprovados para uso clínico e o seu perfil toxicológico
A atividade antitumoral dos complexos de platina dependem da cinética de substituição dos ligantes, com isso o uso de espécies que estabilizem a formação do íon Pt(II) e aumente o efeito trans substituinte torna-se uma alternativa eficaz no combate a fatores de resistência.5 Os complexos precisam apresentar estabilidade no meio fisiológico, até a chegada ao alvo biológico que é principalmente o nDNA (DNA nuclear). Logo, o uso de ligantes que possuem átomos de enxofre em sua estrutura, pode ser uma alternativa de estabilização do íon Pt(II), garantindo com que a estabilidade global do complexo seja alta impossibilitando-o de participar de reações redox, a qual é a causa principal dos danos oxidativos causados nos néfrons, levando muitas vezes a um quadro grave de nefrite.6 A química de complexos de platina contendo ligações metais-enxofre tornou-se de considerável importância biológica, uma vez que esta ligação pode ser formada em meio biológico, sendo em alguns casos responsáveis pelo processo de desativação e eliminação dos candidatos a fármacos platínicos, antes da ligação com as bases nitrogenadas do DNA-nuclear. Alguns trabalhos relatam a síntese, caracterização e avaliação da estabilidade química de alguns complexos de Pt(II) com ligantes contendo o enxofre como núcleo doador de elétrons para a formação da ligação coordenativa. Tais estudos mostram a viabilidade química e estabilidade termodinâmica desses complexos, o que motivou o presente trabalho a utilizar classes de ligantes contendo o enxofre como átomo doador, neste caso os tioéteres.7-9 Outra justificativa ao se utilizar tiocompostos e não aminocompostos, deve-se ao mecanismo de resistência desencadeado após a ligação coordenativa Pt-nDNA, no qual as proteínas responsáveis pela correção do emparelhamento (do inglês MMR - Mismatch Repair Proteins ou proteínas de correção do emparelhamento), são responsáveis pela ocorrência de resistência cruzada entre fármacos aminados, como no caso dos fármacos cisplatina (CDDP) e Carboplatina.10,11 Dessa forma, complexos que apresentem ligantes diferentes das aminas, nesse caso citado a amônia, possui uma captação celular diferenciada e independência quanto à ocorrência das proteínas MMR para desencadear apoptose. Dessa forma, torna-se eminente a busca por ligantes diferenciados, como os utilizados neste trabalho, que apresentem estrutura e conformação diferentes, ao sofrer substituição nucleofílica pelo nDNA. Outra estratégia utilizada para a escolha dos ligantes que irão compor a primeira esfera de coordenação consiste no uso de ligantes que favoreçam a entrada da platina no meio intracelular. Para isso, diversos compostos podem ser usados como iscas para células cancerígenas, como: polissacarídeos, glicosídeos, glicoproteínas, glicolipídeos, lecitinas modificadas, polipeptídeos, lipoproteínas e proteínas. A estratégia do uso desses compostos deve-se à necessidade exacerbada de células cancerígenas em captar nutrientes e aumentar a expressão de receptores de biomoléculas que gerem energia e façam síntese de DNA.12-22 Em 2001, Mikata e colaboradores descreveram a síntese de sete complexos de platina(II) com diaminas formadas a partir de glicinas e D-glicose, D-manose, D-galactose, D-xilose e L-glicose. Os compostos sintetizados apresentaram melhores valores de DL50 e menor toxicidade quando comparados à cisplatina.23 Em 2012, Moker e Theim visando obter menor toxicidade combinada a melhor absorção celular, sintetizaram trinta complexos de platina(II) com glicosídeos coordenados. Os glicosídeos continham em sua estrutura espaçadores hidrofóbicos e o ácido malônico, como ligante. Os complexos de platina(II) foram submetidos a testes de estabilidade e biológicos empregando diferentes linhagens de células tumorais, como carcinoma e pulmão de fibroblastos, onde quatro dos trinta compostos apresentaram melhores resultados de IC50 quando comparados à carboplatina (Figura 2).23
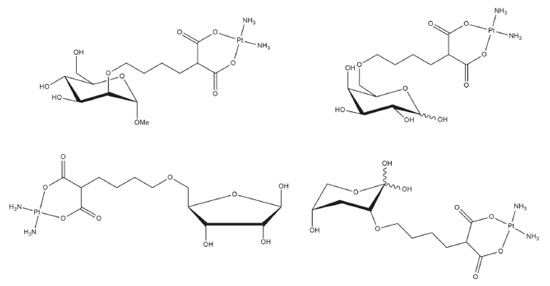 Figura 2. Complexos de platina(II) com glicosídeos que apresentaram melhores resultados de IC50 quando comparados à carboplatina23
O uso de carboidratos funcionalizados apresenta diversas vantagens como à versatilidade em formas de ligação ao metal e a estabilidade do complexo final em água. A incorporação de ligantes dessa natureza objetiva evitar os efeitos colaterais dos quimioterápicos, porque os carboidratos são biologicamente compatíveis, apresentam padrões de reconhecimento celular e são espécies menos tóxicas quando comparados a diversas classes de ligantes utilizados em síntese inorgânica. Devido a essas propriedades, a química de carboidratos tem crescido como uma das mais promissoras linhas de pesquisa em farmacologia, especialmente a classe dos O-glicosídeos 2,3-insaturados. Os glicosídeos 2,3-insaturados podem ser obtidos por reação com nucleófilos do tipo glicais, gerando O-, C-, N- e S-glicosídeos, dependendo do tipo de ligação, através da qual a parte de aglicona liga-se ao C-1 do hidrato de carbono. Os O-glicosídeos 2,3-insaturados podem ser preparados através de um rearranjo alílico do glicídio na presença de um álcool e um ácido de Lewis como catalisador. Esse rearranjo alílico é conhecido como o rearranjo de Ferrier.24,25 Nessa perspectiva, a síntese de complexos de platina com carboidratos, começa a receber uma considerável atenção, já que os poucos relatos demonstram baixa toxicidade e a possibilidade de administração por via oral, devido a sua alta solubilidade.26 Diante do exposto, o presente trabalho teve como objetivo a síntese, caracterização e estudo da atividade antitumoral de dois complexos platínicos, sendo um coordenado ao 3,6-ditia-1,8-octanodiol e o outro ao 3,6-ditia-1-octaneol-4,6-di-O-acetil-α-D-eritro enopiranosídeo (glicosídeo). A fim de completar a esfera de coordenação do íon Pt(II) nos compostos de coordenação, NC=4, foram usados dois íons cloretos.
PARTE EXPERIMENTAL Reagentes e solventes As sínteses foram realizadas nos laboratórios de Química Orgânica e Inorgânica do Departamento de Química, da Universidade Federal Rural de Pernambuco. Os solventes foram purificados e secos segundo métodos específicos, com algumas modificações, imediatamente antes do seu uso. O brometo de 3-[4,5-dimetiltiazol- 2-il]-2,5-difeniltetrazólio (MTT), 3,6-ditia-1,8-octanodiol (Ditia) 97% foi adquirido da Sigma Chemical Company (St. Louis, EUA). Todos os outros reagentes e solventes utilizados apresentam alta pureza e foram adquiridos de fontes comerciais. Caracterizações Os espectros de absorção eletrônica foram obtidos a partir de um espectrofotômetro, modelo Shimatzu, com faixa espectral de 190 a 900 nm. As amostras foram solubilizadas em água milli-Q, na concentração de 10-3 mol L-1. Os espectros de infravermelho foram registrados em um espectrômetro FT-IR Varian 640, utilizando pastilha de KBr na faixa de 4000−400 cm-1. Os espectros de RMN foram registrados na Varian Mercury (400 MHz para RMN 1H, 100 MHz para 13C e 87 MHz para 195Pt) utilizando CDCl3 e D2O como solvente. Os desvios químicos são descritos em partes por milhão (ppm) em relação a uma referência interna de TMS (trimetilsilano), para os núcleos de carbono e hidrogênio. Para as análises por espectrometria de massas de ultra-alta resolução foram preparadas soluções dos dois complexos de platina(II) a 50 ppm em uma mistura água:metanol (1:1 v/v). As soluções foram analisadas por um espectrômetro de massas Exactive Plus com analisador de m/z do tipo Orbitrap com transformada de Fourier (FT-MS, Thermo Scientific, Bremen, Germany) equipado com uma fonte de ionização por ESI, operando nos modos de aquisição positivo ou negativo - ESI(±), com as seguintes condições: voltagem do capilar de +4.4 ou −3.4 kV, lentes em 30 (arb) e temperatura do capilar de 320 °C. Nitrogênio foi utilizado como gás de nebulização. As análises foram realizadas no modo Full Scan com resolução de 140.000 em m/z 200 na faixa de m/z 150-1000, utilizando o software Xcalibur 3.0 (Thermo Scientific, Bremen, Germany). Os espectros de massas finais foram constituídos dos somatórios de 50 espectros por análise, considerando a subtração com o espectro referente a um branco. As identificações dos íons nos espectros de massas foram realizadas utilizando o software Xcalibur 3.0 (Thermo Scientific, Bremen, Germany). As fórmulas mínimas dos complexos foram determinadas incluindo os elementos C, H, O, N, Cl, S e Pt, sendo a composição elementar confirmada pelos íons referentes aos isótopos correspondentes. Foi considerado a correspondência entre o valor da m/z experimental em relação a m/z teórica a partir da biblioteca do software, considerando um erro menor que <2 ppm. Os pontos de fusão foram determinados utilizando um aparelho de ponto de fusão digital eletrotérmico (modelo IA9100) e não estão corrigidos. As rotações específicas foram medidas com um polarímetro Perkin-Elmer modelo 241. Procedimento geral para síntese do 3,4,6-Tri-O-acetil-D-glical Em um balão de fundo redondo de 500 mL, foi preparada uma suspensão de D-glicose (5,0 g, 27,75 mmol) em anidrido acético (36,0 g, 27,0 mmol) adicionando 10,0 g de 31% HBr/AcOH à 0 ºC, sob agitação durante 1 h. Esta solução foi preparada adicionando vagarosamente ácido bromídrico 48% (5,0 mL) em anidrido acético (20,0 mL). À mistura reacional foi adicionado 60,0 g de 31% HBr/AcOH (total de 5,3 mol equivalente de HBr) sob agitação vigorosa a 0 ºC, o sistema foi deixado em agitação por uma noite. Em seguida, o excesso de HBr foi neutralizado acrescentando acetato de sódio anidro (10,0 g, 122 mmol) ao meio reacional. Separadamente foi preparada uma suspensão de CuSO4.5H2O (1,57 g, 6,32 mmol) e zinco em pó (50,0 g, 0,78 mmol) em solução aquosa (50,0 mL) de ácido acético (75,0 mL) contendo acetato de sódio tri-hidratado (47,25 mmol). Essa suspensão foi então adicionada à mistura resultante da neutralização e deixada sob agitação por 6 h. O sólido foi removido através de filtração sob vácuo, lavado primeiro com acetato de etila (3 x 50 mL) e depois com água (3 x 100 mL). A fase orgânica foi lavada com solução aquosa saturada de NaHCO3 (3 x 50 mL) e com solução aquosa de NaCl (2 x 50 mL), e seca com MgSO4. Por fim, o solvente foi removido sob pressão reduzida e o produto foi purificado através de coluna cromatográfica com sistema hexano/AcOEt (9:1) para fornecer o tri-O-Acetil-D-Glical em rendimento de 86%. mp: 54-55 °C (lit.1 52-53 °C); [α]D20 -10,4 (c 1.00, MeOH) [lit.1 [α]D20 59,0 (c 1.00, EtOH)]; IR (KBr): 2959, 1738, 1649, 1373, 1226, 1043 cm-1 ; RMN 1H (300 MHz, CDCl3) δ 6,45 (d, J1-2=6,0 Hz, 1H, H1); 5,32 (br s, 1H, H-2); 5,20 (t, J3-2=J3-4=5,7 Hz, 1H, H-3); 4,84-4,81 (m, 1H, H-5); 4,38 (dd, J4-5=12,0 Hz, J4-3=5,7 Hz, 1H, H4); 4,25-4,16 (m, 2H, H-6, H-6'); 2,07 (s, 3H, OAc); 2,06 (s, 3H, OAc); 2,02 (s, 3H, OAc); RMN 13C (75 MHz, CDCl3) δ 170,5; 170,4; 169,5; 145,6; 98,9; 73,8; 67,4; 67,1; 61,3; 20,9; 20,7; 20,7 (ver Material Suplementar - Figuras 1S e 2S). Síntese do 3,6-ditia-1-octaneol-4,6-di-O-acetil-α-D-eritro enopiranosídeo (C26H38O12S2) Em um balão de fundo redondo (100 mL) foi adicionado o tri-O-acetil-D-glucal 1 (1 mmol), o 3,6-ditia-1,8-octanodiol (1,5 mmol) e 30 mL de CH2Cl2 anidro. Ao meio reacional foi adicionado o catalisador Montmorilonita K-10 (0,050 g, 30% p/p), à temperatura de 0 ºC. Em seguida, a mistura foi deixada em refluxo por 3 h, sendo a reação acompanhada por CCD em sistema Hexano:AcOEt (8:2). Após a reação a mistura foi filtrada, seca sobre MgSO4, e o solvente removido sob pressão reduzida. O produto foi purificado por cromatografia em coluna de sílica gel, utilizando um sistema eluente de hexano:AcOEt (9:1), para produzir o glicosídeo correspondente, em forma de óleo, em rendimento de 79,8%. [α]D25 +43,9 (c 1.00, CH2Cl2); IR (KBr) νmax 3468, 2622, 2252, 1742, 1231, 1037 cm-1; RMN 1H (400 MHz ,CDCl3) δ 6,05 - 5,78 (m, 2H); 5,37 - 5,26 (m, 1H); 5,10 - 4,98 (m, 1H); 4,28 - 4,15 (m, 2H); 4,11 (ddd, J = 2,3; 5,2; 9,7 Hz, 1H); 3,92 (td, J = 6,7; 10,5 Hz, 1H); 3,71 (td, J = 6,7; 10.2 Hz, 1H); 2,84 - 2,68 (m, 4H); 2,15 - 1,97 (m, 6H); RMN 13C (100 MHz, CDCl3) δ 171,6; 171,3; 130,2; 128,3; 95,1; 69,3; 67,9; 66,0; 63,8; 33,5; 32,8; 21,8; 21,7 (ver Material Suplementar - Figuras 3S e 4S). Síntese dos complexos de platina(II) Síntese do cis-dicloro(3,6-ditia-1,8-octanodiol-κ2S)platina(II) - cis-[PtCl2(C6H14S2O2)-κ2S] Em um balão de fundo redondo de 50 mL adicionaram-se 0,1 g (0,24 mmol) de K2[PtCl4], 5 mL de água destilada e 0,044 g (0,24 mmol) do ligante 3,6-ditia-1,8-octanodiol (C6H14S2O2). A mistura foi deixada sob agitação por 24 h ao abrigo da luz. Posteriormente, a solução foi então filtrada, liofilizada, dispersada em etanol e filtrada para a remoção do resíduo de KCl. Posteriormente o solvente foi removido por liofilização, obtendo-se no final um sólido de cor amarelo escuro. O rendimento obtido para a formação do complexo foi de 82%. O complexo apresentou alta solubilidade em água e em solução salina, sendo insolúvel em solventes orgânicos (etanol, acetato de etila, diclorometano, clorofórmio e hexano). Absorção eletrônica (λmáx) 308 (3A2g→3T2g), 370 (d→d); IR (KBr) νmax 3423, 2929, 2870, 1060, 670, 565, 496 cm-1; [M - H]+ com m/z 445,93886 (erro = 0,31385 ppm); RMN 195Pt (87 MHz, D2O) δ -3800 ppm. Síntese do cis-dicloro(3,6-ditia-1-octaneol-4,6-di-O-acetil-α-D-eritro enopiranosídeo-κ2S)platina(II) - cis-[PtCl2(C26H38O12S2)-κ2S] Em um balão de fundo redondo de 50 mL adicionaram-se 0,1 g (0,24 mmol) de K2[PtCl4], 5 mL de água destilada e 0,26 g (0,48 mmol) de 3,6-ditia-1-octaneol-4,6-di-O-acetil-α-D-eritro enopiranosídeo. O sistema foi mantido sob agitação constante por um período de 6 horas. Posteriormente, o sistema foi filtrado, liofilizado e lavado com diclorometano para remoção do excesso de ligante. Para a remoção do KCl, a mistura foi dispersada em etanol, filtrada e liofilizada, obtendo-se ao final um sólido de coloração amarelo. O rendimento obtido para a formação do complexo foi de 69%. O complexo apresentou alta solubilidade em água e em solução salina, sendo insolúvel em solventes orgânicos (etanol, acetato de etila, diclorometano, clorofórmio e hexano). Absorção eletrônica (λmáx) 307 (3A2g→3T2g), 372 (d→d); IR (KBr) νmax 3458, 2924, 2877, 1734, 1370, 1060, 668, 600, 496 cm-1; [M + H]+ com m/z 872,09022 (erro = -1,06910 ppm). Ensaios biológicos Os animais utilizados neste trabalho foram camundongos albinos suíços machos (Mus musculus) com 60 dias de idade, 30-35 g. Os ensaios biológicos foram conduzidos no Laboratório de Prospecção Farmacotoxicológica de Produtos Bioativos - BIOFARMATOX, do Departamento de Antibióticos, da Universidade Federal de Pernambuco. Os animais foram alojados em condições ambientais padrão de temperatura, umidade, sob ciclo claro/escuro 12/12 h. Os camundongos foram alimentados com dieta do biotério (LABINA® purina Brasil) e água ad libidum. Todos os procedimentos descritos foram aprovados pelo Comitê de Ética em Experimentação Animal da UFPE, protocolo número 23076.030363/2017-48. Toxicidade aguda Os ensaios de toxicidade aguda dos complexos de platina sintetizados foram realizados através de metodologia recomendada pela Organization for Economic Cooperation and Development (OECD), e a via de administração foi feita segundo o protocolo de toxidade aguda de dose única da Agência Nacional de Vigilância Sanitária (OECD, 2001).27 A avaliação de toxicidade ocorre inicialmente pela administração da dose de 300 mg kg-1 dos compostos em estudo. Para o experimento foram utilizados 3 (três) grupos de 3(três) animais fêmeas cada, grupo 1: cis-[PtCl2(C6H14S2O2)-κ2S], grupo 2: cis-[PtCl2(C26H38O12S2)-κ2S]; e o grupo 3: solução salina 0,9%; esse experimento foi repetido uma vez. Os compostos de platina sintetizados foram solubilizados em solução salina 0,9% e administrados via intraperitoneal. Os animais foram observados continuamente nas primeiras duas horas e depois a cada 24 h durante o período de 14 dias. No 15º dia os animais foram anestesiados com tiopental (5 mg kg-1) para coleta de sangue por punção cardíaca, e em seguida, eutanasiados. Atividade antitumoral O carcinoma de Erlich, tumor ascítico, foi obtido no Departamento de Antibióticos - UFPE, Brasil. O tumor foi mantido em camundongos albinos suíços na forma ascítica por transplante intraperitoneal. Para o experimento foram inoculadas subcutaneamente células tumorais ascíticas (suspensão de 5 x 106 células), na região axilar de 50 animais previamente pesados e divididos em cinco grupos experimentais (10 animais): (1) Controle (solução salina), (2) Padrão (cisplatina - cis-[PtCl2(NH3)2]), (3) C26H38O12S2, (4) cis-[PtCl2(C6H14S2O2)-κ2S] e (5) cis-[PtCl2(C26H38O12S2)-κ2S]. Após 24 h para o implante, o tratamento foi iniciado. A partir dos dados de toxicidade aguda foram estimadas as doses terapêuticas para os compostos C26H38O12S2 (3,5 mg kg-1), cis-[PtCl2(C6H14S2O2)-κ2S] (3 mg kg-1) e cis-[PtCl2(C26H38O12S2)-κ2S] (5,3 mg kg-1). As doses foram também estabelecidas segundo a quantidade molar de platina, em que os dois complexos sintetizados tiveram a mesma quantidade, garantindo, assim, a efetividade dos complexos quanto às estruturas propostas. A dosagem da cisplatina (1 mg kg-1), utilizada no procedimento para o grupo padrão (fármaco cujas as doses terapêuticas em animais já são bem descritas na literatura), foi determinada para uma faixa na qual ocorresse a menor manifestação dos efeitos colaterais. Os grupos de animais receberam 3,55 mg kg-1 do C26H38O12S2, 3 mg kg-1 do cis-[PtCl2(C6H14S2O2)-κ2S] e 5,33 mg kg-1 do cis-[PtCl2(C26H38O12S2)-κ2S], todos dissolvidos em solução salina 0,9% via intraperitoneal. Os grupos controle e padrão receberam, via intraperitoneal, solução salina e 1 mg kg-1 de cisplatina, respectivamente. Todos os animais receberam o tratamento descrito pelo período de 7 (sete) dias. No oitavo dia, os animais foram pesados e eutanasiados. Os tumores foram dissecados e pesados, e em seguida, foi calculada a inibição do crescimento tumoral dos grupos tratados em relação ao controle. O percentual de inibição do crescimento tumoral (IT) foi calculado pela fórmula: IT (%) = [(A-B)/A] x 100, onde: A = média das massas dos tumores no grupo controle e B = média das massas dos tumores nos grupos tratados. Os resultados de massa relativa dos órgãos e dos tumores foram analisados a partir da média e do desvio padrão de n experimentos. Para verificação da ocorrência de diferenças significativas entre os diferentes grupos, os dados foram comparados por análise de variância (ANOVA) seguida pelo teste de Bonferroni com intervalo de confiança de 95%, quando comparados ao grupo controle.
RESULTADOS E DISCUSSÃO Síntese do 3,6-ditia-1-octaneol-4,6-di-O-acetil-α-D-eritro enopiranosídeo (C26H38O12S2) A reação de glicosidação entre o tri-O-acetil-D-glical 1 e o álcool 2 como nucleófilo foi realizada em presença do catalisador montmorilonita K-10, sob refluxo em CH2Cl2 seco, para fornecer o correspondente glicosídeos 2,3-insaturados em rendimento de 79,8% e alta seletividade em favor do anômero α (Esquema 1).
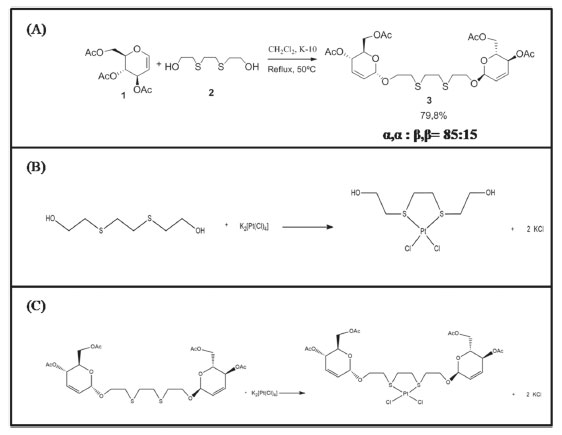 Esquema 1. Equações químicas: (A) Síntese do O-glicosídeo 2,3-insaturado 3, C26H38O12S2, sob catálise ácida, (B) Síntese do composto cis-[PtCl2(C6H14S2O2)-κ2S], e (C) Síntese do composto cis-[PtCl2(C26H38O12S2)-κ2S]
No espectro de infravermelho do C26H38O12S2 foram observados na região de 2963 cm-1 os picos de absorção referentes aos estiramentos simétrico e assimétrico das ligações C-H. Os estiramentos referentes ao C=C do glical aparece na faixa de 1660 cm-1 e na faixa de 1230 cm-1 aparece o estiramento da ligação C-O-C.As carbonilas do grupo acetato do anel piranosídico apareceram na região de 1740 cm-1. A estrutura e configuração do composto C26H38O12S2 foi deduzida através do espectro de RMN 1H e 13C. O espectro de RMN 1H do composto C26H38O12S2 mostrou um simpleto largo em δ 4,90 ppm referente ao hidrogênio anomérico, indicando a configuração axial do grupo 3,6-ditia-1,8-octanodiolil. Assim, conclui-se que o C26H38O12S2 é exclusivamente o α-anômero. Em δ 5,81 ppm aparece um dupleto referente ao acoplamento do hidrogênio H-3 com o H-2, em δ 5,72 ppm aparece outro dupleto referente ao acoplamento de H-2 com o H-3. Os hidrogênios referentes às metilas dos grupos OAc do anel piranosídeo aparecem como dois simpletos na região de δ 2,00 e 1,98 ppm. O sinal de próton de H-4 apareceu a 5,37 ppm como um multipleto. A configuração em C-4 em compostos 2,3-insaturados foi atribuída por análise da constante de acoplamento entre H-4 e H-5. A constante vicinal 3J4,5 é aproximadamente 9,6 Hz para o C26H38O12S2 indicando que a configuração da estrutura eritro. Com relação ao espectro de RMN 13C foi observado um sinal na região de δ 69,3 ppm referente ao carbono C-5 do anel piranosídeo, já o carbono da ligação glicosídica C-1 apresentou dois sinais na região de δ 95,1 ppm, devido a presença do anômero β. Os carbonos C-2 e C-3 do carboidrato aparecem na região de δ 130,2 e 128,3 ppm, respectivamente, enquanto os carbonos das carbonilas dos grupos OAc apareceram na região de δ 171,6-171,3 ppm. Os sinais na região de 33,0 ppm e 67,9 ppm correspondem, respectivamente, aos grupos metilênicos da parte aglicônica e do C-6 do anel piranosídico. Complexos de platina Os complexos de platina(II), cis-[PtCl2(C6H14S2O2)-κ2S] e cis-[PtCl2(C26H38O12S2)-κ2S], foram sintetizados de acordo com o esquema 1 (B) e (C), com rendimentos de 82 e 69%, respectivamente. Os complexos sintetizados apresentaram-se na forma de um sólido com características cristalinas e coloração amarela. Os complexos apresentaram características higroscópicas e solubilidade em água e soro fisiológico. Na Figura 3 são apresentados os espectros de absorção eletrônica do K2[PtCl4], cis-[PtCl2(C6H14S2O2)-κ2S] e cis-[PtCl2(C26H38O12S2)-κ2S], realizados em solução aquosa na concentração de 10-3 mol L-1. O espectro do C26H38O12S2 não foi apresentado, pois o mesmo não apresentou absorbância na região monitorada (200-700 nm).
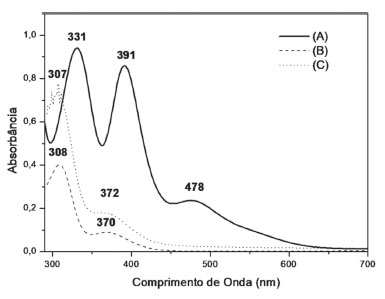 Figura 3. Espectros de absorção eletrônica dos compostos: (A) K2[PtCl4], (B) cis-[PtCl2(C6H14S2O2)-κ2S] e (C) cis-[PtCl2(C26H38O12S2)-κ2S], em solução aquosa na concentração de 10-3 mol L-1
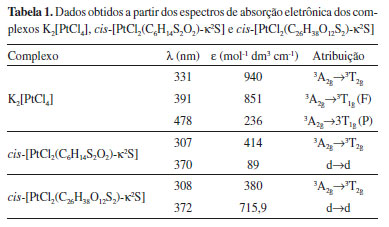
Através do espectro de absorção eletrônica do K2[PtCl4] é possível observar a presença de três transições em 331, 391 e 478 nm, características das transições permitidas, de acordo com o diagrama de Tanabe-Sugano, do tipo 3A2g→3T2g, 3A2g→3T1g(F) e 3A2g→3T1g(P).28 A banda de fraca intensidade em 478 nm é característica de transição d→d do complexo na região referente a cor complementar, região de cor azul-verde (480-550 nm). Os complexos cis-[PtCl2(C6H14S2O2)-κ2S] e cis-[PtCl2(C26H38O12S2)-κ2S] apresentam duas bandas em 307-308 nm, características da transição permitida, de acordo com o diagrama de Tanabe-Sugano, do tipo 3A2g→3T2g; e em 370-372 nm referente a uma banda de transição do campo cristalino, caracterizadas pelo desdobramento dos orbitais d do íon metálico frente às interações eletrostáticas dos ligantes (d→d). Esse sinal em 370-372 nm refere-se à banda de absorção característica da cor do complexo, visto que a cor complementar do amarelo é o violeta (360-450 nm). Uma vez que são notórias as mudanças do perfil das bandas dos complexos de platina em relação ao precursor, esse fato indica que houve modificação eletrônica, e, portanto, os complexos foram formados. Outro fato interessante é que nos complexos sintetizados houve uma coincidência entre as bandas, sendo uma evidência forte da estrutura eletrônica diretamente coordenada ao íon Pt(II), que no caso dos dois complexos são iguais. Na Tabela 1 são sumarizados os resultados obtidos nos espectros de absorção eletrônica dos complexos precursor e sintetizados.
Na Figura 4 são apresentados os espectros de infravermelho dos complexos cis-[PtCl2(C6H14S2O2)-κ2S] e cis-[PtCl2(C26H38O12S2)-κ2S].
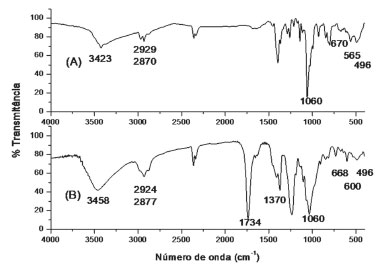 Figura 4. Espectros de infravermelho dos complexos: (A) cis-[PtCl2(C6H14S2O2)-κ2S] e (B) cis-[PtCl2(C26H38O12S2)-κ2S]
O espectro de FTIR do composto cis-[PtCl2(C6H14S2O2)-κ2S] apresentou bandas características do composto, como os estiramentos em 2929 e 2870 cm-1 característico de grupamentos CH; em 3423 cm-1 característico do grupamento OH livre, em 670 cm-1 o estiramento do grupo C-S deslocado para menores números de onda (C-S livre em 690 cm-1), característico da coordenação do íon metálico ao núcleo de enxofre. Observa-se também duas bandas em 496 e 565 cm-1 características da ligação Pt-S em posição "cis". No espectro do complexo cis-[PtCl2(C26H38O12S2)-κ2S] são observadas bandas características que indicam a formação desses compostos, por exemplo, em 1734 cm-1 um estiramento característico da banda C=O (glicosídeo); em 1370 cm-1 característico do grupamento C=C; em 3458 cm-1 referente ao estiramento do grupamento OH; e, em 669 cm-1, o estiramento do grupo C-S deslocado para menores números de onda, característico da coordenação do íon metálico ao núcleo de enxofre. Além disso, é possível verificar a presença de duas bandas de absorção de baixa intensidade em 496 e 600 cm-1 característico de ligação Pt-S na posição "cis".29 O espectro de massas de ultra-alta resolução (Figura 5) do complexo cis-[PtCl2(C6H14S2O2)-κ2S] mostrou a identificação do composto na análise por ESI(-)FT-MS, sendo possível detectar o íon da molécula na forma de [M - H]- com m/z 445,93886 referente a fórmula C6H13O2Cl2PtS2, cujo erro de atribuição foi de 0,31385 ppm. A Figura 5 também mostra a comparação do ESI(-)FT-MS teórico versus o experimental para o composto analisado, reforçando que o íon da molécula em estudo foi realmente detectado pela técnica, onde é possível notar o perfil de distribuição de íons com os diferentes padrões isotópicos da platina (192Pt, 194Pt, 196Pt, 198Pt) e do enxofre (34S), bem como, a combinação dos mesmos. Por exemplo, o íon com m/z 444,93676 é referente à fórmula molecular C6H13O2Cl2194PtS2.
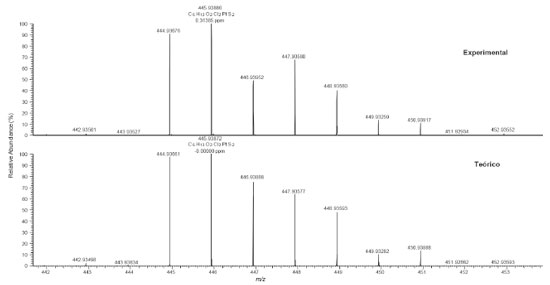 Figura 5. ESI(-)FT-MS experimental para o composto cis-[PtCl2(C6H14S2O2)-κ2S] que apresentou íon com fórmula C6H13O2Cl2PtS2, e seu respectivo espectro de massas teórico
O espectro de massas de ultra-alta resolução (Figura 6) do complexo cis-[PtCl2(C26H38O12S2)-κ2S] mostrou a identificação do composto na análise por ESI(+)FT-MS, sendo possível detectar o íon na forma de [M + H]+ com m/z 872,09022 referente a fórmula C26H39O12Cl2PtS2, com erro de atribuição de -1,06910 ppm. A Figura 6 também mostra a comparação do ESI(+)FT-MS teórico versus o experimental para o composto analisado, confirmando que o íon do complexo em estudo foi realmente detectado pela técnica, sendo possível notar o perfil de distribuição de íons com os diferentes padrões isotópicos da platina (192Pt, 194Pt, 196Pt, 198Pt) e do enxofre (34S), bem como, a combinação dos mesmos. Por exemplo, o íon com m/z 871,03259 é referente à fórmula molecular C26H39O12Cl2194PtS2.
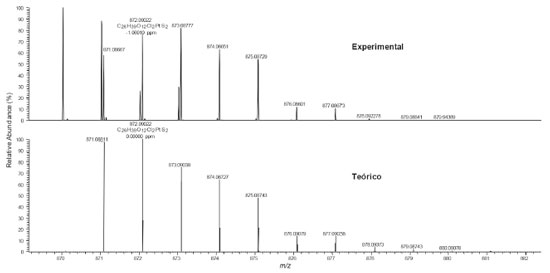 Figura 6. ESI(+)FT-MS experimental para o composto cis-[PtCl2(C26H38O12S2)-κ2S] que apresentou íon com fórmula C26H39O12Cl2PtS2 e seu respectivo espectro de massas teórico
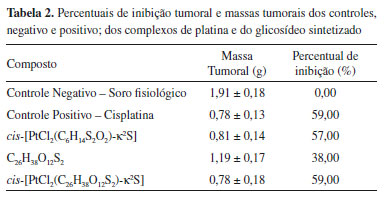
No RMN 195Pt do composto cis-[PtCl2(C6H14S2O2)-κ2S], em D2O, observou-se um pico em δ -3800 ppm, que é relativo a região de compostos do tipo [PtS2X2], sendo S = ligante coordenado ao sítio de enxofre e X=Cl, confirmando, dessa forma, que a ligação coordenativa entre ligante e platina foi formada.30,31 Atividade biológica Através dos ensaios de toxicidade aguda foi possível enquadrar os complexos e glicosídeos em categorias, segundo o protocolo da OECD. O complexo cis-[PtCl2(C6H14S2O2)-κ2S] foi enquadrado na categoria 3 e o complexo cis-[PtCl2(C26H38O12S2)-κ2S] foi enquadrado na categoria 4. Essas categorias expressam a toxicidade dos compostos administrados quanto ao total de óbitos, onde a categoria 1 expressa alta toxicidade e a categoria 5 como a classe de compostos de baixa toxicidade ou atóxicos. Os valores de dose letal a 50% (DL50) para os dois complexos foram 300 e 2000 mg kg-1, para os complexos cis-[PtCl2(C6H14S2O2)-κ2S] e cis-[PtCl2(C26H38O12S2)-κ2S], respectivamente. Nesse ponto vale salientar que a cisplatina está enquadrada na categoria 2, com DL50 de 5 mg kg-1. Esse resultado demonstra a mais baixa toxicidade alcançada pelo glicosídeo em comparação com seu ligante análogo, assim como a baixa toxicidade dos complexos sintetizados em comparação com o fármaco comercial, a cisplatina. As avaliações das massas tumorais extirpadas dos camundongos inoculados com o carcinoma de Ehrlich demonstraram percentuais de inibição semelhantes ao controle positivo, que é a cisplatina, e aos complexos de platina sintetizados. A cisplatina apresentou 59% de inibição, enquanto os complexos cis-[PtCl2(C6H14S2O2)-κ2S] e cis-[PtCl2(C26H38O12S2)-κ2S] apresentaram percentual de 57% e 59%, respectivamente. A análise estatística desses dados indica não haver diferença significativa entre os complexos e o controle positivo. Embora os compostos glicosídicos apresentem atividade tumoral já relatada na literatura, a presença da platina se mostrou determinante para ação antitumoral de acordo com os compostos testados, uma vez que o ligante glicosídeo - C26H38O12S2 - apresentou inibição tumoral de apenas 38%. Na Tabela 2 são apresentados os percentuais de inibição tumoral e massas tumorais (com desvio padrão) dos controles, negativo e positivo; dos complexos de platina e do glicosídeo sintetizado.
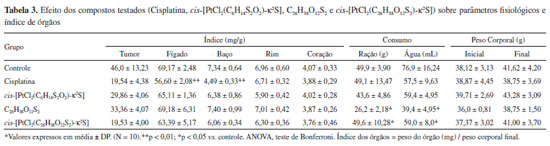
Os compostos de platina sintetizados apresentaram ausência de óbitos nos grupos tratados e percentual de inibição tumoral satisfatório, segundo modelo animal testado. Segundo análise macroscópica dos animais, submetidos ao tratamento quimioterápico durante 7 (sete) dias, todos apresentaram ganho de massa corpórea (mesmo debitando-se contribuição da massa tumoral) (Tabela 3) e não apresentaram alterações de pêlo (queda, espessamento e piloereção). Os parâmetros fisiológicos observados pelo consumo de água e ração não apresentaram diferença significativa entre os grupos tratados. Apesar disso, observa-se que o grupo tratado com o composto cis-[PtCl2(C26H38O12S2)-κ2S] apresentou menor consumo de água e ração, o que afetou no baixo ganho de peso corporal. Avaliando os índices dos órgãos, observa-se uma pequena atrofia do fígado e baço no grupo tratado com cisplatina, associado à alta toxicidade apresentado por esse complexo. No caso dos complexos cis-[PtCl2(C6H14S2O2)-κ2S] e cis-[PtCl2(C26H38O12S2)-κ2S] não foram observados alterações significativas com relação aos índices dos órgãos.
CONCLUSÃO A síntese do ligante glicosídeo, C26H38O12S2, apresentou bons rendimentos (79,8%) e alta seletividade em favor do anômero α. A estrutura e configuração do glicosídeo foram deduzidas através do espectro de RMN 1H e 13C. Os complexos de platina, cis-[PtCl2(C6H14S2O2)-κ2S] e cis-[PtCl2(C26H38O12S2)-κ2S], foram sintetizados com rendimentos de 82 e 69%, respectivamente. Os complexos apresentaram características higroscópicas e solubilidade em água e soro fisiológico, o que demonstrou aplicabilidade como agente antitumoral. Os dados de caracterização demonstraram a formação dos complexos desejados, como a espectrometria de massas que mostrou um m/z 445,93886 referente a fórmula C6H13O2Cl2PtS2 - cis-[PtCl2(C6H14S2O2)-κ2S]; e com m/z 872,09022 referente a fórmula C26H39O12Cl2PtS2 - cis-[PtCl2(C26H38O12S2)-κ2S]. Os dados da atividade antitumoral mostraram percentuais de inibição tumoral para a cisplatina de 59%, enquanto que os complexos cis-[PtCl2(C6H14S2O2)-κ2S] e cis-[PtCl2(C26H38O12S2)-κ2S] apresentaram percentual de 57% e 59%, respectivamente. Apesar de apresentar atividades similares à cisplatina, os sistemas propostos apresentam redução da toxicidade, uma vez que a cisplatina é um fármaco pertencente à categoria 2, o cis-[PtCl2(C6H14S2O2)-κ2S] da categoria 3 e o cis-[PtCl2(C26H38O12S2)-κ2S] da categoria 4, sendo esse último pertencente à categoria toxicológica menos nociva ao ensaio proposto.
MATERIAL SUPLEMENTAR Espectros de 1H e 13C de 3,4,6-Tri-O-acetil-D-glical e 3,6-ditia-1-octaneol-4,6-di-O-acetil-α-D-eritro enopiranosídeo - GlicoDitia - estão disponíveis em http://quimicanova.sbq.org.br, em formato PDF, com acesso livre.
AGRADECIMENTOS Ao Centro de Apoio a Pesquisa da UFRPE (CENAPESQ). Ao CNPq pelo apoio financeiro do projeto Universal 14/2013 (Processo: 472382/2013-6). À CAPES pelas bolsas de mestrado concedidas.
REFERÊNCIAS 1. Rosemberg, B.; VanCamp, L.; Krigas, T.; Nature 1965, 205, 698. 2. Rosemberg, B.; Van Camp, L.; Trosko, J. E.; Mansour, V. H.; Nature 1969, 222, 385. 3. Rosemberg, B.; Naturwissenschaften 1973, 60, 399. 4. Lippert, B.; Cisplatin: Chemistry and Biochemistry of a Leading Anticancer Drug, Verl. Helvetica Chimica Acta, Wiley-VCH, 1999, pag. 3. 5. Cleare, M. J.; Hoeschele, J. D.; Bioinorg. Chem. 1973, 2, 187. 6. da Silva, R. G.; Silva, W. E.; Belian, M. F.; Rev. Virtual Quim. 2018, 10, 1140. 7. Natochin, Y. V.; Efimenko, I. A.; Zhuravleva, M. A.; Shubochkina, E. F.; Terent'eva, S. A.; Biol. Membr. 1992, 9, 382. 8. Antonov, P. G.; Kukushkin, Yu. N.; Shan'ko, A. N.; Konovalov, L. V.; Zh. Obshch. Khim. 1977, 47, 129. 9. Baran, Y.; Kaya, I.; Turkyılmaz, M.; J. Therm. Anal. Calorim. 2012, 107, 869. 10. Andrews, P. A.; Howell, S. B.; Cancer Cells 1990, 2, 35. 11. Burger, H.; Loos, W. J.; Eechoute, K.; Verweij, J.; Mathijssen, R. H. J.; Wiemer, E. A. C.; Drug Resist. Updates 2011, 14, 22. 12. Raymond, E.; Faivre, S.; Chaney, S.; Woynarowski, J.; Cvitkovic, E.; Mol. Cancer Ther. 2002, 1, 227. 13. Oner, E. T.; Hernandez, L.; Combie, J.; Biotechnol. Adv. 2016, 34, 827. 14. Ates, O.; Frontiers in Bioengineering and Biotechnology 2015, 3, 3. 15. Kazak Sarilmiser, H.; Toksoy Öner, E.; Biochem. Eng. J. 2014, 92, 28. 16. Esawy, M. A.; Abdel-Fattah, A. M.; Ali, M. M.; Helmy, W. A.; Salama, B. M.; Taie, H. A.; Hashem, A. M.; Awad, G. E.; Carbohydr. Polym. 2013, 96, 332. 17. Liu, J.; Luo, J.; Ye, H.; Zeng, X.; Food Chem. Toxicol. 2012, 50, 767. 18. Yoo, S.; Yoon, E.; Cha, E.; Lee, H.; Int. J. Biol. Macromol. 2004, 34, 37. 19. Queiroz, E. A. I. F.; Fortes, Z. B.; da Cunha, M. A. A.; Sarilmiser, H. K.; Dekker, A. M. B.; Öner, E. T.; Dekker, R. F. H.; Khaper, N.; Int. J. Biol. Macromol. 2017, 102, 565. 20. Silva, W. E.; de Souza, I. A.; Calazans, G. M. T.; de Sá, G. F.; Alves Jr., S.; Malta, O. M. L.; Farrell, N. P.; PI 1002918-4 A2, 2010. 21. Junicke, H.; Arendt, Y.; Steinborn, D.; Inorg. Chim. Acta 2000,304, 224. 22. Hartinger, C. G.; Nazarov, A. A.; Ashraf, S. M.; Dyson, P. J.; Keppler, B. K.; Curr. Med. Chem. 2008, 2574. 23. Mikata, Y.; Shinohara, Y.; Yoneda, K.; Nakamura, Y.; Brudzinska, I.; Tanase, T.; Kitayama, T.; Takagi, R.; Okamoto, T.; Kinoshita, I.; Doe, M.; Orvigf, C.; Yanoc, S.; Bioorg. Med. Chem. Lett. 2001, 11, 3045. 24. Möker, J.; Thiem, J.; Carbohydr. Res. 2012, 348, 14. 25. Moura, A. L.; Lima, L. M. A.; Bezerra, G. B.; Freiras, J. J. R.; Belian, M. F.; Ramos, C. S.; Avelino, R. A.; Freitas Filho, J. R.; Quim. Nova 2018, 41, 550. 26. Freitas Filho, J. R.; Srivastava, R. M.; Soro, Y.; Cottier, L.; Descotes, G.; J. Carbohydr. Chem. 2001, 20, 561. 27. Organisation for Economic Cooperation and Development; Guidelines for the Testing of Chemicals, OECD 423. Acute Oral Toxicity-Acute Toxic Class Method, Paris, 2001, disponível em https://ntp.niehs.nih.gov/iccvam/suppdocs/feddocs/oecd/oecd_gl423.pdf, acessado em Maio 2020. 28. Martin Jr., D. S.; Tucker, M. A.; Kassman, A. J.; Inorg. Chem. 1965, 1682. 29. Nakamoto, K.; Infrared and Raman spectra of inorganic and coordination compounds: part A: theory and applications in inorganic chemistry, 6 ed., John Wiley & Sons: Hoboken, 2009, xi, 419 p. 30. Lippert, B.; Cisplatin: Chemistry and Biochemistry of a Leading Anticancer Drug, Wiley-VCH / Ed. WHCA, Verlag Helvetica Chimica Acta: Zurique,1999, p. 294. 31. Mebsout, F.; Kauffmann, J.-M.; Patriarche, G. J.; J. Pharm. Biomed. Anal. 1987, 5, 223. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access