Educação
|
|
| Efeito do Hg2+ e dos íons Cu2+, Fe2+, Ni2+, Sn2+ E Zn2+ na estabilidade de nanopartículas de prata: uma prática interdisciplinar de nanotecnologia experimental Effect of Hg2+ and of the ions Cu2+, Fe2+, Ni2+, Sn2+, AND Zn2+ on the stability of silver nanoparticles: an interdisciplinary practice of experimental nanotechnology |
|
Aline Kaori KatanosakaI; Anne Helene FostierII#; Elias Barros SantosI*
I. Universidade Federal de São Paulo, 12231-280 São José do Campos - SP, Brasil Recebido em 28/09/2020 *e-mail: santos.barros@unifesp.br The growing predominance of nanoscience and nanotechnology makes it increasingly important that these topics become an integral part of all scientific education. For this reason, in the present work, an interdisciplinary experiment of nanotechnology is introduced. As silver nanoparticles (AgNPs) are the most applied nanomaterial in consumer products, the current understanding of their stability is needed. Silver nanoparticles were synthesized using chitosan as a capping agent and a size distribution of 9.7 nm was determined by transmission electron microscopy. After preparation, the AgNPs colloid was divided into two parts. One part was stored in dark at 4.0 ± 1.0 oC and it was removed out from the fridge only to be analyzed by UV-vis. The second part was used to study the colloid stability in the presence of Hg2+, and also in the combination of mercury with the ions Cu2+, Fe2+, Ni2+, Sn2+, and Zn2+. The UV-vis analysis indicated that the AgNPs were oxidized in the presence of these ions, but in different intensities, which can be explained by using the electrochemistry approach. This work may be relevant for graduate-level or upper-level undergraduate experimental course preparation as the procedure is simple and easily reproducible in a typical chemistry laboratory. INTRODUÇÃO A nanociência e nanotecnologia é um campo multidisciplinar de pesquisa e desenvolvimento apontado como uma das maiores prioridades estratégicas entre os países desenvolvidos.1 Alguns autores consideram o desenvolvimento da nanotecnologia como parte fundamental para a chamada "Quarta Revolução Industrial", também denominada de Indústria 4.0.2,3 A estimativa atual é que o mercado global em nanotecnologia movimente cerca de U$ 125 bilhões entre 2018-2024. Os principais setores da economia global que lideram os investimentos em nanotecnologia são às áreas de eletrônica, energia, biomédica, cosméticos, defesa, automotiva e agricultura.4 A explicação para o grande interesse na área está relacionada à melhor performance apresentada pelos produtos manufaturados com nanomateriais quando comparados com os mesmos produtos sem nanotecnologia. Com a engenharia de nanomateriais é possível modular as propriedades ópticas, elétricas e a reatividade das nanoestruturas em função do seu tamanho, geometria e composição química, permitindo assim projetar tecnologias mais eficientes.5,6 Como consumidores finais dessas tecnologias, o tema passa a ser de grande importância social, pois terá um impacto direto nas vidas das pessoas nos próximos anos, inclusive na empregabilidade dos novos graduandos.7 Entretanto, apesar do rápido desenvolvimento da nanociência e nanotecnologia nos últimos 20 anos, este tema ainda é pouco abordado na área da educação. Nesse sentido, torna-se cada vez mais relevante e fundamental a abordagem da nanociência e nanotecnologia no sistema educacional, principalmente como parte integrante de toda formação em ciência, tecnologia, engenharia e matemática (STEM education).8 Além disso, é importante que o tema também seja amplamente divulgado para a sociedade, tendo os estudantes atuais em STEM um papel fundamental neste processo de divulgação científica. Vale ressaltar aqui algumas iniciativas importantes de disseminação do tema nanotecnologia para a sociedade, como por exemplo, o National Nanotechnlogy Day nos Estados Unidos (no dia 9 de outubro em analogia ao 109 nanometros da unidade), livro de ficção científica, sites na internet, cartilhas e HQs.9-14 De acordo com Jackman e colaboradores, como a nanotecnologia apresenta um aspecto multidisciplinar é preciso discutir nos sistemas de educação de cada país como introduzir o tema na formação dos estudantes de graduação.15 De acordo com os autores, é preciso levar em consideração a possibilidade de criação de cursos específicos em nanotecnologia, como já existem em algumas universidades nos Estados Unidos e na Europa, ou incluir como disciplina em cursos já existentes, como por exemplo, química, física, biologia, engenharias e cursos tecnológicos. No sistema educacional brasileiro, o assunto nanotecnologia tem sido mais abordado em cursos de pós-graduação, geralmente na forma de disciplinas integrais sobre o tema e/ou como parte da ementa de algum curso afim.16 Nos cursos de graduação em STEM são encontrados alguns exemplos de abordagem do tema nanotecnologia, geralmente como parte da ementa de uma determinada disciplina teórica ou experimental.17,18 Existem poucos exemplos de disciplina integral em nanotecnologia ou de um curso especifico na área. Melo e colaboradores relataram um experimento de nanopartículas de prata e ouro como uma estratégia de introdução do tema nanociência em laboratório de ensino, sendo parte integrante da ementa de uma disciplina de química inorgânica experimental.19 Klobes e Koch propuseram um experimento simples de síntese de nanopartículas de carbono usando lactose e bicarbonato de sódio, que pode ser realizado até em aulas de laboratório para estudantes do ensino médio.20 No ano de 2016, foi publicado no Brasil o livro "Nanotecnologia Experimental" por Toma e colaboradores, com vários exemplos de experimentos que podem ser implementados em aulas de graduação e pós-graduação.21 Diante do exposto, é possível notar que existem algumas iniciativas e propostas que tem contribuído para disseminação e implementação do tema nanociência e nanotecnologia no sistema de educação. Entretanto, é um tema multidisciplinar, podendo ser abordado em diversas áreas do conhecimento, sendo um campo aberto para novas propostas. Neste contexto, o objetivo do presente trabalho é propor um experimento de síntese de nanopartículas de prata coloidal que possa ser facilmente implementado em uma disciplina experimental com foco em nanociência e/ou de interação com a química. Esse experimento pode ser realizado em disciplinas de graduação ou de pós-graduação em Química, Engenharia e Ciência de Materiais e cursos de caráter interdisciplinar. Por exemplo, na Universidade Federal de São Paulo (UNIFESP), unidade de São José dos Campos, tem sido ofertada anualmente a disciplina "Introdução à Nanotecnologia", que inclui uma carga horária experimental de 6 h, possibilitando implementar o experimento. Com essa prática é possível fazer uma abordagem interdisciplinar sobre o uso dos nanomateriais e seu descarte no meio ambiente, além dos assuntos científicos tais como: síntese química, química coloidal, reatividade das nanopartículas, técnicas de caracterização, eletroquímica, entre outros. A prática consiste na síntese de um coloide de prata usando borohidreto de sódio como agente redutor e quitosana como agente apassivador. Em seguida, são realizados testes de estabilidade das AgNPs na presença de Hg2+ e também do Hg2+ combinado com outros íons metálicos. A escolha do íon mercúrio se deu devido a sua presença no meio ambiente como poluente, o que possibilitará trazer uma discussão de caráter interdisciplinar com os estudantes. Para as análises do coloide de AgNPs e das misturas das nanopartículas com os íons, pode ser usada a técnica de espectroscopia de absorção na região do Ultravioleta-visível (UV-vis). Essa técnica permite uma análise rápida, de simples operação e com equipamento comumente disponível em laboratórios de graduação.
PARTE EXPERIMENTAL O procedimento experimental será dividido em três etapas como uma sugestão de roteiro com duração de 2 h por aula, que poderá ser adotado pelo docente em uma disciplina prática. Entretanto, o docente poderá fazer adaptações de acordo com a realidade da sua instituição e o tipo de abordagem que será enfatizada ao realizar o experimento. Reagentes usados no experimento Os reagentes nitrato de prata, de cobre, de níquel, de ferro, de estanho e de zinco, borohidreto de sódio, ácido acético, ácido sulfúrico, peróxido de hidrogênio 35%, quitosana em pó de baixo peso molecular (78% desacetilada) e citrato de mercúrio foram adquiridos da Sigma-Aldrich e usados como recebidos. Primeira aula: Síntese e caracterização das nanopartículas de prata O coloide de nanopartículas de prata foi sintetizado de acordo com um método já reportado na literatura científica, porém, com uma quitosana diferente e algumas adaptações.22 Foi preparada uma mistura de 250 mL de nitrato de prata 2,1 x 10-3 mol L-1 e 200 mL de quitosana 1,0 g L-1, dissolvida em ácido acético (pH = 2,3). Em seguida, lentamente foi adicionado 50 mL de uma solução de borohidreto de sódio 1,0 x 10-2 mol L-1, causando uma mudança de cor imediata do incolor, para o marrom e, em seguida, amarelo. A mistura foi mantida sob agitação magnética à temperatura de 20 oC por 1 h. Após a síntese, o coloide de AgNPs apresentou pH 4,5. Toda a vidraria usada na síntese foi limpa antes com solução piranha (mistura de ácido sulfúrico e peróxido de hidrogênio 4:1 v/v), e em seguida lavadas com água destilada. Os espectros de absorção no UV-vis foram coletados usando um espectrofotômetro JASCO, modelo V-730-iRM. As soluções analisadas foram transferidas para uma cubeta de quartzo de caminho óptico igual a 1 cm. O coloide de AgNPs foi analisado por UV-vis durante 18 meses para investigar a sua estabilidade. As imagens de microscopia eletrônica de transmissão (TEM) foram obtidas usando o microscópio da JEOL, modelo JEM-2100 (200 kV de potência e 0.25 nm de resolução pontual). As amostras para TEM foram preparadas por deposição de gotas do coloide de AgNPs sobre grades de cobre, recobertas com filme fino de carbono. Após a evaporação da água, as amostras foram analisadas. A contagem de tamanho de partículas foi realizada a partir da análise de imagens de TEM usando o software ImageJ. Os valores foram transferidos para o software Origin 8.0 Pro, sendo construído os histogramas de distribuição de tamanho. Segunda aula: Preparo das soluções para uso na terceira aula Foi preparada uma solução estoque de citrato de mercúrio 1,0 x 10-2 mol L-1, usando água deionizada, sendo em seguida diluída nas concentrações 1,0 x 10-3, 1,0 x 10-4, 1,0 x 10-5 e 1,0 x 10-6 mol L-1. Foram preparadas soluções dos íons Cu2+, Fe2+, Ni2+, Sn2+ e Zn2+ na concentração 1,0 x 10-3 mol L-1, usando água deionizada. Foram feitas misturas da solução de mercúrio 1,0 x 10-3 mol L-1 com cada íon metálico individual na mesma proporção, bem como uma mistura de Hg2+ com todos os cinco íons metálicos. Terceira aula: Testes de estabilidade das AgNPs na presença de íons metálicos Para o primeiro teste, foram adicionados volumes incrementais de 25 µL da solução de Hg2+ 1,0 x 10-3 mol L-1, até o máximo de 250 µL, em tubos tipo eppendorf contendo 500 µL do coloide de AgNPs. Após cada adição, o volume da mistura foi completado para 2,0 mL, capacidade do tubo, com água deionizada. Em seguida, as soluções foram analisadas por espectroscopia de absorção na região do Ultravioleta-visível. Para o segundo teste, foram adicionados volumes incrementais (de 200 a 1100 µL) das soluções de Hg2+ 1,0 x 10-4, 1,0 x 10-5 e 1,0 x 10-6 mol L-1 em tubos tipo eppendorf contendo 500 µL do coloide de AgNPs. Após cada adição, o volume da mistura foi completado para 2,0 mL com água deionizada, sendo em seguida analisadas por UV-vis. Para o terceiro teste, o procedimento foi o mesmo para todas as combinações de Hg2+ com os íons metálicos. Foram adicionados 250 µL da mistura em tubos tipo eppendorf contendo 500 µL do coloide de AgNPs. Após completar os volumes com água deionizada para 2,0 mL, as misturas foram analisadas por UV-vis. Todos os testes foram realizados em duplicata. Manejo dos resíduos gerados O tratamento das soluções contendo mercúrio foi baseado na baixa solubilidade que esse metal apresenta em água, que é 6 x 10-6 g por 100 mL a 25 oC e a 1 atm de pressão.23 Após finalizar a prática experimental, o mercúrio estava na forma elementar Hgo, devido a redução dos íons Hg2+ pela oxidação das AgNPs. Com isso, as soluções dos tubos foram transferidas para um único recipiente de vidro, permitindo a formação de uma minúscula esfera de mercúrio imersa em água. O recipiente foi lacrado, identificado e armazenado no abrigo de resíduos do laboratório.
RESULTADOS E DISCUSSÃO As nanopartículas de prata encapadas com quitosana preparadas no presente trabalho apresentam uma forte banda de absorção em 395 nm (Figura 1), atribuída a ressonância de plasmon de superfície (SPR) característica de AgNPs.24 Analisando o coloide de AgNPs por UV-vis durante 18 meses, foi observado que a banda SPR se mantém intensa e os espectros apresentam-se quase totalmente sobrepostos (Figura 1). Após os 18 meses de monitoramento foi detectado apenas um decréscimo da intensidade SPR de 0,25 de absorbância, indicando que o coloide se manteve estável durante esse tempo. Esse resultado sugere que o coloide de AgNPs sintetizado apresenta estabilidade de pelo menos 18 meses, preservando a sua propriedade plasmônica. Durante esse tempo não foi observado nenhum deslocamento na posição da banda SPR, indicando que não houve agregação ou dissolução das nanopartículas, sendo outra evidência da boa estabilidade do coloide. Esse tempo de estabilidade é bastante significativo, uma vez que a maioria dos coloides de prata apresentam estabilidade inferior a um ano, com dependência direta do método de síntese, tipo de apassivador e de armazenamento.25-27 Além disso, pode-se destacar também o papel importante da quitosana como agente apassivador das AgNPs, prevenindo a oxidação da prata e contribuindo para a grande estabilidade do coloide. Como já relatado na literatura, nanopartículas coloidais apassivadas por polímeros geralmente apresentam maior estabilidade do que quando apassivadas por moléculas menores, tanto neutras quanto carregadas negativamente ou positivamente.28,29 Vale ressaltar que, em uma prática experimental, esse monitoramento longo da estabilidade das nanopartículas é inviável devido ao tempo restrito da disciplina. Entretanto, a realização de um experimento igual ao do presente trabalho garantirá que os alunos estarão sintetizando um coloide estável de AgNPs, sendo um aspecto importante para as etapas seguintes e uma correta interpretação dos dados.
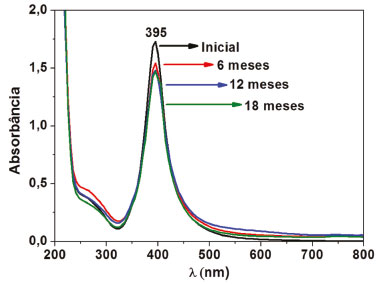 Figura 1. Espectros UV-vis do coloide de AgNPs pós-síntese (inicial) e após 6, 12 e 18 meses
A forma simétrica da banda SPR sugere que as nanopartículas de prata devem apresentar uma distribuição de morfologia uniforme, o que foi confirmado por análises de TEM, como mostrado na Figura 2. Como pode ser observado na Figura 2(a), as nanopartículas de prata exibem morfologia esferoidal. É possível também observar nanopartículas com morfologia irregular, entretanto, isto parece ocorrer em menor frequência. Contando e medindo o diâmetro das nanopartículas em diferentes imagens TEM, foi possível obter a distribuição de tamanho (Figura 2b), a qual se ajusta bem a uma função de distribuição log-normal e o máximo da curva foi usado como indicador do tamanho médio (9,7 nm). Analisando o mesmo coloide de AgNPs após 18 meses da síntese, foi observado o mesmo tipo de morfologia das nanopartículas e um pequeno aumento do tamanho médio para 11,8 nm (Figura 2c e d). Essa pequena variação de tamanho pode ter origem na coalescência de algumas partículas via mecanismo de Ostwald Ripening, levando à formação de AgNPs maiores em função do tempo.30 Outra possibilidade é a ocorrência de uma pequena taxa de oxidação das AgNPs em função do tempo.31 Entretanto, esses efeitos parecem pouco significantes uma vez que as análises por UV-vis e TEM mostraram que as nanopartículas mantiveram sua propriedade plasmônica e integridade física até pelo menos 18 meses. Além disso, na contagem de tamanho de partículas é impossível repetir exatamente a mesma população, sendo pequenas variações de distribuição algo normal de ser observado. Em uma prática experimental realizada em uma instituição sem acesso a um microscópio eletrônico de transmissão, a estimativa do tamanho das nanopartículas de prata pode ser feita comparando a posição da banda SPR obtida com outros trabalhos já publicados. Essa aproximação é válida desde que a síntese tenha sido realizada nas mesmas condições, uma vez que a posição da banda SPR sofre influência do tamanho, do estado de agregação, da geometria e do meio no qual as nanopartículas estejam suspensas.32,33
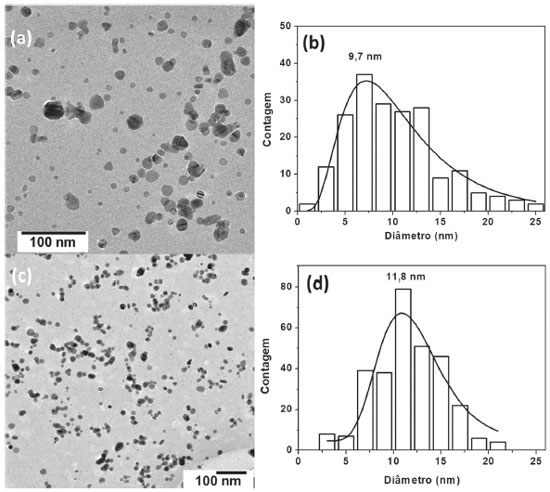 Figura 2. Imagens TEM e suas correspondentes distribuições de diâmetros de AgNPs após a síntese (a)-(b) e após 18 meses da síntese (c)-(d)
Os resultados das medidas de UV-vis do primeiro teste de interação entre as AgNPs e o íon Hg2+ estão mostrados na Figura 3. Como pode ser observado, a adição das alíquotas da solução de Hg2+ 1,0 x 10-3 mol L-1 provocou uma diminuição de intensidade da banda SPR com extinção do sinal após adição total de 125 µL (Figura 3b). Além disso, também são registrados deslocamentos do máximo de absorção da banda plasmon para valores menores que 395 nm, resultando em uma variação máxima de 18,6 nm (Figura 3a). Considerando a diluição, a concentração final de Hg2+, após adição de 125 µL da solução 1,0 x 10-3 mol L-1, foi igual a 1,5 x 10-4 mol L-1. As alterações observadas na banda SPR indicam que as nanopartículas de prata foram oxidadas, levando a uma redução progressiva dos seus respectivos tamanhos até o completo desaparecimento do meio. O comportamento redox do sistema está de acordo com o previsto teoricamente. O potencial padrão de redução do mercúrio (Eo = 0,85 V) é maior do que o da prata (Eo = - 0,80 V), indicando que para esse sistema a prata sofrerá oxidação na presença de íons Hg2+, o qual será reduzido.34 Esse par redox irá produzir uma variação de potencial positivo (0,05 V), indicando espontaneidade do processo e reação global 2Ag0 + Hg2+ → 2Ag+ + Hg0. A diminuição de intensidade da banda SPR em função do aumento da concentração de Hg2+, aprensenta-se como um decaimento exponencial, sugerindo uma saturação do meio após a adição de 125 µL da solução de mercúrio, levando a um desaparecimento total do sinal após a adição de 200 µL (Figura 3b).
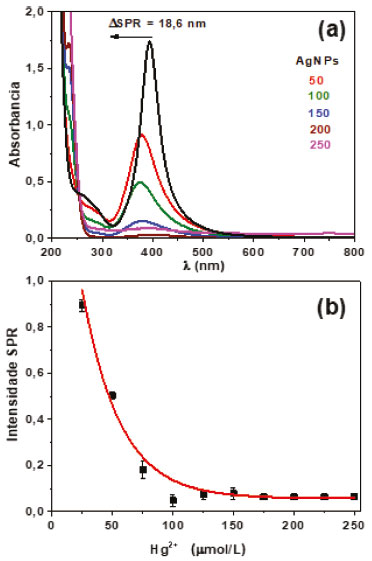 Figura 3. (a) Espectros UV-vis de AgNPs antes e após adições de alíquotas da solução de Hg2+ 1,0 x 10-3 mol L-1. Foram realizadas adições de 25 µL da solução de Hg2+, mas os espectros UV-vis são mostrados apenas a cada 50 µL para evitar sobrecarga de informação na figura. (b) Intensidades SPR do coloide de AgNPs e sua dependência da concentração de Hg2+ após diferentes adições da solução 1,0 x 10-3 mol L-1
Outra forte evidência do processo redox foi a mudança de cor que ocorreu com o coloide de AgNPs em função da quantidade de Hg2+ adicionada (Figura 4). A mudança de cor do amarelo para o incolor indica redução do tamanho das nanopartículas que ocorreu devido a sua oxidação provocada pela presença de Hg2+, liberando íons Ag+ no meio. Dessa maneira, conclui-se que tanto as modificações da banda SPR (diminuição de intensidade e deslocamento para menores valores de comprimento de onda) quanto a mudança de cor do coloide AgNPs são indicadores da interação das nanopartículas de prata com os íons Hg2+. Esse resultado mostra que, apesar da alta estabilidade do coloide de AgNPs, a integridade das nanopartículas é afetada na presença do íon Hg2+. Nessa etapa, o docente também poderá gerar uma discussão com os alunos sobre o efeito colorimétrico no coloide, como resultado da oxidação e consequente diminuição do tamanho das AgNPs. Além disso, é importante considerar a contribuição do efeito de diluição do meio, à medida que as alíquotas da solução de Hg2+ são adicionadas.
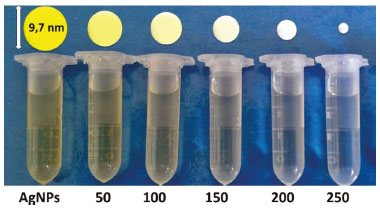 Figura 4. Mudança de cor do coloide de AgNPs após adição de diferentes alíquotas (µL) da solução de Hg2+ 1,0 x 10-3 mol L-1. Como ilustração didática, na parte superior da figura são mostradas esferas (fora de escala), representativas das nanopartículas de prata cujo tamanho diminui à medida que reagem com o Hg2+
Na Figura 5 são apresentados os resultados da análise por UV-Vis das soluções obtidas no segundo teste, no qual foram adicionadas alíquotas incrementais das soluções de Hg2+ nas concentrações 1,0 x 10-4, 1,0 x 10-5 e 1,0 x 10-6 mol L-1. Observa-se comportamento similar ao registrado no primeiro teste, porém, com queda de intensidade e deslocamentos da banda SPR menos acentuados atribuído ao maior efeito de diluição das soluções. É possível notar que à medida que as soluções são mais diluídas, mesmo adicionando uma alíquota de maior volume, a banda SPR ainda se apresenta muita intensa, indicando que a quantidade de Hg2+ adicionada não é suficiente para oxidar todas as AgNPs. Para a solução de Hg2+ 1,0 x 10-6 mol L-1, o deslocamento máximo foi de 1,1 nm após adição de 1100 µL, sendo um valor limite de indicação de alguma mudança, uma vez que, a resolução espectral é de 1,0 nm. Esse resultado mostra que, nas condições experimentais do teste, o limite de detecção confiável é até a solução de Hg2+ 1,0 x 10-5 mol L-1. Entretanto, esse resultado também pode ser interpretado de outra forma. Por exemplo, uma solução de concentração 1,0 x 10-4 mol L-1 não é muito diluída, ela contém uma concentração razoável de íons Hg2+. Ao adicionar 500 µL dessa solução (Figura 5a) a um mesmo volume de AgNPs no tubo, foi observado um deslocamento SPR muito significativo, de 15,6 nm. Esse resultado indica que o coloide de prata é muito concentrado, necessitando da adição de maiores volumes e/ou adição de uma solução mais concentrada de mercúrio para oxidar completamente as AgNPs. Com esse teste, o docente poderá trabalhar com os alunos vários tópicos, como por exemplo, efeito de concentração na estabilidade das AgNPs, limite de detecção, resolução da técnica de análise, entre outros.
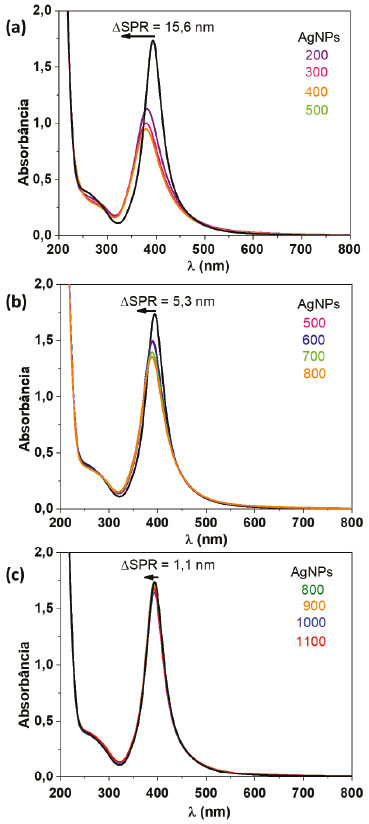 Figura 5. Espectros de absorção na região do UV-Vis do coloide de AgNPs e espectros do coloide após a adição de diferentes volumes (µL) de Hg2+ em diferentes concentrações (a) 10-4, (b) 10-5 e (c) 10-6 mol L-1
Uma vez conhecido o comportamento do sistema, seguiu-se com o terceiro teste objetivando avaliar a influência de outros íons metálicos que podem coexistir no meio com Hg2+, inclusive em um efluente industrial ou meio ambiente.35 Como pode ser observado na Figura 6, a banda SPR em 395 nm praticamente desapareceu após adição de solução contendo a mistura de todos os íons metálicos. Esse resultado indica que há interação entre as AgNPs e o Hg2+, mesmo na presença de outros íons metálicos. Entretanto, é importante avaliar se os outros íons também não atuam como agentes oxidante das AgNPs, como será discutido mais adiante. É importante ressaltar que, como há um aumento na absorção na região próxima de 400 nm, que continua até a região do Ultravioleta, pode ser que ainda haja alguma informação da banda SPR, que está sobreposta. Entretanto, o perfil espectral mostra pouca evidência disso. Para esse teste também houve mudança de cor do meio similar ao observado na Figura 4, do amarelo característico do coloide de AgNPs para o incolor, evidenciando a oxidação das nanopartículas de prata.
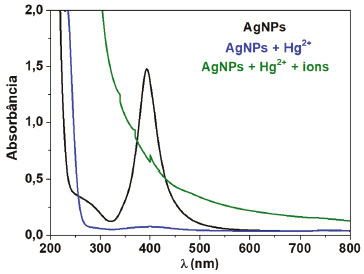 Figura 6. Espectros UV-vis de AgNPs, após adição de 250 µL de Hg2+ 1,0 x 10-3 mol L-1 e após a adição de mesmo volume da mistura dos íons Cu2+, Ni2+, Fe2+, Sn2+ e Zn2+, contendo Hg2+
Para entender melhor o resultado da Figura 6, foram avaliadas a interferência conjunta e as interferências individuais dos íons testados sobre a interação entre as AgNPs e Hg2+, os resultados são apresentados na forma de gráfico de barras em valores de porcentagem na Figura 7. As porcentagens foram calculadas atribuindo 100% para a intensidade da banda SPR do colóide de AgNPs, usado como referência. Pode-se observar que os íons Cu2+ e Ni2+ praticamente não interferem na reação entre AgNPs e Hg2+, uma vez que a queda de intensidade da banda SPR é bem pronunciada e equivalente a intensidade da banda obtida na presença de ions Hg2+, resultando apenas em 4% em relação à intensidade da banda obtida para o coloide AgNPs. Esse resultado está de acordo com os potenciais padrão de redução dos íons cobre e níquel, que são menores do que os potenciais da prata, portanto, esses íons se mantêm oxidados no meio (Tabela 1).36
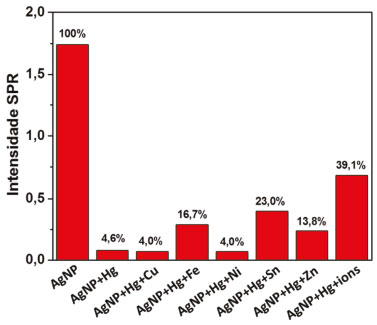 Figura 7. Resultado do teste de estabilidade mostrando a intensidade da banda SPR para cada combinação de Hg2+ e demais íons metálicos em comparação com a intensidade SPR do coloide de AgNPs. Na figura a nomenclatura está simplificada para AgNP e os íons representados pelos símbolos dos respectivos metais
As maiores interferências individuais foram registradas para os íons Fe2+ e Sn2+, para os quais a intensidade da banda SPR em relação à referência foi de 16,7 e 23,0%, respectivamente. Na série eletroquímica, esses íons apresentam potenciais de redução inferiores aos da prata e do íon Hg2+.34,36 Entretanto, em meio aquoso o íon Fe2+ pode ser oxidado a Fe3+ (Eored = 0,77 V), enquanto o Sn2+ pode ser oxidado a Sn4+ (Eored = 0,15 V),35 liberando elétrons para o meio, junto com a oxidação das nanopartículas de prata, levando à redução do Hg2+. Ou seja, os íons Fe2+ e Sn2+ também atuam como fonte de elétrons para o meio, fazendo com que as AgNPs sofram menor oxidação na presença de Hg2+, sendo registrado assim um menor decréscimo no sinal da banda SPR. No caso do íon Zn2+ foi registrada uma certa interferência (intensidade SPR igual a 13,6%), apesar do seu potencial de redução ser muito negativo (Tabela 1).36 Esse resultado sugere que pode haver mais algum tipo de efeito relacionado a dinâmica do sistema em estudo, que necessitaria de uma investigação mais detalhada. Para a mistura de todos os íons foi registrada uma intensidade de banda de 39,1% (Figura 7), mostrando uma interferência conjunto do meio iônico reduzindo a taxa de oxidação das AgNPs. Com a inclusão de mais cátions juntos com o par redox AgNPs/Hg2+, o meio passa a ficar muito complexo, uma vez que pode ocorrer a formação de outros pares redox. Quanto maior a interferência do cátion, mais ele participa da redução do Hg2+, consequentemente, reduzindo a taxa de oxidação das AgNPs, preservando a sua estabilidade. Esse resultado mostra que, apesar da alta estabilidade do coloide, a presença de Hg2+ em meio aquoso pode afetar significativamente a integridade das nanopartículas de prata. Entretanto, a presença de mais íons metálicos no meio reduziu a taxa de oxidação das AgNPs, sendo favorável a sua estabilidade. Vale ressaltar que ao longo do experimento não foi observada evidência de agregação e/ou sedimentação das AgNPs, apesar do forte meio iônico. Com esse último teste, o docente poderá promover uma discussão com os alunos sobre eletroquímica e a nanoquímica do sistema, explorando o aspecto interdisciplinar do experimento. O docente poderá solicitar aos alunos o preenchimento da Tabela 1, justificando os resultados obtidos pela teoria eletroquímica, incluindo informações sobre a espontaneidade da reação. Apesar do presente estudo ter sido conduzido com mercúrio, ele foi usado em concentrações relativamente baixas e em pequenas quantidades. Entretanto, devido à toxicidade do mercúrio, recomendamos que o docente considere realizar o experimento com outras espécies químicas oxidantes, que sejam menos tóxicas ou atóxicas. Essa escolha pode ser realizada considerando os potenciais eletroquímicos da prata e dos agentes oxidantes, além de considerar os objetivos propostos para a aula experimental.
CONCLUSÕES Em resumo, o experimento de síntese de nanopartículas de prata usando borohidredo de sódio como agente redutor e quitosana como agente apassivador, seguido dos testes de estabilidade das nanopartículas na presença de íons metálicos, foi facilmente conduzido. O coloide de AgNPs preparado apresentou-se estável por pelo menos 18 meses, o que contribuiu para a confiabilidade nos dados de UV-Vis obtidos nos testes de estabilidade. Verificou-se que as AgNPs foram completamente oxidadas pelo íon Hg2+, mesmo na presença dos íons Cu2+ e Ni2+, que praticamente não apresentaram interferência. Entretanto, quando o teste foi realizado na presença dos íons metálicos Fe2+, Sn2+ e Zn2+, além da mistura de todos os cinco íons, verificou-se um certo grau de redução na taxa de oxidação das AgNPs. A interferência na oxidação das nanopartículas pode ser interpretada como um efeito positivo do meio iônico, uma vez que nem toda AgNPs foi consumida, preservando ainda a integridade do coloide. Considerando-se a importância do tema nanociência e nanotecnologia na pesquisa e ensino, o presente trabalho pode ser usado como aula demonstrativa ou como experimento de rotina para estudantes de graduação e pós-graduação. Além de conhecimentos fundamentais de síntese química, preparo de soluções e eletroquímica, os alunos poderão ser iniciados em tópicos de nanociência como, por exemplo, tamanho de nanopartículas, química coloidal, propriedade e cor plasmônica de nanoestruturas metálicas.
AGRADECIMENTOS Os autores agradecem a FAPESP pelo suporte financeiro (Processos 2015/16573-5 e 2016/14227-5) e pela bolsa de Iniciação Científica da aluna AKK (Processo 2016/04147-4). Os autores também agradecem ao Laboratório LNNano do CNPEM, Campinas - SP, pelo acesso ao microscópio eletrônico para as análises de TEM.
REFERÊNCIAS 1. https://nano-magazine.com/news/2019/7/16/investing-in-the-nanotechnology-market, acessada em novembro 2020. 2. Regional Innovation Monitor Plus 2016. Thematic Paper 3 - Industry 4.0, Advanced Materials (Nanotechnology), disponível em www.technopolis-group.com, acessada em novembro 2020. 3. Rai, S.; Rai, A.; Nusantara Bioscience 2015, 7, 61. 4. https://www.researchandmarkets.com/reports/4520812/global-nanotechnology-market-by-component, acessada em novembro 2020. 5. Gonzalez, A. L.; Noguez, C.; Beranek, J.; Barnard, A. S.; J. Phys. Chem. C 2014, 118, 9128. 6. Zhou, J.; Chizhik, A. I.; Chu, S.; Jin, D.; Nature 2020, 579, 41. 7. Chan, W. C. W.; Parak, W. J.; ACS Nano 2014, 8, 1075. 8. Davis, V. A.; J. STEM. Educ. 2013, 14, 5. 9. https://www.nano.gov/nationalnanotechnologyday, acessada em novembro 2020. 10. Cook, R.; Nano, 1st ed., Berkley Books: New York, 2013. 11. https://www.nanowerk.com, acessada em novembro 2020. 12. http://www.lqes.iqm.unicamp.br, acessada em novembro 2020. 13. Agência Brasileira de Desenvolvimento Industrial, Cartilha sobre Nanotecnologia, 1a ed., ABDI: Brasilia, 2011. 14. Pinto, A. C.; Vieira, A. G.; Nanotecnologia: Um transporte para um novo universo, 1a ed., Fundacentro: São Paulo, 2008. 15. Jackman, J. A.; Cho, D-J.; Lee, J.; Chen, J. M.; Beserbachen, F.; Bonnell, D. A.; Hersam, M. C.; Weiss, P. S.; Cho, N-J.; ACS Nano 2016, 10, 5595. 16. Tomkelski, M. L.; Scremin, G.; Fagan, S. B.; Ciênc. Educ. (Bauru) 2019, 25, 665. 17. Lu, K.; J. STEM Educ. 2009, 10, 7. 18. Clebsch, A. B.; Watanabe, M.; Revista Renote: Novas Tecnlogias na Educação 2017, 15, 1. 19. Melo Jr., M. A.; Santos, L. S. S.; Gonçalves, M. C.; Nogueira, A. F.; Quim. Nova 2012, 35, 1872. 20. Klobes, B.; Koch, C.; J. Chem. Educ. 2020, 97, 143. 21. Toma, H. E.; Silva, D. G.; Condomitti, U.; Nanotecnologia Experimental, Blucher: São Paulo, 2016. 22. Santos, E. B.; Sigoli, F. A.; Mazali, I. O.; New J. Chem. 2014, 38, 5369. 23. Lenzi, E.; Favero, L. O. B.; Luchese, E. B.; Introdução à Química da Água: Ciência, Vida e Sobrevivência, LTC: Rio de Janeiro, 2014. 24. Dlugosz, O.; Banach, M.; J. Cluster Sci. 2019, 30, 541. 25. Andrieux-Ledier, A.; Tremblay, B.; Courty, A.; Langmuir 2013, 29, 13140. 26. Salsamendi, M.; Cormack, P. A. G.; Graham, D.; New J. Chem. 2013, 37, 3591. 27. Pinto,V. V.; Ferreira, M. J.; Silva, R.; Santos, H. A.; Silva, F.; Pereira, C. M.; Colloids. Surf., A 2010, 364, 19. 28. MacCuspie, R. T.; J. Nanopart. Res. 2011, 13, 2893. 29. Giacomelli, C. E.; Valenti, L. E.; J. Nanopart. Res. 2017, 19, 156. 30. Zong, R.; Wang, X.; Shi, S.; Zhu, Y.; Phys. Chem. Chem. Phys. 2014, 16, 4236. 31. Andrieux-Ledier, A.; Tremblay, B.; Courty, A.; Langmuir 2013, 29, 13140. 32. Safavi, A.; Armadi, R.; Mohammadpour, Z.; Sens. Actuators, B 2017, 242, 609. 33. Mogensen, K. B.; Kneipp, K.; J. Phys. Chem. C 2014, 118, 28075. 34. Atkins, P.; Jones, L.; Princípios de química: questionando a vida moderna e o meio ambiente, 5a ed., Bookman: Porto Alegre, 2012. 35. Manirethan, V.; Gupta, N.; Balakrishnan, R. M.; Raval, K.; Environ. Sci. Pollut. Res. 2020, 27, 24723. 36. Huheey, J. E.; Keiter, E. A.; Keiter, R. L.; Inorganic Chemistry: Principles of Structures and Reactivity, 4th ed., Harper Collins: New York, 1993. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access