Nota Técnica
|
|
| Sistema de baixo custo para execução e monitoramento on-line de reações fotocatalíticas: aplicação em redução de nitro-fenol Low-cost system for online monitoring of photocalytical reactions: application in nitro-phenol |
|
Byanca S. SalvatiI; Sirlon F. BlaskieviczI; Patricia G. CorradiniI,II; Lucia H. MascaroI,*
I. Departamento de Química, Universidade Federal de São Carlos, 13565-905 São Carlos - SP, Brasil Recebido em 26/03/2021 *e-mail: lmascaro@ufscar.br There is a global concern with pollutants and organic contaminants and efficient and inexpensive methods are sought for the treatment of these toxic products. Generally, large volume reactors and the use of expensive equipment are required to monitor a photoreaction. The present work proposes the construction of a colorimetric equipment, which allows the online monitoring of photoreactions, using low-cost materials that allow the analysis from small aliquots. To show the applicability of the system, we studied the reduction reaction of 4-nitrophenol (4NP) with NaBH4. The impedimetric sensor enabled to construct the kinetic curve of the decrease in the chromophore band. It was possible to observe that the 4NP reduction reaction depends on: (i) chromophore concentration; (ii) stability of the reducing agent and; (iii) repulsion between the anions. The system developed here opens doors, as it can be used using a photocatalyst in the form of film, and it has also proved to be an inexpensive alternative for both research and teaching laboratories, as it allows the execution of chemical physics practices such as kinetic monitoring of reactions and mathematical adjustment of the curves. INTRODUÇÃO A presença de poluentes prioritários e contaminantes orgânicos emergentes, incluindo produtos farmacêuticos, pesticidas, hormônios, surfactantes e vários compostos em águas superficiais e no solo, é uma preocupação global.1 Metodologias eficazes e baratas para o monitoramento e tratamento para remoção de produtos orgânicos tóxicos contaminantes, ou em uma conversão em produtos de valor agregado, são cada vez mais estudadas e valorizadas.2 Dentre os resíduos industriais e agrícolas que se buscam converter em compostos de menor toxicidade, destaca-se os compostos nitro aromáticos. O 4-nitro fenol (4NP), é um exemplo desta classe que, mesmo em concentrações baixas (0,1 mg kg-1), pode atuar como disruptor endócrino, promover irritação dérmica e ocular, e apresentar potencial carcinogênico.3,4 Muitos estudos se dedicam a avaliar processos oxidativos baseados em métodos fotoquímicos,5,6 visando a conversão a espécies não-agressivas ou até à completa mineralização desses compostos.2 Mas uma alternativa ao manejo do composto 4NP tem ganho destaque: a fotorredução, que possa gerar compostos de interesse industrial, como 4-aminofenol (4AP), utilizado como precursor do paracetamol. Devido à alta estabilidade química, a redução de 4NP normalmente é promovida por metais nobres, tornando o processo menos viável do ponto de vista econômico. Semicondutores também podem ser combinados a catalisadores metálicos, e o uso de agentes de sacrifício como hidrazina (NH2NH2), ou os íons boro hidreto (BH4-) e sulfito (SO3-2) auxiliam a reação. A redução catalítica de 4NP pelo ânion BH4- tornou-se um dos modelos para avaliar a atividade de um fotocatalisador. Embora a reação seja termodinamicamente possível, é cineticamente restrita pela repulsão dos ânions boro hidreto e nitro fenolato,7 e o que supera essa barreira é a afinidade de adsorção dos ânions na superfície do catalisador, fornecendo os elétrons necessários para complementar a reação.8 Urkude et al.9 conseguiram reduzir efetivamente o nitro à amino sem utilizar nanopartículas metálicas, somente empregando um compósito de TiO2 e polianilina com NaBH4 como agente de sacrifício, utilizando radiação visível. Semicondutores que absorvem a radiação visível como é o caso do BiVO4 são preferíveis, visando o uso da energia solar como fonte de radiação. Outro problema muito comum que afeta a viabilidade de acompanhamento dessas reações, especialmente em aspectos cinéticos, é a infraestrutura instrumental.10,11 A montagem de sistemas de valor mais acessível pode trazer contribuições relevantes para o estudo de materiais, sem falar na possibilidade de aplicação na formação de recursos humanos, podendo ser utilizado em aulas práticas, como uma ferramenta auxiliadora no processo de ensino e aprendizagem. Além da elaboração deles, com materiais de baixo custo, muitas vezes considerado lixo eletrônico,12 o entendimento dos princípios mencionados permite a miniaturização do equipamento e, por consequência, do sistema reacional empregado. Neste trabalho, o uso de um sensor impedimétrico LDR (Light Dependent Resistor), que é de fácil acesso e baixo custo, foi utilizado para acompanhamento da fotorreação de 4-nitrofenol. Uma cubeta de quartzo foi utilizada como um fotorreator, sem necessidade de retirar alíquotas. A reação foi acompanhada por um multímetro, e o sistema foi validado, com um auxílio de outras técnicas.
PARTE EXPERIMENTAL Montagem do sistema Ideia do sistema de detecção O sensor LDR é um componente cuja resistência varia linearmente com a intensidade da luz: quanto maior a quantidade de luz incidente, menor a resistência observada. Ao utilizar um diodo emissor de luz (LED) com radiação na faixa de absorção do analito, ou seja, um cromóforo que absorva parte desta radiação, haverá uma mudança na resposta do detector. Assim, será possível obter uma relação linear entre a concentração deste cromóforo e a resistência lida no multímetro através de uma constante de proporcionalidade (eq. 1). Dessa forma, é possível a construção de curvas de concentração ou até mesmo curvas cinéticas de uma reação onde se tem a variação do cromóforo de interesse em função do tempo.  em que I0 é a intensidade do sinal (resistência) na ausência do analito, que se refere a máxima transmitância possível, I é a intensidade na presença do analito, α é a constante de proporcionalidade e c a concentração. Montagem experimental A Figura 1 ilustra a montagem do sistema. Uma espuma rígida foi utilizada para fazer um suporte para cubeta, cortando-a nas dimensões mostradas na Figura 1S (disponível no Material Suplementar - MS), com auxílio de um estilete. Esse suporte foi fixado com fita adesiva sob um agitador magnético. Na parte superior do suporte o sensor LDR foi inserido e atado com conector bipolar para que fosse possível encaixar o multímetro posteriormente. Utilizando-se um suporte universal e garra, fixou-se o sistema de iluminação (LED M405L2 Thorlabs - UK), com comprimento de onda 405 nm, verificado pelo espectro de emissão, apresentado na Figura 2S (disponível no MS). Com um radiômetro aferiu-se a potência da luz para 100 mW/cm2 e, nesta distância (~10 cm) fixou-se o agitador com o suporte. Um multímetro foi conectado ao sensor LDR para que fosse possível fazer a leitura da resistência. A Figura 3S (disponível no MS) apresenta uma fotografia do aparamento experimental montado.
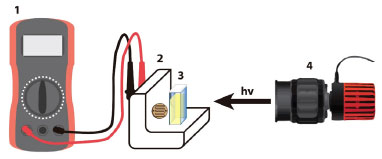 Figura 1. Esquema representativo do funcionamento do protótipo de colorímetro: (1) multímetro para coleta de dados; (2) suporte com o LDR e a (3) cubeta com analito e (4) fonte de radiação
Acompanhamento da reação de fotorredução do nitro-fenol Para a escolha da fonte de iluminação mais adequada para o monitoramento da concentração do 4NP, um espectro de UV-vis do 4NP protonado e na forma de ânion fenolato foi coletado. A Figura 2 mostra um espectro na faixa de 200 a 600 nm, para soluções de 4NP em pH 5,5 (majoritariamente na forma fenol) e 8,5 (majoritariamente na forma fenolato). Visto que a forma desprotonada do 4NP tem uma banda predominante na região de 400 nm, optou-se por utilizar o LED 405 nm (M405L2 Thorlabs - UK) como fonte de radiação.
 Figura 2. Espectro de UV-vis do 4NP nas formas de fenol e fenolato
Com o sistema pronto, fez-se uma curva de calibração do p-nitrofenol (24-50 μmol L-1). Utilizou-se cinco pontos de concentrações, a partir de uma solução estoque de nitrofenol (5,0 × 10-4 mol L-1), diluindo em tampão fosfato 0,01 mol L-1, ajustado para pH 7,5, com soluções estoque de HCl e KOH. Em todos os pontos, o valor da resistência da solução foi acompanhado. Espectros de absorção também foram obtidos em um espectrômetro UV-vis comercial (Varian, Cary 5G UV-vis-NIR) para comparação com o sensor do protótipo. Fotólise dos reagentes Após a calibração do sensor, a fotólise do nitrofenol foi realizada. Em uma cubeta, adicionou-se 0,5 mL da solução estoque de 4NP e 2,5 mL de tampão bicarbonato, ajustado em pH 8,0. A cubeta foi colocada no sistema com o agitador ligado para garantir a homogeneidade da solução, e então, o LED foi ligado e as medidas de resistência foram anotadas a cada 30 minutos até 360 minutos. Foram feitos espectros pré e pós reação no equipamento comercial. A fotólise do reagente NaBH4 também foi avaliada. Em uma cubeta, adicionou-se 3,0 mL de tampão bicarbonato ajustado em pH 9,0 e 1,0.10-4 mol de NaBH4. A cubeta foi colocada no agitador com LED 405 nm, acompanhando a resistência durante 60 minutos. Espectros de absorção UV-vis da solução foram realizados antes e após reação. Estudo de pH A fotorredução do 4NP foi monitorada em pH 6, 7, 8 e 9. Usou-se tampão fosfato para realização da medida em pH 6 e 7 e tampão bicarbonato para os demais valores de pH; os ajustes foram feitos com soluções estoque de HCl e KOH. Em todos os experimentos colocou-se em uma cubeta 0,5 mL da solução estoque de 4NP e 2,5 mL de tampão com pH ajustado. A cubeta foi colocada no sistema sob agitação e uma pequena alíquota de solução de NaBH4 (1,0 × 10-5 mol L-1) foi adicionada ao sistema. Os valores da resistência da solução foram acompanhados pelo tempo de reação e medidas de espectroscopia de absorção na região UV-vis foram realizados antes e após a reação. No pH 8,0, a reação também foi feita no escuro, acompanhada em UV-vis utilizando-se o programa "Scanning Kinetics". Também foi realizada uma reação da mesma forma descrita anteriormente, mas usando no lugar do LED um simulador solar acoplado a um filtro (O-56), que corta a radiação abaixo de 560 nm. Estudo com LED de menor potência Com o intuito de verificar se a mesma reação poderia ser mediada por um LED de menor potência, que tornaria possível diminuir ainda mais o custo do sistema, fez-se a reação de p-nitrofenol com NaBH4 em pH 8,0, substituindo-se o LED 405 nm por um LED comercial comum (LED alto brilho azul, 408 nm). O espectro de emissão deste LED está apresentado na Figura 2S do MS. O LED foi fixado em um quadrado de espuma rígida e ligado a uma fonte de alimentação 6 V (carregador de celular), inserindo um resistor de 100 Ω entre a fonte e o LED. O suporte com LED foi acoplado ao suporte com sensor LDR utilizando-se tarraxas. Antes dessa reação, testou-se uma curva de calibração nas mesmas condições adotadas para o LED 405 nm.
RESULTADOS E DISCUSSÃO Calibração do sistema LDR A curva de calibração do p-nitrofenol obtido pelo protótipo do colorímetro apresentou linearidade, como apresentado na Figura 3(a). O coeficiente de determinação linear foi de r2=0,98, indicando uma boa correlação entre o sinal obtido e a faixa de concentração analisada. A título de comparação, a mesma curva de concentração foi realizada em espectrômetro de UV-Vis, pela intensidade de absorbância em 400 nm (Figura 3(b)). O coeficiente obtido pelo espectrômetro foi semelhante ao obtido pelo protótipo do colorímetro, destacando a boa aplicação do sistema desenvolvido.
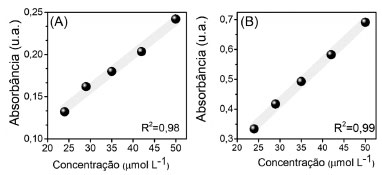 Figura 3. (A) Curva de calibração 4NP utilizando sensor colorimérico do protótipo; (B) curva de calibração do 4NP utilizando espectrômetro UV-vis
Fotólise das substâncias Um possível caminho da redução do 4NP é gerar o aminofenol (4AP). Para avaliar se os compostos 4NP e NaBH4 não apresentariam fotólise, acompanhou-se o sistema por 60 min em iluminação. Os valores obtidos no monitoramento da fotólise do 4NP estão apresentados na Figura 4S, no MS. No caso do NaBH4, como a solução não mostrou nenhuma banda na região de emissão do LED, não foi possível o acompanhamento pelo sensor. Para confirmação da fotoestabilidade dos reagentes, medidas de absorção de UV-Vis foram realizadas nas amostras, antes e após a iluminação, conforme representado na Figura 4. Na espectroscopia de UV, a banda de absorção em 300 nm pode indicar o 4AP, enquanto a banda em 400 nm indica absorção do nitrofenolato.8 Na fotólise do p-nitrofenol, obteve-se uma degradação quase imperceptível da banda em 400 nm, indicando que qualquer reação que ocorra estaria sendo bem lenta (Figura 4(a)). Descartou-se também influência da luz na degradação do NaBH4, uma vez que a sua fotólise não apresentou qualquer banda notável no UV (Figura 4(b)).
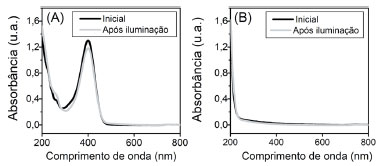 Figura 4. Gráfico de absorbância por comprimento de onda antes e após 1 h de iluminação em 400 nm para (A) e 50 μmol L-1 de 4-nitrofenol em solução tampão de bicarbonato ajustado pH=8, (B) 100 μmol L-1 de NaBH4 em solução tampão de bicarbonato ajustado em pH 9,0
Estudo cinético da fotorredução de 4-nitrofenol Após realizar a correlação de concentração de 4NP com a resistência da solução do sistema e descartar a hipótese de autofotólise dos compostos estudados, iniciaram-se os estudos cinéticos. Os ajustes iniciais mostraram um comportamento de primeira ordem da reação, assim, os ajustes matemáticos foram realizados levando em consideração a lei das velocidades integradas da seguinte forma: 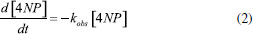 Reajustando a expressão (2) tem-se:  Integrando a expressão (3) do tempo inicial ao tempo "t" se obtém a expressão: 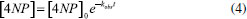 em que [4NP] é a concentração de 4NP no tempo "t", [4NP]0 é a concentração inicial de 4NP, kobs é a constante velocidade de pseudo-primeira ordem e t é o tempo. Por fim, substituindo a concentração da expressão (1) na expressão (4), obtém-se a seguinte expressão em função da absorbância:  Efeito de pH Em meio aquoso, o 4-nitrofenol e seu ânion apresentam duas formas de ressonância (Figura 2), benzenóide e quinonóide, onde uma carga negativa está localizada no grupo nitro.13 O aumento do pH do meio modifica a distribuição dessas espécies, promovendo a desprotonação do grupo hidroxila, e a ressonância da forma quinonóide (desprotonada) é a responsável pela absorção da radiação na região de 400 nm (cor amarela).13 Assim, para avaliar a influência da desprotonação da substância 4NP, acompanhou-se a reação com o sistema homemade nos pHs 6,0, 7,0, 8,0 e 9,0. Para avaliar a possível formação de produtos, medidas de absorção por UV-vis foram realizadas nas soluções nas condições iniciais e após a reação. O sinal-resposta para cada condição e os respectivos espectros de absorção de UV-Vis estão apresentados na Figura 5.
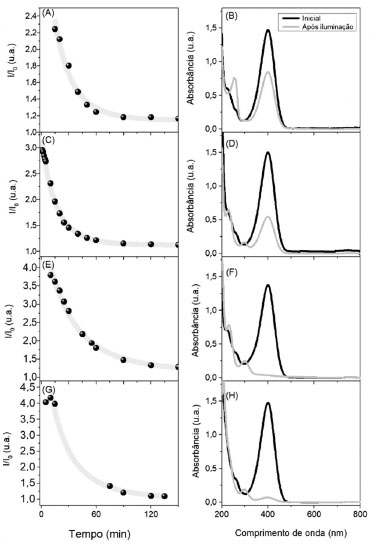 Figura 5. Gráfico da relação sinal resposta em função do tempo da reação e respectivos espectros UV-Vis inicial e pós reação do 4NP em A,B) pH 6,0; C,D) pH 7,0; E,F) pH 8,0 e G,H) pH 9,0
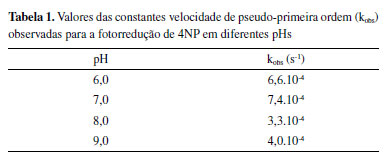
De maneira a extrair os parâmetros cinéticos da reação, as curvas obtidas em diferentes pH foram ajustadas pela equação (4), uma vez que dados da literatura indicam que a reação de fotorredução do 4NP segue comportamento de pseudo-primeira ordem.14 A expressão aqui deduzida pode ser inserida em softwares como o Origin 9® e realizar o ajuste matemático diretamente pela equação exponencial, uma vez que a linearização, apesar das facilidades atreladas, pode diminuir a precisão de um ajuste.15 Nos estudos cinéticos da influência do pH notou-se que no pH 6,0 (Figura 5 (a) e (b)), houve uma pequena diminuição da banda do 4NP, porém sem formar banda em 300 nm. Possivelmente isso ocorreu porque o NaBH4 se degrada muito rapidamente em pH mais baixos. O tempo de meia vida da hidrólise espontânea do NaBH4 pode ser calculado pela seguinte equação.16 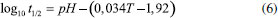 em que t1/2 é o tempo de meia vida, em minutos e T é a temperatura, em Kelvin. O tempo de meia vida do composto em pH 6 está na ordem de frações de segundos, aumentando exponencialmente em função do pH.16 No pH 7,0 (Figura 5 (c) e (d)), os resultados foram parecidos com estes também, com uma melhora na degradação em 400 nm e um discreto aparecimento de banda em 300 nm. Em pH 8,0 (Figura 5 (e) e (f)), a completa degradação do 4NP e a formação da possível banda de aminofenol foram obtidas. Nesse pH, mais de 50% do 4NP presente encontra-se na forma quinonóide, visto que o pKa da espécie é 7,15. Além de uma maior quantidade do cromóforo, o tempo de meia vida do NaBH4 já aumenta para aproximadamente 40 s, favorecendo a reação pela maior absorção em 400 nm e pelo maior tempo de meia vida de NaBH4 no meio. No pH 9,0 (Figura 5 (g) e (h)), é possível notar que, assim como no pH 8,0, há uma contribuição do pH mais alto na excitação do cromóforo, porém aqui, provavelmente ocorre também uma repulsão de ânions do cromóforo com os do boro-hidreto. Nota-se, com isso, que a reação é termodinamicamente possível, porém cineticamente dificultada pela ocorrência da repulsão das cargas.17,18 A Tabela 1 apresenta os valores das constantes velocidade de pseudo-primeira observadas para a reação de fotorredução de 4-nitrofenol em diferentes valores de pH. Como observado nos espectros completos apresentados na Figura 5, não necessariamente o consumo do 4NP ocorrerá por completo em todos os valores de pH. Em algumas situações a hidrólise espontânea do NaBH4 pode competir com a reação de redução do 4NP. Em suma, existem 3 fatores que explicam as constantes de velocidade obtidas: (i) o tempo de meia vida do NaBH4; (ii) a concentração do 4NP na forma desprotonada (cromóforo) e (iii) a repulsão entre os íons fenolato e borohidreto. Em valores de pH mais baixos, o tempo de meia vida do íon borohidreto é exponencialmente reduzido e a reação atinge um patamar devido a decomposição desta espécie, e não pelo final da reação com o 4NP, o que foi confirmado fazendo novas adições de NaBH4 no pH sob iluminação e observando o decaimento do sinal até a completa extinção da banda em 400 nm, mostrada na Figura 5S do MS. Com isso, a constante de velocidade obtida acaba sendo, no caso do pH 6, uma medida indireta do consumo do NaBH4. O mecanismo completo da reação ainda precisa ser investigado em trabalhos futuros, porém, propõe-se que ela se inicie devido a uma foto ativação do cromóforo,19 assim, com o aumento do pH também há um aumento da concentração do cromóforo do 4NP, que faria com que a reação ocorresse por completo e de maneira mais rápida, porém, como visto no pH 9, a repulsão entre os ânions acaba impedindo que a reação acontecesse por completo, com isso o pH 8 acabou se mostrando a melhor relação entre os 3 fatores citados.
Para verificar se a reação foi um efeito de excitação do cromóforo pelo LED emitindo em 405 nm, realizou-se a mesma reação no escuro (Figura 6(a)), e não foi observado nenhum consumo da banda em 400 nm, apenas uma pequena flutuação na absorbância. Ao analisar em função do tempo, esta flutuação mostrou-se ser um indicativo da influência do ânion borohidreto, deslocando levemente o pH do meio, porém, atenuado pelo tampão utilizado. Ao iluminar a cubeta com radiação acima de 560 nm (Figura 6(b)), também por 2 horas não foi possível observar a mesma variação de bandas que ao iluminar com o LED405, indicando que a reação ocorre majoritariamente por uma foto excitação do cromóforo do 4NP. Ainda, como a iluminação estava fora da região de absorção do 4NP, nesse caso não foi possível monitorar a concentração do cromóforo pelo sensor LDR.
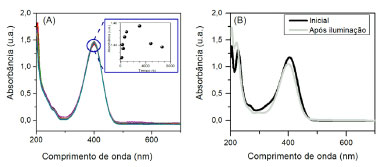 Figura 6. Espectros de UV-Vis da reação do 4NP em pH 8 A) ao longo do tempo e sem iluminação, a variação da banda em 400 nm em função do tempo está apresentada no inset do gráfico; B) Inicial e após iluminação acima de 560 nm
Estudo com LED de menor potência No intuito de baratear ainda mais o sistema, optou-se por realizar a reação do 4NP com NaBH4 utilizando um LED comum, que custa menos de R$1,00. De acordo com fabricante, a emissão é em 408 nm, que é próximo ao relatado por outros trabalhos na literatura.20 Para validar esse sistema, foi feita uma nova curva de calibração com o 4NP (apresentada na Figura 6S do MS), que assim como no LED 405 apresentou uma boa linearidade na relação sinal/resposta (R2=0,98), mostrando-se adequada para o monitoramento do 4NP. Ao realizar a reação, entretanto, o 4NP se comportou da mesma maneira que quando a reação foi realizada no escuro (Figura 6(a)). Ao medir a irradiância do LED, essa se encontrava em torno de 100 µW cm-2, 1000x menor do que a densidade de potência utilizada com o LED 405. Isso indica que a potência do LED comum não é suficiente para ativar reações fotoquímicas, apesar de ser eficiente para o monitoramento colorimétrico como demonstrado aqui e em outros trabalhos da literatura.21,22
CONCLUSÕES Neste trabalho foi possível o desenvolvimento de um sistema que, de maneira eficiente aproveita a fonte de iluminação de uma reação fotocatalítica para o monitoramento de um cromóforo (4NP). Um ponto a ressaltar é que esse sistema permite trabalhar com volumes reacionais reduzidos em relação a reatores convencionais, gerando uma economia dos reagentes envolvidos, bem como a detecção online ainda torna possível manter esse volume de trabalho constante. Ainda são necessários estudos, valendo-se de outras técnicas para uma elucidação concreta do mecanismo da reação do 4NP com NaBH4, porém, combinando os dados obtidos no sensor do protótipo com espectros obtidos em equipamento de UV-Vis comercial, foi possível inferir que, dependendo do pH, a reação possivelmente conduzia ao produto de fotorredução 4AP. O sensor impedimétrico empregado permitiu construir a curva cinética da diminuição da banda do cromóforo 4NP em 405 nm, e observou-se que esta reação depende de 3 principais fatores: (i) Concentração do cromóforo; (ii) Estabilidade do agente redutor e; (iii) Repulsão entre os ânions. Com o aumento do pH, o equilíbrio fenol/fenolato é deslocado para a forma aniônica do 4NP, responsável pela absorção na faixa de luz utilizada, e muito provavelmente a reação se dê pela excitação dessa molécula, visto que não ocorreu ao ser iluminada com radiação de maior comprimento de onda. Ainda, apesar da decomposição do íon boro hidreto em meio aquoso também diminuir com o aumento do pH, a repulsão aniônica entre os reagentes faz com que um valor intermediário (pH 8) seja um ponto otimizado para a reação completa. Por fim, notou-se que o LED utilizado também aquecia o sistema, porém, em um estudo do efeito da temperatura atingida por esse sistema, a reação no escuro teve mudanças pouco significativas. O sistema aqui desenvolvido abre portas, pois pode ser empregado utilizando um fotocatalisador na forma de filme, e também se mostrou uma alternativa barata tanto para laboratórios de pesquisa, quanto de ensino, pois permite a execução de práticas de físico-química como o acompanhamento cinético de reações e o ajuste matemático das curvas.
MATERIAL SUPLEMENTAR Algumas imagens dos sistemas utilizados neste trabalho estão disponíveis em http://quimicanova.sbq.org.br, na forma de arquivo PDF, com acesso livre.
AGRADECIMENTOS Os autores agradecem à Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) - Código Financeiro 001 e ao Conselho Nacional de Pesquisa e Desenvolvimento, pelas bolsas concedidas. Os autores também agradecem à Fundação de Pesquisa de São Paulo (FAPESP) pela assistência financeira ao projeto e pelas bolsas concedidas (2018/16401-8, 2014/50249-8, 2013/07296-2).
REFERÊNCIAS 1. Uyguner-Demirel, C. S.; Birben, N. C.; Bekbolet, M.; Catal. Today 2017, 284, 202. 2. Kefeni, K. K.; Mamba, B. B.; Sustainable Mater. Technol. 2020, 23, 140. 3. Bae, S.; Gim, S.; Kim, H.; Hanna, K.; Appl. Catal., B 2016, 182, 541. 4. Li, C.; Taneda, S.; Suzuki, A. K.; Furuta, C.; Watanabe, G.; Taya, K.; Toxicol. Appl. Pharmacol. 2006, 217, 1. 5. Zhou, M.; Wu, Z.; Zhu, J.; Ye, Q.; Fu, J.; Chin. J. Catal. 2002, 23, 376. 6. Malinowska, B.; Walendziewski, J.; Robert, D.; Weber, J.; Stolarski, M.; Appl. Catal., B 2003, 46, 441. 7. Huang, J.; Vongehr, S.; Tang, S.; Lu, H.; Meng, X.; J. Phys. Chem. C 2010, 114, 15005. 8. Hernández-Gordillo, A.; Romero, A. G.; Tzompantzi, F.; Oros-Ruiz, S.; Gómez, R.; J. Photochem. Photobiol., A 2013, 257, 44. 9. Urkude, K.; Thakare, S. R.; Gawande, S.; J. Environ. Chem. Eng. 2014, 2, 759. 10. Burgess, A. E.; Davidson, J. C.; J. Chem. Educ. 2014, 91, 300. 11. Benito-Lopez, F.; Verboom, W.; Kakuta, M.; Gardeniers, J. H. G.; Egberink, R. J.; Oosterbroek, E. R.; van den Berg, A.; Reinhoudt, D. N.; Chem. Commun. 2005, 2857. 12. Mercer, C.; Leech, D. N.; J. Chem. Educ. 2017, 94, 816. 13. Muniz-Miranda, M.; Appl. Catal., B 2014, 146, 147. 14. Singh, J.; Mehta, A.; Rawat, M.; Basu, S.; J. Environ. Chem. Eng. 2018, 6, 1468. 15. Zeviani, W. M.; Dissertação de mestrado, Universidade Federal de Lavras, Lavras, Brasil, 2009. 16. Richardson, B. S.; Birdwell, J. F.; Pin, F. G.; Jansen, J. F.; Lind, R. F.; J. Power Sources 2005, 145, 21. 17. Fahrenbach, A. C.; Bruns, C. J.; Li, H.; Trabolsi, A.; Coskun, A.; Stoddart, J. F.; Acc. Chem. Res. 2014, 47, 482. 18. Tomsho, J. W.; Benkovic, S. J.; J. Org. Chem. 2012, 77, 2098. 19. Den Heijer, J.; Shadid, O.; Cornelisse, J.; Havinga, E.; Tetrahedron 1977, 33, 779. 20. Rabello, B. R.; Caetano, W.; Quim. Nova 2018, 41, 920. 21. Reis, R. A.; Dissertação de mestrado, Universidade Estadual Paulista, Brasil, 2014. 22. Silva, V. B.; Orth, E. S.; Quim. Nova 2017, 40, 238. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access





