Artigo
|
|
| Clorofila extraída de resíduo industrial da erva-mate (Ilex paraguaiensis) uma possibilidade de economia circular Chlorophyll extracted from industrial waste from mate-herb (Ilex paraguaiensis) a possibility of circular economy |
|
André R. PettersonI,#; Vanderlei A. de LimaII; Fauze J. AnaissiI,*
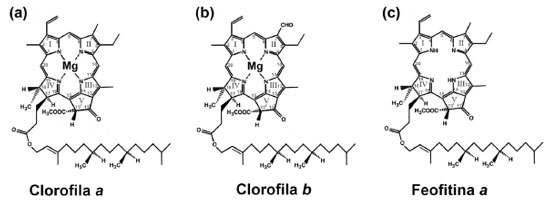
I. Departamento de Química, Universidade Estadual do Centro-Oeste, 85040-167 Guarapuava - PR, Brasil Recebido em: 21/12/2021 *e-mail: fjanaissi@gmail.com Chlorophyll is the most abundant green pigment on the planet, it is unstable and decomposes naturally. Mate-herb is a traditional native plant in the southern region of South America, and its tea is part of the local culture and extractive agriculture. The mate-herb industry generates as a by-product a resinous material rich in chlorophyll whose use is proposed to be a natural pigment. The chlorophyll extraction method uses ethanol as a solvent; its structural modification leads to the obtainment of derivatives like pheophytin, Co-pheophytin, Ni-pheophytin, and Zn-pheophytin. The samples were analyzed by electronic (VISIBLE) and vibrational (FTIR) spectroscopy, and energy-dispersive X-ray fluorescence spectrometry (EDXRF). Color analysis (CIE L*a*b*) was performed by decomposition in grayscale and the classification of the samples by the supervised machine learning (ML) algorithm Random Forest (RF), showing adequate accuracy for this type of matrix. The pigments were dispersed in synthetic enamel paint to study color stability when exposed to lighting. It was verified that Co-pheophytin and Ni-pheophytin are the most stable. The chlorophyll extracted from the resin presents an economically viable use for residues from mate-herb industries, whose family farmers benefit, with the bias of environmental and social sustainability, within the circular economy. INTRODUÇÃO Clorofilas são consideradas os pigmentos verdes mais abundantes em plantas, algas e bactérias. Nas suas formas originais ou modificadas têm sido utilizadas em várias formulações na indústria farmacêutica, em suplementos alimentares, na culinária, na composição de cosméticos e de produtos fitossanitários.1-8 Clorofilas são macrocíclicos tetrapirrólicos com uma estrutura que inclui um quinto anel isocíclico contendo um sistema de ligações duplas conjugadas coplanares cuja densidade eletrônica é deslocada para os orbitais π. Têm um átomo de magnésio coordenado no centro macrocíclico, e uma cadeia de fitol (phy, C20H40) esterificando o ácido propiônico no C17 (Figura 1).9-12
A clorofila a é o representante de maior importância e abundância nas espécies vegetais, com um grupo metila (-CH3) no C7 (Figura 1a). A clorofila b (segunda em abundância nos vegetais) diferencia-se pela presença de um grupo aldeído (-CHO) no C7 (Figura 1b). A feofitina é o derivado protonado (sem metal) da clorofila (Figura 1c).11-13 As clorofilas se decompõem facilmente quando expostas ao calor, à luz, e em condições ácidas e básicas. A remoção dos íons magnésio (Mg2+) do centro do anel macrocíclico aumenta a estabilidade da molécula,14,15 mas sua cor muda de verde para marrom. A substituição do magnésio por outros metais pode restabelecer a cor verde da clorofila com aumento de sua estabilidade química.15-18 A erva-mate (Ilex paraguaiensis) é uma planta nativa da região sul da América do Sul e o produto da infusão de suas folhas é utilizado amplamente como bebida. Durante o processamento na indústria ervateira, a ação mecânica das facas sobre folhas e ramos da planta gera um material resinoso rico em compostos bioativos, e que pode ser utilizado como fonte de extração de clorofilas.19 O modelo econômico mundial tradicional (linear), apoiado no uso indiscriminado dos recursos naturais por meio da lógica take make dispose, é considerado não-sustentável e contrário às agendas globais de sustentabilidade.20-22 A necessidade de limitar a exploração dos recursos à sua capacidade de renovação tem levado os gestores da economia global a buscar formas de exploração alternativas. A economia linear não considera com a devida profundidade a gestão dos recursos naturais e, neste contexto, a economia circular, por prezar e incentivar a reciclagem e o reaproveitamento dos materiais, valorizando todos os atores da cadeia produtiva,23,24 surge como instrumento de contribuição para o cumprimento dos 17 Objetivos de Desenvolvimento Sustentável (ODS) da Organização das Nações Unidas.25 A necessidade do alto nível do uso dos materiais preconizada pela economia circular coloca a Química como grande protagonista deste processo, destacando o uso das biomassas renováveis como fonte de recursos nos processos químicos.26 A literatura relata diversos métodos de obtenção e modificação de clorofilas de diferentes espécies de vegetais, utilizando solventes de baixa sustentabilidade ambiental ou perigosos, como metanol, acetona, éter de petróleo, dentre outros.10,11,13,16,18,27,28 O processo de extração utilizando etanol apresenta uma solução sustentável - com apelo econômico, ambiental e social - para o destino do resíduo gerado na produção de erva-mate, transformando-o em insumo para diversas indústrias - o que era produto de descarte passa a ser fonte de renda. O etanol é classificado na categoria Green no GSK Solvent Sustainability Guide e apresenta maior sustentabilidade ambiental que os solventes orgânicos tradicionais utilizados na extração de clorofilas.29 O presente trabalho apresenta a extração de clorofila a partir de resíduo industrial gerado da produção de erva-mate, utilizando etanol como solvente, seguido da sua modificação para obter metal-feofitina, substituindo o íon magnésio do centro do macrocíclico por cátions de metais de transição - cobalto, níquel ou zinco. As amostras foram caracterizadas por espectroscopias eletrônica e vibracional, e colorimetria. O padrão de cor RGB (red-green-blue) foi obtido e os tons de cinza das amostras foram utilizados para classificação pelo algoritmo supervisionado de aprendizado de máquina (ML, machine learning) Random Forest (RF). As amostras foram dispersas em tinta e avaliadas como pigmentos inorgânicos.
PARTE EXPERIMENTAL Materiais O resíduo do processamento da erva-mate foi coletado em indústria na região da cidade de Guarapuava, Paraná-Brasil, e armazenadas ao abrigo da luz e sob refrigeração (-15 oC). O etanol utilizado foi adquirido em posto de combustível, filtrado em papel filtro (45 µm) para retirada de eventuais particulados. Foram utilizados os seguintes reagentes: ácido clorídrico (HCl, 37%, grau P.A., Labsynth®, Brasil), cloreto de cobalto (II) hexa-hidratado (CoCl2·6H2O, grau P.A., Neon, Brasil), cloreto de níquel (II) hexa-hidratado (NiCl2·6H2O, grau P.A., Neon, Brasil), cloreto de zinco (II) penta-hidratado (ZnCl2·5H2O, grau P.A., Neon, Brasil). Preparação da resina e extração da clorofila A resina retirada dos equipamentos de processamento da erva-mate foi recebida em pedaços medindo cerca de 10 cm x 5 cm, de cor verde oliva, com odor característico de erva-mate; foi fragmentada com o uso de utensilio cortante (tipo faca), e triturada em moinho tipo Willye (Tecnal Equipamentos Científicos, modelo TE-650) até ficar totalmente pulverizada e com granulometria uniforme (< 1 mm). Em seguida o pó foi seco em estufa (60 oC por 24 h). A extração foi realizada em extrator Soxhlet, utilizando 25 g de resina em pó, e 250 mL de etanol por cerca de 3 horas, totalizando 12 ciclos de refluxo. O extrato etanólico verde foi monitorado em um espectrofotômetro de absorção (Visível) para confirmação da presença de clorofila. Síntese de metal-feofitina Em um béquer, foram colocados, sob agitação, 200 mL do extrato etanólico contendo clorofila e gotejados 84 µL de ácido clorídrico (10-5 mol de HCl) levando à formação da feofitina, evidenciada pela percepção visual da mudança da cor da solução de verde para marrom e monitorado em espectrofotômetro de absorção (Visível). Alíquotas de 50 mL foram separadas para a complexação com os íons cobalto (II), níquel (II) ou zinco (II). Para a síntese de metal-feofitina, cada alíquota foi aquecida, em balão de fundo redondo acoplado a um condensador de refluxo, até a ebulição, seguida pela adição gota-a-gota de 2,5 mL de solução etanólica (0,2 mol L-1) do respectivo sal cloreto (CoCl2, NiCl2 ou ZnCl2), e mantida sob ebulição por 20 minutos. As soluções foram armazenadas sob refrigeração (8 oC) e ao abrigo de luz. Análises dos extratos Os extratos etanólicos foram caracterizados por espectroscopia eletrônica de absorção na região do visível (Visível) em um espectrofotômetro marca Shimadzu, modelo UV-1800; por espectroscopia vibracional na região do infravermelho por transformada de Fourier (FTIR), em espectrofotômetro marca Perkin Elmer, modelo Frontier. Analise química por energia dispersiva de fluorescência de raios X (EDXRF) em espectrofotômetro Shimadzu, modelo EDX-7000. Análise de cor pela decomposição em tons de cinza e classificação das amostras por Random Forest (RF). Aplicação dos extratos Os extratos etanólicos das amostras (clorofila, feofitina, Co-feofitina, Ni-feofitina, Zn-feofitina) foram secos por evaporação à temperatura entre 60 oC a 65 oC, obtendo os pigmentos em pó. Os pigmentos foram dispersos em tinta esmalte sintético branco (marca Madeiras e Metais Coralar, Coral AkzoNobel) na proporção de 10% em massa. A tinta pigmentada foi aplicada em discos de madeira para análise.
RESULTADOS E DISCUSSÃO Síntese dos complexos metal-feofitina O extrato de clorofila acidificado apresentou mudança em sua cor de verde intenso para marrom, atribuído a saída do íon Mg2+, indicando a formação de feofitina (Figura 2). Os íons metálicos adicionados na forma de sal cloreto (cobalto, níquel ou zinco) foram incorporados pelo ligante feofitina, formando complexos com diferentes tons de verde (Figura 2).
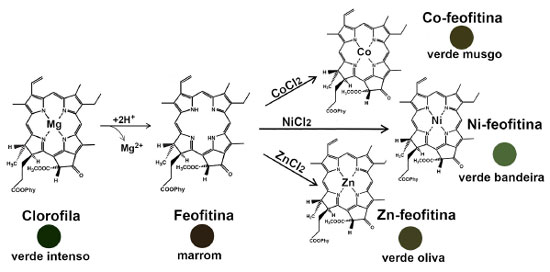 Figura 2. Transformações químicas promovidas na clorofila: 1º) acidificação para remoção do íon Mg2+ e formação de feofitina; 2º) combinação com sais cloreto para formar os complexos M-feofitina (M2+ = Co2+, Ni2+, Zn2+)
Espectroscopia eletrônica (visível) Os espectros eletrônicos de absorção na região do visível para os extratos da clorofila e da feofitina são mostrados na Figura 3a. Foi observado as bandas Soret (B1 e B2) entre 400-500 nm e as bandas Q (Q1, Q2, Q3 e Q4) entre 500-700 nm. Para a clorofila a presença do íon Mg2+ coordenado no macrocíclico tetrapirrólico apresenta maior simetria (D4h) do que o macrocíclico feofitina (D2h) e, consequentemente, uma simplificação no padrão dessas bandas.30 No espectro da feofitina a saída do íon Mg2+ provoca um deslocamento hipsocrômico (para o azul) da banda Soret, conforme sumarizado na Tabela 1. Os espectros de absorção dos complexos M-feofitina (Co-feofitina, Ni-feofitina e Zn-feofitina) são apresentados na Figura 3b e sumarizados na Tabela 1.
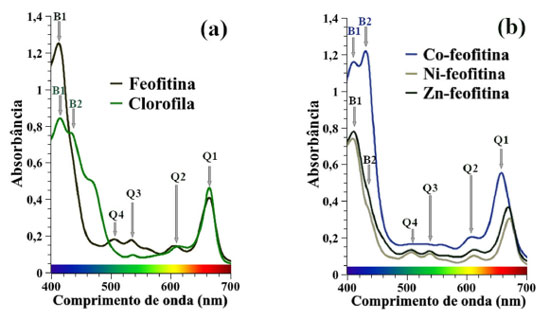 Figura 3. Espectros de absorção (VIS) dos extratos de clorofila e de feofitina (a); e dos complexos M-feofitina (b); destacando-se as bandas Soret (B1 e B2) e bandas Q (Q1, Q2, Q3 e Q4)
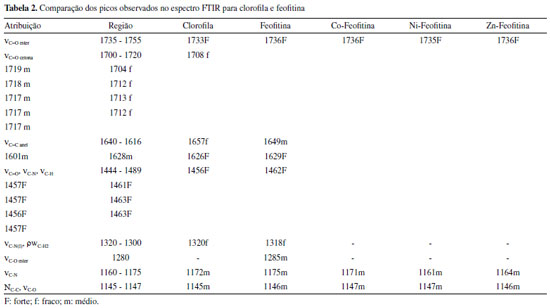
Durante o processo de extração, além da clorofila a se extrai também frações de clorofila b e de pigmentos carotenoides.11,15,19 As bandas de absorção (B1 e B2) do espectro da clorofila são referentes às clorofilas a e b, respectivamente.11-14,31 A banda situada em 470 nm no espectro da clorofila (Figura 3a) é atribuída à presença de moléculas de carotenoides.15,32 As amostras apresentaram bandas de absorção na região do violeta e azul (banda Soret) e na região do amarelo e vermelho (bandas Q). Os deslocamentos hipsocrômicos das bandas Q nas M-feofitinas (Co2+, Ni2+, Zn2+) têm sido relatadas na literatura.32,33 Cada íon metálico central possui diferentes energias de ligação com o macrocíclico; sendo a mais fraca na Mg-clorofila (interação eletrostática), aumentando de intensidade no complexo Zn-feofitina (ligação covalente coordenada), e fortes interações covalentes de coordenação nos complexos Co-feofitina e Ni-feofitina.34 De acordo com energia de estabilização do campo cristalino (EECC), e considerando o raio iônico, observa-se que Ni2+ (d8) apresenta maior estabilidade (EECC = -1,2 Dq ou 6/5 Δo) e menor raio iônico (0,070 nm), enquanto Zn2+ (d10) apresenta estabilidade nula (EECC = 0) e maior raio iônico (0,075 nm).35 O íon Co2+ (d7) situa-se em posição intermediária, tanto em relação ao raio iônico (0,074 nm) quanto à estabilidade (EECC = -0,8 Dq ou 4/5 Δo). Dessa forma, e sob o ponto de vista da EECC e raio iônico, é esperado que os complexos M-feofitina apresentem também diferenças nos espectros eletrônicos. A EECC do complexo Zn-feofitina deixa o espectro eletrônico próximo do espectro da feofitina, com pequeno deslocamento hipsocrômico das bandas Q e Soret. O íon Zn2+ apresenta configuração eletrônica de camada cheia (d10), e se comporta como sistema simétrico e apresenta um único estado de energia. Na comparação dos espectros entre Zn-feofitina e Ni-feofitina, as diferenças são mais perceptíveis na banda Q em 664-666 nm, com pequeno deslocamento da banda do espectro da Ni-feofitina para o vermelho, que pode estar relacionado à menor carga residual do Ni2+, que geralmente têm menor afinidade por ligantes adicionais.30 O complexo Co-feofitina apresenta espectro de absorção com 2 bandas Q, influência da configuração d7 do íon Co2+, que na presença de ligantes de campo forte ocorre um desdobramento do orbital x2-y2 para região de mais alta energia, ficando à disposição para interagir com os ligantes. Isso explica os deslocamentos hipsocrômicos e o alargamento das bandas do espectro da Co-feofitina.35,36 Espectroscopia no infravermelho (FTIR) Os espectros vibracionais na região do infravermelho são mostrados na Figura 4a. As principais mudanças nas estruturas da clorofila e feofitina ocorrem na região entre 1750 cm-1 e 1100 cm-1 (Figura 3b).37 Na Tabela 2 estão relacionadas as posições das bandas (número de onda) que caracterizam cada composto, acompanhadas das atribuições forte (F), médio (m) ou fraco (f).
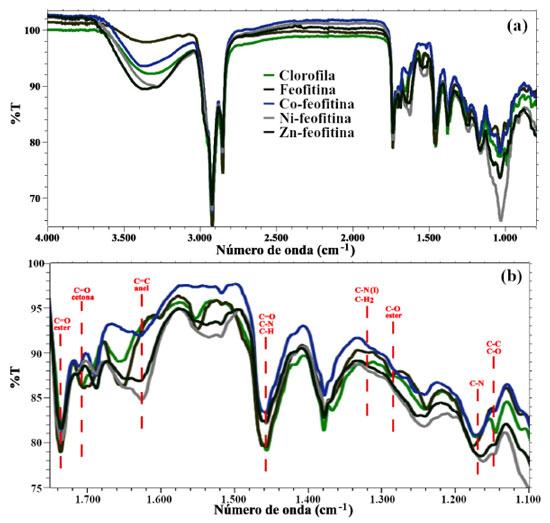 Figura 4. Espectros FTIR da clorofila, feofitina e complexos M-feofitina (3a); destacando as regiões entre 1750 cm-1 e 1100 cm-1 (3b)
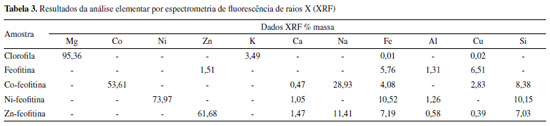
As bandas na região entre 1700 - 1755 cm-1 referem-se as vibrações relacionadas com as ligações C=O de esteres e cetonas de compostos neutros. Clorofila e feofitina apresentam bandas fortes em 1733 cm-1 e 1736 cm-1, bandas fracas em 1708 cm-1 e 1704 cm-1, respectivamente. Na banda de maior intensidade da feofitina ocorre um deslocamento para a região de maior energia em relação à clorofila. Os modos vibracionais dos anéis pirrólicos aparecem como bandas nas regiões de: 1616 - 1640 cm-1 (C=C); 1510 1580 cm-1 (N-H anel II na feofitina); 1300 - 1320 cm-1 (C-N anel III); 1444 1489 cm-1 (C=O, C-N, C-H) do anel isocíclico anexo ao anel pirrólico III. A banda da clorofila em 1657 cm-1 está presente na feofitina em 1601 cm-1, e uma segunda banda em 1649 cm-1. Em 1550 cm-1; 1515 cm-1 e 1320 cm-1, as bandas apresentam, respectivamente, sinais médio, fraco e fraco, o sinal da feofitina deslocou-se para região de mais baixa energia em relação à clorofila. Pode-se concluir com base nas informações anteriores que o núcleo porfirínico da feofitina apresenta maior estabilidade em relação à clorofila. Isso é percebido pela tendência da feofitina apresentar modos vibracionais em regiões de maior energia (maior número de onda) que a clorofila. No caso das M-feofitina, todas apresentam bandas em regiões de baixa energia em relação à feofitina base livre. Entre 1616 1640 cm-1 (C=C anéis) as bandas da Co-feofitina são distintas das demais M-feofitina. Este fato é um indicativo dos diferentes modos de coordenação desses complexos. O Ni(II) tende a se encaixar dentro do sistema de anéis formando um composto planar; o Zn(II) tende a atrair mais um ligante formando um complexo com estrutura piramidal quadrada; e o Co(II) é capaz de formar estrutura octaédrica distorcida que interfere nas vibrações do macrocíclico.30 Clorofila e feofitina apresentaram bandas fracas na região entre 1320 1300 cm-1, e nas M-feofitina as bandas são muito fracas. Na região entre 1160 1175 cm-1, relacionada às vibrações C-N do anel, novamente a feofitina apresenta modos vibracionais em regiões de maior energia (maior número de onda) que a clorofila. Para as M-feofitina os modos vibracionais aumentam de energia no sentido Ni-feofitina < Zn-feofitina < Co-feofitina, coincidindo com a crescente complexidade estrutural planar < piramidal < octaédrica. Espectrometria de fluorescência de raios X (XRF) A Tabela 3 resume os resultados da análise química por energia dispersiva de fluorescência de raios X (EDXRF) obtidos para amostras em pó. O magnésio foi encontrado somente na amostra de clorofila; a sua ausência na feofitina é um indicativo que o processo de remoção do íon Mg2+ foi bem-sucedido. Desta forma, a presença dos elementos cobalto, níquel e zinco encontrados na respectiva M-feofitina, indica que ocorreu a metalação conforme proposto. Por outro lado, alguns elementos minoritários foram encontrados, atribuído ao fato da matéria-prima ser de origem vegetal e não ter passado por nenhum processo de purificação. A porcentagem de magnésio e os demais elementos encontrados na clorofila são compatíveis com outros trabalhos descritos na literatura.17
Dispersão das amostras em esmalte sintético e teste fotoestabilidade As amostras de clorofila, feofitina e M-feofitina na forma de pó foram dispersas como pigmentos em tinta esmalte sintético branco; e aplicado sobre discos de madeira. Os discos receberam duas demãos de tinta e foram armazenadas ao abrigo da luz por 120 horas, em seguida expostas a iluminação para avaliar estabilidade dos pigmentos. O teste de fotoestabilidade à luz artificial foi realizado com um diodo emissor de luz com refletor parabólico de alumínio com ângulo de abertura de 25 graus (lâmpada LED PAR20 marca Brilia), fluxo luminoso 550 lm, temperatura de cor 6.500 k, potência 5,5 W e intensidade luminosa de 1350 cd, aparato representado na Figura 5a.
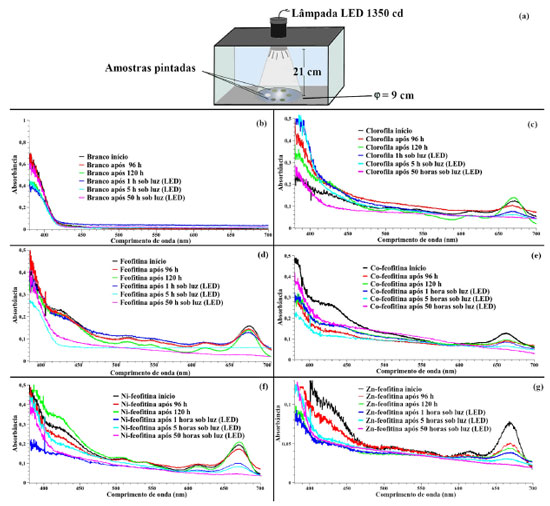 Figura 5. Aparato para teste de estabilidade à luz (5a); espectros eletrônico das amostras expostas a luz: branco (5b), clorofila (5c), feofitina (5d), Co-feofitina (5e), Ni-feofitina (5f), Zn-feofitina (5g)
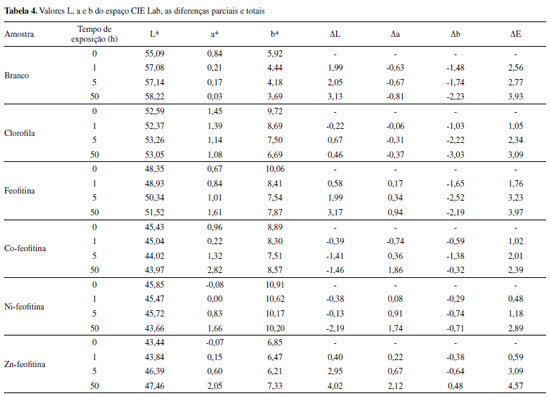
O teste foi monitorado por medidas de espectros no visível e colorimetria, nos seguintes intervalos de tempo: recém pintado; ao abrigo da luz por 96 horas e 120 horas; e exposto a luz de LED após 1 hora; 5 horas e 50 horas. O aparato para fotoestabilidade consiste em uma caixa de polipropileno opaco, em cuja tampa foi adaptada uma lâmpada LED. As especificações da lâmpada e a distância das amostras permite calcular a iluminância incidente nas amostras. A relação entre intensidade luminosa (I) e iluminância (E) é dada pela equação (1).38  em que E é a iluminância em lux (lx); I é a intensidade luminosa em candela (cd); r é a distância da fonte de luz em metros (m); θ é o ângulo de inclinação da lâmpada (neste caso igual a zero). Aplicando os valores na equação 1:  Considerando como tempo de exposição de 50 horas, a dose total de iluminância recebida pelas amostras foi de 1.530 klux (50 h x 30,6 klux). Considerando que um ambiente interno com incidência de 10 horas/dia de luz, iluminado por cerca de 200 lux conclui-se que essa dose representou cerca de 765 dias ininterruptos de exposição em ambiente interno.38,39 A Figura 5 (b-g) mostra os espectros eletrônicos em função do tempo de exposição. Para branco (Figura 5 b), os espectros se mantiveram relativamente estáveis; as amostras contendo pigmento apresentaram uma diminuição gradual da intensidade das bandas Q e Soret, até sua total extinção em função do tempo de exposição à luz (Figura 5 c-g). O desaparecimento das bandas é um indicativo de decomposição química dos pigmentos, especialmente do anel macrocíclico, responsável pela formação das bandas Q e Soret. A diminuição da intensidade das bandas Q e Soret foi seguida de mudanças na cor das amostras. As diferenças nas cores das amostras foram medidas em colorímetro portátil (Tecnal Equipamentos, modelo NR60CP-3nh) no espaço de cor CIE L*a*b* (Tabela 4). As medidas de L* variam de 0 (preto) à 100 (branco), a* do verde ao vermelho, e b* do amarelo ao azul (Figura 6f).40 Os valores medidos de L* estão todos na região positiva e mais clara do espaço de cor (Figura 6). Com o tempo de exposição à luz, os pigmentos Co feofitina e Ni-feofitina tiveram uma pequena diminuição do valor de L*, indicando escurecimento da tinta, enquanto os pigmentos Clorofila, Feofitina e Zn-feofitina tiveram aumento dos valores de L*, indicando um clareamento da superfície. As medidas do parâmetro a* apresentam tendência de tons de cinza, próximas do centro para todas as amostras; e com o tempo de exposição à luz os valores foram deslocados no sentido do verde para o vermelho. De forma similar, os valores de b* para todas as amostras foram deslocadas do amarelo em direção à região do azul (Figura 6).
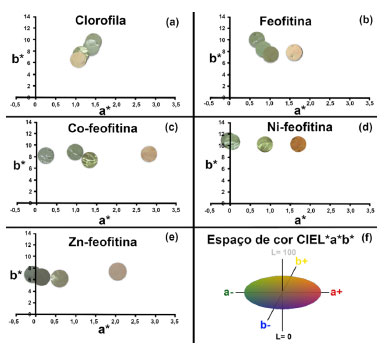 Figura 6. Deslocamento no espaço de cores CIE L*a*b* ao longo da exposição à luz para Clorofila (6a), Feofitina (6b), Co-feofitina (6c), Ni-feofitina (6d), Zn-feofitina (6e) e representação do espaço de cor (6f)
As diferenças de cor observadas para cada amostra foram calculadas de acordo com equação (2); sendo ΔL (mais claro ou mais escuro), Δa (mais vermelho ou mais verde) e Δb (mais amarelo ou mais azul).40 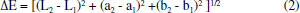 A amostra com Co-feofitina apresentou menor diferença de cor (ΔE = 2,39), enquanto, Ni-feofitina (ΔE = 2,89) e clorofila (ΔE = 3,09) apresentaram diferenças de mais difícil distinção, quando comparada com o branco (ΔE = 3,93). O valor de ΔE foi maior para a amostra Zn-feofitina (ΔE = 4,57). Análise e classificação por aprendizado de máquina O aprendizado de máquina (machine learning, ML) é um método de análise de dados da área da inteligência artificial que se utiliza de técnicas estatísticas para automatizar a criação de modelos analíticos, e têm sido utilizado com frequência como ferramenta auxiliar em análises químicas.41-47 O algoritmo Random Forest (RF) apresenta resultados mais efetivos para a classificação das amostras dos pigmentos do que outras técnicas de estatística multivariada. A análise de cor por meio do algoritmo supervisionado de ML, utilizando algoritmo RF compreende diversas etapas de preparação das amostras.43,46,48 Os pigmentos aplicados em discos foram fotografados e destacados 4 pontos (50 x 50 pixels), para representar cada amostra, conforme Figura 7. Os dados coletados foram tratados no software para análise exploratória de dados multivariados Chemostat para a decomposição das imagens em seus tons de cinza, pelos canais RGB (Red, Green, Blue). Cada amostra gerou 256 tons de cinza por canal, totalizando 768 atributos de cor por amostra. Os dados foram transpostos em colunas no software LibreOffice Calc© para seleção por critério da média. Colunas com média inferior a 0,70 foram descartadas, reduzindo de 768 para 435 atributos de cor. O software WEKA (Waikato Environment for Knowledge Analysis, Versão 3.6.14©) foi utilizado para seleção dos melhores atributos de cor por meio do algoritmo genético (GA), 61 dos 435 atributos foram considerados importantes e, portanto, selecionados para classificar as amostras.
 Figura 7. Fotos dos pigmentos dispersos na tinta e aplicados em discos de madeira para separação das amostras por suas cores
O software WEKA foi utilizado para construção e validação dos modelos de classificação utilizando-se o algoritmo Random Forest. Assim, 66,67% das 72 amostras destacadas foram selecionadas para a construção do modelo de classificação. Os 33,33% restante das amostras foram utilizados para a validação do modelo. Utilizou-se o Cross-validation para visualizar qual parâmetro da rede é mais adequado para a classificação. Sendo que 48 amostras selecionadas (66,67%), 10% foram utilizadas para construir o modelo e 90% foram utilizadas para fazer a validação. O processo dessa validação interna demonstrou que 72% das amostras foram corretamente classificadas indicando que o modelo por Cross-validation foi adequado para classificação das amostras. Após a geração do modelo por Cross-validation, o modelo com conjunto total de dados (66,67% das amostras) foi rodado no software WEKA. Essa classificação ocorreu com 100% de acerto para a classificação das amostras. Por fim, foi rodada a validação externa do modelo de classificação com as 24 amostras restantes (33,33% das amostras), resultando em acurácia de 79,17%. Apenas 5 amostras das 24 utilizadas para esse modelo foram incorretamente classificadas. Os resultados das classificações das amostras, matriz de confusão e taxas de acertos do modelo final são apresentados na Tabela 5.
A matriz de classificação (Tabela 5b) apresenta 2 amostras do pigmento branco (Bco), 3 do pigmento clorofila (Clor), 4 do pigmento feofitina (Feof) e 5 do pigmento Zn-feofitina classificadas corretamente. Estes casos apresentaram 100 % de acurácia (coluna TP Rate na Tabela 5c). A matriz de classificação (Tabela 5b) demonstra que de 8 amostras da Co-feofitina, 4 foram classificadas corretamente, 3 foram classificadas como Ni-feofitina e 1 foi classificada como Zn feofitina. Neste caso a acurácia destacada na coluna TP Rate (Tabela 5c) foi 50% para Co-feofitina. O pigmento Ni-feofitina apresentou 1 amostra classificada corretamente e uma amostra classificada como clorofila, com acurácia (TP Rate) de 50%. A classificação incorreta das amostras de Co-feofitina e Ni-feofitina diminuiu a precisão (coluna precision da Tabela 5c) da classificação de clorofila para 75% e de Zn-feofitina para 83,3%. A acurácia geral da classificação (Tabela 5a) ficou em 79,17% e, portanto, apresentando acurácia adequada para esse tipo de matriz. À exceção das amostras de Co-feofitina e Ni-feofitina que tiveram a acurácia da classificação reduzida, os demais resultados da seleção realizados pelo algoritmo RF (Tabela 5), estão de acordo com as demais caracterizações espectroscópicas (eletrônica e vibracional) dos pigmentos. Clorifila e economia circular Há uma demanda crescente da indústria mundial por pigmentos naturais,49-51 que vai ao encontro da necessidade de preservação dos recursos naturais. A produção anual de erva-mate no Brasil é de cerca de 1 milhão de toneladas/ano e o Paraná é responsável por cerca de 60%.52 A indústria ervateira paranaense gera mais de 5 toneladas/ano de resíduos ricos em clorofila que são descartados e podem ser aproveitado como fonte de recursos de alto valor agregado. O processo de reaproveitamento de resíduos utilizando-se de reagentes e técnicas sustentáveis apresentado neste trabalho é uma contribuição para a desejada transição do modelo econômico linear para a economia circular.
CONCLUSÕES Os resultados demonstraram ser possível utilizar o resíduo industrial como fonte para extração de clorofila. O uso do etanol como solvente de extração e síntese dos complexos apresenta-se como uma alternativa verde em substituição a solventes orgânicos mais tóxicos ao ser humano e ao meio ambiente que tradicionalmente são utilizados, como metanol, diclorometano, éter de petróleo, acetona, hexano. As análises por espectroscopia eletrônica (Visível) apresentaram espectros característicos para compostos do tipo macrocíclicos tetrapirrólicos com presença de bandas Q e Soret bem definidas, e deslocamentos compatíveis com as alterações no centro metálico do anel macrocíclico. A espectroscopia na região do infravermelho (FTIR), mostrou diferenças significativas na posição das bandas devido à substituição do íon Mg2+ por metais de transição formando novos complexos. A espectroscopia de fluorescência de raios X certificou a presença de magnésio na clorofila, e sua ausência na feofitina e M-feofitina. Os compostos obtidos mostraram ser viáveis para uso como pigmento em tintas tipo esmalte sintético, e os experimentos de fotodegradação apresentaram resultados compatíveis à tinta comercial branco para os pigmentos à base de clorofila, feofitina, Co-feofitinas e Ni-feofitina. A análise de cor por meio do algoritmo RF veio corroborar os resultados obtidos nas caracterizações por espectroscopia eletrônica e vibracional das amostras dos pigmentos. Esse tipo de abordagem poderia ser utilizado para classificação de tintas na indústria desse setor. Além disso, o aproveitamento de resíduos da indústria de erva-mate é uma oportunidade que pode gerar renda extra para o pequeno empreendedor rural e tal atividade poderia fortalecer a economia circular.
AGRADECIMENTOS Os autores agradecem as agências de fomento CAPES (Capes 01), CNPq (308625/2019-6; 427127/2018-1), Finep e Fundação Araucária (001/2016 - CPBA/PROPESP).
REFERÊNCIAS 1. https://bvsms.saude.gov.br/bvs/saudelegis/anvisa/2013/rdc0008_06_03_2013.html, acessada em fevereiro 2022. 2. Ferruzzi, M. G.; Failla, M. L.; Schwartz, S. J.; J. Agric. Food Chem. 2001, 49, 2082. 3. Lanfer-Marquez, U. M.; Rev. Bras. Cienc. Farm. 2003, 39, 227. 4. Ma, L.; Dolphin, D.; Phytochemistry 1999, 50, 195. 5. Harashima, I.; Horikawa, S.; Kubota, M.; Maruoka, T.; Oizumi, T.; Sato, N.; Jpn. JPH0948925A, 1995. 6. Nelson, R. E.; Ferruzzi, M. G.; J. Food Sci. 2008, 73, H86. 7. Canales, E. M. C.; Zamudio, A. A.; Sanchez, F. L.; Mex. MX2008006155A, 2008. 8. Bernard, L. M. C.; Creeth, J. E.; Stead, W. J.; Bra. PI00082350A, 2000. 9. Perez-Galvez, A.; Viera, I.; Roca, M.; Curr. Med. Chem. 2018, 24, 4515. 10. Bernardo, M. K. O.; Organo, V. G.; Orient. J. Chem. 2014, 30, 445. 11. Costa, P. F. A.; Gerola, A. P.; Pereira, P. C. S.; Souza, B. S.; Caetano, W.; Fiedler, H. D.; Nome, F.; Hioka, N.; J. Mol. Liq. 2019, 274, 393. 12. Li, Y.; Chen, M.; Funct. Plant Biol. 2015, 42, 493. 13. Yuen, J. M.; Harris, M. A.; Liu, M.; Diers, J. R.; Kirmaier, C.; Bocian, D. F.; Lindsey, J. S.; Holten, D.; Photochem. Photobiol. 2015, 91, 331. 14. Orzeł, Ł.; Rutkowska-Zbik, D.; Świrski, M.; Stochel, G.; J. Coord. Chem. 2018, 71, 1837. 15. Maestrin, A. P. J.; Neri, C. R.; De Oliveira, K. T.; Iamamoto, O. A. S. E. Y.; Quim. Nova 2009, 32, 1670. 16. Darmokoesoemo, H.; Setyawati, H.; Ningtyas, A. T. A.; Kusuma, H. S.; Rasayan J. Chem. 2017, 10, 313. 17. Chen, L.; He, L.; Xie, J.; Qiu, Z.; Qi, J.; Jiang, Y.; Xiao, H.; Chen, Y.; de Hoop, C. F.; Hse, C. Y.; BioResources 2019, 14, 5327. 18. Rahayuningsih, E.; Pamungkas, M. S.; Olvianas, M.; Putera, A. D. P.; J. Food Sci. Technol. 2018, 55, 1028. 19. Efing, L. M. A. C.; Tese de Doutorado, Universidade Federal do Paraná, Brasil, 2008. 20. Lucas, M. R.; Sousa, K. A.; Ramos, I. J.; Rego, C.; Em Pesquisa em inovação: múltiplos olhares rumo a uma convergência formativa (recurso eletrônico); Pôrto Jr, G., org.: EDUFT: Palmas, 2019, cap. 1. 21. Pereira, R.; Anais do 27o APDR Congress, Angra do Heroismo, Portugal, 2020. 22. Tavares, A.; Borschiver, S.; Cadernos de Prospecção 2021, 14, 810. 23. Araújo, M. G.; Vieira, A. O.; Em Política Nacional de Resíduos Sólidos: implementação e monitoramento de resíduos urbanos; Besen, G. R., Freitas, L., Jacobi, P. R., orgs.; IEE USP: São Paulo, 2017; cap. 3. 24. De Assunção, G. M.; Sist. Gestão 2019, 14, 223. 25. United Nations Conference on Trade and Development (UNCTAD); World Investment Report 2014 Investing in the SDGs: an Action Plan; UNISDR: Genebra, 2014, cap. 4. 26. Ferreira, P. G.; Silva, F. de C. da; Ferreira, V. F.; Rev. Virtual Quim. 2017, 9, 452. 27. Zabelin, A. A.; Shkuropatova, V. A.; Makhneva, Z. K.; Moskalenko, A. A.; Shuvalov, V. A.; Shkuropatov, A. Y.; Biochim. Biophys. Acta, Bioenerg. 2014, 1837, 1870. 28. Witte, K.; Streeck, C.; Mantouvalou, I.; Suchkova, S. A.; Lokstein, H.; Grötzsch, D.; Martyanov, W.; Weser, J.; Kanngießer, B.; Beckhoff, B.; Stiel, H.; J. Phys. Chem. B 2016, 120, 11619. 29. Alder, C. M.; Hayler, J. D.; Henderson, R. K.; Redman, A. M.; Shukla, L.; Shuster, L. E.; Sneddon, H. F.; Green Chem. 2016, 18, 3879. 30. Giovannetti, R.; Em Macro to Nano Spectroscopy; Uddin, J., ed.; Coppin State University: Baltimore, 2012, cap. 6. 31. Bevilacqua, A. C.; Köhler, M. H.; Iglesias, B. A.; Piquini, P. C.; Comput. Mater. Sci. 2019, 158, 228. 32. Kang, Y. R.; Park, J.; Jung, S. K.; Chang, Y. H.; Food Chem. 2018, 245, 943. 33. Grajek, H.; Rydzyński, D.; Piotrowicz-Cieślak, A.; Herman, A.; Maciejczyk, M.; Wieczorek, Z.; Chemosphere 2020, 261, 127434. 34. Karcz, D.; Boroń, B.; Matwijczuk, A.; Furso, J.; Staroń, J.; Ratuszna, A.; Fiedor, L.; Molecules 2014, 19, 15938. 35. E. Toma, H.; Química de Coordenação, Organometálica e Catálise; 2a ed., Blucher: São Paulo, 2016. 36. Toma, H. E.; Bonifácio, L. da S.; Anaissi, F. J.; Quim. Nova 2005, 28, 897. 37. Li, X.; Zhou, R.; Xu, K.; Xu, J.; Jin, J.; Fang, H.; He, Y.; Molecules 2018, 23, 1010. 38. Grieneisen, H. P.; Anais do Congresso Brasileiro de Metrologia. Bento Gonçalves, Brasil, 2015. 39. Zhuang, G.; Jaber, M.; Rodrigues, F.; Rigaud, B.; Walter, P.; Zhang, Z.; J. Colloid Interface Sci. 2019, 552, 204. 40. Quindici, M.; O segredo das cores; All Print Editora: São Paulo, 2013. 41. Ghaedi, M.; Ghaedi, A. M.; Negintaji, E.; Ansari, A.; Vafaei, A.; Rajabi, M.; J. Ind. Eng. Chem. 2014, 20, 1793. 42. Li, R.; Cui, L.; Meng, Y.; Zhao, Y.; Fu, H.; Atmos. Environ. 2019, 208, 10. 43. O'Brien, J. J.; Spry, P. G.; Nettleton, D.; Xu, R.; Teale, G. S.; J. Geochem. Explor. 2014, 149, 74. 44. Lee, S.; Choi, H.; Cha, K.; Chung, H.; Microchem. J. 2013, 110, 739. 45. Li, Y.; Zou, C.; Berecibar, M.; Nanini-Maury, E.; Chan, J. C. W.; van den Bossche, P.; Van Mierlo, J.; Omar, N.; Appl. Energy 2018, 232, 197. 46. Shi, P.; Wang, Y.; Xu, J.; Zhao, Y.; Yang, B.; Yuan, Z.; Sun, Q.; Comput. Electron. Agric. 2021, 180, 105860. 47. Heid, E.; Green, W. H.; J. Chem. Inf. Model. (2021), doi: 10.1021/acs.jcim.1c00975. DOI: http://dx.doi.org/10.1021/acs.jcim.1c00975. 48. Zaimes, G. N.; Gounaridis, D.; Symeonakis, E.; Ecol. Indic. 2019, 103, 630. 49. Osorio, L. L. D. R.; Flórez-López, E.; Grande-Tovar, C. D.; Molecules 2021, 26, 515. 50. Chiocchio, I.; Mandrone, M.; Tomasi, P.; Marincich, L.; Poli, F.; Molecules 2021, 26, 495. 51. Lourenço-Lopes, C.; Fraga-Corral, M.; Jimenez-Lopez, C.; Pereira, A. G.; Garcia-Oliveira, P.; Carpena, M.; Prieto, M. A.; Simal-Gandara, J.; Resources 2020, 9, 101. 52. http://www.ipardes.gov.br/anuario_2019/estrutura.html#opc4_2, acessada em fevereiro 2022. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access