Artigo
|
|
| Estudo one-pot da aplicação do catalisador de Grubbs de primeira geração em reações de metátese da piperina e eugenol: a influência da ligação dupla terminal One-pot study of the application of catalyst first-generation Grubbs in metathesis reactions of piperine and eugenol: the influence of the double- bond terminal |
|
Ana K. B. CostaI; Kerlane A. FernandesI; Vanessa B. VieiraI; Aline A. C. FrançaII; Wanessa A. Limaa; Pedro M. de Almeidaa; José M. E. de MatosII; Benedito S. L. NetoIII; José L. S. SáI,*; Francielle A. MartinsI
I. Departamento de Química, Universidade Estadual do Piauí, 64002-150 Teresina - PI, Brasil Recebido em: 12/12/2021 *e-mail: joseluiz@ccn.uespi.br In this paper, the piperine (PIP) and eugenol (EUG) organic compounds were used as substrates in olefin metathesis reactions catalyzed by first-generation Grubbs catalyst (G1) - [RuCl2(PCy3)2(=CHPh)], Cy is cyclohexyl and Ph is phenyl, in a one-pot system. The reactions occurred at 50 ºC, for 24, 48, or 96 h using the two substrates simultaneously in the ratio Ru:PIP:EUG of 1:1:1 and 1:10:10 mol. The results were evaluated by GC-MS, discussed in terms of the electronic and steric characteristics of the G1, and the structural proprieties of the substrates. In the Ru:PIP:EUG ratio of 1:1:1 mol, a dimeric species was observed for the olefin metathesis of EUG, in all time studied and in an additional experiment at 70 ºC for 48 h. When the Ru:PIP:EUG ratio was 1:10:10 mol, this dimer was not observed. Isomerization processes also were observed at all temperatures and catalyst:substrates ratio. The reaction yield increased with the raise of substrates amount. There was no cross-metathesis reaction. This fact was attributed to the chelating effect of the double coordination of the PIP to the catalyst. INTRODUÇÃO Os processos catalíticos são amplamente utilizados na indústria química a fim de viabilizar a produção de diversos produtos, sendo que mais de 80% de todos os produtos da indústria química são obtidos por algum processo catalítico.1 A catálise, que consiste em uma reação mediada pela presença de um catalisador, pode ser classificada em dois tipos: catálise homogênea (o catalisador e os reagentes encontram-se na mesma fase) e catálise heterogênea (o catalisador e os reagentes encontram-se em fases distintas). A principal diferença entre elas consiste na fase dos catalisadores utilizados.2,3 Nos últimos anos, as reações de metátese de olefina, exemplo de catálise homogênea, vêm se configurando como importante ferramenta na elaboração de novas rotas industriais para a obtenção de importantes produtos petroquímicos, poliméricos, farmacêuticos e produtos químicos em gerais. Essas reações consistem no rearranjo dos átomos de carbono das olefinas, pelo qual as ligações duplas carbono-carbono são redistribuídas na presença de um catalisador.4-6 A ação dos catalisadores é fator primordial na reatividade dos substratos, visto que vários metais de transição utilizados na formação dos complexos apresentam afinidade por grupos funcionais ou por moléculas presentes no meio, sendo importante a utilização de catalisadores que reajam preferencialmente com a olefina do substrato.7,8 Nesse sentido, destacam-se os catalisadores de Schrock, que são complexos moleculares metálicos de molibdênio e tungstênio,9 e os catalisadores de Grubbs, à base de rutênio.10 Os catalisadores de Grubbs são um pouco menos ativos que os de Schrock, em contrapartida, são menos sensíveis a impurezas e a grupos funcionais, o que se configura como uma vantagem em relação aos catalisadores de Schrock.9-11 Os catalisadores de Ru são amplamente utilizados por apresentarem tolerância a grupos funcionais, com baixa sensibilidade para umidade e oxigênio, possibilitando assim a reação de metátese com uma infinidade de substratos, bem como compostos naturais e bioativos.8,12-14 Os produtos naturais configuram-se como excelentes opções para produção de diversos produtos a serem utilizados industrialmente, pois apresentam grande disponibilidade, capacidade de renovação e baixo custo, podendo ser submetidos a diversos processos químicos, para obtenção de novos produtos.14,15 A piperina, ((2E,4E)-5-(1,3-benzodioxol-5-yl)-1-piperidin-1-ylpenta-2,4-dien-1-one), representada na Figura 1, é um alcaloide nitrogenado que apresenta em sua estrutura três subunidades: função amida, constituída por um anel piperidina com fração carbonil α-β insaturada; uma cadeia de butadieno e um grupo 1,3-benzodioxol, também chamado de núcleo piperonal.16,17 Considerada como principal metabólito secundário extraído do gênero Piper, é um composto natural da classe dos alcaloides, encontrados nos frutos das pimentas pertencentes à família Piperaceae, principalmente na pimenta preta (P. nigrum) e na pimenta longa (P. longum L.).17,18
 Figura 1. Fórmula estrutural da piperina e do eugenol
Em seus estudos, França et al. realizaram uma ampla pesquisa em bancos de dados a respeito dos países que mais publicaram artigos científicos sobre a piperina, das áreas de maior aplicação e também de patentes depositadas com essa molécula. Esses autores observaram que as propriedades biológicas e farmacológicas da piperina têm sido destaque nas pesquisas em relação às reações de modificação da molécula, através de diferentes reações químicas,19 de forma a instigar pesquisas nesse sentido, de modificar a piperina para obtenção de produtos derivados, similares, mas com diferentes características. As principais propriedades da piperina consistem em atividades antioxidante, anti-inflamatória, antitumoral e antimicrobiana, além de ser benéfica no tratamento da doença de chagas e da leishmaniose e ainda ser forte candidata a fármaco para a prevenção e tratamento de doenças neurodegenerativas e neurológicas.16-18,20,21-25 O eugenol (2-methoxy-4-prop-2-enylphenol) é um composto fitoquímico fenólico oriundo de óleos essenciais, tendo sido isolado pela primeira vez a partir do cravo-da-índia. Seu nome deriva do nome científico da espécie, Eugenia aromaticum, sendo também encontrado em outras plantas aromáticas como Cinnamomum verum, Ocimum basilicum, Cinnamomum tamala, Illicium anisatum, Melissa officinalis, Ocimum tenuifloruma e Myristica fragrans (Figura 1).26,27 Dentre os compostos fenólicos voláteis, o eugenol vem despertando interesse dos cientistas por possuir notáveis propriedades, tais como elevada lipossolubilidade, baixa toxicidade, atividades antipirética, analgésica, anti-inflamatória, antioxidante, antimicrobiana, anticâncer, neuroprotetora e atividade antifúngica.26,28-31 A piperina e o eugenol são olefinas que apresentam propriedades biológicas e farmacológicas bastante interessantes que podem ser consequência da classe de metabólitos à qual pertencem. Com isso o objetivo deste trabalho é analisar a influência da ligação dupla terminal na reatividade da reação de metátese de olefina, utilizando-se o catalisador de Grubbs de 1a geração (G1) na síntese de novas moléculas a partir da piperina e do eugenol.
PARTE EXPERIMENTAL Materiais e reagentes Catalisador de Grubbs de primeira geração (G1) - [RuCl2(PCy3)2(=CHPh)], piperina (99%), eugenol (99%), etilvinil éter (99%), todos da Sigma-Aldrich; clorofórmio (CHCl3) da Dinâmica; nitrogênio (N2) com 5.0 de pureza e hélio (He) com 5.0 de pureza, da W. Martins. Procedimentos gerais para reações de metátese de olefinas Reações de metátese Todas as reações de metátese foram realizadas e manipuladas sob atmosfera de nitrogênio (N2). As reações ocorreram em um balão de fundo redondo (100 mL), no qual os substratos piperina e eugenol foram solubilizados em 10 mL de clorofórmio previamente desgaseificado, por 30 minutos. Em seguida adicionaram-se 100 mg do catalisador de Grubbs de 1a Geração (G1), e o sistema permaneceu sob refluxo em banho de óleo termostático com temperatura controlada sob agitação magnética constante. Transcorrido o tempo de reação, foram adicionados ao sistema 3 µL de etilvinil éter, para a desativação do catalisador e finalização da reação. As reações aconteceram à temperatura de 50 ºC ou 70 ºC, com relação equivalente de catalisador:substratos (sendo substratos a soma de eugenol e piperina) de 1:1 ou 1:10 mol (também podendo ser expresso pela razão catalisador:eugenol:piperina de 1:0,5:0,5 ou 1:5:5 mol), e os ensaios ocorreram nos tempos de 24, 48 ou 96 h. Para a análise de cromatografia gasosa acoplada à espectrometria de massas (CG-EM), uma alíquota de 1 mL foi retirada e dissolvida em 1 mL de clorofórmio. Os produtos de metátese cruzada esperados para os substratos utilizados, baseados no mecanismo da reação de metátese cruzada, estão dispostos na Figura 2.
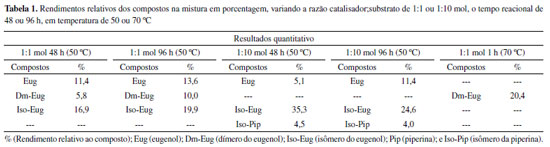
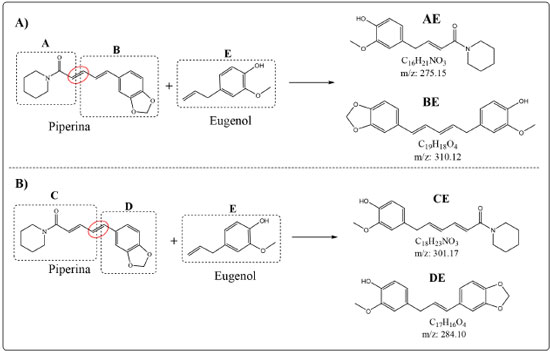 Figura 2. Ilustração de exemplos de produtos esperados para a reação de metátese cruzada da piperina com o eugenol. A piperina foi dividida em 4 fragmentos (A, B, C e D) de acordo com a possibilidade de a reação acontecer pela ligação dupla próxima ao grupo amida com fração carbonil α-β-insaturada e pela ligação dupla próximo ao grupo 1,3-benzodioxol, e o eugenol como (E). A) Ilustração dos produtos AE e BE pela reação com a ligação dupla próxima ao grupo amida da piperina com o eugenol. B) Ilustração dos produtos CE e DE pela reação com a ligação dupla próxima ao grupo 1,3-benzodioxol da piperina com o eugenol. Outras possibilidades também são possíveis
A reação de homometátese da piperina e do eugenol aconteceu de maneira análoga ao reportado anteriormente para a metátese cruzada, apenas com um substrato por vez. Os produtos de metátese esperados para os substratos utilizados, baseados no mecanismo da reação de homometátese, estão dispostos na Figura 3.
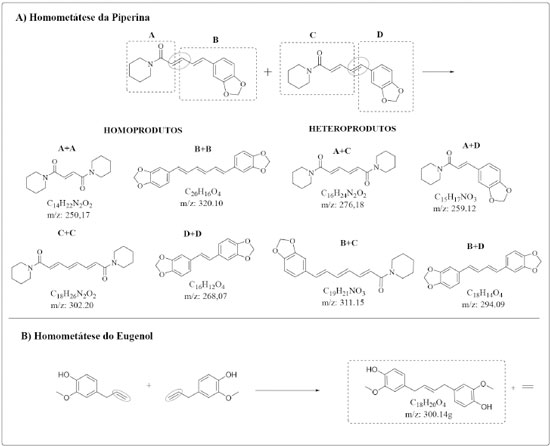 Figura 3. A) Ilustração de alguns produtos esperados para a reação de homometátese da piperina. Os demais produtos de cada reação específica não estão apresentados para contemplar o balanço de massa. B) Ilustração da equação da reação de homometátese do eugenol para a formação do principal produto esperado
Caracterizações Análise de cromatografia gasosa acoplada à espectrometria de massa (CG-EM) As análises de CG-EM foram realizadas em um cromatógrafo Shimadzu QP2010-SE equipado com uma coluna Rtx®-5MS de 30 m, utilizando-se o hélio como gás de arraste. A análise com o detector de massas foi realizada com o tempo de aquisição de 40 min. O programa utilizado foi o GCMS solutions, que possui uma biblioteca para detecção do composto.
RESULTADOS E DISCUSSÃO Os resultados das análises por CG-EM são apresentados na Figura 4. Na Tabela 1 estão resumidos os resultados dos rendimentos dos principais produtos. Em nenhuma das condições de síntese realizadas foi possível observar a formação de produtos de metátese cruzada. No tempo de 24 h não houve a formação de produto de isomerização em nenhuma das proporções ou temperaturas estudadas para piperina ou eugenol.
 Figura 4. Cromatogramas da reação de metátese cruzada da piperina com o eugenol. As concentrações catalisador:substratos foram de 1:1 ou 1:10 mol, nos tempos reacionais de 48 ou 96 h em temperatura de 50ºC. Eug (eugenol); Dm-Eug (dímero do eugenol); PCy3 (triciclohexilfosfina); O=PCy3 (triciclohexilfosfina oxidada); Iso-Eug (isômero do eugenol); Pip (piperina); e Iso-Pip (isômero da piperina)
Por 48 h, na proporção catalisador:substratos de 1:1 mol, observou-se a formação de produto de metátese do eugenol, denominado dímero de eugenol, de razão m/z = 300 g mol-1, com pico aparecendo em cerca de 5 min. de tempo de retenção (Figura 4A). O produto da isomerização do eugenol também foi notado, com pico relativo em torno de 22 min. de tempo de retenção. O dímero de eugenol e o isômero do eugenol estão presentes com 6 e 17% na mistura, respectivamente. A reação de metátese do eugenol utilizando o catalisador de Grubbs de 2a geração foi realizada, sendo relatada a formação do dímero com m/z = 300 g mol-1, corroborando assim a proposta de produto deste trabalho e ainda que a reação de homometátese do eugenol é favoravel.32 O produto da dimerização do eugenol também foi sintetizado atraves da reação de metátese com o catalisador de Hoveyda-Grubbs suportado com SBA-15 e analisado quanto a atividade antioxidante no teste de DPPH, apresentando maior atividade antioxidante quando comparado ao eugenol associado à melhor capacidade do dímero na eliminação de radicais livres.33 Ainda nessa análise, observaram-se picos referentes à triciclohexilfosfina (PCy3), à triciclohexilfosfina oxidada (O=PCy3) e picos relativos aos dois substratos da mistura (rendimento resumido na Tabela 1S). Relacionando-se apenas o eugenol e seus produtos, as porcentagens na mistura são 30% de substrato, 14,6% do dímero e 56,5% do isômero (Tabela 2). Destaca-se que nenhum desses produtos foram observados em experimentos sem adição do catalisador, em qualquer tempo, temperatura ou razão catalisador:substratos. Por 48 h, na proporção catalisador:substratos de 1:1 mol, nenhum produto de reação, seja metátese de olefinas, seja isomerização, ocorreu com a piperina nas reações de metátese cruzada.
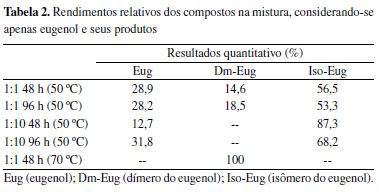
Aumentando o tempo reacional para 96 h, mantendo-se a razão catalisador:substratos de 1:1 mol, observou-se perfil similar ao cromatograma para o experimento realizado por 48 h (Figura 4B). Nenhum produto de metátese cruzada, metátese de olefinas ou isomerização da piperina foram observados. Mas houve aumento do rendimento de dímero de eugenol e eugenol isomerizado para cerca de 10 e 20% de rendimento, respectivamente. Relacionando eugenol e seus produtos, têm-se 28,2% de substrato, 18,5% do dímero e 53,3% do isômero do eugenol na mistura. Com rendimentos muito próximos aos obtidos nos experimentos realizados por 48 h (Tabela 2). Na reação por 48 h, com razão catalisador:substratos 1:10 mol, não foi observado dímero de eugenol nem outros produtos previstos de metátese da piperina ou de metátese cruzada (Figura 4C), sendo que, nessa reação, a piperina foi isomerizada com rendimento relativo de 4,5%. O mais notável foi o aumento do rendimento do isômero do eugenol de cerca de 17%, nas reações por 48 h com razão catalisador:substratos 1:1 mol, para cerca de 35% com razão catalisador:substratos 1:10 mol. Relacionando apenas o eugenol e seu isômero, tem-se na mistura 12% para eugenol e 87,3% para o iso-eugenol. No mesmo tempo de reação, mas com razão catalisador:substratos 1:1 mol, a porcentagem do isômero foi de 56,5%. Ainda para essa relação, no experimento por 96 h e razão catalisador:substratos 1:10 mol (Figura 4D), observaram-se na mistura 31,8% para eugenol e 68,2% para o iso-eugenol (Tabela 2). Em relação ao tempo de 48 h, não houve variação de porcentagem na mistura para iso-piperina (Tabela 1). Na Tabela 1S estão resumidas as porcentagens na mistura dos demais compostos observados e identificados. A reação de metátese cruzada não aconteceu quando eugenol e piperina são misturados com G1 como catalisador, nas condições estudadas, evidenciando que, nesse sistema, há preferência pela ligação dupla terminal do eugenol. Praticamente sem impedimento estérico nessa molécula, a metátese de olefinas do eugenol foi evidenciada, observando-se, porém, que G1 não foi capaz de promover a metátese de olefinas da piperina. Reações de homometátese foram realizadas para os substratos isolados (Figuras 2S e 3S), e nenhum produto foi notado por 48 h nas razões catalisador:substratos 1:1 e 1:10 mol para a piperina. Nas mesmas condições foi observada a formação do dímero do eugenol, o que parece evidenciar ainda mais a necessidade da existência de uma ligação dupla olefínica terminal. O estímulo para realização das reações de metátese cruzada do eugenol e piperina advém de estudos descritos na literatura, com metil-eugenol (ME),15 álcool cinamílico (AC) e acetato cilamílico (ACM),34 catalisados por catalisadores de Grubbs de primeira geração (G1), segunda geração (G2) e pré-catalisadores [RuCl2(PPh3)2piperidina] (LN-1) e [RuCl2(PPh3)2peridroazepina] (LN-2). Mesmo sem ligação dupla olefínica terminal, AC e ACM sofreram reação de metátese. Além disso, em todos os casos, houve reações sucessivas que geraram novas espécies ativas a partir da coordenação inicial do substrato. Assim, esperava-se que a coordenação inicial com o eugenol gerasse uma espécie ativa capaz de promover a metátese da piperina.15,34 Já em relação à formação do dímero do eugenol, produto de homometátese do eugenol, a partir da mistura dos dois substratos, o aumento da razão catalisador:substratos de 1:1 para 1:10 mol suprimiu a sua formação. Não se descarta a possibilidade da coordenação de duas moléculas de eugenol, uma vez que é conhecido que G1 perde a fosfina durante o processo reacional. Essa reação de caráter associativo deve dificultar a formação do intermediário ciclometalobutano, impedindo a metátese de olefinas, mas favorece a isomerização dos substratos, inclusive da piperina. A fim de confirmar a tendência de favorecimento do processo de metátese de olefina nos experimentos com catalisador:substratos de 1:1 mol, ensaios nessa razão por 48 h, em 70 ºC, foram realizados (Figura 5), havendo o consumo total do eugenol e formação de dm-eugenol com cerca de 20% na mistura. Relacionando apenas eugenol e dm-eugenol, 100% desse último foi notado. A 70 ºC, em 48 h, nenhuma transformação ocorreu com a piperina.
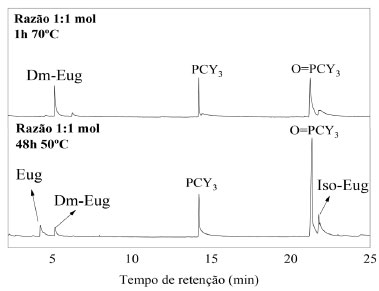 Figura 5. Cromatogramas da reação de metátese cruzada da piperina com o eugenol. Razão catalisador:substratos de 1:1 mol, por 48 h a 70 ºC. Eug (eugenol); Dm-Eug (dímero do eugenol); PCy3 (triciclohexilfosfina); O=PCy3 (triciclohexilfosfina oxidada); Iso-Eug (isômero do eugenol)
Para a complementação das análises de cromatografia gasosa, utilizaram-se os espectros de massas do produto da reação de metátese do eugenol (Figura 3S) e realizou-se a proposta para o mecanismo de fragmentação do dímero de eugenol formado (Figura 4S). A proposta de fragmentação foi baseada estudos sobre a comparação do espectro de massas do estilbeno com o de outras substâncias.35 De fato, a coordenação da piperina ao centro metálico de Ru ocorreu, uma vez que se observou a formação de iso-piperina (Figura 4C, 4D). É provavel que a coordenação tenha formado uma espécie inerte, incapaz estericamente de promover a formação do ciclometalobutano, intermediário dos processos de metátese. A principal proposta para a inércia de moléculas como a piperina, que possuem mais de uma ligação dupla olefínica, ou mesmo heteroátomos, como oxigênio com hibridação sp2, é a coordenação dupla33,15 (Figura 6). O efeito quelante estabiliza o complexo, dificultando a mobilidade necessária para formação dos intermediários reacionais. Com o acetato cinamílico, a coordenação dupla do oxigênio e da ligação dupla olefínica também dificultaram o processo de metátese.15 Outro exemplo foi a observação da coordenação dupla das duas ligações duplas olefínicas do norbornadieno nas reações de polimerização via metátese. Comparando com o similar norborneno, com apenas uma ligação dupla olefínica, há uma diminuição do rendimento de polimerização.36
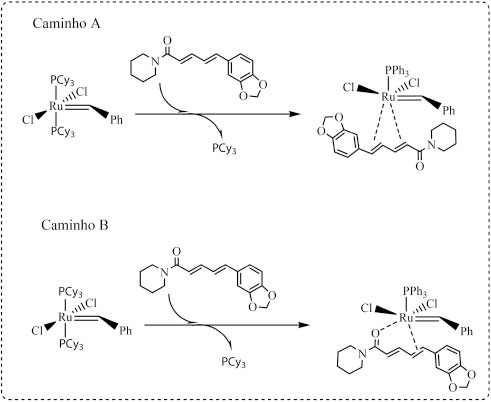 Figura 6. Mecanismo de formação da espécie inerte, incapaz estericamente de promover a formação do ciclometalobutano
CONCLUSÕES A partir do estudo apresentado, observou-se que a metátese cruzada não aconteceu, fato atribuído ao efeito quelante da coordenação dupla da piperina. O catalisador de Grubbs (G1) foi ativo para a metátese do eugenol e inativo para a metátese da piperina. O G1 apresentou preferência pela ligação dupla terminal, praticamente sem impedimento estérico, presente na molécula do eugenol, e não foi capaz de promover a metátese da piperina, mesmo tendo ocorrido a coordenação da piperina ao centro metálico de Ru do catalisador, fato confirmado pela observação de isômero da piperina. Processos de isomerização também foram observados para o eugenol, reforçando a ação catalisadora de G1 para esse tipo de reação. MATERIAL SUPLEMENTAR Informações adicionais (Tabela 1S, Figuras 1S-4S) estão disponíveis em http://quimicanova.sbq.org.br, na forma de arquivo PDF, com acesso livre.
AGRADECIMENTOS Os autores agradecem ao Programa de Pós-Graduação em Química (PPGQ-UESPI) e ao Laboratório GERATEC pela oportunidade no desenvolvimento desta pesquisa.
REFERÊNCIAS 1. Bernado-Gusmão K.; Pergher S. B. C.; dos Santos E. N.; Quim. Nova 2017, 40, 650 [Crossref]. 2. Patra S. G.; Das N. K.; Polyhedron 2021, 200 [Crossref]. 3. Santos, A. G.; Tese de Doutorado, Universidade Federal de Minas Gerais, Brasil, 2017. 4. Calderon, N.; Acc. Chem. Res. 1972, 5, 128 [Crossref]. 5. Carvalhais, P. L. E.; Dissertação de Mestrado, Universidade Federal de Minas Gerais, Brasil, 2019. 6. Guo, C.; Li, X.; Zhu, X.; Chu, W.; Liu, S.; Wang, Y.; Zeng, P.; Guo, S.; Xu, L.; Chin. J. Catal. 2018, 39, 37 [Crossref]. 7. Nicolaou, K. C.; Bulger, P. G.; Sarlah, D.; Angew. Chem. 2005, 44, 4490 [Crossref]. 8. Nienałtowsk, T.; Krzesińsk, P.; Baumert, M. E.; Skoczen, A.; Suska-Kauf, E.; Pawłowska, J.; Kajetanowicz, A.; Grela, K.; ACS Sustainable Chem. Eng. 2020, 8, 18215 [Crossref]. 9. Schrock, R. R.; J. Mol. Catal. A: Chem. 2004, 21, 213 [Crossref]. 10. Novak, B. M.; Grubbs, R. H.; J. Am. Chem. Soc. 1988, 110, 960 [Crossref]. 11. Bielawski, C. W.; Grubbs, R. H.; Prog. Polym. Sci. 2007, 32, 1 [Crossref]. 12. Matos, J. M. E; Batista, N. C.; Carvalho, R. M.; Santana, S. A. A.; Puzzi, P. N.; Sanches, M.; Lima-Neto, B. S.; Quim. Nova 2007, 30, 431 [Crossref]. 13. Buffon, R.; Chemkeys 2002, 10, 9650 [Crossref]. 14. Calixto, J. B.; Cienc. Cult. 2003, 55, 3. 15. Vieira, V. B.; da Silva, E. A.; Carvalho Jr., V. P.; Lima-Neto, B. S.; Sá, J. L. S.; Quim. Nova 2020, 43, 24 [Crossref]. 16. Aguiar, C. P.; Lopes, D. C.; Borges, R. S.; Chem. Data Collect. 2018, 17, 138 [Crossref]. 17. Quija, C. R.; Chorilli, M.; Crit. Rev. Anal. Chem. 2020, 50, 62 [Crossref]. 18. Hua, S.; Liu, J.; Zhang, Y.; Li, J.; Zhang. X.; Dong, L.; Zhao, Y.; Fu, X.; Food Science & Nutrition 2019, 7, 3443 [Crossref]. 19. França, A. A. C.; Pereira, A. D.; Fernandes, K. A.; Costa, A. K. B.; Ramos, M. A.; Martins, F. A.; Batista, N. C.; Matos, J. M. E.; Sá, J. L. S.; Rev. Virtual Quim. 2021, 13, 310-322 [Crossref]. 20. Dias, M. S.; Junior, E. P. V.; Santos, B. C. dos; Martins, F. A.; Almeida, P. M.; Peron, A. P.; An. Acad. Bras. Cienc. 2021, 93, e20201772 [Crossref]. 21. Dzoyem, J. P.; Boulens, N.; Allémann, E.; Delie, F.; Plant. Med. International Open 2021, 8, 3, 122 [Crossref]. 22. Bontempo, M.; Pimenta e Seus Benefícios à Saúde, Alaúde Editorial; São Paulo, 2007. 23. Choi, J. W.; Lee, S. K.; Kim, M. J.; Kim, D. G.; Shin, J. Y.; Zhou, Z.; Jo, I. J.; Song, H. J. Bae, G. S.; Park, S. J.; Mol. Med. Rep. 2019, 20, 3709 [Crossref]. 24. Shoba, G.; Joy, D.; Joseph, T.; Majeed, M.; Rajendran, R.; Srinivas, P. S. S. R.; Planta Med. 1998, 64, 353 [Crossref]. 25. Azam, S.; Park, J-U.; Kim, I-S.; Choi, D-K.; Biomedicines 2022, 10, 154 [Crossref]. 26. Nikhat, P.; Jabeen, A.; Prasad, B.; J. Adv. Sci. Res. 2021, 12, 8 [Crossref]. 27. Zheng, G.Q.; Kenney, P.M.; Lam, L. K. T.; J. Nat. Prod. 1992, 55, 999 [Crossref]. 28. Nejad, S. M.; Ozgunes, C.; Basaran, N.; Turk. J. Pharm. Sci. 2017, 4, 201 [Crossref]. 29. Vidal, L. V. O.; Furuya, W. M.; Graciano, T. S.; Schamber, C. R.; Silva, L. C. R.; Santos, L. D.; Souza, S. R.; Rev. Bras. Saude Prod. Anim. 2007, 8, 335 [Crossref]. 30. Bendre, R. S.; Rajput, J. D.; Bagul, S. D.; Bendre P. S. K.; Nat. Prod. Chem. Res. 2016, 4, 3 [Crossref]. 31. Saracino, I. M.; Foschi, C.; Pavoni, M.; Spigarelli, R.; Valerii, M. C.; Spisni, E.; Antibiotics 2022, 11, 73 [Crossref]. 32. Carey, P. J.; Honors Teses, University of Tennessee, Chattanooga, USA, 2015. 33. Bizzarri, B. M.; Fanelli, A.; Piccinino, D.; De Angelis, M.; Dolfa, C.; Palamara, A. T.; Nencioni, L.; Zippilli, C.; Crucianelli, M.; Saladino, R.; Catalysis 2019, 9, 983 [Crossref]. 34. Sousa, D. A.; Meneses, P. S.; Gois, P. D.S.; Silva, E. A.; Carvalho. Jr., V. P.; Lima-Neto; B. S.; Sá, J. L. S.; Lett. Org. Chem. 2020, 17, 596 [Crossref]. 35. Güsten, H.; Klasinc, L.; Kramer, V.; Marsel, J.; Org. Mass Spectrom. 1974, 8, 323 [Crossref]. 36. Sá, J. L. S.; Vieira, L. H.; Nascimento, E. S. P.; Lima-Neto, B. S.; Appl. Catal., A 2010, 374, 194 [Crossref]. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access