Artigo
|
|
| Liberação lenta do óleo de copaíba adsolubilizado em hidróxidos duplos lamelares: um material promissor para pomadas cutâneas Slow-release of copaiba oil adsolubilized into layered double hydroxides: a promising material for skin ointments |
|
Daiane A. R. NogueiraI,*; Silvia JaergerI; Margani Taise FinII; Rubiana Mara MainardesII; Leandro ZattaIII; Luciano TormenIV; Rafael MarangoniI
I. Departamento de Química, Universidade Estadual do Centro-Oeste, 85040-080 Guarapuava - PR, Brasil Recebido em: 07/01/2022 *e-mail: dnogueira.unicentro@outlook.com In this work, Zn/Al layered double hydroxides intercalated with dodecyl sulfate ion (DS) in molar ratios (Zn2+/Al3+) 2:1, 3:1 and 4:1 were synthesized by co-precipitation method and then they were adsolubilized with essential oil of copaiba in the concentrations of 3, 5, 10, 13 and 15% wt/wt to be used as carriers in therapeutic ointments for skin injury treatments. The XRD results showed a diffraction pattern corresponding to the structure of LDHs with the presence of diffraction peaks referring to the basal reflection planes. Typical stretching and vibration bands of copaiba essential oil in FTIR spectra confirmed the adsolubilization process. The oil release plateau in the ointment was above 80% at normalized values in a time of approximately 20 h, the time required for dissolution and release of molecules adsorbed in the layered structure of the material for molar ratios 2:1 and 3:1 and the release of the solubilized molecules in the interlayer space. In contrast, LDH with a 4:1 molar ratio showed slower release and did not reach the plateau in 48 h, as this material has the ability to retain oil molecules in the LDH for longer, causing a slower release in relation to other molar ratios. The analysis for the non-intercalated copaiba oil showed a gradual increase in the concentration of the oil in the ointment, indicating a different curve profile. INTRODUÇÃO Diariamente muitas pessoas adquirem alguma forma de lesão de pele, seja por abrasão, corte, queimadura ou por doenças cutâneas pré-malignas ou malignas como a psoríase e o carcinoma basocelular, essas lesões podem atingir a derme, epiderme e outras camadas mais profundas da pele.1 Em geral, a forma mais comum para tratar essas lesões é a administração do medicamento diretamente no local por meios de via tópica.2 As pomadas e curativos formam uma película protetora semi-oclusiva e respirável que permite a hidratação do local, além de ser menos invasivo em comparação com a administração parenteral, diminui os riscos das toxicidades sistêmicas.1-3 Porém, o uso de curativos pode causar grande desconforto para a pessoa lesionada, pois a cada troca, ocorre o aumento da dor no paciente porque as terminações nervosas da pele são constantemente agredidas.4 Nesses casos, o uso de pomadas com princípios ativos de liberação lenta torna-se uma excelente alternativa de tratamento, submetendo a lesão a quantidade correta de fármaco por um período prolongado, sem a necessidade de trocas de curativos. A pomada mais empregada dentre os medicamentos de uso tópico é a sulfadiazina de prata 1%, a qual é indicada para profilaxias, tratamento de queimaduras e áreas de abrasão em enxertos de pele. Ela é classificada como anti-infectante, porém, não possui propriedades cicatrizantes, sendo necessário então o uso de medicamentos complementares, elevando os custos do tratamento.5 Outros compostos que podem ser utilizados como tratamento de lesões na pele são os princípios ativos naturais, muito utilizados na medicina popular desde os povos mais antigos, dentre alguns já estudados podem ser citados a babosa e aroeira,6 Hibiscus hirtus, Heliotropium indicum (fedegoso),7 Lippia gracilis Schauer (Alecrim da Chapada),6 calêndula e girassol,8 óleos de bergamota, camomila, cravo, gengibre, rosa, melaleuca e copaíba,7 dentre outros. O óleo de copaíba extraído do tronco da árvore da Copaífeira Langsdorffii é um líquido viscoso, de coloração que vai do amarelo ao marrom (dependendo da região da qual a árvore é plantada). O óleo possuí propriedades antimicrobiana, antibacteriana, anti-inflamatória, analgésica, anti-tumoral8,9 e recentemente foi descoberto sua atividade antinociceptiva tópica. Uma desvantagem dos óleos essenciais, em geral, é seu valor agregado, além de sua baixa estabilidade molecular, portanto, apesar de terem inúmeros benefícios conhecidos, ainda são realizados poucos estudos e pouca aplicabilidade em escala industrial. Uma alternativa para redução de custos seria a utilização de um sistema de liberação lenta para esses óleos, considerando que nos casos de medicamentos tópicos reduz a necessidade de aplicação em curto espaço de tempo, diminuindo a quantidade de produto a ser utilizado. As moléculas do óleo também seriam protegidas da luz para evitar oxidação e degradação de seus constituintes, garantindo uma estabilidade molecular por mais tempo e aumentando a eficácia do produto.10 Um sistema de liberação controlada necessita de um carreador, ou seja, um material capaz de absorver as moléculas do composto e liberá-las por tempo prolongado. Dentre muitos carreadores já estudados, os materiais lamelares são uma classe de materiais que funcionam bem para esse fim.11-24 São compostos de estrutura cristalina formada pelo empilhamento de unidades denominadas lamelas. Esses materiais possuem um ambiente favorável para intercalações topotáticas de natureza hospede/hospedeiro, em que o reticulo cristalino é capaz de comportar espécie em sua estrutura, em um espaço chamado de espaço interlamelar (denomina-se hospedeiro), e a espécie que se hospeda (hospede) terá suas características determinada pela estrutura da lamela hospedeira.11,18,25,26 Essas lamelas se formam através de ligações covalentes e permanecem unidas entre si por ligações fracas, sendo ligações de Van der Waals se as lamelas forem neutras e ligações eletrostáticas se as lamelas forem eletricamente carregadas. A classificação com base à natureza elétrica das lamelas, pode ser dividida entre lamelas negativas, neutras e positivas.24,27 Dentro dessa classificação, os hidróxidos duplos lamelares (HDL's) são compostos que possuem lamelas com resíduo de carga positiva e são derivados da estrutura da brucita a qual possui sítios octaédricos regulares com centro metálicos de magnésio coordenados com íons hidroxilas, porém, a estrutura dos HDL's não forma sítios octaédricos regulares, mas sim achatados na direção do empilhamento das lamelas. As unidades octaédricas compartilham vértices com três octaédricos adjacentes, formando uma lamela bidimensional infinita na direção cristalográfica a. Os cátions divalentes são parcialmente substituídos por cátions trivalentes, fazendo com que o composto apresente um resíduo de carga positiva e, dessa forma, a lamela apresenta dois cátions metálicos com cargas 2+ e 3+, podendo ainda variar as proporções entre eles e espécies aniônicas no domínio interlamelar neutralizando as cargas.28 A região interlamelar de HDL pode ser expandida por grandes ânions, como por exemplo surfactantes, aumentando a capacidade de intercalação e permitindo que um adsorbato orgânico hidrofóbico possa ser intercalado nesta fase orgânica. Esse processo é denominado de adsolubilização.17,27,19-31 O objetivo deste trabalho consiste em formular um material com óleo essencial de Copaíba adsolubilizado em hidróxidos duplos lamelares (HDL) de Zn/Al em razões molares variadas, a escolha desse conjunto de íons consiste em usar como referência as argilas medicinais que são muito utilizadas para tratamentos de pele, e que, em sua grade maioria, possuem esse grupo de metais.32 A proposta do trabalho consiste também em avaliar o comportamento do composto em liberação lenta ao ser adicionado a um excipiente de pomada de tratamentos dermatológicos.
PARTE EXPERIMENTAL Materiais Foram utilizados os sais nitrato de zinco hexahidratado (Zn(NO3)2·6H2O P.A. Synth) e nitrato de alumínio nonahidratado (Al(NO3)3·9H2O P.A. Neon) para as sínteses de HDL 2:1, 3:1 e 4:1, respectivamente. Hidróxido de sódio em micro pérolas (NaOH P.A. Synth) e dodecil sulfato de sódio (DSS NaC12H25SO4 95% Neon). O óleo de copaíba utilizado para adsolubilização foi gentilmente disponibilizado pela FERQUIMA pureza 100%. Os reagentes e materiais utilizados no experimento de liberação foram água destilada e álcool etílico 95% (Synth) como meio receptor, e membrana de nitrocelulose do tipo filtro de 0,45 µm HA 47 mm (Merck milipore) como barreira protetora. A extração foi realizada com n-hexano grau cromatográfico (98%). A pomada base utilizada foi adquirida em uma farmácia de manipulação VITAFARMA, com formulação composta por vaselina sólida e lanolina. Síntese dos hidróxidos duplos lamelares Os hidróxidos duplos lamelares foram preparados pelo método de co-precipitação a pH constante, e em temperatura ambiente. As solução dos sais nitrato de zinco nas concentrações de: 0,48 mol L-1 (2:1), 0,62 mol L-1 (3:1) e 0,69 mol L-1 (4:1), e nitrato de alumínio nas concentrações de: 0,24 mol L-1 (2:1), 0,21 mol L-1 (3:1) e 0,17 mol L-1 (4:1), foi gotejada para cada razão molar simultaneamente com uma solução de hidróxido de sódio 1 mol L-1, em um frasco reacional contendo 4 vezes a quantidade em mols do sal DSS em relação a capacidade de troca aniônica dos HDL's, sob agitação constante até o pH atingir o valor de aproximadamente 9. Em seguida, o precipitado formado foi lavado 5 vezes com água destilada e seco a 80 °C por 24 h, posteriormente o material foi macerado e armazenado. Obtendo-se uma série de HDL's intercalados com os ânions dodecilsulfato (DS, chamados de HDL/DS) com diferentes relações estequiométricas denominados Zn2Al/DS, Zn3Al/DS, Zn4Al/DS, em relação ao HDL's provenientes das relacões estequiométricas 2:1, 3:1 e 4:1 (M2+/M3+), respectivamente. Adsolubilização do óleo de copaíba Os HDL/DS obtidos no passo anterior foram misturados e macerados com óleo de copaíba por 10 minutos até a total incorporação do óleo no HDL, nas proporções de 3, 5, 10, 13 e 15% (m/m) de óleo em relação aos HDLs de partida, obtendo-se então os HDL's de ZnAl/DS adsolubilizados com óleo de copaíba (HDL/Copa), denominados Zn2Al/CopaX%, Zn3Al/CopaX% e Zn4Al/CopaX%, em que X equivale ao % (m/m) de óleo adsolubilizado no HDL, de forma a se obter 5 amostras para cada HDL, respectivamente. Incorporação do HDL/Copa na pomada base A incorporação dos HDL/Copa em pomada base procedeu-se com a mistura de 40% (m/m) de HDL/Copa em relação a base da pomada composta por 46,63% de vaselina sólida, lanolina anidra 26,67%, BHT 0,03% e glicerina 26,67%. Com a finalidade de promover uma boa dispersão do material a suspensão foi mantida sob agitação constante por aproximadamente 30 minutos a temperatura ambiente. Os HDL/Copa contendo 10% de óleo foi selecionado para os testes de liberação, pois nessa concentração o material encontrou-se em pó diferentemente daqueles contendo mais que 10% do óleo, os quais apresentavam uma mistura pastosa. Assim, foi possível obter uma pomada mais homogênea para realização dos testes de liberação. Testes de liberação Foram realizados em sistemas de células de Franz da marca Hanson Research, placa de agitação da Mixdrive 6 e banho termostatizado Solab. Utilizaram-se membranas de nitrocelulose, e as células foram mantidas em agitação constante de 400 rpm e em banho termostatizado a 37 °C (temperatura corpórea), e o meio receptor foi uma solução etanólica (70/30 v/v), respectivamente. As amostras avaliadas foram: HDL/Copa 10% nas três razões molares (2:1, 3:1 e 4:1), e com concentração de HDL/Copa - pomada de 40% (m/m) respectivamente. As alíquotas retiradas foram de 1 mL, o meio receptor foi repreenchido com a solução etanólica. Os tempos de coleta foram: 0,5, 1, 2, 3, 4, 6, 9, 18, 24, 36, 48, 60 e 72 h. As aliquotas foram, então, tratadas e caracterizadas através da técnica de cromatografia gasosa. Caracterizações As medidas de Difratometria de Raios X (DRX) foram realizadas em um difratômetro de raios X modelo D2 Phaser da Bruker, utilizando radiação de cobre Kα (λ; = 1,5418 Å). As análises foram conduzidas em porta amostras de acrílico com velocidade de varredura de 5 a 70° 2θ e incremento de 0,07° min-1. As análises de Espectroscopia na região do Infravermelho com transformada de Fourier (FTIR), foram realizadas, em um equipamento Frontier Perkim-Elmer spectrometer com módulo de refletância total atenuada (ATR) em método de cristal de diamante, os espectros de FTIR foram obtidos em um intervalo de 4000 a 400 cm-1, com resolução de 4 cm-1 e acumulação e 32 varreduras. As análises termogravimétricas (TG /DSC) foram realizadas em um equipamento SDT Q600 da TA Industries, no Laboratório de Física aplicada à materiais da Unicentro. As análises foram realizadas em módulo de DSC-TG Standard, em cadinho de alumina e atmosfera de ar em 100 mL/min, a rampa de aquecimento foi de 8,33 °C min-1 até a temperatura de 1000 °C. As amostras realizadas foram, HDL/DS (2:1, 3:1 e 4:1) óleo de copaíba (puro), HDL/Copa 3, 5, 10, 13 e 15%. As análises cromatográficas foram realizadas em um equipamento MS QP2010 ultra da marca Shimadzu, e GC-2010 plus Shimadzu. Utilizou-se uma coluna DB-5 MS, espessura de 0,25 µm, comprimento de 30 m e diâmetro de 0,25 mm. As extrações das amostras foram feitas com volume de 750 µL para 250 µL de hexano, agitação em agitador vórtex por 2 minutos e centrifugadas por 3 minutos. A injeção foi realizada manualmente, volume de 2 µL. O método de análise desenvolvido para o óleo de copaíba ocorreu em temperatura inicial de 60 °C, a temperatura do injetor em 190 °C e modo de injeção splitless. A rampa de aquecimento foi de temperatura inicial em 60 °C para 125 °C com aquecimento de 10 °C min-1, passando para 200 °C min-1 com aquecimento de 5 °C min-1 com tempo de análise de 22,5 minutos.
RESULTADOS E DISCUSSÃO Caracterização dos HDLs sintetizados adsolubilizados com o óleo de copaíba A Figura 1 apresenta os difratogramas de raios X (DRX) para os materiais sintetizados, sendo esses os hidróxidos duplos lamelares de Zn/Al intercalados com dodecilsulfato de sódio (HDL/DS) e os materiais adsolubilizados com o óleo de copaíba (HDL/Copa) para as diferentes razões molares e concentrações de óleo sintetizadas.
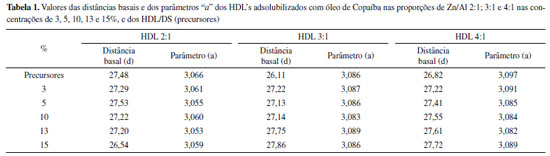
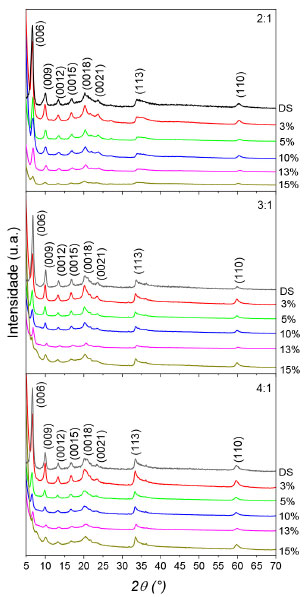 Figura 1. Difratometrias de raios X para as amostras de HDL/DS (2:1, 3:1 e 4:1, Zn/Al) e HDL/Copa, com as suas respectivas variações de percentual do óleo de copaíba de 3 a 15%
Os HDL/DS sintetizados apresentaram padrão de difração correspondente a estrutura dos hidróxidos duplos lamelares comumente encontrado na literatura,30,33 em que se observa a presença de picos de difração referentes aos planos de reflexão basal na direção cristalografica c, correpondente ao empilhamento das lamelas (00l).28,34 As distâncias basais foram calculadas pela equação de Bragg, e corrigidos de acordo com os cálculos de Hermans,35 e os valores obtidos foram de 27,48 Å para Zn2Al/DS, 26,11 Å para o Zn3Al/DS e 26,82 Å para o Zn4Al/DS. Esses valores estão de acordo com os reportados na literatura indicando a formação da fase lamelar de HDL intercalado com os ânions dodecilsulfato.36,37 Como a quantidade de Al3+ é maior nas razões molares de Zn/Al 2:1 > 3:1 > 4:1 respectivamente, o alumínio é proporcional à quantidade de ânions dodecilsulfato intercalados por possuir carga 3+, pois uma carga residual maior na lamela permite uma maior intercalação de ânions (DSS) no espaço lamelar, aumentando as repulsões das cadeias de carbono do DS. Os DRX dos HDLs adsobulizados com óleo copaíba indicam que os materiais obtidos permanecem com estrutura lamelar bem organizada, sendo observada pela sequencia de picos basais (00l). Onde observou-se uma sequencia basal de picos até a ordem (0 0 12), perdendo ordenamento do empilhamento basal de forma progressiva a partir do pico (0 0 15) com o aumento do percentual de óleo de copaíba nos materiais. Com aumento da porcentagem de óleo adsolubilizado, pôde-se observar um pequeno deslocamento nos picos (0 0 3) para menores ângulos em 2θ com o concomitante aumento na distância basal, indicando a presença do óleo de copaíba intercalado junto com o DS na região interlamelar dos materiais (Tabela 1). As distâncias basais dos HDL's incorporados como óleo de copaíba também foram calculados pela lei de Bragg e corrigidos de acordo com os cálculos de Hermans.35 A pequena variação na distância basal é em função do DS já provoca um aumento em d, suficiente para alocar as moléculas orgânicas do óleo de copaíba, isso porque as cadeias carbônicas do dodecilsulfato de sódio são muito volumosas, logo, a distância basal não modifica seus valores consideravelmente com o processo da adsolubilização. Alguns trabalhos reportados na literatura também observam essa pequena variação, como, por exemplo, artigo de Cursino,36 que reporta a adsolubilização de benzofenona em compostos de Zn2Al/DS e Zn4Al/DS, os quais não alteraram significativamente a distância basal de (26,2 Å e 26,5 Å). O mesmo fenômeno pode ser observado em materiais de Zn/Al intercalados com dodecilbenzeno sulfonato e adsolubilizados com a mesma molécula orgânica (benzofenona).
A Tabela 1 descreve os valores dos parâmetros de rede "a" (a = 2*d (110)). É possível observar, que o valor do parâmetro de rede aumenta com o aumento da razão molar nos materiais precursores. Como a está relacionado com a distância entre os metais na estrutura lamelar, ou seja, o aumento da proporção de Zn2+ em relação ao Al3+, modifica a distância entre os metais porque o raio iônico do Zn2+ é maior (0,74 Å), em comparação com raio iônico do Al3+ (0,53 Å). Os valores obtidos para a comprovam que a série de materiais de HDL Zn/Al com distintas razões molares foram satisfatoriamente sintetizadas. Os espectros de infravermelho (FTIR) realizados para os compostos HDL/DS (2:1, 3:1 e 4:1), HDL/Copa (3, 5, 10, 13 e 15%) e para o óleo de copaíba puro são representados na Figura 2.
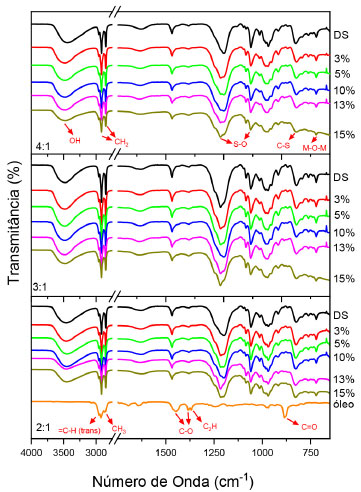 Figura 2. Espectros de infravermelho para as amostras de HDL/DS (2:1, 3:1 e 4:1, Zn/Al) e HDL/Copa, com as suas respectivas variações de percentual do óleo de copaíba de 3 a 15%, e do óleo de copaíba puro
Todos os espectros analisados apresentaram um perfil similar, com bandas nas mesmas regiões, nas quais, as bandas nas regiões de 729 cm-1 representam vibrações de ligações M-O-H, proveniente das lamelas dos HDL. Em 827 cm-1 a banda refere-se à ligação C-S do ânion dodecilsufato. As bandas em 1052 e 1210 cm-1 são referentes aos estiramentos simétricos e assimétricos das ligações de S-O respectivamente, também provenientes do DSS, indicando mais uma vez a presença do mesmo na estrutura lamelar dos HDL's. As bandas em 2869 e 2926 cm-1 são pertencentes aos modos vibracionais da molécula do CH2 e a banda em 3439 é referente aos movimentos vibracionais das ligações O-H das lamelas e das moléculas de água adsorvidas ou presentes na região interlamelar ou adsorvidas na lamela.30,38,39 Ao analisar o espectro do óleo de copaíba, observa-se bandas relacionadas aos modos vibracionais das cadeias orgânicas sendo elas: 2927 e 2853 cm-1, referentes a estiramentos simétricos e assimétricos do grupo metila (CH3), bandas em 1464 e 1374 cm-1, as quais são características do desdobramento da ligação CH2 e, para o óleo de copaíba, pode-se identificar os principais picos nas posições em 885 cm-1 correspondentes aos estiramentos carbono com duplas ligações e oxigênio (C=O). Essa banda não aparece nos espectros dos materiais intercalados possivelmente por uma interação entre o óleo e o ambiente hidrofóbico após a adsolubilização fazendo com que a banda tenha um deslocamento ou sobreposições.40 A banda em 1368 cm-1 refere-se a C2H, as bandas em 1447 cm-1 e 1384 cm-1 corresponde as ligações simplesde carbono e oxigênio a (C-O). A posição da banda vibracional em 3070 cm-1 está associada ao estiramento de duplas ligações em carbonos ligados por ligação simples em hidrogênio (=C-H(trans)), assim como os modos vibracionais em 2930 e 2852 cm-1 que correspondem aos estiramentos de CH3 e CH2, respectivamente.7,9 Os espectros das amostras de HDL/Copa apresentam picos semelhantes para o conjunto das amostras, onde é possível verificar que a banda em 722 cm-1 (M-O-M) proveniente das lamelas dos HDL's, corroborando os resultados observados nos difratogramas de raios X (Figura 1) que indicam que o material permanece na estrutura lamelar mesmo após a intercalação, as bandas a baixo deste valor que seriam referentes as ligações M-O e M-O-M, não podem ser visualizadas, pois o sistema do equipamento só permite analises até 650 cm-1, em modo ATR. As bandas 1056 e 1204 cm-1 (S-O) indicando a presença do DS presente na estrutura lamelar, as bandas em 1465, 2858 e 2938 cm-1 (CH2) dos componentes do óleo adsolubilizado e a banda em 3490 cm-1, é proveniente do movimento da ligação O-H da água adsorvida ou interlamelar como já citado. As análises termogravimétricas (TG/DSC) realizadas para as amostras de HDL/DS nas razões molares 2:1, 3:1 e 4:1, para os HDL/Copa nas concentrações (3, 5, 10, 13 e 15%), e para o óleo de copaíba puro estão presentes na Figura 3.
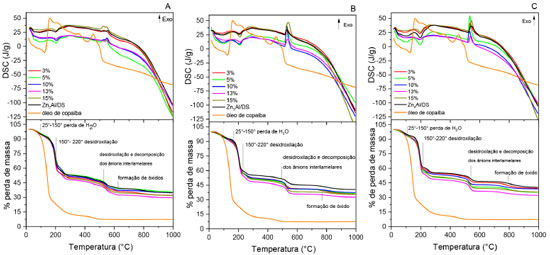 Figura 3. Análises de TGA/DSC para os HDL/DS, HDL/Copa nas concentrações de 3%, 5%, 10%, 13% e 15% , nas razões 2:1(A), 3:1(B) e 4:1(C) e para o óleo de copaíba
As curvas termogravimétricas das amostras dos HDLs precursores seguem uma série muito semelhante de eventos térmicos, o primeiro evento se inicia de uma temperatura ambiente até aproximadamente 150 °C, trata-se de um evento endotérmico, referente à eliminação de água interlamelar e de água adsorvida na superfície do sólido. O segundo evento ocorre na faixa de 154 a 220 °C (evento endotérmico), correspondente à desidroxilação das lamelas. Essa também é a faixa de temperatura em que ocorre a maior perda de massa. Eventos até aproximadamente 480 °C podem ser caracterizados pela decomposição do restante das hidroxilas e dos ânions intercalados no espaço lamelar. Acima dessa temperatura, ocorre a formação dos óxidos de zinco e alumínio de acordo com a composição dos HDL's.37 Para o óleo de copaíba puro, o primeiro evento térmico que ocorre é um evento endotérmico com cerca de 75% da perda de massa, em uma faixa de temperatura entre a temperatura ambiente de 25 °C e aproximadamente 183 °C referente a queima dos sesquiterpenos presentes na amostra. O evento exotérmico que ocorre entre as temperaturas de 330 até 480 °C corresponde à queima de diterpenos da amostra.9 Nas três razões molares é possível perceber que o material com maiores percentagens de óleo (13% e 15%) foram os que tiveram uma menor percentagem de resíduo (formação de óxido). Isso se deve ao fato da maior quantidade de óleo, seja ele adsolubilizado ou adsorvido no material, gerando uma maior quantidade matéria orgânica queimada, e menor percentagem de resíduo. Quanto ao perfil térmico geral, todas as amostras obtiveram uma quantidade menor de resíduo em comparação aos materiais precursores, indicando que houve adsolubilização do óleo em todas as concentrações. As curvas de TGA/DSC mostraram que o material de razão molar Zn2Al/DS obteve uma maior quantidade de perda de massa em relação aos materiais Zn3Al/DS e Zn4Al/DS, isso devido ao fato do material citado intercalar uma maior quantidade de DS e, dessa forma, possuir mais matéria orgânica e gerar menos resíduos. Quando comparados os materiais 3:1 e 4:1, os valores das análises foram muito semelhantes, indicando que o DS está em proporções muito parecidas nos dois materiais. Uma hipótese atribuída a essa questão refere-se ao posicionamento das moléculas de DS no espaço lamelar. Quando as moléculas intercalam em posição mais linear, as mesmas permitem uma quantidade maior de intercalação, processo contrario de quando as moléculas intercalam na posição mais horizontal, diminuindo a quantidade intercalada.41 Testes de liberação do óleo de copaíba presente nos HDL sintetizados Os materiais foram dispersos em base de pomada utilizada para queimaduras, essa dispersão torna-se essencial porque as pomadas são de mais fácil aplicação em feridas cutâneas e são capazes de manter a umidade da pele, além de tornar possível, eventualmente, a dispersão de mais compostos ativos,5 visando assim tornar o experimento de liberação o mais próximo da sua potencial aplicação. Optou-se pelo material de adsolubilização na concentração de 10% de óleo de copaíba para fazer os testes de liberação, pois são os materiais que melhor dispersaram na pomada de base e que carregam a maior quantidade de óleo, nesta condição. A Figura 4 apresenta os espectros na região do infravermelho médio para as pomadas obtidas pela dispersão dos materiais HDL/Copa10%:
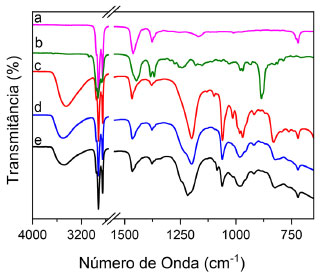 Figura 4. Espectros de infravermelho para a pomada base (a), óleo de copaíba (b), Zn2Al/Copa10% (c), Zn3Al/Copa10% (d) e Zn4Al/Copa10% (e)
Os espectros dos HDL/COPA incorporados na pomada apresentaram bandas características de todos os precursores, confirmando assim que o mesmo manteve sua estrutura lamelar adsolubilizada com os respectivos óleos, mesmo após a incorporação do mesmo na pomada. As bandas apresentadas coincidem com os valores já apresentados: em 819 cm-1, refere-se as ligações C-S correspondente ao DS intercalado no material, as bandas de 1060 e 1206 cm-1 correspondem as estiramentos simétricos e assimétricos das ligações S-O, também pertencentes ao DS, bandas de 1377 e 1460 cm-1 aos desdobramentos das ligações CH2 e 2863 e 2926 cm-1 são vibracionais das metilas presentes nas cadeias orgânicas e, em 3481, a banda se refere ao estiramento da ligação O-H das moléculas de água interlamelares ou adsorvidas na superfície das lamelas.30,38,41 Testes de liberação Os materiais lamelares podem ser classificados como excipientes a base de materiais inorgânicos e, muitas vezes, são utilizados para liberações controladas por apresentarem boa compatibilidade com espécies orgânicas, além de serem biocompatíveis. Apresentam síntese de baixo custo e muitas vezes de elevada pureza, além de possuírem propriedades de trocas aniônicas.26,34,41,42 A liberação controlada ou sustentada de fármaco é determinada como a liberação gradativa de um fármaco de administração oral ou tópica na qual respeita-se as condições do sistema em que o princípio ativo será liberado.43 A liberação controlada tem por objetivo manter a dose terapêutica com o menor número de administrações de doses possíveis, ou seja, manter por mais tempo o princípio ativo no organismo e abaixo do nível de toxicidade. A toxicidade avaliada para o óleo de copaíba e reportada na literatura possui um valor baixo, com testes in vivo. Para Sachetti,44 os valores foram de 2000 mg/kg, para Fenandes et al. a DL50 estimada foi de 3090 mg/kg. Portanto, é seguro trabalhar com a intercalação desse oléo, por baixa toxicidade. Os componentes liberados nas cromatografias do óleo de copaíba podem ser observado na Figura 1S, os quais são condizentes com os reportados na literatura,7-10,44,45 contendo basicamente sesquiterpenos e diterpenos. O composto majoritário e de liberação mais rápida no óleo de copaíba é o β-cariofileno, o qual é responsável pelas propriedades terapêuticas microbicidas, anti-inflamatórias e cicatrizantes.8 Os cromatogramas obtidos nas análises de cromatografia para os compostos HDL/Copa na concentração de 10%, nas três razões molares (2:1, 3:1 e 4:1) já incorporados na pomada, seguem um padrão. A Figura 5 mostra a relação da área do pico do b-cariofileno obtidas nos cromatogramas com analises dos materiais HDL/Copa e de um material preparado apenas com óleo de copaíba na pomada base (branco), sem a interferencia do HDL.
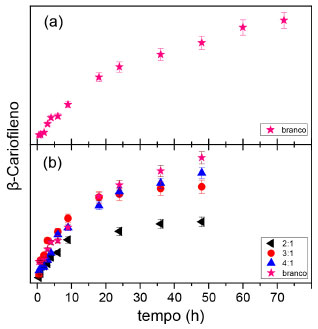 Figura 5. Curvas da área do pico do composto β-cariofileno presente no óleo de Copaíba das amostras Zn2Al/Copa10% (  ), Zn3Al/Copa10%( ), Zn3Al/Copa10%( ), Zn4Al/Copa10% ( ), Zn4Al/Copa10% ( ) entre os tempos de 0,5 h - 48 h em (b) e amostra com óleo de copaíba livre na pomada base-branco( ) entre os tempos de 0,5 h - 48 h em (b) e amostra com óleo de copaíba livre na pomada base-branco( ) no tempo de 0,5 h - 72 h (a) ) no tempo de 0,5 h - 72 h (a)
Quando comparados, pode-se perceber que o material puro possui uma área de pico muito maior em relação a todos os materiais de interesse. Foram realizadas analises complementares até o tempo de 72 h para o branco (mostrado no gráfico (a) da Figura 5) para analisar melhor o comportamento do óleo puro. Os dados obtidos indicaram que o material permanece aumentando sua concentração no meio reacional, ou seja, o óleo comporta-se com um perfil diferente quando não está intercalado no material precursor, o que já seria esperado, considerando que as moléculas do óleo estariam livres na pomada. Porém, o princípio ativo de forma livre não é interessante nos casos de óleos essenciais, porque as moléculas desses compostos são volateis e a concentração do produto diminuiria depois de algum tempo, a instabilidade física em função da degradação térmica nesse caso também se torna um empecilho.7,10 Outra questão a ser abordada se refere aos cromatogramas indicarem uma liberação rápida do β-cariofileno para o meio reacional, o que sugere que o material não manterá concentração por muito tempo, pois será rapidamente absorvido, ou seja, com resultados opostos ao objetivo principal do trabalho. As normalizações das curvas foram realizadas em função do ponto com maior liberação da curva e são apresentadas na Figura 6, foi possível perceber que, para os compostos de HDL/Copa nas razões molares de 2:1 e 3:1, o tempo de 48 h é suficiente para que os compostos se encontrem em equilíbrio, enquanto que para razão molar de 4:1 o composto continua a aumentar sua porcentagem de liberação. Isso pode ocorrer devido ao fato do material HDL/Copa 4:1 possuir mais óleo adsolubilizado e menos DS intercalado como já observado nos raios X (Figura 2) apresentados anteriormente. Dessa forma, é capaz de reter o óleo em sua estrutura por mais tempo.
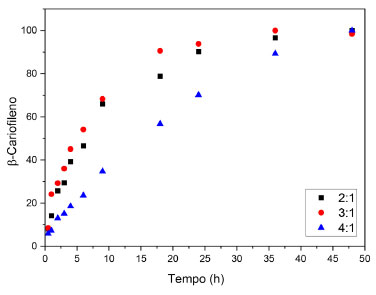 Figura 6. Curva de liberação do composto β-cariofileno presente no óleo de Copaíba da amostra Zn2Al/Copa10% (  ), Zn3Al/Copa10%( ), Zn3Al/Copa10%( ), Zn4Al/Copa10% ( ), Zn4Al/Copa10% ( ) entre os tempos de 0,5 h - 48 h ) entre os tempos de 0,5 h - 48 h
Nota-se que o perfil de liberação ocorre em duas etapas, uma primeira com uma liberação mais rápida nas primeiras horas (chamado de efeito burst), e uma segunda etapa com a liberação mais lenta e controlada. Nesse caso, sugere-se que o material possua uma quantidade de moléculas adsorvidas em sua superfície. Essa rápida liberação pode ser vantajosa se considerarmos que uma alta concentração do principio ativo no início da liberação pode ser mais efetiva frente a uma infecção, por exemplo.46-48 O platô de sustentação da liberação foi acima de 80% nos valores normalizados em um tempo de 20 h, aproximadamente, tempo necessário para ocorrer a dissolução e liberação das moléculas adsorvidas na estrutura lamelar do material para as razões molares 2:1 e 3:1 e para que ocorra a liberação do das moléculas adsolubilizadas no espaço interlamelar, considerando que a amostra 4:1 não alcançou platô em 48 h, portanto, esse material possui capacidade de reter no hidróxido duplo lamelar as moléculas do óleo por mais tempo, fazendo uma liberação mais lenta em relação às outras razões molares.
CONCLUSÕES Os resultados demonstrados indicam um material promissor para aplicabilidade de liberação lenta de óleos essenciais. A adsolubilização do óleo de copaíba ocorreu de forma satisfatória em todas as razões molares, 2:1, 3:1 e 4:1, na matriz lamelar de (Zn/Al), sendo comprovadas pelas técnicas de DRX com os cálculos das distâncias basais indicando que ocorreu a intercalação, a espectroscopia de infravermelho com bandas apresentadas nos espectros características dos materiais e através das análises termogravimétricas indicando eventos térmicos do material lamelar e do óleo de copaíba. Os gráficos de liberações foram analisados pelo pico de maior intensidade de área (β-cariofileno) e mostraram um bom resultado para o óleo de copaíba, o qual seguiu o padrão de liberações lentas para os princípios ativos. Quanto às razões molares 2:1 e 3:1, os compostos alcançaram platô de liberação em aproximadamente 25 h. O composto 4:1 não alcançou platô no tempo de analise de liberação de 48 h, sendo necessária análises com tempos maiores de liberação. MATERIAL SUPLEMENTAR O cromatograma obtido para o óleo de copaíba puro (Figura 1S) pode ser encontrado em http://quimicanova.sbq.org.br, em formato pdf, com acesso livre.
AGRADECIMENTOS Este estudo teve o apoio do Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) [projeto 455906/2014-9]. O presente trabalho foi realizado com apoio da Coordenação de Aperfeiçoamento de Pessoal de Nível Superior - Brasil (CAPES) - Código de Financiamento 001.
REFERÊNCIAS 1. Ahmad, N.; Ahmad, R.; Mohammed Buheazaha, T.; Salman AlHomoud, H.; Al-Nasif, H. A.; Sarafroz, M.; Saudi J. Biol. Sci. 2020, 27, 1024 [Crossref]. 2. Kuhlmann, M.; Wigger-Alberti, W.; Mackensen, Y. V.; Ebbinghaus, M.; Williams, R.; Krause-Kyora, F.; Wolber, R.; Wound Medicine 2019, 24, 24 [Crossref]. 3. Lopes, D. R,; Souza, M. S. C.; Barbosa, C. P. L.; Silva, G. W. B.; Souza, A. G. A.; Revista Brasileira de Queimaduras 2016, 15, 283. 4. Fontes, K. B.; Jaques, A. E.; Ciência, cuidado e Saúde 2006, 6, 481 [Crossref]. 5. Ferreira, F. V.; De Paula, L. B.; Revista Brasileira de Queimaduras 2013, 12, 132. 6. Ferraz, R. P. C.; Bomfin, D. S.; Carvalho, N. C.; Soares, M. B. P.; Silva, T. B.; Machado, E.; Prata, A. P. N.; Costa, E. V.; Moraes, V. R.; Nogueira, P. C.; Bezerra, D. P.; Phytomedicine 2013, 20, 615 [Crossref]. 7. Martins, C. P.; Graf, M. M. T.; Rodrigues, M. B. C.; Revista Fitos 2016, 10, 95 [Crossref]. 8. Souza, D. S. S.; Trabalho de Conclusão de Curso, Universidade do Maranhão, 2018. 9. Souza, J. P. B.; Tese de Doutorado, Universidade de São Paulo, Brasil, 2011. 10. Monteiro, M. H. A. A.; Macedo, H. W.; Silva, A. J.; Paumgaetten, F. J. R.; Revista Fitos 2013, 8, 1. 11. Barhumi, H.; Maaref, A.; Rammar, M.; Martelet, C.; Jafrezi, N.; Moustry, C.; Mater. Sci. Eng., C 2006, 26, 328 [Crossref]. 12. Geraud, E.; Prevot, V.; Forano, C.; Moustry, C.; Chem. Commun. 2008, 13, 1554 [Crossref]. 13. Ambrogi, V.; Perioli, L.; Marmottini, F.; Rossi, C.; Eur. J. Pharm. Biopharm. 2007, 66, 253 [Crossref]. 14. Gao, X.; Lei, L.; O'hare, D.; Xie, J.; Gao, P.; Chang, T.; J. Solid State Chem. 2013, 203, 174 [Crossref]. 15. Grasser, M. S.; Colloids Surf. B. 2009, 73, 103 [Crossref]. 16. Bugatti, V.; Gorrassi, G.; Montanari, F.; Nocchetti, M.; Tamaro, L.; Vittoria, V.; Appl. Clay Sci. 2011, 52, 34 [Crossref]. 17. Keypour, H.; Khanmohammadi, H.; Wainwright, K. P.; J. Iran. Chem. Soc. 2004, 1, 53 [Crossref]. 18. Deák, Á.; Csapó, E.; Juhásh, Á.; Dákáni, I.; Janovak, L.; Appl. Clay Sci. 2018, 156, 28 [Crossref]. 19. Sahoo, P. K.; Panda, H. S.; Baradur, D.; Mater. Chem. Phys. 2013, 142, 106 [Crossref]. 20. Wang, Y.; Zhang, D.; Mater. Res. Bull. 2012, 47, 3185- 3194. [Crossref]. 21. Tammaro, L.; Vittoria, V.; Calarco, A.; Petillo, O.; Riccitielo, F. P. G.; Journal of Dentistry 2014, 42, 60 [Crossref]. 22. Trikeriostis, M.; Ghanotaks, D. F.; Int. J. Pharm. 2007, 332, 176 [Crossref]. 23. Nejadi, K.; Davaran, S.; Baggalzadeh, R.; Superlattices Microstruct. 2014, 75, 257 [Crossref]. 24. Faranhaz, B.; Hussein, M.; Gani, S. A.; Fakusari, S.; Zainal, Z.; J. Solid State Chem. 2015, 221, 21 [Crossref]. 25. Adad, L. B.; Dissertação de Mestrado, Universidade Federal do Paraná, Brasil, 1999. 26. Silva, T. A.; Nascimento, T. G.; Yatsuzuka, R. E.; Grillo, L. A. M.; Dornelas, C. B.; Einstein 2019, 17, 1 [Crossref]. 27. Bini, M.; Monteforte, F.; J. Anal. Pharm. Res. 2018, 7, 1 [Crossref]. 28. Marangoni, R.; Mikoski, A; Wypych, F. J.; Colloid Interface Sci. 2010, 351, 384 [Crossref]. 29. Clearfield, A.; Kieke, M.; Kwan, J.; Colon, J. L.; Wang, R. C. J.; Incl. Phenom. Mol. Recognit. Chem. 1991, 11, 361 [Crossref]. 30. El-abboubi, M.; Taoufik, N.; Mahjoub, F. Z.; Oussama, A.; Kzaiber, F.; Barka, N.; Mater. Today: Proc. 2021, 37, 3894 [Crossref]. 31. Esumi, K.; Yamamoto, S.; Colloids Surf., A 1998, 137, 385 [Crossref]. 32. Huang, Q.; Gong, S.; Han, W.; Chen, Y.; Shu, X.; J. Microencapsul. 2020, 37, 297. [Crossref]. 33. Cordeiro, C. S.; Silva, F. R.; Marangoni, R.; Wypych, F.; Ramos, L. P.; Catal. Lett. 2012. 142, 763. 34. Benicio, L. P. F.; Silva, R. A.; Lopes, J. A.; Eulálio, D.; Santos, R. M.; Aquino, L. A.; Vergutez, L.; Novais, R. F.; Costa, L. M.; Pinto, F. G.; Tronto, J.; Rev. Bras. Cienc. Solo 2015, 39, 1 [Crossref]. 35. Hermans, J. J.; Keune, K.; Loon, A. V.; Corkey, R. W.; Iedema, P. D.; Polyhedron 2014, 81, 335 [Crossref]. 36. Cursino, A. C. T.; Lisboa, F. S; Pyrrho, A. S.; Souza, V. P.; Wypych, F.; J. Colloid Interface Sci. 2013, 397, 88 [Crossref]. 37. Jaeger, S.; Zawadiski, S. F.; Wypych, F.; Leuteritz, A.; J. Braz. Chem. Soc., 2017, 28, 2391 [Crossref]. 38. Li, L.; Dai, Y.; Xu, Q.; Zhang, B.; Zhang, F.; You, Y.; Ma, D.; J. Alloys Compd. 2021, 882, 160752 [Crossref]. 39. Liu, Y.; Yu, Z.; Wang, Q.; Zhu, X.; Long, R; Appl. Clay Sci. 2021, 209, 106138 [Crossref]. 40. Pereira, I. C. S.; Santos, N. R. R.; Middea, A.; Prudencio, E. R.; Luchese, R. H.; Moreira, A. P. D.; Oliveira, R. N; Polimeros 2019, 29, 1.[Crossref]. 41. Li, L; Qian, Y.; Han, H.; Qiao, P.; Zhang, H.; Polym. Polym. Compos. 2021, 29, 842 [Crossref]. 42. Psenicka, M., Skoda, J., Pospisil, M. Appl. Clay Sci. 2020, 189 [Crossref]. 43. Wang, Y. C.; Kao, S. H.; Hsieh, H.; Biomacromolecules 2003, 4, 3 [Crossref]. 44. Sachetti, C. G.; Fascinelli, M. L.; Sampaio, J. A.; Lameira, O. A.; Caldas, E. D.; Food Chem. Toxicol. 2011, 49, 1080 [Crossref]. 45. Mirante, D. C.; Dissertação de Mestrado, Universidade Estadual de Ponta Grossa, Brasil, 2015. 46. Ogawa, C. A.; Plepis, A. M.; Polim.: Cienc. Tecnol. 2002, 12, 115 [Crossref]. 47. Minarini, P. R. R.; Dissertação de Mestrado, Universidade de São Paulo, Brasil, 2006. 48. Caputo, S. L.; Campos, M. I. C.; Dias, H. J.; Crotti, A. E. M.; Fajardo, J. B.; Vanelli, C. P.; Presto, A. C. D.; Alves, M. S.; Aerestrup, F. M.; Paula, A. C.; Silva Filho, A. A.; Aerestrup, B. J. V.; Pereira, O. S.; Corrêa, J. O.; Int. Immunopharmacol. 2020, 80, 106177 [Crossref]. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access