Artigo
|
|
| Mitigación de la formación de acrilamida en papas fritas tipo chips mediante la adición de antioxidantes fenólicos de inca muña (Clinopodium bolivianum) Acrylamide mitigation in potato chips by addition of polyphenols from inca muña (Chenopodium bolivianum) |
|
Marianella ZegarraI; Ana Aguilar-GalvezI; Rosana ChirinosI; Diego García-RíosII; Marienela CalsinIII; Romina PedreschiII; David CamposI,*
I. Instituto de Biotecnología, Universidad Nacional Agraria La Molina, Av. La Molina, La Molina 12056, Lima, Peru Recebido em: 01/06/2022 *e-mail: dcampos@lamolina.edu.pe The aim of this study was to evaluate the influence of Inca muña phenolic antioxidants in the reduction of acrylamide (AA) in potato chips. The potatoes were cut into 2 mm thick slices, the addition of antioxidants was evaluated by immersion at atmospheric pressure and by vacuum impregnation (VI) at 80 kPa for 10 min. In both cases, two antioxidant concentrations were used (1 and 2 mg Gallic acid equivalents (GAE) mL-1) and times of 15, 30, 60 and 120 s. The greatest reduction of AA was obtained by VI with 1 mg GAE mL-1 for 120 s (67.4%) and 2 mg GAE mL-1 for 15 s (59.3%); while immersion at atmospheric pressure with 2 mg GAE mL-1 for 30 s and 60 s resulted in reductions of 50.8 and 50.9%, respectively. Besides, the addition of phenolics from Inca muña had no influence on the colour of potato chips. VI treatment resulted in increased amounts of phenolic compounds and antioxidant capacity in the potato chips being the most abundant phenolic compounds hesperidin and luteolin glucoside; while in the control samples phenolic corresponded to chlorogenic acid isomers. INTRODUCCIÓN El tratamiento térmico es un proceso ampliamente utilizado en la industria de los alimentos dado que es posible generar alimentos inocuos, así como productos con atributos sensoriales agradables para el consumidor. No obstante, a temperaturas > 120 °C, se puede formar acrilamida (AA) compuesto considerado "probable cancerígeno para humanos" (grupo 2A) debido a sus propiedades neurotóxicas y genotóxicas las que han sido reportadas en base a estudios realizados con animales.1 La comisión de regulación de la Unión Europea (2017/2158) ha establecido medidas para la mitigación y niveles de referencia para algunos alimentos; recomendando niveles de AA máximos de 750 µg kg-1 para papas fritas (chips).2 La formación de AA se da por la reacción entre la asparagina libre y los azúcares reductores (fructosa y glucosa) como parte de la reacción de Millard (RM). A lo largo de los últimos años se han propuesto diferentes alternativas para mitigar la formación de AA; así Maan et al.3 recomiendan cambios en las técnicas y condiciones de procesamiento (reducción de temperatura, empleo del vacío, empleo de microondas, uso de freidoras de aire, tratamiento con ultrasonido, etc.), empleo de aditivos (algunos aminoácidos, sales, ácidos, asparaginasa, etc.), blanqueado (reducción de precursores), fermentación (reducción de asparagina) y la adición de extractos antioxidantes naturales. Diversos estudios han mostrado que los compuestos fenólicos naturales son una alternativa importante para la mitigación de la formación de acrilamida; sin embargo, en algunos trabajos se incrementó el contenido de AA y en otros no se observó ninguna influencia.4 Este comportamiento se puede atribuir a que las diferentes estructuras de los compuestos fenólicos reaccionan de distinta manera con los precursores de la AA o con los compuestos intermedios de la RM o con la misma AA. También, estudios realizados con los mismos antioxidantes han reportado resultados contradictorios lo cual podría deberse a la concentración de antioxidante usado, condiciones de reacción o también a la forma de preparación del antioxidante.5 Estudios realizados con extractos de plantas (té verde, orégano, tomillo, romero, canela, menta, bambú, etc.) han reportado una mitigación de AA en papas fritas que puede llegar hasta 76%.6-8 Los trabajos antes mencionados adicionan los antioxidantes fenólicos mediante inmersión a presión atmosférica; sin embargo, la impregnación al vacío es una alternativa que ha sido estudiada por diversos autores con el fin de incrementar los compuestos bioactivos en papas fritas chips, entre ellos Duarte-Correa et al.9 impregnaron vitaminas C, E y Ca; Moreira y Almohaimeed,10 Lopez y Moreira,11 estudiaron la impregnaron de compuestos fenólicos. El Perú es un país que cuenta con gran biodiversidad de plantas aromáticas y medicinales, siendo una de las más ricas en antioxidantes fenólicos la Inca muña (Clinopodium bolivianum);12 estas son una fuente importante ácido clorogénico (isómero) > ácido rosmarínico > eriocitrina > naringenina > ácido coumaroil quinico (isómero) > quercetina glucósido > Hesperetina-7- rhamnoglucosido y otros en menores concentraciones.13 Dada la necesidad de reducir los niveles de AA en diferentes productos y particularmente en el caso de papas fritas (chips), el presente trabajo tiene por objetivo evaluar la influencia de los polifenoles de Inca muña en la mitigación de AA. Se determinará la influencia de tiempo y concentración de los polifenoles; así como la adición por inmersión a presión atmosférica e impregnación al vacío sobre el contenido de AA y se determinará el perfil y contenido de compuestos fenólicos.
PARTE EXPERIMENTAL Materia prima e insumos Inca Muña (Clinopodium bolivianum) fue adquirida en un mercado local, las hojas se seleccionaron, secaron, molieron y se almacenaron a -20 °C hasta su uso. La papa variedad Canchan fue adquirida en un mercado local. El aceite vegetal de girasol de la marca Crisol fue adquirido de la empresa Alicorp S.A.A. (Lima, Perú). Reactivos 2,2'-azino-bis (3-ethylbenzothiazoline-6-sulphonic acido) (ABTS), 2 N Folin-Ciocalteau, ácido 3,5 dinitrosalicílico (DNS) D-0550, 6-Hidroxi-2,5,7,8 tetrametil-chroman-2-ácido carboxílico (Trolox) fueron adquiridos de Sigma Chemicals (St. Louis, MO, EE.UU.). Los estándares: acrilamida, asparagina, d3-acrilamida, ácidos fenólicos (caféico, clorogénico, p-cumárico, ferúlico, benzoico, protocateico, rosmarínico y gálico) flavonoles (quercetina y rutina) flavonas (crisina, luteolina y apigenina), flavanonas (naringenina, eriodictiol) fueron adquiridos de Sigma Chemicals (St. Louis, MO, USA). QuEChERS® dSPE (Phenomenex, EE.UU.). La resina de adsorción macroporosa DA-201C (Suqing Chemestry, China) fue utilizada. Todos los solventes y otros productos químicos de grado analítico, HPLC o MS se adquirieron de Merck (Alemania) y J. T. Baker (Trinidad y Tobago). Obtención del extracto de Inca muña Para la obtención del extracto se empleó los parámetros reportados por Campos et al.13 La extracción se realizó con etanol al 40%, a 60 °C por 70 min, bajo agitación constante y en condiciones de oscuridad. Luego se centrifugó a 1520 g por 15 min recuperándose el sobrenadante, el que fue concentrado en un rotavapor a 50 °C, obteniéndose el extracto crudo concentrado (ECC). El ECC fue purificado mediante cromatografía de adsorción, se inyectó 80 mL de extracto (pH 3.5) en una columna de vidrio (4.5 x 45 cm) empacada con la resina DA 201C, el lavado de la columna se realizó con 3 volúmenes de agua destilada. La elución de los polifenoles se realizó con una solución de etanol al 80%, a temperatura ambiente y flujo constante (2 mL min-1). El extracto obtenido se concentró en un rotavapor a 50 °C y posteriormente se liofilizó, obteniéndose el extracto purificado liofilizado (EPL). Evaluación del extracto en sistemas modelos > Se empleó el procedimiento reportado por Oral et al.,14 con algunas modificaciones. Se preparó soluciones equimolares de glucosa - asparagina (0.1 mol L-1) en tampón fosfato (0.067 mol L-1) a pH 6.5. A esta solución se le añadió el EPL a diferentes concentraciones 0 (control), 1.25; 5.0; 7.5; 10.0 y 20.0 mg equivalentes de ácido gálico (EAG) mL-1. Se añadió 2 mL de cada solución a tubos de ensayo de 8 mL con tapa de teflón y se calentaron durante 15 min a 160 °C en un baño de aceite y se enfriaron inmediatamente con agua fría para detener la reacción. Después de enfriar, se llevó a un volumen de 7 mL con agua ultra pura y se homogenizó. Se determinó el contenido de AA y los resultados se expresaron mg de AA mL-1. Elaboración de papas fritas chips Las papas se cortaron en rodajas de 2.5 ± 0.5 mm de espesor y se seleccionaron aquellas con un diámetro de ~ 60 mm, se lavaron con agua destilada por 15 s con el fin de eliminar el almidón superficial e inmediatamente se realizó el tratamiento de inmersión a presión atmosférica o impregnación al vacío con los antioxidantes fenólicos. Para ambos tratamientos se evaluó dos concentraciones del EPL, 0.1 y 0.2 mg EAG mL-1 a pH 6.7, con una relación rodajas de papa:solución antioxidante de 1:9 (w/v), a 30 °C por tiempos de 15, 30, 60 y 120 s. La impregnación al vacío se realizó a 92 kPa y el tiempo de relación fue de 10 min. Después de la adición de los compuestos fenólicos las rodajas fueron escurridas sobre papel y se procedió a realizar la fritura en una freidora Imaco (modelo IDF25-W 2.5L, China) a 180 °C por 4 min. Las hojuelas fritas fueron colocadas sobre papel adsorbente para remover el exceso de aceite y se determinó el color, una porción fue almacenada a -20 °C hasta la determinación de acrilamida. Para cada tratamiento se realizó un control en el que se reemplazó la solución de antioxidantes con agua destilada, esto con fin reducir el efecto de una leve reducción de los precursores.8 Los resultados se expresaron en porcentaje de reducción de AA respecto al control. Todos los tratamientos y controles fueron realizados por triplicado. Análisis fisicoquímicos Análisis de compuestos fenólicos, de la capacidad antioxidante "in vitro" e identificación de los polifenoles mediante LC-MSe Las papas fritas previamente molidas fueron desengrasadas con éter etílico anhidro mezclándose en una proporción 1:10 (w/v), la operación se repitió tres veces para obtener la torta desengrasada. Los extractos se obtuvieron a partir de la torta desengrasada con metanol al 80% y la determinación de compuestos fenólicos totales (CFT) se realizó de acuerdo a Singleton y Rossi.15 La reacción se realizó con 500 μL de extracto, 250 μL del reactivo de Folin-Ciolcateau 1 N y 1250 μL de carbonato de sodio 1.2 N. Después de 30 min se determinó la absorbancia a 755 nm. Los resultados se expresaron en mg equivalente de ácido gálico (EAG) por g o mL según el caso. La capacidad antioxidante (CA) hidrofílica ABTS fue determinada de acuerdo al método de Arnao et al.16 Los resultados se expresaron en µmol equivalente de trolox (ET) por g o mL según el caso. La identificación de los compuestos fenólicos mediante UHPLC (ACQUITY UPLC I Clase; Waters Corp., Milford, MA, EE. UU.) equipado con una columna Acquity BEH (1,7 μm, 100 × 2,1 mm DI, Waters Corp), precolumna (1,7 μm, 5 × 2,1 mm) conectado a un espectrómetro de masas cuadruplo-tiempo de vuelo (Xevo G2-XS QToF; Waters Corp). Se empleó el procedimiento reportado por Campos et al.13 Brevemente, la fase móvil fue agua con 0.1% de ácido fórmico (A) y acetonitrilo con 0.1% de ácido fórmico (B). El gradiente fue el siguiente: 2% de B durante 2 min, 2 a 7% de B en 2 min, 7 a 12% de B en 11 min, 12 a 26% de B en 5 min, 26 a 55% de B en 5 min, 55 a 95% B en 1 min y durante 3 min 100% de B. El flujo fue de 0,2 mL min-1 y la temperatura de 30 °C. Los espectros de masa fueron adquiridos utilizando ionización "electrospray" (ESI) en modo negativo (-3,5 kV), voltaje del cono 40 V, temperatura 120 °C, temperatura de desolvatación 550 °C y flujo de gas de 1000 L h-1. El modo de adquisición utilizado fue el centroide MSe con baja energía de colisión (4 V) y una rampa de alta energía de colisión (6-50 V). El espectrómetro de masas se calibró con formiato de sodio 0.5 mol L-1 y se usó leucina-encefalina (200 pg μL-1) como "LockMass". Los cromatogramas se procesaron con el programa MassLynx v 4.1 (Waters Corp., Milford, MA, EE. UU.). Se utilizaron datos de PubChem, así como espectros de masas de estándares para realizar la identificación de compuestos. Paralelamente se realizaron análisis mediante UPLC (ACQUITY UPLC H Class; Waters Corp., Milford, MA, USA) conectado a un detector de arreglo de fotodiodos (λPDA, Waters). La columna y condiciones de análisis fueron las mismas que se emplearon en el análisis de espectrometría de masas, salvo que la detección se realizó en el rango de 350 - 700 nm. Determinación de materia seca y azúcares Se determinó el contenido de materia seca mediante el método de la AOAC,17 el análisis se realizó hasta que se alcanzó peso constante. Los contenidos de glucosa fructosa y sacarosa fueron determinados mediante UHPLC - IR. La extracción de azúcares se realizó de acuerdo a Serpen y Gökmen.18 El análisis se realizó mediante el HPLC Waters 2695 (Waters, Milford, MA) equipado con autoinyector, detector de índice de refracción 2414 y software Empower 2. Se empleó la columna Shodex VG-50 4E (5 µm, 250 x 4.6 mm) y precolumna (5 µm, 10 x 4.6 mm). Para la elución isocrática se empleó acetonitrilo al 80%, el flujo de 1 mL min-1 y 40 °C durante 20 minutos. Determinación de asparagina La asparagina fue determinada de acuerdo a Koklamaz et al.,19 con algunas modificaciones. Brevemente, 1 g de papa frita se sometió a extracción en tres etapas sucesivas con 10, 5 y 5 mL de agua ultra pura, la separación fue realizada por centrifugación a 1520 g por 15 min y se combinaron los tres extractos. Un mL de extracto se purificó en cartucho Oasis HLB de 6 cc, recuperándose el extracto con acetonitrilo al 50% el que se filtró a través de un filtro Millipore de 0.22 µm (Millipore, Bedford, MA). El análisis fue realizado mediante UHPLC UltiMate 3000 (Thermo Scientific, Alemania). La separación se realizó con la columna Kinetex Hilic (2.1 x 100 mm, 1.7 µm; Phenomenex) con un flujo de 0.35 mL min-1, 40 °C y un volumen de inyección de 2 µL. La fase móvil fue agua ultra pura con ácido fórmico (0.15%) y formiato de amonio (15 mmol L-1) (solvente A), y acetonitrilo con ácido fórmico (0.05%) (solvente B). La elución se realizó a través del gradiente: durante 1 min 10% de A, en 2 min se incrementó A hasta 25%, en 6 min se incrementó A hasta 50%, en 1 min disminución de A hasta 10%, durante 5 min se mantuvo A en 10%. La detección se realizó mediante el espectrómetro de masa TSQ Quantum Access Max (Thermo Scientific, CA, EE.UU.) equipado con fuente de ionización (H-ESI). Se empleó los siguientes parámetros: voltaje de ionización 3.5 kV, temperatura de vaporización 250 °C, temperatura del capilar 270 °C, modo SRM. Los datos fueron adquiridos mediante software Chromeleon T y TSQ TuneT y procesados con el programa XcaliburT (ThermoScientific, CA, EE.UU.). Determinación de acrilamida mediante LC-MS La extracción de acrilamida se realizó de acuerdo a Bertuzzi et al.,20 con algunas modificaciones. En un tubo de centrífuga de 50 mL se pesó 2 g de hojuelas de papa frita molida, se adicionó 5 mL de hexano, 10 mL de agua ultra pura, 10 mL de acetonitrilo y 500 µL de solución de d3-AA (1 µg mL-1) (estándar interno) y se mezcló vigorosamente durante un minuto. Posteriormente, se adicionó 8 g de sulfato de magnesio anhidro y 0.5 g de cloruro de sodio mezclándose por 5 minutos. Posteriormente se centrifugó a 1,520 g por 2 min a 15 °C y se recuperó el sobrenadante. Se realizó una reextracción con acetonitrilo por 5 min y se centrifugó a 1520 g por 2 min a 15 °C. Se mezclaron ambos sobrenadantes y el volumen se llevó a 20 mL. Una alícuota de 1.5 mL se adicionó a tubos QuEChERS (dSPE Kit - 2mL CT, Phenomenex), se agitó por 3 min, luego se centrifugó a 16000 g por 10 min y el sobrenadante se evaporó a sequedad bajo una corriente de N2. Se reconstituyó con agua ultra pura y se filtró en 0.22 µm. El análisis cromatográfico fue realizado mediante UHPLC (UltiMate 3000 chromatograph, Thermo Scientific, Alemania). La separación fue realizada en la columna HSS T3 (2.1 x 100 mm, 1.8 µm; Waters, Irlanda) a un flujo de 0.2 mL min-1 y 30 °C. La fase móvil fue metanol a 0.5% y ácido fórmico al 0.05%. Se inyectó 2 µL de solución y la elución isocrática se realizó durante 7 min a 30 °C. La detección se llevó acabo en el espectrómetro de masa triple cuádruplo TSQ Quantum Access (Thermo Scientific, CA, EE.UU.) equipado con fuente ionización (H-ESI) en modo SRM. Los parámetros de ionización fueron: voltaje de 3.5 kV, temperatura de vaporización 250 °C y temperatura del capilar 270 °C. Los datos mediante el software Chromeleon T and TSQ Tune T y procesados con el programa XcaliburT (ThermoScientific, CA, EE.UU.). La identificación y cuantificación fue realizada gracias a una curva estándar (0.005 a 1 µg mL-1 con 0.1 µg mL-1 de d3-AA, SI). Análisis de color Se determinó con el colorímetro Konica Minolta Chroma metre (CR-400; Konica Minolta, Tokyo, Japón), usando el sistema CIELAB. El instrumento fue calibrado con una placa de cerámica (L* = 93.3; a* = 0.31, b* = 0.33). Se determinó el cambio total del color (ΔE) y el ángulo Hue (h*) de acuerdo a Serpen y Gökmen.18 Las mediciones de color se realizaron en seis hojuelas en seis puntos aleatorios de las hojuelas de papa frita (tres puntos por cara). Análisis estadístico Los resultados se reportan como el promedio de tres repeticiones ± la desviación estándar. El análisis de varianza (ANOVA) fue utilizado y la prueba de Tukey con el fin de evaluar estadísticamente las diferencias significativas (p < 0.05). El análisis se realizó empleando el software Statgraphics Centurion XV (Stat Point Technologies, Inc., Warrenton, VA, EEUU).
RESULTADOS Y DISCUSIÓN Compuestos fenólicos totales, capacidad antioxidante de los extractos de Inca muña y características de la papa canchan Los resultados del contenido de CFT y CA se presentan en la Tabla 1. El extracto crudo liofilizado presentó un contenido de CFT de 234.6 ± 8.0 mg EAG/g y una CA de 2,354.2 ± 114.5 µmol ET/g, mientras que para el EPL el contenido de CFT fue de 258.9 ± 3.7 mg EAG/g y una CA de 3,109.4 ± 35.9 µmol ET/g. Se observa que en la etapa de purificación se incrementó en 10.4 y 32.1% el contenido de CFT y la CA, respectivamente. Así mismo, se tiene los valores específicos de la CA fueron de 10.03 y 12.01 µmol ET/mg EAG para el ECL y el EPPL respectivamente. Con la purificación mediante cromatografía de adsorción se logra eliminar compuestos hidrofílicos como azúcares y aminoácidos libres, y también pigmentos que pueden tener impacto negativo en la formación de acrilamida y en las características sensoriales de las papas fritas.
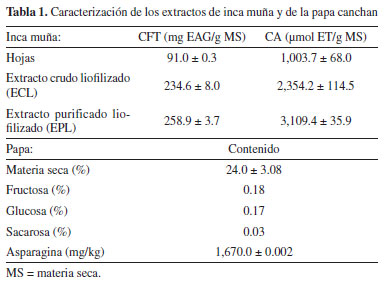
Los valores de materia seca, azúcares reductores y asparagina (Tabla 1) fueron de 24.0 ± 3.1%; 0.35 ± 0.0% y 1.67 ± 0.0 g/kg de papa, respectivamente. Esta variedad puede llegar a tener hasta 25% de materia seca,21 así mismo el rango de 20.8-22.3% fue reportado Kotsiou et al.22 Plata-Guerrero et al.23 reportan valores similares de asparagina en papas españolas, entre 1300 y 1700 mg/kg. La ratio asparagina libre/azúcares reductores encontrada es de 0.45, Muttucumaru et al.24 encontraron que la ratio de 2.257 ± 0.149 es el punto de inflexión, por debajo este valor se produce cantidades importantes de AA. Evaluación de la formación de acrilamida en sistemas modelo glucosa/asparagina Este modelo equimolar (glucosa/asparagina) ha sido utilizado por varios autores ya que estos precursores sometidos a tratamiento térmico generan una cantidad importante de AA.8,25 Los sistemas modelos permiten entender los mecanismos de reacción en la formación de AA, pero estos no son comparables con los sistemas reales.26 Los resultados obtenidos se presentan en la Figura 1, se muestra los valores de AA expresados en porcentaje respecto al tratamiento control. Se observa que el extracto de Inca muña permite reducir el contenido de acrilamida con respecto al control (sin antioxidante) el que presentó un valor de AA de 37.2 µg mL-1. A concentración de CFT > 1.25 mg mL-1, a medida que se incrementa la concentración se reduce la formación de acrilamida; así para 5, 7.5 y 20 mg de AGE mL-1 se obtuvieron reducciones de 32.2; 51.7 y 97.1% respectivamente. Un comportamiento similar fue reportado por Kotsiou et al.22 para extractos obtenidos de orégano, perteneciente a la familia Lamiaceae, igual que la Inca muña.
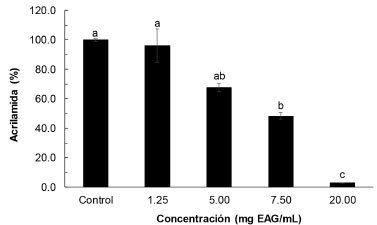 Figura 1. Influencia de la concentración de compuestos fenólicos en el contenido de acrilamida en sistemas modelo. Letras diferentes sobre las barras indican diferencias significativas (p < 0.05)
Oral et al.14 evaluaron en sistemas modelo fructosa/asparagina y encontraron para diferentes compuestos fenólicos y para algunos extractos vegetales, reducciones de AA entre 30-85%, excepto para la oleorupeína que ocasionó un incremento en la AA. Zhu et al.27 trabajaron con sistemas modelo igual al empleado en este trabajo, estudiaron el efecto de diferentes compuestos fenólicos puros (p-cumárico, rutina, ácido gálico, quercetina, hesperidina, y ácido ferúlico, entre otros) encontrando que la mayor mitigación de AA (53%) se dio con p-cumárico y un incremento en el contenido de AA de 9% con hesperidina; mientras que con los extractos de menta, semillas de comino y anís estrellado las reducciones de AA fueron de 75%, 73% y 69%, respectivamente, pero el extracto de acebo chino (Ilex cornuta) facilitó la formación de AA incrementándola en 18%. La mitigación o incremento en el contenido de acrilamida estaría relacionada con el tipo de antioxidante.27 En este trabajo la reducción de AA se debería a la presencia de ácido rosmarínico que es uno de los principales compuestos fenólicos de los extractos de Inca muña;13 al respecto Yuan et al.25 encontraron que en sistemas modelo este compuesto ocasiona una reducción de AA de 42.93 a 94.40%. Determinación de acrilamida en papas fritas chips Los resultados de la influencia de los polifenoles de Inca muña a diferentes tiempos de inmersión a presión atmosférica o impregnación al vacío en la reducción de AA en las papas fritas se presentan en la Figura 2. Se observa en la Figura 2A que la reducción de AA respecto al control (sin antioxidante) depende del tiempo de inmersión a presión atmosférica y de la concentración de compuestos fenólicos en la solución de inmersión; así, para la concentración de 1 mg EAG mL-1 la mayor reducción de AA (51.1 ± 5.9%) se obtuvo con 30 s de inmersión; el empleo de un mayor o menor tiempo de inmersión da niveles de reducción de AA significativamente menores, los que a su vez no difieren entre ellos (p > 0.05). Mientras que para la concentración de 2 mg EAG mL-1 la mayor reducción de AA (50.8 ± 7.0) se obtuvo a los 30 y 60 s de inmersión, en cambio a los 15 y 120 s la reducción de AA fue similar pero significativamente menor (p > 0.05) que la obtenida a 30 y 60 s. De manera similar, Zhang et al.8 emplearon antioxidantes extraídos de hojas de bambú negro logrando reducir 74.1% y 76.1% en papas chips y papas fritas a la francesa respectivamente con una inmersión de 60 s. Haddarah et al.28 evaluaron la formación de AA en papas fritas previamente sumergidas en extractos de jengibre, hojas de hinojo y hojas de borraja reportando valores de reducción de 21.91, 29.15 y 66.29%; los autores relacionan la mayor reducción de AA con la mayor capacidad antioxidante. También, se ha encontrado en la literatura resultados contradictorios, en algunos casos la adición de polifenoles contribuye a incrementar la formación de AA, al respecto Constantinou y Koutsidis,4 indican que esto está relacionado con el tipo y concentración del antioxidante, así como la concentración de reactantes (precursores). De acuerdo a Liu et al.26 los polifenoles inhiben la formación de AA al atrapar grupos carbonilo y previenen la oxidación lipídica; sin embargo, algunos polifenoles pueden promover la formación de AA ya que al proporcionar grupos carbonilo aceleran la conversión de 3-aminopropionamida (3-APA) a AA e inhiben su eliminación. Los mecanismos de inhibición, así como los de incremento en los niveles de AA observados como consecuencia de la adicción de polifenoles, a la fecha no han sido claramente establecidos.
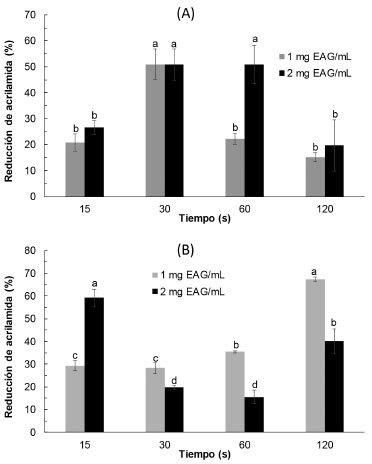 Figura 2. Influencia del tiempo de inmersión a presión atmosférica (A) e impregnación al vacío (B) en la reducción de acrilamida en papas fritas chips, con dos concentraciones de compuestos fenólicos. Letras diferentes sobre las barras indican diferencias significativas (p < 0.05)
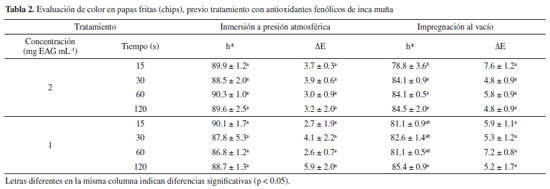
En la Figura 2B se presenta los valores de AA obtenidos en papas fritas chips previamente tratadas mediante impregnación al vacío en extractos de Inca muña. Los mayores niveles de reducción de AA se obtuvieron con 15 s de impregnación a 2 mg EAG mL-1 (67.4 ± 0.9%) y 120 s de impregnación a 1 mg EAG mL-1 (59.2 ± 3.2%), siendo estos valores estadísticamente similares (p < 0.05). Se observa que a 1 mg EAG mL-1 tiende a aumentar la mitigación de AA con el tiempo de impregnación; mientras que con 2 mg EAG mL-1 una disminución en la mitigación se observa con el tiempo de impregnación. Este comportamiento puede deberse a que las soluciones concentradas pueden promover la formación de una capa densa de solutos en la superficie de los alimentos actuando como barrera contra la penetración de los solutos lo que dificulta la transferencia de masa; este fenómeno ha sido observado por Corrêa et al..29 Otra posible explicación a lo observado en este trabajo puede estar relacionado con el comportamiento del ácido rosmarínico presente el extracto de Inca muña; dicho ácido tiene un comportamiento dual, antioxidante y prooxidante que depende la cantidad adicionada, tal como ha sido reportado por Hedegaard et al.30 y corroborado por Yuan et al..25 Evaluación de color en papas fritas chips El color de las rodajas de papa frita es el primer rasgo de calidad evaluado por los consumidores y es fundamental en la aceptación del producto. Los resultados de color se presentan en la Tabla 2, los valores que se han tomado como referencia para observar algún cambio de color en el producto fueron h* y ΔE. Para la inmersión a presión atmosférica, los valores h* se encuentran entre 86.8 y 90.3; mientras que ΔE fluctuó entre 2.6 y 5.9, en ambos no se observa diferencias significativas (p > 0.05). En el caso de la impregnación al vacío, los valores h* se encuentran entre 78.8 - 85.4; mientras que ΔE fluctuó entre 4.8 - 7.6, de la misma manera que en el caso anterior no se observa diferencias significativas. Los valores h* son similares a los reportados por Lopez y Moreira,11 quienes encontraron valores h* entre 81 - 84 en papas fritas chips previamente impregnadas al vacío con extracto de té verde. El mayor valor ΔE obtenido para la impregnación al vacío se justifica en una tonalidad más rojiza dada por una mayor penetración de pigmentos en la matriz. Una tendencia similar ha sido reportada por Lopez y Moreira.11
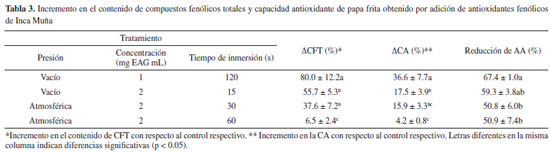
Compuestos fenólicos y capacidad antioxidante en papas fritas chips Los resultados de la evaluación de los CFT y CA realizada sobre aquellos tratamientos en los que se logró una mayor reducción de AA se presentan en la Tabla 3. Se observa mayor incremento el contenido CFT y CA para los tratamientos de impregnación al vacío que la inmersión a la presión atmosférica; al respecto Lopez y Moreira,11 Abalos et al.,31 señalan que la impregnación al vacío es una técnica efectiva para aumentar el contenido de polifenoles en papa fritas chips y camote. Con la impregnación al vacío, se alcanza un contenido de CFT de 125.06 ± 26.45 y 145.67 ± 15.63 µmol ET/100 g para tiempos de impregnación de 15 y 120 s respectivamente; siendo estos valores cercanos máximo (196.11 ± 15.41 µmol ET/100 g reportado por Lopez y Moreira.11 Los valores de coeficiente de correlación (R) entre ΔCFT vs ΔCA, ΔCFT vs reducción de AA y ΔCA vs reducción de AA fueron de 0.93, 0.79 y 0.75 respectivamente, lo cual indica una importante influencia de los CFT o la CA en la reducción de la AA. Sin embargo, la evaluación de la CA puede ser influenciada por compuestos melanoidinos u otros intermedios de la RM. Por esta razón Jin et al.5 señalan que la CA no es una medición adecuada para indicar el efecto que se tendría en la reducción de AA.
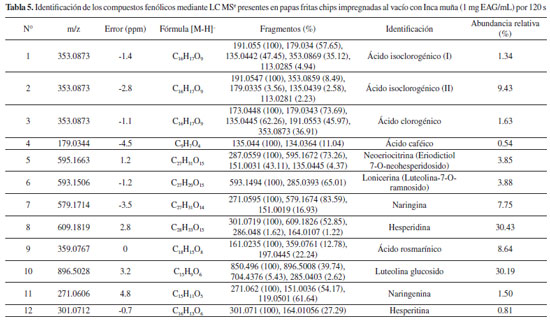
En las Tablas 4 y 5 se presentan los resultados de detección de compuestos en papas fritas chips (control) e impregnadas previamente. La identificación ha sido realizada a través de los espectros de masa obtenido mediante LC - MSe (Figura 1S Material suplementario) y los espectros de absorción obtenidos mediante PDA. En la muestra control se identificaron 4 compuestos entre ellos ácido clorogénico y ácido caféico (picos 3 y 4), identificados gracias a estándares previamente inyectados; mientras que los picos 1 y 2 fueron identificados como isómeros de ácido clorogénico debido al ion molecular m/z 353 y fragmentos m/z 191, m/z 179 y m/z 135 que corresponderían a ácido quínico, ácido caféico y ácido caféico descarboxilado, respectivamente. En la muestra impregnada también se identificaron los compuestos presentes en la muestra control (Figura 2S, material suplementario), mientras que los otros compuestos identificados (5 a 12) corresponden a compuestos presentes en el extracto de muña los que han sido previamente identificados por Campos et al..13 El pico 7 tentativamente identificado como naringina, con ion molecular m/z 579 y fragmento 271 correspondiente a la naringenina (aglicona), como resultado de la pérdida de un disacárido (tentativamente un ramnosil-hexosido). El pico 8 con ion molecular m/z 609 corresponde a hesperidina, con un fragmento m/z 301 (hesperitina), resultante de la pérdida del residuo disacárido (tentativamente un ramnosil-hexosido). El pico 9 fue identificado como ácido rosmarínico por comparación con el estándar auténtico. El pico 10 corresponde a la luteolina glucósido con ion molecular m/z de 896 y fragmento m/z de 285 correspondiente a luteolina (aglicona), la diferencia entre dos de los fragmentos de m/z = 146, que correspondería a un ramnosil. El pico 11 fue identificado como naringenina por comparación con estándar autentico. El pico 12 corresponde a la hesperitina identificado por comparación con el estándar auténtico.
Los resultados de abundancia relativa de los compuestos fenólicos en las papas fritas impregnadas no concuerdan con lo reportado para el extracto de Inca muña. Compuestos como ácido rosmarínico, eriocitrina e isómeros de ácido clorogénico, abundantes en el extracto de Inca muña, se esperaría que fueran los más abundantes en las papas fritas impregnadas; sin embargo, no es así, es posible que hayan reaccionado con otros compuestos y/o sean poco estables a la temperatura de fritura. Los antioxidantes más abundantes en papas fritas impregnadas fueron hesperidina y luteolina glucosido; mientras que en la muestra control fue el ácido clorogénico.
CONCLUSIONES El extracto obtenido de Inca muña, parcialmente purificado mediante cromatografía de adsorción resultó ser eficiente en la mitigación de AA en papas fritas chips. Los mejores resultados fueron obtenidos mediante impregnación al vacío comparado con la inmersión a presión atmosférica; sin embargo, bajo las mejores condiciones en ambos procesos los niveles de mitigación son superiores a 50%. Por otro lado, se obtuvo un incremento importante en el contenido de compuestos fenólicos totales y en la capacidad antioxidante mediante la impregnación al vacío, además de que presentan un perfil de antioxidantes fenólicos complejo, lo que podría dar lugar a un producto más saludable. El color no fue afectado bajo las condiciones de procesamiento. Los resultados obtenidos muestran que los niveles de acrilamida en las papas fritas chips se encuentran cercanos o por debajo del valor máximo recomendado (750 µg kg-1) por la Unión Europea. La Inca muña constituye un recurso subutilizado y por tanto representa una fuente importante de compuestos fenólicos para la mitigación de acrilamida.
AGRADECIMIENTOS Al Fondo Nacional de Desarrollo Científico, Tecnológico, y de Innovación Tecnológica-FONDECYT y al Banco Mundial, por el financiamiento para el desarrollo de la presente investigación (Convenio de Subvención N° 65-2018-FONDECYT-BM-IADT-AV).
REFERENCIAS 1. International Agency for Research on Cancer (IARC); 1994, 60, 389, disponible en https://publications.iarc.fr/78, accedido en Julio 2022. 2. European Commission. OJEU, 2017/2158; 2017, 304, 24, disponible en http://eur-lex.europa.eupri/en/oj/dat/2003/l_285/l_28520031101en00330037.pdf, accedido en Julio 2022. 3. Maan, A.; Anjum, M.; Khan, M.; Nazir, A.; Saeed, F.; Afzaal, M.; Aadil, R.; Food Rev. Int. 2020, 38, 70. [Crossref] 4. Constantinou, C.; Koutsidis, G.; Food Chem. 2016, 197, 769. [Crossref] 5. Jin, C.; Wu, X.; Zhang, Y.; Food Res. Int. 2013, 51, 611. [Crossref] 6. Ashkezari, M.; Salehifar, M.; J. Food Meas. Charact. 2019, 13, 735. [Crossref] 7. Morales, G.; Jimenez, M.; García, O.; Mendoza, M.; Beristain, C.; LWT - Food Sci. Technol. 2014, 23, 1. [Crossref] 8. Zhang, Y.; Chen, J.; Zhang, X.; Wu, X.; Zhang, Y.; J. Agric. Food Chem. 2007, 55, 523. [Crossref] 9. Duarte-Correa, Y.; Díaz-Osorio, A.; Osorio-Arias, J.; Sobral, P. J.; Vega-Castro, O.; Innov. Food Sci. Emerg. Technol. 2020, 64, 102437. [Crossref] 10. Moreira, R. G.; Almohaimeed, S.; J. Food Eng. 2018, 228, 57. [Crossref] 11. Lopez, S. V.; Moreira, R. G.; J. Food Sci. 2019, 84, 807. [Crossref] 12. Chirinos, R.; Pedreschi, R.; Rogez, H.; Larondelle, Y.; Campos, D.; Ind. Crops Prod. 2013, 47, 145. [Crossref] 13. Campos, D.; García-Ríos, D.; Aguilar-Galvez, A.; Chirinos, R.; Pedreschi, R.; J. Food Process. Preserv. 2022, 46, e16310. [Crossref] 14. Oral, R.; Dogan, M.; Sarioglu, K.; Food Chem. 2014, 142, 423. [Crossref] 15. Singleton, V. L.; Rossi, J. A.; Am. J. Enol Vitic. 1965, 16, 144. 16. Arnao, M.; Cano, A.; Acosta, M.; Food Chem. 2001, 73, 239. [Crossref] 17. AOAC (Association of Official Analytical Chemists); Off. methods anal. AOAC Int. (16th ed). 1995. 18. Serpen, A.; Gökmen, V.; J. Food Compost. Anal. 2009, 22, 589. [Crossref] 19. Koklamaz, E.; Palazoğlu, T. K.; Kocadağlı, T.; Gökmen, V.; J. Sci. Food Agric. 2014, 94, 2002. [Crossref] 20. Bertuzzi, T.; Rastelli, S.; Mulazzi, A.; Pietri, A.; Food Addit. Contam., Part B 2017, 10, 292 [Crossref] 21. INIAP (Instituto Nacional de Investigaciones Agropecuarias), 2016, disponible en http://cipotato.org/wp-content/uploads/2016/04/poscosecha_-C_Monteros.pdf, accedido en Julio 2022. 22. Kotsiou, K.; Tasioula-Margari, M.; Kukurová, K.; Ciesarová, Z.; Food Chem. 2010, 123, 1149. [Crossref] 23. Plata-Guerrero, R.; Guerra-Hernández, E.; García-Villanova, A.; J. Liq. Chromatogr. Relat. Technol. 2009, 3i2, 2556. [Crossref] 24. Muttucumaru, N.; Powers, S. J.; Elmore, J. S.; Dodson, A.; Briddon, A.; Mottram, D. S.; Halford, N. G.; Food chem. 2017, 220, 76. [Crossref] 25. Yuan, Y.; Qi, M.; Liu, H.; Yan, H.; Int. J. Food Sci. Technol. 2019, 54, 2700. [Crossref] 26. Liu, Y.; Wang, P.; Chen, F.; Yuan, Y.; Zhu, Y.; Yan, H.; Hu, X.; Food Chem. 2015, 186, 46. [Crossref] 27. Zhu, F., Cai, Y., Ke, J. & Corke, H.; J. Sci. Food Agric. 2009, 89, 1674. [Crossref] 28. Haddarah, A.; Naim, E.; Dankar, I.; Sepulcre, F.; Pujolà, M.; Chkeir, M.; Food Chem. 2021, 350, 129060. [Crossref] 29. Corrêa, J. L.; Pereira, L. M.; Vieira, G. S.; Hubinger, M. D.; J. Food Eng. 2010, 96, 498. [Crossref] 30. Hedegaard, R. V.; Granby, K.; Frandsen, H.; Thygesen, J.; Skibsted, L. H.; Eur. Food Res. Technol. 2008, 227, 519. [Crossref] 31. Abalos, R. A.; Naef, E. F.; Aviles, M. V.; Gómez, M. B.; LWT - Food Sci. Technol. 2020, 131, 109773. [Crossref] |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access