Artigo
|
|
| Fósseis moleculares da matéria orgânica siluriana da formação tianguá (bacia do Parnaíba), nordeste do Brasil: implicações paleoambientais e maturação térmica Molecular fossils from silurian organic matter of the tianguá formation (Parnaíba basin), northeastern Brazil: paleoenvironmental implications and thermal maturation |
|
Iara Samara de Alcantara SilvaI; Michel R. de B. ChavesII; Ailton da Silva BritoIII; Afonso C. R. NogueiraIII; Sidney Gonçalo de LimaI,*
I. Departamento de Química, Universidade Federal do Piauí, Campus Universitário Ministro Petrônio Portella, 64049-550 Teresina - PI, Brasil Recebido em 16/02/2022 *e-mail: sidney@ufpi.edu.br The Parnaíba Basin covers an area of 665,888 km2 between the northern and northeastern regions of Brazil. It is completely made up of siliciclastic sedimentary and volcanic rocks with ages varying between the Silurian and the Cretaceous. Among the formations of the Basin, the Tianguá Formation is considered a potential source rock. However, there are few geochemical and/or geological studies and no research work on the molecular parameters of the organic matter (OM) present in its outcropping rocks (OR). Thus, the objective of the present work is to characterize the OM, concerning the depositional paleoenvironment and the degree of thermal evolution, through molecular parameters and OM content. The OM was extracted using the Soxhlet system, chromatographed by classical methods, and analyzed using GC-MS and GC-MS/MS. The samples exhibited low total organic carbon values (TOC <1) and the molecular parameters of saturated and aromatic hydrocarbons suggested a marine depositional environment, with algae, bacteria, and terrestrial plants input. The C30 biomarkers (24-n-propylcholestane), identified using synthetic standards and usually associated with the Chrysophyte algae, corroborated the marine origin of the depositional environment. In addition, some molecular parameters suggested little thermal evolution. INTRODUÇÃO A descoberta relativamente recente de campos de gás natural tornou a Bacia do Parnaíba uma fronteira exploratória, o que despertou o interesse das companhias petrolíferas e gerou a necessidade de estudos detalhados das prováveis rochas geradoras e reservatórias da bacia. O gás da Bacia do Parnaíba tem potencial para colocar o Brasil em um novo patamar no cenário internacional de exploração e produção de gás natural em bacias sedimentares terrestres. De acordo com a Agência Nacional do Petróleo1 o Brasil possui 29 bacias sedimentares com grande potencial em pesquisas de hidrocarbonetos, possuindo uma área de extensão de 7,175 milhões de km2, mas somente um pequeno percentual dessas áreas está sob contratação para as atividades de exploração e produção. Os estudos sobre o potencial gerador da Bacia do Parnaíba estão focados principalmente nos folhelhos devonianos da Formação Pimenteiras,2-4 que forma, junto com os arenitos e diamictitos da Formação Cabeças, o principal sistema petrolífero da Bacia. Ainda assim, pouca atenção tem sido dada aos folhelhos da Formação Tianguá, devido, provavelmente, aos baixos teores de carbono orgânico total, que normalmente são inferiores a 1,0%, alcançando até 1,2% em alguns níveis.5 No entanto, essa Formação vem sendo considerada uma provável geradora secundária, o que torna necessário estudos detalhados de cunho geoquímico para identificar o real potencial gerador dos folhelhos da Formação Tianguá. Os poucos dados disponíveis sobre geoquímica orgânica dessa unidade são restritos a tese apresentada por Rodrigues,6 na qual a petrografia revelou alta proporção de matéria orgânica (MO) oxidada, liptinita e matéria orgânica amorfa. Os dados de reflectância de vitrinita (0,60-1,35) indicam que esta unidade se encontra termicamente matura em grande parte da bacia, onde os maiores valores de refletância de vitrinita estão associados à ocorrência das maiores espessuras das rochas intrusivas. A Formação Tianguá faz parte da sequência mais antiga da Bacia do Parnaíba, denominada de Grupo Serra Grande. É composta por folhelhos, siltitos e arenitos micáceos depositados em plataforma marinha rasa, ricos em microfósseis marinhos7,8 da época Llandovery.9 Características geológicas A Bacia intracratônica do Parnaíba está inserida na Plataforma Sul-Americana, localizada na porção nordeste ocidental do Brasil, abrangendo cerca de 600.000 km2 e com um pacote de rochas essencialmente siliciclásticas, além de vulcânicas juro-cretáceas, que alcança cerca de 3,5 km de espessura no depocentro.8,10 O preenchimento litoestratigráfico da Bacia do Parnaíba foi subdivido em cinco sequências deposicionais denominadas siluriana, mesodevoniana-eocarbonífera, neocarbonífera-eotriássica, jurássica e cretácea, com base em discordâncias regionais, dados sísmicos e bioestratigráficos.8,10,11 A origem da Bacia está relacionada aos pulsos terminais do Ciclo Brasiliano que promoveu o início da subsidência do embasamento e formação de feições grabenformes, preenchidos posteriormente pelos sedimentos clásticos das formações Riachão (proterozóico) e Jaibaras (cambro-ordoviciano).10,12 Com a continuação da evolução termo-mecânica da bacia, formou-se no Siluriano uma grande depressão que foi preenchida por sedimentos flúvio-deltaicos a marinho raso, perfazendo um ciclo transgressivo-regressivo completo10 representado pelo Grupo Serra Grande. O Grupo Serra Grande compreende as formações Ipu, Tianguá e Jaicós que formam uma super sequência de segunda ordem. A Formação Ipu representa o início do preenchimento da sinéclise e registra a primeira glaciação da Bacia do Parnaíba.7 Por sua vez, a Formação Tianguá representa a primeira transgressão marinha da Bacia do Parnaíba e registra a superfície de inundação máxima da sequência siluriana. Seus depósitos são correlacionáveis no Brasil com a Formação Pitinga da Bacia do Amazonas e Formação Vila Maria da Bacia do Paraná, na África do Norte com os folhelhos da Formação Imirhou e com os arenitos Elmina da Bacia Accra e na África do Sul é correlacionada com a Formação Pakhuis e os folhelhos Cedarberg.7 Os depósitos da Formação Tianguá jazem concordantemente sobre os depósitos glaciais da Formação Ipu. Compreendem uma sequência de (1) folhelhos negros a cinza escuro laminados, normalmente fortemente bioturbados que passam para (2) arenito fino a médio com estratificação espinha-de-peixe, com intercalação de folhelhos e (3) folhelhos cinzas escuros a esverdeados7,13 que chegam a 270 m de espessura no depocentro.14 Essas características sugerem deposição dos sedimentos com origem em ambiente marinho raso dominado por maré, durante a transgressão pós-glacial que se instalou no Gondwana após a glaciação siluriana. O conteúdo orgânico previamente identificado é de origem marinha, de ambiente nerítico, dominado por acritarcos, quitinozoários, algas clorofíceas e Tasmanites, com poucos miósporos e hemicordados.7,9 Esses microfósseis estão entre os seres eucariotas mais antigos registrados em sedimentos marinhos rasos, sendo considerados como prováveis algas plactônicas que se espalharam nos mares paleozoicos.13 As amostras utilizadas nesse trabalho foram coletadas em afloramentos na porção norte da borda leste da bacia onde o Grupo Serra Grande aflora. Essa região apresenta boas exposições tanto da Formação Tianguá quantos das outras duas unidades da sequência siluriana (Figura 1).
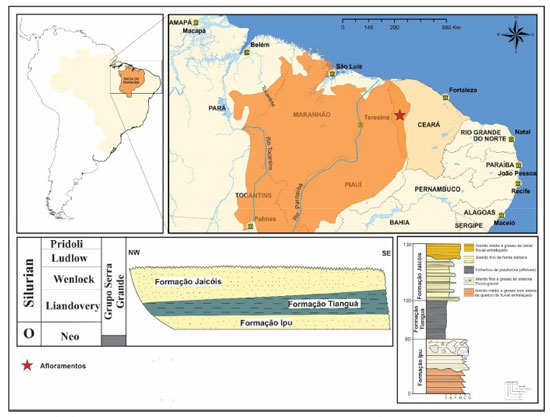 Figura 1. Mapa de localização da Bacia do Parnaíba com os respectivos afloramentos da sequência siluriana onde as amostras utilizadas neste trabalho foram coletadas. O perfil estratigráfico mostra que a Formação Tianguá ocorre na borda leste, com cerca de 20 m de espessura sobreposta a Formação Ipu e sotoposta a Formação Jaicós
Estudos sobre a Formação Tinguá são essencialmente de cunho palinológico, sedimentológico e estratigráfico. Há uma ausência de estudos sobre a geoquímica orgânica, principalmente sobre a composição molecular, que associados aos dados geológicos, permitam uma maior discussão sobre a potencialidade dessa unidade para a geração de hidrocarbonetos. Assim, o objetivo geral desse estudo foi caracterizar a MO presente em rochas de afloramento por meio de fósseis químicos (biomarcadores) usando parâmetros moleculares obtidos por meio das técnicas cromatografia a gás com detecção por espectrometria de massas (CG-EM) e por detecção de massas sequencial (CG-EM/EM) e avaliar o paleoambiente deposicional, maturação e origem da MO.
MATERIAIS E MÉTODOS Tratamentos das amostras Um total de três amostras de rochas de afloramento da Formação Tianguá coletadas no município de Tianguá-CE foram submetidas a raspagem para evitar a contaminação associada à exposição subaérea. Em seguida, foram lavadas com água destilada, etanol e por fim foram secas. As rochas foram trituradas para obter os respectivos pós antes de suas análises geoquímicas. Análise de carbono orgânico total (COT) Aproximadamente 0,5 g de amostra foi lavada com HCl a quente durante 1 hora. A massa do resíduo insolúvel foi determinada e levada para combustão no analisador de Teor de Carbono Orgânico Total (COT) LECO CS 632. A quantidade liberada de CO2 foi medida através de um detector de condutividade térmica e o valor do COT da amostra foi expresso em porcentagem de massa relativa à amostra original. Extração da matéria orgânica por Soxhlet Cerca de 150 g de amostra pulverizada foi submetida à extração em sistema do tipo Soxhlet. A amostra foi transferida para o papel-filtro dobrado em forma de cone, que em seguida foi transferido para o Soxhlet, enquanto o cobre metálico, empregado para a remoção do enxofre elementar, foi transferido para o balão. O sistema de solvente utilizado para a extração foi uma solução de 220 mL de diclorometano/metanol 12% (v/v), mantido durante 24 horas e, em seguida, essa solução foi filtrada para a retirada do cobre. Uma vez realizada a extração, a matéria orgânica (MO) foi concentrada em rotaevaporador, sendo então transferida para um frasco pesado e devidamente identificado. Cromatografia líquida em coluna A MO obtida foi fracionada através de cromatografia em coluna (CC) utilizando sílica impregnada com AgNO3 a 10% como fase estacionária, em uma proporção 1:55 (amostra: fase estacionária). Na coluna, foram usados 13 mg de MO da amostra PFT-I, 10,6 mg da amostra PFTT-II e 10,1 mg da amostra PFT-III para a obtenção das frações de hidrocarbonetos. O sistema de eluentes utilizados foram hexano (10 mL) para a fração saturada (P1); hexano: acetato de etila 20% (10 mL) para a fração aromática (P2); acetato de etila: metanol 5% (10 mL) para a fração NSO (P3).15 Método de análise para CG-EM As análises por CG-EM das frações saturadas foram realizadas em um cromatógrafo da Shimadzu, modelo GCMS-QP2010 SE, equipado com auto injetor AOC-5000, seguindo as seguintes condições de análise: injetor 290 °C, razão split de 1:10, temperatura inicial do forno de 60 °C (1 min). Para esse método, duas rampas de aquecimento foram apresentadas, a primeira de 6 °C/min até 280 °C permanecendo por 5 min e a segunda de 1 °C/min até 315 °C, mantendo assim durante 15 min. Para a cromatografia dos componentes, foi empregada uma coluna Rtx-5MS, 30 m × 0,25 mm, espessura do filme interno de 0,10 µm com fase estacionária de 5% difenil e 95% de difenildimetilpolissiloxano, usando hélio como gás de arraste com fluxo de 1,0 mL/min. A temperatura de interface e da fonte de íons foi 300 °C e 260 °C, respectivamente. O analisador de massas utilizado foi do tipo quadrupolo, ionizador de impacto eletrônico (70 eV) e os fragmentos detectados na faixa de 47 a 650 Da. A identificação dos biomarcadores foi feita por comparação das ordens de eluição, tempos de retenção e espectros de massas com dados da literatura. Método de análise para CG-EM/EM As frações foram analisadas em um sistema CG-EM (ThermoScientific, TSQ Quantum XLS Ultra, Triplo Quadrupolo) primeiramente no modo de varredura (m/z 50-650), no modo EI positivo, utilizando uma coluna capilar de sílica fundida (EquityTM-1; 30 m x 0,25 mm d.i; d.f. = 0,10 µm). A temperatura inicial do forno foi de 60 °C, mantida por 4 min, seguido de uma rampa de 6 °C min-1 até uma temperatura de 280 °C, onde permaneceu por 5 min e, em seguida, 1 °C/min até 310 °C, mantendo assim por 10 min. O gás de arraste foi hélio, mantido sob fluxo constante de 1 mL min-1. A temperatura da linha de transferência foi de 300 °C e a temperatura da fonte foi de 230 °C. Após a otimização das condições de análises, os íons precursores e produtos foram selecionados. A amostra foi novamente analisada, a fim de determinar a energia de colisão (EC) mais apropriada para o conjunto de fragmentações propostas, sendo as condições otimizadas descritas: EC de 70 eV, pressão do gás de colisão (Argônio) foi mantida em 1 mTorr, digitalização Tempo de Ciclo de 1 s. A identificação de biomarcadores foi realizada por comparação da ordem de eluição, tempos de retenção e espectros de massa no modo de varredura com os dados da literatura.
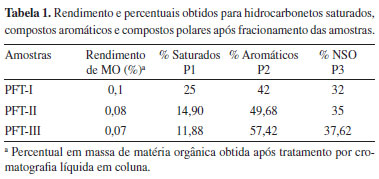
RESULTADOS E DISCUSSÃO Carbono orgânico total (COT) Os valores de COT para as amostras de afloramento da Formação Tianguá foram inferiores 1,0%, o que impossibilitou a análise por Rock-Eval, medida que fornece informação sobre potencial de geração de hidrocarbonetos16 e que, junto com o COT, define o tipo de matéria orgânica presente no sedimento. Esse valor de COT inferior a 1% coincide com os resultados obtidos para amostras de testemunhos relatados por Rodrigues (1995), um trabalho pioneiro em estudo geoquímico orgânico para a Bacia do Parnaíba. As frações de matéria orgânica obtida por meio da cromatografia líquida em coluna apresentaram rendimentos variando de 11,9-25% para a fração saturada, 42-57,4% para fração aromática e de 32-37,62% para os compostos polares (NSO) (Tabela 1). De modo geral, os resultados mostraram a predominância de compostos aromáticos e polares (NSO) em relação à fração saturada.
n-alcanos lineares e isoprenóides Todas as amostras da fração saturada mostraram características bem semelhantes, apresentando a série de n-alcanos variando de n-C15 a n-C37 (Figura 2) e distribuição unimodal com a maior abundância entre n-C16 e n-C18, sendo que este predomínio de compostos de cadeia curta e maior abundância relativa de n-C18 tem sido relatado em sedimentos provenientes de ambientes marinhos anóxicos.17 A Tabela 2 apresenta os parâmetros geoquímicos calculados para os hidrocarbonetos da fração saturada da Formação Tianguá.
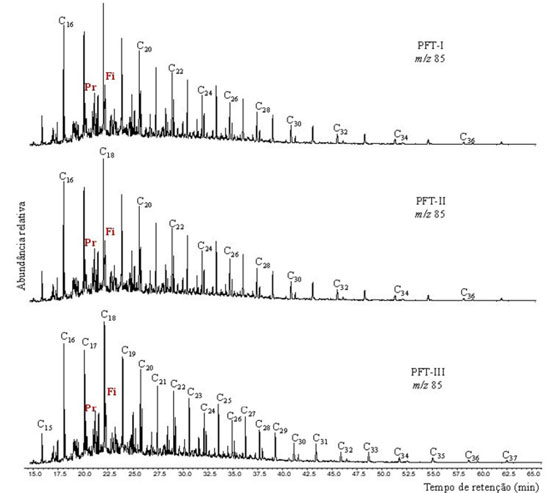 Figura 2. Cromatograma de íons reconstruídos m/z 85 (n-alcanos) da Formação Tianguá, Bacia do Parnaíba, identificados em CG-EM
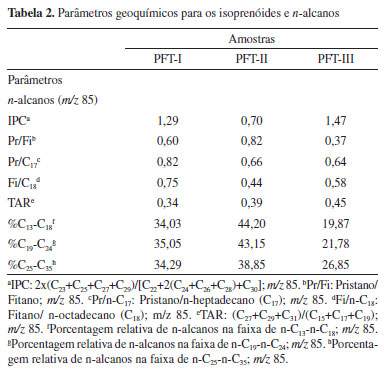
O IPC (índice de preferência de carbono) indica baixa maturidade térmica de MO quando seu valor for <<1 ou mesmo >>1, segundo Peters, Walters e Moldowan, o que indicaria que as amostras de afloramento apresentam MO imatura, uma vez que os valores de IPC para as amostras analisadas variaram de 0,70 a 1,47. Entretanto, esse parâmetro deve ser utilizado com cautela e em conjunto com outros parâmetros de biomarcadores específicos para avaliação da maturidade térmica, uma vez que eles são afetados pelos processos de biodegradação e fonte que ocorrem nesses compostos.18 As relações de n-alcanos e isoprenoides (Pr/C17 e Fi/C18) apresentaram valores característicos de extrato maduro, enquanto o cálculo para a relação Pr/Fi (Tabela 2) apresentou valores variando de 0,37 a 0,82, sugerindo ambiente deposicional redutor. As porcentagens relativas dos grupos de n-alcanos que variam de n-C13-n-C18, n-C19-n-C24 e n-C25 a n-C35 foram calculadas. Os grupos correspondem a três fontes biológicas de produtores de ácidos graxos, sendo o primeiro grupo (n-C13 a n-C18) originário de fitoplâncton e zooplâncton, o segundo grupo (n-C19 e n-C24) sendo proveniente de bactérias e o terceiro grupo (n-C25 para n-C35) a partir de plantas vasculares superiores.19,20 Os parâmetros calculados para os grupos n-C13 a n-C18 e n-C19 a n-C24 (Tabela 2) sugeriram uma maior contribuição de fitoplâncton, zooplâncton e bactérias no paleoambiente deposicional. Terpanos tri, tetra e pentacíclicos Nas amostras estudadas foram identificados terpanos tricíclicos, tetracíclicos e pentacíclicos em CG-EM pelo íon base m/z 191 (Figura 3). Todos os compostos identificados estão listados na Tabela 1S no material suplementar. Os terpanos tricíclicos (Figura 3) detectados nesse trabalho variaram de C20 até C24, enquanto para os tetracíclicos foram identificados os compostos C24, C25 e C26. Todas as amostras mostraram uma distribuição similar para estas classes.
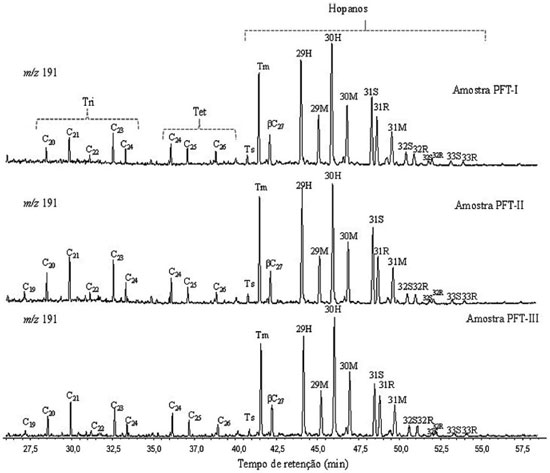 Figura 3. Cromatograma de íons monitorados m/z 191 para os terpanos tricíclicos, tetracíclicos, hopanos identificados em CG-EM
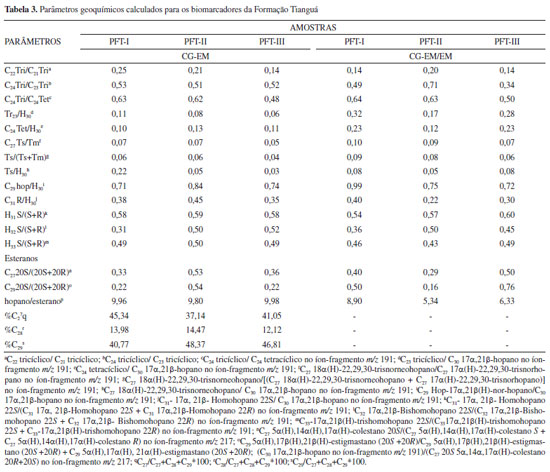
Os terpanos tricíclicos podem fornecer informações sobre a origem da MO. Tendo isso em vista, as razões C22Tri/C21Tri (0,14-0,25); C24Tri/C23Tri (0,51-0,53) e C24Tri/C24Tet (0,48-0,63) apresentaram valores relativamente baixos a médios (Tabela 3), podendo indicar matéria orgânica de origem mista, proveniente de algas, bactérias e plantas terrestres.21-23
Ao comparar os terpanos tri com os pentacíclicos, valores <1 para as relações C23Tri/C30Hopano (0,06-0,11) apresentaram indicativo de contribuição de matéria orgânica de origem bacteriana.24,25 Por sua vez, os valores baixos de terpanos tetracíclicos obtidos para a relação C24Tet/C30Hopano (0,10-0,13) sugerem condição marinha e contribuição de matéria orgânica de algas e microrganismos.26 Para obter esses parâmetros, os terpanos tricíclicos foram confirmados por CG-EM/EM por meio do monitoramento das transições m/z 262→191; 276→191; 290→191; 304→191; 318→191 e 332→191, que estão apresentados na Figura 4.
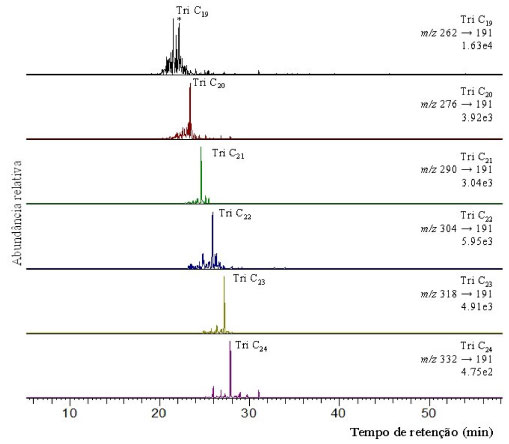 Figura 4. Análise em CG-EM/EM dos terpanos tricíclicos para as transições íon precursor-íon produto (m/z 262→191; 276→191; 290→191; 304→191; 318→191; 332→191) da amostra PFT-I
Para os terpanos pentacíclicos, foi observada a predominância de 17α(H),22,29,30-tris-nor-hopano (Tm), C29 nor-hopano (H29), 17α,21β(H)-hopano (H30) e homohopanos de C31 a C33 (22S e 22R) (Figura 3). Todos os hopanos pentacíclicos identificados nas amostras foram confirmados por CG-EM/EM através do monitoramento das transições m/z 370→191; 398→191; 412→191; 426→191; 440→191 e 454→191, que estão apresentadas na Figura 5. Tm e Ts (18α(H)-22,29,30-trisnorneohopano), apresentados na Figura 3, são conhecidos por serem influenciados pela maturação, tipo de matéria orgânica e pela litologia.26-28 As razões Ts/(Ts+Tm) e C27Ts/Tm (Tabela 3) podem, por sua vez, ser utilizadas para avaliação da maturidade, uma vez que durante a diagênese, o Tm é instável e se converte em Ts (mais estável), diminuindo a sua proporção com o aumento da maturação.28 Os valores obtidos para os índices Ts/(Ts+Tm) (0,04-0,06) e Ts/Tm (0,05-0,07) indicam que as amostras apresentam baixa maturidade térmica.
 Figura 5. Análise em CG-EM/EM das transições íon precursor-íon produto (m/z 370→191; m/z 398→191; m/z 412→191; m/z 426→191; m/z 440→191 e m/z 454→191). H: Hopanos; M: Moretanos (17β,21α(H)-Hopano) da amostra PFT-I
Os biomarcadores C31 22R-homohopano e C30 hopano são utilizados para caracterizar diferentes ambientes deposicionais. Dessa forma, amostras provenientes de ambientes marinhos apresentam valores da razão C31 22R-homohopano/C30 hopano geralmente superiores a 0,25, enquanto para ambientes lacustres essa razão é inferior a 0,25.26,29 As amostras estudadas apresentaram valores entre 0,35 e 0,45 (Tabela 3), portanto sugerindo ambiente deposicional marinho. Os homohopanos C31 ou C32 (Figura 3) são comumente usados para avaliação da maturidade por meio da razão entre seus isômeros 22S/(22S + 22R), que aumenta de 0 até ~0,6 (equilíbrio em 0,57-0,62) durante o processo de evolução térmica, culminando na janela de geração de óleo.28,30 Os valores para todas as amostras apresentaram proporções baixas para os homohopano H31, H32, H33, sugerindo evolução térmica baixa. Esteranos Esteranos e diasteranos foram analisados a partir do íon base m/z 217 nos cromatogramas de íons reconstruídos e a distribuição desses biomarcadores é mostrada na Figura 6. Esses compostos foram identificados através da comparação de ordem de eluição e confirmados por meio das transições m/z 372→217; m/z 386→217; m/z 400→217 em CG-EM/EM, conforme mostrado na Figura 7. Os compostos identificados para os esteranos regulares estão listados na Tabela 2S no material suplementar.
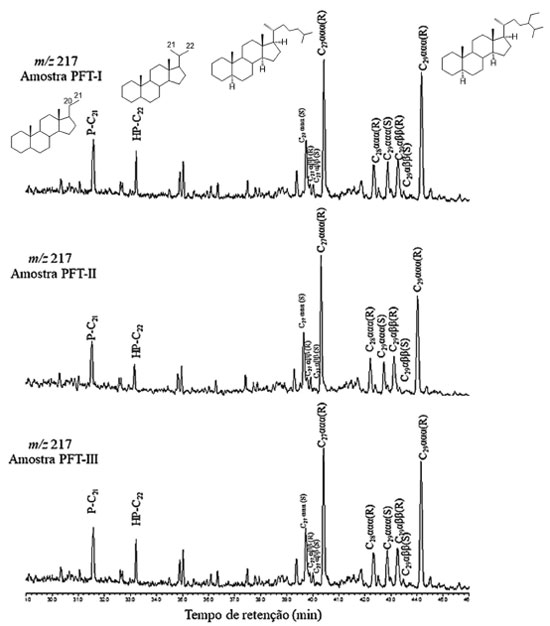 Figura 6. Cromatograma de íons reconstruídos para o íon-fragmento m/z 217 típico mostrando a distribuição dos esteranos do extrato da MO das três amostras da formação Tianguá
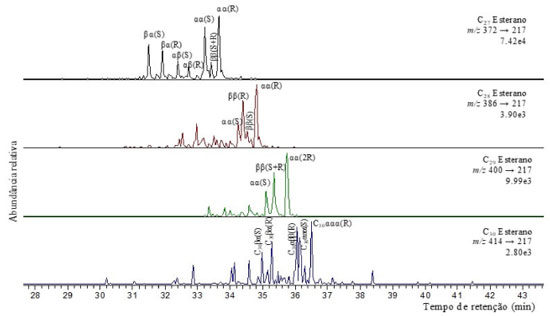 Figura 7. Análise em CG-EM/EM das transições íon precursor-íon produto (m/z 372→217; m/z 386→217; m/z 400→217 e m/z 414→217) para a amostra PFT-I
Os esteranos foram identificados em todas as amostras analisadas, com a predominância dos esteranos C27 e C29 (Figura 6), sendo também observada a presença dos esteranos de baixa massa molecular pregnano (P-C21) e homopregnano (HP-C22), normalmente encontrados em amostras provenientes de ambientes hipersalinos.31 Em geral, as amostras estudadas apresentaram valores baixos para as razões C27 20S/(20S+20R) (0,33-0,53) e C29 20S/(20S+20R) (0,22‑0,54) quando analisados por CG-EM (Tabela 3), salvo a amostra PFT-II, que apresentou valores que se aproximem do valor de equilíbrio (0,52-0,55) para a isomerização desses esteranos.32,33 Para uma melhor avaliação desses parâmetros, uma análise das amostras em CG-EM/EM foi realizada, devido a uma possível co-eluição desses compostos com outras classes de biomarcadores. Com exceção do C29 da amostra PFT-III, os valores obtidos para C27 20S/(20S+20R) (0,29-0,50) e C29 20S/(20S+20R) (0,16-0,76) (Tabela 3) novamente se mostraram abaixo dos valores de equilíbrio, sugerindo baixa maturação térmica. O esterano C29 (40,77% a 48,37%) apresentou a maior abundância relativa nas amostras analisadas por CG-EM (Tabela 3) em relação aos esteranos C27 (37,14 a 45,34) e C28 (12,12 a 14,47), o que denota uma contribuição de vegetais superiores.29,34 No entanto, Volkman observou que quando a maioria dos parâmetros estudados para a MO indicam origem marinha, o predomínio do esterano C29 é indicativo da contribuição de algas marinhas, já que ele também ocorre em grande abundância em certas espécies destes organismos, o que pode ser corroborado pelas razões C31-22R-hopano/C30-hopano e C24Tet/C30Hopano, que também sugerem origem marinha. A presença do esterano C30 também foi detectada nas amostras em estudo (Figura 7, transição m/z 414→217). Esses compostos podem ser identificados em nível de traço ou em baixas concentrações e são utilizados para diferenciar fontes marinhas de fontes terrestres.18 Quando ocorre a identificação dos esteranos C30 do tipo 24-n-propil-colestano, este é comumente utilizado como um indicador de deposição sedimentar marinha.35 A Figura 8 apresenta as respectivas transições típicas de C30 esteranos, mais especificamente para os biomarcadores 24-n-propilcolestano e 24-isopropilcolestano. Os 24- n-propilcolestanos são biomarcadores diagnósticos para algas crisófitas marinhas da ordem Sarcinochrysidales e algas pardas, enquanto os isómeros de 24-isopropilcolestanos (produto diagenético do 24-isopropilcolesterol) podem ser produzidos por demosponjas marinhas.29 Estudos recentes de Gold et al.36 forneceram suporte adicional para a afinidade poriferiana de 24-isopropilcolestanos em rochas de idade Neoproterozoica (a hipótese de "biomarcador de esponja") e sugerem que algumas algas no registro geoquímico também poderiam ter contribuições de animais.
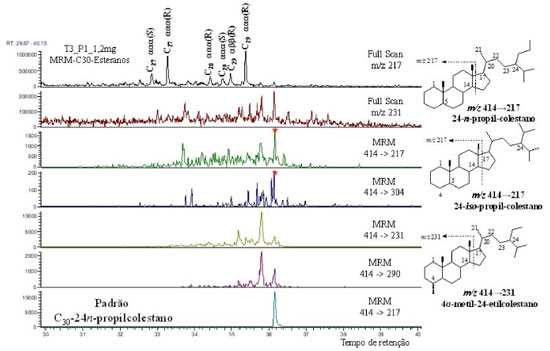 Figura 8. Cromatograma de íons reconstruídos para as transições dos íons-fragmento m/z 414→217 (24-n-propilcolestano, incluindo o padrão sintético, e 24-isopropilcolestano), m/z 414 →304 (típicas para a série 24-n-propilcolestano), m/z 414→231 (24-etilcolestano), m/z 414→290 (série 4-metilcolestano) da amostra PFT-I. O 24-n-propilcolestano (C30), na transição m/z 414→217, foi sintetizado pelos colaboradores do grupo de pesquisa no Instituto de Química da UNICAMP como parte de um projeto em parceria com a Petrobras34
Hidrocarbonetos policíclicos aromáticos (HPAs) A distribuição de hidrocarbonetos aromáticos policíclicos nas três amostras de afloramento analisadas permitiu identificar os compostos fenantreno, por meio do íon m/z 178, e alquifenantrenos, por meio do íon m/z 192 (Figura 9). Esses e os demais HPAs identificados estão presentes na Tabela 3S.
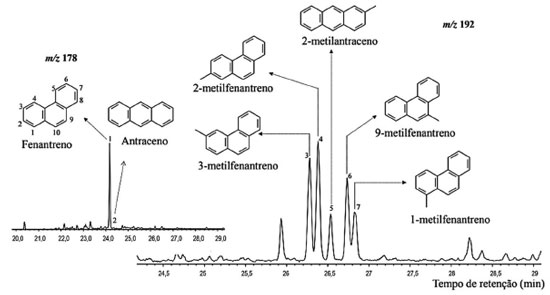 Figura 9. Cromatograma de íons reconstruídos para m/z 178 (Fenantreno) e m/z 192 (metil-fenantreno) para a amostra PFT-I
Fenantreno e metilfenantrenos, compostos derivados de esteroides e triterpenoides,35 foram identificados pelos íons m/z 178 e m/z 192, respectivamente A distribuição dos alquilderivados do fenantreno (3-MF, 2-MF, 1-MF e 9-MF) depende da maturidade da matéria orgânica, uma vez que com o aumento da evolução térmica, a proporção entre os isômeros dessa classe de compostos frequentemente exibe variações regulares. Essas variações são decorrentes do processo de metilação do fenantreno, que se inicia durante a diagênese com a produção de 9-MF no início desse processo.37 Dessa forma, a predominância desse isômero sobre os demais em sedimentos imaturos e levemente maturos está possivelmente associado a esse processo de metilação.38 Os valores baixos para a razão ∑MF/F refletem a baixa formação dos alquiderivados a partir da metilação do fenantreno, pontuando a baixa maturidade das amostras. Ainda, dentre os isômeros de metilfenantreno (1-MF, 2-MF, 3-MF, 4-MF e 9-MF), o 9-MF, 1-MF e 4-MF são menos estáveis do que os isômeros 2-MF e 3-MF, indicando que em amostras imaturas há uma predominância dos primeiros e após o equilíbrio entre isômeros ser atingido em amostras maturas, há o enriquecimento de 2-MF e 3-MF. Dessa forma, os índices de metil-fenantreno (IMF) IMF-1, IMF-2 e a razão de metil-fenantrenos (RMF) (Tabela 4) pode ser empregados como parâmetros geoquímicos calculados com base na isomerização dos metilfenantrenos.39 Com isso, os valores baixos para IMF-1, IMF-2 e RMF corroboram a baixa maturidade das amostras de afloramento avaliadas.
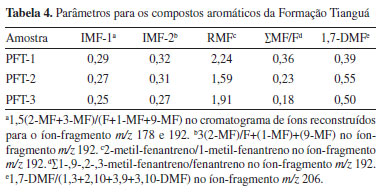
A identificação dos dimetil-fenantrenos (DMF) se deu pelo íon m/z 206, conforme ilustrado na Figura 10, em que é exibido o cromatograma de íons reconstruídos com a distribuição desses compostos. Enquanto Khan et al.40 afirmavam que os valores das proporções de 1,7-DMF/(1,3- DMF +2,10- DMF +3,9- DMF +3,10‑ DMF) ≤ 0,35 poderiam sugerir contribuição de pteridospermas ou pteridospermas de glossopteris, Hossain et al.41 apontou que quando esses valores estivessem de 0,19 a 1,09 para essas proporções era indicativo de fontes variáveis de matéria orgânica e/ou uma mudança de flora. Esse último é o caso para as amostras em estudo, cujos valores de 1,7-DMF variaram de 0,39-0,55 (Tabela 4).
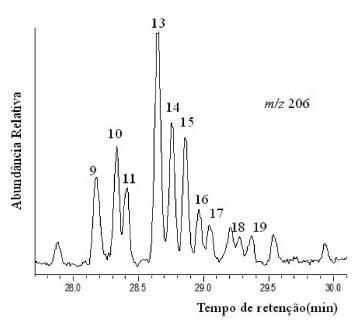 Figura 10. Perfil dos dimetilfenatrenos no cromatograma de íons reconstruídos do íon m/z 206 da amostra PFT-I
CONCLUSÕES Os n-alcanos em todos os extratos variaram entre n-C14 a n-C37 e distribuição unimodal com maior predominância entre n-C16 e n-C18, característico de ambiente marinho. As razões dos isoprenoides Pristano (Pr) e Fitano (Fi) sugerem um ambiente deposicional redutor. As relações C22Tri/C21Tri, C24Tri/C23Tri e C24Tri/C24Tetra e esteranos C27, C28 e C29 apresentaram características de origem mista para a MO, cuja contribuição marinha é possivelmente proveniente de algas e bactérias. A deposição em ambiente marinho com contribuição de matéria orgânica algálica é corroborado pela relação C24Tri/C30Hopano e C30 24-n-propilcolestanos. Os parâmetros calculados para os grupos n-C13 a n-C18 e n-C19 a n-C24 indicaram que a matéria orgânica marinha da Formação Tianguá é composta por fitoplâncton, zooplâncton e bactérias. Logo, apesar das condições transgressivas pós-glacial, o ambiente deposicional marinho raso dominado por maré foi provavelmente o fator inibidor da alta. A unidade apresenta matéria orgânica de alta qualidade para geração de hidrocarboneto. Contudo, o baixo teor de carbono orgânico (< 1%) somado à baixa maturação térmica, indicada pelas relações C27 e C29 20S/(20S+20R) esteranos regulares, homohopano H31, H32, H33, IMF-1 e IMF-2, apontam baixo potencial enquanto rocha geradora.
MATERIAL SUPLEMENTAR As tabelas indicando os terpanos tri, tetracíclicos e hopanos pentacíclicos (Tabela 1S), esteranos (Tabela 2S) e hidrocarbonetos aromáticos (Tabela 3S) identificados nos cromatogramas obtidos a partir da matéria orgânica das rochas de afloramento da Formação Tianguá podem ser encontrados no material suplementar, que pode ser acessado gratuitamente em http://quimicanova.sbq.org.br, na forma de arquivo pdf.
AGRADECIMENTOS Os autores agradecem ao Laboratório de Geoquímica Orgânica (LAGO), a UFPI, a CAPES e a FAPEPI pela bolsa concedida.
REFERÊNCIAS 1. https://www.gov.br/anp/pt-br/assuntos/exploracao-e-producao-de-oleo-e-gas, acessada em agosto 2022. 2. Young, C. G. K.; Tese de doutorado, Universidade Federal do Rio de Janeiro, Brasil, 2006. 3. Sousa, I. V. A. F.; Tese de doutorado, Universidade Federal do Rio de Janeiro, Brasil, 2007. 4. Gama Junior, J. M.; Tese de doutorado, Universidade de Brasília, Instituto de Geociências, Brasil, 2008. 5. de Araújo, D. B.; Bacia do Parnaíba: Sumário Geológico e Setores em Oferta, 2015. 6. Rodrigues, R. A,; Tese de doutorado, Universidade Federal do Rio Grande do Sul, 1995. 7. Caputo, M. V.; Lima, E. C.; Anais do XXXIII congresso brasileiro de geologia, Rio de Janeiro, Brasil, 1984. 8. Góes A. M.; Feijó, F. J.; Boletim de Geociência da Petrobras 1994, 8, 57. 9. Le Hérissé, A.; Mello, J. H. G.; Quadros, L. P.; Grahn, Y.; Steemans, P.; Seção Exploração de Petróleo, 2001, 20. 10. Vaz, P. T.; Rezende, N. das G. de A.; Filho, J. R. W.; Travassos, W. A. S.; Bol. Geociência Petrobras 2007, 15, 253. 11. Della, F. J. C.; Tese de Doutoramento, Universidade do Rio Grande do Sul, Brasil, 1990. 12. Oliveira, D. C.; Mohriak, W.; Mar. Pet. Geol. 2003, 20, 351. [Crossref] 13. Santos, M. E. C.; Carvalho, M. S.; Programa de Levantamento Geológios Básicos do Brasil-PLGB; Paleontologia das bacias do Parnaíba, Grajaú e São Luís; 211a ed.; CPRM- Serviço Geólogico do Brasil, 2009. 14. Caputo, M. V.; Tese de Doutorado, Universidade da California, Santa Barbara, 1984. 15. Moura, A. K. S.; Santos A. L. S.; Citó, A. M. G. L.; XIII Congresso de Geoquímica dos Países da Língua Portuguesa, 2016. 16. Sykes, R.; Snowdon, L. R.; Org. Geochem. 2002, 33, 1441. [Crossref] 17. Wang, Y.; Fang, X.; Zhang, T.; Li, Y.; Wu, Y.; He, D.; Wang, Y.; Appl. Geochem. 2010, 25, 1478. [Crossref] 18. Peters, K. E.; Walters, C. C.; Moldowan, J. M.; The biomarker guide: biomarkers ad isotopes in petroleum exploration and earth history; vol. 2, 2nd ed.; Cambridge University Press: New York, 2005, cap. 13. 19. Fabiańska, M. J.; Kurkiewicz, S.; Int. J. Coal Geol. 2013, 107, 24. [Crossref] 20. Tissot, B. P.; Welte, D. H.; Petroleum Formation Occurrence, Springer-Verlag: New York, 1984. 21. Ding, X.; Liu, G.; Zha, M.; Gao, C.; Huang, Z.; Qu, J.; Lu, X.; Wang, P.; Chen, Z.; Mar. Pet. Geol. 2016, 69, 231. [Crossref] 22. Marynowski, L.; Narkiewicz, M.; Grelowski, C.; Sediment. Geol. 2000, 137, 187. [Crossref] 23. Hakimi, M. H.; Ahmed, A. F.; Mar. Pet. Geol. 2016, 75, 356. [Crossref] 24. Abohajar, A.; Littke, R.; Schwarzbauer, J.; Weniger, P.; Boote, D. R. D.; J. Pet. Geol. 2015, 38, 119. [Crossref] 25. Peters, K. E.; Moldowan, J. M.; Org. Geochem. 1991, 17, 47. [Crossref] 26. Hatem, B. A.; Abdullah, W. H.; Hakimi, M. H.; Mustapha, K. A.; Mar. Pet. Geol. 2016, 72, 83. [Crossref] 27. Moldowan, J. M.; Fago, F. J.; Geochim. Cosmochim. Acta 1986, 50, 343. [Crossref] 28. Seifert, W. K.; Michael Moldowan, J.; Geochim. Cosmochim. Acta 1978, 42, 77. [Crossref] 29. Peters, K. E.; Walters, C. C.; Moldowan, J. M. The Biomarker Guide: Biomarkers and Isotopes in Petroleum Exploration and Earth History, vol. 2; 2nd ed., Cambridge University Press: Cambridge, 2005. 30. Seifert, W. K.; Moldowan, J. M.; Phys. Chem. Earth 1980, 12, 229. [Crossref] 31. Haven, H. L. T.; Leeuw, J. W. D.; Peakman, T. M.; Maxwell, J. R.; Geochim. Cosmochim. Acta 1986, 50, 853. [Crossref] 32. Seifert, W. K.; Moldowan, J. M. In Methods in Geochemistry and Geophysics; Elsevier, 1986; pp. 261-290. 33. Peters, K. E.; Walters, C. C.; Moldowan, J. M. The biomarker guide, vol. 2: biomarkers and isotopes in the petroleum systems and earth history; 2nd ed.; Cambridge University Press: Cambridge, 2005; Vol. 2. 34. Mustafa, K. A.; Sephton, M. A.; Watson, J. S.; Spathopoulos, F.; Krzywiec, P.; Mar. Pet. Geol. 2015, 66, 1042. [Crossref] 35. Rohrssen, M.; Gill, B. C.; Love, G. D.; Org. Geochem. 2015, 80, 1. [Crossref] 36. Gold, D. A.; O'Reilly, S. S.; Watson, J.; Degnan, B. M.; Degnan, S. M.; Krömer, J. O.; Summons, R. E.; Geobiology 2017, 15, 836. [Crossref] 37. Radke, M.; Welte, D. H.; Willsch, H.; Geochim. Cosmochim. Acta 1982, 46, 1. [Crossref] 38. Budzinski1, H.; Garrigues, P.; Connan, J.; Devillers, J.; Domine, D.; Radke, M.; Oudins, J. L.; Geochim. Cosmochim. Acta 1995, 59, 2043. [Crossref] 39. Szczerba, M.; Rospondek, M. J.; Org. Geochem. 2010, 41, 1297. [Crossref] 40. Khan, M. S. R.; Sharma, A. K.; Sahota, S. K.; Mathur, M.; Org. Geochem. 2000, 31, 1495. [Crossref] 41. Hossain, H. M. Z.; Sampei, Y.; Hossain, Q. H.; Roser, B. P.; Sultan-Ul-Islam, M.; Res. Org. Geochem. 2014, 29, 17. [Crossref] |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access