Artigo
|
|
| Um novo composto de coordenação dinuclear projetado para não apresentar danos oxidativos e efeitos toxicológicos A new dinuclear coordination compound designed to have no oxidative damage and toxicological effects |
|
Jamerson H. F. da SilvaI; André GalembeckI; Mônica F. BelianII,*; Wagner E. SilvaII; Jandyson M. SantosII; Jacinto da Costa Silva NetoIII; Jaciana S. AguiarIV; Teresinha GonçalvesIV
I. Departamento de Química Fundamental, Universidade Federal de Pernambuco, 50670-901 Recife - PE, Brasil Recebido em: 28/07/2022 The synthesis, characterization, acute toxicity, antitumor activity, and histopathological analysis of a novel dinuclear platinum(2+) complex - [Pt(DACH-κ2N)µ-(C4H2O6-κ4O)Pt(DACH-κ2N)] - is reported. Through acute toxicity tests, it was possible to place the platinum complexes into categories according to the OECD protocol. The dinuclear complex was classified in category 2 (cisplatin - category 1; and oxaliplatin - category 2). Analyzing the interaction between dsDNA and dinuclear complex was observed an Tm increase, suggesting that the dinuclear complex-dsDNA interact probably through of the interstrand form. Evaluations of tumor masses extracted from mice inoculated with Ehrlich carcinoma demonstrated a percent of tumor inhibition similar for cisplatin and oxaliplatin, but statistically different and superior for the case of the dinuclear complex. Cisplatin and oxaliplatin showed 41.4 and 40.8% inhibition, respectively, while the dinuclear complex presented 66.3%. The histopathological analysis demonstrated that the group treated with cisplatin showed more significant tissue damage, moderate hepatic steatosis, and nephritis. The livers, spleens, and kidneys of the animals treated with the dinuclear complex were within the normality range with no tissue lesions, and absence of metastasis. INTRODUÇÃO Nos últimos anos, algumas estratégias para a síntese de novos complexos de platina configuram um campo de pesquisa particularmente relevante, uma vez que novos protótipos terapêuticos podem surgir como "resoluções inovadoras" para alguns problemas toxicológicos consagradamente apresentados por fármacos antitumorais platínicos, disponíveis no mercado farmacológico, tais como: cisplatina (CDDP), carboplatina (CARBO) e oxaliplatina (OXA) (Figura 1). Alguns procedimentos estratégicos são construídos baseados na redução dos efeitos colaterais e toxicológicos apresentados por esses fármacos, além de minimizar ou retardar o aparecimento do fenômeno de resistência a múltiplas drogas (do inglês, multi-drug resistance - MDR).1-8 Dentro deste contexto, compostos não tradicionais de platina, por exemplo, surgiram como alternativa viável para o desenvolvimento de novos agentes antineoplásicos, entre os quais se ressaltam a possibilidade de ativação de isômeros platínicos trans (em alguns casos); complexos platínicos com utilização de ligantes bioativos (sistemas híbridos); ou pela formação de complexos com mais de um centro metálico (complexos polinucleares - Figura 1). Sendo esta última, a estratégia utilizada em nosso trabalho.9-14
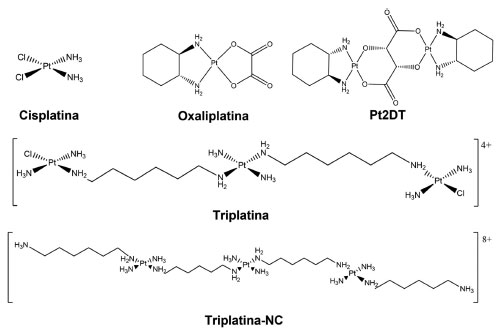 Figura 1. Estruturas químicas de complexos de platina mononucleares (cisplatina e oxaliplatina, disponíveis no mercado farmacêutico) e polinucleares (PPCs, incluindo o Pt2DT)
Os complexos polinucleares de platina (do inglês, polynuclear platinum complexes - PPCs) demonstraram maior atividade antitumoral, quando comparados aos sistemas mononucleares, em decorrência da capacidade em contornarem o fenômeno MDR, apresentando assim, uma maior atividade antitumoral baseada na eficiência do desencadeamento da apoptose celular. Essa eficiência consiste em mecanismos bioquímicos, apresentados pelos PPCs, cujas interações Pt-DNA nuclear (nDNA) são entre as fitas que compõe a dupla hélice (interação interfitas). Isso gera um maior acúmulo de lesões gênicas e ligações cruzadas de longo alcance, e são responsáveis por alterações conformacionais (torções) na estrutura do nDNA de difícil correção, desencadeando apoptose.15-17 Em relatos da literatura, os PPCs demonstraram propriedades biológicas interessantes em ensaios in vitro, entre as quais podemos ressaltar o aumento da taxa de acúmulo em células tumorais, incluindo, principalmente, as linhagens celulares resistentes à cisplatina e mutantes p53.18,19 Alguns PPCs entraram nas fases I e II dos ensaios clínicos no ano de 1990, como o complexo triplatina - BBR3464 (Figura 1a).20,21 Neste complexo, dois dos três centros de platina possuem ligantes cloreto, os quais permitem a formação de duas ligações monofuncionais com nDNA, através de ligações cruzadas de longo alcance.22,23 O complexo triplatina demonstrou alta citotoxicidade, cujas concentrações de dose letal foram da ordem de micromolar.24 De acordo com o exposto, este trabalho propõe a obtenção de um PPC (dinuclear) baseado no ligante em ponte, o íon tartarato (C4H2O64-), com a perspectiva de produzir um complexo análogo à oxaliplatina. O uso do ligante tartarato para a síntese do sistema dinuclear foi fundamental, uma vez que é um ácido de baixa toxicidade, podendo ser encontrado em uvas e mosto, banana e tamarindo.25 Além disso, compostos com o íon tartarato, segundo o sistema de classificação biofarmacêutica (SCB), são altamente solúveis e permeáveis, favorecendo dinâmicas maiores de influxo celular.26 A esfera de coordenação do íon Pt2+, cujo número de coordenação é 4, foi completada através do ligante (1R,2R)(-)1,2-diaminociclohexano (DACH) (Figura 1). O composto dinuclear foi caracterizado através de técnicas espectroscópicas e espectrométricas, e avaliado biologicamente, através de ensaios de toxicidade aguda e atividade antitumoral. Os resultados obtidos nos ensaios biológicos foram comparados com os padrões comerciais de CDDP e OXA.
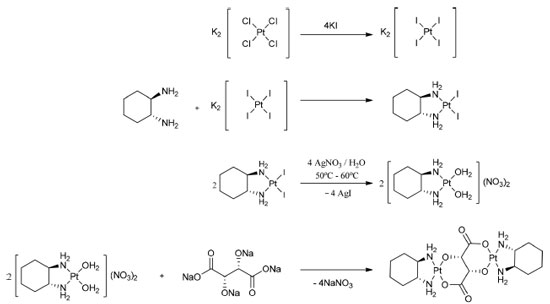
PARTE EXPERIMENTAL Síntese do Di-(1R,2R)(-)1,2-diaminociclohexano µ-(2R,3R)-2,3 dioxidosuccinatodiplatina(2+) - [Pt(DACH-κ2N) µ-(C4H2O6-κ4O)Pt(DACH-κ2N)] - codificado como Pt2DT Em um balão de fundo redondo de 50 mL foram adicionados 415 mg de K2[Pt(Cl)4] (1 mmol) e 664 mg de KI (4 mmol) dissolvidos em 10,0 mL de água deionizada. A temperatura foi mantida entre 50 60 ºC sob agitação por 5 minutos. O sistema foi então resfriado até a temperatura ambiente, e após isso, foi adicionado 114 mg de (1R, 2R)(-)1,2-diaminociclohexano (1 mmol). A reação foi mantida no escuro sob agitação durante 3 h. A mistura foi decantada e o sólido foi lavado com água ultrapura, etanol à frio (50 mL) e éter etílico (50 mL). Posteriormente, o sólido foi mantido em um dessecador sob vácuo. A síntese do complexo dinuclear de platina foi realizada após a desprotonação dos grupos hidroxila e carboxila do ácido (2R,3R) tartárico (TA) através do metóxido de sódio em metanol, com consequente formação do (2R,3R)-2,3-dioxidosuccinato. Em um balão de fundo redondo foram adicionados 92 mg (4 mmol) de sódio metálico em 20 mL de metanol. O sistema foi mantido por 1 h sob agitação, e, posteriormente, adicionou-se 150 mg (1 mmol) do ácido (2R,3R)-tartárico, deixando o sistema por mais 1h sob agitação. Após o tempo reacional, foi adicionado 5 mL de éter etílico e a amostra foi então resfriada. Depois de 12 h, o sobrenadante foi removido e o sólido lavado com etanol à frio. O sólido foi secado e armazenado para posterior síntese do dinuclear. Em um balão de fundo redondo de 20 mL foram adicionados 1126 mg de diiodo-1,2-diaminociclohexanoplatina(2+) (2,0 mmol) e 680 mg de AgNO3 (4,0 mmol) em um mínimo de água destilada (~10 mL). O sistema foi mantido sob agitação durante 2 h no escuro. Após este tempo, a reação foi filtrada para remoção do precipitado. O sobrenadante foi então transferido para um balão de fundo redondo contendo 238 mg de (2R,3R)-2,3-dioxidossuccinato de tetrassódio (1,0 mmol) em 20 mL de etanol. A reação foi mantida sob agitação, na ausência de luz, por 3 h. Ao final desse período, a reação foi filtrada, congelada e mantida a temperatura de -5 ºC, seguida de liofilização. O complexo foi lavado com etanol à frio para remoção de impurezas e secado sob vácuo (rendimento: 98%). Caracterizações Os espectros de infravermelho foram obtidos através de um espectrofotômetro Varian modelo 640-IR na faixa de 4000 a 400 cm-1, com resolução espectral de 4 cm-1. As amostras foram dispersadas em pastilhas de KBr. Os espectros de absorção foram adquiridos com espectrofotômetro Agilent 8453, na faixa de 200 a 700 nm. As soluções dos complexos de platina foram preparadas com concentração de 10-3 mol L-1. Os espectros de ressonância magnética nuclear foram obtidos usando um espectrômetro Varian Unity Plus 400 a uma frequência de 400 MHz para 1H, 100 MHz para 13C e 85 MHz para 195Pt. As amostras analisadas foram dissolvidas em DMSO-d6. Para os processos de calibração de deslocamento químico, o 1H foi relativo a TMS (tetrametilsilano) e 195Pt foi relativo a um padrão de K2[PtCl4] dissolvido em D2O, cujo pico característico de 195Pt foi observado em região característica, em -1630 ppm. As medidas de espectrometria de massa foram realizadas através de um espectrômetro de massa Exactive Plus de ultra-alta resolução com um analisador Orbitrap m/z, com transformada de Fourier (FT MS, Thermo Scientific, Bremen, Alemanha) e equipado com uma fonte de ionização por ESI, operando no modo de aquisição positivo ESI (+), nas seguintes condições: tensão capilar de +4,4 kV, lentes a 50° e temperatura capilar de 320 °C. Para a análise, preparou-se uma solução do complexo de platina a 50 ppm, dissolvendo-o em uma mistura água: metanol (1:1). O nitrogênio foi usado como gás nebulizador. As análises foram realizadas no modo full scan com resolução de aquisição de 140.000 em m/z 200. Os espectros de massas foram adquiridos na faixa de m/z 150-1000, utilizando o software Xcalibur 3.0 (Thermo Scientific, Bremen, Alemanha) para obtenção e processamento de dados.. O espectro de massa final foi composto pela soma de 50 espectros por análise, considerando a subtração espectral como branco. As identificações de íons nos espectros de massa foram realizadas usando o software Xcalibur 3.0 (Thermo Scientific, Bremen, Alemanha). As fórmulas foram apuradas, incluindo os elementos C, H, O, N e Pt como composição elementar confirmada pelos íons referentes aos isótopos correspondentes. A correspondência entre o valor do m/z experimental em relação ao m/z teórico foi retirada da biblioteca do software, para fórmulas atribuídas com erro inferior a 2 ppm. Medições de desnaturação de DNA Uma quantidade de DNA de fita dupla (Calf Thymus dsDNA, da Sigma-Aldrich) foi dissolvida em um volume de tampão fosfato (10 mmol L-1, pH = 7) suficiente para atingir a concentração de dsDNA de 50 µg mL-1. Para a confirmação desse parâmetro de concentração foi realizada a espectroscopia de absorção eletrônica, através de um espectrofotômetro UV-Vis modelo UV-1900 da Shimadzu, cujo o máximo de absorção em 260 nm deve ser igual a 1. Depois disso, a solução de dsDNA tamponada e as soluções dos complexos de Pt2+ com o dsDNA foram degaseificadas em sistemas de baixa pressão. Para a obtenção das temperaturas de desnaturação do dsDNA (Td), transferiu-se as soluções tamponadas para cubeta de quartzo (1 cm) tampadas com tampa de teflon, as quais foram inseridas em um compartimento de amostra com temperatura controlada (QNW qpod 2e), com taxa de aumento da temperatura de 1 ºC min-1, chegando a 90 ºC. Para as medidas de absorção eletrônica e obtenção da curva da Td, foi fixado o comprimento de onda em 260 nm e realizadas aquisições a cada 5 ºC. As características das soluções utilizadas na avaliação da Td consistiram em: (i) solução dsDNA em tampão fosfato pH 7 (padrão); (ii) 100 µL de uma solução de cisplatina 1 mmol L-1 em 4 mL de solução tamponada de dsDNA, (iii) 100 µL de uma solução de oxaliplatina 1 mmol L-1 em 4 mL de solução tamponada de dsDNA e (iv) 100 µL de uma solução de Pt2DT 1 mmol L-1 em 4 mL de solução tamponada de dsDNA. Todas as soluções de Pt-dsDNA foram mantidas durante 10 min a 20 ºC. Atividade biológica Os animais utilizados nos ensaios biológicos foram camundongos albinos suíços machos (Mus musculus), com 60 dias de idade e pesando 30 ± 5 g. Os animais foram mantidos em condições ambientais padrão de temperatura, umidade, sob ciclos de 12 h de luz e escuridão. Os camundongos foram alimentados com ração animal (LABINA L, Purina®, Brasil) e água ad libidum. O uso do complexo dinuclear de platina recebeu aprovação do Comitê de Ética em Experimentação Animal da Universidade Federal de Pernambuco (licença número: 23076.030363/2017-48). Os ensaios de toxicidade aguda para o complexo de platina dinuclear foram realizados utilizando a metodologia recomendada pela Organização para Cooperação e Desenvolvimento Econômico (OCDE). A via de administração intraperitonial foi escolhida de acordo com o protocolo de toxicidade aguda da ANVISA.27,28 A avaliação da toxicidade ocorre inicialmente pela administração de uma dose de 300 mg kg-1 dos compostos de teste. Para o experimento, foram utilizados 4 (quatro) grupos de 3 (três) animais fêmeas cada: grupo 1: cisplatina, grupo 2: oxaliplatina, grupo 3: Pt2DT; e grupo 4: solução salina a 0,9%. Para a administração das doses, foram preparadas soluções estoques dos complexos de platina em soro fisiológico com concentração de 30 mg mL-1. As soluções foram avaliadas quanto a sua estabilidade química em solução de soro fisiológico por um período de 60 dias, através do uso da espectroscopia de absorção eletrônica. Para isto, foi retirada uma alíquota de 3 mL da solução do complexo dinuclear a cada 24 horas e realizada uma leitura no espectrômetro. Não verificou-se alterações nos máximos de absorção e deslocamentos de bandas, sugerindo que a espécie é estável no meio utilizado por um período de até 60 dias. Apesar disso, e para evitar problemas durante a experimentação animal, foram preparadas as soluções estoque no momento da aplicação das doses nos animais. Essa administração de dose ocorreu após a pesagem de cada animal (~30 g), com a finalidade de calcular o volume que seria administrado em cada caso, não superando um limite de dose de 300 µL. Este experimento foi realizado em duplicata. Os animais foram observados continuamente por 2 h e depois a cada 24 h, por 14 dias. No 15º dia, os animais foram anestesiados para coleta do sangue, por punção cardíaca; e depois eutanasiados. Os ensaios de atividade antitumoral foram realizados através da inoculação de uma suspensão de 5 × 106 células de carcinoma de Erlich mL-1 de soro fisiológico, via subcutânea na região axilar de 40 animais sadios divididos em 4 grupos experimentais (10 animais/grupo): (1) Controle (solução salina), (2) e (3) Padrões (cisplatina e oxaliplatina, respectivamente); e (4) Pt2DT. Após 24 h do implante, o tratamento foi iniciado. A partir dos dados de toxicidade aguda, uma dose terapêutica do complexo dinuclear 5 mg kg-1 (~1,3 × 10-5 mols de Pt) foi escolhida baseada na quantidade equimolar de Pt comparado à oxaliplatina 5 mg kg-1 (~1,3 × 10-5 mols de Pt). No caso da cisplatina, o procedimento padrão utiliza 1 mg kg-1 (0,33 × 10-5 mols de Pt) impossibiliatndo o uso de outras doses, devido a alta toxicidade aguda apresentada pelo fármaco comercial. Todos os animais receberam o tratamento descrito durante 7 (sete) dias, e no oitavo dia, os animais foram pesados e sacrificados. Os tumores foram dissecados, pesados e, em seguida, foi calculada a inibição do crescimento tumoral dos grupos tratados em relação ao controle. A porcentagem de inibição do crescimento tumoral (TWI) foi calculada pela fórmula: 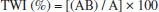 onde: A = massas tumorais médias no grupo controle e B = massas tumorais médias no grupo tratado. Os resultados da massa relativa dos órgãos e tumores foram analisados a partir da média e desvio padrão de n experimentos. Para verificar a ocorrência de diferenças significativas entre os diferentes grupos, os dados foram comparados por análise de variância (ANOVA) seguida do teste de Bonferroni com intervalo de confiança de 95%, quando comparado ao grupo controle. Amostras de sangue dos animais foram coletadas para verificação dos parâmetros hematológicos e bioquímicos. Os órgãos fígado, rins e baço foram armazenados em solução de formalina a 10% (pH = 7,2/tampão fosfato) para posterior avaliação histopatológica. Para o processamento dos exames histopatológicos, as amostras foram seccionadas em fragmentos de 2 mm de espessura e submetidas à pós-fixação na mesma solução de infusão. Os fragmentos foram processados para inclusão em resina plástica à base de metacrilato de glicol (LEICA), permanecendo imersos em tampão fosfato por 24 h. Posteriormente, foram desidratados em banhos de álcool e incluídos na resina plástica. Os cortes histológicos de 4 µm de espessura foram corados com hematoxilina-eosina, montados em lâminas e submetidos a análises morfológicas e morfométricas em microscópio óptico.
RESULTADOS E DISCUSSÃO Síntese do Di-(1R,2R)(-)1,2-diaminociclohexano µ-(2R,3R)- 2,3-dioxidosuccinatodiplatina(2+) - [Pt(DACH-κ2N) µ-(C4H2O6-κ4O)Pt(DACH-κ2N)] - codificado como Pt2DT A rota sintética para a obteção do complexo dinuclear, Pt2DT, é apresentada na Figura 2. O complexo obtido se apresentou na forma de um sólido branco amarelado, com solubilidade em água e dimetilsulfóxido; e insolúvel em solventes orgânicos, como: metanol, etanol, diclorometano, clorofórmio, acetato de etila e hexano.
Os dados obtidos a partir dos espectros no infravermelho dos ligantes (DACH, ácido tartárico e C4H2O6Na4) e do complexo Pt2DT estão sumarizados na Tabela 1 (ver material suplementar).
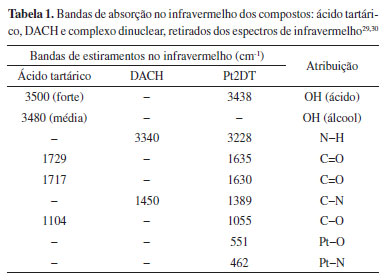
Os espectros no infravermelho dos ligantes DACH e TA apresentam bandas de absorção características dos grupos funcionais, como em 3500 e 1450 cm-1 referentes aos estiramentos dos grupamentos N-H e C-N (DACH), respectivamente; e em 3480, 1729, 1717 e 1091 cm-1 (TA), referindo-se aos estiramentos dos grupamentos O-H e C=O (Tabela 1). Observa-se mudanças significativas entre os espectros no infravermelho dos ligantes e do complexo, como o deslocamento para menores números de onda ou ausência das bandas dos grupamentos N-H (3438 cm-1), C-N (1384 cm-1), O-H (3228 cm-1), C=O (1635 cm-1) e C-O (1068 cm-1). Estes deslocamentos sugerem a formação do complexo desejado, através dos modos de coordenação κ2O e κ2N. Ainda foi possível observar a presença de bandas de absorção no infravermelho nas regiões de 462 e 551 cm-1, referentes aos estiramentos Pt-N e Pt-O, respectivamente (ver material suplementar). O espectro de ressonância magnética nuclear de 1H do complexo Pt2DT é apresentado na Figura 3.
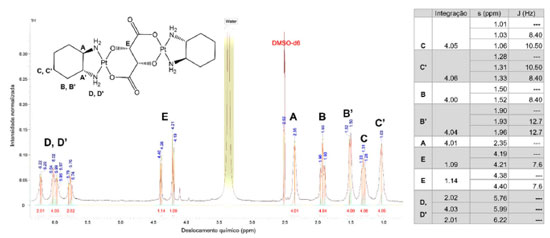 Figura 3. Espectro de RMN 1H do complexo dinuclear com os respectivos acoplamentos e deslocamentos químicos dos sinais presentes, em DMSO-d6
O espectro de RMN de 1H do complexo dinuclear apresentou os seguintes sinais (Figura 3): sinais entre 1,01-1,33 ppm referentes a prótons C e C' (4H, 4H' - J = 8,4 e 10,5 Hz, tripletos); sinais entre 1,50-1,96 ppm referentes aos prótons B e B' (4H, 4H' - J = 8,4 e 12,7 Hz, tripletos); um sinal em 2,35 ppm referente aos prótons metínicos - A (4H, singleto alargado) do ligante DACH; sinais entre 4,1 e 4,5 ppm referentes aos prótons do anel glicolato - E (2H - J = 7,6 Hz, dubletos); três grandes sinais em 5,76, 5,99, 6,22 ppm referentes aos prótons do grupo amino (8H, multipletos).31 Os sinais apresentados no espectro de 1H, como o referenciado em E não se apresentam como um único singleto em decorrência da rigidez do esqueleto estrutural do complexo dinuclear que promove a diferenciação magnética dos prótons do tipo E. A multiplicidade do sinal observado é dubleto devido ao acoplamento do próton com o núcleo platínico, ocasionando a presença de sinais satélites.32 Os demais fenômenos observados quanto a diferenciação na multiplicidade de sinais e aumento nas constantes de acoplamento são justificáveis devido a presença de centros metálicos dominados pela contribuição paramagnética, a qual é derivada da circulação eletrônica diamagnética ao redor do núcleo de platina, cujo efeito pode resultar no alargamento de sinais, resultando em uma perda "identitária" das constantes de acoplamento observadas, habitualmente, para a molécula orgânica isoladamente.32,33 Na Figura 4 é apresentado o espectro de RMN de 13C do complexo dinuclear.
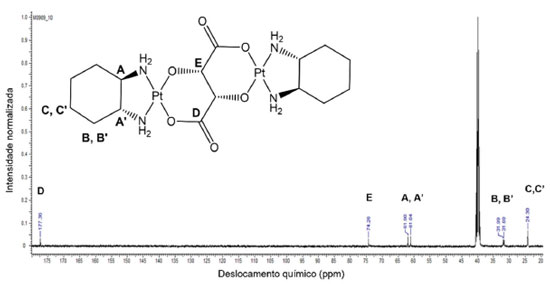
O espectro de 13C NMR (Figura 4) mostra um sinal a 177,36 ppm de carbonilas (D) e um sinal a 74,29 ppm (E), do tartarato tetrassódico. Também é possível observar sinais em 61,90 e 61,04 ppm referentes a A/A', sinais divididos em 31,99 e 31,69 ppm referentes a B/B' e sinais a 24,30 ppm referentes a C/C', dos ligantes DACH. Na Figura 5 é apresentado o espectro de RMN 195Pt do complexo dinuclear.
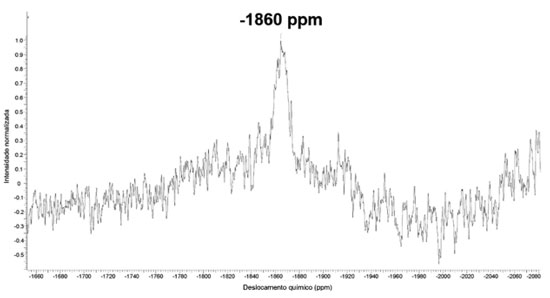
O espectro de RMN de 195Pt do complexo dinuclear (Figura 5) mostrou um sinal em -1860 ppm, o que sugere que os núcleos de Pt2+ apresentam posições quimicamente e magneticamente equivalentes (ambiente químico ao qual o núcleo platina está inserido - esfera de coordenação), uma vez que a presença de um único sinal, ou seja, se houvessem ambientes diferentes quanto a esfera de coordenação do íon, o espectro apresentaria dois sinais e não apenas um. O valor do deslocamento químico pode ser justificado pela presença do grupo carboxilato e do ligante DACH coordenado. Este deslocamento químico também comprova a esfera de coordenação primária do complexo de platina, ou seja, modo N,N-O,O.32-34 Na Figura 6 é apresentado o espectro de massas de ultra-alta resolução ESI (+) FT-MS do complexo dinuclear.
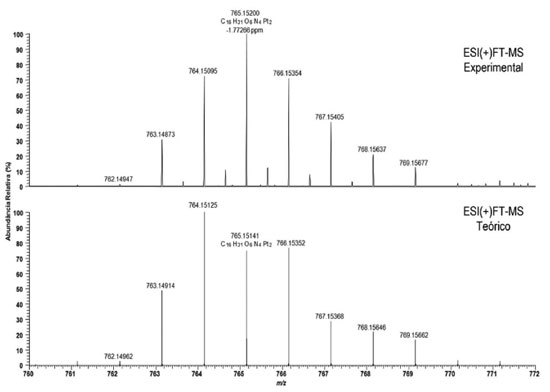
O espectro de massas do complexo dinuclear identifica a espécie sintetizada na forma de um íon [M + H]+ com m/z = 765,15200 (erro = -1,77266 ppm), cuja fórmula química é C16H31O6N4Pt2. Esta fórmula estimada refere-se ao íon de platina com dois isótopos de 195Pt. A Figura 6 também mostra uma comparação entre o ESI (+) FT MS experimental com o teoricamente esperado para o complexo de platina dinuclear. É possível identificar o perfil de distribuição de íons com os diferentes padrões isotópicos da platina (192Pt, 194Pt, 196Pt, 198Pt), bem como a combinação entre dois íons em uma mesma estrutura. Por exemplo, o íon com m/z 764,15095 (experimental) e 764,15125 (teórico) refere-se à fórmula molecular C16H31O6N4195Pt194Pt. Observe também que as abundâncias relativas para a distribuição de íons isotópicos são semelhantes para os dados experimentais e teóricos, corroborando para a formação do complexo desejado. Medições de desnaturação de DNA De acordo com o experimento de desnaturação de dsDNA (Figura 7) foi possível observar que os complexos de platina mononucleares, cisplatina e oxaliplatina, interagem com o dsDNA na conformação conhecida como intrafita, ou seja, a platina ligada coordenativamente à bases da mesma fita de dsDNA. Esse tipo de interação ocasiona, experimentalmente, o fenômeno de desnaturação em temperaturas mais baixas do que o dsDNA livre, e isto ocorre devido a formação da ligação coordenativa Pt-dsDNA que rompe as ligações de hidrogênio presentes contribuindo para a diminuição da Td.
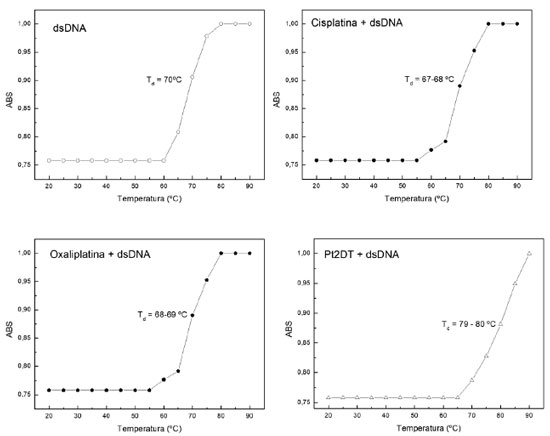 Figura 7. Experimento de temperatura de desnaturação do dsDNA (absorbância normalizada versus temperatura): (◦) solução de dsDNA (50 µg mL-1) em tampão fosfato (10 mmol L-1, pH = 7) (dsDNA - padrão) e com adição de 100 µL de soluções 1 mmol L-1 de oxaliplatina (⬟) e cisplatina (•), e do complexo dinuclear (ρ), tamponados com fosfato
Analisando os dados da Td é possível observar um aumento, no caso do dsDNA, na presença do complexo dinuclear, o que sugere uma possível interação da forma interfita devido a necessidade de uma maior temperatura para que haja a separação das fitas do dsDNA. Esse incremento de energia (aumento de temperatura) ocorreu através do moniromento dos eventos de separação dos domínios do dsDNA (conversão térmica gradual em uma única fita) para a ocorrência do hipercromismo. Essa observação acerca do aumento da temperatura de decomposição do dsDNA sugere que os mecanismos de interação do complexo dinuclear com o DNA ocorrem através dos dois núcleos de platina, os quais evitam a formação da simples fita, através de interações fortes (ligações coordenativas - tipo interfita). Na Tabela 2 estão apresentadas as faixas de Td observadas para as soluções tamponadas de dsDNA livre e combinados com os complexos de platina: (i) solução de dsDNA contendo cisplatina, (ii) solução de dsDNA contendo oxaliplatina e (iii) solução de dsDNA contendo um complexo dinuclear de platina(2+).

Atividade biológica do Pt2DT Os ensaios de toxicidade aguda do complexo de platina dinuclear foram realizados para obteção de uma classificação de acordo com sua letalidade, e assim, obter uma dose segura para o ensaio de atividade antitumoral (in vivo). Na dose de 5 mg kg-1, administrada por via intraperitoneal (i.p.), o complexo dinuclear de platina não induziu toxicidade aguda em animais após tratamento por 14 dias. O nível sem efeitos adversos observáveis (no observable adverse effect level - NOAEL)35 para o complexo PtDT foi de 5 mg kg-1, assim como a dose máxima tolerada (MTD), ou seja, a dose mais alta para a qual os camundongos se recuperaram inteiramente de todos os efeitos do complexo de platina ficou entre 5 e 50 mg kg-1. Esta dose para a cisplatina é de 1 mg kg-1, e a dose máxima tolerada entre 1 e 5 mg kg-1. O NOAEL é obtido a partir de ensaios de toxicidade aguda, avaliação clínica e resultados histopatológicos. Os resultados obtidos mostram que o complexo dinuclear é cerca de 5 vezes menos tóxico quando comparado à cisplatina. A dose letal mínima (DLM: a dose mais baixa que induziu a primeira mortalidade em camundongos) foi de 50 mg kg-1 (limites de confiança de 95%). O complexo Pt2DT foi incluído na categoria 2 (5-50 mg kg-1) de classificação toxicológica. O complexo dinuclear foi enquadrado na mesma categoria que a oxaliplatina em relação à toxicidade aguda, porém devido a presença de dois núcleos de platina, a dose do complexo dinuclear foi calculada para atender a mesma concentração molar utilizada pela oxaliplatina no ensaio antitumoral, tornando este um ponto positivo a seu favor, pois a bioatividade expressada e possibilidade de redução de efeitos colaterais não se deve somente a relação equimolar de platina presente, mas pelo mecanismo de difusão e de ação do complexo dinuclear. O grupo dos animais, no ensaio antitumoral, tratado com o complexo dinuclear não teve óbitos e foi observado um excelente percentual de inibição tumoral de 66,3%. A análise macroscópica dos animais submetidos ao tratamento quimioterápico por sete dias mostrou que todos ganharam massa corporal (mesmo que a massa tumoral tenha contribuído), não tiveram alterações comportamentais (agressividade) e não apresentaram alterações na pelagem (queda, espessamento e piloereção). A Tabela 3 resume os dados de atividade antitumoral do controle negativo (solução salina), controle positivo (cisplatina e oxaliplatina) e do complexo Pt2DT.

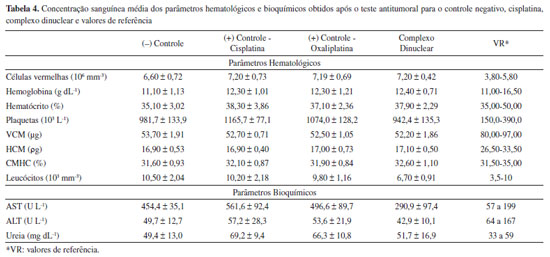
Como esperado, os tumores do grupo controle negativo apresentaram maior massa e coloração avermelhada, o que pode ser atribuído à vascularização típica de tumores malignos. Os grupos tratados com cisplatina, oxaliplatina e o complexo dinuclear de platina apresentaram menores valores de massa tumoral e coloração mais pálida em relação ao grupo controle, o que pode ser um indicativo de inibição da vascularização tumoral (fator antiangiogênico). O percentual de inibição tumoral (TWI%) para o composto proposto foi satisfatório e superior ao obtido pela cisplatina e oxaliplatina, mesmo quando utilizadas quantidades equimolares de platina nas doses, como o caso da oxaliplatina. A análise preliminar das amostras extraídas do baço, fígado e rins, mostrou que esses órgãos não sofreram danos aparentes, nem metástases. As análises hematológicas foram realizadas em amostras de sangue total e os seguintes parâmetros foram avaliados: contagem de hemácias (RBC), concentração de hemoglobina (HGB) e os seguintes índices hematrimétricos: volume corpuscular médico (VCM), hemoglobina corpuscular média (HCM), concentração média de hemoglobina corpuscular (CMHC), hematócrito, leucócitos e plaquetas (PLT). A análise dos parâmetros bioquímicos foi realizada a partir do soro extraído, livre de hemólise, onde foi possível quantificar a ureia, aspartame aminotransferase (AST) e alinina aminotransferase (ALT). Os resultados hematológicos e bioquímicos obtidos são mostrados na Tabela 4.
Como o tratamento quimioterápico envolve uma série de problemas relacionados ao sangue, a avaliação desses parâmetros hematológicos pode sugerir a possibilidade de algum fator relacionado à administração dos compostos. Nosso estudo verificou que a concentração de hemácias nos grupos tratados com cisplatina, oxaliplatina e complexo dinuclear não apresentou diferença estatística significativa em relação ao grupo controle (solução salina). Apesar dos valores obtidos estarem em uma faixa superior aos valores de referência (VR), esse fato não é, necessariamente, decorrente do uso de complexos de platina, uma vez que o grupo controle negativo também apresentou alterações nesse parâmetro em relação ao VR. Possivelmente, a diferença neste parâmetro pode estar relacionada à presença de carcinoma, que pode causar alterações na concentração de hemácias. Os valores de hemoglobina e hematócrito não apresentaram diferenças estatísticas significativas entre os grupos e os níveis obtidos para os grupos estão dentro dos valores de referência. Os valores de VCM encontrados para os grupos não apresentaram diferenças estatísticas significativas, embora todos estivessem abaixo dos valores de referência, o que pode estar associado à anemia hipocrômica por deficiência de ferro, condição comum entre pacientes que recebem doses de cisplatina. Os níveis de CMHC referentes à concentração de hemoglobina no interior das hemácias estavam dentro dos valores de referência para todos os grupos. A concentração de leucócitos no sangue foi superior aos valores de referência tanto no grupo tratado com cisplatina quanto no controle negativo. Nos animais tratados com o complexo dinuclear, entretanto, esses valores permaneceram dentro dos valores de referência. Variações na concentração de leucócitos podem indicar processos inflamatórios nos animais, causados por células tumorais ou devido à quimioterapia. Segundo relatos da literatura, pacientes submetidos à quimioterapia com CDDP apresentam leucopenia. Neste caso, é possível destacar a resposta do grupo tratado com o complexo dinuclear, o qual apresentou a contagem de leucócitos dentro dos valores de referência, indicando que o complexo em estudo não desencadeou processos de leucopenia, tão comum na administração de fármacos platínicos. A variação mais significativa nos parâmetros hematológicos medidos está na contagem de plaquetas, responsável pela coagulação do sangue. Os grupos controle e tratado apresentaram valores acima do VR (aproximadamente três vezes maior que o limite superior estabelecido), não havendo diferença estatística significativa entre os grupos.36 A alta contagem de plaquetas pode ser atribuída à presença de carcinoma nos animais, e devido a isso, todos os grupos (tratado e controle) apresentaram valores superiores, como esperado. A partir dos parâmetros bioquímicos foram verificados os níveis de ureia, transaminase e aminotransferase, sendo essas duas últimas enzimas responsáveis pelo metabolismo de algumas proteínas presentes em grande quantidade no hepatócito (células do fígado). Os níveis de AST e ALT podem estar associados a sinais de insuficiência hepática causada por lesões de hepatócitos. Os resultados da utilização de doses equimolares de platina para os complexos obtiveram variações de AST e ATL fora dos limites de referência, o que pode remeter a uma possível lesão associada às células hepáticas, principalmente aumentando os níveis séricos de AST. Os resultados para o complexo dinuclear sintetizado mostram que os níveis de AST estavam próximos dos valores de referência e, os níveis de ATL encontram-se inferiores ao encontrado para os padrões cisplatina e oxaliplatina. Estes valores sugerem que as células hepáticas sob tratamento quimioterápico com o complexo dinuclear apresentam menores lesões, sugerindo que o metabolismo do complexo não desencadeia injúrias hepáticas, como esteatose, esteato-hepatite, síndrome de obstrução sinusoidal, hepatite aguda e necrose hepática.37,38 Os níveis de ureia sugerem possíveis efeitos da administração dos complexos. De acordo com os resultados obtidos em nosso estudo, a administração do complexo dinuclear não alterou significativamente a concentração de ureia, enquanto o CDDP mostrou aumento dos níveis de ureia. Conforme relatado na literatura, a administração de CDDP em regime quimioterápico diminui a taxa de filtração renal causada por envolvimento de órgãos e nefrotoxicidade.39 As imagens de seções de tecido do fígado, baço e rins dos animais tratados com cisplatina e o complexo dinuclear são mostradas na Figura 8. Os cortes do tecido hepático dos animais tratados com cisplatina (Figura 8a) apresentam regiões com esteatosa hepática moderada e infiltrados inflamatórios importantes (seta preta), corroborando com a hepatotoxicidade apresentada pelo regime quimioterápico.40
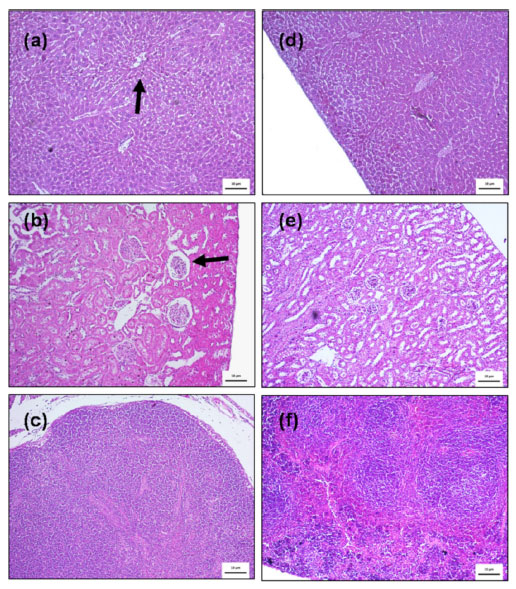 Figura 8. Imagens de cortes histológicos dos órgãos dos animais tratados com cisplatina: (a) fígado: esteatosa hepática moderada e infiltrados inflamatórios importantes indicados com a seta preta, (b) rins: seta preta indicando mudanças na cápsula de Bowman (nefrite) (c) baço; e com o complexo dinuclear: (d) fígado, (e) rins e (f) baço
A Figura 8b mostra uma imagem de um corte no tecido renal de animais tratados com cisplatina; a seta preta na imagem aponta para mudanças na cápsula de Bowman, ou seja, variações nos espaços de Bowman. Esta cápsula é uma estrutura dentro dos rins (néfrons) de mamíferos onde ocorre a ultrafiltração renal; o sangue entra sob alta pressão através da arteríola aferente, que é filtrada através de três camadas diferentes. Essas variações no espaçamento de Bowman, infiltrações linfoplasmocitárias e alterações nas estruturas dos néfrons sugerem que os animais tratados com cisplatina já apresentavam lesão renal associada a possível nefrite. A nefrotoxicidade já havia sido observada e confirmada em estudos clínicos com uso de cisplatina,41 e observada nesses estudos histopatológicos. Para o grupo tratado com o complexo dinuclear, Figuras 8d-f, não foi observada esteatose hepática ou infiltrado inflamatório no fígado (Figura 8d). A análise histopatológica dos rins mostrou que os animais tratados com o complexo dinuclear estavam dentro dos limites da normalidade, sem alterações (Figura 8e). A análise do baço de todos os animais tratados com CDDP e complexo dinuclear foi normal (Figuras 8c e 8f).
CONCLUSÃO O complexo dinuclear foi caracterizado e sua estrutura confirmada por análises espectrocópicas e espectrométrica. A estratégia sintética para a construção de um sistema dinuclear de platina, cujo ligante em ponte consistiu no uso do tartarato tetrassódico e o ligante DACH (1R, 2R)(-)1,2-diaminociclohexano, apresentou rendimentos excelentes e boa reprodutibilidade sintética. A proposta terapêutica baseia-se na formação de um complexo portador de duas unidades análogas à oxaliplatina, contudo, os resultados obtidos através dos experimentos de avaliação da temperatura de desnaturação do dsDNA, sugerem que as dinâmicas de substituição observadas diferenciam-se entre os casos do dinuclear proposto (com interações interfitas) e o análogo mononuclear (oxaliplatina, com interações intrafita). O complexo dinuclear apresentou cerca de 10 ºC de Td acima do análogo mononuclear e do dsDNA livre, o que reforça a ideia de abandonar uma retórica científica que associa o composto dinuclear proposto como um mero carreador de duas unidades análogas de oxaliplatina e sem qualquer efeito estrutural dinâmico. Vale salientar que os novos efeitos dessa dinâmica também foram expressos nos ensaios biológicos (antitumorais, bioquímicos e histopatológicos), os quais foram demasiadamente distantes entre os complexos de platina (mononucleares e dinuclear). O complexo dinuclear mostrou-se promissor devido aos resultados de inibição tumoral (66%) e toxicidade aguda (categoria 2), além dos resultados hematológicos, bioquímicos e histopatológicos demostrarem menores efeitos colaterais e danos oxidativos ao modelo biológico testado.
AGRADECIMENTOS Os autores agradecem ao LABMAQ - UFRPE e UFPE; CAPES e CNPq pelas bolsas concedidas e FACEPE pelo apoio financeiro ao projeto APQ-0994-1.06/15. MATERIAL SUPLEMENTAR O material suplementar relacionado a este artigo está disponível em http://quimicanova.sbq.org.br, em formato PDF, com acesso livre.
REFERÊNCIAS 1. Bolhuis, H.; van Veen, H. W.; Poolman, B.; Driessen, A. J.; Konings, W. N.; FEMS Microbiol. Rev. 1997, 21, 55. [Crossref] 2. Baguley, B. C.; Marshall, E. S.; Expert Opin. Drug Discovery 2008, 3, 153. [Crossref] 3. Meads, M. B.; Hazlehurst, L. A.; Dalton, W. S.; Clin. Cancer Res. 2008, 14, 2519. [Crossref] 4. Huls, M.; Russel, F. G.; Masereeuw, R.; J. Pharmacol. Exp. Ther. 2009, 328, 3. [Crossref] 5. Turco, M. C.; Romano, M. F.; Petrella, A.; Bisogni, R.; Tassone, P.; Venutta, S.; Leukemia 2004, 18, 11. [Crossref] 6. Szakács, G.; Peterson, J. K.; Ludwig, J. A.; Booth-Genthe, C.; Gottesman, M. M.; Nat. Rev. Drug Discovery 2006, 5, 219. [Crossref] 7. Higgins, C. F.; Nature 2007, 446, 749. [Crossref] 8. da Silva, R. G.; Silva, W. E.; Belian, M. F.; Rev. Virtual Quim. 2018, 10, 1140. [Crossref] 9. Wong, E.; Giandomenico, C. M.; Chem. Rev. 1999, 99, 2451. [Crossref] 10. Dilruba, S.; Kalayda, G. V.; Cancer Chemother. Pharmacol. 2016, 77, 1103. [Crossref] 11. Neves, A. P.; Vargas, M. D.; Rev. Virtual Quim. 2011, 3, 196. [Crossref] 12. Kritchenkov, A. S.; Stanishevskii, Y. N.; Skorik, Y. A.; Pharm. Chem. J. 2019, 53, 6. [Crossref] 13. Zhang, X.; Liu, D.; Lv, F.; Yu, B.; Shen, Y.; Cong, H.; Colloids Surf., B 2019, 182, 110373. [Crossref] 14. Provencher-Mandeville, J.; Descôteaux, C.; Mandal, S. K.; Leblanc, V.; Asselin, E.; Bérubé, G.; Bioorg. Med. Chem. Lett. 2008, 18, 2282. [Crossref] 15. Perego, P.; Caserini, C.; Gatti, L.; Carenini, N.; Romanelli, S.; Supino, R.; Colangelo, D.; Viano, I.; Leone, R.; Spinelli, S.; Pezzoni, G.; Manzotti, C.; Farrell, N.; Zunino, F.; Mol. Pharmacol. 1999, 55, 528. [Link] acessado em fevereiro 2023 16. Shao, P.; Sun, W.; Inorg. Chem. 2007, 46, 8603. [Crossref] 17. Wheate, N.; Collins, J. G.; Coord. Chem. Rev. 2003, 241, 133. [Crossref] 18. Harris, A. L.; Ryan, J. J.; Farrell, N.; Mol. Pharmacol. 2006, 69, 666. [Crossref] 19. Martelli, L.; Di Mario, F.; Botti, P.; Ragazzi, E.; Martelli, M.; Kelland, L.; Biochem. Pharmacol. 2007, 74, 20. [Crossref] 20. Olszewski, U.; Hamilton, G.; Anti-Cancer Agents Med. Chem. 2010, 10, 293. [Crossref] 21. Qu, Y.; Kipping, G. R.; Farrel, N. P.; Dalton Trans. 2015, 44, 3563. [Crossref] 22. Manzotti, C.; Pratesi, G.; Menta, E.; Di Domenico, R.; Cavalletti, E.; Fiebig, H. H.; Kelland, L. R.; Farrell, N.; Polizzi, D.; Supino, R.; Pezzoni, G.; Zunino, F.; Clin. Cancer Res. 2000, 6, 2626. [Link] acessado em fevereiro 2023 23. Boulikas, T.; Vougiouka, M.; Oncol. Rep. 2003, 10, 1663. [Crossref] 24. Benedetti, B. T.; Peterson, E. J.; Kabolizadeh, P.; Martínez, A.; Kipping, R.; Farrell, N. P.; Mol. Pharmaceutics 2011, 8, 940. [Crossref] 25. Rizzon, L. A.; Sganzerla, V. M. A.; Cienc. Rural 2007, 37, 911. [Crossref] 26. de Souza, J.; Freitas, Z. M. F.; Storpirtis, S.; Rev. Bras. Cienc. Farm. 2007, 43, 515. [Crossref] 27. Mosmann, T.; J. Immunol. Methods 1983, 65, 55. [Crossref] 28. Organization for Economic Cooperation and Development (OECD); Guidelines for the Testing of Chemicals, OECD 423: Acute Oral Toxicity - Acute Toxic Class Method, Paris, 2001. [Link] acessado em fevereiro 2023 29. Khokhar, A. R.; Al-Baker, S.; Siddik, Z. H.; J. Inorg. Biochem. 1994, 54, 39. [Crossref] 30. Pazout, R; Housková, J.; Dusek, M.; Maixner, J.; Kacer, P.; Struct. Chem. 2011, 22, 1325. [Crossref] 31. Margoitta, N.; Ranaldo, R.; Intini, F. P.; Natile, G.; Dalton Trans. 2011, 40, 12877. [Crossref] 32. Ursini, C. V.; Quim. Nova 1997, 20, 72. [Link] acessado em fevereiro 2023 33. Still, B. M.; Kumar, P. G. A.; Aldrich-Wright, J. R.; Price, W. S.; Chem. Soc. Rev. 2007, 36, 665. [Crossref] 34. Chen, Y.; Guo, Z.; Sadler, P. J. Em Cisplatin: Chemistry and Biochemistry of a Leading Anticancer Drug; Lippert, B., ed.; Wiley-VCH: Zurique, 1999, cap. 11. 35. Loomis, T. A.; Hayes, A. W.; Loomis's Essentials of Toxicology, 4th ed.; Academic Press: California, 1996, p. 276. 36. Araújo, F. T. M.; Teixeira, A. C. P.; Araújo, M. S. S.; Silva, C. H.; Corrêa, D. A. N.; Martins-Filho, O. A.; Magalhães, V. P.; Carvalho, A. T.; Revista da Sociedade Brasileira de Ciência em Animais de Laboratório 2015, 3, 95. [Link] acessado em fevereiro 2023 37. Sharma, A.; Houshyar, R.; Bhosale, P.; Choi, J.; Gulati, R.; Lall, C.; Clinical and Molecular Hepatology 2014, 20, 317. [Crossref] 38. Rubbia-Brandt, L.; Audard, V.; Sartoretti, P.; Roth, A. D.; Brezault, C.; Le Charpentier, M.; Dousset, B.; Morel, P.; Soubrane, O.; Chaussade, S.; Mentha, G.; Terris, B.; Ann. Oncol. 2004, 15, 460. [Crossref] 39. Peres, L. A. B.; da Cunha Júnior, A. D.; J. Bras. Nefrol. 2013, 35, 332. [Crossref] 40. Waseem, M.; Bhardwaj, M.; Tabassum, H.; Raisuddin, S.; Parvez, S.; Drug Chem. Toxicol. 2015, 38, 452. [Crossref] 41. Miller, R. P.; Tadagavadi, R. K.; Ramesh, G.; Reeves, W. B.; Toxins 2010, 2, 2490. [Crossref] |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access