Revisão
|
|
| Estudo de compostos poliaromáticos não convencionais e mercúrio na baía de todos os santos, brasil: avanços recentes e contribuição para melhor compreensão do ambiente marinho Unconventional polyaromatics compounds and mercury in the todos os santos bay, brazil: recent advances and contributions to better understand of their role in the marine environment |
|
Madson Moreira NascimentoI,II; Natália MenezesI,II; Sabrina Teixeira MartinezII,III; Maria Elisabete MachadoI,II,IV; Gisele Olímpio da RochaI,II,IV; Jailson Bittencourt de AndradeI,II,III,*
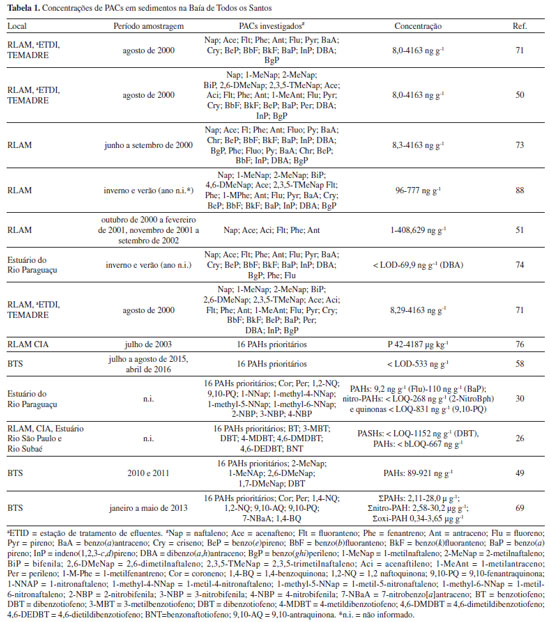
I. Instituto Nacional de Ciência e Tecnologia em Energia e Ambiente (INCT E&A), Universidade Federal da Bahia, 40170-115 Salvador − BA, Brasil Recebido em: 09/02/2023 *e-mail: jailsondeandrade@gmail.com; jailsondeandrade@fieb.org.br Baía de Todos os Santos (BTS) is the second-largest Brazilian bay; it was the first oil producing region in Brazil, with three large industrial parks in its north-northeast portion. In addition, the BTS has two large ports and a population of around 3 million inhabitants distributed among 14 cities. In the present study, recent studies on contamination by polycyclic aromatic compounds (PACs) and Hg in sediments, water, and biota from the BTS region are presented and critically discussed. Among the PACs, studies evaluating the presence of polycyclic aromatic hydrocarbons (PAHs) and their nitrated (nitro-PAHs), oxygenated derivatives (oxy-PAHs), and those containing atoms of S as a heteroatom (PASHs) are considered, as well as the element Hg distributed in seawater, sediments, and biota. Regarding biomonitoring organisms, recent results on polychaetes, ascidians, and corals are presented. Trends for future studies are presented at the end of the text. INTRODUÇÃO Considerando as modificações do ambiente físico decorrentes das atividades humanas na história recente do planeta, os oceanos têm sido o principal reservatório ambiental que recebem diferentes tipos e intensidades variadas de poluição. E mesmo que um determinado grupo de poluentes tenham sido gerados a centenas de quilômetros de distância das regiões costeiras, estes chegam eventualmente aos oceanos.1 E isso vem se intensificando principalmente nos últimos ~ 3 séculos, visto a necessidade de geração de alimentos, energia, e outras commodities necessárias para a manutenção do bem-estar da sociedade moderna, que é cada vez mais exigente1 2 3 4 5 e que vêm crescendo exponencialmente nesse mesmo período.5,6 De acordo com a Organização das Nações Unidas, a população mundial alcançou a marca de 8 bilhões de habitantes no dia 15 de novembro de 2022.7,8 Ainda, essas projeções estimam que em 2030 a população será de 8,5 bilhões, em 2050 será de 9,7 bilhões e em 2080 poderá chegar a 10,4 bilhões de habitantes, permanecendo nesse patamar até 2100.6 7 8 E mesmo sendo observado que a taxa de crescimento populacional atual vem sendo desacelerada (quando comparada à taxa dos anos 1950s), associada aos grandes problemas de saúde pública mundial (e.g. pandemia do COVID-19, dentre outras doenças endêmicas) e a diminuição da taxa de fertilidade humana, garantir níveis mínimos de subsistência e vida digna a todos os habitantes, globalmente − e simultaneamente, também garantir a conservação do ambiente físico do planeta − é o grande desafio da humanidade desse milênio. Do ponto de vista mundial, algumas iniciativas vêm sendo propostas na tentativa de garantir a conservação do meio ambiente e o bem-estar da sociedade através da sustentabilidade, tais como os 17 Objetivos do Desenvolvimento Sustentável (ODS) da ONU, a Década da Ciência Oceânica7 (2021-2030), o movimento Net Zero 20509 com propostas de geração de energia baseada na descarbonização da matriz energética, e iniciativas para tentar mitigar as mudanças climáticas.7,10 11 12 As atividades humanas vêm alterando, muitas vezes de modo irreversível, os ecossistemas marinhos. Os ecossistemas marinhos vêm sofrendo ação antrópica direta de diferentes origens.5,13 Diferentes níveis de poluição, seja de substâncias orgânicas e/ou de inorgânicas, são liberados nos oceanos por uma ampla variedade de emissores. E após emitida, os poluentes são geralmente distribuídos heterogeneamente em águas costeiras, estuários, baías e outras áreas offshore, principalmente aquelas adjacentes às regiões metropolitanas e grandes centros industriais.1,2,4,5,13,14 A entrada de diferentes classes de compostos e/ou elementos traço no ambiente marinho provoca uma ampla e intricada gama de estressores ou "forçantes" antrópicas para o meio abiótico (água, sedimentos e material particulado em suspensão), contribuindo para alterar a biogeoquímica marinha e, principalmente, afetando os organismos vivos que dependem de condições ambientais amenas para sobreviver.3,15 Estima-se que os ecossistemas marinhos sejam o tipo de ecossistema mais amplamente "exploitado" ao redor do mundo. Por exemplo, apesar das zonas costeiras corresponderem a apenas 4% da área total do planeta e 11% da área dos oceanos no mundo, mais de um terço da população mundial vive dentro de um raio de 100 km dos oceanos.16,17 E mais de 90% da população mundial depende da pesca, aquacultura e de outros serviços ecossistêmicos fornecidos por essas regiões. Estima-se que o valor de mercado dos oceanos, considerando todos os serviços ecossistêmicos que fornece, juntamente com os recursos costeiros e marinhos e as indústrias associadas, seja da ordem de US$ 3 trilhões (ou 5% do PIB global) por ano.5,14,16 Do ponto de vista da biodiversidade marinha, estima-se que cerca de 50% das regiões de pântanos salinos, 35% dos manguezais, 30% dos recifes de corais, 29% das gramíneas marinhas, e 89% dos recifes de ostras já foram perdidos ou degradados ao redor do mundo nas últimas décadas.16 Logo, além dos evidentes problemas ambientais e de saúde humana que a poluição química de ecossistemas marinhos pode provocar, ela também apresenta imenso risco econômico1 à sociedade se não forem conservados adequadamente. Dentre os diferentes tipos de fontes de contaminantes para o ambiente marinho, destacam-se aqueles derivados da "exploitação" de petróleo, da queima de combustíveis fósseis para geração de energia e derramamentos acidentais de óleo, dentre outros. Os componentes do óleo apresentam elevada toxicidade e conferem contaminação crônica do ambiente marinho em nível global.18 Dentre as milhares de espécies químicas que compõem o petróleo, destacam-se os compostos policíclicos aromáticos (PACs) e o mercúrio, dentre outros. Essas substâncias vêm sendo frequentemente empregadas como traçadores de fontes petrogênicas e pirogênicas do ambiente marinho.19 20 21 22 23 24 25 Em relação aos PACs, durante as últimas décadas os estudos têm priorizado investigar apenas 16 PAHs não substituídos classificados como prioritários segundo a US EPA.20 21 22 23,26,27 Entretanto, dentro da classe de compostos classificados como PACs há várias centenas de substâncias. Dentre elas encontram-se os hidrocarbonetos policíclicos aromáticos (PAHs) que contém em sua estrutura apenas átomos de C e H, mas também uma série de derivados dos PAHs, sejam eles os nitro-PAHs, que contém pelo menos um grupo nitro (-NO2), os oxi-PAHs, que possuem pelo menos um grupo carbonila (-C=O), ou hidroxila (-OH), ou um grupo carboxila (-COOH), dentre outras possibilidades, como substituinte no anel benzênico. Adicionalmente, os poliaromáticos que apresentam pelo menos um átomo de S ou N ou O como heteroátomo no anel benzênico, sendo conhecidos como PASH, PANH e PAOH, respectivamente.19,26,27 Um outro subgrupo dos PACs é o dos alquil-PAHs, em que os substituintes dos anéis benzênicos são grupamentos alquilas.28 Todos esses compostos apresentam elevada toxicidade, apresentando-se como carcinogênicos, teratogênicos e/ou mutagênicos, além de causar interferência endócrina, sendo os PAHs substituídos (nitro-PAHs, oxi-PAHs e alquil-PAHs) e os PASH, PANH e PAOH mais nocivos à saúde do que os PAHs não substituídos.24,29 30 31 Logo, restringir os estudos sobre os poliaromáticos aos 16 prioritários não é mais suficiente.32,33 Considerando todas as possibilidades de investigação com os recentes avanços científicos e tecnológicos, não se justifica mais permanecer investigando uma quantidade tão restrita de PACs pois, nesse caso, significa avaliar uma parte muito estreita do todo. O mercúrio (Hg) é um metal que ocorre naturalmente na crosta terrestre (na forma de minerais), persistente, não-essencial, ubíquo no ambiente, neurotóxico e que tende a se bioacumular em organismos marinhos e a se biomagnificar através da cadeia alimentar, podendo afetar a saúde humana e animal.25,34 35 36 37 38 Fontes antrópicas de Hg incluem a queima de combustíveis fósseis, emissões industriais, mineração e o garimpo de ouro. Como o Hg também é um dos componentes do petróleo, as fontes petrogênicas já citadas aqui também contribuem para a sua ocorrência nos ecossistemas aquáticos. Estima-se que desde os anos 1500s, a quantidade de Hg nos oceanos tenha aumentado entre 36-1313 milhões de mols, sendo que, globalmente, o conteúdo de Hg antrópico seja de 290 ± 80 milhões de mols, com quase 2/3 dessa quantia estando em regiões oceânicas de menos de 1000 metros de profundidade.36 No Brasil, no final de 2019, mais de 3.000 km da costa brasileira foram diretamente impactados pelo maior derrame de petróleo já visto na região.39 38 39 40 41 42 Os estudos indicaram que o petróleo provavelmente veio de um navio grego que transportava óleo de origem venezuelana no Oceano Atlântico e chegou na costa brasileira intemperizado, o que o deixou mais pesado e em subsuperfície, dificultando a sua detecção e contenção.42,43 Foram encontrados registros das manchas em mais de 980 pontos, alcançando diversos ecossistemas e áreas de proteção ambiental e atingindo diretamente diversas espécies ameaçadas de extinção.43,44 Desde então, muitos estudos com diferentes abordagens tentam avaliar quais os efeitos do derrame de óleo nas áreas afetadas. No estado da Bahia, o trecho de mar aberto foi diretamente afetado pelo derrame. Por sua vez, a Baía de Todos os Santos (Figura 1), por ser uma área mais reclusa geograficamente, estima-se que tenha sido menos afetada pelo derrame. A Baía de Todos os Santos (BTS) é a segunda maior baía do Brasil, com uma área de 1233 km2, é influenciada pelo clima tropical-úmido e hospeda diversos ecossistemas, como recifes de corais, manguezais e gramíneas.34,45 A BTS foi a primeira região produtora de petróleo no Brasil (iniciada em 1939), onde foi instalada a primeira refinaria brasileira, a Refinaria Lantufo Alves (RLAM) em 1950. Na região da BTS há algumas dezenas de indústrias instaladas no Pólo Petroquímico de Camaçari e o Centro Industrial de Aratu, e há dois portos importantes para o país, o Porto de Salvador e o Porto de Aratu. Adicionalmente, no seu entorno estão localizados quatorze municípios, abrigando uma população total de cerca de 3 milhões de habitantes,25 sendo que mais de 80% dessa população vive em Salvador e região metropolitana. Desaguando na BTS há três principais tributários, sendo eles, o Rio Subaé, Rio Paraguaçu e o Rio Jaguaripe. No presente estudo são apresentados e criticamente discutidos estudos recentes sobre a contaminação por PACs e Hg em sedimentos, água e biota da região da BTS. Como esses contaminantes são encontrados em nível de traço, sub-traço e/ou ultra-traço no ambiente, são discutidos também os avanços analíticos que necessitaram de ser desenvolvidos e validados para a determinação de PACs e Hg em amostras ambientais complexas.
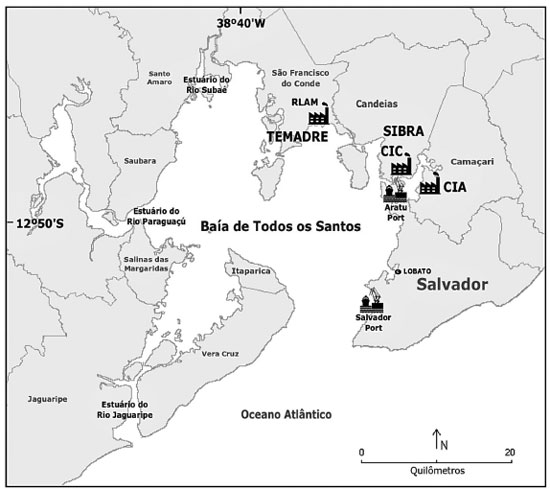 Figura 1. Mapa da Baía de Todos os Santos, Bahia, apresentando informações sobre atividades industriais e portuárias relevantes para a área
AVANÇOS NAS TÉCNICAS ANALÍTICAS PARA DETERMINAÇÃO DE PACS E HG EM AMOSTRAS AMBIENTAIS As amostras provenientes do ambiente marinho, tais como sedimentos, água do mar e biota oferecem um grande desafio do ponto de vista da química analítica devido a elevada complexidade da sua matriz. Além disso, os contaminantes orgânicos da classe dos compostos policíclicos aromáticos (PACs) são frequentemente encontrados nessas amostras em níveis de traço ou ultra-traço, o que exige o emprego de técnicas de preparo de amostras eficientes, muitas vezes combinadas a técnicas instrumentais mais sensíveis e seletivas, como sistemas de cromatografia (mono ou bidimensional) acopladas a espectrômetros de massas de resolução unitária ou, até mesmo, de alta resolução. Nos últimos anos, a maioria dos estudos que investigou a ocorrência e distribuição de contaminantes orgânicos da classe dos PACs em amostras do ambiente marinho oriundas da BTS focou na determinação de hidrocarbonetos policíclicos aromáticos (PAHs) prioritários, empregando-se protocolos de preparo de amostras oficiais, como extração por Soxhlet, extração em fase sólida (SPE) e extração líquido-líquido (LLE). Neste sentido, pode-se destacar duas grandes questões científicas que permaneceram pouco exploradas: a primeira refere-se a ausência de estudos mais abrangentes a respeito dos derivados substituídos dos PAHs, tais como alquil-HPAs, nitro-PAHs, oxi-PAHs e com heteroátomo no anel aromático (PASH, PANH e PAOH), os quais apresentam uma maior reatividade e toxicidade do que os PAHs correspondentes.32,33,46 A segunda questão diz respeito a eficiência das metodologias analíticas de extração e determinação dos PACs. Sabe-se que tanto a extração por Soxhlet e a LLE clássica apresentam desvantagens consideráveis, principalmente relacionadas ao consumo excessivo de solventes orgânicos tóxicos, longos tempos de extração, múltiplas etapas de limpeza do extrato e fracionamento, dificuldade de automação e baixa velocidade analítica, além da geração de uma quantidade elevada de resíduos.47 Atualmente, com a popularização dos princípios da química analítica verde e do preparo de amostras verde,48 muitos procedimentos analíticos vêm sendo desenvolvidos com foco na sustentabilidade, miniaturização e redução/eliminação do uso de reagentes tóxicos.48 Evolução dos métodos de extração sólido-líquido para determinação de PACs em sedimentos e biota marinha Uma avaliação detalhada dos trabalhos publicados reportando a extração de PAHs em sedimentos e biota coletados ao longo da BTS, mostraram que a extração por Soxhlet tem sido preferencialmente empregada visando, principalmente, a determinação dos 16 PAHs prioritários da US EPA.49 40 41 42 43 44 45 46 47 48 49 50 51 52 53 Neste tipo de técnica - também chamada de extração sólido-líquido - uma massa de 10 a 25 g da amostra de sedimento previamente seca em estufa ou liofilizada é transferida para um reservatório de vidro, que é gradualmente preenchido com o solvente extrator obtido de um sistema de destilação.47 Quando o volume do solvente extrator excede o volume máximo do reservatório de vidro, o excesso é direcionado para o balão de destilação, onde o solvente é novamente volatilizado e, posteriormente condensado, repetindo o ciclo de extração.47 Os solventes orgânicos clorados, tais como o diclorometano puro51,52,54 ou misturas entre diclorometano e n-hexano (1:1, v/v)49,50,53,54,55 são os solventes extratores mais utilizados. O volume total de solvente orgânico consumido durante a extração varia de 150 a 250 mL, com tempo total de extração podendo variar de 4 h a 24 h, por amostra.50,52,54,56 Nestes casos, uma etapa de concentração do extrato é obrigatória para evitar diluição excessiva dos analitos e reduzir o volume de resíduo gerado, geralmente realizada utilizando-se rotaevaporadores, reduzindo-se o volume inicial do extrato para aproximadamente 1 mL. Uma etapa de fracionamento é frequentemente utilizada visando a separação da fração contendo os hidrocarbonetos saturados da fração contendo PAHs. Para isso, uma coluna cromatográfica aberta contendo sorventes sólidos como sílica e alumina ou a mistura entre eles é utilizada. Para eluição das frações contendo os analitos, solventes apolares como n-hexano, são empregados para obtenção da fração dos hidrocarbonetos saturados, enquanto o diclorometano é empregado para eluição da fração contendo os PAHs. Em algumas ocasiões, misturas de solventes compostas por n-hexano/diclorometano podem ser utilizadas.56 A etapa seguinte consiste reduzir o volume das frações coletadas para 1 a 2 mL utilizando-se sistemas de rotaevaporação ou secagem em fluxo de nitrogênio, com subsequente injeção em um sistema de cromatografia, como GC-MS ou GC FID. As técnicas clássicas de extração sólido-líquido, como a extração via Soxhlet são uma das primeiras opções para extração de PACs em sedimentos e biota. Isso porque, além de serem técnicas oficiais de órgãos como US EPA, são consideradas técnicas de extração exaustivas, ou seja, permitem a extração completa do analito da matriz da amostra. No entanto, essas técnicas apresentam algumas desvantagens, como consumo excessivo de tempo e reagentes, uso de volumes consideráveis de solventes orgânicos tóxicos, como o diclorometano e múltiplas etapas, o que torna o procedimento laborioso e susceptível a formação de artefatos e ao incremento de erros sistemáticos. Recentemente, alguns trabalhos publicados no âmbito da BTS reportaram o uso de técnicas alternativas, as quais permitem o uso de um volume menor de solvente orgânico e uma redução no tempo de extração. Um trabalho desenvolvido por do Ó Martins et al.57 reportou a determinação de 16 PAHs prioritários em amostras de ostras coletadas no entorno da BTS, utilizando a extração assistida por micro-ondas (MAE). Os autores utilizaram um volume de 50 mL de uma mistura composta por diclorometano/n-hexano (1:1, v/v) e 1 g da amostra na extração por MAE. O tempo total de aquecimento em MAE foi de 50 min (incluindo o tempo de resfriamento). Similarmente, a técnica MAE foi empregada por de Almeida et al.58 na extração de 16 PAHs prioritários de amostras de sedimentos coletadas em regiões industrializadas no entorno da BTS. Neste trabalho, foi utilizada 10 g da amostra de sedimento e a extração por MAE foi conduzida utilizando-se 25 mL de uma mistura composta por diclorometano/acetona (1:1, v/v). Em ambos os casos, nota-se uma redução expressiva do volume de solvente orgânico utilizado, que pode chegar a ser 5 a 10 vezes inferiores quando comparada a extração por Soxhlet. O tempo de extração também foi reduzido de 24 h para apenas 50 min ou menos. Como a MAE utiliza sistemas fechados, a exposição do analista a vapores tóxicos é minimizada. As principais desvantagens da MAE são o elevado custo, necessidade de analistas treinados, limitação da quantidade de amostras a ser inserida no tubo de extração59 e risco de explosão quando solventes orgânicos são aquecidos sob elevada pressão. Além disso, o número de amostras a serem processadas depende diretamente da quantidade de tubos (de extração) disponíveis e do tamanho do carrossel do micro-ondas, limitando a velocidade analítica do procedimento. Embora a MAE apresente uma significante redução no consumo de solventes orgânicos em relação a extração por Soxhlet, seu consumo de solvente ainda é significativo, uma vez que normalmente são requeridos volumes entre 10-50 mL visando obter boa eficiência no processo de extração. Visando contornar as limitações observadas tanto na extração por Soxhlet quanto na MAE, foram desenvolvidas novas metodologias analíticas de extração sólido-líquido em microescala, focadas nos princípios da química analítica verde60 e no preparo de amostras verde.48 Ou seja, metodologias com baixo consumo de solventes orgânicos, tempo de extração reduzido e que permitem o uso de quantidades reduzidas de amostras (10 a 100 mg). Além disso, essas metodologias permitiram a determinação simultânea dos 16 PAHs prioritários e de muitos derivados substituídos, tais como: oxi-PAHs, nitro-PAHs e aqueles contendo enxofre heterocíclico (PASH). O primeiro trabalho deste tipo foi desenvolvido por Santos et al.29 visando a determinação de 20 PAHs, 27 nitro-PAHs e 5 oxi-PAHs (quinonas) em amostras de sedimentos coletados ao longo do Rio Paraguaçu, que é um dos principais rios localizados no entorno da BTS. As amostras de sedimentos foram submetidas a extração sólido-líquido em microescala auxiliada pela extração assistida por ultrassom (USE), utilizando-se um sistema miniaturizado baseado no uso de um dispositivo comercial denominado "Whatman Mini-UniPrep syringeless filter" cujo nome foi simplificado para microextrator. Neste procedimento, 25 mg da amostra e 500 µL de uma mistura composta por 82% diclorometano e 18% de acetonitrila (v/v) foram utilizados, seguido de extração por ultrassom durante 23 min. Utilizando-se essa metodologia, os autores conseguiram obter limites de detecção tão baixos quanto 5 ng g-1 e valores de recuperação relativa variando de 70 a 118% para todos os compostos. A concentração de PAHs, oxi-PAHs e nitro-PAHs nas amostras de sedimento coletadas variou de 8,6 a 110 ng g-1, 814 a 831 ng g-1 e 23 a 268 ng g-1, respectivamente. Com base nos resultados obtidos, observou-se que o procedimento de extração sólido-líquido em microescala forneceu resultados similares comparado as metodologias convencionais com a vantagens significativas em relação a redução do consumo de solvente orgânico e da quantidade de amostra, além de garantir uma elevada frequência analítica. Nos trabalhos mais recentes, a extração sólido-líquido em microescala foi aprimorada visando incluir novas classes de compostos policíclicos aromáticos. Em um trabalho desenvolvido por Bahia et al.26 uma nova metodologia de extração sólido-líquido em microescala foi desenvolvida visando determinar sete novos PAHs contendo enxofre heterocíclico (PASHs), além dos 17 PAHs convencionais em amostras de sedimentos coletadas em regiões da BTS com intensa atividade de exploração e refino de petróleo. O procedimento desenvolvido apresentou valores de limite de detecção e quantificação baixos o suficiente para determinação dos PAHs nas amostras de sedimento em nível de traço (poucos ng g-1) e recuperações relativas superiores a 80%. Avanços significativos também foram observados em relação às amostras de biota marinha, as quais apresentam uma complexidade mais elevada em relação a sua matriz. Similarmente ao observado em relação as amostras de sedimentos, a determinação de PACs em biota tem sido conduzida majoritariamente por Soxhlet, o que permitiu o desenvolvimento de novos procedimentos analíticos focados na extração sólido-líquido em microescala. O primeiro trabalho empregando-se a técnica de extração sólido-líquido em microescala para determinação de PACs em amostras de biota foi publicado por Sola et al.31 Neste estudo, 18 PAHs, 27 nitro-PAHs e 6 oxi-PAHs foram determinados em amostras de poliquetas coletadas em regiões entre marés em quatro regiões da BTS (Madre de Deus, Aratu, Inema e Ribeira). A grande vantagem no procedimento desenvolvido está na possibilidade de se analisar as poliquetas individualmente - recurso muito útil para estudos com famílias ou espécies distintas - devido à baixa quantidade de amostra requerida para análise. Um esquema ilustrativo do procedimento desenvolvido pode ser visto na Figura 2.
 Figura 2. Representação da metodologia de extração sólido-líquido para determinação de PACs em poliquetas (fonte: adaptado de Sola et al.)31
Algumas variações na extração sólido-líquido foram realizadas de modo a permitir a determinação de PACs em amostras de biota marinha com uma matriz mais complexa. Nascimento et al.24 desenvolveram um novo procedimento analítico visando a determinação de 41 PACs em ascídias (Phallusia nigra) além do potente mutagênico 3-nitrobenzantrona e seus metabólitos. Um novo dispositivo de extração sólido-líquido de duas vias (extração e filtração) foi desenvolvido e o procedimento de extração foi combinado com uma etapa de cleanup em microescala baseado na extração em fase micro-sólida dispersiva. O procedimento apresentou baixos limites de detecção e quantificação e valores de recuperação variando de 75 a 124%. Técnicas preparo de amostra miniaturizadas para determinação de PACs em amostras de água superficial e subterrânea A maioria dos PAHs possuem baixa solubilidade em água, elevado coeficiente de partição octanol-água (log kow) e elevado coeficiente de partição em carbono orgânico (koc),32 logo, as concentrações destes compostos tendem a ser maiores nos sedimentos e na biota aquática do que nos corpos d'água. No entanto, os seus derivados mais reativos e mais polares, como nitro-PAHs e oxi-PAHs são mais solúveis e possuem maior mobilidade do que os PAHs correspondentes.61 Alguns trabalhos reportaram concentrações de nitro-PAHs em água doce variando de 0,97 ng mL-1 (9-nitroantraceno, 9-NAnt) a 7,16 ng mL-1 (1-nitropireno, 1-NPyr), enquanto as concentrações de oxi-PAHs variaram de 0,69 ng mL-1 (5,12-naftacenodiona) a 2,36 ng mL-1 (2-fluorenocarboxaldeído).62 Um estudo63 recente mostrou que nitro-PAHs podem ser detectados em água superficial em diferentes estações do ano. As concentrações reportadas no estudo variaram de 8,5 ng L-1 (2-nitrobifenila, 2-NBP) a 57,7 ng L-1 (1-NPyr). Diante do exposto, o desenvolvimento de metodologias analíticas mais sensíveis e eficientes, que permitam a determinação destes PACs não-convencionais em diferentes compartimentos do ambiente aquático em nível de traço ou ultra traço é de fundamental importância para assegurar a qualidade da água. O trabalho desenvolvido por Santos et al.30 foi um dos primeiros a reportar o desenvolvimento de uma nova metodologia de extração em microescala para determinação simultânea de PAHs e seus derivados nitrados e oxigenados em amostras de água superficial e subterrânea, coletadas no entorno da BTS. Os autores empregaram a técnica de microextração em gota única (SDME), onde 10 mL da amostra foi extraída com apenas 1 µL de tolueno. Após a validação, o procedimento analítico apresentou baixos limites de quantificação, com valores que variaram de 0,060 a 0,090 ng mL-1 para os PAHs, 23,2 a 1159 ng mL-1 para os oxi-PAHs e 1,24 a 4,31 ng mL-1 para os nitro-PAHs. As recuperações obtidas variaram de 36% a 152% para os PAHs, 23% a 103% para os nitro-PAHs e 48% a 134% para os oxi-PAHs. O método foi aplicado na determinação destes compostos em oito amostras de água superficial de rio, seis amostras de água subterrânea e oito amostras de água do mar. Ao todo, oito PAHs, seis nitro-PAHs e dois oxi-PAHs foram detectados e quantificados nas amostras de águas superficiais e subterrâneas. As concentrações obtidas variaram de 0,06 a 0,70 ng mL-1 para PAHs, 270 a 1605 ng mL-1 para os oxi-PAHs e 2,02 a 5,61 ng mL-1 para os nitro-PAHs. Apesar dos baixos limites de quantificação alcançados pelo método SDME e o consumo quase que irrisório de solvente orgânico (1 µL), algumas desvantagens foram observadas. A etapa de extração e injeção no sistema cromatográfico era realizada em uma amostra por vez, o que resultou em uma perda significativa de velocidade analítica. Logo, o procedimento se mostrou inadequado para um estudo mais abrange da BTS, onde várias amostras de diferentes localidades deveriam ser analisadas rapidamente. Dois anos depois, Nascimento et al.64 desenvolveram um novo procedimento de extração de PACs baseado na extração em fase micro-sólida dispersiva (D-µ-SPE). Este procedimento foi desenvolvido com objetivo de analisar um grande número de amostras por batelada, combinando atributos como simplicidade, baixos limites de detecção e quantificação e elevados valores de fator de pré-concentração. O procedimento baseou-se na criação de um dispositivo de extração (150 mm de comprimento) de vidro de borossilicato em formato cilíndrico com um tubo estreito (45 mm) em uma das extremidades (Figura 3). Uma ponteira de micropipeta de 5 mL contendo 25 mg de lã de vidro foi acoplada ao final do dispositivo e utilizada como agente de filtração. O procedimento consistiu em transferir 250 mL de uma amostra de água para o dispositivo de extração, adicionar 100 mg do sorvente C18 e 1 mL do solvente dispersor (2-propanol). Após 32 min de agitação em vórtex, o sorvente disperso na solução da amostra foi recolhido na ponteira contendo lã de vidro por filtração a vácuo. O sorvente filtrado foi transferido para um dispositivo microextrator de vidro (Whatman Mini-Uniprep syringeless filter), que foi submetido a uma etapa de dessorção em microescala com 500 µL de n-hexano e sonicação durante 20 min (Figura 3).
 Figura 3. Esquema de extração em fase micro-sólida dispersiva utilizando o dispositivo customizado (fonte: reproduzido de Nascimento et al.64 com autorização da Elsevier. Todos os direitos autorais reservados para Elsevier)
Após dessorção, a solução contendo os analitos foi filtrada no dispositivo de dessorção e levada para injeção no GC-MS. Após otimização e validação, o procedimento desenvolvido apresentou limites de quantificação para PAHs variando de 0,0027 ng mL-1 (fenantreno, Phe) a 0,0050 ng mL-1 (Indeno[1,2,3-cd]pireno, InP) e de 3,72 ng mL-1 a 5,67 ng mL-1 e de 0,79 ng mL-1 a 1,68 ng mL-1, para oxi-PAHs e nitro-PAHs, respectivamente. Esses limites foram cerca de 10 vezes menores do que os obtidos por SDME, representando um grande avanço em relação a quantificação destes compostos em baixas concentrações. O procedimento desenvolvido foi aplicado na determinação de PAHs, nitro-PAHs e oxi-PAHs em amostras coletadas em diferentes regiões da BTS. Os PAHs de baixa massa molar foram detectados com mais frequência do que os PAHs de elevada massa molar, devido a sua maior solubilidade em água. Avanços analíticos para determinação de mercúrio em amostras ambientais coletadas na BTS A determinação de mercúrio em amostras ambientais normalmente é conduzida utilizando-se a técnica de geração de vapor frio.37 No entanto, o uso de instrumentos analíticos que permitem a análise direta, sem a necessidade de empregar procedimentos de digestão ácida ou extração, tem-se mostrado vantajosos na determinação de mercúrio total em amostras de sedimento e biota coletados na BTS. Em um artigo publicado por de Jesus et al.37 um método utilizando um novo agente quelante, o ditiotreitol (DTT) foi desenvolvido para extração de mercúrio total em amostras de sedimento superficial coletados no Rio Paraguaçu, localizado na divisa entre Cachoeira e São Felix e que estão situados dentro da BTS. O procedimento de extração foi otimizado e a determinação foi realizada utilizando-se a geração de vapor frio com detecção por espectrometria de fluorescência atômica (CV AFS). Para validação do procedimento, os autores utilizaram três materiais de referência certificados de sedimentos distintos (SRM MESS-3, SRM PACS-2, SRM NIST 1646a), além da determinação de mercúrio por meio do analisador direto de mercúrio (DMA-80) (Figura 4). Os autores mostraram que não houve diferença estatisticamente significativa quando se comparou os dados de concentração de mercúrio em sedimentos analisados tanto por CV AFS quanto por DMA. Deste modo, embora o método de extração utilizando o agente quelante DTT tenha sido desenvolvido com sucesso, o estudo também mostrou que o DMA-80 pode ser considerada uma alternativa mais atrativa para determinação de mercúrio em amostras ambientais complexas, uma vez que dispensa etapas laboriosas de tratamento da amostra, além de se utilizar massa de amostra tão baixa quanto 25 mg.
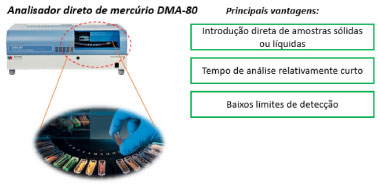 Figura 4. Esquema ilustrativo de análise de amostras sólidas utilizando o DMA-80 (fonte: adaptado de Milestone)65
O DMA-80 tem sido a primeira escolha na determinação de mercúrio em amostras de sedimentos, material particulado atmosférico,38 combustíveis38 e biota25,66 coletadas na região da BTS. Este fato pode ser atribuído a fatores como elevada velocidade analítica na análise das amostras, simplicidade do procedimento analítico e eliminação de múltiplas etapas do preparo de amostras. As aplicações mais comuns envolvem a determinação de mercúrio total em amostras de sedimento superficial66,67 e coletados em testemunhos de sedimento,34 macroalgas e gramas marinhas.67 As amostras de biota marinha da BTS, as quais possuem uma matriz de maior complexidade em comparação aos sedimentos, também foram analisadas utilizando-se o DMA. Estudos recentes, desenvolvidos por Sola et al.66 e Martinez et al.25 empregaram o DMA na determinação de mercúrio total em diferentes partes de organismos marinhos, como poliquetas e ascídias, respectivamente. Uma vez que foi necessário seccionar as amostras em partes distintas (resultando em valores baixos de massa), o uso do DMA favoreceu a determinação de mercúrio total com elevada sensibilidade.
OCORRÊNCIA DE POLICÍCLICOS E HG NA BAÍA DE TODOS OS SANTOS Água Os nitro-PAHs e oxi-PAHs podem estar presentes em corpos d'água devido principalmente às atividades antrópicas.30,64 Alguns nitro-PAHs apresentam baixa solubilidade em água e, portanto, podem ser adsorvidos em materiais sólidos e carbonáceos.61 Já os oxi-PAHs, como as quinonas, são mais solúveis em água, logo a mobilidade desses compostos em meio aquoso é maior do que a dos PAHs prioritários.30 Na BTS há estudos muito limitados para PACs em águas. Celino et al.68 avaliaram os PAHs prioritários a fim de identificar fontes antrópicas e mais recentemente, Santos et al.30 e Nascimento et al.64 incluíram nitro-PAHs e oxi-PAHs. O primeiro trabalho descrito na literatura foi realizado em águas superficiais dos estuários dos Rios Paraguaçu e Jaguaripe, ambos tributários da BTS.30 Os autores avaliaram os PAHs prioritários e as concentrações totais variaram de 0,0029 a 0,1079 ng L-1, com valor médio de 0,0344 ng L-1. Naftaleno (Nap), acenaftileno (Aci), acenafteno (Ace), fluoreno (Flu), fenantreno (Phe) e antraceno (Ant) foram predominantes em ambos os locais, o que, segundo os autores, foi um indicativo de fontes petrogênicas. Posteriormente, o mesmo grupo de pesquisa68 realizou um estudo mais amplo em 19 pontos distribuídos no entorno da BTS. Os PAHs de baixa massa molar também foram predominantes, indicando fontes petrogênicas. Os resultados foram confirmados pelo emprego das razões Phe/Ant e fluoranteno/pireno (Flt/Pyr). Por fim, uma análise de componentes principais (PCA), indicou correlação entre todas as amostras analisadas. Santos et al.30 foram os primeiros a determinar simultaneamente 52 PACs (20 PAHs, 27 nitro-PAHs e 5 quinonas) em amostras de água superficial do Rio Paraguaçu e água do mar da BTS. Entre os compostos estudados, oito PAHs, seis nitro-PAHs e duas quinonas foram identificados e quantificados nas amostras analisadas, com concentrações que variaram de 0,41 μg L-1 a 1,05 μg L-1 para os PAHs; de 8,93 de 22,8 μg L-1 para os nitro-PAHs e de 1605 a 1868 μg L-1 para quinonas. Quinonas foram encontradas principalmente nas amostras do Rio Paraguaçu e nitro-PAHs nas amostras de água do mar da BTS. Por sua vez, os PAHs tiveram as menores concentrações em ambos os locais e os valores foram inferiores aos estabelecidos pela legislação brasileira (Decreto-Lei nº 236/98 de 01/08/1998) para águas superficiais destinadas a consumo humano. O predomínio de nitro-PAHs e quinonas nas amostras preocupa tanto do ponto de vista ambiental quanto de saúde pública, uma vez que não há limites estabelecidos na legislação para a presença desses compostos em água, e esses apresentam toxicidades maiores que os PAHs. Posteriormente, Nascimento et al.64 determinaram simultaneamente 30 PACs incluindo os 16 PAHs prioritários, 3 quinonas e 11 nitro-PAHs em amostras de água do mar (coletadas em locais da BTS caracterizados pelo intenso tráfego de pequenas embarcações e navios) e água doce coletadas no Rio Paraguaçu. A metodologia desenvolvida pelos autores permitiu a detecção de compostos em nível de ng L-1. As concentrações acima do LOQ para PAHs nessas amostras variaram de 0,13 ng L-1 (fenantreno, Phe) a 19,5 ng L-1 (naftaleno, Nap), os PAHs de alta massa molar não foram quantificados nas amostras. O nitro-PAH 1-nitronaftaleno (1-NNAp), um composto derivado do naftaleno (Nap), não foi quantificado nas amostras, o que está relacionado a sua baixa solubilidade em água. Em relação as quinonas, apenas a 9,10-fenantraquinona (9,10-PQ) foi encontrada na concentração de 19,8 μg L-1. Quando comparado ao trabalho de Santos et al.,30 verificou-se que as concentrações de nitro-PAHs e quinonas foram menos frequentes e menores, o que pode estar relacionado as características individuais dos pontos amostrados e a época de coleta. A escassez de estudos sobre PACs em águas na BTS provavelmente está relacionada ao fato de a água não ser um bom indicador de poluição marinha, pois os níveis de concentração são apenas um snapshot e sujeita a muitos processos (físico-químicos, diluição, degradação e fotólise, dentre outros). Ainda, como a contribuição da porção apolar das moléculas dos PACs é considerável, e também seus elevados valores de log Kow e log Koc, uma vez esses compostos sendo emitidos para os corpos d'água, eles tendem a sofrer partição para o material particulado em suspensão, eventualmente se depositando nos sedimentos ou serem sorvidos pelos organismos marinhos. Em relação aos níveis de Hg, não foram encontrados estudos que avaliaram os níveis de Hg em amostras de água na BTS. Os níveis de Hg foram determinados em amostras de sedimento e de biota coletados na BTS, conforme discutido a seguir. Sedimentos Os sedimentos possuem a capacidade de acumular contaminantes em concentrações superiores às observadas na coluna d'água, por isso são largamente utilizados para indicar o nível de poluição e contaminação ambiental.27 Na BTS há um número considerável de estudos empregando essa matriz para avaliar os níveis de PACs (Tabela 1). Entretanto, a maioria considera apenas os 16 PAHs prioritários, o que pode não ser suficiente para avaliar eficientemente as fontes petrogênicas e pirogênicas e os processos associados. Nestes casos, o emprego de PAHs alquilados e PACs contendo heteroátomos de enxofre no anel, por exemplo, fornecem informações mais precisas uma vez que estão presentes nos combustíveis fósseis em concentrações superiores aos 16 PAHs prioritários.26,27
Para os nitro-PAHs e oxi-PAHs, embora sejam encontrados em quantidades menores do que os PAHs prioritários nos sedimentos, sua carcinogenicidade e mutagenicidade de ação direta são de uma a cinco ordens de magnitude superiores do que os PAHs não substituídos, além disso, são bons indicadores de fontes pirogênicas.29,69 Estudos de nitro-PAHs e quinonas em sedimentos, realizados pelo grupo de pesquisa liderado por de Andrade são pioneiros no Brasil e também na BTS. Santos et al.29 foram os primeiros a avaliar a presença de PAHs, vinte e sete nitro-PAHs e cinco quinonas em sedimentos do Rio Paraguaçu, principal afluente da BTS. Os PACs 1,2-naftoquinona (1,2-NQ), 9,10-fenantraquinona (9,10-PQ), nitronaftaleno, metil nitronaftaleno, nitrobifenila e nitrofluoreno, foram encontrados em níveis de ng g-1 (Tabela 1). O mesmo conjunto de compostos foi empregado para um estudo mais abrangente, incluindo 48 amostras de sedimentos na região entre marés de praias arenosas localizadas na BTS.69 As concentrações mais elevadas de PAHs e nitro-PAHs foram encontradas nas amostras com alto percentual de areia fina-média e baixo teor de matéria orgânica (Tabela 1). A presença da 3-nitrobenzantrona (3-NBA), importante composto mutagênico, foi detectado em 86% das amostras com alta correlação com os demais PACs, indicando fonte pirogênica, refletindo os efeitos do tráfego intenso de embarcações na BTS. Os compostos heterocíclicos contendo átomos de enxofre no anel aromático (PASHs) podem representar até 10% do total de compostos aromáticos presentes no petróleo.70 Na BTS, Bahia et al.26 avaliaram os PASHs em conjunto com os PAHs prioritários, e as concentrações de benzotiofeno (BT) e dibenzotiofeno (DBT) foram eficientes para indicar influência petrogênica na região da RLAM e a influência industrial na região do Complexo Industrial de Aratu, respectivamente. Entretanto, o número limitado de padrões analíticos disponíveis comercialmente, a inexistência de materiais de referência certificado e problemas de coeluição27 estão entre os principais motivos para o número limitado de estudos em sedimentos empregando PASHs. A maioria dos estudos em sedimentos se refere aos 16 PAHs prioritários e estão localizados na área adjacente a refinaria de petróleo, na porção nordeste (RLAM) e noroeste (Complexo Industrial de Aratu) da BTS.50,55,71 72 73 Em geral, concentrações mais elevadas (> 500 ng g-1) são encontradas em pontos mais próximos a RLAM (Tabela 1), indicando que as atividades portuárias e relacionadas a refinaria influenciam o ambiente marinho estudado. Uma avaliação ambiental em 28 pontos foi realizada na parte nordeste (RLAM) da BTS por Venturini e Tommasi50 e Venturini et al.,71 além das análises de PAHs, foram analisadas as características granulométricas, teores de carbono orgânico total (COT), nitrogênio total, enxofre e hidrocarbonetos alifáticos. Nos pontos mais próximos a RLAM, verificou-se a ocorrência de contaminação petrogênica, com algum aporte pirogênico e a presença de petróleo degradado ou intemperizado nos sedimentos. As maiores concentrações estavam diretamente relacionadas a sedimentos com maiores teores de COT. Os resultados destes estudos foram empregados por Muniz et al.73 para aplicar o índice biótico marinho (AMBI) a fim de verificar a saúde bentônica do ecossistema local usando esses conjuntos de dados. Barros et al.74 analisaram sedimentos coletados no inverno e no verão em um estuário afluente da BTS (Paraguaçu). De acordo com os autores, o local não foi severamente afetado por fontes antrópicas pois na maioria dos pontos as concentrações dos PAHs estavam abaixo dos valores de LOD. Celino e Queiroz51 investigaram a presença de PAHs de baixa massa molar (Nap, Ace, Acy, Flu, Ant e Phe) em 43 pontos da BTS, incluindo área de produção, área de refino e área portuária. Acenafteno (Ace), fluoreno (Flu), fenantreno (Phe), antraceno (Ant) apresentaram valores de concentração superiores àquelas estabelecidas pelo NOAA para área portuária. Segundo os autores, ao aplicar as razões diagnósticas Phe/Ant e Ant/(Ant+Phe) para esses mesmos compostos indicaram fonte pirogênica associada a petróleo. Várias razões diagnósticas foram aplicadas como ferramentas para distinguir a fonte de PAHs em sedimentos de 24 pontos da BTS.75 Na maioria dos casos, as taxas de diagnóstico apontaram a combustão incompleta como a única ou principal fonte de PAHs, enquanto o exame detalhado dos dados revelou a presença de resíduos de óleo. Esses autores, questionaram o uso exclusivo de razões de diagnóstico para identificação de fontes em áreas tropicais, devido ao rápido intemperismo de hidrocarbonetos petrogênicos nestes locais. Nesses casos, o emprego de nitro-PAHs, quinonas e PASHs pode ser uma alternativa promissora. Estudos mais recentes com PAHs têm relatado a ocorrência de efeitos decorrentes da atividade petrolífera no manguezal sedimentar do estuário do rio São Paulo.73 A influência antrópica nos níveis, distribuição e origem desses compostos no inverno e verão neste estuário foram avaliadas por Almeida et al.58 Apesar de ser uma região cronicamente exposta à atividade da indústria do petróleo, as concentrações de PAHs foram de moderadas a baixas e significativamente maiores na estação chuvosa, sugerindo influência do escoamento superficial da chuva na contribuição dos níveis de PAHs encontrados. Em geral, as concentrações de PAHs no sedimento do local estão de acordo com os valores obtidos nos estudos anteriores em outras regiões da BTS.73,75 Os autores empregaram as razões InP/(InP + BghiP), BaA/(BaA + Cry), Flu/(Flu + Pyr) e Ant/(Ant + Phe) que indicaram fontes pirogênicas como causas principais da entrada de PAHs. Esses resultados, segundo os autores, destacam que a deposição atmosférica, associada ao escoamento superficial, pode influenciar a distribuição de PAHs no estuário. O mesmo grupo de pesquisa54 realizou um estudo mais abrangente, com mais amostragens ao longo da BTS. As concentrações totais de PAHs (Σ16 PAHs) nos sedimentos variaram de abaixo do LOD a 533 ng g-1, com um valor médio de 147 ng g-1. Quando comparados com estudos anteriores feitos na BTS, os níveis de PAHs encontrados pelos autores foram relativamente mais baixos. Venturini e Tommasi50 por exemplo, relataram uma concentração máxima de 4163 ng g-1 para PAHs totais na região localizada mais próxima a RLAM e centros urbanos (região nordeste da BTS). Wagener et al.76 relataram uma concentração total dos 16 PAHs prioritários de 2226 ng g-1 próximo ao Porto de Aratu e ao Complexo Industrial de Aratu. Ambos os estudos demonstram que as maiores concentrações de PAHs são encontradas nas margens da baía onde as principais fontes potenciais de PAHs estão na porção noroeste, próximo de um terminal de petróleo, o centro urbano de São Francisco do Conde (local de produção de petróleo e gás) e a foz do Rio Subaé, com várias atividades antrópicas ocorrendo ao longo de sua sub-bacia, como atividades industriais, lançamento de efluentes domésticos, uso de agrotóxicos nas lavouras e lançamento inadequado de resíduos sólidos. PAHs de alta (high, H) massa molar (ΣHPAHs, quatro a seis anéis) corresponderam em média a 95% da composição total dos PAHs nos sedimentos da BTS, enquanto os de baixa (low, L) massa molar (Σ LPAHs, dois a três anéis) corresponderam a uma proporção média de 5% indicativa de maiores contribuições de PAHs de fontes pirogênicas para o ambiente. As concentrações de vinte e quatro PAHs foram determinadas em amostras de sedimento e mariscos em sete pontos da BTS.49 No sedimento os valores Σ24 PAHs variaram de 89 (Baía de Itagipe) a 921 ng g-1 (Ilha de Itaparica) e de 72 (Baía de Itagipe) a 760 ng g -1 (Ilha de Itaparica), respectivamente. Essas concentrações estão de acordo com estudos anteriores na área54,58 (Tabela 1). As concentrações na Baía de Itagipe foram comparáveis às encontradas em áreas de baixa contaminação. No entanto, concentrações dos PAHs encontradas na Ilha de Itaparica e no estuário do Subaé foram da mesma ordem de grandeza de sedimentos de locais altamente contaminados. Todas as outras amostras apresentaram níveis de PAHs que indicavam contaminação moderada por PAHs. Na maioria das amostras, as razões ([InP]/([InP] + [BghiP]) indicaram atividades pirogênicas (combustão de óleo) como a principal fonte de PAHs. Também foram relatados valores indicando fontes de óleo para a Ilha de Itaparica e Rio Subaé. Em ambas as áreas, o tráfego de embarcações pode estar causando esse aporte de óleo. Apesar do elevado número de fontes antrópicas de mercúrio (Hg) na BTS, os dados sobre este elemento em sedimentos ainda são escassos.34,37,77,78 A primeira avaliação foi realizada por Seeliger et al.76 que relataram concentrações de Hg na faixa de 10 a 820 μg g-1 em sedimentos coletados no estuário do Rio Subaé. No início dos anos 2000, concentrações de Hg variando entre 194-343 μg kg-1 foram encontradas na praia da Ribeira.78 Fostier et al.67 determinaram Hg em sedimentos coletados em oito locais próximo de fontes desse elemento: Praia da Penha, Ilha do Medo, Praia Salinas da Margarida, Ilha de Maré, Praia de Madre de Deus, Ilha das Bimbarras, Praia do Caboto e Praia da Ribeira. Em cerca de 45% das amostras de sedimento, a concentração de Hg foi de duas a quatro vezes maior que o valor superior considerando o background regional de Hg (15 μg kg-1). Entretanto, essas concentrações, que variaram de 2,1 a 64,5 μg kg-1, estiveram abaixo do limite brasileiro (150 μg kg-1) para sedimentos de água salgada adotado como TEL (Threshold Effect Level), que indica o nível máximo em que não há efeito adverso sobre a comunidade biológica.79 A avaliação da evolução histórica da contaminação por Hg na BTS, registrada em testemunhos de sedimentos datados de várias áreas nesta baía foi realizada por Hatje et al.34 houve um enriquecimento antrópico significativo de Hg na BTS ao longo do século passado. Os resultados fornecem evidências de um grande sumidouro de Hg em sedimentos de fundo que pode se tornar uma fonte substancial para a coluna de água, possivelmente se traduzindo em riscos ecológicos e até toxicológicos se os sedimentos forem perturbados por atividades humanas. Segundo os autores, o acúmulo de Hg na BTS representa principalmente o legado de emissões históricas de uma usina de cloro e álcalis já desativada na Baía da Ribeira, uma fundição de Pb na bacia do Rio Subaé e emissões atmosféricas. Outras fontes de Hg citadas são entradas contínuas de atividades humanas atuais, como operações portuárias, cultivo de camarão e indústria de petróleo. Ocorrência em organismos marinhos: ascídias, poliquetas e recifes de corais No presente estudo, consideramos apenas organismos sésseis e/ou sedentários, tais como poliquetas, ascídias e corais, que são ótimas espécies biomonitores da poluição de diferentes substâncias químicas (tais como Hg e PACs). Espécies marinhas com razoável a elevada mobilidade, tais como peixes e tartarugas,80,81 dentre outras possibilidades, por causa de características inerentes às espécies, não seriam bons biomonitores de uma área específica sob estudo, já que os níveis de contaminantes eventualmente encontrados seriam resultantes de todo o trecho de mar que tiveram acesso durante o tempo de vida dos mesmos, e não facilmente correlacionado a BTS, que é foco deste estudo. Invertebrados marinhos como ascídias e poliquetas podem ser usados como biomonitores da poluição ambiental.25,31,66 As ascídias são organismos marinhos sésseis, representados tanto por formas solitárias quanto coloniais, que possuem sifões de inspiração e expiração que se conectam ao cesto branquial para funções de respiração e alimentação.25,82 Devido a sua característica de organismo filtrador, as ascídias tornam-se possíveis biomonitores de espécies químicas presentes na água do mar.82 As ascídias habitam ambientes costeiros e estuarinos, sua distribuição é determinada pela temperatura, salinidade e hidrodinâmica83,84 e têm sido investigadas como biomonitores de poluição por elementos traço e compostos orgânicos.24,85,86 Recentemente, a espécie de ascídia solitária Phallusia nigra foi explorada em estudos sobre poluição por mercúrio na BTS, os níveis de mercúrio foram quantificados em diferentes tecidos das ascídias.25 Neste estudo, as ascídias da espécie Phallusia nigra foram coletadas por mergulho SCUBA e dissecadas em três tecidos: túnica, hepatopâncreas e cesto branquial (Figura 5). Verificou-se que a P. nigra bioacumula mercúrio em diferentes concentrações em seus tecidos, sendo o cesto branquial o único tecido capaz de diferenciar pequenas variações espaciais de poluição. O estudo concluiu que os resultados obtidos para estes organismos filtradores podem ser correlacionados com os níveis de poluição na água do mar, sendo a P. nigra um excelente organismo biomonitor de poluição por mercúrio em áreas marinhas.25
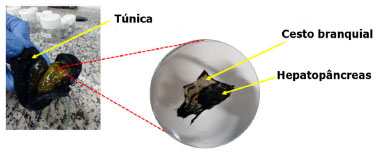 Figura 5. Ilustração de uma ascídia e suas principais partes: túnica, cesto branquial e hepatopâncreas. Essa ilustração foi feita pela Dra. Rayane Sorrentino, que é taxonomista de ascídias, e gentilmente cedida para compor o presente estudo
Outro grupo de invertebrados marinhos que pode ser utilizado como biomonitor de poluição por mercúrio é o das poliquetas, vermes segmentados pertencentes ao filo Annelida. Recentemente, o estudo publicado por Sola et al.66 com espécies de poliquetas estritamente sedentárias que vivem permanentemente enterradas no sedimento, mostrou que os níveis de mercúrio encontrados nestes invertebrados podem ser correlacionados com os níveis de poluição do sedimento. Neste trabalho, as poliquetas foram seccionadas em três regiões: região anterior, abdômen e região posterior. E diferentemente dos resultados encontrados para as ascídias Phallusia nigra, onde o mercúrio apresenta-se em diferentes concentrações ao longo dos tecidos,25 o conjunto de dados obtido para as poliquetas não mostrou predominância no acúmulo de mercúrio ao longo das três regiões investigadas do corpo destes animais.25 A importância destes animais é devido a capacidade de biocumulação do mercúrio que polui o sedimento. Cabe ressaltar que as análises de mercúrio total publicadas por Martinez et al.25 e Sola et al.66 foram realizadas de forma direta utilizando a técnica analítica com o DMA-80, sem a necessidade de fazer tratamento elaborado da amostra, conforme descrito anteriormente. Além disso, os tecidos foram analisados individualmente, sem a necessidade de fazer pool de amostras, o que permitiu realizar um maior número de análises por local utilizando menos indivíduos (Figura 6).
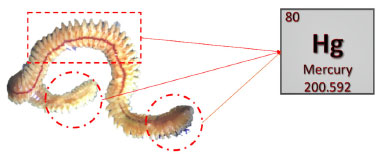 Figura 6. Ilustração de uma poliqueta e o estudo da ocorrência de mercúrio em suas diferentes partes: região anterior, abdômen e região posterior
Com relação à importância da utilização de invertebrados marinhos como biomonitores de PACs, o primeiro relato da ocorrência da 3-NBA em organismos marinhos ocorreu em amostras de poliquetas coletadas na BTS.31 A 3-NBA é um potente mutagênico descoberto em 1997 e denominado "O Demônio do Diesel", que é classificada como uma nitrocetona policíclica aromática. Esta substância desperta a atenção da comunidade científica devido ao seu potencial mutagênico e carcinogênico, mesmo presente em quantidades extremamente pequenas em partículas de escape de diesel.88 A 3-NBA foi a substância química que produziu a maior pontuação já relatada no "teste de Ames", uma medida padrão do potencial causador de câncer por substâncias químicas tóxicas.89 Em poliquetas da BTS, além da 3-NBA foram quantificados 18 PAHs, 6 oxi-PAHs e 27 nitro-PAHs. A análise dos gráficos de razão diagnóstico para determinar a origem dos PAHs nestes invertebrados evidenciou que os poluentes eram provenientes tanto de fontes petrogênicas quanto de fontes pirogênicas.31 Resultados estes que estão de acordo com o esperado, uma vez que alguns pontos de coleta da BTS são caracterizados por intenso tráfego marítimo de grandes e de pequenas embarcações, além do descarte de resíduos e da exploração de petróleo.41 Com relação a utilização de ascídias na determinação de PAHs, recentemente um procedimento eficaz de extração sólido-líquido em combinação com etapa de cleanup baseada em microextração em fase sólida dispersiva foi desenvolvido e aplicado em ascídias Phallusia nigra coletadas na Baía de Todos os Santos para a determinação de 44 PACs, incluindo o potente composto mutagênico 3-NBA e seus metabólitos 3-aminobenzantrona (3-ABA) e 3-acetil-aminobenzantrona (3-Ac-ABA).24 A síntese da 3-NBA e dos seus metabólitos 3-ABA e 3-Ac-ABA foi realizada conforme o esquema a seguir (Esquema 1).
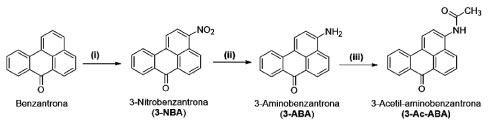 Esquema 1. Síntese da 3-NBA e de seus metabólitos. (i) HNO3 fumegante, nitrobenzeno, 45 °C, 1 h; (ii) solução aquosa Na2S 15%, refluxo, 2,5 h; (iii) piridina, anidrido acético, temperatura ambiente, 48 h
O desenvolvimento de metodologias analíticas para a determinação da 3-NBA e dos seus metabólitos 3-ABA e 3-Ac-ABA é de extrema importância. Pesquisas mostram que a 3-NBA em células uroteliais humanas cancerígenas é metabolizada em 3-ABA e 3-Ac-ABA para formar adutos de DNA não acetilados e acetilados.90,91 Ou seja, ocorre um processo de bioativação da 3-NBA para que esta exerça a sua potente toxicidade (Esquema 2). Entretanto, ainda não foi relatada a ocorrência dos metabólitos da 3-NBA em organismos marinhos e o impacto destas benzantronas na biota marinha ainda é desconhecido.
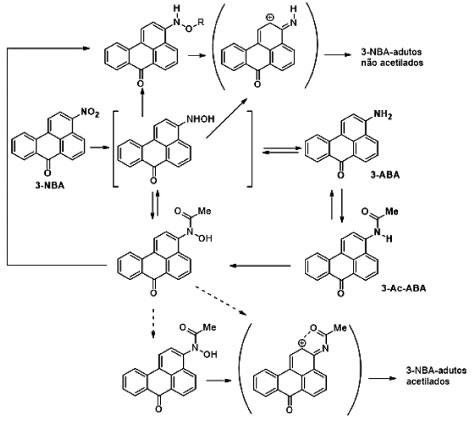 Esquema 2. Proposta de formação dos adutos não acetilados e adutos acetilados de DNA derivados da 3-NBA (fonte: adaptado de Arlt et al.)90
Corais escleractíneos também são considerados importantes organismos a serem utilizados como biomonitores já que deixam registrado em seu esqueleto um arquivo da variação temporal de parâmetros climáticos e de poluição ambiental.92 Além de serem biomonitores, estes organismos possuem uma alta relevância ecológica pois são um dos principais construtores dos recifes de corais, já que depositam carbonato de cálcio formando uma estrutura rochosa de alta complexidade que serve de abrigo para uma grande diversidade de organismos e permite a composição de um ambiente com grande produtividade.93,94 A redução da abundância de corais escleractíneos e a consequente substituição por organismos não construtores afeta todo o ecossistema recifal e constitui um fenômeno que indica estresse ambiental chamado de mudança de fase.95,96 Na Baía de Todos os Santos, grande parte dos recifes de corais encontra-se na sua porção nordeste, região que apresenta atividades industriais e portuárias, além do adensamento urbano da cidade de Salvador e região metropolitana (Figura 7A). Estes recifes vêm passando por um processo de redução da cobertura de corais escleractíneos e substituição pelo zoantídeo Palythoa cf. variabilis (Duerden, 1898) que é uma espécie de antozoário que não deposita carbonato de cálcio, sendo esse o primeiro registro de mudança de fase no Atlântico Sudoeste97 (Figura 7B). Ao contrário das regiões de alta diversidade como o Caribe no Atlântico, recifes marginais como estes que ocorrem no Atlântico Sul apresentam uma baixa diversidade, porém, uma grande incidência de espécies endêmicas.98 Embora alguns estudos sugiram que as espécies dessa região são resistentes a impactos principalmente globais como as mudanças climáticas, a grande incidência de ameaças locais reduz essa resistência.99,100 A poluição na região é uma das hipóteses de ameaça mais prováveis para explicar a ocorrência desse fenômeno de mudança de fase já que há registro de contaminação por metais e hidrocarbonetos policíclicos aromáticos em sedimento de áreas próximas.101 Além disso, dados de mercúrio na ascídia Phallusia nigra Savigny, 1816, coletados nestes recifes evidenciam concentrações maiores desse elemento em pontos mais próximos das fontes de contaminação.25
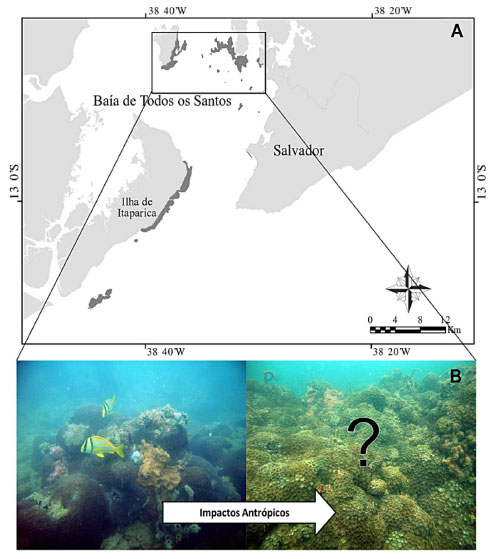 Figura 7. Processo de mudança de fase ocorrendo em recifes de corais da Baía de Todos os Santos. (A) Mapa da região com distribuição dos recifes de corais em cinza escuro e um destaque para os recifes internos que sofrem mais pressão antropogênica. (B) Esquema do processo de mudança de fase para dominância de zoantídeos (fotos: Igor Cruz)
Apesar disso, existem poucos estudos na Baía de Todos os Santos que medem diretamente o efeito da poluição nos corais e estes são restritos a abordagens de aprimoramento de técnicas de descontaminação amostral para análise de elementos traço em esqueleto do coral Siderastrea stellata Verrill, 1868.92,102 Avanços nos estudos de determinação de compostos policíclicos aromáticos e mercúrio nos corais escleractíneos permitirão compreender não somente como a poluição afeta recifes de corais da região, mas como tem se dado os padrões de contaminação da baía ao longo do tempo.
CONCLUSÕES E TENDÊNCIAS PARA ESTUDOS FUTUROS Com o crescente aumento da população mundial, as forçantes antrópicas vêm contribuindo para alterações importantes dos ecossistemas marinhos. Na Baía de Todos os Santos, há um número crescente de estudos de contaminantes orgânicos (PACs) e inorgânicos (Hg e outros elementos traço) nas últimas décadas. As emissões industriais, petrogênicas e pirogênicas são as principais fontes para as espécies químicas consideradas. Considerando (i) o histórico de exploração de petróleo na BTS, (ii) os níveis de concentrações dos PACs e Hg encontrados em períodos anteriores e posteriores ao derrame de óleo ocorrido em 2019 da mesma ordem de grandeza, (iii) característica geográfica da BTS (que confere um ambiente protegido) e (iv) as condições hidrodinâmicas de suas águas, não foram ainda encontradas evidências de que a BTS tenha sido diretamente afetada pelo derrame de óleo. Entretanto, para compreender melhor os processos físicos e biogeoquímicos e da contaminação ambiental da BTS, novas investigações precisam ser desenvolvidas na região. As tendências para novos estudos são:
LISTA DE ABREVIAÇÕES 1-MeAnt = 1-metilantraceno 1-MeNap = 1-metilnaftaleno 1-MePhe = 1-metilfenantreno 1,2-NQ = 1,2 naftoquinona 1,4-NQ = 1,4-naftoquinona 1,4-BQ = 1,4-benzoquinona 1NNAp = 1-nitro-naftaleno 2-MeNap = 2-metilnaftaleno 2-NBP = 2-nitrobifenila 2-NPyr = 2-nitropireno 2,3,5-TMeNap = 2,3,5-trimetilnaftaleno 2,6-DMeNap = 2,6-dimetilnaftaleno 3-MBT = 3-metilbenzotiofeno 4-MDBT = 4-metildibenzotiofeno 4,6-DEDBT = 4,6-dietildibenzotiofeno 4,6-DMDBT = 4,6-dimetildibenzotiofeno 7-NBaA = 7-nitrobenzo[a]antraceno 9,10-AQ = 9,10-antraquinona 9,10-PQ = 9,10-fenantraquinona Ace = acenafteno Aci = acenaftileno Ant = antraceno BaA = benzo(a)antraceno BaP = benzo(a)pireno BbF = benzo(b)fluoranteno BeP = benzo(e)pireno BgP = benzo(ghi)perileno BiP = bifenila BkF = benzo(k)fluoranteno BNT = benzonaftotiofeno BT = benzotiofeno BTS = Baía de Todos os Santos CIA = Centro Industrial de Aratu CIC = Complexo Industrial de Camaçari Cor = coroneno COT = carbono orgânico total Cry = criseno CV-AFS = geração de vapor à frio com detecção por espectrometria de fluorescência atômica D-μSPE = extração em fase micro-sólida dispersiva DBA = dibenzo(a,h)antraceno DBT = dibenzotiofeno DMA = analisador direto de mercúrio DTT = ditiotreitol ETDI = estação de tratamento de esgoto Flt = fluoranteno Flu = fluoreno InP = indeno(1,2,3-cd)pireno LOD = limite de detecção LOQ = limite de quantificação MAE = extração assistida por microondas Nap = naftaleno nitro-PAHs = hidrocarbonetos policíclicos aromáticos nitrados oxi-PAHs = hidrocarbonetos policíclicos aromáticos oxigenados PACs = compostos policíclicos aromáticos PAHs = hidrocarbonetos policíclicos aromáticos PANH = hidrocarbonetos policíclicos aromáticos contendo nitrogênio como heteroátomo PAOH = hidrocarbonetos policíclicos aromáticos contendo oxigênio como heteroátomo PASH = hidrocarbonetos policíclicos aromáticos contendo enxofre como heteroátomo PCA = análise de componentes principais Per = perileno Phe = fenantreno Pyr = pireno RLAM = Refinaria Lantufo Alves SDME = microextração em gota pendente ou microextração em gota única TEL = threshold effect level TEMADRE = Terminal Marítimo de Madre de Deus US EPA = United States Environmental Protection Agency ΣHPAHs = soma das concentrações dos PAHs de alta massa molar, 4-6 anéis benzênicos ΣLPAHs = soma das concentrações dos PAHs de baixa massa molar, 2-3 anéis benzênicos
AGRADECIMENTOS Os autores gostariam de agradecer a Agência Nacional de Desenvolvimento Científico e Tecnológico (CNPq), Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES, Código de Financiamento 001), Serviço Nacional de Treinamento Industrial, Departamento Regional da Bahia (SENAI/CIMATEC), ao Instituto Nacional de Ciência e Tecnologia em Energia & Ambiente (INCT E&A, projeto CNPq, n° 465497/2014-4), Fundação de Amparo à Pesquisa do Estado da Bahia (FAPESB, projeto n° 5545/2019), e o Centro Interdisciplinar em Energia e Ambiente (CIEnAm) da Universidade Federal da Bahia. Os autores também agradecem o projeto Pesquisando Kirimurê: Convergindo Educação, Ciência, Tecnologia e Inovação (CNPq, projeto n° 442187/2018-1) e o projeto Impactos Subletais do Derramamento de Óleo de 2019 sobre as Funções Ecológicas Chaves de Ecossistemas Marinhos da Bahia (CNPq, projeto n° 440800/2020-0). M. M. N. agradece ao CNPq por sua bolsa (DTI-A, projeto n° 381058/2021-2), G. O. R. e J. B. A. agradecem pelas suas bolsas de produtividade em pesquisa do CNPq. Os autores agradecem o Prof. Igor Cruz pela autorização do uso de duas fotografias utilizadas na Figura 7 do presente artigo e a Dra. Rayane Sorrentino pela ilustração da ascídias.
REFERÊNCIAS 1. Willis, K. A.; Serra-Gonçalves, C.; Richardson, K.; Schuyler, Q. A.; Pedersen, H.; Anderson, K.; Stark, J. S.; Vince, J.; Hardesty, B. D.; Wilcox, C.; Nowak, B. F.; Lavers, J. L.; Semmens, J. M.; Greeno, D.; MacLeod, C.; Frederiksen, N. P. O.; Puskic, P. S.; Rev.: Methods Technol. Fish Biol. Fish. 2022, 32, 145. [Crossref] 2. Bowler, D. E.; Bjorkman, A. D.; Dornelas, M.; Myers-Smith, I. H.; Navarro, L. M.; Niamir, A.; Supp, S. R.; Waldock, C.; Winter, M.; Vellend, M.; Blowes, S. A.; Böhning-Gaese, K.; Bruelheide, H.; Elahi, R.; Antão, L. H.; Hines, J.; Isbell, F.; Jones, H. P.; Magurran, A. E.; Cabral, J. S.; Bates, A. E.; People and Nature 2020, 2, 380. [Crossref] 3. Camp, E. F.; Emerging Top. Life Sci. 2022, 6, 107. [Crossref] 4. Merkens, J. L.; Reimann, L.; Hinkel, J.; Vafeidis, A. T.; Global and Planetary Change 2016, 145, 57. [Crossref] 5. Jouffray, J. B.; Blasiak, R.; Norström, A. V.; Österblom, H.; Nyström, M.; One Earth 2020, 2, 43. [Crossref] 6. https://www.un.org/en/global-issues/population, acessada em junho 2023. 7. https://sdgs.un.org/goals, acessada em junho de 2023. 8. https://news.un.org/en/story/2022/07/1122272, acessada em junho 2023. 9. International Energy Agency (IEA); IEA Net Zero by 2050: A Roadmap for the Global Energy Sector, 2021. [Link] acessado em maio 2023 10. Guarieiro, L.; Rezende, M.; Barbosa, W.; da Rocha, G.; Pereira, P. A.; Fernandes, D.; Lopes, W.; Mota, C.; de Andrade, J.; J. Braz. Chem. Soc. 2022, 33, 1353. [Crossref] 11. Guarieiro, L. L. N.; dos Anjos, J. P.; da Silva, L. A.; Santos, A. A. B.; Calixto, E. E. S.; Pesso, F. L. P.; de Almeida, J. L. G.; Andrade Filho, M.; Marinho, F. S.; da Rocha, G. O.; de Andrade, J. B.; J. Braz. Chem. Soc. 2022, 33, 844. [Crossref] 12. Boyce, D. G.; Tittensor, D. P.; Garilao, C.; Henson, S.; Kaschner, K.; Kesner-Reyes, K.; Pigot, A.; Reyes, R. B.; Reygondeau, G.; Schleit, K. E.; Shackell, N. L.; Sorongon-Yap, P.; Worm, B.; Nat. Clim. Change 2022, 12, 854. [Crossref] 13. Zhou, Q.; Wang, S.; Liu, J.; Hu, X.; Liu, Y.; He, Y.; He, X.; Wu, X.; Geosci. Front. 2022, 13, 101427. [Crossref] 14. Duran, R.; Cravo-Laureau, C.; FEMS Microbiol. Rev. 2016, 40, 814. [Crossref] 15. Townsend, M.; Davies, K.; Hanley, N.; Hewitt, J. E.; Lundquist, C. J.; Lohrer, A. M.; Frontiers in Marine Science 2018, 5, 359. [Crossref] 16. Barbier, E. B.; Curr. Biol. 2017, 27, R507. [Crossref] 17. Climate Change 2022, Impacts, Adaptation and Vulnerability; Cross-Chapter Paper 2: Cities and Settlements by the Sea, Cambridge, 2021. [Link] acessado em maio 2023 18. Dong, Y.; Liu, Y.; Hu, C.; Macdonald, I. R.; Lu, Y.; Science 2022, 376, 1300. [Crossref] 19. Lundstedt, S.; White, P. A.; Lemieux, C. L.; Lynes, K. D.; Lambert, I. B.; Öberg, L.; Haglund, P.; Tysklind, M.; Ambio 2007, 36, 475. [Crossref] 20. Idowu, O.; Carbery, M.; O'Connor, W.; Thavamani, P.; Chemosphere 2020, 246, 125779. [Crossref] 21. Idowu, O.; Tran, T. K. A.; Baker, P.; Farrel, H.; Zammit, A.; Semple, K. T.; O'Connor, W.; Thavamani, P.; Sci. Total Environ. 2020, 736, 139574. [Crossref] 22. Idowu, O.; Semple, K. T.; Ramadass, K.; O'Connor, W.; Hansbro, P.; Thavamani, P.; Environ. Int. 2019, 123, 543. [Crossref] 23. Idowu, O.; Tran, T. K. A.; Webster, G.; Chapman, I.; Baker, P.; Farrel, H.; Zammit, A.; Semple, K. T.; Hansbro, P. M.; O'Connor, W.; Thavamani, P.; Sci. Total Environ. 2020, 742, 140497. [Crossref] 24. Nascimento, M. M.; Martinez, S. T.; Prazeres, E. S.; Sorrentino, R.; de Andrade, J. B.; Microchem. J. 2022, 174, 107081. [Crossref] 25. Martinez, S.; Felix, C.; Sorrentino, R.; Cruz, I.; de Andrade, J.; J. Braz. Chem. Soc. 2023, 34, 228. [Crossref] 26. Bahia, P. V. B.; Nascimento, M. M.; Hatje, V.; de Andrade, J. B.; Machado, M. E.; J. Chromatogr. A 2021, 1653, 462414. [Crossref] 27. Machado, M. E.; Nascimento, M. M.; Bahia, P. V. B.; Martinez, S. T.; de Andrade, J. B.; TrAC, Trends Anal. Chem. 2022, 150, 116586. [Crossref] 28. Kahkashan, S.; Wang, X.; Ya, M.; Chen, J.; Wu, Y.; Cai, Y.; Saleem, M.; Inam, A.; Aftab, J.; Chemosphere 2019, 233, 652. [Crossref] 29. Santos, L. O.; Santos, A. G.; de Andrade, J. B.; Mar. Pollut. Bull. 2018, 136, 248. [Crossref] 30. Santos, L. O.; dos Anjos, J. P.; Ferreira, S. L. C.; de Andrade, J. B.; Microchem. J. 2017, 133, 431. [Crossref] 31. Sola, M. C. R.; Santos, A. G.; Martinez, S. T.; Nascimento, M. M.; da Rocha, G. O.; de Andrade, J. B.; Sci. Rep. 2020, 10, 3465. [Crossref] 32. Achten, C.; Andersson, J. T.; Polycyclic Aromat. Compd. 2015, 35, 177. [Crossref] 33. Andersson, J. T.; Achten, C.; Polycyclic Aromat. Compd. 2015, 35, 330. [Crossref] 34. Hatje, V.; Andrade, R. L. B.; Jesus, R. M.; Masqué, P.; Albergaria-Barbosa, A. C. R.; de Andrade, J. B.; Santos, A. C. S. S.; Mar. Pollut. Bull. 2019, 145, 396. [Crossref] 35. Chen, C. Y.; Driscoll, C. T.; Eagles-Smith, C. A.; Eckley, C. S.; Gay, D. A.; Hsu-Kim, H.; Keane, S. E.; Kirk, J. L.; Mason, R. P.; Obrist, D.; Selin, H.; Selin, N. E.; Thompson, M. R.; Environ. Sci. Technol. 2018, 52, 9556. [Crossref] 36. Lamborg, C. H.; Hammerschmidt, C. R.; Bowman, K. L.; Swarr, G. J.; Munson, K. M.; Ohnemus, D. C.; Lam, P. J.; Heimbürger, L. E.; Rijkenberg, M. J. A.; Saito, M. A.; Nature 2014, 512, 65. [Crossref] 37. de Jesus, R. M.; Brandao, G. C.; dos Santos, W. N. L.; dos Santos, L. O.; de Andrade, J. B.; J. Braz. Chem. Soc. 2020, 31, 2553. [Crossref] 38. de Jesus, R. M.; dos Anjos, J. P.; Torres, E. A.; da Rocha, G. O.; de Andrade, J. B.; Energy Fuels 2020, 34, 16173. [Crossref] 39. Escobar, H.; Science 2019, 366, 672. [Crossref] 40. Campelo, R. P. S.; de Lima, C. D. M.; de Santana, C. S.; da Silva, A. J.; Neumann-Leitão, S.; Ferreira, B. P.; Soares, M. O.; de Melo Júnior, M.; Melo, P. A. M. C.; Mar. Pollut. Bull. 2021, 167, 112281. [Crossref] 41. Azevedo, R. N. A.; Bezerra, K. M. M.; Nascimento, R. F.; Nelson, R. K.; Reddy, C. M.; Nascimento, A. P.; Oliveira, A. H. B.; Martins, L. L.; Cavalcante, R. M.; Environ. Pollut. 2022, 314, 120283. [Crossref] 42. de Andrade, J. B.; Coutinho, R.; An. Acad. Bras. Cienc. 2022, 94, e20220905. [Crossref] 43. Soares, M. O.; Teixeira, C. E. P.; Bezerra, L. E. A.; Paiva, S. V.; Tavares, T. C. L.; Garcia, T. M.; de Araújo, J. T.; Campos, C. C.; Ferreira, S. M. C.; Matthews-Cascon, H.; Frota, A.; Mont'Alverne, T. C. F.; Silva, S. T.; Rabelo, E. F.; Barroso, C. X.; de Freitas, J. E. P.; de Melo Júnior, M.; Campelo, R. P. S.; de Santana, C. S.; Carneiro, P. B. M.; Meirelles, A. J.; Santos, B. A.; Oliveira, A. H. B.; Horta, P.; Cavalcante, R. M.; Marine Policy 2020, 115, 103879. [Crossref] 44. Magris, R. A.; Giarrizzo, T.; Mar. Pollut. Bull. 2020, 153, 110961. [Crossref] 45. Andrade, R. L. B.; Hatje, V.; Masqué, P.; Zurbrick, C. M.; Boyle, E. A.; Santos, W. P. C.; Mar. Pollut. Bull. 2017, 125, 459. [Crossref] 46. Murray, J. R.; Penning, T. M. Em Comprehensive Toxicology, vol. 7, 3rd ed.; Elsevier Science: Amsterdam, 2018. [Crossref] 47. de Castro, M. D. L.; Priego-Capote, F.; J. Chromatogr. A 2010, 1217, 2383. [Crossref] 48. López-Lorente, A. I.; Pena-Pereira, F.; Pedersen-Bjergaard, S.; Zuin, V. G.; Ozkan, S. A.; Psillakis, E.; TrAC, Trends Anal. Chem. 2022, 148, 116530. [Crossref] 49. Eça, G. F.; Albergaria-Barbosa, A. C. R.; de Souza, M. M.; Costa, P. G.; Leite, A. S.; Fillmann, G.; Hatje, V.; Mar. Pollut. Bull. 2021, 173, 112944. [Crossref] 50. Venturini, N.; Tommasi, L. R.; Mar. Pollut. Bull. 2004, 48, 97. [Crossref] 51. Celino, J. J.; Queiroz, A. F. S.; REM, Rev. Esc. Minas 2006, 59, 265. [Crossref] 52. Nascimento, R. A.; de Almeida, M.; Escobar, N. C. F.; Ferreira, S. L. C.; Mortatti, J.; Queiroz, A. F. S.; Mar. Pollut. Bull. 2017, 119, 223. [Crossref] 53. Costa, A. B.; de Souza, J. R. B.; Zucchi, M. R.; de Azevedo, A. E. G.; de Argollo, R. M.; Mar. Pollut. Bull. 2016, 105, 411. [Crossref] 54. de Souza, J. R. B.; Zucchi, M. R.; Costa, A. B.; de Azevedo, A. E. G.; Spano, S.; Mar. Pollut. Bull. 2017, 119, 239. [Crossref] 55. Egres, A. G.; Hatje, V.; Miranda, D. A.; Gallucci, F.; Barros, F.; Ecol. Indic. 2019, 96, 229. [Crossref] 56. Martins, L. K. P.; Nascimento, I. A.; Fillmann, G.; King, R.; Evangelista, A. J. A.; Readman, J. W.; Depledge, M. H.; Environ. Res. 2005, 99, 387. [Crossref] 57. do Ó Martins, A. B.; de Assis, A. H. S.; Cardoso Filho, M. S.; Hatje, V.; Moreira, I. T. A.; de Albergaria-Barbosa, A. C. R.; Mar. Pollut. Bull. 2020, 151, 110781. [Crossref] 58. de Almeida, M.; do Nascimento, D. V.; Mafalda, P. O.; Patire, V. F.; de Albergaria-Barbosa, A. C. R.; Mar. Pollut. Bull. 2018, 137, 399. [Crossref] 59. Dimpe, K. M.; Nomngongo, P. N.; TrAC, Trends Anal. Chem. 2016, 82, 199. [Crossref] 60. Gałuszka, A.; Migaszewski, Z.; Namieśnik, J.; TrAC, Trends Anal. Chem. 2013, 50, 78. [Crossref] 61. Bandowe, B. A. M.; Meusel, H.; Sci. Total Environ. 2017, 581-582, 237. [Crossref] 62. Guiñez, M.; Bazan, C.; Martinez, L. D.; Cerutti, S.; Microchem. J. 2018, 139, 164. [Crossref] 63. Kong, J.; Dai, Y.; Han, M.; He, H.; Hu, J.; Zhang, J.; Shi, J.; Xian, Q.; Yang, S.; Sun, C.; J. Environ. Sci. (Beijing, China) 2021, 102, 159. [Crossref] 64. Nascimento, M. M.; da Rocha, G. O.; de Andrade, J. B.; Talanta 2019, 204, 776. [Crossref] 65. https://www.milestonesci.com/direct-mercury-analyzer/, acessada em maio 2023. 66. Sola, M. C. R.; de Jesus, R. M.; Nascimento, M. M.; da Rocha, G. O.; de Andrade, J. B.; Sci. Total Environ. 2022, 851, 157965. [Crossref] 67. Fostier, A. H.; Costa, F. N.; Korn, M. G. A.; Environ. Sci. Pollut. Res. 2016, 23, 19686. [Crossref] 68. Celino, J. J.; Corseuil, H. X.; Fernandes, M.; Hadlich, G. M.; Resources and Environment 2012, 2, 141. [Link] acessado em maio 2023 69. Sola, M. C. R.; Santos, A. G.; Nascimento, M. M.; da Rocha, G. O.; de Andrade, J. B.; Sci. Total Environ. 2022, 810, 152019. [Crossref] 70. Machado, M. E.; de Menezes, E. W.; Bregles, L. P.; Caramão, E. B.; Benvenutti, E. V.; Zini, C. A.; J. Sep. Sci. 2013, 36, 1636. [Crossref] 71. Venturini, N.; Tommasi, R.; Bícego, M. C.; Martins, C. C.; Brazilian Journal of Oceanography 2004, 52, 123. [Link] acessado em maio 2023 72. Venturini, N.; Muniz, P.; Bícego, M. C.; Martins, C. C.; Tommasi, L. R.; Estuarine, Coastal Shelf Sci. 2008, 78, 457. [Crossref] 73. Muniz, P.; Venturini, N.; Pires-Vanin, A. M. S.; Tommasi, L. R.; Borja, A.; Mar. Pollut. Bull. 2005, 50, 624. [Crossref] 74. Barros, F.; Hatje, V.; Figueiredo, M. B.; Magalhães, W. F.; Dórea, H. S.; Emídio, E. S.; Estuarine, Coastal Shelf Sci. 2008, 78, 753. [Crossref] 75. Wagener, A. L. R.; Hamacher, C.; Farias, C. O.; Godoy, J. M.; Scofield, A. L.; Mar. Chem. 2010, 64, 284. [Crossref] 76. Wagener, A. L. R.; Carreira, R. S.; Hamacher, C.; Scofield, A. L.; Farias, C. O.; Cordeiro, L. G. M. S.; Luz, L. G.; Baêta, A. P.; Kalas, F. A.; Mar. Pollut. Bull. 2011, 62, 1877. [Crossref] 77. Seeliger, U.; de Lacerda, L. D.; Patchineelam, S. R.; Metals in Coastal Environments of Latin America, 1st ed.; Springer: Germany, 1988. 78. CRA - Centro de Recursos Ambientais; Diagnóstico da Concentração de Metais Pesados e Hidrocarbonetos de Petróleo nos Sedimentos e Biota da Baía de Todos os Santos, Salvador, 2005. [Link] acessado em maio 2023 79. CONAMA; Resolução no 344, de 25 de março de 2004. [Link] acessado em maio 2023 80. Rodriguez, C. A. B.; de Lacerda, L. D.; Bezerra, M. F.; Moura, V. L.; de Rezende, C. E.; Bastos, W. R.; Environ. Sci. Pollut. Res. 2020, 27, 20527. [Crossref] 81. Bezerra, M. F.; Lacerda, L. D.; Rezende, C. E.; Franco, M. A. L.; Almeida, M. G.; Macêdo, G. R.; Pires, T. T.; Rostán, G.; Lopez, G. G.; Environ. Pollut. 2015, 206, 236. [Crossref] 82. Tzafriri-Milo, R.; Benaltabet, T.; Torfstein, A.; Shenkar, N.; Frontiers in Marine Science 2019, 6, 611. [Crossref] 83. Lambert, G.; Can. J. Zool. 2005, 83, 34. [Crossref] 84. Parrinello, D.; Bellante, A.; Parisi, M. G.; Sanfratello, M. A.; Indelicato, S.; Piazzese, D.; Cammarata, M.; Ecotoxicol. Environ. Saf. 2017, 136, 126. [Crossref] 85. Jiang, A.; Yu, Z.; Wang, C. H.; African Journal of Marine Science 2009, 31, 289. [Crossref] 86. Kotterman, M.; van der Veen, I.; van Hesselingen, J.; Leonards, P.; Osinga, R.; de Boer, J.; Biomol. Eng. 2003, 20, 425. [Crossref] 87. Evangelista, A. J. A.; Nascimento, I. A.; Pereira, S. A.; Lopes, M. B. N. L.; Martins, L. K. P.; Fillmann, G.; Cienc. Mar. 2005, 31, 43. [Crossref] 88. Enya, T.; Suzuki, H.; Watanabe, T.; Hirayama, T.; Hisamatsu, Y.; Environ. Sci. Technol. 1997, 31, 2772. [Crossref] 89. Takamura-Enya, T.; Suzuki, H.; Hisamatsu, Y.; Mutagenesis 2006, 21, 399. [Crossref] 90. Arlt, V. M.; Glatt, H.; Muckel, E.; Pabel, U.; Sorg, B. L.; Seidel, A.; Frank, H.; Schmeiser, H. H.; Phillips, D. H.; Int. J. Cancer 2003, 105, 583. [Crossref] 91. Pink, M.; Verma, N.; Zerries, A.; Schmitz-Spanke, S.; Chem. Res. Toxicol. 2017, 30, 1855. [Crossref] 92. Eça, G. F.; Mendonça Filho, C. V. S.; Hatje, V.; Santos, W. P. C.; Quim. Nova 2012, 35, 581. [Crossref] 93. Costanza, R.; de Groot, R.; Sutton, P.; van der Ploeg, S.; Anderson, S. J.; Kubiszewski, I.; Farber, S.; Turner, R. K.; Global Environmental Change 2014, 26, 152. [Crossref] 94. GCRMN Global Coral Reef Monitoring Network; Status of Corals Reefs of the World: 2020, United Nations Environmental Programme, 2020. [Link] acessado em maio 2023 95. Done, T. J.; Hydrobiologia 1992, 247, 121. [Crossref] 96. Bell, J. J.; Micaroni, V.; Strano, F.; Emerging Top. Life Sci. 2022, 6, 95. [Crossref] 97. Cruz, I. C. S.; de Kikuchi, R. K. P.; Longo, L. L.; Creed, J. C.; Mar. Ecol. 2015, 36, 318. [Crossref] 98. Leão, Z. M. A. N.; Kikuchi, R. K. P.; Testa, V. Em Latin American Coral Reefs; Cortés, J., ed.; Elsevier Science: Amsterdam, 2003. [Crossref] 99. Leão, Z. M. A. N.; Kikuchi, R. K. P.; Mar. Pollut. Bull. 2005, 51, 599. [Crossref] 100. Cruz, I. C. S.; Waters, L. G.; Kikuchi, R. K. P.; Leão, Z. M. A. N.; Turra, A.; Mar. Pollut. Bull. 2018, 135, 551. [Crossref] 101. Hatje, V.; Bícego, M. C.; de Carvalho, G. C.; de Andrade, J. B. Em Baía de Todos os Santos: Aspectos Oceanográficos; Hatje, V.; de Andrade, J. B., orgs.; EDUFBA: Salvador, 2009, p. 243. [Link] acessado em maio 2023 102. Mendonça Filho, C. V. S.; dos Santos, W. P. C.; de Kikuchi, R. K. P.; Hatje, V.; Microchem. J. 2012, 102, 123. [Crossref] |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access