Revisão
|
|
| Aplicação da espectrometria de massas com ionização por paper spray e técnicas relacionadas na análise direta de matrizes biológicas para detecção de drogas - uma revisão Application of paper spray ionization mass spectrometry and related techniques in the direct analysis of biological matrices for detection of drugs - a review |
|
João Francisco Allochio FilhoI,II; Bruna Carneiro PiresI; Nayara A. SantosI,III; Sara Joaquina Inocencio DionisioI; Nathália dos S. ConceiçãoI; Amanda Eiriz FeuI, Warley de Souza BorgesI; Valdemar Lacerda Jr.I; Wanderson RomãoI,III,IV,*
I. Departamento de Química, Universidade Federal do Espírito Santo, 29075-910 Vitória − ES, Brasil Recebido em 27/12/2022 *e-mail: wandersonromao@gmail.com In recent years, technological development in analytical instrumentation has progressed vigorously, which has allowed the evolution of analytical techniques that play an indispensable role within society, highlighting mass spectrometry. Parallel to the technological advance of this technique, the development of new ionization methods that are simpler, faster, and allow direct analysis without the need for prior treatment or sample processing is underway. The methods of ambient ionization derived from paper spray have been developing rapidly in current days, mainly in the forensic field, due to the chemical modifications made in the paper substrate and the introduction of new types of organic materials that function as a probe/substrate to collect, store, and ionize the sample, then enabling more efficient and selective analyzes. This review highlights direct analyzes by applying paper spray ionization in the forensic field and some variations of this technique, including Thread Spray Ionization (TSI) when a fabric thread is used; Touch Spray Ionization (TSI), which uses materials such as metallic needles, medical swabs, and wooden sticks; Fiber Spray Ionization (FSI), which applies polymeric fibers as substrates. INTRODUÇÃO Em termos analíticos, podemos dizer que a espectrometria de massas ambiente (em inglês, Ambient Mass Spectrometry - AMS) é uma evolução decorrente do desenvolvimento da ionização por electrospray (em inglês, Electrospray Ionization - ESI) desenvolvida por Fenn e Yamashita (1984),1 a qual se baseia na nebulização da amostra a partir da aplicação de um potencial (2-5 kV) no capilar de injeção criando um spray de partículas carregadas em forma de gotículas. Posteriormente, essas gotículas atravessam um fluxo de gás contra-corrente para remover as últimas moléculas de solvente, o que resulta na dessolvatação e dessorção das espécies carregadas para a fase gasosa, as quais são, então, atraídas para o interior do espectrômetro de massas,1,2 de acordo com o esquema mostrado na Figura 1.
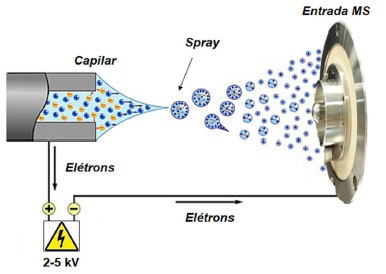 Figura 1. Representação simplificada da técnica de ESI (fonte: autor)
O surgimento da ESI possibilitou a realização de experimentos de espectrometria de massas (em inglês, Mass Spectrometry - MS) a partir da ionização dos analitos da amostra à pressão atmosférica (em inglês, Atmospheric Pressure Ionization - API), permitindo a identificação dos constituintes químicos, principalmente polares e de elevada massa molecular, além de extinguir o complicado procedimento para introdução da amostra no alto vácuo do espectrômetro de massas.3 Dessa maneira, considera-se que a ESI alavancou o desenvolvimento de diversas outras fontes, apesar da fonte de ionização química à pressão atmosférica (em inglês, Atmospheric Pressure Chemical Ionization - APCI), introduzida em 1973 por Horning et al., que possui três principais mecanismos de ionização: i) ionização de Penning (M•+); ii) transferência de prótons ([M + H]+ ou [M - H]- e iii) formação de adutos do gás reagente ([M + NH4]+), e que induz a ionização da amostra em solução através de uma nuvem de íons direcionados e gerados a partir da aplicação de uma descarga elétrica em um fluxo de gás (N2 ou He, normalmente), ser considerada uma das pioneiras na introdução das técnicas API.3 Apesar das técnicas que utilizam API resultarem na simplificação das análises de MS, ainda requerem um procedimento de preparo de amostras, bem como o controle da pressão utilizada. Nesse contexto, em direção ao avanço na simplicidade e generalidade da aplicação da MS, a AMS apresenta-se como uma técnica que possui reduzido ou nenhum preparo de amostra, e realiza suas análises em condições ambientes, ou seja, diretamente da amostra.4 Desde o pioneirismo de Takáts et al. (2004)5 e Cody et al. (2005)6 no desenvolvimento das primeiras técnicas de AMS, as quais estão incluídas ionização por dessorção com electrospray (em inglês, Desorption Electrospray Ionization - DESI) e análise direta em tempo real (em inglês, Direct Analysis in Real Time - DART), respectivamente, este novo e vasto campo da MS tem crescido intensamente nos últimos anos, possibilitando a análise direta de amostras em seu estado natural e uma maior simplicidade operacional. Na ionização por DESI, um electrospray é gerado por um fluxo baixo de solvente e a aplicação de um gás nebulizador e um potencial de alta voltagem (normalmente 4-5 kV) que resultam em um feixe de microgotículas carregadas. O spray ao ser direcionado para uma superfície (amostra), promove a extração, dessorção e ionização do ponto atingido. Ademais, o solvente utilizado pode ser selecionado para otimizar a ionização de determinados compostos.7 Por outro lado, nas análises por DART é utilizado um fluxo de gás, hélio ou nitrogênio, que é submetido a um feixe de elétrons pela aplicação de um potencial de alta voltagem entre dois eletrodos, que promovem a formação de íons, elétrons e espécies neutras com excitação eletrônica, que constituem o plasma. Após, o gás juntamente com o plasma formado passam por uma série de eletrodos que favorecem a remoção de espécies iônicas oriundas da mistura gasosa, e por uma câmara de aquecimento que resultará na formação de espécies neutras eletronicamente excitadas, aptas para ionizar o gás circudante (atmosférico do ambiente) e as moléculas do analito, principalmente por íons secundários criados a partir do ar circundante, ou seja, por íons reagentes. Esses íons do analito após formados por processos de ionização química à pressão atmosférica são finalmente transferidos para o analisador de massas.7 São vários os possíveis mecanismos envolvidos na formação de íons em análises por DART, que dependem da molécula analisada, bem como das condições de operação como; a polaridade e o gás utilizado. Em geral, dois mecanismos podem ser considerados predominantes: i) ionização de Penning e ii) transferência de prótons. A ionização de Penning envolve a transferência de energia do gás excitado (N*) para um analito (M), formando um cátion radical da espécie molecular (M•+):3,7 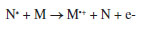 Na ionização por transferência de prótons, geralmente utilizando o hélio como gás, os átomos de hélio metaestáveis reagem com a água na atmosfera, produzindo aglomerados de água ionizada capazes de protonar a molécula da amostra, caso o analito possua maior afinidade por próton do que a mistura gasosa ionizada (clusters de água):7 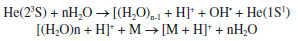 Em geral, a ionização por DART produz espectros de massas relativamente simples, e caracterizados pela presença de dois tipos principais de íons: M•+ ou [M + H]+ (modo positivo de ionização) e M•− ou [M − H]− (modo negativo de ionização).3,7 A fim de verificar como estas duas técnicas (DESI e DART) estão sendo utilizadas, em termos de quantidade de publicações, foi realizada uma busca na base de dados "Web of Science" utilizando as palavras chaves "title", "abstract" e "author keywords" no período de 2004-2022 (termo: "DESI") e 2005-2022 (termo: "DART"). O resultado dessa busca pode ser verificado na Figura 2. Os artigos que aplicam DESI como técnica de análise somam um total de 1611 e para DART foram encontrados 903 artigos. Na Figura 3, estão listadas os 20 autores mais citados sobre cada técnica, sendo que os artigos que introduziram DESI e DART possuem o maior número de citações.
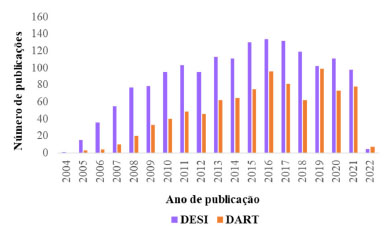 Figura 2. Gráfico representativo mostrando o número de trabalhos publicados utilizando as técnicas de DESI (2004-2022) e DART (2005-2022) (fonte: Web of Science, acesso em 19 de janeiro de 2022)
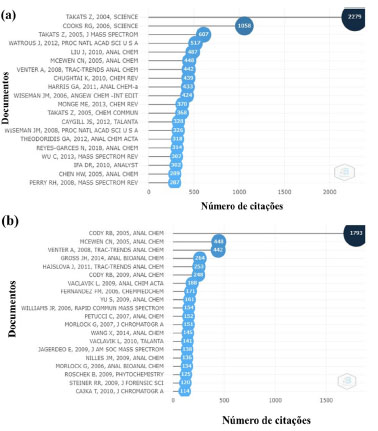 Figura 3. Gráfico representativo mostrando os 20 artigos mais citados com número de citações, utilizando as técnicas (a) DESI e (b) DART (fonte: Web of Science, acesso em 19 de janeiro de 2022 e Bibliometrix)7
Independente das novas técnicas de AMS desenvolvidas desde então, estas podem ser consideradas modificações da DESI ou DART.8,9 Dessa maneira, apesar das dezenas de técnicas de AMS e suas variantes desenvolvidas na última década,10 podemos dividi-las e caracterizá-las com base em dois principais métodos de ionização em destaque:11,12 (i) Técnicas baseadas em ESI: DESI, ionização extrativa por electrospray (em inglês, Extractive Electrospray Ionization - EESI), ionização por spray em papel (em inglês, Paper Spray Ionization - PSI), ionização por electrospray baseada em sonda (em inglês, Probe Electrospray Ionization - PESI), ionização ambiente por spray sônico (em inglês, Easy Ambient Sonic-Spray Ionization - EASI) e ionização por electrospray com ablação a laser (em inglês, Laser Ablation Electrospray Ionization - LAESI); (ii) Técnicas baseadas em APCI: DART, ionização por plasma a baixa temperatura (em inglês, Low Temperature Plasma - LTP), ionização por descarga de barreira dielétrica (em inglês, Dielectric Barrier Discharge Ionization - DBDI), ionização química por dessorção à pressão atmosférica (em inglês, Desorption Atmospheric Pressure Chemical Ionization - DAPCI) e ionização por sonda de análise ambiente de amostras (em inglês, Atmospheric Solids Analysis Probe - ASAP). A Tabela 1 apresenta o artigo de origem de cada uma das técnicas citadas anteriormente, bem como seu ano de desenvolvimento e o autor que as desenvolveu. Assim como é surpreendente o número de técnicas de AMS disponíveis atualmente em prol da pesquisa científica no ramo da MS, também é notável o seu vasto campo de aplicações. Por exemplo, diversos estudos relatam o uso da AMS na análise de produtos farmacêuticos, componentes biológicos, metabólitos, macromoléculas, no controle de qualidade de alimentos, de contaminantes ambientais, no controle de drogas ilícitas e na investigação forense, assim como a sua aplicação em análise e diagnóstico clínico de doenças.21 Nesse contexto, a escolha da melhor técnica de AMS aplicável à matriz que se pretende estudar se torna uma tarefa analítica imprescindível, necessitando de considerações acerca de parâmetros como sensibilidade, limites de detecção (LD) e quantificação (LQ), reprodutibilidade, eficiência de ionização, preparo e estado físico da amostra, tamanho das moléculas em análise, por exemplo, para que o método utilizado seja aquele que ofereça o melhor resultado.22-24 Dentre as principais técnicas de AMS utilizadas atualmente, podemos destacar a PSI e suas variações, como a ionização por spray em folha vegetal (em inglês, Leaf Spray Ionization - LSI),25 e a ionização por spray de toque (em inglês, Touch Spray Ionization - TSI),26 podendo esta última técnica ser correlacionada com outros métodos de ionização além da PSI. Aliado aos parâmetros analíticos citados anteriormente, o desenvolvimento da técnica de AMS se destaca, principalmente, pela eficiência, simplicidade e praticidade do método de ionização ambiente. Diante disso, as técnicas baseadas em ESI, que geram íons dos analitos via protonação, desprotonação, cationizadas ou anionizadas a partir de diferentes tipos de substratos, tais como: papel, sonda, palitos de madeira e swabs, por exemplo, se sobressaem por serem reprodutivas, brandas, rápidas, requererem o mínimo de amostra e solvente, e permitirem a análise direta sem, ou com mínimo, tratamento prévio e interferência na amostra. Todas estas características fazem da AMS uma técnica bastante promissora em estudos forenses, pois possibilita a análise direta das amostras, in natura e, assim, permite a sua preservação e a integridade dos dados químicos presentes nela. Estas características são essenciais para a análise de evidências de crimes e seu posterior uso em processos judiciais. Aplicações da AMS em química forense Atualmente, o uso da AMS tem sido uma das principais técnicas aplicada na Química Forense capaz de fornecer análise direta e não destrutiva de evidências com simplicidade, sensibilidade e exatidão.10 Além disso, a AMS permite produzir dados químicos confiáveis com menos interferência e alta confiabilidade utilizando procedimentos não invasivos e de baixo consumo de tempo, os quais permitem manter a integridade da amostra.27 Apesar da AMS ser eficiente na análise de matrizes forenses diversas, como sangue, sêmen, saliva, cabelo, documentos, cédulas de dinheiro, drogas ilícitas, resíduos de arma de fogo, explosivos, resíduos de incêndio, impressões digitais, alimentos e bebidas, combustíveis, entre outros,27 a identificação e determinação de substâncias ilícitas de uso abusivo utilizando AMS continua sendo objeto de estudo de muitas pesquisas. A Figura 4 mostra que mais de 150 trabalhos envolvendo a análise de matrizes forenses a partir do uso da AMS foram publicados na última década, dos quais mais de 50% compreendem o estudo de drogas ilícitas. Por exemplo, DART tem sido usado para a triagem de amostras de ervas suspeitas de conter canabinóides sintéticos ilegais;28 DESI foi aplicado em análises química e toxicológica rápidas de medicamentos na forma de comprimidos29 de forma similar; DAPPI foi utilizado para analisar drogas ilícitas e substâncias controladas na forma de comprimidos e de pó,30 e o estudo comparativo com a DESI sobre a resposta à presença de drogas de abuso nas amostras de urina mostrou melhores resultados para essa última técnica, a qual foi menos influenciada pela complexidade da matriz biológica.31 Ainda, podemos destacar o uso da EASI acoplada à cromatografia de camada fina (em inglês, Thin Layer Chromatography - TLC) para avaliação direta da presença de adulterantes em amostras de cocaína (COC),32 dentre outras técnicas de AMS aplicadas em estudos forenses.27
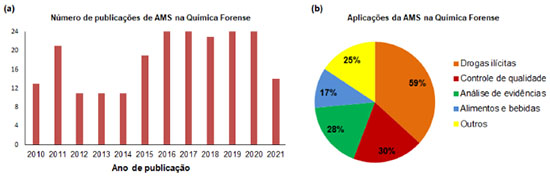 Figura 4. (a) Gráfico representativo mostrando o número de trabalhos publicados na última década utilizando a técnica de AMS na Química Forense (termos: "AMS" e "Forensic Chemistry"), e (b) os tipos de áreas de aplicações de AMS na Química Forense (fonte: Web of Science, acesso em 29 de julho de 2021)
Particularmente a técnica de PSI-MS é muito popular dentro da Química Forense e compreende mais de 45% de todas as publicações nessa área de estudo na última década, de acordo com levantamento realizado na plataforma Web of Science. Essa importância da PSI-MS deve-se muito à sua praticidade, velocidade de análise, baixo custo, necessidade de uma quantidade menor de amostra e a sua reprodutibilidade, como pode ser comprovado em estudos prévios sobre falsificação de documentos,33 explosivos,34 segurança alimentar,35 adulteração de bebidas,36 e drogas de abuso.37-39 A PSI-MS é considerada como uma técnica barata pois não necessita do uso de gases nebulizadores, como é o caso da ESI, e caracteriza-se por empregar um pedaço de papel constituído normalmente de celulose purificada, que é cortado em formato triangular, com pontas afiadas, e mantida por um clipe metálico com a parte aguda direcionada em frente à entrada do equipamento MS a uma distância que varia em poucos milímetros, de acordo com a ilustração da Figura 5.40 A aplicação de uma alta tensão desencadeia a formação de um spray proveniente da solução da amostra que é adicionada em um volume de microlitros na superfície do papel. Ocasionalmente, uma quantidade mínima de solvente puro é adicionada para ajudar a dessorção dos analitos da superfície do papel a partir da ruptura das interações entre os analitos e as fibras porosas hidrofílicas do papel celulósico que retém a amostra adsorvida.41
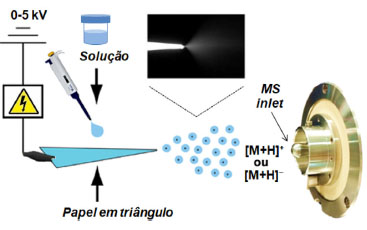 Figura 5. Representação esquemática da técnica de PSI-MS operando em modo positivo ou negativo, gerando íons [M+H]+ ou [M−H]-, respectivamente (fonte: adaptado de Wang et al.,40 copyright (2010) John Wiley and Sons
O mecanismo de pulverização e formação do spray na superfície do papel é centrado no princípio da ESI descrito anteriormente e, assim, pode ser explicado pelo alto potencial induzido no papel que permite a concentração de carga em sua superfície devido ao campo elétrico gerado entre a entrada do equipamento de MS e o papel. Assim, as forças de Coulomb ajudam os analitos a quebrarem as interações entre eles e as fibras celulósicas do papel úmido, formando gotículas carregadas que são posteriormente dessolvatadas e resultam nos íons dos analitos presentes na amostra que serão conduzidos para o interior do equipamento de MS.41 A utilização da PSI-MS permite a análise e determinação de evidências sem qualquer pré-tratamento ou modificação, preservando as suas características químicas que são cruciais para determinar pistas de um crime, principalmente em amostras complexas como o sangue,41-44 plasma,45 urina,44,46 e saliva,44 as quais representam matrizes biológicas frequentemente estudadas na área da toxicologia forense.47 Por exemplo, a quantificação de anfetamina (AM), metanfetamina (MA), 3,4-metilenodioxi-anfetamina (MDA), 3,4-metilenodioxi-N-metilanfetamina (MDMA), 3,4-metilenodioxi-N-etilanfetamina (MDEA), morfina, COC e Δ9-tetrahidrocanabinol (Δ9-THC) em amostras de sangue foi avaliada por meio da PSI-MS resultando em excelentes LDs, que variaram de 0,03 a 12 ng mL-1.48 Em comparação, os pesquisadores realizaram um estudo a partir do método extraction spray ionization, que utiliza um pedaço de papel (Whatman, grau 31ET-Chr, 6 × 0,5 × 0,7 mm), pré-carregado com uma amostra de sangue de 1,5 μL e seco ao ar livre por 5 min, em um capilar de vidro. A tira de amostra após ser inserida no capilar nanospray recebeu a adição de 10 μL de solvente para extração e pulverização. Esta análise apresentou valores de LD entre 0,06 e 2 ng mL-1. Por outro lado, os LQs para ambos os métodos foram semelhantes, com valores de desvio padrão relativo (DPR) variando de 1 a 5% para concentrações de drogas acima do limite inferior de quantificação de 10-40 ng mL-1.48 Ainda, os pesquisadores relataram a eficiência da PSI-MS na determinação de oito anfetaminas presentes em amostras de sangue com valores de LD variando de 15 a 50 ng mL-1 e precisão inferior a 15%.49 Em outro estudo, Yang et al. (2018)50 acoplaram a microextração em fluxo lento (em inglês, Slug-Flow Microextraction - SFME) à PSI-MS para a quantificação de AM, MA e MDA em sangue e urina. O uso de SFME na extração das anfetaminas das matrizes biológicas aumentou a sensibilidade de detecção em até duas vezes em comparação com a análise tradicional de PSI-MS. Os valores de LD e LQ obtidos na avaliação das amostras de sangue e urina foram semelhantes com valores variando entre 0,01-0,05 ng mL-1 e 0,05-0,2 ng mL-1, respectivamente.51 A sensibilidade da PSI-MS é muito dependente das características físico-químicas do papel, sendo que a sua forma, superfície e constituição química podem interferir diretamente no processo de adsorção e dessorção do analito.52 Além disso, a eluição do analito na superfície do papel depende da força de interação entre eles, por exemplo, ligação de hidrogênio e forças de van der Waals.53 Su et al. (2013)54 mostraram o tratamento do papel (substrato) com uma solução aquosa de HNO3, ou NaClO, que permitiu o aumento considerável da relação sinal-ruído (S/R) das drogas ilícitas detectadas nas amostras de sangue, a partir da diminuição do efeito de matriz resultante da remoção das moléculas presentes na composição química do papel que ionizam na faixa de massa dos analitos alvo, e que podem causar efeito de supressão iônica nos sinais de interesse (drogas). Assim, as modificações químicas do substrato papel podem melhorar a eficiência da PSI-MS na determinação de drogas em matrizes biológicas, por exemplo, papel de baixa hidrofilicidade à base de silano aplicado para quantificar COC e anfetaminas em sangue humano, soro e urina,55 e polímeros molecularmente impressos (em inglês, Molecularly Imprinted Polymers - MIP) em papel utilizado na determinação da COC em fluidos orais.56 Nesse sentido, podemos destacar que a utilização de papel modificado ou substratos com características hidrofóbicas podem ter a habilidade de diminuir ou eliminar as interações polares com os analitos presentes nas amostras, permitindo um processo de eluição mais eficiente e aumentando a ionização dos analitos.57 Por outro lado, o surgimento de novas técnicas de AMS que utilizam a análise direta pode permitir uma maior agilidade e confiabilidade na obtenção dos resultados de avalição de matrizes complexas como sangue e urina, por exemplo. Portanto, o surgimento de novos substratos capazes de superar as fortes interações com os analitos que afetam a avaliação de matrizes biológicas por PSI-MS é notável. Por exemplo, o uso de palitos de madeira foi bastante eficiente na análise de drogas em urina,58,59 e fluidos orais.58,60 Polímero sintético de organosiloxano (OSX) de baixa hidrofilicidade permitiu a determinação de novas substâncias psicoativas em urina com DPR menor que 1%;57 e fibras de carbono foram utilizadas na detecção de MA em urina sem qualquer pré-tratamento da amostra.61 Polímeros condutores derivados de pirrol e anilina foram sintetizados recentemente utilizando um papel cromatográfico como suporte para quantificar COC, Δ9-THC, canabidiol (CBD) e canabinol (CBN) em urina simulada. Os resultados obtidos para o papel revestido com o polímero condutor mostraram valores de LD e LQ variando de 1,4 a 12,3 ng mL-1 e 4,3 a 37,4 ng mL-1, respectivamente, com coeficiente de determinação (R2) maior que 0,985. Estes resultados foram melhores quando comparados aos relatados para a PSI-MS tradicional e/ou quando utilizada a cromatografia líquida acoplada à espectrometria de massas (LC-MS) para a maioria das substâncias estudadas.62 De maneira semelhante, foi relatado que o uso de grafeno mesoporoso como revestimento em papel condutor permitiu um excelente valor de LQ de 1 pg mL-1 na quantificação de AM. Esse resultado representa uma sensibilidade quase 10 vezes melhor em comparação ao papel cromatográfico comum, podendo ser explicado a partir de uma melhoria no processo de adsorção/dessorção e na eficiência de eluição correlacionadas às propriedades morfológicas e condutoras na superfície do substrato de grafeno.63 Ainda, substratos tipo aptâmeros de carbono foram desenvolvidos por revestimento em superfície de papel celulósico para serem aplicados como sorventes na extração de MA em amostras de saliva e sangue, e então avaliados pela técnica de PSI-MS acoplada à espectrometria de mobilidade iônica (em inglês, Ion Mobility Spectrometry - IMS). Os autores relataram valores de LD variando de 0,6-1,5 ng mL-1 para saliva e 0,45-0,9 ng mL-1 para amostras de sangue contendo MA.64 Outros dois tipos de substratos relatados na literatura são a ionização por spray em fio (em inglês, Thread Spray Ionization - TSI) e a ionização por spray de toque (TSI). Espectrometria de massas com ionização por spray em fio (TSI-MS) A TSI-MS é um tipo de análise que foi relatada recentemente por Jackson et al. (2018)65 que utiliza um único fio de tecido, e.g., nylon, algodão, poliéster ou uma mistura de algodão/poliéster, como substrato para a ionização do analito através de um processo que ocorre na superfície do tecido e leva à formação do cone de Taylor na ponta do fio ejetando as partículas carregadas do analito, como demonstrado na Figura 6.
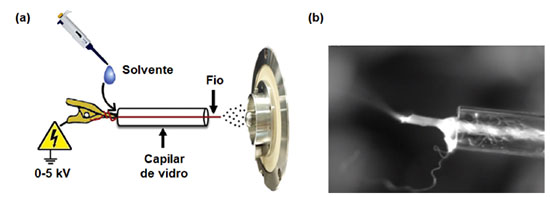 Figura 6. (a) Esquema experimental da técnica de ionização em fio. (b) Formação do cone de Taylor na ponta do fio de tecido (fonte: adaptado de Jackson et al.,65 copyright (2018) Elsevier B.V)
Esta técnica de análise ambiente possui algumas vantagens em comparação com outros métodos de ionização ambiente baseados em substrato, inclusive o PSI, por exemplo: i) a capacidade de manter a corrente de íons produzida por períodos mais longos devido à evaporação limitada do solvente dentro do capilar de vidro; ii) a eficiente ionização de analitos presentes em solução ou previamente depositados em um tecido, sendo o seu uso oportuno em análises diretas de resíduos em roupas para aplicações forenses; iii) o fio de tecido é mais dúctil, permitindo seu fácil armazenamento, transporte e amostragem de matrizes como o interior de frutas, por exemplo, sem a destruição completa da amostra; iv) ao contrário do papel, o substrato baseado em fio possui pontas afiadas naturais provenientes de suas fibras internas (vide Figura 6b), permitindo que um sinal de íon estável seja gerado sem forte dependência da geometria da ponta e v) vários tipos de fio de tecidos estão disponíveis comercialmente para o uso como substrato na análise, viabilizando e flexibilizando o desenvolvimento experimental.65 O uso de fio de tecido como substrato mostrou-se eficiente na determinação de diazepam, COC e anfetaminas em amostras de sangue. Os fios de algodão foram utilizados de duas formas: i) naturais, de composição hidrofílica e ii) tratados quimicamente por silanização, adquirindo composição hidrofóbica.66 Os resultados obtidos em cada um dos casos podem ser visualizados na Tabela 2 e revelam que o tratamento químico dos fios de algodão permite, por exemplo, quantificar COC com LD mais de 60% menor e uma melhora no LQ de até 80%, o que reflete num ganho elevado de sensibilidade em comparação aos fios não tratados. Os autores ainda relatam a obtenção de linearidades com valores de R2 > 0,999 e DPR inferiores a 10%. Uma provável explicação para os melhores resultados obtidos com o uso de fios tratados de característica hidrofóbica baseia-se nas interações analito/substrato que correm ao longo das fibras do tecido. Nesse sentido, nota-se que tais interações são mais intensas no caso de fios de composição hidrofílica que absorvem a amostra em suas fibras mais internas e dificultam o processo de extração do analito. Tal observação pode ser confirmada pela maior eficiência analítica obtida com o fio tratado por 60 min, o qual adquire uma maior hidrofobicidade em suas fibras em comparação ao fio tratado por 30 min, assim como no aumento da sensibilidade na determinação do diazepam, uma substância com elevada hidrofobicidade (LogP = 2,82), revelando uma redução de mais de 80% no valor do LQ. Por fim, os autores descobriram que o fio de tecido tratado foi capaz de armazenar a amostra de sangue contaminado por mais de 40 dias sem que houvesse uma degradação efetiva e sem ocasionar a perda da sensibilidade do método. Este fato pode resultar da concentração da amostra numa pequena região que leva a uma proteção passiva superficial, ao contrário do que ocorre no fio hidrofílico que dispersa a amostra por uma maior área superficial do tecido, aumentando a taxa de oxidação da amostra.66 Portanto, verifica-se que o uso da técnica de ionização em fio representa um interessante, versátil e eficiente meio para analisar e determinar substâncias ilícitas contidas em amostras biológicas cruas, possuindo um grande potencial de aplicação na área de toxicologia, assim como permitindo estudos forenses de diferenciação de tipos sanguíneos.67 Ainda, observou-se recentemente a possibilidade do acoplamento desta técnica à DESI para ganho de sensibilidade na análise de matrizes biológicas.68,69 Deste modo, vislumbra-se que a técnica de TSI baseada na coleta in situ e não invasiva da amostra seguida da análise direta no equipamento de MS, sem tratamento prévio ou processamento da amostra, pode funcionar de maneira semelhante ao método abordado anteriormente, e ser eficiente na análise de compostos em matrizes biológicas, preservando ainda as informações químicas dos analitos contidos na amostra.26 Espectrometria de massas com ionização por spray de toque (TSI-MS) O primeiro estudo sobre o desenvolvimento da TSI-MS foi publicado por Kerian, Jarmusch e Cooks em 2014.26 Essa técnica consiste na utilização de uma sonda/substrato, normalmente agulhas metálicas, que permite adsorver materiais in situ sob diversas condições físicas e sob diferentes tipos de superfície, tais como: roupas, cascas de alimentos, folhas vegetais e papel, por exemplo, e transferi-los para o espectrômetro de massas na forma de um spray de moléculas ionizadas gerado a partir de um potencial elétrico aplicado e auxiliado por um solvente, permitindo que os analitos sejam dessorvidos da superfície da sonda/substrato e conduzidos diretamente para a entrada do espectrômetro de massas. Dessa maneira, o processo de ionização da amostra na TSI-MS fundamenta-se, basicamente, de maneira semelhante àquele ocorrido na técnica de ESI. Por essas características, a TSI-MS pode ser empregada em diversos tipos de análises, por exemplo: sangue, tecidos biológicos, resíduos agroquímicos, controle de qualidade de alimentos e bebidas, estudos forenses e farmacológicos, dentre outros (Figura 7).26
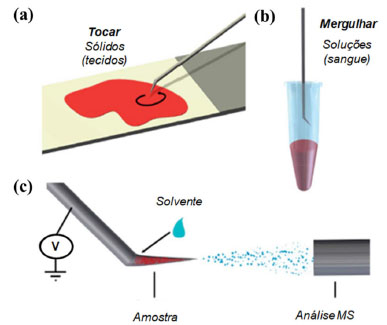 Figura 7. Amostragem de (a) sólidos: tecidos biológicos, e (b) líquidos: sangue, utilizando TSI-MS. (c) Aplicação de alta voltagem e solvente para a emissão de gotas de analito ionizado (fonte: adaptado de Kerian et al.,26 copyright (2014) The Royal Society of Chemistry)
A praticidade da TSI-MS pode ser verificada na etapa de amostragem, na qual o material a ser analisado pode ser adsorvido pela sonda de forma simples e variada, por exemplo: tocando, mergulhando, arranhando ou golpeando a amostra. Após a amostragem, a sonda contendo o material a ser analisado é direcionada em frente à entrada do espectrômetro de massas e conectada à fonte de alta voltagem, e quando se aplica solvente orgânico o electrospray é formado.26 A técnica de TSI-MS não necessita, essencialmente, do uso de sondas constituídas de materiais específicos ou com formatos pré-determinados, mas estas devem permitir uma eficiente amostragem, uma segura transferência do material, acomodar o solvente aplicado e promover o seu fluxo no spray e, assim, facilitar o processo de extração do analito e de produção de partículas carregadas (Figura 8). No entanto, materiais que permitem uma ótima adsorção, extração, separação e ionização da amostra apresentam vantagens na análise de materiais utilizando a TSI-MS.26
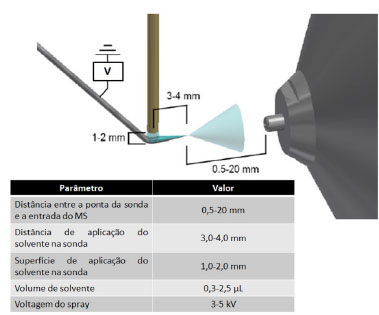 Figura 8. Especificações técnicas gerais adotadas para experimentos típicos de TSI-MS (fonte: adaptado de Kerian et al.,26 copyright (2014) The Royal Society of Chemistry)
Sendo um componente indispensável na metodologia de TSI-MS, a sonda/substrato exerce duplo papel na instrumentação da técnica, servindo tanto como meio de amostragem quanto de ionização, permitindo a análise direta de matrizes complexas sem um tratamento prévio. Comumente, as sondas utilizadas na TSI-MS são constituídas de estruturas capilares metálicas e pontiagudas que facilitam a formação do electrospray e a ionização das moléculas, dentre as quais se destacam: agulhas metálicas, aplicadas em diversas análises de tecidos biológicos;70,71 swab médicos, utilizados em estudos clínicos72-75 e forenses,76,77 e palitos de madeira aplicados no monitoramento de fármacos.58,78 Exemplo interessante é o uso de swab de microamostagem por absorção volumétrica para a determinação de drogas de abuso como anfetaminas, catinonas, fentanil e análogos, dentre outros, em amostras de fluido oral.79 O método utiliza a coleta de volumes fixos de fluido biológico a partir do contato entre a amostra e a ponta do swab que é capaz de absorver de forma específica um determinado volume de amostra. Neste caso, foi utilizado o swab para absorção de 10 μL de amostra, o qual foi mergulhado no interior do recipiente contendo o fluido oral. Posteriormente, foi adicionado um volume de solução do padrão interno e de solvente de eluição ao swab, o qual foi posicionado em frente ao equipamento de MS para a análise direta da amostra coletada, de acordo com a ilustração da Figura 9. Os autores relataram resultados de R2 variando entre 0,9545 e 0,9997, e valores de LD e LQ de 0,08-4,86 ng mL-1 e 0,25-16,19 ng mL-1, respectivamente, para a maioria dos trinta tipos de analitos estudados.79
 Figura 9. Representação do experimento de TSI-MS utilizando swab de micro-amostragem por absorção volumétrica. (A) Visão frontal mostrando o swab ao centro, a agulha de alta tensão à esquerda, e a seringa de solvente de eluição à direita. (B) Imagem ampliada da ponta de amostragem do swab. (C) Monitoramento da formação do electrospray na ponta do swab utilizando uma caneta laser (fonte: adaptado de Morato et al.,79 copyright (2019) American Chemical Society)
Sondas de composição orgânica, como o caso dos swabs médicos, à base de celulose, e dos palitos de madeira, além de permitirem a formação de íons, podem propiciar a adsorção seletiva de analitos presentes na amostra. Um tipo de material capaz de desempenhar este papel de sonda orgânica são as fibras poliméricas, mas o seu uso no campo da MS se destaca, principalmente, como sorvente na microextração em fase sólida (em inglês, Solid-Phase Microextration - SPME) ou como MIPs, e compreende principalmente o acoplamento às técnicas de GC-MS (em inglês, Gas Chromatography-Mass Spectrometry), HPLC-MS (em inglês, High-Performance Liquid Chromatography-Mass Spectrometry) e CE-MS (em inglês, Capillary Electrophoresis-Mass Spectrometry).80-82 No entanto, a utilização de fibra polimérica de baixa polaridade é capaz de apresentar uma alta sensibilidade na análise de amostras biológicas devido à sua hidrofobicidade, morfologia e porosidade.57,83,84 As técnicas que empregam a AMS e fibras poliméricas como substratos são atualmente conhecidas como técnicas de espectrometria de massas por ionização com spray em fibra (em inglês, Fiber Spray Ionization Mass Spectrometry - FSI-MS),85,86 sendo estas fundamentadas tanto no processo de formação de electrospray a partir de materiais porosos através da capilaridade, como já relatado e patenteado por John Fenn,87 quanto na produção de nano-electrospray a partir de polímeros mesoporosos como discutido por Tepper e Kessick.88 O uso de fibras como substratos na TSI-MS já é referenciada na literatura, não havendo uma novidade nesse sentido. Por outro lado, verificou-se uma enorme carência no desenvolvimento de fibras poliméricas com composição química específica que possa proporcionar uma melhor sensibilidade e seletividade nos experimentos de FSI-MS, bem como foi observado a inexpressiva aplicação desta técnica em estudos forenses, principalmente na detecção e determinação de drogas presentes em amostras biológicas como sangue e urina. Nesse sentido, Wang et al. (2017)83 mostraram o uso de microesferas de poliestireno (PE) produzidas por um processo de polimerização a quente para revestir a superfície do papel cromatográfico formando um papel revestido de PE e impregnado de microesferas que foi utilizado na determinação de medicamentos como amitriptilina, clozapina, quetiapina, verapamil e risperidona, por exemplo, em amostras de sangue, soro e urina. O método mostrou excelentes valores de LQ de 4-84 pg mL-1, representando uma melhoria de até 546 vezes na sensibilidade em comparação com papel cromatográfico não modificado. Posteriormente, o papel revestido com PE foi modificado utilizando um processo de cozimento produzindo um substrato vítreo revestido de PE com microesferas impregnadas dentro das fibras celulósicas, o qual foi aplicado na análise de proteínas e peptídeos em amostras de sangue. Os resultados mostraram que o substrato vítreo apresentou uma sensibilidade até 1348 vezes melhor na detecção de biomoléculas presentes no sangue em comparação com o papel comum.84 Em outro trabalho, o uso de fibra oca constituída de polipropileno (PP) foi avaliado tanto como agente sorvente quanto substrato na detecção de 4-cloroanfetamina, cetamina e MDMA em amostras de urina. Os resultados de FSI-MS obtidos com o uso da fibra de PP mostraram que o método foi capaz de extrair eficientemente a 4-cloroanfetamina da urina, melhorando sua intensidade em até 20 vezes quando utilizado a técnica de FSI-MS em comparação com a PSI-MS.85 Além disso, a fibra de PP conseguiu identificar a anfetamina MDMA em uma amostra simulada de urina com LD de 2 ng mL-1, representando uma sensibilidade até 360 vezes maior após a etapa de enriquecimento do analito através da microextração em fase líquida (em inglês, Liquid-Phase Microetraction - LPME) em comparação a nenhuma etapa de extração (Figura 10).86 Dessa maneira, a habilidade da fibra de PP em agir como extrator e substrato ionizante, combinada com seu baixo custo e a sua capacidade de ser mergulhada diretamente na amostra, faz com que esse tipo de material seja bastante versátil para a FSI-MS, podendo ser uma eficiente alternativa para estudos forenses por permitir uma análise sem tratamento prévio ou processamento da amostra.86,89
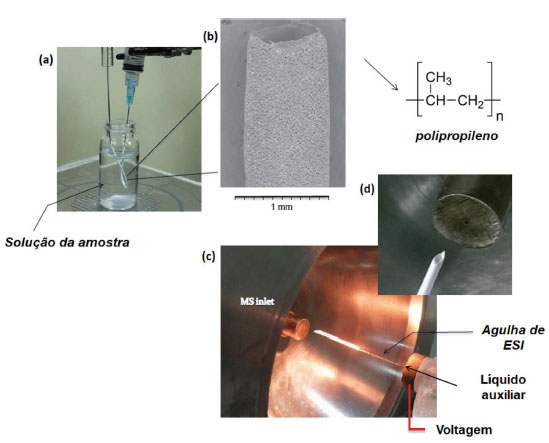 Figura 10. Representação da técnica de HF-LPME utilizando fibra de polipropileno. (a) Processo de microextração em fase líquida. (b) Imagem de microscopia eletrônica de varredura (MEV) da fibra. (c) Visualização da montagem do sistema de análise por FSI-MS. (d) Expansão da entrada do espectrômetro mostrando a estrutura física da fibra (fonte: adaptado de Liou et al.,86 copyright (2017) Elsevier B.V)
Em 2020, Allochio Filho et al.90 aplicaram uma fibra oca de PP na FSI-MS (ver Figura 11) para avaliação de amostras apreendidas de drogas, como comprimido, papel mata-borrão, haxixe e COC em pó e em uma amostra de urina de um caso de abuso de drogas. Além disso, um estudo quantitativo da COC por FSI-MS foi realizado diretamente da urina, sem qualquer pré-tratamento de amostra. Assim, a fibra de PP foi mergulhada na solução e, em seguida, comparada com resultados obtidos usando PSI-MS. O método de FSI-MS se mostrou eficaz como técnica de AMS e apresentou sensiblidade maior que o PSI-MS.
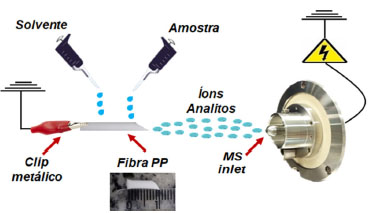 Figura 11. Representação esquemática da técnica FSI-MS (fonte: adaptado de Allochio Filho et al.,90 copyright (2020) John Wiley and Sons)
Comparação de PSI-MS e suas variações com técnicas de CG e HPLC HPLC-MS e GC-MS são técnicas muito conhecidas e consolidadas para análise de diferentes compostos orgânicos em diversos tipos de matrizes. Essas técnicas são bastante utilizadas por possuirem alta sensibilidade, apresentando baixos valores de LDs e LQs. Porém, na maioria das vezes, para que matrizes biológicas sejam aplicadas em HPLC e GC, é preciso um preparo da amostra, pois elas não podem ser inseridas diretamente no equipamento. Assim, a técnica de PSI-MS e suas variações podem ser utilizadas como técnicas alternativas para detectar e/ou quantificar drogas de abuso em diferentes amostras biológicas, com injeção direta da matriz, diminuindo o tempo de análise e os possíveis erros gerados durante o procedimento de preparo de amostra. A Tabela 3 mostra uma comparação entre alguns estudos envolvendo a determinação e quantificação de drogas de abuso em matrizes como sangue, urina e saliva utilizando a PSI-MS e suas variações e técnicas de GC e HPLC. É possivel ver que a PSI-MS possui desempenho analítico similar ou próximos às técnicas clássicas de GC e HPLC, apresentando alta sensibilidade, com valores de LDs e LQs na ordem de ng mL-1. Isso faz com que essa técnica seja promissora para análise de drogas de abuso em diferentes tipos de matrizes.
CONCLUSÃO Considerando o que foi exposto, pode-se constatar que as técnicas baseadas em AMS, principalmente a PSI-MS e suas variações, estão se mostrando promissoras em toxicologia forense, com alta sensibilidade na análise de drogas de abuso. Além disso, possuem a vantagem da análise direta da matriz, sem precisar de um preparo da amostra. Assim, em termos de baixo custo e facilidade de operação, a PSI-MS apresenta vantagens na realização de análises rápidas e econômicas. Durante essa revisão foi possível concluir que o desempenho do substrato de papel pode ser melhorado com o surgimento de novos substratos, visando sempre a melhoria na extração, eficiência de ionização e nos custos de análise. Assim, a PSI-MS vêm sendo bastante explorada e está em constante evolução para que melhores resultados possam ser encontrados, principalmente no campo da toxicologia forense para análise de drogas de abuso em diferentes matrizes biológicas.
AGRADECIMENTOS Os autores agradecem à CAPES (código financeiro 1), FAPES (Edital CNPq/FAPES nº 23/2018 - PRONEM (596/2018)), e ao CNPq (310057/2020-5, INCT Forense 465450/2014-8, e 422555/2018-5) pelo suporte financeiro. Os autores também gostariam de agradecer ao Núcleo de Competências em Química do Petróleo e ao Laboratório Multiusuário de Petroleômica e Forense/LabPetro pelo uso de suas instalações.
REFERÊNCIAS 1. Yamashita, M.; Fenn, J. B.; J. Phys. Chem. 1984, 88, 4451. [Crossref] 2. Alberici, R. M.; Simas, R. C.; Sanvido, G. B.; Romão, W.; Lalli, P. M.; Benassi, M.; Cunha, I. B. S.; Eberlin, M. N.; Anal. Bioanal. Chem. 2010, 398, 265. [Crossref] 3. Desiderio, D. M.; Nibbering, N. M.; Kraj, A. Em Mass Spectrometry: Instrumentation, Interpretation, and Applications; Ekman, R.; Silberring, J.; Brinkmalm, A. W.; Kraj, A., eds.; John Wiley & Sons: New Jersey, 2008. 4. Cooks, R. G.; Ouyang, Z.; Takats, Z.; Wiseman, J. M.; Science 2006, 311, 1566. [Crossref] 5. Takáts, Z.; Wiseman, J. M.; Gologan, B.; Cooks, R. G.; Science 2004, 306, 471. [Crossref] 6. Cody, R. B.; Larame, J. A.; Anal. Chem. 2005, 77, 2297. [Crossref] 7. Hoffmann, E.; Stroobant, V.; Mass Spectrometry - Principles and Applications, 3rd ed.; John Wiley & Sons Ltd: England, 2007. 8. Huang, M.; Yuan, C.; Cheng, S.; Cho, Y.; Shiea, J.; Annu. Rev. Anal. Chem. 2010, 3, 43. [Crossref] 9. Huang, M.; Cheng, S.; Cho, Y.; Shiea, J.; Anal. Chim. Acta 2011, 702, 1. [Crossref] 10. Feider, C. L.; Krieger, A.; Dehoog, R. J.; Eberlin, L. S.; Anal. Chem. 2019, 91, 4266. [Crossref] 11. Chen, R.; Deng, J.; Fang, L.; Yao, Y.; Chen, B.; Wang, X.; Luan, T.; Trends Environ. Anal. Chem. 2017, 15, 1. [Crossref] 12. Li, X.; Ma, W.; Li, H.; Ai, W.; Bai, Y.; Liu, H.; Anal. Bioanal. Chem. 2018, 410, 715. [Crossref] 13. Chen, H.; Venter, A.; Cooks, R. G.; Chem. Commun. 2006, 19, 2042. [Crossref] 14. Hiraoka, K.; Nishidate, K.; Mor, K.; Asakawa, D.; Suzuki, S.; Rapid Commun. Mass Spectrom. 2007, 21, 3139. [Crossref] 15. Haddad, R.; Sparrapan, R.; Kotiaho, T.; Eberlin, M. N.; Anal. Chem. 2008, 80, 898. [Crossref] 16. Liu, J.; Wang, H.; Manicke, N. E.; Lin, J. M.; Cooks, R. G.; Ouyang, Z.; Anal. Chem. 2010, 82, 2463. [Crossref] 17. McEwen, C. N.; McKay, R. G.; Larsen, B. S.; Anal. Chem. 2005, 77, 7826. [Crossref] 18. Takáts, Z.; Cotte-Rodriguez, I.; Talaty, N.; Chen, H.; Cooks, R. G.; Chem. Commun. 2005, 15, 1950. [Crossref] 19. Na, N.; Zhao, M.; Zhang, S.; Yang, C.; Zhang, X.; J. Am. Soc. Mass Spectrom. 2007, 18, 1859. [Crossref] 20. Nemes, P.; Vertes, A.; Methods Mol. Biol. 2010, 656, 159. [Crossref] 21. Cody, R. B.; New Developments in Mass Spectrometry: Preface, vol. 25, 1st ed.; Royal Society of Chemistry: Cambridge, 2015. 22. Chen, H.; Gamez, G.; Zenobi, R.; J. Am. Soc. Mass Spectrom. 2009, 20, 1947. [Crossref] 23. Badu-Tawiah, A. K.; Eberlin, L. S.; Ouyang, Z.; Cooks, R. G.; Annu. Rev. Phys. Chem. 2013, 64, 481. [Crossref] 24. Klamp, C. W.; Himmelsbach, M.; Anal. Chim. Acta 2015, 890, 44. [Crossref] 25. Liu, J.; Wang, H.; Cooks, R. G.; Ouyang, Z.; Anal. Chem. 2011, 83, 7608. [Crossref] 26. Kerian, K. S.; Jarmusch, A. K.; Cooks, R. G.; Analyst 2014, 139, 2714. [Crossref] 27. Correa, D. N.; Santos, J. M.; Eberlin, L. S.; Eberlin, M. N.; Teunissen, S. F.; Anal. Chem. 2016, 88, 2515. [Crossref] 28. Musah, R. A.; Domin, M. A.; Walling, M. A.; Shepard, J. R. E.; Rapid Commun. Mass Spectrom. 2012, 26, 1109. [Crossref] 29. Leuthold, L. A.; Fathi, M.; Giroud, C.; Augsburger, M.; Varesio, E.; Rapid Commun. Mass Spectrom. 2006, 20, 103. [Crossref] 30. Kauppila, T. J.; Flink, A.; Haapala, M.; Laakkonen, U.; Aalberg, L.; Ketola, R. A.; Kostiainen, R.; Forensic Sci. Int. 2011, 210, 206. [Crossref] 31. Suni, N. M.; Lindfors, P.; Laine, O.; Östman, P.; Ojanperä, I.; Kotiaho, T.; Kauppila, T. J.; Kostiainen, R.; Anal. Chim. Acta 2011, 699, 73. [Crossref] 32. Sabino, B. D.; Romão, W.; Sodré, M. L.; Correa, D. N.; Pinto, D. B. R.; Alonso, F. O. M.; Eberlin, M. N.; Am. J. Anal. Chem. 2011, 2011, 658. [Crossref] 33. Domingos, E.; de Carvalho, T. C.; Pereira, I.; Vasconcelos, G. A.; Thompson, C. J.; Augusti, R.; Rodrigues, R. R. T.; Tose, L. V.; Santos, H.; Araujo, J. R.; Vaz, B. G.; Romão, W.; Anal. Methods 2017, 9, 4400. [Crossref] 34. Fedick, P. W.; Bills, B. J.; Manicke, N. E.; Cooks, R. G.; Anal. Chem. 2017, 89, 10973. [Crossref] 35. Pereira, I.; Rodrigues, S. R. M.; de Carvalho, T. C.; Carvalho, V. V.; Lobón, G. S.; Bassane, J. F. P.; Domingos, E.; Romão, W.; Augusti, R.; Vaz, B. G.; Anal. Methods 2016, 8, 6023. [Crossref] 36. Teodoro, J. A. R.; Pereira, H. V.; Sena, M. M.; Piccin, E.; Zacca, J. J.; Augusti, R.; Food Chem. 2017, 237, 1058. [Crossref] 37. de Paula, C. C. A.; Lordeiro, R. A.; Piccin, E.; Augusti, R.; Anal. Methods 2015, 7, 9145. [Crossref] 38. Santos, H.; Lima, A. S.; Mazega, A.; Domingos, E.; Thompson, C. J.; Maldaner, A. O.; Filgueiras, P. R.; Vaz, B. G.; Romão, W.; Anal. Methods 2017, 9, 3662. [Crossref] 39. de Carvalho, T. C.; Tosato, F.; Souza, L. M.; Santos, H.; Merlo, B. B.; Ortiz, R. S.; Rodrigues, R. R. T.; Filgueiras, P. R.; Augusti, R.; Roma, W.; Franc, H. S.; Forensic Sci. Int. 2016, 262, 56. [Crossref] 40. Wang, H.; Liu, J.; Cooks, R. G.; Ouyang, Z.; Angew. Chem., Int. Ed. 2010, 49, 877. [Crossref] 41. Espy, R. D.; Manicke, N. E.; Ouyang, Z.; Cooks, R. G.; Analyst 2012, 10, 2344. [Crossref] 42. Jett, R.; Skaggsa, C.; Manicke, N. E.; Anal. Methods 2017, 9, 5037. [Crossref] 43. Mckenna, J.; Jett, R.; Shanks, K.; Manicke, N. E.; J. Anal. Toxicol. 2018, 42, 300. [Crossref] 44. Wang, H.; Ren, Y.; McLuckey, M. N.; Manicke, N. E.; Park, J.; Zheng, L.; Shi, R.; Cooks, R. G.; Ouyang, Z.; Anal. Chem. 2013, 85, 11540. [Crossref] 45. Zhang, C.; Manicke, N. E.; Anal. Chem. 2015, 87, 6212. [Crossref] 46. Michely, J. A.; Meyer, M. R.; Maurer, H. H.; Anal. Chem. 2017, 89, 11779. [Crossref] 47. Quiroz-Moreno, C. D.; Prata, P. S.; de Almeida, J. R.; Cevallos, A. S.; Augusto, F.; J. Anal. Methods Chem. 2018, 2018, 1. [Crossref] 48. Espy, R. D.; Teunissen, S. F.; Manicke, N. E.; Ren, Y.; Ouyang, Z.; Van Asten, A.; Cooks, R. G.; Anal. Chem. 2014, 86, 7712. [Crossref] 49. Teunissen, S. F.; Fedick, P. W.; Berendsen, B. J. A.; Nielen, M. W. F.; Eberlin, M. N.; Cooks, R. G.; Van Asten, A. C.; J. Am. Soc. Mass Spectrom. 2017, 28, 2665. [Crossref] 50. Yang, Y.; Wu, J.; Deng, J.; Yuan, K.; Chen, X.; Liu, N.; Wang, X.; Luan, T.; Anal. Chim. Acta 2018, 1032, 75. [Crossref] 51. Kennedy, J. H.; Palaty, J.; Gill, C. G.; Wiseman, J. M.; Rapid Commun. Mass Spectrom. 2018, 32, 1280. [Crossref] 52. Yang, Q.; Wang, H.; Maas, J. D.; Chappell, W. J.; Manicke, N. E.; Cooks, R. G.; Ouyang, Z.; Int. J. Mass Spectrom. 2012, 312, 201. [Crossref] 53. Ren, Y.; Wang, H.; Liu, J.; Chromatographia 2013, 76, 1339. [Crossref] 54. Su, Y.; Wang, H.; Liu, J.; Wei, P.; Cooks, R. G.; Ouyang, Z.; Analyst 2013, 138, 4443. [Crossref] 55. Damon, D. E.; Davis, K. M.; Moreira, C. R.; Capone, P.; Cruttenden, R.; Badu-Tawiah, A. K.; Anal. Chem. 2016, 88, 1878. [Crossref] 56. Tavares, L. S.; Carvalho, T. C.; Romão, W.; Vaz, B. G.; Chaves, A. R.; J. Am. Soc. Mass Spectrom. 2018, 29, 566. [Crossref] 57. Dulay, M. T.; Zare, R. N.; Rapid Commun. Mass Spectrom. 2017, 31, 1651. [Crossref] 58. So, P. K.; Ng, T. T.; Wang, H.; Hu, B.; Yao, Z. P.; Analyst 2013, 138, 2239. [Crossref] 59. Ng, T.; So, P.; Hu, B.; Yao, Z.; J. Food Drug Anal. 2018, 27, 428. [Crossref] 60. Hu, B.; So, P. K.; Yang, Y.; Deng, J.; Choi, Y. C.; Luan, T.; Yao, Z. P.; Anal. Chem. 2018, 90, 1759. [Crossref] 61. Wu, M.; Wang, H.; Zhang, J.; Guo, Y.; Anal. Chem. 2016, 88, 9547. [Crossref] 62. Romão, W.; Borges, K. B.; Anal. Methods 2019, 11, 3388. [Crossref] 63. Ji, J.; Nie, L.; Liao, L.; Du, R.; Liu, B.; Yang, P.; J. Chromatogr. B: Anal. Technol. Biomed. Life Sci. 2016, 1015-1016, 142. [Crossref] 64. Zargar, T.; Khayamian, T.; Jafari, M. T.; Microchim. Acta 2018, 185, 1. [Crossref] 65. Jackson, S.; Swiner, D. J.; Capone, P. C.; Badu-Tawiah, A. K.; Anal. Chim. Acta 2018, 1023, 81. [Crossref] 66. Swiner, D. J.; Jackson, S.; Iii, G. R. D.; Walsh, B. K.; Kouatli, Y.; Badu-Tawiah, A. K.; Anal. Chim. Acta 2019, 1082, 98. [Crossref] 67. Jackson, S.; Frey, B. S.; Bates, M. N.; Swiner, D. J.; Badu-Tawiah, A. K.; Analyst 2020, 145, 5615. [Crossref] 68. Chen, L.; Cabot, J. M.; Rodriguez, E. S.; Ghiasvand, A.; Innis, P. C.; Paull, B.; Analyst 2020, 145, 6928. [Crossref] 69. Chen, L.; Ghiasvand, A.; Lam, S. C.; Rodriguez, E. S.; Innis, P. C.; Paull, B.; Anal. Chim. Acta 2022, 1193, 338810. [Crossref] 70. Alfaro, C. M.; Jarmusch, A. K.; Pirro, V.; Kerian, K. S.; Masterson, T. A.; Cheng, L.; Cooks, R. G.; Anal. Bioanal. Chem. 2016, 408, 5407. [Crossref] 71. Kerian, K. S.; Jarmusch, A. K.; Pirro, V.; Koch, M. O.; Masterson, T. A.; Cheng, L.; Cooks, R. G.; Analyst 2015, 140, 1090. [Crossref] 72. Jarmusch, A. K.; Pirro, V.; Kerian, K. S.; Cooks, R. G.; Analyst 2014, 139, 4785. [Crossref] 73. Yang, B.; Wang, F.; Yang, X.; Zou, W.; Wang, J.; Zou, Y.; Liu, F.; Liu, H.; Huang, O.; J. Mass Spectrom. 2016, 51, 1237. [Crossref] 74. Cohen-Gadol, A. A.; Hattab, M.; Cooks, R. G.; Analyst 2017, 142, 4058. [Crossref] 75. Jarmusch, A. K.; Pirro, V.; Logsdon, D. L.; Cooks, R. G.; Talanta 2018, 184, 356. [Crossref] 76. Pirro, V.; Jarmusch, A. K.; Vincenti, M.; Cooks, R. G.; Anal. Chim. Acta 2015, 861, 47. [Crossref] 77. Fedick, P. W.; Bain, R. M.; Forensic Chem. 2017, 5, 53. [Crossref] 78. Yang, Y.; Deng, J.; Yao, Z.; J. Am. Soc. Mass Spectrom. 2014, 25, 37. [Crossref] 79. Morato, M.; Pirro, V.; Fedick, P. W.; Cooks, R. G.; Anal. Chem. 2019, 91, 7450. [Crossref] 80. Freitas, L. A. S.; Vieira, A. C.; Mendonça, J. A. F. R.; Figueiredo, E. C.; Analyst 2014, 139, 626. [Crossref] 81. Szultka, M.; Szeliga, J.; Jackowski, M.; Anal. Bioanal. Chem. 2012, 403, 785. [Crossref] 82. van Pinxteren, D.; Teich, M.; Herrmann, H.; J. Chromatogr. A 2012, 1267, 178. [Crossref] 83. Wang, T.; Zheng, Y.; Wang, X.; Austin, D. E.; Zhang, Z.; Anal. Chem. 2017, 89, 7988. [Crossref] 84. Li, J.; Zheng, Y.; Mi, W.; Muyizere, T.; Zhang, Z.; Anal. Methods 2018, 10, 2803. [Crossref] 85. Wang, J.; Lai, P.; Liou, Y.; Chen, C.; Lin, C.; J. Chromatogr. Sep. Tech. 2015, 6, 1. [Crossref] 86. Liou, Y.; Wang, J.; Chen, C.; Lin, C.; Int. J. Mass Spectrom. 2017, 421, 178. [Crossref] 87. Fenn, J. B.; US pat. 6,297,499 B1 2001. 88. Tepper, G.; Kessick, R.; Appl. Phys. Lett. 2009, 94, 084106. [Crossref] 89. Liou, Y. W.; Wang, S. H.; Hsu, C. H.; Hsu, Y. T.; Chen, C. H.; Chen, C. C.; Lin, C. H.; Int. J. Mass Spectrom. 2018, 430, 104. [Crossref] 90. Allochio Filho, J. F.; dos Santos N. A.; Borges, K. B.; Lacerda Junior, V.; Pelição, F. S.; Romão, W.; Rapid Commun. Mass Spectrom. 2020, 34, e8747. [Crossref] 91. Cunha, R. L.; Lopes, W. A.; Pereira, P. A. P.; Microchem. J. 2016, 125, 230. [Crossref] 92. Kim, J.; Sim, Y. E.; Kim, J. Y.; Anal. Sci. Technol. 2020, 33, 23. [Crossref] 93. Kusano, M.; Sakamoto, Y.; Natori, Y.; Miyagawa, H.; Tsuchihashi, H.; Ishii, A.; Zaitsu, K.; Forensic Sci. Int. 2019, 300, 125. [Crossref] 94. Di Trana, A.; Mannocchi, G.; Pirani, F.; La Maida, N.; Gottardi, M.; Pichini, S.; Busardò, F. P.; J. Anal. Toxicol. 2020, 44, 769. [Crossref] 95. de Oliveira, S. C. W. S. E. F.; Zucoloto, A. D.; de Oliveira, C. D. R.; Hernandez, E. M. M.; Fruchtengarten, L. V. G.; de Oliveira, T. F.; Yonamine, M.; J. Mass Spectrom. 2019, 54, 600. [Crossref] 96. Calò, L.; Anzillotti, L.; Maccari, C.; Cecchi, R.; Andreoli, R.; Front. Chem. 2020, 8, 1. [Crossref] |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access





