Artigo
|
|
| Caracterização físico-química dos méis e polens das abelhas sem ferrão das espécies Melipona flavolineata e Melipona fasciculata Physico-chemical characterization of honeys and pollens of stingless bees of the species Melipona flavolineata and Melipona fasciculata |
|
Emily Vitória dos Santos Oliveira; Giovana Kathelly Costa Vasconcelos; Josyane Brasil da Silva; Elen Vanessa Costa da Silva
Departamento de Tecnologia de Alimentos, Universidade do Estado do Pará, 66095-100 Belém, PA - Brasil Recebido em 13/03/2023 *e-mail: elen.vanessa@uepa.br This study aimed to analyze the physicochemical characteristics of honey and pollen of two different species of stingless bees Melipona flavolineata and Melipona fasciculata from different regions in the State of Pará, the two totally different localities, Mosqueiro Island and Castanhal municipality, different climate and vegetation directly influence the quality and characteristics of these raw materials. The honey and pollen samples were collected and stored in hermetically sealed pots, the honey was kept at room temperature and the pollen at a freezing temperature of −12 °C to −15 °C, the analyzes were carried out in the laboratory of the Universidade do Estado do Pará - Campus Castanhal. For physicochemical characterization of honey, moisture, acidity, pH, ash, insoluble solids, HMF reducing sugar, total and apparent sucrose, HMF and color were performed. For the physicochemical characterization of the pollen, moisture, ash, protein, acidity, reducing and total sugars were analyzed. Regarding the honey collected in the meliponario of the municipality of Castanhal, they obtained different results from the honey collected in Mosqueiro, even being of the same species. In the pollen collected from the stingless bees of the meliponario located on the island of Mosqueiro, there were high levels of lipids, the results of proteins obtained from the pollen of Castanhal were high, unlike the pollen of the island of Mosqueiro. INTRODUÇÃO A diversidade de flora e biomas do Brasil e a grande variedade de espécies de abelhas sem ferrão existente conferem um enorme potencial para produção e valorização de méis produzidos por essas abelhas. Além da importância econômica para os produtores, esse produto possui características sensoriais diferenciadas dos méis tradicionalmente consumidos no Brasil, tornando-o um produto com alto valor agregado.1 As abelhas sem ferrão possuem como principal produto o mel e o pólen. O mel é considerado um fluido viscoso, aromático e doce elaborado por abelhas a partir do néctar e/ou exsudatos sacarínicos de plantas, principalmente de origens florais, os quais, depois são colocados em potes para sua alimentação. É um produto que tem apresentado uma demanda crescente de mercado, entretanto estudos sobre as características físico-químicas que auxiliem na definição de padrões de qualidade para sua comercialização ainda são escassos na região. Portanto, é de fundamental importância a caracterização de méis principalmente nas regiões tropicais, onde a flora apícola é bastante diversificada, associada às taxas elevadas de umidade e temperatura.2 O tipo de pólen mais estudado no mundo é aquele coletado pela espécie Apis mellifera, e pouco é conhecido sobre a composição química do pólen coletado pelas abelhas sem ferrão. Nesse sentido, saber seus componentes é importante para caracterizar os produtos obtidos de diferentes regiões, climas, e espécies de abelhas, para ter um melhor controle de qualidade, e incentivar a criação de abelhas sem ferrão para extração comercial de seus produtos.3 O trabalho objetivou analisar as características físico-químicas do mel e pólen das abelhas sem ferrão M. flavolineata e M. fasciculata de diferentes lugares e épocas do ano, em um meliponário situado em Castanhal e de um meliponário situado na ilha de Mosqueiro. Meliponicultura vs. apicultura A produtividade de mel das abelhas sem ferrão é inferior a das abelhas africanizadas, porém, obtém melhor preço no mercado por possuir características únicas e diferenciadas como aroma, sabor e por se tratar de um produto especial, orgânico e raro. Cerca de 70 espécies de meliponídeos poderiam ser criadas para uso em polinização ou para produção de mel, que por não terem ferrão, têm a vantagem de serem manuseadas por crianças e pessoas alérgicas ao veneno da Apis mellifera e ainda sem o uso de roupas especiais, diminuindo seu custo. Por essas características, a meliponicultura pode ser utilizada como ferramenta de conservação e restauração de áreas naturais. É uma prática econômica que permite a convivência de pessoas e unidades de conservação, por exemplo, o que colabora para a construção de um novo modelo de desenvolvimento compatível com a proteção da biodiversidade.4 O mel das abelhas sem ferrão pode deteriorar-se mais rapidamente que o mel Apis mellifera devido ao seu menor nível de doçura e maior teor de umidade. Esses são critérios-chave para fatores como: a determinação dos melhores processos em termos de conservação e armazenamento; a prevenção da fermentação ou cristalização; e o controle de aumentos de atividade de água para valores em que certos fungos filamentosos como Penicillium e Mucor poderiam crescer em sua superfície.5 Este mel requer maiores níveis de cuidado durante a colheita e precisa ser refrigerado, pasteurizado ou submetido a desumidificação para garantir sua durabilidade. Se for refrigerado ao longo do tempo, a cristalização pode ocorrer. Os processos de pasteurização e desumidificação reduzem o teor de água, mas podem ser responsáveis pela perda de aromas e sabores no mel.6 Abelhas indígenas sem ferrão ocorrem praticamente em todos os tipos de habitats, possuindo muitas espécies com hábitos de nidificação variados e consequentemente com grande variabilidade na sua biologia. Essa diversidade permite que a meliponicultura seja desenvolvida em diversos biomas com as respectivas abelhas locais. Porém, na Amazônia, por exemplo, existem centenas de espécies diferentes de meliponídeos, mas nem todas produzem mel em quantidade suficiente que compense sua criação com o propósito de geração de renda para seus criadores.4 Comparada a outras atividades agropecuárias, a apicultura necessita de baixo custo inicial de implantação e de manutenção. A apicultura é uma atividade da pecuária que tem destaque por trazer benefícios sociais, econômicos e ecológicos. Em todo o país milhares de empregos são gerados com manejo das abelhas, fabricação e comércio de equipamentos, processamento dos produtos e polinização de culturas agrícolas.7 Entretanto, para obtenção do sucesso na apicultura, um dos fatores de maior relevância para os produtores é a capacitação, para a obtenção de informações técnicas e novas tecnologias no âmbito da atividade. Através do fornecimento de técnicas de manejo básicas para os apicultores, há uma tendência de aumento na produtividade, otimizando os recursos naturais disponíveis. A partir dessa inserção, a atividade torna-se ainda mais vantajosa, conciliada com a preservação ambiental, ocasionando na produção sustentável uma alternativa para os agricultores familiares.8,9
PARTE EXPERIMENTAL Materiais e métodos Coleta da amostra de mel e pólen O mel e pólen da espécie Melipona fasciculata e Melipona flavolineata foram adquiridos no meliponário da Universidade do Estado do Pará, localizado nas dependências da empresa privada em Castanhal, PA e também na ilha de Mosqueiro, PA, em uma propriedade privada de uma produtora da região. A coleta de 4 amostras foi realizada nos períodos em que os potes tinham mel e pólen disponíveis. O mel das duas espécies Melipona fasciculata e Melipona flavolineata foi colhido furando os potes existentes na melgueira e utilizando a seringa para coleta. As amostras de mel foram colocadas em frascos estéreis e armazenadas em temperatura ambiente no período de 24 horas até o início das análises no dia seguinte.

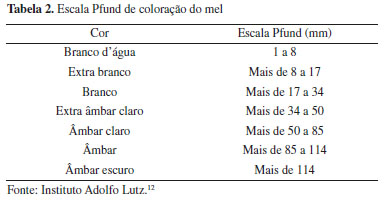
As amostras de pólen foram coletadas de potes diretamente na colônia, utilizando espátula e posteriormente, acondicionadas em potes hermeticamente fechados e transportadas para o laboratório da Universidade do Estado do Pará, onde ficaram armazenadas na temperatura de congelamento entre −12 °C a −15 °C , no período de 24 horas a 48 horas antes da análise. As análises foram realizadas no Laboratório de Alimentos localizado nas dependências da Universidade do Estado do Pará (UEPA). Caracterização físico-química do mel Umidade Determinada com auxílio de um refratômetro.10 Cinzas 2 g das amostras foram primeiramente carbonizadas lentamente, em seguida levadas à mufla, modelo 318M25T, marca QUIMIS, aquecida a 550 ºC. Após cinco horas de incineração, as amostras foram resfriadas em dessecador e pesadas.11 Sólidos insolúveis Pesou-se 20 g de mel que foram diluídos com uma mínima quantidade de água aquecida a 80 ºC. Filtrou-se a amostra em papel de filtro previamente seco em estufa a 105 ºC por 1 hora. Após este procedimento, o papel de filtro foi lavado com água destilada até ausência de açúcares, depois levado para estufa a 135 ºC durante 1 hora, para posterior pesagem, método por gravimetria.11 Acidez Determinada pelo método baseado em volumetria de neutralização. Pesou-se 5 g de amostra e adicionou-se 75 mL de água e 2 gotas de fenolftaleína. Titulou-se com hidróxido de sódio (NaOH) 0,01 N até aparecimento da coloração levemente rósea.12 pH Utilizou-se pHmetro, calibrado regularmente com soluções tampões pH 4,0 e 7,0.13 Açúcares redutores Foi preparada uma solução de mel (5 g de mel + 100 mL de H2O), posteriormente diluiu-se 10 mL desta solução para 100 mL de água. Titulou-se com uma solução contendo 5 mL de solução de Fehling A (34,639 g de sulfato de cobre pentahidratado + 1000 mL de H2O), 5 mL de solução de Fehling B (173 g tartarato duplo de sódio e potássio + 50 g de hidróxido de sódio + 1000 mL H2O), 40 mL de água, a titulação foi realizada na chapa aquecedora, iniciou-se a processo de titulação, quando a solução contendo Fehling A e B começou a ebulir.12 O teor de açúcar redutor foi calculado pela Equação (1): 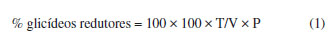 T: fator de correção da solução de Fehling; V: mL de amostra gasta na titulação; P: peso da amostra em gramas na solução. Açúcar total Pipetou-se 25 mL da solução de mel obtida na determinação de açúcares redutores para um balão volumétrico de 100 mL e adicionou-se 25 mL de água. Foi adicionado 1 mL de solução de ácido clorídrico e posteriormente aquecido a 65 ºC em banho-maria por 30 minutos. O frasco foi removido do banho e deixado em repouso para a solução resfriar naturalmente até a temperatura ambiente. Neutralizou-se com solução de hidróxido de sódio, usando papel indicador de pH. Completou-se o volume com água.12 Para o cálculo da sacarose foi utilizada a Equação (2): 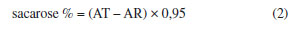 AT: açúcar total; AR: açúcar redutor. Hidroximetilfurfural Pesou-se 5 g da amostra e adicionou-se 25 mL de água e transferiu-se para balão volumétrico de 50 mL. Posteriormente foi adicionado 0,5 mL de solução de Carrez 1 (15 g K4Fe(CN)6.3H2O + 100 mL de H2O) e 0,5 mL de solução de Carrez 2 (30 g Zn(OAc)2.2H2O + 100 mL de H2O) e misturou-se. A amostra foi filtrada e os primeiros 10 mL descartados. Pipetou-se 5 mL do filtrado em dois tubos de ensaio. No primeiro tubo adicionou-se 5 mL de água e no segundo 5 mL de bissulfito de sódio (0,2%), como referência. Foi medida a absorbância da amostra, utilizando espectrofotômetro nos comprimentos de onda de 284 e 336 nm.10 Para o cálculo do hidroximetilfurfural (HMF), utilizou-se a seguinte Equação (3): 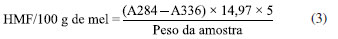 Fator: 14,97 = (126/16,830) (1000/10) (100/5); onde: 126 = peso molecular do HMF; 16,830 = absortividade molecular do HMF a 284 nm; 1000 = mg g-1; 10 = centilitros L-1; 100 = porcentagem de HMF; 5 = peso teórico da amostra. Cor Por espectrofotômetro a 560 nm, em célula de 1 cm, usando-se como branco a glicerina pura. Os valores foram analisados com base na escala de Pfund.12
Caracterização físico-química do pólen Umidade Foi realizada através de método gravimétrico, submetendo a amostra em estufa com circulação e renovação de ar a temperatura de 105 °C, até a obtenção de peso constante.12 Cinzas Para a determinação de cinzas a amostra foi carbonizada até cessar a liberação de fumaça e, posteriormente calcinada em mufla a 550 °C até a obtenção de peso constante.12 Lipídios O teor de gordura foi obtido pelo método de extração direta, através do extrator tipo Soxhlet, utilizando n-hexano como solvente.12 Proteínas A análise proteica foi baseada na determinação de nitrogênio total e foi conduzida de acordo com o método de digestão micro-Kjeldahl, onde o nitrogênio existente é transformado em amônia, utilizando o fator empírico 6,25.12 Acidez Foi realizada em uma amostra de 5 g de pólen em 50 mL de água adicionando 4 gotas de solução de fenolftaleína e posterior titulação com solução de hidróxido de sódio 0,1 mol L-1 até coloração rosa.12 Açúcares redutores e totais Foram feitos através do método titulométrico com soluções de Fehling A e B.12
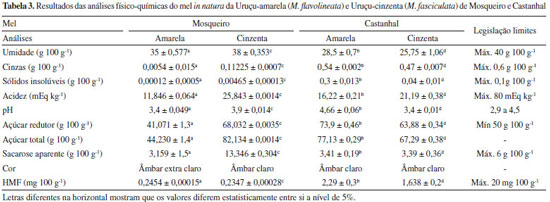
RESULTADOS E DISCUSSÃO Na Tabela 3 encontram-se os resultados das análises físico-químicas dos méis da Uruçu-amarela (M. flavolineata) e Uruçu-cinzenta (M. fasciculata) de Mosqueiro e Castanhal.
Analisando amostras de méis de meliponídeos de ambos os lugares, constatou-se que os valores obtidos em umidade, cinzas, acidez, açúcar redutor, açúcar total e HMF encontram-se dentro dos padrões de identidade e qualidade do mel de Abelhas Nativas sem Ferrão. Como podemos observar na Tabela 2, nota-se que os resultados das amostras Castanhal e Mosqueiro estão dentro dos parâmetros estabelecidos pela legislação dos padrões de identidade e qualidade do mel de Abelhas Nativas sem Ferrão, no máximo de 40 g 100 g-1 para umidade, um fator relevante para ser considerado são os períodos de coletas das amostras, os méis de Castanhal apresentaram valores de umidade menores: M. flavolineata 28,5% e M. fasciculata 25,75%, enquanto da ilha de Mosqueiro apresentaram umidade acima de 30%; M. flavolineata e M. fasciculata respectivamente 35 e 38%, os méis de Mosqueiro foram coletados em período chuvoso. O maior valor de umidade no mel das abelhas do meliponídeo de Mosqueiro está relacionado a estação climática, visto que em épocas chuvosas o mel tende a apresentar-se mais úmido e o mesmo foi colhido no primeiro semestre, que foi o período em que houve maior produção de mel disponível para coleta. Em uma estação chuvosa o mel também pode sofrer um processo de fermentação maior se comparado com a estação seca.14 No estudo foram encontrados maiores valores de umidade para o mel coletado na estação chuvosa, a umidade do mel variou de 23,4 a 36,4 g 100 g-1 para Melipona, resultados semelhantes aos que foram encontrados. Outros fatores também interferem na elevada umidade de mel de Meliponas como o ambiente tropical úmido em que o mel é produzido, baixa taxa de desidratação do néctar durante o processo de transformação do mel, o qual é influenciado por condições ambientais tais como umidade relativa do ar, temporada de colheita do mel e outras, como a espécie de abelhas, colheita dos néctares de flores e frutos ricos em água e outros fatores.15 Analisando os valores de sólidos insolúveis (Tabela 3), as espécies de M. flavolineata e M. fasciculata, dos méis de Mosqueiro, apresentaram valores de 0,00012 para M. flavolineata e 0,00465 para M. fasciculata, enquanto os méis de Castanhal apresentaram valores de 0,3 e 0,4, respectivamente. Os resultados das análises de cinzas para o mel de M. flavolineata e M. fasciculata de Castanhal foram de 0,54 e 0,47 respectivamente, em relação ao mel de Mosqueiro para M. flavolineata foi de 0,0054 e M. fasciculata 0,11225, somente a amostra de Castanhal da espécie M. flavolineata não se encontrou dentro dos parâmetros da legislação para o mel de abelha sem ferrão. Essas análises identificam a pureza e qualidade do produto, durante a coleta e o processamento, pois podem ainda estar presentes nesse mel pequenas partículas de solos, cerumes e vegetais coletados pelas abelhas. Os valores de pH para o mel de Mosquiero foram de 3,4 para M. flavolineata e 3,9 para M. fasciculata e acidez foram respectivamente de 11,846 e 25,843. No mel de Castanhal os valores de pH foram de 4,66 para M. flavolineata e 3,4 para a M. fasciculata, enquanto a acidez foi de 16,22 e 21,19, respectivamente, encontrando-se dentro dos padrões da Legislação do Brasil, com exceção do pH na amostra de Castanhal (M. flavolineata). Tanto o pH quanto a acidez livre são fatores que regem a qualidade do produto, pois esses parâmetros podem indicar a deterioração do mel. O baixo pH inibe o crescimento microbiano, entretanto, acidez maior do que 50 mEq kg-1 pode indicar a fermentação de açúcares em ácidos orgânicos16 ocorrendo a formação de ácido acético, enquanto a produção do ácido glucônico é devido a conversão da glicose pela ação da enzima glicose oxidase.17 Observa-se que o mel com maior teor de umidade (Uruçu cinzenta - Mosqueiro) apresentou-se mais ácido, corroborando a afirmação que a enzima glicose-oxidase possui maior ação em méis mais líquidos, consequentemente acidificando mais rapidamente. Autores encontraram pH de ASF (abelha sem ferrão (Meliponas)) de diferentes regiões, para abelha Melipona subnitida D. de 3,1 ± 0,2 e 5,3 ± 0,4 e valores de acidez livre para méis de meliponíneos dentro da faixa de 6,83 a 48,58 mEq kg-1.9 Os teores de açúcares redutores do mel da região Mosqueiro apresentaram valores de 41,07 e 68,032, respectivamente para as espécies de M. flavolineata e M. fasciculata. Para o mel de Castanhal esses valores foram de 73,9 para M. flavolineata e 63,88 para M. fasciculata.
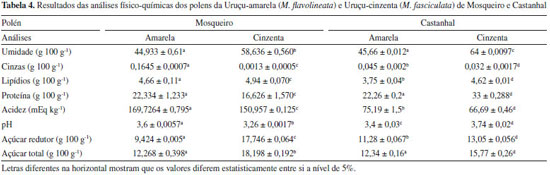
A composição do açúcar depende principalmente da natureza botânica do mel, origem geográfica e clima.18 Teores de açúcares redutores podem chegar a corresponder cerca de 80% da quantidade total.19 Os teores de açúcares redutores para as amostras de mel de abelhas sem ferrão variaram de 53,0 e 70,7%.20 Em relação aos açucares totais para os méis de Melipona da região de Mosqueiro obtiveram-se valores médios de 44,230 e 82,134 (Tabela 3). E para Melipona de Castanhal valores médios 77,13 e 67,29 (Tabela 3). Estudo com amostras de mel de Melipona constataram valores de açúcares totais variando de 50,63 a 59,60%.21 e teor médio geral para açúcares totais de 59,74%, com uma variação entre 50,42 a 68,03%.21 Os valores de sacarose dos méis de Castanhal se encontraram dentro do parâmetro para legislação de abelhas sem ferrão com máximo 6 g 100 g-1, tais valores foram de 3,41 para M. flavolineata e 3,39 para M. fasciculata. No entanto o mel do meliponídeo situado na ilha de Mosqueiro apresentou valor de 13,346 ± 0,304 para M. fasciculata. O teor elevado de sacarose pode ser indicativo, na maioria das vezes, de uma colheita prematura (onde o mel não está totalmente maduro) e o período do ano em que esse mel foi coletado, isto é, a sacarose ainda não foi totalmente transformada em glicose e frutose pela ação da inventasse.1 Estudos de sacarose aparente em mel de abelha sem ferrão variaram de 0,95 a 1,95.22 E outros estudos obtiveram valores para sacarose aparente média de 2,14 a 2,99 e que variaram de 1,1 a 4,8%.23 A cor do mel é considerada um parâmetro de qualidade, de preferência e aceitação entre os consumidores, a cor do mel de Mosqueiro foi de âmbar extra claro para Uruçu-amarela e âmbar claro para Uruçu-cinzenta, em relação as cores dos méis de Castanhal ambas apresentaram cor âmbar claro. Os minerais também influenciam diretamente na coloração do mel, apresentando-se em maiores concentrações nos méis escuros quando comparados aos méis claros, como é possível ver pela amostra da espécie Uruçu-amarela da região de Mosqueiro que teve uma quantidade de minerais menor e por consequência uma cor mais clara que as demais amostras devido esse fator.24 Destaca-se que a coloração do mel é influenciada por diversos fatores, sendo eles: origem floral, maturação do mel, variações climáticas ao longo do período do fluxo do néctar, tempo e temperatura em que o mel permanece armazenado em colmeias, presença de elementos químicos, vitaminas B e C, processo de caramelização, produtos de reação de Maillard, teor de flavonoides e ácidos fenólicos e, quanto maior for a concentração desses componentes, mais intensa será a cor do mel.14,25,26 Os resultados indicaram a presença de HMF abaixo dos valores permitidos pela Legislação Brasileira para todas as amostras, sendo um indicativo que esse mel não foi superaquecido ou teve adulterações por adição de glicose ou açúcar invertido. Estudo relatou concentrações de HMF abaixo de 0,31 mg nas trinta amostras de mel de Melipona em avaliação.27 O HMF se polimeriza com compostos iniciais e forma melanoidinas que é o seu produto final, então é certo dizer que o aumento de açúcares redutores na presença de aminoácidos é o ativador para a reação, visto que ocorre apenas na presença destes compostos, logo os fatores HMF, proteínas, açúcares redutores e cor estão certamente ligados.28 Com isso é possível concluir ainda que, o maior teor de HMF da espécie Uruçu-amarela da região de Castanhal se dá pela maior quantidade de açúcar redutor presente na amostra e o inverso desse ocorreu com a amostra da mesma espécie da região de Mosqueiro, visto que possui menor teor de HMF e açúcares redutores. Como podemos observar na Tabela 2, as amostras de pólen apresentaram valores de umidade fora do padrão quando comparado com a legislação para pólen apícola in natura que é de no máximo 30%. As amostras de Uruçu-amarela de Mosqueiro e Castanhal apresentaram-se estatisticamente iguais entre si. A maior umidade no pólen de melíponas in natura pode estar relacionada às condições climáticas e vegetação. A composição físico-química do pólen pode apresentar variações que estão relacionados a diferentes fatores, como a origem botânica e geográfica,10 condições ambientais, maturidade,29 estado nutricional da planta e o clima da região.30,31 Sua composição varia da espécie floral, condição nutricional da planta, clima e região. Uma explicação plausível para tal condição pode estar relacionado à natureza higroscópica do pólen, pois é um produto suscetível a condições ambientais.31 A alta temperatura ambiente aumenta a temperatura interna da colmeia, o que induz as abelhas a resfriarem as colônias por meio da ventilação e por sua vez provoca mais evaporação o que aumenta a umidade relativa do ambiente da colmeia e pode dificultar a perda de água do pólen armazenado.32 O trabalho teve uma média de umidade de 34,58 g 100 g-1 para a estação chuvosa e 54,54 g 100 g-1 para a estação seca.33 Em outro trabalho é relatado que o valor de umidade no pólen apícola pode variar tanto de acordo com características regionais e ambientais quanto, pelos métodos utilizados para sua determinação.34 Para cinzas, o pólen de Mosqueiro apresentou valores de 0,1645 para M. flavolineata e 0,0013 para M. fasciculata, para o pólen coletado em Castanhal M. flavolineta foi de 0,045 e M. fasciculata foi de 0,032, logo é possível dizer que houve boas práticas de manipulação durante a coleta. O teor total de cinzas está diretamente ligado ao teor de minerais e, portanto, valores baixos de cinzas podem corresponder a níveis mais baixos de minerais na planta.32 Analisando os estudos a cerca desse parâmetro pode-se refutar que o teor de cinzas é bem menor em regiões mais tropicais. Como foi observado nos resultados expressados na Tabela 2, as amostras de pólen coletadas em Mosqueiro, apresentaram valores de lipídios de: M. flavolineata 4,66 e 4,94 para M. fasciculata, já para o pólen coletado em Castanhal, M. flavolineta foi de 3,75 e M. fasciculata foi de 4,62; essa diferença pode estar relacionada a vários fatores, principalmente relacionado a polinização. As abelhas obtêm lipídios exclusivamente do pólen, e a quantidade de lipídios pode variar entre os tipos de pólen.34 Já existem indicativos de que estas abelhas possam ser estratégicas para a polinização de diversas espécies arbóreas de grande interesse econômico e social. Um exemplo importante é o caso da palmeira juçara ou açaizeiro-do-sul.35 O açaizeiro é altamente dependente de polinização cruzada, necessitando de insetos para a formação de seus frutos. A sua polinização é feita principalmente por insetos, destacando-se as abelhas sem ferrão.36 Estudo sobre o polén de abelhas nativas determinou lipídeos do pólen de Melipona subnitida, Melipona sclutellaris e Melipona mandacaia, os valores são expressos respectivamente, lipídeos: 4,21%, 5,99% e 4,29%.14 Em relação aos valores de proteína, todas as amostras se apresentam dentro dos valores estabelecidos pela Legislação Brasileira de no mínimo 8%. O pólen de Mosqueiro apresentou valores de 22,334 para M. flavolineata e 16,626 para M. fasciculata, para o pólen coletado em Castanhal, M. flavolineta foi de 22,26 e M. fasciculata foi de 33. Tais variações de proteína no pólen da abelha sem ferrão podem estar relacionadas a diversidade do pólen das diferentes localidades. A mudança no teor de proteína observada em diferentes estações do ano pode ser influenciada por diferenças na diversidade de pólen.27 Vários outros estudos dizem que a composição química do pólen pode variar dependendo da origem vegetal e geográfica e o conjunto de outros fatores como condições climáticas, estação do ano, tipo de solo e cada tipo de pólen tem suas próprias características específicas relacionadas com a genética das espécies de flores e plantações visitadas pelas abelhas e que podem influenciar nas propriedades biológicas.14,37,38 Estudo apresentou valores de proteína bruta ou total (15,98% a 30,27%)3 que é bem semelhante ao resultado obtido para ambas as espécies de ambas regiões que variaram entre 16,626 a 33%, os maiores valores de proteína encontrada foram do município de Castanhal. Os valores de pH e acidez do pólen de Mosqueiro foram de 3,6 para o pH e 169,726 de acidez para M. flavolineata e 3,26 de pH e 150,957 de acidez para M. fasciculata, para o pólen coletado em Castanhal M. flavolineta foi de 3,4 o pH e 75,19 a acidez e M. fasciculata foi de 3,74 o valor de pH e 66,69 a acidez. O baixo valor de pH e alto valor de acidez do pólen dessas abelhas podem ser devido às transformações que ocorreram ao longo do processo de coleta a armazenamento pelas abelhas nos potes. Por esses motivos não se pode utilizar a legislação de pólen apícola para pólen de abelha melípona. O pólen de Apis é obtido por um mecanismo na entrada da colmeia chamado coletor de pólen. O pólen assim retirado é idêntico aos existentes nas flores, não passou por nenhum processo digestivo, ao contrário do pólen encontrado no interior dos potes fechados das abelhas nativas que passaram pelo processo digestivo das abelhas e de microrganismos. As enzimas glicose oxidase transformam a glicose em ácido gliconico, aumentando a acidez e reduzindo o pH.39 Em um estudo foram encontrados resultados médios para espécie de Melipona Tetragonis 110,31 mEq kg-1 e a espécie de Melipona Scaptotrigona xanthotricha 150,957 mEq kg-1 para acidez e de pH 3,47 e 3,42 respectivamente.40 No trabalho, foram analisadas duas espécies M. flavolineata e M. fasciculata encontrando pH de 3,7 e 3,8 respectivamente.41 Com relação aos açúcares total e redutor para as duas espécies e municípios, o pólen da M. favolineata da ilha Mosqueiro apresentou valores médios de açúcar redutor e total, respectivamente, de 9,42 e 12,26 e para o pólen da mesma espécie coletado no município de Castanhal os valores foram de 11,28 para açúcar redutor e 12,24 para açúcar total. Já para a espécie de M. fasciculata os valores de açúcar redutor e total da ilha de Mosqueiro foram: 17,746 e 18,198 respectivamente, enquanto no município de Castanhal para o pólen da mesma espécie esses valores foram respectivamente de 13,05 e 15,77. A variação dos valores de açúcar redutor pode estar principalmente relacionado a origem do pólen coletado por essas abelhas, pois suas características mudam conforme a vegetação presente no ambiente onde ocorre o processo de polinização das abelhas, em Mosqueiro há predominância de açaizeiros, que é uma palmeira de presença assegurada em grande faixa do território paraense, participando da vegetação característica das centenas de ilhas existentes na Bacia Amazônica, bem como nas várzeas dos rios e afluentes que nela desaguam. Ainda que os estudos e experiências sejam iniciais, já existem indicativos de que estas abelhas possam ser estratégicas para a polinização de diversas espécies arbóreas de grande interesse econômico e social. Um exemplo importante é o caso da palmeira juçara ou açaizeiro-do-sul Euterpes edullis.41 Pelo que se pôde constatar, assim como as abelhas conseguem selecionar as espécies vegetais pela composição química e a concentração de açúcares de seu néctar42 o mesmo acontece com o pólen, cujo valor nutritivo as abelhas conseguem diferenciar.43 A presença de açúcares redutores (frutose e glicose) serve como um indicativo de qualidade do pólen. Dado que o uso da frutose na alimentação, em comparação à glicose e à sacarose, resulta em efeito glicêmico reduzido.44 As abelhas coletam pólen de grupos de plantas que são específicos para cada espécie. Sendo assim as variações dos dados das composição físico-química podem ser correlacionadas com a espécie de abelha, grupos específicos de famílias botânicas e podendo ainda está relacionada ao período de coleta pelas mesmas.44 No estudo de polén da espécie de Melipona scutellaris, foi determinada uma média geral de 24,08 para açúcares de pólen de Melipona, com valores de 34,58 g 100 g-1 para o período chuvoso e 14,38 g 100 g-1 para o período seco.31 De acordo com autores,43 encontraram em "samburá" de M. flavolineata e M. fasciculata valores de 14,50% e 18,09% de açúcares, respectivamente.
CONCLUSÕES Os resultados evidenciam que os méis coletados em Mosqueiro apresentaram maiores valores de umidade e pH, e baixos valores de sólidos insolúveis, cinzas e HMF, os altos valores de umidade podem estar diretamente relacionados ao clima da região, assim também como os baixos valores de HMF se relacionam com clima úmido da ilha de Mosqueiro. No pólen coletado das abelhas sem ferrão da ilha de Mosqueiro verificou-se grande influência da vegetação local por meio das análises físico-químicas realizadas principalmente em relação aos lipídeos, foi possível identificar alto teores de lipídeos, o pólen do meliponário de Castanhal teve alto teor de proteínas, diferentemente do pólen do meliponário de Mosqueiro, enquanto o pólen de Castanhal apresentou teores de lipídeos menores, e em relação a umidade foi possível observar valores elevados.
REFERÊNCIAS 1. Sodré, G. G.; Silva, L. C. M.; Moreti, A. C. C. C.; Otsuk, I. P.; Carvalho, C. A. L.; Cienc. Rural 2007, 37, 1139. [Crossref] 2. Santa, B. M. F.; Machado, C. S.; Sodré, G. S.; Silva, F. L.; Carvalho, C. A. L.; Braz. J. Food Technol. 2018, 21, 1. [Crossref] 3. Rebelo, K. S.; Ferreira, A. G.; Carvalho-Zilse, G. A.; Cienc. Rural 2016, 46, 927. [Crossref] 4. Afonso, M. G.: Vantagens e Desvantagens Ecológicas da Meliponicultura para a Conservação da Biodiversidade; Trabalho de Conclusão de Curso, Universidade Federal do Paraná, Paraná, Brasil, 2012. [Link] acessado em junho 2023 5. Gomes, S.; Dias, L. G.; Moreira, L. L.; Rodrigues, P.; Estevinho, L.; Food Chem. Toxicol. 2010, 48, 544. [Crossref] 6. Silva, C. V.: Características Físico-Químicas de Mel de Capixingui e Silvestre da Região de Ortigueira - PR; Trabalho de Conclusão de Curso, Universidade Tecnológica Federal do Paraná, Paraná, Brasil, 2013. [Link] acessado em junho 2023 7. Vargas, T.: Avaliação da Qualidade do Mel Produzido na Região dos Campos Gerais do Paraná; Dissertação de Mestrado, Universidade Estadual de Ponta Grossa, Paraná, Brasil, 2006. [Link] acessado em junho 2023 8. Khan, A. S.; Matos, V. D. D.; Lima, P. V. P. S.; Revista de Economia e Sociologia Rural 2000, 47, 651. [Link] acessado em junho 2023 9. de Sousa, M. N. A.; Bezerra, A. L. D.; Suárez, L. A. B.; Brasil, M. G. F.; Medeiros, A. C.; Maracajá, P. B.; Revista Brasileira de Gestão Ambiental 2019, 13, 1. [Link] acessado em junho 2023 10. AOAC Oficial Methods of Analysis, disponível em: h ttps://law.resource.org/pub/us/cfr/ibr/002/aoac.methods.1.1990.pdf, acessada em junho 2023. 11. CODEX Alimentarius Internacional Food Standards, disponível em: https://www.fao.org/fao-who-codexalimentarius/meetings/archives/en/?s=1989&y=1991, acessada em junho 2023. 12. Instituto Adolfo Lutz; Métodos Químicos e Físicos para Análise de Alimentos, 4ª ed.; Instituto Adolfo Lutz: São Paulo, 2008. [Link] acessado em junho 2023 13. Ministério da Agricultura (MAPA); Instrução Normativa nº 11, de 20 de outubro de 2000. [Link] acessado em junho 2023 14. Karabagias, I. K.; Badeka, A.; Kontakos, S.; Karabournioti, S.; Kontominas, M. G.; Food Chem. 2014, 146, 548. [Crossref] 15. Grando, R. C.: Caracterização Físico-Química e Perfil Sensorial de Méis de Abelhas Nativas, sem Ferrão, Oriundas da Região Centro-Sul do Estado do Paraná, Brasil; Dissertação de Mestrado, Universidade Federal da Fronteira do Sul, Paraná, Brasil, 2018. [Link] acessado em junho 2023 16. Bergamo, G.; Seraglio, S. K. T.; Gonzaga, L. V.; Fett, R.; Costa. A. C. O.; Food Res. Int. 2019, 116, 745. [Crossref] 17. Braghini, F.: Estabilidade de Méis de Abelhas sem Ferrão (Meliponinae spp.) Submetidos a Diferentes Condições Térmicas; Dissertação de Mestrado, Universidade Federal de Santa Catarina, Santa Catarina, Brasil, 2016. [Link] acessado em junho 2023 18. Escuredo, O.; Dobre, I.; Fernandez-Gonz, A. M.; Seijo, M. C.; Food Chem. 2014, 149, 84. [Crossref] 19. Silva, T. M. S.; Camara, C. A.; Lins, A. C. S.; Agra, M. F.; Silva, E. M. S.; Reis, I. T.; Freitas, B. F.; An. Acad. Bras. Cienc. 2009, 81, 173. [Crossref] 20. Oliveira, F.; Freitas, B. T. T. R.; Silva, J. R.; Farias, R. C.; Matos, T. A. L.; Guia Ilustrado das Abelhas "Sem Ferrão"das Reservas Amanã e Mamirauá, edição eletrônica; Amazonas, 2013. [Link] acessado em junho 2023 21. Almeida-Muradian, L. B.; Matsuda, A. H.; Bastos, D. H. M.; Quim. Nova 2007, 30, 707. [Crossref] 22. Parpinelli, R. S.: Qualidade Microbiológica e Caracterização Físico-Química de Amostras de Mel de Abelhas sem Ferrão de Seis Regiões do Estado do Paraná; Tese de Doutorado, Universidade Estadual de Maringá, Paraná, Brasil, 2016. [Link] acessado em junho 2023 23. Souza, B. A.; Roubik, D. W.; Barth, O. M.; Heard, T. A.; Enríquez, E.; Carvalho, C. A. L.; Villas-Bôas, J. K.; Marchini, L. C.; Locatelli, J. C.; Persano-Oddo, L.; Almeida-Muradian, L. B.; Bogdanov, S.; Vit, P.; Interciencia 2006, 31, 867. [Link] acessado em junho 2023 24. Santos, D. C.; Moura Neto, L. G.; Martins, J. N.; Silva, K. F. N. L.; Revista Verde de Agroecologia e Desenvolvimento Sustentável 2009, 4, 21. [Link] acessado em junho 2023 25. Costa, A. C. V.; Sousa, J. M. B.; Silva, M. A. A.; Garruti, D. S.; Madruga, M. S.; Food Res. Int. 2017, 105, 110. [Crossref] 26. Lacerda, J. J. J.; Santos, J. S.; Santos, S. A.; Rodrigues, G. B.; Santos, M. L. P.; Quim. Nova 2010, 33, 1022. [Crossref] 27. Lira, A. F.; Sousa, J. P. L. M.; Lorenzon, M. C. A.; Vianna, C. A. F. J.; Castro, R. N.; Acta Veterinária Brasílica 2014, 8, 169. [Crossref] 28. Biluca, F. C.; Braghini, F.; Gonzaga, L. V.; Costa, A. C. O.; Fett, R.; J. Food Compos. Anal. 2016, 50, 61. [Crossref] 29. Isidorov, V. A.; Bagan, R.; Bakier, S.; Swiecicka, I.; Food Chem. 2015, 171, 84. [Crossref] 30. Estevinho, L. M.; Rodrigues, S.; Pereira, A. P.; Feás, X.; Int. J. Food Sci. Technol. 2012, 47, 429. [Crossref] 31. Monsanto, M. G.: Caracterização de Compostos Fenólicos e de Minerais em Alguns Pólenes Apícolas; Dissertação de Mestrado, Escola Superior Agrária do Instituto Politécnico, Castelo Branco, Portugal, 2013. [Link] acessado em junho 2023 32. Marchini, L. C.; Reis, V. D. A.; Moretti, A. C. C.; Cienc. Rural 2006, 36, 949. [Crossref] 33. Almeida-Anacleto, D.: Recursos Alimentares, Desenvolvimento das Colônias e Características Físico-Químicas, Microbiológicas e Polínicas de Mel e Pólen de Meliponíneos, do Município de Piracicaba, Estado de São Paulo; Tese de Doutorado, Universidade de São Paulo, São Paulo, Brasil, 2007. [Link] acessado em junho 2023 34. Sattler, J. A. G.: Caracterização do Potencial Bioativo do Polén Apícola de Eucalyptus sp. In Vitro e sua Influência sobre Parâmetros de Estresse Oxidativo e de Inflamação In Vivo; Tese de Doutorado, Universidade de São Paulo, São Paulo, Brasil, 2018. [Link] acessado em junho 2023 35. Roulston T. H.; Cane, J. H.; Plant Syst. Evol. 2000, 222, 187. [Crossref] 36. Dorneles, L. L.: Interações entre Euterpe edulis Aart. (Arecaceae) e Insetos Visitantes Florais em Sistema Agroflorestal na Ilha de Santa Catarina; Dissertação de Mestrado, Universidade Federal de Santa Catarina, Santa Catarina, Brasil, 2010. [Link] acessado em junho 2023 37. Venturieri, G. C.; Leon, F. A.; Resumo da II Semana dos Polinizadores: Palestras e Resumos, Petrolina, Brasil, 2012. [Link] acessado em junho 2023 38. Santos, C. S.; Ribeiro, A. S.; Revista Verde de Agroecologia e Desenvolvimento Sustentável 2009, 4, 1. [Link] acessado em junho 2023 39. Cavagnoli, M. L.; Lima, R. L.; Arias, J. L. O.; Berrio, A. C. B.; Kupski, L.; Barbosa, S. C.; Primel, E. G.; Food Chem. 2021, 363, 130175. [Crossref] 40. Brand, H.; Acta Biol. Parana. 2011, 40, 129. [Link] acessado em junho 2023 41. Souza, C. M.; Silva, S. M. P. C.; Nascimento, A. S.; Silva, F. L.; Bagaldo, A. R.; Carvalho, C. A. L.; J. Apic. Res. 2021, 61, 70. [Crossref] 42. Pinheiro, F. D. M.; Costa, C. Y. P.; Baptista, R. D. C.; Venturieri, G. C.; Pontes, M. A. N.; Encontro de Profissionais da Química da Amazônia, Pará, Brasil, 2007. [Link] 43. Kalaycioğlu, Z.; Kaygusuz, H.; Döker, S.; Kolayli, S.; Erim, F. B.; LWT--Food Sci. Technol. 2017, 84, 402. [Crossref] 44. Dorneles, L. L.; Zillikens, A.; Steiner, J.; Padilha, M. T. S.; Iheringia, Ser. Bot. 2013, 68, 47. [Link] acessado em junho 2023 |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access