Revisão
|
|
| Nanocápsulas de núcleo lipídico: preparação, caracterização e aplicações biológicas Lipid-core nanocapsules: preparation, characterization and biological applications |
|
Danieli R. Dallemole; Taiane M. Ciocheta; Luiza A. Frank; Aline de C. S. Alves; Bárbara P. Zoche; Silvia S. Guterres; Karina Paese; Adriana R. Pohlmann*
Faculdade de Farmácia, Universidade Federal do Rio Grande do Sul, 90610-000 Porto Alegre - RS, Brasil Recebido em 01/02/2023 *e-mail: adriana.pohlmann@ufrgs.br Lipid-core nanocapsules (LNCs) are core-shell structures, in which the core is an organogel formed by a solid lipid dispersed in a triglyceride, and the shell is a polymer. Those nanocapsules encapsulate poorly-water soluble drugs by dispersion in the core and/or interaction with the polymer. The core and the shell act as diffusional barriers differenting the LNC from previously developed polymeric nanocapsules containing an oily core and a polymer shell, which unique diffusional barrier is the shell. In this review, we discuss the supramolecular structure, the physico-chemical characterization, including sizing, surface potential, fluorescent labeling strategies, as well as the interfacial reactions in water to coat and functionalise the LNC surface. Different organometallic complexes have been synthesized to decorate the nanocapsules envisaging the treatment of atherosclerosis, cancer, mucopolysaccharidosis I, and hypertension. We also describe the main applications of the nanoformulations in the pharmaceutical, medical, and veterinary fields, including in vitro and in vivo evaluations of toxicity and efficacy. INTRODUÇÃO O desenvolvimento de nanocarreadores de fármacos oferece novas opções para o tratamento de doenças.1 Os nanocarreadores com tamanhos de partículas submicrométricos exibem propriedades únicas relacionadas ao aumento da relação área de superfície-volume, e, portanto, um número significativo de átomos está presente na superfície das nanopartículas, contribuindo para a interação com sistemas biológicos.2 Nas últimas décadas, diferentes tipos de nanocarreadores foram desenvolvidos, incluindo nanopartículas inorgânicas e nanopartículas orgânicas, como dendrímeros, lipossomas, micelas poliméricas e nanopartículas poliméricas.3 As nanopartículas poliméricas foram desenvolvidas como uma alternativa aos lipossomas propostos como carreadores de fármacos.4 Desde então, vários polímeros e outros materiais têm sido utilizados para a preparação de nanoesferas (matriz polimérica) e nanocápsulas (núcleo-casca).5,6 A seleção das matérias-primas deve propiciar características de biodegradabilidade e/ou biocompatibilidade às nanopartículas.1 Devido à diversidade de polímeros, fármacos, óleos e tensoativos que podem ser utilizados, vários métodos também foram desenvolvidos, os quais já foram amplamente descritos na literatura.5,7 Em 1989, o método de deposição interfacial de polímero pré-formado foi proposto para a preparação de nanocápsulas poliméricas.8 Em geral, o fármaco é dissolvido no núcleo oleoso e a parede polimérica oferece uma barreira difusional para a sua liberação, que pode apresentar curvas de primeira ordem (monoexponenciais ou biexponenciais). Alternativamente, a decomposição da parede polimérica determina a liberação do fármaco, produzindo uma curva de ordem zero. Empregando este método de preparação foram obtidas nanocápsulas que apresentaram duas barreiras difusionais para a liberação de um pró-fármaco.9 Esta característica é decorrente da formação de um organogel no núcleo e de uma parede polimérica. Com o intuito de diferenciá-las de outras nanocápsulas poliméricas, essas novas estruturas foram nomeadas como nanocápsulas de núcleo de lipídico (LNCs, do inglês: lipid-core nanocapsules)10 (Figura 1S). As nanocápsulas poliméricas8 e as LNCs apresentam propriedades físico-químicas e biológicas diversas, como, por exemplo, flexibilidade11 e penetração cutânea.12 As LNCs podem aumentar a estabilidade química (ou fotoquímica) e solubilidade aparente de fármacos,13,14 possibilitar a coencapsulação de substâncias ativas (núcleo/superfície)15,16 e controlar sua liberação.17 Outras vantagens incluem o aumento do efeito terapêutico e da biodisponibilidade de fármacos,18 a redução de efeitos adversos19,20 e o direcionamento ativo de fármacos e biofármacos.21,22 Além disso, esses nanocarreadores têm baixa toxicidade como demonstrado em diferentes modelos de estudo in vivo.23-26 Esse conjunto de características fazem das LNCs nanocarreadores eficientes, pois apresentam resultados relevantes e promissores no âmbito médico, farmacêutico e veterinário. Nos últimos anos, a estrutura supramolecular das LNCs, assim como estratégias de marcação fluorescente, ou de revestimentos e funcionalização de superfície por reação interfacial (in situ) têm sido descritos. Assim, este artigo de revisão descreve a preparação das LNCs, sua composição e marcação com sondas fluorescentes, seu revestimento para estabilização física coloidal e sua funcionalização de superfície por formação de complexos organometálicos, e, ainda, uma visão geral das suas principais aplicações biológicas estudadas até o momento.
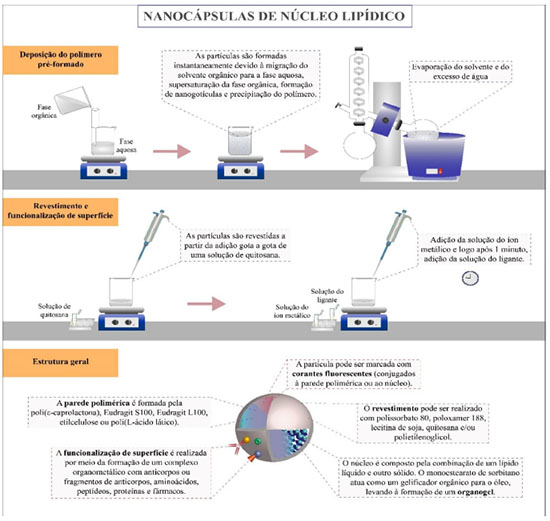
FATORES EXPERIMENTAIS QUE INFLUENCIAM AS CARACTERÍSTICAS FÍSICO-QUÍMICAS DAS NANOCÁPSULAS DE NÚCLEO LIPÍDICO Mecanismo de formação As LNCs são preparadas pelo método de deposição interfacial de polímero pré-formado, também conhecido como deslocamento de solvente (Figura 1). A fase orgânica, contendo as matérias-primas lipofílicas, é injetada (funil ou seringa) na fase aquosa, contendo um tensoativo ou dispersante, sob agitação magnética moderada.8 As nanocápsulas são formadas instantaneamente, devido à migração do solvente orgânico para a fase aquosa.27 Essa migração leva à supersaturação da fase orgânica e, como consequência, à formação de nanogotículas e precipitação interfacial do polímero.6 A presença de tensoativo ou dispersante na fase aquosa previne a agregação. Nesse contexto, a estrutura supramolecular é formada a partir de um mecanismo de automontagem, seguido pela redução do tamanho das partículas na etapa de evaporação do solvente.28 Em geral, a proporção entre a fase orgânica e a fase aquosa é de 1:2 (v/v); porém, é possível reduzir o volume da fase aquosa entre 40-60%, a fim de minimizar o tempo e a energia consumidos na etapa de evaporação do solvente e concentração da formulação, sem alterar o diâmetro médio de partícula.29 O controle do tamanho (diâmetro médio e distribuição de diâmetros) está relacionado à viscosidade da fase orgânica. Para a obtenção de LNCs com distribuição de tamanhos unimodal, regime diluído, ou semidiluído, da fase orgânica deve ser empregado.28 Existe uma proporção ideal entre monoestearato de sorbitano, óleo e polímero [1:4,1:2,6 (m/m/m)] para formar LNCs sem que haja a contaminação com nanoesferas ou nanoemulsão na formulação.13 Idealmente, para se obter uma formulação cineticamente estável, a proporção entre o polissorbato 80 e o monoestearato de sorbitano é de 2:1.28,30 Devido a otimização das quantidades de matérias-primas e dos processos de síntese, o rendimento das dispersões aquosas de LNCs é de 100%.
As LNCs são preparadas a partir de duas fases, em geral: acetona e água. Ocasionalmente, pequenos volumes de etanol podem ser adicionados à fase orgânica, para auxiliar na solubilização de matérias-primas e, também, para modificar a difusão da acetona para a fase aquosa, permitindo a formação de LNCs com diâmetros menores.31 A evaporação ocorre sob pressão reduzida (evaporador rotativo) a 40-45 °C.29 Quanto ao fluxo de injeção, fluxos mais rápidos (38 mL min-1) levam à formação de nanocápsulas com diâmetros menores.32 No caso de se utilizar uma seringa, os diâmetros são menores (Dh = 102 ± 11, PDI = 0,11 ± 0,01) do que os diâmetros obtidos se empregando funil (Dh = 153 ± 7 nm, PDI = 0,13 ± 0,01),33 devido ao maior fluxo de injeção. Considerando esses fatores, a produção das LNCs pode ser facilmente ampliada em ambiente laboratorial, mantendo a reprodutibilidade entre os lotes, cujos volumes finais podem ser de 10 mL ou de 100 mL.34-36 Além disso, a produção dessas nanocápsulas pode ser transposta para a escala industrial.10 Núcleo lipídico: um organogel O núcleo das LNCs é composto por um lipídio sólido (por exemplo: monoestearato de sorbitano) e um lipídio líquido (geralmente um triacilglicerol de cadeias médias). O lipídio sólido atua como geleificante de baixa massa molar para o óleo, levando à formação de um organogel.37 O organogel altera as propriedades mecânicas e confere maior rigidez às LNCs em comparação com outras nanocápsulas poliméricas.12 O monoestearato de sorbitano contribui para aumentar a eficiência de encapsulação de fármacos lipofílicos, pois interage de forma não covalente.37 Além disso, a formação do organogel aumenta a viscosidade do núcleo, promovendo a resistência à difusão do fármaco,9,10 atuando assim, como uma segunda barreira difusional para o fármaco disperso/solubilizado no núcleo. Adicionalmente, estudos demonstraram que o monostearato de sorbitano pode ser substituído por outras substâncias lipofílicas sólidas, como o palmitato de cetila e o colesterol.30 Em geral, as LNCs são obtidas empregando-se triglicerídeo cáprico/caprílico como lipídeo líquido. No entanto, óleos vegetais,38-42 óleos de origem animal43 e óleos minerais44 também são relatados como componentes líquidos (Tabelas 1S, 2S, 3S e 4S). Esses óleos apresentam composições distintas e, consequentemente, características singulares que podem influenciar nas propriedades físico-químicas das nanocápsulas. Óleos mais viscosos produzem nanocápsulas de maiores tamanhos.45 Além disso, o óleo pode modular a liberação do fármaco,46 contribuir para o efeito biológico,43 afetar a estabilidade de armazenamento45 e a eficiência de encapsulação do fármaco.47 A encapsulação do fármaco nas LNCs não depende exclusivamente da sua solubilidade na fase dispersa, mas a lipofilia (logaritmo da distribuição, log D) do fármaco influencia a sua distribuição na formulação. Desta forma, um algoritmo, para determinar o mecanismo de distribuição, foi validado (8 fármacos) baseando-se nos valores de log D correlacionados com seis tipos de distribuições, que variam desde a completa dissolução do fármaco na fase externa (fármacos hidrofílicos) até a completa encapsulação do fármaco no núcleo das LNCs (fármacos altamente lipofílicos).48 A escolha do óleo deve considerar suas características e compatibilidade biológica,49 sua capacidade de dispersar ou solubilizar a substância ativa40 e sua propriedade não-solvente para o polímero.46 Além disso, o polímero deve interagir com o monoestearato de sorbitano, o que não ocorre quando polímeros metacrílicos positivos são empregados nas formulações ocasionando agregação das partículas.50 Desta forma, os estudos de pré-formulação são essenciais visando a produção de LNCs com características adequadas ao objetivo proposto. Parede polimérica A poli(ε-caprolactona) é comumente utilizada como parede polimérica das LNCs10 (Tabelas 1S, 2S, 3S e 4S), oportunizando a redução da degradação da substância ativa durante as etapas de preparação,20 o aumento da eficiência de encapsulação, a liberação controlada, a modulação da penetração da substância ativa nas camadas da pele51 e, consequentemente, melhora dos efeitos biológicos em comparação aos nanocarreadores lipídicos convencionais.52 Adicionalmente, as LNCs podem ter a parede de Eudragit® S100,53 Eudragit® L100,53 etilcelulose,54 ou, ainda, de poli(L-lactídeo) (PLLA).55 O uso de diferentes polímeros permite a obtenção de nanocápsulas com características físico-químicas e comportamento biológico distintos. Revestimento de superfície LNCs revestidas com polissorbato 80, poloxamer 188, lecitina (Lipoid S75), quitosana e poli(etilenoglicol) (PEG) foram descritas (Tabelas 1S, 2S, 3S e Figura 1). O polissorbato 8056 e o poloxamer 188,47 tensoativos polioxigenados não-aniônicos, contribuem para a estabilidade cinética do sistema coloidal por mecanismo de impedimento estéreo. O revestimento com lecitina 99% (como único estabilizante de interface) diminui a estabilidade coloidal comparado ao revestimento de polissorbato 80.56 Uma estratégia para se obter o revestimento com quitosana é utilizar lecitina 75-80% (que possui impurezas aniônicas, como ácido fosfatídico) juntamente com polissorbato 80, para posterior reação interfacial com solução aquosa ácida de quitosana.57 A lecitina e o polissorbato 80 formam uma corona hidrofílica composta de micelas na interface nanocápsula-água,58 estabilizando a formulação por um mecanismo híbrido envolvendo impedimento estéreo e repulsão eletrostática.59 O método é baseado em auto-organização dos materiais seguido de reação interfacial, reagindo o grupo amônio da quitosana com grupos fosfato da lecitina e ácido fosfatídico. O potencial de superfície é positivo e as formulações líquidas dessas nanocápsulas têm sua estabilidade cinética decorrente do impedimento estéreo do polissobato 80 e da repulsão eletrostática da quitosana.60 Recentemente, foi descrito o processo de revestimento com quitosana em uma etapa, com a vantagem de reduzir o tempo de preparação, uma vez que, a solução acidificada de quitosana é adicionada à fase aquosa, na ausência do polissorbato 80.61 Em alguns estudos, o revestimento de nanopartículas poliméricas com quitosana é realizado sem a adição de lecitina.62,63 A superfície de quitosana aumenta a mucoadesão das nanopartículas,61,64 melhora a atividade antimicrobiana,58 e pode, ainda, oportunizar a formação de complexos organometálicos decorando as LNCs.21,59,65 O revestimento com PEG, para reduzir o reconhecimento das nanopartículas pelo sistema fagocítico mononuclear e aumentar seu tempo de meia-vida na corrente sanguínea,66 é realizado pela adição do polímero (PEG 6000 ou PEG 4000) na fase aquosa, mantendo as demais etapas de preparação (na ausência de lecitina e/ou quitosana).62,67,68 O revestimento é obtido pela formação de ligações de hidrogênio intermoleculares com a poli(ε-caprolactona).63 Funcionalização de superfície: complexação organometálica A funcionalização da superfície de nanocarreadores tem por objetivo modificar a estrutura externa da partícula, a fim de promover o direcionamento ativo e favorecer o reconhecimento entre o ligante de superfície e os receptores nas células e tecidos-alvo.69 Além disso, as moléculas acopladas na superfície do nanocarreador podem apresentar maior estabilidade em ambientes biológicos.1 Outra vantagem da funcionalização de superfície é a possibilidade de combinar diferentes substâncias ativas no mesmo nanocarreador.15,70 Nesse sentido, LNCs foram funcionalizadas (Tabela 4S) com fármacos,22,70 biofármacos,21,65,71 aminoácidos e peptídeos72,73,74 e proteínas.59,75 As LNCs, uma vez formadas por auto-organização,28 podem ser funcionalizadas em três etapas de reações interfaciais consecutivas: (i) reação da quitosana com os grupos fosfatos da lecitina; (ii) reação de um íon metálico (por exemplo, Fe2+, Zn2+ ou Au3+) com o grupo amina da quitosana, formando um quelato pela interação do íon metálico com o grupo hidroxila em posição C-3 da quitosana, e (iii) reação de um ligante (contendo átomos de oxigênio ou nitrogênio) com o quelato (Figura 2S).21,59,65 Todas essas etapas in situ são realizadas em água, sob agitação magnética e temperatura ambiente (Figura 1).70,72,75 A adição do ligante (1 min após a adição do íon metálico) é necessária para passivar a superfície, uma vez que na ausência do ligante, as nanocápsulas reagem entre si formando rapidamente microagregados.21,65 Mesmo que o ligante possa interagir com a quitosana sem a presença do íon metálico, a presença do complexo organometálico é essencial para o melhor resultado terapêutico.70 Conjugação de materiais estruturais com corantes fluorescentes A rodamina B foi conjugada através de método clássico de ativação da função carboxílica com os grupos α,ω-hidroxila da poli(ε-caprolactona) para o rastreamento das LNCs em sistemas biológicos.76 O conjugado (Rho-PCL), após purificação, é misturado com poli(ε-caprolactona) na proporção 1:10 (m/m), sendo as LNCs fluorescentes quimicamente estáveis (ao menos 4 h) em tampão fosfato salino e meios gástrico e intestinal simulados (pH = 7,4; pH = 1,2; e pH = 6,8, respectivamente).77 Estudos in vitro de captação celular (microscopia confocal) foram conduzidos com as LNCs fluorescentes,65,78,79 assim como estudos de penetração e distribuição cutâneas em tecido animal.12 As LNCs fluorescentes podem ser detectadas (microscopia intravital) no parênquima cerebral de camundongos após a administração da formulação por via oral, intravenosa e intraperitoneal.77,79 LNCs contendo Rho-PCL (emissão no vermelho) foram preparadas contendo também em seu núcleo um derivado benzoxazólico (emissão no azul) observando-se que as nanocápsulas foram internalizadas intactas em células de câncer de mama (MCF-7) e, após 24 h, a sonda azul foi liberada no interior celular sugerindo a degradação das LNCs.22 Em outro estudo de captação celular, a rodamina B foi conjugada com óleo de rícino,80 o conjugado foi misturado com triglicerídeo de cadeias médias (1:10, m/m) obtendo-se LNCs fluorescentes. Após aplicação em macrófagos humanos (linhagem U937) foi observada emissão fluorescente (microscopia) próxima ao núcleo das células. Formulações líquidas esterilizadas e isotônicas Atualmente, a esterilização de formas farmacêuticas líquidas pode ser obtida por filtração, autoclavagem, irradiação e tratamentos com óxido de etileno, formaldeído e plasma gasoso.81,82 Obter formulações nanotecnológicas esterilizadas sem alterar suas características é um desafio. LNCs preparadas com poli(ε-caprolactona) mantêm suas características físico-químicas após a esterilização por autoclavagem (134 ºC, 2,1 bar por 10 min).82,83 Alternativamente, LNCs (d90 < 220 nm) podem ser esterilizadas por filtração esterilizante (0,22 μm).84 Formulações isotônicas de LNCs foram obtidas empregando-se glicerol,82 sem alteração da viscosidade e da estabilidade cinética das formulações, além de não induzir hemólise em teste in vitro.
CARACTERIZAÇÃO FÍSICO-QUÍMICA DAS FORMULAÇÕES LÍQUIDAS Técnicas espectroscópicas e microscopias de luz, de força atômica, ou eletrônica são empregadas para caracterizar as propriedades físico-químicas das formulações quanto à distribuição e à dispersão de diâmetros, ao diâmetro médio, à densidade numérica de partículas, à morfologia e características de superfície. Adicionalmente, são utilizadas técnicas para avaliar a mobilidade eletroforética (potencial zeta), pH, e à quantificação e eficiência de encapsulação (Figura 3S).85 Além disso, a calorimetria de varredura diferencial, espalhamento de raios X a baixo ângulo,37 microscopia eletrônica de varredura,86 microscopia de força atômica,70 e espectroscopia de infravermelho com transformada de Fourier65 também são empregadas para caracterizar as formulações de nanocápsulas, elucidando a estrutura supramolecular, a morfologia e a interação entre as matérias-primas. Pode-se citar a levitação acústica de gota única como uma técnica promissora na área de desenvolvimento de sólidos por aspersão.87 No entanto, esta técnica ainda não foi aplicada para a formulações de LNCs. Técnica de espalhamento de luz A difração de laser (DL), o espalhamento de luz dinâmico (dynamic light scattering - DLS) e a análise de rastreamento de nanopartículas (nanoparticle tracking analysis - NTA) são técnicas complementares, utilizadas para a determinação das curvas de distribuição de diâmetro, assumindo geometria esférica de partículas. A DL caracteriza o diâmetro de partículas baseado em espalhamento Mie (partículas menores dispersam a radiação eletromagnética em ângulos maiores). O equipamento fornece a curva de distribuição no intervalo de 40 nm a 1000 mm.88 Desta forma, esta técnica é utilizada como screening inicial na caracterização, visto que pode indicar a presença de microagregados na formulação, o que não é desejado. O DLS e o NTA são técnicas baseadas na dispersão de Rayleigh e na equação de Stoke-Einstein. A radiação eletromagnética é dispersada por partículas em movimento translacional muito menores do que o comprimento de onda da fonte laser utilizada. O DLS analisa por espectroscopia de correlação de fótons o diâmetro hidrodinâmico a partir da flutuação na intensidade da luz espalhada em função do tempo, enquanto o NTA mede o diâmetro hidrodinâmico registrando o movimento individual através da luz espalhada partícula a partícula empregando um microscópio de luz. No caso da preparação de amostras ser realizada de forma quantitativa, empregando-se o NTA pode-se acessar a densidade numérica de nanocápsulas, ou seja a concentração por volume.88,89 Além disso, esta técnica correlaciona a curva de diâmetros com a intensidade de luz espalhada permitindo a determinação de nanocristais de fármaco misturados com as nanocápsulas (solução supersaturada) mesmo que tenham a mesma distribuição de diâmetros.28 Considerando as metodologias mencionadas, o diâmetro médio das LNCs varia de 71 a cerca de 700 nm (Tabelas 1S, 2S, 3S e 4S). As diferenças de tamanho descritas para esse tipo de nanopartícula estão relacionadas à sua composição, massa molar do polímero, componentes lipídicos, substância ativa e modificações de superfície, assim como pelas técnicas usadas para caracterizá-las. Microscopia eletrônica de transmissão A microscopia eletrônica de transmissão (MET) caracteriza as nanopartículas após secagem sobre o suporte (sob condições de vácuo). Desta forma, os diâmetros obtidos por MET podem ser menores que aqueles avaliados por DLS.88 No entanto, no caso de LNCs, a caracterização por MET é geralmente aplicada para ilustrar e confirmar a forma esférica das partículas.21,46,90-92 Adicionalmente, a rugosidade superficial e a presença de corona hidrofílica (estruturas micelares de tensoativos) na superfície das nanocápsulas foram caracterizadas.58,93 Potencial zeta O potencial zeta, avaliado por mobilidade eletroforética, estima o potencial de superfície das partículas,88 podendo ser usado para caracterizar o revestimento de superfície.57,58 Neste contexto, valores de potencial zeta negativos foram descritos para as LNCs estabilizadas com polissorbato 80, poloxamer 188, lecitina e PEG, enquanto que para nanocápsulas revestidas com quitosana, com ou sem funcionalização, valores positivos foram determinados (Tabelas 1S, 2S, 3S e 4S). Potenciometria O pH (potencial hidrogeniônico) de formulações de LNCs varia geralmente entre 3,9 e 7,5. As matérias-primas determinam o pH, assim como a sua variação em função do tempo é indicativo de alteração de espécies ionizáveis ou da hidrólise de ésteres, sendo um indicativo de estabilidade.46 Quando é usado o revestimento com quitosana, dispersa em solução acidificada, as formulações apresentam valores de pH entre 4 e 5.41 Alterações de pH ao longo das etapas de obtenção das LNCs podem ocasionar a ionização de fármacos, diminuindo a eficiência de encapsulação.74,91 Quantificação de substâncias ativas e eficiência de encapsulação A concentração de fármaco nas formulações é determinada de forma direta por métodos analíticos validados seguindo diretrizes de agências regulatórias nacionais e internacionais.94,95 A cromatografia a líquido com detector ultra-violeta (CLAE) é a técnica mais utilizada,70,96,97 sendo a cromatografia a líquido com espectrômetro de massa em Tandem uma alternativa.98 A escolha do método de quantificação e a preparação de amostra dependem da concentração do analito e da matriz. A eficiência de encapsulação é determinada de forma indireta empregando-se a ultrafiltração-centrifugação, separando o fármaco solúvel (na fase contínua) das LNCs.48 No entanto, é importante verificar previamente se a membrana de filtração é ou não uma barreira para a passagem do fármaco, visto que, se for o caso, o resultado da eficiência de encapsulação será superestimado devido à sua retenção na membrana. Além disso, para a ultrafiltração, membranas de filtração com poros de diferentes tamanhos podem ser selecionadas, considerando-se a massa molecular da substância ativa e o diâmetro das nanocápsulas, permitindo apenas a permeação de pequenas moléculas para o ultrafiltrado. Após isolamento do fármaco solúvel, este é quantificado no ultrafiltrado, e esta concentração é subtraída da concentração total de fármaco presente na formulação.48 A eficiência de encapsulação nas LNCs varia de 20% a 100% dependendo da lipofilia do fármaco e suas interações com os materiais constituintes (Tabelas 1S, 2S, 3S e 4S). Estabilidade cinética As formulações líquidas de LNCs são dispersões termodinamicamente instáveis, mas sua estabilidade cinética pode ser aumentada com eficientes revestimentos de superfície. A parede polimérica é hidrofóbica favorecendo as interações partícula-partícula, o que gera agregação das LNCs em função do tempo. A estabilidade cinética pode ser avaliada por espalhamento múltiplo de luz em função do tempo para determinar fenômenos de aglomeração, agregação (floculação e coalescência), sedimentação e cremagem.12,99 A otimização das proporções dos materiais constituintes das LNCs fornece formulações cineticamente estáveis.12,46,99 A funcionalização de superfície diminui essa estabilidade, mas ainda assim as formulações apresentam relativa estabilidade.60,70,75 O espalhamento múltiplo de luz em temperatura variável permite estimar a entalpia relativa entre formulações, determinando uma ordem de estabilidade para as formulações comparadas.56 APLICAÇÕES BIOLÓGICAS O uso das LNCs apresenta diferentes vantagens como descrito anteriormente. No entanto, os nanocarreadores também possuem limitações como dificuldades de aplicação, perda de estabilidade, acúmulo em órgãos inespecíficos, reconhecimento pelo sistema fagocitário e toxicidade indesejada.100 Para contornar esses obstáculos o desenvolvimento de novas formulações vem sendo estudado, permitindo a otimização entre os componentes a fim de melhorar a estabilidade das dispersões. Além disso, as LNCs podem ser incorporadas em diferentes formas farmacêuticas (líquidas, sólidas e semissólidas). Os pós secos podem ser obtidos por aspersão das formas líquidas por spray-drier,33,101 comprimidos podem ser preparados pelo método de granulação úmida102 e os hidrogéis podem ser preparados pela dispersão de agentes espessantes diretamente na formulação líquida.103,104 Essa versatilidade de obtenção de diferentes produtos possibilita o planejamento para a administração das LNCs por diferentes vias: oral,99 injetável,75 pulmonar e nasal,33,73,105 vaginal41 ou cutânea.51,106 Outra estratégia para atingir alvos específicos é a modificação de superfície citada nas seções anteriores, que também pode modular a ativação do sistema imune e a toxicidade. Assim, os estudos com LNCs devem considerar os objetivos a serem atingidos para delinear a composição final da partícula. Neste contexto, os estudos de desenvolvimento e ensaios pré-clínicos, assim como alguns estudos na área veterinária, conduzidos entre 2013 e 2021, são abordados nas próximas seções. Estudos anteriores de preparação e avaliação de formulações contendo LNCs foram amplamente discutidos em artigo de revisão.10 Câncer Culturas celulares in vitro, mecanismo de ação e internalização celular As nanopartículas utilizam da condição fisiopatológica do câncer (alta vascularização, angiogênese e função linfática prejudicada) para a entrega de fármacos ao tecido tumoral (efeito de permeabilidade e retenção aumentada).107 Além disso, o direcionamento para o tecido tumoral pode ser otimizado pela funcionalização de superfície com moléculas específicas (anticorpos, peptídeos, proteínas).69 A encapsulação de drogas ou de fármacos em LNCs ocasiona citotoxicidade aumentada frente a células tumorais, dentre elas a indometacina em células de glioma (C6 e U138-MG),108 resveratrol em células de glioma (C6),109 curcumina em células de glioma (C6 e U251MG),38 tretinoína em células epiteliais de adenocarcinoma pulmonar (A549 resistente ao mesmo fármaco)110 e em células de câncer de mama triplo negativo (MDA-MB-231),111 éster dietílico do metotrexato em células de adenocarcinoma de mama resistentes (MCF-7 e MDA-MB-231),112 metotrexato em células de glioma (C6),113 acetileugenol em células de melanoma (SK-MEL-28),114 doxorrubicina em células de adenocarcinoma de mama (MCF-7),78 imiquimode em células de câncer cervical (SiHa)41,64 e em melanoma (SK-MEL-28),104 metotrexato em células de glioma (GL261),79 Lapatinibe em células de câncer de bexiga (T24),42 erlotinibe em células de câncer de pulmão (A549),115 floretina em células de melanoma (SK-MEL-28),103 extrato rico em licopeno de goiaba vermelha em células de adenocarcinoma de mama (MCF-7)116 e bozepinibe em células de glioma (C6 e U138).105 As LNCs apresentam seletividade para células malignas105,109 e compatibilidade com células normais.39,103 Os mecanismos de atividade antitumoral in vitro das formulações de LNCs foram apoptose,14,42,64,105,108-110,112-115,117 necrose,114 parada da fase G0/G1,42,108-110,113 parada da fase G2/M38,108 e parada da fase S105,109 do ciclo celular, e, ainda, supressão da progressão do ciclo celular devido ao aumento de células na fase sub-G1,115 redução da formação de colônias,42,115 autofagia,38,64 modulação das vias de sobrevivência de PI3K/AKT, GSK3β e β-catenina, além da indução da diferenciação celular,108 aumento da liberação de óxido nítrico,114 Liberação da citocina pró-inflamatória interleucina-6,64 indução da senescência celular,103 e inibição da ativação de NF-kB induzida por lipopolissacarídeo e produção de espécies reativas de oxigênio em células microgliais.116 Adicionalmente, efeitos sinérgicos foram determinados quando LNCs contendo tretinoína foram combinadas com 5-fluorouracil ou doxorrubicina (MDA-MB-231, câncer de mama).111 O acetileugenol nanoencapsulado foi internalizado pelas células de melanoma (SK-MEL-28 e B16F10),114,117 bem como LNCs contendo curcumina foram captadas pelas células de glioma (C6 e U251MG) por endocitose.38 A internalização da doxorrubicina encapsulada pelas células de câncer de mama (MCF-7) ocorreu por endocitose mediada por caveolina e por endocitose de fase fluida.78 Formulação líquida de LNCs contendo metotrexato mostrou diferentes mecanismos de internalização: em células de glioma (GL261) - captação mediada por endocitose dependente de caveolina; e em células imunes do cérebro (células microgliais BV2) - fagocitose e macropinocitose.79 LNCs funcionalizadas LNCs contendo doxorrubicina foram funcionalizadas com o ácido arginilglicilaspártico (RGD),72 Ligante para a integrina αvβ3 (superexpressa em células tumorais). Neste estudo, foi observada maior citotoxicidade quando a formulação foi aplicada em astrocitoma de glioblastoma humano (U87MG), que apresenta uma maior expressão dessa integrina, do que quando aplicada em células de adenocarcinoma de mama humano (MCF-7), que apresentam menor expressão. Na sequência desse estudo, LNCs contendo alfa-bisabolol e doxorrubicina, e funcionalizadas com RGD, demonstraram citotoxicidade maior do que o tratamento padrão frente às linhagens de glioblastoma (U87MG e U138MG), com parada do ciclo celular na fase S.74 E, ainda, em modelo de membrana corioalantoide (CAM) de ovos embrionados de galinha a formulação apresentou efeitos anti-angiogênicos (RGD). LNCs funcionalizadas com bromelina ocasionaram um maior efeito antiproliferativo (MCF-7) quando comparado à bromelina em solução, mesmo apresentando uma atividade proteolítica in vitro similar.59 LNCs funcionalizadas com bevacizumabe apresentaram maior efeito citotóxico (células de glioma C6) que o anticorpo em solução, e quando a formulação foi aplicada em modelo CAM de ovos embrionados de galinha apresentou um potente efeito anti-angiogênico (principal mecanismo de ação do bevacizumabe) na presença e na ausência do fator de crescimento endotelial vascular (VEGF, do inglês).65 Um estudo comparativo,22 onde 3 formulações de LNCs foram preparadas contendo: a) metotrexato (encapsulado e funcionalizado na superfície), b) éster dietílico de metotrexato (funcionalizado na superfície), ou c) éster dietílico de metotrexato (encapsulado, e fenilalanina, um aminoácido sem atividade na superfície), demonstrou para todas as formulações ausência de citotoxicidade em células não-tumorais (HaCaT) e, seletivamente, citotoxicidade para células de carcinoma de mama (MCF-7). As LNCs com superfície decorada (a e b) apresentaram atividade antiproliferativa e captação celular maiores nas células tumorais. LNCs duplamente funcionalizadas com doxorrubicina e ácido fólico diminuíram seletivamente a proliferação celular com resultados melhores para a linhagem tumoral de carcinoma de células transicionais da bexiga (T24) em comparação à linhagem celular de adenocarcinoma de ovário (OVCAR-3).15 Além disso, estas LNCs funcionalizadas foram captadas pelas células de câncer de mama (MDA-MB-231), causando morte celular por apoptose, diminuição da capacidade de migração das células, inibição da formação de colônias e aumento dos níveis de óxido nítrico.118 Estudos in vivo Em modelo murino de glioma, uma significativa redução do tamanho do tumor foi observada após a nanoencapsulação de trans-resveratrol,109 curcumina38 ou metotrexato,113 além de uma melhora da taxa de sobrevida dos animais,38 ou diminuição dos achados histopatológicos característicos de glioblastoma humano (necrose, infiltração linfocítica, hemorragia intratumoral, edema intratumoral, presença de pseudopaliçada).38,109 LNCs contendo metotrexato levaram a uma diminuição nos níveis da proteína BCL-2 em ratos, sugerindo um mecanismo intrínseco da via de apoptose em seu efeito.109 Essa formulação aumentou a expressão de CD73 nas células de glioblastoma in vitro e linfócitos T no microambiente tumoral in vivo, e diminuiu a porcentagem de células T reguladoras (Treg) − importantes para a progressão do câncer, uma vez que induzem uma resposta imune pró-tumoral.119 A combinação de LNCs contendo bozepinibe (intranasal) e temozolomida (intraperitoneal) apresentou efeitos sinérgicos reduzindo o tamanho do tumor em um modelo de glioma (C6) em ratos.105 E a combinação de duas formulações de LNCs funcionalizadas seja com bevacizumabe (tratamento) ou com o peptídeo específico para a mutação vIII do receptor do fator de crescimento epidérmico (EGFRvIII) (pré-tratamento), ambas por via intranasal, reduziu consideravelmente o tumor (C6), e os achados histopatológicos (edema peritumoral, proliferação vascular, necrose e hemorragia), observando-se maior infiltração de linfócitos T CD8+ no tecido tumoral.73 Após a administração de LNCs fluorescentes (vias intravenosa, peritoneal e oral), a emissão de fluorescência no parênquima cerebral em camundongos demonstrou que as LNCs atravessaram a barreira hematoencefálica, sendo que a formulação contendo indometacina e éster etílico de indometacina mostrou redução significativa do volume tumoral (GL261).77 Na sequência desse estudo, a encapsulação de metotrexato em LNCs também mostrou redução significativa do volume tumoral (implantação intracranial de células GL261).79 LNCs (sem fármaco), formulação usada muitas vezes como controle nos estudos, quando aplicada em modelo de melonama afeta os mecanismos intracelulares. Dessa forma, a pré-exposição das células in vitro, levou a uma maior suscetibilidade à morte celular quando as células foram submetidas à privação de soro, hipóxia ou quando na presença de neutrófilos. Nesse sentido, células de melanoma co-cultivas com neutrófilos reduziram a secreção de mediadores químicos pró-tumorais (VEGF, arginase-1, interleucina 10, metaloproteínase 9 e TGF-β). Nos neutrófilos ocorreu o aumento na produção de espécies reativas de oxigênio. Isso indica que as LNCs alteram a sinalização entre as células tumorais e neutrófilos, resultando em neutrófilos com fenótipo antitumoral.117 Em modelo in vivo, após a administração oral, esta formulação inibiu o desenvolvimento tumoral em camundongos (B16F10 - linhagem celular implantada).114 Doenças do sistema nervoso central Atividade antipsicótica, anticonvulsivante e antidepressiva LNCs revestidas com polissorbato 80 podem entregar fármacos ao tecido cerebral,19,77 decorrente da capacidade desse tensoativo em aumentar a permeabilidade de nanocarreadores através da barreira hematoencefálica.120 Dessa forma, olanzapina encapsulada em LNCs teve aumento da biodisponibilidade plasmática e cerebral,98,121 assim como o efeito antipsicótico (vias intraperitoneal e oral) em modelo animal de comportamento estereotipado foi melhorado,19,91,121 promovendo efeito sedativo121 e redução no ganho de peso e nos níveis de colesterol total.19 Além disso, essa formulação incorporada em hidrogéis termossensíveis tem potencial para administração via intramuscular.31 Em outro estudo, a quetiapina encapsulada em LNCs teve uma liberação sustentada e um aumento na sua concentração no tecido cerebral.122,123 A resistência terapêutica à quetiapina é decorrente de alterações nos transportadores de influxo na barreira hematoencefálica, descritas em modelo animal de esquizofrenia, utilizando modelagem farmacocinética semi-mecanística.124 Contudo, o tratamento com LNCs contendo quetiapina reverteu o efeito disruptivo do bloqueio sensório-motor em um modelo de esquizofrenia neurodesenvolvimental.125 Outro estudo pré-clínico demonstrou uma melhora no efeito antidepressivo do cloridrato de trazodona quando encapsulado.47 Enquanto que formas secas (pós e grânulos dispersíveis) de nanocápsulas revestidas com quitosana contendo fenitoína, reduziram a gravidade de convulsões e aumentaram a sobrevivência dos animais em um modelo agudo de convulsões induzidas por pilocarpina.101,126 Doença de Alzheimer Atualmente a doença de Alzheimer tem tratamento disponível limitado à redução e controle de sintomas.127 Formulação de LNCs contendo resveratrol administrada em pré-tratamento ou co-tratamento modulou a neuroinflamação em culturas in vitro organotípicas de hipocampo de rato estimulada pelo peptídeo β-amiloide, protegendo as células contra a formação de espécies reativas de oxigênio e a morte celular.128 In vivo, a formulação protegeu contra a perda de memória, a neurodegeneração e a neurotoxicidade.129 Da mesma forma, LNCs contendo curcumina mostraram um efeito neuroprotetor, que foi associado à diminuição da fosforilação da proteína tau, ao aumento nos níveis de sinaptofisina e fator neurotrófico derivado do cérebro (BDNF), à ativação da via de sinalização Akt/GSK-3,130 bem como, à redução dos níveis de citocinas inflamatórias no córtex pré-frontal, hipocampo e soro de roedores.131 Além disso, as LNCs contendo curcumina promoveram efeitos antioxidantes via redução de espécies reativas e da restauração da atividade das enzimas superóxido dismutase e catalase e efeitos antidepressivos.132 A administração de LNCs contendo meloxicam, ou a combinação de meloxicam e curcumina co-encapsulados, melhorou a memória dos animais, sendo a atividade atribuída à redução da ciclooxigenase-2 (COX-2) no cérebro dos roedores133,134 e ao aumento de uma enzima envolvida na excitabilidade neuronal (Na+, atividade de K+ ATPase).133 LNCs contendo crisina também melhoraram a memória e o aprendizado em camundongos fêmeas, reduzindo os danos cerebrais pela diminuição da neuroinflamação e do estresse oxidativo.135 Outras doenças do sistema nervoso central A sinvastatina, usada no tratamento da dislipidemia, também apresenta efeitos pleiotrópicos.136 Neste contexto, a administração de LNCs contendo sinvastatina em ratos, que receberam 4 meses de uma dieta hiperlipídica, foi capaz de evitar alterações cognitivas e o déficit de memória em animais hipercolesterolêmicos e obesos.86 Além disso, essa formulação após secagem apresentou propriedades aerodinâmicas adequadas para administração pela via pulmonar.137 LNCs contendo curcumina foram mais efetivas do que a curcumina livre na atenuação da neuroinflamação, na perda de peso, na redução da atividade locomotora e no desenvolvimento de comportamento do tipo depressivo em um modelo de rato de comportamento doentio induzido por lipopolissacarídeo (LPS).138 Além disso, a administração da formulação evitou o comprometimento da memória em ratos expostos passivamente à fumaça do cigarro, efeito relacionado à regulação das atividades enzimáticas de Na+ K+ ATPase e Ca+ ATPase e ao estresse oxidativo.34 Hipertensão e doenças cardiovasculares LNCs (em solução aquosa ou na forma pulverulenta) contendo carvedilol, utilizado para tratar insuficiência cardíaca congestiva severa, demonstraram características físico-químicas e mucoadesividade adequadas para a administração por via sublingual.40,139 Paralelamente, a hesperetina (um flavonoide com propriedades venoativas) nanoencapsulada pode ser impregnada em tecido de poliamida (por ex.: meias elásticas de compressão), mantendo o flavonoide no tecido mesmo após sucessivas lavagens com água e sabão neutro, e favorecendo a sua penetração através da pele.140 A administração de LNCs contendo resveratrol, em um modelo murino de síndrome metabólica induzida por uma dieta rica em gordura, reduziu a pressão arterial sistólica e diastólica dos animais, e diminuiu o peso corporal e a resistência à insulina.141 Em ratos espontaneamente hipertensos, um efeito anti-hipertensivo prolongado (até 24 h) foi observado após a administração de LNCs contendo a combinação de furosemina (encapsulado) e captopril (complexado à superfície da partícula).70 Além disso, LNCs contendo ambrisentana reverteram a disfunção sistólica, preveniram a remodelação vascular e a progressão da hipertensão arterial pulmonar em ratos.142 Como estratégia terapêutica para a aterosclerose, LNCs funcionalizadas com o fragmento de anticorpo scFv anti-LDL(-) mantiveram a capacidade do fragmento de reconhecer e reagir com lipoproteína de baixa densidade eletronegativa [LDL (-)] (in vitro).21 Na sequência, o tratamento agudo de camundongos (Ldlr-/-) com essa formulação, inibiu a progressão das lesões ateroscleróticas e o processo inflamatório associado.60,71 Um estudo in vitro demonstrou que LNCs contendo ácido docosahexaenóico e superfície funcionalizada com o anticorpo anti-molécula de adesão celular endotelial plaquetária (PECAM-1) são internalizadas por células endoteliais (HUVEC), revelando o potencial de entrega às células endoteliais associadas à artéria inflamada.143 Atividades anti-hiperalgésica, anti-inflamatória e imunossupressora LNCs contendo (-)-linalol atuam como reservatório para sua liberação sustentada, e aumento do efeito anti-hiperalgésico em modelo murino de dor muscular não inflamatória crônica.144 LNCs contendo meloxicam mostraram melhor efeito anti-inflamatório do que o fármaco livre em modelo murino de pleurisia.145 Além disso, a formulação demonstrou atividade antinociceptiva e efeitos antiedematogênicos em modelos agudos de nocicepção induzida por substâncias químicas.146 O pré-tratamento com LNCs contendo alfa-bisabolol reduziu a hiperresponsividade das vias aéreas, acúmulo de neutrófilos, mieloperoxidase, níveis de quimiocinas e danos histológicos nos pulmões de camundongos com lesão aguda induzida por LPS.18 Usando o mesmo modelo in vivo, LNCs contendo resveratrol aumentaram a resposta anti-inflamatória pela modulação das vias PI3K/Akt e ERK1/2.147 A instilação nasal de microaglomerados de LNCs contendo budesonida, em modelo murino de asma, promoveu a redução do influxo de células imunes no lavado broncoalveolar e secreção de quimiocina inflamatória (eotaxina-1).33 A formulação também inibiu a remodelação das vias aéreas devido à redução da fibrose peribrônquica e hipersecreção de muco, no modelo crônico da doença. Outro glicocorticoide, o deflazacort, quando encapsulado manteve seu efeito anti-inflamatório, sendo capaz de restaurar a integridade da barreira epitelial brônquica (células-Calu 3 in vitro), sugerindo a redução de suscetibilidade a alérgenos e patógenos, relatados em casos de asma e rinite alérgica.148 Considerando doenças articulares degenerativas, LNCs contendo a associação resveratrol e curcumina foram internalizadas por condrócitos humanos primários, levando a uma redução dos níveis de óxido nítrico e a proteção dos condrócitos inflamados contra alterações morfológicas e apoptose (in vitro).17 Em roedores portadores de artrite, um efeito antiedematogênico superior da formulação foi demonstrado em relação aos polifenóis em solução ou encapsulados individualmente. Além disso, a formulação reduziu as alterações teciduais, como fibrose da membrana sinovial, cartilagem e perda óssea.149 Da mesma forma, LNCs contendo vitamina D3, ou a associação vitamina D3 e curcumina, promoveram a modulação do metabolismo purinérgico, reduzindo a inflamação associada à artrite.150,151 E, a formulação de LNCs contendo metotrexato reduziu os níveis de citocinas in vitro em células mononucleares sinoviais derivadas de pacientes com artrite reumatoide (modelo de resistência ao metotrexato) e apresentou in vivo a diminuição do edema de pata com uma redução de 75% da dose, comparada à solução do fármaco.152 A atividade antiedematogênica também foi observada em outro estudo com LNCs contendo tacrolimus.153 Adicionalmente, a nanoencapsulação evitou a hiperglicemia nos animais tratados (efeito adverso relacionado à terapia convencional). A encapsulação do tacrolimus aumentou a sua biodisponibilidade oral, e independente da via de administração, oral ou intraperitoneal, a atividade imunossupressora foi equivalente.99 LNCs (sem fármaco) foram internalizadas por leucócitos do sangue periférico, reduzindo a secreção intracelular de citocinas (TNF-α, IL-8) e a transmigração celular quando sob estimulação inflamatória. Esses achados foram associados a inibição da via MAP quinase e influxo intracelular de cálcio. Dessa forma as LNCs sem fármaco podem interromper e prevenir processos inflamatórios indesejados.84 Assim como acima mencionado no caso de câncer, os resultados mostram que as LNCs apresentam atividade per se. Doenças parasitárias A leishmaniose é uma doença tropical negligenciada, sendo necessário o desenvolvimento de novos tratamentos.154 Neste sentido, LNCs contendo quercetina106 e LNCs contendo uma chalcona sintética antileishmania (CH8)155 reduziram a carga parasitária em lesões cutâneas provocada por Leishmania amazonensis. A formulação com quercetina reduziu o tamanho da lesão cutânea com uma dose efetiva 40 vezes menor do que a droga livre.106 O segundo estudo demonstrou que LNCs contendo CH8 foram internalizadas por macrófagos infectados in vitro, mostrando um direcionamento intracelular para os vacúolos parasitóforos, ativando mecanismos microbicidas dos macrófagos como: produção de espécies reativas de oxigênio, óxido nítrico e atividade proteolítica intracelular.155 LNCs contendo pirimetamina aumentaram a eficácia e a tolerabilidade do fármaco em modelo pré-clínico de Toxoplasma gondii (toxoplasmose), resultando no aumento da taxa de sobrevivência dos animais tratados.96 Adicionalmente, LNCs contendo curcumina apresentaram atividade tripanocida in vitro (Trypanosoma evansi) e in vivo a formulação atenuou a parasitemia em ratos.35 Mais recentemente, LNCs contendo curcumina, revestidas com quitosana, mostraram atividade antimalárica (Plasmodium falciparum − resistente à cloroquina W2) mais efetiva do que outras formulações revestidas com polissorbato 80 ou PEG 6000, o que pode estar relacionado a natureza catiônica da superfície dessas partículas.63 Atividade antimicrobiana LNCs contendo fluconazol foram capazes de reverter a resistência antifúngica de isolados de Candida albicans, C. krusei, C. glabrata e C. tropicalis (com múltiplos mecanismos de resistência, incluindo bomba de efluxo de fármacos).52 Ademais, LNCs contendo fluconazol, ou amiodarona, ou a associação fluconazol e amiodarona, diminuíram a carga fúngica pulmonar em modelo de criptococose murina, após administração intranasal.16 Por outro lado, LNCs contendo dapsona, revestidas com lecitina/polissorbato 80, ou com lecitina-quitosana/polissorbato 80, demonstraram atividades antibacteriana e antifúngica contra isolados de Staphylococcus aureus multirresistente, Aspergillus fumigatus, Aspergillus flavus e Aspergillus niger.58 Na continuidade dos estudos, outras duas formulações de LNCs produzidas com os mesmos revestimentos, mas contendo ácido fusídico, melhoraram a atividade antibacteriana do fármaco frente as bactérias Gram-positivas: Staphylococcus aureus, Enterococcus faecalis e Staphylococcus epidermidis.93 LNCs (sem fármaco) e revestidas com quitosana mostraram atividade antimicrobiana, o que pode estar associado a atividade antimicrobiana descrita para a quitosana.58 Enquanto que, LNCs contendo ciprofloxacino mostraram um efeito antibacteriano contra Pseudomonas aeruginosa e Staphylococcus aureus, evitando a formação de estruturas semelhantes a biofilme.36 Aplicação tópica As LNCs apresentam a capacidade de modular a liberação e a permeação/penetração de substâncias ativas através de peles e mucosas.14,51,92,156-160 Considerando que as LNCs (organogel) apresentam flexibilidade menor do que as nanocápsulas (óleo),11 após aplicação tópica as primeiras funcionam como reservatório nas camadas mais externas da pele (estrato córneo e epiderme viável).12 Adicionalmente, a incorporação das LNCs em diferentes veículos (supensão, hidrogéis e pós) modula a mucoadesividade da formulação.161 Formulações semissólidas de LNCs contendo os fármacos halcinonida,159 furoato de mometasona156 ou Fenitoína,51 bem como, formulações líquidas de LNCs contendo propionato de clobetasol158 ou dutasterida (LNCs revestidas com lecitina/polissorbato 80 ou lecitina-quitosana/polissorbato 80)92 reduziram a permeação dos fármacos nas camadas mais profundas da pele (in vitro), mesmo quando a pele se encontrava lesionada.51 Cabe salientar, ainda, que a aplicação tópica de LNCs contendo propionato de clobetasol,158 ou LNCs contendo dutasterida,92 maximizou o direcionamento dos fármacos para anexos da pele (folículos pilosos). Formulações semissólidas de LNCs contendo dipropionato de betametasona, ou fenitoína, reduziram a inflamação do tecido em um modelo animal de dermatite de contato160 e promoveram a cicatrização de feridas cutâneas;51 assim como, hidrogéis preparados com LNCs contendo óleo de pequi (revestidas com lecitina/polissorbato 80 ou lecitina-quitosana/polissorbato 80) promoveram a cicatrização de feridas dérmicas.162 Contudo, os hidrogéis contendo as LNCs revestidas com lecitina-quitosana/polissorbato 80 apresentaram os melhores resultados, atribuídos a uma produção eficaz de fibras de colágeno (colágeno tipo I) e às propriedades antimicrobianas intrínsecas da quitosana. Por outro lado, LNCs contendo ácido lipóico reverteram a ação pró-oxidante do ácido lipóico livre, porém sem benefícios adicionais à cicatrização.163 Outro estudo mostrou que os hidrogéis contendo LNCs contendo óleo de arroz reduziram o estresse oxidativo e a resposta inflamatória, bem como, preveniram o edema de orelha induzido por luz UVB, em camundongos.164 Um estudo recente conduzido com LNCs contendo a associação ácido lipóico e resveratrol demonstrou aumento da fotoestabilidade e da capacidade antioxidante, promovendo uma liberação controlada e permeação in vitro das substâncias ativas através do estrato córneo.14 Além disso, uma formulação de LNCs contendo a associação resveratrol e curcumina favoreceu a permeação de resveratrol em camadas mais profundas da pele (epiderme e derme viáveis) devido à interação da curcumina com bicamadas lipídicas do estrato córneo, facilitando a passagem do resveratrol. Ademais, as LNCs foram internalizadas por fibroblastos dérmicos humanos (células NHDF-p), revelando o potencial de liberação das substâncias antioxidantes em nível subcelular.157 Gastroproteção Administradas via oral, as LNCs (sem fármaco) diminuíram a formação de úlceras induzidas por etanol e reduziram a peroxidação lipídica no tecido gástrico em ratos.165 Adicionalmente, LNCs contendo alfa-bisabolol promoveram a gastroproteção quando etanol (contato direto) ou indometacina (inibição sistêmica de prostaglandinas) foram usadas na indução de úlceras gástricas.166 O efeito foi decorrente da formação de filmes oclusivos na superfície da mucosa, da preservação da camada de muco no tecido gástrico, e da prevenção de lesões hemorrágicas e infiltrações celulares. Redução de efeitos adversos Em ensaio HET-CAM (do inglês: Hens Egg Test-Chorion Allantoic Membrane), o potencial de irritação de ditranol e dipropionato de betametasona foi reduzido após encapsulação em LNCs.20,167 Por sua vez, a encapsulação de meloxicam em LNCs atenuou o potencial ulcerogênico do fármaco e a peroxidação lipídica no estômago e fígado de ratos.168 Da mesma forma, a encapsulação de haloperidol em LNCs reduziu a genotoxicidade em células do sangue, além da hepatotoxicidade e da nefrotoxicidade.169 A nanoencapsulação também protegeu contra o desenvolvimento agudo e subcrônico de discinesia oral, um efeito adverso motor do haloperiol.43 Terapia de reposição enzimática A mucopolissacaridose tipo I, doença genética rara caracterizada pela deficiência da enzima alfa-L-iduronidase, é tratada com laronidase, terapia de reposição enzimática.170 A funcionalização de LNCs com laronidase aumentou a sua atividade catalítica pela diminuição da agregação da enzima.75 A formulação foi testada in vitro em fibroblastos de pacientes com mucopolissacaridose tipo I, mostrando-se segura, e in vivo em modelo animal de deficiência de alfa-L-iduronidase, modificando o perfil farmacocinético da laronidase e aumentando a atividade da enzima sérica após administração intravenosa. Além disso, a atividade enzimática foi maior em órgãos periféricos (fígado, baço, rim e coração) do que a solução de laronidase, após 4 h da administração, sendo que a atividade aumentada foi mantida no fígado e rim por 24 h. Nanocápsulas de núcleo lipídico aplicadas à fertilização in vitro A suplementação de meios de cultivo com LNCs (sem fármaco),171 ou LNCs com tretinoína172 ou LNCs com melatonina,173,174 demonstrou efeitos benéficos para a maturação de oócitos e desenvolvimento de embriões bovinos, promovendo baixo ou nenhum efeito tóxico. Os mecanismos envolvidos estão relacionados à redução de espécies reativas de oxigênio,171-174 a baixas taxa de apoptose em embriões oriundos de oócitos cultivados na presença das LNCs,172 à baixa expressão de genes relacionados à apoptose nos blastocistos,172-174 à regulação positiva de genes antiapoptóticos174 e de enzimas antioxidantes173,174 e a melhores taxas de clivagem e formação de blastocistos.172,174 Ademais, LNCs contendo melatonina atravessam a zona pelúcida e a membrana plasmática de oócitos, permanecendo no seu interior até o estágio de blastocisto, sugerindo que a liberação intracelular sustentada da melatonina favorece o desenvolvimento embrionário.173,174 Além disso, LNCs (sem fármaco) revestidas com superfície aniônica (lecitina/polissorbato 80) ou catiônica (lecitina-quitosana/polissorbato 80) não afetaram a viabilidade, a cinética e a morfologia dos espermatozoides bovinos [quando usadas em concentrações de até 20% (v/v)].175 Esses resultados mostram que as LNCs são promissoras na suplementação de meios de cultivo para a fertilização in vitro, não apresentando toxicidade para células reprodutivas e embrionárias bovinas. Toxicidade Estudos toxicológicos, considerando fatores físicos e químicos, são realizados para determinar se materiais organizados ou dimensionados na escala nanométrica podem apresentar risco ao meio ambiente, aos animais e/ou aos humanos.176 Existem evidências de hepatotoxicidade, nefrotoxicidade, cardiotoxicidade, toxicidade reprodutiva, genotoxicidade e reações de hipersensibilidade associadas ao uso de nanopartículas inorgânicas (principalmente metálicas) e orgânicas (lipídicas, proteicas e poliméricas).177 Nesse sentido, existe a necessidade de investigação dos efeitos tóxicos relacionados a cada tipo de nanopartícula. Diferentes formulações de LNCs tiveram sua toxicidade avaliada (Tabela 5S). Em relação às LNCs (sem fármaco), baixa ou nenhuma toxicidade foi registrada em ratos quando estas nanocápsulas foram administradas em dose única ou várias doses via intraperitoneal23,90 ou via intradérmica.90,178 Efeitos cardiotóxicos tampouco foram evidenciados, quando a formulação foi administrada por via intravenosa.179 Ainda, as LNCs não foram letais para o nematoide Caenorhabditis elegans após exposição aguda, apesar de que a maior dose aplicada reduziu o tamanho corporal dos nematoides.24 Quanto à toxicidade ambiental, LNCs contendo óleo de farelo de arroz, óleo de soja ou óleo de semente de girassol não produziram genotoxicidade em raízes de cebola (Allium cepa).46 Quanto aos diferentes revestimentos de superfície, as LNCs catiônicas (quitosana) ou as neutras (PEG ou polissorbato 80) apresentam baixa toxicidade para ratos machos68 e fêmeas.62 No geral, essas formulações não alteraram o peso corporal, ou as características histológicas de diferentes órgãos; contudo, algumas alterações nas enzimas hepáticas, no perfil lipídico e marcadores de função renal foram registradas.62,68 Adicionalmente, os diferentes revestimentos não provocaram ansiedade, nem alterações na atividade locomotora, ou alterações comportamentais ou na memória.62 LNCs contendo curcumina e meloxicam, ou LNCs contendo meloxicam, revestidas ou não revestidas com PEG apresentaram-se seguras,67,97 não causando, em ratos, efeitos letais, ou alterações em marcadores hepáticos e renais,97 ou, em camundongos, não apresentaram genotoxicidade, nem toxicidade hematológica, bioquímica e histológica.67 Sinais de toxicidade não foram observados em larvas de Galleria mellonella expostas sistemicamente de forma aguda a LNCs revestidas com polissorbato 80, ou lecitina/polissorbato 80, ou lecitina-quitosana/polissorbato 80.25 Em mucosa nasal de coelho ex vivo, LNCs contendo sinvastatina, revestidas com quitosana, não apresentaram potencial irritativo ou toxicidade.61 Similarmente, LNCs contendo prednisolona não foram citotóxicas para as células epiteliais da córnea, nem irritativas para a CAM de ovos de galinha.44 Além disso, a curcumina encapsulada em LNCs não apresentou toxicidade a roedores fêmeas prenhas ou ao feto.180 Mesmo quando revestimentos polioxigenados (polissorbato 80 ou PEG) ou catiônico (quitosana) foram empregados na formulação contendo curcumina, efeitos teratogênicos e irritantes em modelo de embrião de galinha não foram observados.26 Considerando a baixa toxicidade, LNCs são nanocarreadores seguros e biodegradáveis, como demonstrado após avaliação da massa molar da parede de poli(ε-caprolactona), que é hidrolisada mais rapidamente na presença de microrganismos do que quando a formulação é esterilizada.83 Devido a suas características, LNCs foram estudadas na prevenção de efeitos tóxicos e prejudiciais do paraquat, um herbicida tóxico.181 O pré-tratamento de células epiteliais alveolares (A549) com LNCs contendo melatonina aumentou a viabilidade celular e reduziu os danos ao DNA. Adicionalmente, a formulação protegeu in vivo nematoides (C. elegans) frente à peroxidação lipídica.182 De forma geral, as LNCs apresentam baixa toxicidade em modelos experimentais in vitro ou in vivo, no entanto, os achados até o momento não descartam a necessidade de novos estudos em relação a esse tema. Estudo clínico e patentes Atualmente, LNCs contendo o quimioterápico imiquimode estão sob investigação em ensaio clínico183 em pacientes acometidos com ceratose actínica, uma lesão de boca pré-tumoral. O recrutamento dos pacientes foi encerrado, porém ainda não foram divulgados os resultados do estudo. No que diz respeito às patentes, podemos citar, no campo da nanotecnologia cosmética, o desenvolvimento do sistema Nanophoton®. Esse sistema é baseado na coencapsulação de um filtro UV juntamente com óleo de buriti nas nanocápsulas poliméricas e o desenvolvimento de uma formulação fotoprotetora, com maior fotoestabilidade e atuação em amplo espectro de radiação.184,185 Outra invenção refere-se à encapsulação de finasterida nas nanocápsulas e a incorporação destas em uma formulação de aplicação tópica, com o objetivo de tratar a alopecia. Após o ensaio de 23 dias, os animais (modelo murino) tratados com a formulação desenvolvida apresentaram crescimento de pelos em quase todo o dorso, enquanto que nos controles e no grupo que recebeu o fármaco veiculado em uma nanoemulsão o crescimento de pelos ocorreu em pequenas áreas apenas.186,187
CONCLUSÃO As LNCs são produzidas por um processo de automontagem, controlado pela viscosidade, regime de diluição e fluxo de injeção da fase orgânica. A proporção otimizada das matérias-primas permite rendimentos quantitativos (100%) de nanocápsulas. A estratégia de revestimento e funcionalização de superfície in situ, permite versatilidade na escolha de ligantes, abrindo a perspectiva para a medicina personalizada. Devido a essas características, aliadas às vantagens já descritas para nanocarreadores como: liberação sustentada, aumento do efeito terapêutico e da biodisponibilidade de fármacos, redução de doses e de efeitos adversos, um número expressivo de estudos tem investigado a aplicação dessa estratégia na área veterinária e na área médica e farmacêutica, a exemplo do tratamento de processos inflamatórios ou de doenças complexas e heterogêneas como o câncer. Apesar das vantagens apresentadas pelas LNCs alguns obstáculos devem ser superados, incluindo a baixa eficiência de encapsulação de algumas substâncias ativas. Outro fator bastante relevante é a inclusão das LNCs sem fármaco como controle nos desenhos experimentais, a fim de distinguir o efeito da estrutura supramolecular e formulação contendo a substância ativa, visto os relatos de atividade das partículas per se. Investigações como essas contribuirão para a elucidação dos mecanismos pelos quais as LNCs sem fármaco atuam em sistemas biológicos. Ainda, o aumento do número de estudos em modelos biológicos in vivo, com avaliação das terapias a longo prazo e em ciclos (a exemplo dos tratamentos para o câncer), auxiliará na translação dessa tecnologia para novos ensaios clínicos a fim de avaliar a eficácia e toxicidade em humanos.
MATERIAL SUPLEMENTAR No material suplementar encontram-se a Figura 1S que apresenta uma linha do tempo sobre o desenvolvimento e aplicações das LNCs; Figura 2S que é uma representação da complexação organometálica entre o íon Zn2+ e o aminoácido fenilalanina, utilizado como ligante modelo; Figura 3S que ilustra as principais técnicas de caracterização das LNCs; Tabela 1S com a caracterização físico-química das LNCs revestidas com poloxamer 188, polissorbato 80 e/ou lecitina; Tabela 2S com a caracterização físico-química das LNCs revestidas com quitosana; Tabela 3S com a caracterização físico-química das LNCs revestidas com PEG; Tabela 4S com a caracterização físico-química das LNCs com funcionalização de superfície; Tabela 5S que apresenta os estudos sobre toxicidade das LNCs.
AGRADECIMENTOS Este trabalho foi realizado no âmbito do Instituto Nacional de Ciência e Tecnologia em Nanotecnologia Farmacêutica: uma abordagem transdisciplinar INCT-NANOFARMA, que é financiado pela Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP, Brasil) Projeto # 2014/50928-2, e pelo Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq, Brasil) Projeto # 465687/2014-8. O presente trabalho também contou com apoio da Coordenação de Aperfeiçoamento de Pessoal de Nível Superior - Brasil (CAPES) - código de financiamento 001. Os autores também agradecem à Fundação de Amparo à Pesquisa do Estado do Rio Grande do Sul (FAPERGS).
REFERÊNCIAS 1. Nicolas, J.; Mura, S.; Brambilla, D.; Mackiewicz, N.; Haddleton, D. M.; Chem. Soc. Rev. 2013, 42, 1147. [ Crossref] 2. Frank, L. A.; Contri, R. V.; Beck, R. C. R.; Pohlmann, A. R.; Guterres, S. S.; WIREs Nanomedicine and Nanobiotechnology 2015, 7, 623. [ Crossref] 3. Apolinário, A. C.; Salata, G. C.; Bianco, A. F. R.; Fukumori, C.; Biangini, L.; Quim. Nova 2020, 43, 212. [ Crossref] 4. Vauthier, C.; J. Drug Targeting 2019, 27, 2330. [ Crossref] 5. Deng, S.; Gigliobianco, M. R.; Censi, R.; Martino, P. D.; Nanomaterials 2020, 10, 1. [ Crossref] 6. Rivas, C. J. M.; Tarhini, M.; Badri, W.; Miladi, K.; Greige-Gerges, H.; Agha, Q.; Arturo, S.; Rodríguez, G.; Álvarez, R.; Fessi, H.; Elaissari, A.; Int. J. Pharm. 2017, 532, 66. [ Crossref] 7. Crucho, C. I. C.; Barros, M. T.; Mater. Sci. Eng., C 2017, 80, 771. [ Crossref] 8. Fessi, H.; Puisieux, F.; Devissaguet, J. P.; Ammoury, N.; Benita, S.; Int. J. Pharm. 1989, 55, 1. [ Crossref] 9. Jäger, E.; Venturini, C. G.; Poletto, F. S.; Colomé, L. M.; Pohlmann, J. P. U.; Bernardi, A.; Battastini, A. M. O.; Guterres, S. S.; Pohlmann, A. R.; J. Biomed. Nanotechnol. 2009, 5, 130. [ Crossref] 10. Pohlmann, A. R.; Fonseca, F. N.; Paese, K.; Detoni, C. B.; Coradini, K.; Beck, R. C.; Guterres, S. S.; Expert Opin. Drug Delivery 2013, 10, 623. [ Crossref] 11. Fiel, L. A.; Rebêlo, L. M.; Santiago, T. M.; Adorne, M. D.; Guterres, S. S.; Sousa, J. S.; Pohlmann, A. R.; Soft Matter 2011, 7, 7240. [ Crossref] 12. de Brum, T. L.; Fiel, L. A.; Contri, R. V.; Guterres, S. S.; Pohlmann, A. R.; J. Nanosci. Nanotechnol. 2015, 15, 773. [ Crossref] 13. Venturini, C. G.; Jäger, E.; Oliveira, C. P.; Bernardi, A.; Battastini, A. M. O.; Guterres, S. S.; Pohlmann, A. R.; Colloids Surf., A 2011, 375, 200. [ Crossref] 14. Davies, S.; Contri, R. V.; Guterres, S. S.; Pohlmann, R. A.; Guerreiro, I. C. K.; Colloids Surf., B 2020, 192, 111023. [ Crossref] 15. Cé, R.; Lavayen, V.; Couto, G. K.; de Marchi, J. G. B.; Pacheco, B. P.; Natividade, L. A.; Fracari, T. O.; Ciocheta, T. M.; Cristo, A. C. S.; Jornada, D. S.; Guterres, S. S.; Seixas, F.; Collares, T.; Pohlmann, A. R.; Pharm. Res. 2021, 38, 301. [ Crossref] 16. Oliveira, N. K.; Frank, L. A.; Squizani, E. D.; Reuwsaat, J. C. V.; Marques, B. M.; Motta, H.; Garcia, A. W. A.; Kinskovski, U. P.; Barcellos, V. A.; Schrank, A.; Pohlmann, A. R.; Staats, C. C.; Guterres, S. S.; Vainstein, M. H.; Kmetzsch, L.; Eur. J. Pharm. Sci. 2021, 162, 105816. [ Crossref] 17. Kann, B.; Spengler, C.; Coradini, K.; Rigo, L. A.; Bennink, M. L.; Jacobs, K.; Offerhaus, H. L.; Beck, R. C. R.; Windbergs, M.; Anal. Chem. 2016, 88, 7014. [ Crossref] 18. D'Almeida, A. P. L.; de Oliveira, M. T. P.; de Souza, E. T.; Coutinho, D. S.; Ciambarella, B. T.; Gomes, C. R.; Terroso, T.; Guterres, S. S.; Pohlmann, A. R.; Silva, P. M. R.; Martins, M. A.; Bernardi, A.; Int. J. Nanomed. 2017, 12, 4479. [ Crossref] 19. Dimer, F. A.; Ortiz, M.; Pase, C. S.; Roversi, K.; Friedrich, R. B.; Pohlmann, A. R.; Burger, M. E.; Guterres, S. S.; J. Biomed. Nanotechnol. 2014, 10, 1137. [ Crossref] 20. Savian, A. L.; Rodrigues, D.; Weber, J.; Ribeiro, R. F.; Motta, M. H.; Schaffazick, S. R.; Adams, A. I. H.; de Andrade, D. F.; Beck, R. C. R.; da Silva, C. B.; Mater. Sci. Eng., C 2015, 46, 69. [ Crossref] 21. Bender, E. A.; Cavalcante, M. F.; Adorne, M. D.; Colomé, L. M.; Guterres, S. S.; Abdalla, D. S. P.; Pohlmann, A. R.; Pharm. Res. 2014, 31, 2975. [ Crossref] 22. Oliveira, C. P.; Büttenbender, S. L.; Prado, W. A.; Beckenkamp, A.; Asbahr, A. C.; Buffon, A.; Guterres, S. S.; Pohlmann, A. R.; Nanomaterials 2018, 8, 7. [ Crossref] 23. Bulcão, R. P.; Freitas, F. A.; Venturini, C. G.; Dallegrave, E.; Durgante, J.; Göethel, G.; Cerski, C. T. S.; Zielinsky, P.; Pohlmann, A. R.; Guterres, S. S.; Garcia, S. C.; Toxicol. Sci. 2013, 132, 162. [ Crossref] 24. Charão, M. F.; Souto, C.; Brucker, N.; Barth, A.; Jornada, D. S.; Fagundez, D.; Ávila, D. S.; Eifler-Lima, V. L.; Guterres, S. S.; Pohlmann, A. R.; Garcia, S. C.; Int. J. Nanomed. 2015, 10, 5093. [ Crossref] 25. Cé, R.; Silva, R. C.; Trentin, D. S.; de Marchi, J. G. B.; Paese, K.; Guterres, S. S.; Macedo, A. J.; Pohlmann, A. R.; J. Nanosci. Nanotechnol. 2020, 20, 1486. [ Crossref] 26. de Carvalho, F. B.; de Gomes, M. G.; Savall, A. S. P.; Fidelis, E. M.; Piton, S.; Ribeiro, A. C. F.; Munieweg, F. R.; Oelke, C. A.; Haas, S. E.; Pharmacol. Rep. 2021, 73, 563. [ Crossref] 27. Lai, P.; Daear, W.; Löbenberg, R.; Prenner, E. J.; Colloids Surf., B 2014, 118, 154. [ Crossref] 28. Jornada, D. S.; Fiel, L. A.; Bueno, K.; Gerent, J. F.; Petzhold, C. L.; Beck, R. C. R.; Guterres, S. S.; Pohlmann, A. R.; Soft Matter 2012, 8, 6646. [ Crossref] 29. Jornada, D. S.; Friedrich, R. B.; Ferrarini, S.; de Marchi, J. G.; Gerent, J. F.; de Ferreira, F. P.; Guterres, S. S.; Pohlmann, A. R.; J. Colloid Sci. Biotechnol. 2015, 4, 79. [ Crossref] 30. Bianchin, M. D.; Külkamp-Guerreiro, I. C.; de Oliveira, C. P.; Contri, R. V.; Guterres, S. S.; Pohlmann, A. R.; J. Drug Delivery Sci. Technol. 2015, 30, 180. [ Crossref] 31. Dimer, F. A.; Pohlmann, A. R.; Guterres, S. S.; J. Nanosci. Nanotechnol. 2013, 13, 8144. [ Crossref] 32. Klein, A. C.: Estudo da Influência do Solvente Orgânico e do Fluxo de Injeção no Controle de Tamanho de Nanocápsulas de Núcleo Lipídico Preparadas Através do Método de Deslocamento de Solvente; Dissertação de Mestrado, Universidade Federal do Rio Grande do Sul, Porto Alegre, Brasil, 2013. [ Link] acessado em julho 2023 33. Ortiz, M.; Coutinho, D. D. S.; Ciambarella, B. T.; de Souza, E. T.; Paula, A.; Almeida, L. D.; Durli, T. L.; Machado, P.; Bernardi, A.; Sonvico, F.; Pohlmann, A. R.; Martins, M. A.; Guterres, S. S.; Drug Delivery Transl. Res. 2020, 10, 1700. [ Crossref] 34. Jaques, J. A. S.; Doleski, P. H.; Castilhos, L. G.; da Rosa, M. M.; Souza, V. C. G.; Carvalho, F. B.; Marisco, P.; Thorstenberg, M. L. P.; Rezer, J. F. P.; Ruchel, J. B.; Coradini, K.; Beck, R. C. R.; Rubin, M. A.; Schetinger, M. R. C.; Leal, D. B. R.; Neurobiol. Learn. Mem. 2013, 100, 98. [ Crossref] 35. Gressler, L. T.; Oliveira, C. B.; Coradini, K.; Rosa, L. D.; Grando, T. H.; Baldissera, M. D.; Zimmermann, C. E.; da Silva, A. S.; Almeida, T. C.; Hermes, C. L.; Wolkmer, P.; Silva, C. B.; Moreira, K. L. S.; Beck, R. C. R.; Moresco, R. N.; da Veiga, M. L.; Stefani, L. M.; Monteiro, S. G.; Parasitology 2015, 142, 439. [ Crossref] 36. Torge, A.; Wagner, S.; Chaves, P. S.; Oliveira, E. G.; Guterres, S. S.; Pohlmann, A. R.; Titz, A.; Schneider, M.; Beck, R. C. R.; Int. J. Pharm. 2017, 527, 92. [ Crossref] 37. Poletto, F. S.; de Oliveira, C. P.; Wender, H.; Regent, D.; Donida, B.; Teixeira, S. R.; Guterres, S. S.; Rossi-Bergmann, B.; Pohlmann, A. R.; J. Nanosci. Nanotechnol. 2015, 15, 827. [ Crossref] 38. Zanotto-Filho, A.; Coradini, K.; Braganhol, E.; Schröder, R.; de Oliveira, C. M.; Simões-Pires, A.; Battastini, A. M. O.; Pohlmann, A. R.; Guterres, S. S.; Forcelini, C. M.; Beck, R. C. R.; Moreira, J. C. F.; Eur. J. Pharm. Biopharm. 2013, 83, 156. [ Crossref] 39. Venturini, C. G.; Bruinsmann, F. A.; Contri, R. V.; Fonseca, F. N.; Frank, L. A.; D'Amore, C. M.; Raffin, R. P.; Buffon, A.; Pohlmann, A. R.; Guterres, S. S.; Eur. J. Pharm. Sci. 2015, 79, 36. [ Crossref] 40. Chaves, P. S.; Ourique, A. F.; Frank, L. A.; Pohlmann, A. R.; Guterres, S. S.; Beck, R. C. R.; Eur. J. Pharm. Biopharm. 2017, 114, 88. [ Crossref] 41. Frank, L. A.; Chaves, P. S.; D'Amore, C. M.; Contri, R. V.; Frank, A. G.; Beck, R. C. R.; Pohlmann, A. R.; Buffon, A.; Guterres, S. S.; Eur. J. Pharm. Biopharm. 2017, 114, 202. [ Crossref] 42. Buss, J. H.; Begnini, K. R.; Bruinsmann, F. A.; Ceolin, T.; Sonego, M. S.; Pohlmann, A. R.; Guterres, S. S.; Collares, T.; Seixas, F. K.; Front. Oncol. 2019, 9, 1. [ Crossref] 43. Benvegnú, D. M.; Roversi, K.; Barcelos, R. C. S.; Trevizol, F.; Pase, C. S.; Segat, H. J.; Dias, V. T.; Savian, A. L.; Piccoli, B. L.; Piccolo, J.; Dutra-Filho, C. S.; Emanuelli, T.; da Silva, C. B.; Beck, R. C. R.; Burger, M. E.; Neurochem. Res. 2018, 43, 477. [ Crossref] 44. Katzer, T.; Chaves, P.; Bernardi, A.; Pohlmann, A.; Guterres, S. S.; Beck, R. C. R.; J. Microencapsulation 2014, 31, 519. [ Crossref] 45. Venturini, C. G.; Bruinsmann, F. A.; Oliveira, C. P.; Contri, R. V.; Pohlmann, A. R.; Guterres, S. S.; J. Nanosci. Nanotechnol. 2016, 16, 1310. [ Crossref] 46. Rigo, L. A.; Frescura, V.; Fiel, L.; Coradini, K.; Ourique, A. F.; Emanuelli, T.; Quatrin, A.; Tedesco, S.; da Silva, C. B.; Guterres, S. S.; Pohlmann, A. R.; Beck, R. C. R.; Pharm. Dev. Technol. 2014, 19, 789. [ Crossref] 47. Elhesaisy, N.; Swidan, S.; Sci. Rep. 2020, 10, 1. [ Crossref] 48. Oliveira, C. P.; Venturini, C. G.; Donida, B.; Poletto, F. S.; Guterres, S. S.; Pohlmann, A. R.; Soft Matter 2013, 9, 1141. [ Crossref] 49. Kalepu, S.; Manthina, M.; Padavala, V.; Acta Pharm. Sin. B 2013, 3, 361. [ Crossref] 50. Franco, C.; Antonow, M. B.; Beckenkamp, A.; Buffon, A.; Ceolin, T.; Tebaldi, M. L.; Silveira, G. P.; Guterres, S. S.; Pohlmann, A. R.; React. Funct. Polym. 2017, 119, 116. [ Crossref] 51. Cardoso, A. M.; de Oliveira, E. G.; Coradini, K.; Bruinsmann, F. A.; Aguirre, T.; Lorenzoni, R.; Barcelos, R. C. S.; Roversi, K.; Rossato, D. R.; Pohlmann, A. R.; Guterres, S. S.; Burger, M. E.; Beck, R. C. R.; Adv. Mater. Sci., Energy Technol. Environ. Eng.: Proc. Int. Conf. 2019, 96, 205. [ Crossref] 52. Bianchin, M. D.; Borowicz, S. M.; Machado, G. R. M.; Pippi, B.; Guterres, S. S.; Pohlmann, A. R.; Fuentefria, A. M.; Külkamp-Guerreiro, I. C.; Colloids Surf., B 2019, 175, 523. [ Crossref] 53. Antonow, M. B.; Lorenzoni, R.; Barbosa, G. M.; Ourique, A. F.; Gomes, P.; Raffin, R. P.; Adv. Mater. Sci. Eng. 2016, 2016, 7395896. [ Crossref] 54. Quinteros, D. A.; Ferreira, L. M.; Schaffazick, S. R.; Palma, S. D.; Allemandi, D. A.; Cruz, L.; J. Pharm. Sci. 2016, 105, 3183. [ Crossref] 55. Carletto, B.; Koga, A. Y.; Novatski, A.; Mainardes, M. R.; Lipinski, L. C.; Farago, P. V.; Colloids Surf., B 2021, 203, 111720. [ Crossref] 56. Fiel, L. A.; Adorne, M. D.; Guterres, S. S.; Netz, P. A.; Pohlmann, A. R.; Colloids Surf., A 2013, 431, 93. [ Crossref] 57. Bender, E. A.; Adorne, M. D.; Colomé, L. M.; Abdalla, D. S. P.; Guterres, S. S.; Pohlmann, A. R.; Int. J. Pharm. 2012, 426, 271. [ Crossref] 58. Cé, R.; Marchi, J. G.; Bergamo, V. Z.; Fuentefria, A. M.; Lavayen, V.; Guterres, S. S.; Pohlmann, A. R.; Colloids Surf., A 2016, 511, 153. [ Crossref] 59. Oliveira, C. P.; Prado, W. A.; Lavayen, V.; Büttenbender, S. L.; Beckenkamp, A.; Martins, B. S.; Lüdtke, D. S.; Campo, L. F.; Rodembusch, F. S.; Buffon, A.; Pessoa, A.; Guterres, S. S.; Pohlmann, A. R.; Pharm. Res. 2017, 34, 438. [ Crossref] 60. Cavalcante, M. F.; Adorne, M. D.; Turato, W. M.; Kemmerer, M.; Uchiyama, M. K.; Asbahr, A. C. C.; Alves, A. C. S.; Farsky, S. H. P.; Drewes, C.; Spatti, M. C.; Kazuma, M. S.; Boss, M.; Guterres, S. S.; Akati, K.; Brüne, B.; Namgaladze, D.; Pohlmann, A. R.; Addalla, D. S. P.; Frontiers in Medicine 2021, 8, 446. [ Crossref] 61. Bruinsmann, F. A.; Pigana, S.; Aguirre, T.; Souto, G. D.; Pereira, G. G.; Bianchera, A.; Fasiolo, L. T.; Colombo, G.; Marques, M.; Pohlmann, A. R.; Guterres, S. S.; Sonvico, F.; Pharmaceutics 2019, 11, 1. [ Crossref] 62. de Gomes, M. G.; Pereira, M. P.; Teixeira, F. E. G.; Carvalho, F.; Savall, A. S. P.; Bicca, D. F.; Fidelis, E. M.; Botura, P. E.; Cibin, F. W.; Piton, S.; Hass, S. E.; Biomed. Pharmacother. 2020, 121, 109575. [ Crossref] 63. dos Santos, R. B.; Nakama, K. A.; Pacheco, C. O.; de Gomes, M. G.; de Souza, J. F.; Pinto, A. C. S.; de Oliveira, F. A.; da Fonseca, A. L.; Varotti, F.; Fajardo, A. R.; Hass, S. E.; Mater. Sci. Eng., C 2021, 118, 111356. [ Crossref] 64. Frank, L. A.; Gazzi, R. P.; Mello, P. A.; Buffon, A.; Pohlmann, A. R.; Guterres, S. S.; Eur. J. Pharm. Biopharm. 2019, 136, 9. [ Crossref] 65. Alves, A. C. S.; Lavayen, V.; Figueiró, F.; Dallemole, D. R.; Dias, A. F.; Cé, R.; Battastini, A. M. O.; Guterres, S. S.; Pohlmann, A. R.; Pharm. Res. 2020, 37, 91. [ Crossref] 66. Torchilin, V. P.; Nat. Rev. Drug Discovery 2014, 13, 813. [ Crossref] 67. Nishihira, V. S. K.; Fontana, B. D.; Ianiski, F. R.; de Almeida, H. S.; Posser, C. P.; Dias, J. B.; Parodi, C. B.; Piva, M. M.; Gris, A.; Mendes, R. E.; Duarte, M. M. M. F.; Sagrillo, M. R.; Luchese, C.; Rech, V. C.; Vaucher, R. A.; Biomed. Pharmacother. 2018, 107, 1259. [ Crossref] 68. Pereira, M. P.; de Gomes, M. G.; Izoton, J. C.; Nakama, K. A.; dos Santos, R. B.; Savall, A. S. P.; Ramalho, J. B.; Roman, S. S.; Luchese, C.; Cibin, F. W.; Pinton, S.; Haas, S. E.; Biomed. Pharmacother. 2019, 116, 109014. [ Crossref] 69. Onzi, G.; Guterres, S. S.; Pohlmann, A. R.; Frank, L. A.; The ADME Encyclopedia, 1st ed.; Springer: Cham, 2021. [ Crossref] 70. Michalowski, C. B.; Arbo, M. D.; Altknecht, L.; Anciuti, A. N.; Abreu, A. S. G.; Alencar, L. M. R.; Pohlmann, A. R.; Garcia, S. C.; Guterres, S. S.; Pharmaceutics 2020, 12, 1. [ Crossref] 71. Cavalcante, M. F.; Kazuma, S. M.; Bender, E. A.; Adorne, M. D.; Ullian, M.; Veras, M. M.; Saldiva, P. H. N.; Maranhão, A. Q.; Guterres, S. S.; Pohlmann, A. R.; Abdalla, D. S. P.; Eur. J. Pharm. Biopharm. 2016, 107, 120. [ Crossref] 72. Antonow, M. B.; Franco, C.; Prado, W.; Beckenkamp, A.; Silveira, G. P.; Buffon, A.; Guterres, S. S.; Pohlmann, A. R.; Nanomaterials 2017, 8, 2. [ Crossref] 73. Alves, A. C. S.; Lavayen, V.; Dias, A. F.; Bruinsmann, F. A.; Scholl, J. N.; Cé, R.; Visioli, F.; Battastini, A. M. O.; Guterres, S. S.; Figueiró, F.; Pohlmann, A. R.; Nanomedicine 2021, 16, 1775. [ Crossref] 74. Dallemole D. R.; Terroso, T.; Alves, A. C. S.; Scholl, J. N.; Onzi, G. R.; Cé, R.; Paese, K.; Battastini, A. M. O.; Guterres, S. S.; Figueiró, F.; Pohlmann A. R.; Pharmaceutics 2021, 13, 862. [ Crossref] 75. Mayer, F. Q.; Adorne, M. D.; Bender, E. A.; de Carvalho, T. G.; Dilda, A. C.; Beck, R. C. R.; Guterres, S. S.; Giugliani, R.; Matte, U.; Pohlmann, A. R.; Pharm. Res. 2015, 32, 941. [ Crossref] 76. Poletto F. S.; Fiel A. L.; Lopes M. V.; Schaab G.; Gomes A. M. O.; Guterres S. S.; Rossi-Bergmann, B.; Pohlmann A. R.; J. Colloid Sci. Biotechnol. 2012, 1, 89. [ Crossref] 77. Rodrigues, S. F.; Fiel, L. A.; Shimada, A. L.; Pereira, N. R.; Guterres, S. S.; Pohlmann, A. R.; Farsky, S. H.; J. Biomed. Nanotechnol. 2016, 12, 986. [ Crossref] 78. Antonow, M. B.; Asbahr, A. C. C.; Raddatz, P.; Beckenkamp, A.; Buffon, A.; Guterres, S. S.; Pohlmann, A. R.; Adv. Mater. Sci., Energy Technol. Environ. Eng.: Proc. Int. Conf. 2017, 76, 374. [ Crossref] 79. Pereira, N. R. C.; Loiola, R. A.; Rodrigues, S. F.; de Oliveira, C. P.; Büttenbender, S. L.; Guterres, S. S.; Pohlmann, A. R.; Farsky, S. H.; Int. J. Nanomed. 2018, 13, 4563. [ Crossref] 80. Fiel, L. A.; Contri, R. V.; Bica, J. F.; Figueiró, F.; Battastini, A. M. O.; Guterres, S. S.; Pohlmann, A. R.; Nanoscale Res. Lett. 2014, 9, 1. [ Crossref] 81. Vetten, M. A.; Yah, C. S.; Singh, T.; Gulumian, M.; Nanomedicine: Nanotechnology, Biology and Medicine 2014, 10, 1391. [ Crossref] 82. Paese, K.; Ortiz, M.; Frank, L. A.; Külkamp-Guerreiro, I. C.; Rolim, C. M. B.; Barros, D. M.; Pohlmann, A. R.; Guterres, S. S.; AAPS PharmSciTech 2017, 18, 212. [ Crossref] 83. Calgaroto, S.; Fauri, L. E.; Frank, L. A.; Paese, K.; Guterres, S. S.; Pohlmann, A. R.; React. Funct. Polym. 2018, 133, 161. [ Crossref] 84. Sandri, S.; Hebeda, C. B.; Loiola, R. A.; Calgaroto, S.; Uchiyama, M. K.; Araki, K.; Frank, L. A.; Paese, K.; Guterres, S. S.; Pohlmann, A. R.; Farsky, S. H. P.; Nanomedicine 2019, 14, 1429. [ Crossref] 85. Gazzi, R. P.; Contri, R. V.; Pohlmann, A. R.; Guterres, S. S.; Frank, L. A.; The ADME Encyclopedia, 1st ed.; Springer: Cham, 2021. [ Crossref] 86. Lorenzoni, R.; Davies, S.; Cordenonsi, L. M.; Viçosa, J. A. S.; Mezzomo, N. J.; de Oliveira, A. L.; do Carmo, G. M.; Raffin, R. P.; Alves, O. L.; Vaucher, R. A.; Rech, V. R.; Eur. J. Pharm. Sci. 2020, 151, 105397. [ Crossref] 87. Wulsten, E.; Kiekens, F.; van Dycke F.; Voorspoels, J.; Lee, G.; Int. J. Pharm. 2009, 378, 116. [ Crossref] 88. Bhattacharjee, S.; J. Controlled Release 2016, 235, 337. [ Crossref] 89. Maguire, C. M.; Rösslein, M.; Wick, P.; Prina-Mello, A.; Sci. Technol. Adv. Mater. 2018, 19, 732. [ Crossref] 90. Bulcão, R. P.; Bubols, G. B.; Nascimento, S. N.; Gauer, B.; Sauer, E.; Baierle, M.; Charão, M. F.; Moro, A.; Brucker, N.; Bruinsmann, F. A.; Schnorr, C.; Moreira, J. C. F.; Pohlmann, A. R.; Guterres, S. S.; Garcia, S. C.; Toxicol. Res. (Cambridge, U. K.) 2015, 4, 994. [ Crossref] 91. Veragten, A.; Contri, R. V.; Betti, A. H.; Herzfeldt, V.; Frank, L. A.; Pohlmann, A. R.; Rates, S. M. K.; Guterres, S. S.; React. Funct. Polym. 2020, 148, 104493. [ Crossref] 92. Ushirobira, C. Y.; Afiune, L. A. F.; Pereira, M. N.; Cunha-Filho, M.; Gelfuso, G. M.; Gratieri, T.; Int. J. Biol. Macromol. 2020, 151, 56. [ Crossref] 93. Cé, R.; Pacheco, B. Z.; Ciocheta, T. M.; Barbosa, F. S.; Alves, A. C. S.; Dallemole, D. R.; Lavayen, V.; Guterres, S. S.; Steppe, M.; Pohlmann, A. R.; React. Funct. Polym. 2021, 162, 104876. [ Crossref] 94. Agência Nacional de Vigilância Santária (ANVISA); RDC nº 166, de 24 de julho de 2017. [ Link] acessado em julho 2023 95. International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use (ICH); Validation of Anatical Procedures: Text and Methodology Q2(R1), 2005. [ Link] acessado em julho 2023 96. Pissinate, K.; Martins-Duarte S. E.; Schaffazick, S. R.; de Oliveira, C. P.; Vommaro, R. C.; Guterres, S. S.; Pohlmann, A. R.; de Souza, W.; Parasitol. Res. 2014, 113, 555. [ Crossref] 97. Nakama, K. A.; dos Santos, R. B.; Silva, C. E. R.; Izoton, J. C.; Savall, A. S. P.; Gutirrez, M. E. Z.; Roman, S. S.; Luchese, C.; Pinton, S.; Haas, S. E.; Arabian J. Chem. 2020, 13, 2456. [ Crossref] 98. Dimer, F. A.; Pigatto, M. C.; Pohlmann, A. R.; Costa, T. D.; Guterres, S. S.; Quim. Nova 2014, 37, 1371. [ Crossref] 99. Friedrich, R. B.; Dimer, F. A.; Guterres, S. S.; Beck, R. C. R.; Pohlmann, A. R.; J. Biomed. Nanotechnol. 2014, 10, 1599. [ Crossref] 100. Blanco, E.; Shen, H.; Ferrari, M.; Nat. Biotechnol. 2015, 9, 941. [ Crossref] 101. Oliveira, E. G.; Cardoso, A. M.; Paese, K.; Coradini, K.; de Oliveira, C. V.; Pohlmann, A. R.; Oliveira, M. S.; Guterres, S. S.; Beck, R. C. R.; Int. J. Pharm. 2018, 551, 121. [ Crossref] 102. Friedrich, R. B.; Bastos, M. O.; Fontana, M. C.; Ourique, A. F.; Beck, C. R.; J. Nanosci. Nanotechnol. 2010, 10, 5885. [ Crossref] 103. Casarini, T. P. A.; Frank, L. A.; Benin, T.; Onzi, G.; Pohlmann, A. R.; Guterres, S. S.; Mater. Sci. Eng., C 2020, 120, 111681. [ Crossref] 104. Gazzi, R. P.; Frank, L. A.; Onzi, G.; Pohlmann, A. R.; Guterres, S. S.; Drug Delivery Transl. Res. 2020, 10, 1829. [ Crossref] 105. Dias, A. F.; Dallemole, D. R.; Bruinsmann, F. A.; Silva, L. F. L.; Cruz-López, O.; Conejo-García, A.; Battastini, A. M. O.; Campos, J. M.; Guterres, S. S.; Pohlmann, A. R.; Figueiró, F.; Nanomedicine 2021, 16, 2095. [ Crossref] 106. Souza-Batista, A. J.; Poletto, F. S.; Philipon, C. I. M. S.; Guterres, S. S.; Pohlmann, A. R.; Rossi-Bergmann, B.; Parasitology 2017, 144, 1769. [ Crossref] 107. Subhan, M. A.; Yalamart, S. S. K.; Filipczak, N.; Parveen, F.; Torchilin, V. P.; J. Pers. Med. 2021, 11, 571. [ Crossref] 108. Bernardi, A.; Frozza, R. L.; Hoppe, J. B.; Salbego, C.; Pohlmann, A. R.; Guterres, S. S.; Int. J. Nanomed. 2013, 8, 711. [ Crossref] 109. Figueiró, F.; Bernardi, A.; Frozza, R. L.; Terroso, T.; Zanotto-Filho, A.; Jandrey, E. H. F.; Moreira, J. C. F.; Salbego, C. G.; Edelweiss, M. I.; Pohlmann, A. R.; Guterres, S. S.; Battastini, A. M. O.; J. Biomed. Nanotechnol. 2013, 9, 516. [ Crossref] 110. Schultze, E.; Ourique, A.; Yurgel, V. C.; Begnini, K. R.; Thurow, H.; de Leon, P. M. M.; Campos, V. F.; Dellagostin, O. A.; Guterres, S. R.; Pohlmann, A. R.; Seixas, F. K.; Beck, R. C. R.; Collares, T.; Eur. J. Pharm. Biopharm. 2014, 87, 55. [ Crossref] 111. Schultze, E.; Buss, J.; Coradini, K.; Begnini, K. R.; Guterres, S. S.; Collares, T.; Beck, R. C. R.; Pohlmann, A. R.; Seixas, F. K.; Biomed. Pharmacother. 2017, 96, 404. [ Crossref] 112. Yurgel, V. C.; Oliveira, C. P.; Begnini, K. R.; Schultze, E.; Thurow, H. S.; Leon, P. M. M.; Dellagostin, O. A.; Campos, V. F.; Beck, R. C. R.; Guterres, S. S.; Collares, T.; Pohlmann, A. R.; Seixas, F. K.; Int. J. Nanomed. 2014, 9, 1583. [ Crossref] 113. Figueiró, F.; de Oliveira, C. P.; Rockenbach, L.; Mendes, F. B.; Bergamin, L. S.; Jandrey, E. H. F.; Edelweiss, M. I.; Guterres, S. S.; Pohlmann, A. R.; Battastini, A. M. O.; J. Biomed. Nanotechnol. 2015, 11, 1808. [ Crossref] 114. Drewes, C. C.; Fiel, L. A.; Bexiga, C. G.; Asbahr, A. C. C.; Uchiyama, M. K.; Cogliati, B.; Araki, K.; Guterres, S. S.; Pohlmann, A. R.; Farsky, S. P.; Int. J. Nanomed. 2016, 11, 1261. [ Crossref] 115. Bruinsmann, F. A.; Buss, J. H.; Souto, G. D.; Schultze, E.; de Alves, A. C. S.; Seixas, F. K.; Collares, T. V.; Pohlmann, A. R.; Guterres, S. S.; AAPS PharmSciTech 2020, 21, 1. [ Crossref] 116. Vasconcelos, A. G.; Valim, M. O.; Amorim, A. G. N.; Pais, C.; Peixoto, M.; Almeida, D.; Borges, T. K. S.; Socodato, R.; Brand, G. D.; Saraiva, J.; Mattos, C.; Relvas, J.; Plácido, A.; Eaton, P.; Ramos, D. A. R.; Kückelhaus, S. A. S.; Roberto, J.; Leite, S. A.; Food Res. Int. 2020, 136, 109548. [ Crossref] 117. Drewes, C. C.; Alves, A. C.; Hebeda, C. B.; Copetti, I.; Sandri, S.; Uchiyama, M. K.; Araki, K.; Guterres, S. S.; Pohlmann, A. R.; Farsky, S. H.; Int. J. Nanomed. 2017, 12, 7153. [ Crossref] 118. Cé, R.; Couto, G. K.; Pacheco, B. Z.; Dallemole, D. R.; Paschoal, J. D.; Pacheco, B. S.; Guterres, S. S.; Seixas, F.; Collares, T.; Pohlmann, A. R.; Eur. J. Pharm. Sci. 2021, 165, 105943. [ Crossref] 119. Figueiró, F.; de Oliveira, C. P.; Bergamin, L. S.; Rockenbach, L.; Mendes, F. B.; Jandrey, E. H. F.; Moritz, C. E. J.; Pettenuzzo, L. F.; Sévigny, J.; Guterres, S. S.; Pohlmann, A. R.; Battastini, A. M. O.; Purinergic Signalling 2016, 12, 303. [ Crossref] 120. Li, X.; Tsibouklis, J.; Weng, T.; Zhang, B.; Yin, G.; Feng, G.; Cui, Y.; Savina, I. N.; Mikhalovska, L. I.; Susan, R.; Howel, C. A.; Mikhalovsky, S. V.; Li, X.; Tsibouklis, J.; Weng, T.; Zhang, B.; Yin, G.; Feng, G.; Cui, Y.; Savina, I. N.; Mikhalovska, L. I.; Sandeman, S. R.; J. Drug Targeting 2017, 25, 2330. [ Crossref] 121. Dimer, F. A.; Pigatto, M. C.; Boque, C. A.; Pase, C. S.; Roversi, K.; Pohlmann, A. R.; Burger, M. E.; Rates, S. M. K.; Costa, T. D.; Guterres, S. S.; J. Biomed. Nanotechnol. 2015, 11, 1482. [ Crossref] 122. Carreño, F.; Paese, K.; Silva, C. M.; Guterres, S. S.; Costa, T. D.; Mol. Pharmaceutics 2016, 13, 1289. [ Crossref] 123. Carreño, F.; Paese, K.; Silva, C. M.; Guterres, S. S.; Costa, T. D.; J. Pharm. Biomed. Anal. 2016, 119, 152. [ Crossref] 124. Carreño, F.; Helfer, V. E.; Staudt, K. J.; Olivo, L. B.; Paese, K.; Meyer, F. S.; Herrmann, A. P.; Guterres, S. S.; Rates, S. M. K.; Trocóniz, I.; Costa, T. D.; J. Pharmacol. Exp. Ther. 2020, 375, 49. [ Crossref] 125. Carreño, F.; Helfer, V. E.; Staudt, K. J.; Paese, K.; Meyer, F. S.; Herrmann, A. P.; Guterres, S. S.; Rates, S. M. K.; Costa, T. D.; Schizophr. Res. 2020, 218, 173. [ Crossref] 126. Oliveira, E. G.; de Oliveira, R. S.; Zatta, K. C.; Furian, A. F.; Oliveira, M. S.; Pohlmann, A. R.; Guterres, S. S.; Beck, R. C. R.; Mater. Sci. Eng., C 2020, 111, 110753. [ Crossref] 127. Karthivashan G.; Ganesan, P.; Park, S.; Kim, J.; Choi, D.; Drug Delivery 2018, 25, 307. [ Crossref] 128. Frozza, R. L.; Bernardi, A.; Hoppe, J. B.; Meneghetti, A. B.; Battastini, A. M. O.; Pohlmann, A. R.; Guterres, S. S.; Salbego, C.; J. Biomed. Nanotechnol. 2013, 9, 2086. [ Crossref] 129. Frozza, R. L.; Bernardi, A.; Hoppe, J. B.; Meneghetti, A. B.; Matté, A.; Battastini, A. M. O.; Pohlmann, A. R.; Guterres, S. S.; Salbego, C.; Mol. Neurobiol. 2013, 47, 1066. [ Crossref] 130. Hoppe, J. B.; Coradini, K.; Frozza, R. L.; Oliveira, C. M.; Meneghetti, A. B.; Bernardi, A.; Pires, E. S.; Beck, R. C. R.; Salbego, C. G.; Neurobiol. Learn. Mem. 2013, 106, 134. [ Crossref] 131. Giacomeli, R.; Izoton, J. C.; dos Santos, R. B.; Boeira, S. P.; Jesse, C. R.; Haas, S. E.; Brain Res. 2019, 1721, 146325. [ Crossref] 132. Fidelis, E. M.; Savall, A. S. P.; Abreu, E. L.; Carvalho, F.; Teixeira, F. E. G.; Haas, S. E.; Sampaio, T. B.; Pinton, S.; Neuroscience 2019, 423, 122. [ Crossref] 133. Ianiski, F. R.; Alves, C. B.; Ferreira, C. F.; Rech, V. C.; Savegnago, L.; Wilhelm, E. A.; Luchese, C.; Metab. Brain Dis. 2016, 4, 793. [ Crossref] 134. Gutierrez, M. E. Z.; Savall, A. S. P.; Abreu, E. L.; Nakama, K. A.; Santos, R. B. S.; Guedes, M. C. M.; Ávila, D. S.; Luchese, C.; Haas, S. E.; Quines, C. B.; Pinton, S.; Neural Regener. Res. 2021, 16, 783. [ Crossref] 135. Giacomeli, R.; de Gomes, M. G.; Reolon, J. B.; Haas, S. E.; Colomé, L. M.; Jesse, C. R.; Behav. Brain Res. 2020, 390, 112696. [ Crossref] 136. Bedi, O.; Dhawan, V.; Sharma, P. L.; Kumar, P.; Naunyn-Schmiedeberg's Arch. Pharmacol. 2016, 389, 695. [ Crossref] 137. Lorenzoni, R.; Cordenonsi, L. M.; Davies, S.; Antonow, M. B.; Diedrich, A. S. M.; Santos, C. G.; Vitalis, G. S.; Garrastazu, G.; Buttini, F.; Sonvico, F.; Gomes, P.; Raffin, R. P.; J. Microencapsulation 2019, 36, 317. [ Crossref] 138. de Gomes, M. G.; Teixeira, F. E. G.; de Carvalho, F. B.; Pacheco, C. O.; da Silva Neto, M. R.; Giacomeli, R.; Ramalho, J. B.; dos Santos, R. B.; Domingues, W. B.; Campos, V. F.; Haas, S. E.; J. Neuroimmunol. 2020, 345, 577270. [ Crossref] 139. Chaves, P. S.; Frank, L. A.; Torge, A.; Schneider, M.; Pohlmann, A. R.; Guterres, S. S.; Beck, R. C. R.; Powder Technol. 2019, 354, 348. [ Crossref] 140. Menezes, P. P.; Frank, L. A.; Lima, B. S.; de Carvalho, Y. M. B. G.; Serafini, M. R.; Quintans-Júnior, L. J.; Pohlmann, A. R.; Guterres, S. S.; Araújo, A. A. S.; Int. J. Nanomed. 2017, 12, 2069. [ Crossref] 141. Shahraki, A.; Bahadorikhalili, S.; Hashemzaei, M.; Hajinezhad, M.; Afsharimoghaddam, A.; Sarani, F.; Tajrobekar, O.; Biosci. Biotechnol. Res. Commun. 2017, 10, 623. [ Crossref] 142. Zancan, L. R.; Bruinsmann, F. A.; Paese, K.; Türck, P.; Bahr, A.; Zimmer, A.; Carraro, C. C.; Schenkel, P. C.; Belló-Klein, A.; Schwertz, C. I.; Driemeier, D.; Pohlmann, A. R.; Guterres, S. S.; Int. J. Pharm. 2021, 15, 121181. [ Crossref] 143. Leão, M. C.; Pohlmann, A. R.; Alves, A. C. S.; Farsky, S. H. P.; Uchiyama, M. K.; Araki, K.; Sandri, S.; Guterres, S. S.; Castro, I. A.; Eur. J. Pharm. Biopharm. 2021, 159, 99. [ Crossref] 144. Andrade, T. D. A.; Menezes, P.; de Carvalho, Y. M. G.; Lima, B. S.; de Souza, E. P. B. S. S.; Araujo, A. A. S.; Melo, M. A. O.; Quintans-Júnior, L. J.; Quintans, J. S. S.; Guterres, S. S.; Pohlmann, A. R.; Shanmugan, S.; Frank, L. A.; Serafini, M. R.; AAPS PharmSciTech 2020, 21, 184. [ Crossref] 145. Ianiski, F. R.; da Silva, F. D. A.; Wilhelm, E. A.; Fernandes, R. S.; Alves, M. P.; Duarte, M. M. M. F.; Luchese, C.; J. Appl. Biomed. 2015, 14, 105. [ Crossref] 146. Villalba, B. T.; Ianiski, F. R.; Wilhelm, E. A.; Fernandes, R. S.; Alves, M. P.; Luchese, C.; Life Sci. 2014, 115, 36. [ Crossref] 147. de Oliveira, M. T. P.; Coutinho, D. S.; de Souza, E. T.; Guterres, S. S.; Pohlmann, A. R.; Silva, P. M. R.; Martins, M. A.; Bernardi, A.; Int. J. Nanomed. 2019, 14, 5215. [ Crossref] 148. Rigo, L. A.; Carvalho-Wordarz, C. S.; Pohlmann, A. R.; Guterres, S. S.; Schneider-Daum, N.; Lehr, C. M.; Beck, R. C. B.; Eur. J. Pharm. Biopharm. 2017, 119, 1. [ Crossref] 149. Coradini, K.; Friedrich, R. B.; Fonseca, F. N.; Vencato, M. S.; Andrade, D. F.; Oliveira, C. M.; Battistel, A. P.; Guterres, S. S.; da Rocha, M. I. U. M.; Pohlmann, A. R.; Beck, R. C. R.; Eur. J. Pharm. Sci. 2015, 78, 163. [ Crossref] 150. Silveira, K. L.; da Silveira, L. L.; Thorstenberg, M. L. P.; Cabral, F. L.; Castilhos, L. G.; Rezer, J. F. P.; de Andrade, D. F.; Beck, R. C. R.; Palma, H. E.; de Andrade, C. M.; Pereira, R. S.; Martins, N. M. B.; dos Santos, C. M. B.; Leal, D. B. R.; Cell Biochem. Funct. 2016, 34, 262. [ Crossref] 151. Silva, J. L. G.; Passos, D. F.; Bernardes, V. M.; Cabral, F. L.; Schimites, P. G.; Manzoni, A. G.; de Oliveira, E. G.; da Silva, C. B.; Beck, R. C. R.; Jantsch, M. H.; Maciel, R. M.; Leal, D. B. R.; Inflammation 2019, 42, 1595. [ Crossref] 152. Boechat, A. L.; de Oliveira, C. P.; Tarrago, A. M.; da Costa, A. G.; Malheiro, A.; Guterres, S. S.; Pohlmann, A. R.; Int. J. Nanomed. 2015, 10, 6603. [ Crossref] 153. Friedrich, R. B.; Coradini, K.; Fonseca, F. N.; Guterres, S. S.; Beck, R. C. R.; Pohlmann, A. R.; J. Nanosci. Nanotechnol. 2016, 16, 1265. [ Crossref] 154. Burza, S.; Croft, S. L.; Boelaert, M.; Lancet 2018, 6736, 1. [ Crossref] 155. Escrivani, D. O.; Lopes, M. V.; Poletto, F.; Ferrarini, S. R.; Sousa-Batista, A. J.; Steel, P. G.; Guterres, S. S.; Pohlmann, A. R.; Rossi-Bergmann, B.; Nanomedicine: Nanotechnology, Biology and Medicine 2020, 24, 102121. [ Crossref] 156. Melero, A.; Ourique, A. F.; Guterres, S. S.; Pohlmann, A. R.; Lehr, C. M.; Beck, R. C. R.; Schaefer, U.; Skin Pharmacol. Physiol. 2014, 27, 217. [ Crossref] 157. Friedrich, R. B.; Kann, B.; Coradini, K.; Offerhaus, H. L.; Beck, R. C. R.; Windbergs, M.; Eur. J. Pharm. Sci. 2015, 78, 204. [ Crossref] 158. Mathes, C.; Melero, A.; Conrad, P.; Vogt, T.; Rigo, L.; Selzer, D.; Prado, W. A.; de Rossi, C.; Garrigues, T. M.; Hansen, S.; Guterres, S. S.; Pohlmann, A. R.; Beck, R. C. R.; Lehr, C. M.; Schaefer, U. F.; J. Controlled Release 2016, 223, 207. [ Crossref] 159. Lopes, C. E.; Langoski, G.; Klein, T.; Ferrari, P. C.; Farago, P. V.; Braz. J. Pharm. Sci. 2017, 53, e15250. [ Crossref] 160. Bazana, M. T.: Desenvolvimento de Géis-Creme a partir do Produto Liofilizado Contendo Nanocápsulas de Óleo de Borragem e Diproprionato de Betametasona; Dissertação de Mestrado, Universidade Federal de Santa Maria, Santa Maria, Brasil, 2015. [ Link] acessado em julho 2023 161. Chaves, P. D. S.; Frank, L. A.; Frank, A. G.; Pohlmann, A. R.; Guterres, S. S.; Beck, R. C. R.; AAPS PharmSciTech 2018, 19, 1637. [ Crossref] 162. Pires, J.; Cargnin, S. T.; Costa, S. A.; Sinhorin, V. D. G.; Damazo, A. S.; Sinhorin, A. P.; Bicudo, R. C.; Cavalheiro, L.; Valladão, D. M. S.; Pohlmann, A. R.; Guterres, S. S.; Ferrarini, S. R.; Eur. J. Pharm. Sci. 2020, 150, 105356. [ Crossref] 163. Külkamp-Guerreiro, I. C.; Souza, M. N.; Bianchin, M. D.; Isoppe, M.; Freitas, J. S.; Alves, J. A.; Piovezan, A. P.; Pohlmann, A. R.; Guterres, S. S.; Acta Cirúrgica Brasileira 2013, 28, 708. [ Crossref] 164. Rigo, L. A.; da Silva, C. R.; de Oliveira, S. M.; Cabreira, T. N.; da Silva, C. B.; Ferreira, J.; Beck, R. C. R.; Eur. J. Pharm. Biopharm. 2015, 93, 11. [ Crossref] 165. Bueno, K.; Adorne, M.; Jornada, D. S.; da Fonseca, F.; Guterres, S.; Pohlmann, A.; Curr. Pharm. Des. 2013, 19, 7294. [ Crossref] 166. Terroso, T. F.; Condotta, K. B.; da Fonseca, F. N.; Jornada, D. S.; Ferreira, G. O.; Ellwanger, J. H.; Schmidt, J. A.; Pohlmann, A. R.; Guterres, S. S.; J. Drug Delivery Sci. Technol. 2016, 36, 99. [ Crossref] 167. Weber, J.; Funk, N. L.; Motta, M. H.; Guedes, A. M.; Visintainer, A. P. C.; Tedesco, S. B.; da Silva, C. D. B.; J. Nanosci. Nanotechnol. 2016, 16, 1354. [ Crossref] 168. Villalba, B. T.; Ianiski, F. R.; Vogt, A. G.; Pinz, M. P.; Reis, A. S.; Vaucher, R. A.; Soares, M. P.; Wihelm, E. A.; Luchese, C.; Regul. Toxicol. Pharmacol. 2016, 81, 316. [ Crossref] 169. Roversi, K.; Benvegnú, D. M.; Roversi, K.; Trevizol, F.; Vey, L. T.; Elias, F.; Fracasso, R.; Motta, M. H.; Ribeiro, R. F.; Hausen, B. S.; Moresco, R. N.; Garcia, S. C.; da Silva, C. B.; Burger, M. E.; J. Nanopart. Res. 2015, 17, 199. [ Crossref] 170. Parini, R.; Deodato, F.; Di Rocco, M.; Lanino, E.; Locatelli, F.; Messina, C.; Rovelli, A.; Scarpa, M.; Orphanet Journal of Rare Disease 2017, 12, 112. [ Crossref] 171. Lucas, C. G.; Remião, M. H.; Bruinsmann, F. A.; Lopes, I. A. R.; Borges, M. A.; Feijó, A. L. S.; Basso, A. C.; Pohlmann, A. R.; Guterres, S. S.; Campos, V. F.; Seixas, F. K.; Collares, T.; Toxicol. In Vitro 2017, 45, 194. [ Crossref] 172. Lucas, C. G.; Remião, M. H.; Komninou, E. R.; Domingues, W. B.; Haas, C.; de Leon, P. M. M.; Campos, V. F.; Ourique, A.; Guterres, S. S.; Pohlmann, A. R.; Basso, A. C.; Seixas, F. K.; Beck, R. C. R.; Collares, T.; Reprod. Toxicol. 2015, 58, 131. [ Crossref] 173. Komninou, E. R.; Remião, M. H.; Lucas, C. G.; Domingues, W. B.; Basso, A. C.; Jornada, D. S.; Deschamps, J. C.; Beck, R. C. R.; Pohlmann, A. R.; Bordignon, V.; Seixas, F. K.; Campos, V. F.; Guterres, S. S.; Collares, T.; PLoS One 2016, 11, 1. [ Crossref] 174. Remião, M. H.; Lucas, C. G.; Domingues, W. B.; Silveira, T.; Barther, N. N.; Komninou, E. R.; Basso, A. C.; Jornada, D. S.; Beck, R. C. R.; Pohlmann, A. R.; Varela Junior, A. S.; Seixas, F. K.; Campos, V. F.; Guterres, S. S.; Collares, T.; Reprod. Toxicol. 2016, 63, 70. [ Crossref] 175. Silva, A. C. J.; Remião, M. H.; Lucas, C. G.; Domingues, B.; Silveira, T.; Paschoal, J. D.; Jornada, D. S.; Corcine, C. D.; Varela Junior, A. S.; Prado, W.; Campos, V. F.; Seixas, F. K.; Guterres, S. S.; Pohlmann, A. R.; Collares, T.; Toxicol. In Vitro 2017, 40, 214. [ Crossref] 176. Fischer, H. C.; Chan, W. C. W.; Curr. Opin. Biotechnol. 2007, 18, 565. [ Crossref] 177. Sharma, S.; Parveen, R.; Chatterji, B. P.; Curr. Pathobiol. Rep. 2021, 9, 133. [ Crossref] 178. Bulcão, R. P.; de Freitas, F. A.; Dallegrave, E.; Venturini, C. G.; Baierle, M.; Durgante, J.; Sauer, E.; Cassini, C.; Cerski, C. T.; Zielinsky, P.; Salvador, M.; Pohlmann, A. R.; Guterres, S. S.; Garcia, S. C.; Eur. J. Pharm. Biopharm. 2014, 86, 167. [ Crossref] 179. Fracasso, R.; Baierle, M.; Goëthel, G.; Barth, A.; Freitas, F.; Nascimento, S.; Altknecht, L.; Olsen, V.; Paese, K.; da Silva, V. D.; Castro, I.; Andrades, M.; Clausell, N.; Pohlmann, A.; Guterres, S.; Garcia, S. C.; Toxicol. Res. (Cambridge, U. K.) 2015, 5, 168. [ Crossref] 180. Giacomeli, R.; Teixeira, F. E. G.; Carvalho, F. B.; Pacheco, C. O.; Parisotto, A. J. M.; Ribeiro, A. C. F.; de Gomes, M. G.; Haas, S. E.; Food Chem. Toxicol. 2020, 144, 111625. [ Crossref] 181. Charão, M. F.; Baierle, M.; Gauer, B.; Goethel, G.; Fracasso, R.; Paese, K.; Brucker, N.; Moro, A. M.; Bubols, G. B.; Dias, B. B.; Matte, U. S.; Guterres, S. S.; Pohlmann, A. R.; Garcia, S. C.; Mutat. Res., Genet. Toxicol. Environ. Mutagen. 2015, 784-785, 1. [ Crossref] 182. Charão, M. F.; Goethel, G.; Brucker, N.; Paese, K.; Eifler-Lima, V. L.; Pohlmann, A. R.; Guterres, S. S.; Garcia, S. C.; BMC Pharmacol. Toxicol. 2019, 20, 1. [ Crossref] 183. https://clinicaltrials.gov/ct2/show/NCT04219358, acessada em julho 2023. 184. Polhmann, A. R.; Guterres, S. S.; Jäger, A.; WO 2010/040194 A2 2010. 185. Polhmann, A. R.; Guterres, S. S.; Jäger, A.; PI0904197-4 A2 2011. 186. Polhmann, A. R.; Jornada, D. S.; Guterres, S. S.; BR 10 2012 022034-2 A2 2012. 187. Polhmann, A. R.; Jornada, D. S.; Guterres, S. S.; PCT-WO 2014/032151 A1 2014. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access