Artigo
|
|
| Extratos pirolenhosos de casca de coco, acácia negra e eucalipto: caracterização físico-química e avaliação in vitro como potenciais inibidores da urease Pyroligneous acids of coconut shell, black wattle and eucalyptus: physical-chemical characterization and in vitro evaluation as potential urease inhibitors |
|
Núbia Rangel CândidoI; Luzia Valentina ModoloII; Vânya Márcia Duarte PasaI; Ângelo de FátimaI*
I. Departamento de Química, Universidade Federal de Minas Gerais, 31270-901 Belo Horizonte - MG, Brasil Recebido em 24/01/2023 *e-mail: adefatima@qui.ufmg.br The increase in food production to meet the demand of the world's growing population is largely conditioned by the efficiency of agricultural fertilizers. The development of relatively low-cost urease inhibitors and more environmentally friendly ones is a challenge for agriculture, especially because urea is the most used nitrogen fertilizer globally. The pyroligneous acid (PA), a by-product of wood charcoal production, stimulates plant growth, increases crop productivity, improves microbial metabolism, and induces plant tolerance to (a)biotic stresses. This work investigated the in vitro urease inhibitory potential of tree PAs of distinct plant biomass origin and production process. Coconut (Cocus nucifera) shell PA showed the highest urease inhibitory activity, followed by black wattle (Acacia mearnsii) PA and eucalyptus (Eucalyptus urograndis, a hybrid of Eucalyptus grandis and Eucalyptus urophylla). The same sequence was observed for the content of phenols and humic substances (humic acids + fulvic acids). This fact probably justifies the greater inhibitory activity, since both humic substances and some phenols normally present in PA, such as hydroquinone, have already been reported in the literature as urease inhibitors. The results are promising in terms of urease inhibition by PA samples, especially due to its low cost, biodegradability, non-toxicity, high solubility in water, and beneficial effects on plant development. INTRODUÇÃO A expectativa de crescimento da população mundial para 8,5 bilhões de pessoas até 2030, apresenta-se como um desafio para o setor agrícola, uma vez que se projeta uma necessidade de expansão da produção de alimentos em 35%, para o mesmo período.1 Nesse contexto, o Brasil terá um papel de protagonista, como um dos principais países produtores e exportadores deste setor. Estima-se que 87% do crescimento esperado para a produção agrícola global venha de melhorias no rendimento e eficácia da capacidade produtiva de alimentos.2 Dessa forma, a busca por estratégias que aumentem o rendimento e a rentabilidade do produtor, ao passo que também fortaleçam a sustentabilidade do meio rural, são primordiais para que alcancemos as metas estabelecidas. Dentre os insumos agrícolas de grande impacto na produtividade encontram-se os fertilizantes. No Brasil, o uso desses produtos para adubação aumentou em 87%, entre 2000 e 2015, contribuindo para o significativo crescimento da produção de grãos de 150%, experimentado no mesmo período.1 Entretanto, a produção nacional de fertilizantes é historicamente muito inferior à demanda interna. Estima-se que, em 2020, mais de 80% desses insumos utilizados no Brasil foram importados,3 o que vem, ao longo dos anos, reforçando a dependência das importações. Um fator agravante está associado ao não aproveitamento integral dos fertilizantes aplicados, decorrente de perdas por lixiviação, volatilização, entre outras. Os fertilizantes nitrogenados são os mais consumidos no mundo, sendo que mais de 50% desta classe é aplicada sob a forma de ureia. Ao ser aplicada ao solo, a ureia sofre hidrólise, resultando na formação de dois gases (amônia e dióxido de carbono) e água. Na presença da enzima urease, essa reação é cerca de 1014 vezes mais rápida.4 Por isso, grande parte do nitrogênio aplicado não é efetivamente aproveitada pela planta, sendo perdida, principalmente, pela volatilização da amônia. Uma forma de evitar essas perdas é por meio da inibição da enzima urease. Outros métodos incluem, por exemplo, a associação da aplicação da ureia com períodos de chuva ou irrigação, promovendo o movimento da ureia para camadas mais profundas do solo. Entretanto, não são tão efetivos. Uma alternativa possível será apresentada nesse trabalho, envolvendo um coproduto da atividade de carvoejamento, denominado extrato pirolenhoso (EP). O Brasil é o maior produtor de carvão vegetal do mundo e, consequentemente, o país com maior potencial para produção de EP. Diversos estudos sobre a utilização do EP na agricultura relatam efeitos benéficos no crescimento vegetal,5 na produtividade,6 na indução de resistência,7,8 no enraizamento,5 no desenvolvimento da microbiota benéfica do solo,9 na repelência de insetos,10,11 na germinação das sementes12,13 e na compostagem.14 A coleta do EP nas carvoarias envolve a condensação da fumaça liberada na pirólise da madeira, contribuindo com a redução de emissões e garantindo melhorias tanto ambientais quanto sociais. O EP de eucalipto produzido em fornos de alvenaria é o tipo de EP de maior oferta no Brasil. O eucalipto corresponde a 76,9% de toda a área estimada de florestas plantadas no país (dados de 2021)15 e os fornos de alvenaria são os mais utilizados para produção de carvão vegetal.16 Nesses fornos a carbonização (pirólise lenta) dura em média três a quatro dias. A acácia negra é uma outra espécie de madeira dura com cultivo comercial, utilizada na produção de carvão vegetal, principalmente, no sul do Brasil, embora em escala muito inferior ao eucalipto. O carvão de acácia negra é destinado, em sua maioria, ao consumo residencial em churrasqueiras. De acordo com a Embrapa, estima-se que a casca de coco corresponda a cerca de 70% de todo lixo gerado nas praias brasileiras.17 Um dos destinos para esse resíduo é a produção de carvão vegetal para briquete e carvão ativado. Em geral, a carbonização da casca de coco se dá em fornos metálicos, de forma mais rápida (30 h), em relação aos fornos de alvenaria. A ampla utilização do EP na agricultura, em especial como inibidor da urease, pode contribuir consideravelmente para o desenvolvimento da produção agrícola brasileira, promovendo um maior aproveitamento dos fertilizantes nitrogenados, um melhor desenvolvimento das culturas e maiores produtividades, fatores essenciais para alimentar a crescente população de forma sustentável. Sendo assim, o objetivo deste trabalho é caracterizar e avaliar in vitro o potencial inibidor da urease de três extratos pirolenhosos produzidos a partir de diferentes biomassas e processos. Trata-se de um estudo inovador, pois até o presente momento, não se tem conhecimento de trabalhos nos quais tenha sido avaliado o efeito inibitório da urease in vitro dos extratos pirolenhosos de eucalipto (Eucalyptus urograndis), acácia negra (Acacia mearnsii) e casca de coco (Cocus nucifera).
PARTE EXPERIMENTAL Foram analisadas três amostras comerciais de 1 L de extrato pirolenhoso (EP) fornecidas pela empresa EPB Extrato Pirolenhoso do Brasil. As amostras se diferenciam pela biomassa (casca de coco, acácia negra e eucalipto) e pelo tipo de forno utilizado no processo produtivo (forno metálico ou de alvenaria) (Tabela 1). O extrato pirolenhoso foi obtido pela condensação de uma fração dos gases gerados na carbonização dessas biomassas, entre as temperaturas de 80 e 150 °C, conforme orientações técnicas da Embrapa.18

Determinação de macro e micronutrientes Os macronutrientes nitrogênio, potássio, fósforo, cálcio, magnésio e enxofre, os micronutrientes cobre, ferro, manganês, molibdênio, zinco, sódio e boro, bem como alumínio e cobalto presentes nas amostras de EP foram determinados conforme o Manual de Métodos Analíticos Oficiais para Fertilizante e Corretivos, do Ministério da Agricultura, Pecuária e Abastecimento.19 O fósforo total foi determinado conforme o método gravimétrico do Quimociac, que consiste na solubilização do fósforo da amostra por extração fortemente ácida e posterior precipitação do íon ortofosfato como fosfomolibdato de quinolina, o qual é filtrado, secado e pesado. O nitrogênio foi determinado conforme o macrométodo da Liga de Raney que se fundamenta na mineralização do nitrogênio orgânico (amonificação), seguida da destilação alcalina da amônia que é direcionada para uma solução de ácido bórico. O borato de amônio formado é titulado com solução ácida padronizada. As quantidades de cálcio, magnésio, alumínio, cobalto, cobre, ferro, manganês, molibdênio e zinco foram determinadas usando um espectrofotômetro de absorção atômica (Agilent mod. 55B), com abertura de amostra por digestão ácida, enquanto as quantidades de potássio e sódio foram determinadas por método espectrométrico por emissão. O enxofre foi determinado pelo método gravimétrico do sulfato de bário, que se baseia na oxidação de todas as formas de enxofre a sulfato de enxofre por peróxido de hidrogênio em meio alcalino seguida da precipitação como sulfato de bário. O boro foi determinado conforme o método espectrofotométrico da Azometina-H a 420 nm. Nesse método o ácido bórico age como catalisador, acelerando a reação de condensação do ácido 4-amino-5-hidroxi-2,7-naftalenodissulfônico com aldeído salicílico para formar azometina-H (coloração amarela). Determinação de carbono orgânico A quantidade de carbono orgânico (Corg) dos extratos pirolenhosos (EPs) foi determinada pelo método de oxidação com o dicromato de potássio, conforme Manual de Métodos de Análise de Solo da Embrapa,20 por via úmida. Neste método, a determinação do Corg ocorre indiretamente em função da reação do carbono com o dicromato de potássio, na presença de ácido sulfúrico concentrado e de uma fonte externa de calor, que são usados como catalisadores da reação. O dicromato remanescente é quantificado por titulação com solução de sulfato ferroso amoniacal padronizada. pH, condutividade elétrica, densidade e índice de refração A medição do potencial hidrogeniônico (concentração de íons H+) das amostras foi realizada utilizando um potenciômetro com eletrodo combinado de vidro (pHmetro Digimed mod. DM-22) aferido e calibrado com soluções-padrão de pH 4,00 e pH 7,00. A condutividade elétrica foi medida com o auxílio de um condutivímetro digital (Tecnal mod. Tec-4MP), que foi ajustado à temperatura da amostra e aferido com solução de KCl 0,01 mol L-1 (condutividade de 1,4 mS cm-1). Para a determinação da densidade das amostras (massa específica) foi utilizado um picnômetro Gay-Lussac com capilar de 25 mL de capacidade. Inicialmente, verificou-se o volume do picnômetro. O picnômetro, limpo, seco e previamente pesado foi imerso em banho de água termostatizado a 20 ± 0,5 °C por 20 min. Após esse período, o picnômetro foi seco com papel absorvente e pesado. O mesmo procedimento foi repetido substituindo a água pela amostra. Por fim, o volume foi calculado dividindo a diferença entre a massa do picnômetro com a água destilada e a massa do picnômetro vazio, em gramas, pela densidade da água a 20 °C. A densidade da amostra foi calculada dividindo a diferença entre a massa do picnômetro com a amostra e a massa do picnômetro vazio, em gramas, pelo volume calculado. Foram determinados também os índices de refração (grau BRIX)21 dos EPs, utilizando o refratômetro da marca Hanna mod. HI96801. Determinação de ácidos húmicos e fúlvicos As quantidades de ácidos húmicos (AH) e fúlvicos (AF) foram determinadas conforme método volumétrico do dicromato de potássio descrito no Manual de Métodos Analíticos Oficiais para Fertilizante e Corretivos, do Ministério da Agricultura, Pecuária e Abastecimento.19 O método consiste na extração do extrato húmico total (EHT) com solução alcalina, separação das frações AH e AF pela diferença de solubilidade em meio ácido (pH 1; AFs solúveis e AHs insolúveis) e quantificação das frações pela determinação da quantidade de carbono orgânico total por oxidação com o dicromato de potássio. As amostras foram submetidas a extração alcalina com pirofosfato de sódio 0,1 mol L-1 em NaOH 0,1 mol L-1 para obtenção do extrato húmico total (EHT). Cada sistema foi agitado manualmente, seguido de manutenção da mistura em repouso por 24 h. A mistura foi centrifugada por 15 min, o sobrenadante recolhido e reservado, e foi adicionada novamente a solução extratora até o desprendimento e suspensão do precipitado. A mistura foi deixada em repouso por 1 h e centrifugada novamente por 15 min. O sobrenadante foi recolhido e combinado com o sobrenadante obtido anteriormente, compondo a solução de extrato húmico total (EHT). Posteriormente, foi realizado o fracionamento do EHT em AH e AF. O pH do EHT foi ajustado a pH 1,0 seguido de decantação por 18 h e filtração em filtro de membrana de 0,45 μm sob vácuo. O filtrado foi recolhido e o volume ajustado para 100 mL com água, compondo a fração de AF. Ao precipitado resultante foi adicionado NaOH 0,1 mol L-1 até a lavagem completa do filtro. Para compor a fração de AH, o solubilizado foi recolhido em balão e volume ajustado com água para 100 mL. Por fim, o carbono orgânico total das frações AH e AF foi quantificado por oxidação com o dicromato de potássio. Quantificação de aminoácido por HPLC Para quantificação dos aminoácidos, as análises foram realizadas conforme protocolo descrito por White et al.22 Inicialmente foi realizada a hidrólise proteica da amostra com adição de uma solução de HCl 6 mol L-1 em fenol 1%, a 106 °C por 24 h. Posteriormente, o hidrolisado foi submetido à derivatização pré-coluna com fenilisotiocianato formando os derivados de feniltiocarbamil-aminoácidos. Em seguida, foi realizada a separação e quantificação dos produtos a 254 nm por cromatografia líquida de alta eficiência (HPLC) com detector de UV para quantificação de ácido aspártico, ácido glutâmico, serina, glicina, histidina, taurina, arginina, treonina, alanina, prolina, tirosina, valina, metionina, cistina, isoleucina, leucina, fenilalanina, lisina e hidroxiprolina. Quantificação de hidrocarbonetos poliaromáticos - HPAs Para quantificação dos hidrocarbonetos poliaromáticos (HPAs) as amostras foram preparadas conforme Método da Agência de Proteção Ambiental dos Estados Unidos U.S. EPA 3510C:1996 PAH/SVOC por extração líquido-líquido em funil de separação e, posteriormente, foram analisadas em cromatógrafo gasoso acoplado a espectrômetro de massas (GC/MS), conforme U.S. EPA 8270 D:2007. Foram quantificados os HPAs benzo[a]pireno, benzo[a]antraceno, benzo[b]fluoranteno, benzo[k]fluoranteno, benzo[g,h,i]perileno, criseno, dibenzo[a,h]antraceno, e indeno[1,2,3-cd]pireno sugeridos pela Embrapa na Circular 17723 para o controle de qualidade do EP. Cromatografia gasosa acoplada à espectrometria de massas Para a identificação dos principais compostos presentes no EP foi utilizada a técnica de cromatografia gasosa acoplada à espectrometria de massas (GC-MS) e a metodologia descrita por Banel e Zygmunt.24 Para tal, foi feita uma extração dos compostos orgânicos solúveis com éter metil-terc-butílico (MTBE). Anteriormente à extração com MTBE, foi adicionado 1 g de cloreto de sódio (NaCl) em amostras de 4 mL visando diminuir a solubilidade dos compostos orgânicos em água e assim aumentar a extração dos mesmos. A extração foi realizada duas vezes com 2 mL de MTBE por 10 min em vórtex, seguida de centrifugação (2 min/4000 rpm). As fases orgânicas provenientes das duas extrações foram coletadas com o auxílio de uma seringa e combinadas. Foi adicionado sulfato de sódio anidro para remoção da água residual e posteriormente, a amostra foi seca em N2 e, então, ressuspendida em 300 μL de MTBE e submetida à análise cromatográfica. A separação cromatográfica foi conduzida em coluna analítica NA-WAX (30 m × 0,25 mm, 0,25 μm), de acordo com o seguinte programa de temperatura: 2 min sob temperatura constante de 60 °C, seguido de aumento de 5 °C min-1, e posterior estabilização em 220 °C por 16 min. O injetor operou no modo split na razão de separação 1:10 (mantendo a temperatura do injetor constante em 250 °C). Foi utilizado hélio como gás de arraste, sob fluxo de 0,7 mL min-1 na coluna. A aquisição dos espectros foi obtida no intervalo de 40-400 m/z. A identificação dos componentes do extrato foi feita de acordo com comparações entre os espectros das substâncias e a base de dados das bibliotecas NIST e Wiley. Determinação da quantidade total de fenóis O teor total de compostos fenólicos foi determinado pelo ensaio de Folin-Ciocalteau de acordo com o procedimento descrito por Rover e Brown.25 O método é baseado na redução química do reagente de Folin-Ciocalteu (mistura de ácidos fosfotúngstico e fosfomolíbdico) pela oxidação dos compostos fenólicos, produzindo óxido de tungstênio e óxido de molibdênio de cor azul que absorvem no comprimento de onda de 760 nm. Foram adicionados 100 μL do reagente de Folin-Ciocalteau em 10 μL de amostra, seguida da adição de 150 μL de solução de carbonato de sódio 10% m/v. A mistura foi agitada durante 10 s e deixada à temperatura ambiente ao abrigo da luz. Após 2 h, a absorbância foi determinada a 765 nm usando espectrofotômetro UV-Vis. O ácido gálico foi usado para construir a curva analítica. As soluções padrão de calibração do ácido gálico foram produzidas dissolvendo 0,5 g de ácido gálico em 10 mL de metanol e depois avolumadas para 100 mL com água (5 g L-1 final). Padrões com concentrações de 50, 100, 200, 400, 600, 800 e 1000 mg L-1 foram criados diluindo 10, 20, 40, 80, 120, 160, 200 μL em água até 1 mL, respectivamente. Efeito do extrato pirolenhoso sobre a atividade da urease in vitro A atividade de urease in vitro foi determinada utilizando o método do indofenol.26 O método consiste na quantificação do íon amônio gerado a partir da hidrólise da ureia, catalisada ou não pela urease. Os íons amônio reagem com fenol e hipoclorito de sódio (NaClO), na presença do catalisador nitroprussiato de sódio, para formar o indofenol que tem coloração azul. A intensidade da cor formada é proporcional à concentração de amônia na amostra testada e a determinação é realizada por leitura espectrofotométrica. As amostras de EP nas concentrações finais de 0,2, 0,4 ou 0,6%, bem como o controle negativo (água) e controle positivo (ácido aceto-hidroxâmico, conhecido inibidor da urease) foram incubados na presença de tampão fosfato 20 mmol L-1 e ureia na concentração final de 10 mmol L-1, na presença ou ausência de urease tipo III de Canavalia ensiformis, em microplacas de 96 poços. As placas foram incubadas por 10 min a 600 rpm e 25 °C, em agitador de placa (Biosan Plate Thermo Shaker PST-60HL-4). Após a incubação, foram adicionadas a "solução A" (fenol 1% m/v e nitroprussiato de sódio - SNP 0,005% m/v) e a "solução B" (NaOH 0,5% m/v e NaOCl 0,1% m/v), na ausência de luz, uma vez que o nitroprussiato é fotossensível. Por fim, as placas foram novamente incubadas a 37 °C por 15 min a 600 rpm para realização de leitura espectrofotométrica a 630 nm. A quantidade de indofenol formado é proporcional à concentração de amônio no meio e inversamente proporcional à inibição enzimática. No presente ensaio foi utilizada a urease purificada da Canavalia ensiformis (Jack bean). Como o EP consiste em uma mistura de centenas de compostos não é possível calcular sua concentração em micromolar, sendo assim as dosagens foram calculadas em relação ao volume da mistura de ureia, urease, água e tampão (Tabela 2).
RESULTADOS E DISCUSSÃO Os resultados obtidos com a caracterização físico-química das amostras de EP estudadas no presente trabalho são apresentados na Tabela 3. O pH das amostras variou em torno de 3,0 a 3,8, em concordância com outros trabalhos da literatura.27,28 Segundo Theapparat Y. et al.,27 o pH dos EPs varia de 2 a 4 devido à presença de ácidos orgânicos, como ácido acético, ácido fórmico e ácido propiônico. Ademais, a quantidade desses compostos, e consequentemente o valor de pH, oscilam em função da biomassa, do tipo de forno, da temperatura de carbonização, entre outros fatores.27 Os critérios para julgar a qualidade dos EPs foram sugeridos por Wada (1997)29 como sendo pH em torno de 3, densidade em torno de 1,010-1,050 g mL-1, coloração amarelo pálido ou marrom avermelhado, odor de defumado, aparência visualmente transparente sem matéria suspensa e o teor de alcatrão dissolvido não ser superior a 3%. Observa-se que as quantidades de macro (N, P, K, Ca, Mg e S) e micronutrientes (B, Cl, Cu, Fe, Mn, Mo e Zn), quando presentes, são pequenas e apresentam grande variabilidade entre as amostras de EP.
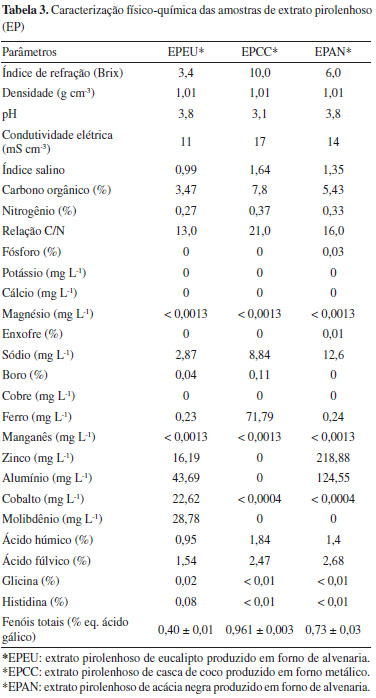
As concentrações de macronutrientes em plantas variam de 30 a 60.000 mmol kg-1 de massa seca, enquanto as de micronutrientes variam de 0,001 a 3 mmol kg-1 de massa seca.30 O molibdênio, encontrado apenas na amostra de eucalipto (EPEU), é um dos micronutrientes requerido em mais baixa quantidade pelas plantas (0,1 ppm de matéria seca)31 e está relacionado com o metabolismo do nitrogênio.30 Este micronutriente está presente na enzima nitrato redutase que catalisa a redução do nitrato a nitrito, primeiro passo do processo de assimilação do nitrogênio do nitrato em aminoácidos e também é encontrado na nitrogenase bacteriana, responsável pela fixação biológica do N2 pelos microrganismos.32 O zinco apresentou-se em maior quantidade na amostra de acácia negra (EPAN), embora também tenha sido encontrado na amostra de eucalipto (EPEU). Junto ao boro, o zinco é o micronutriente que mais frequentemente está associado à deficiência de nutrientes em culturas de solos das regiões tropicais32 e sua concentração nas plantas é em torno 20 ppm de matéria seca.31 O zinco é componente e ativador de várias enzimas, incluindo desidrogenases (alcoólica, glutâmica e lática), sintetases, carboxilases, isomerases.32 Além disso, existem evidências que indicam a participação do zinco na síntese do triptofano, precursor dos hormônios da classe das auxinas.30,32 O ferro foi encontrado em quantidades relativamente altas na amostra de casca de coco em relação às demais. O ferro é parte do grupo prostético de proteínas que participam das etapas fotoquímica e bioquímica da fotossíntese, da fixação do nitrogênio e da respiração celular.30 Sua concentração média nas plantas é em torno de 100 ppm de matéria seca.31 O Brix é uma escala numérica utilizada para soluções de sacarose, na qual um teor de Brix igual a 10 equivale a, aproximadamente, 10 gramas de sacarose em 100 mL de solução. Segundo Oasmaa e Kuoppala,21 quando se aplica o método Brix à análise da fase aquosa dos líquidos de pirólise, determina-se a quantidade total de açúcares (aldoses e cetoses) juntamente com a fração de hidroxi-aldeídos e hidroxi-cetonas, cujas estruturas químicas são semelhantes. Ainda, de acordo Oasmaa e Kuoppala,21 grande parte desses carboidratos é insolúvel em éster em geral e não é eluída nas análises de GC-MS. As amostras apresentaram diferentes valores de Brix, sendo o EPEU com a menor concentração (3,4 g em 100 mL) e o EPCC com a mais alta concentração, equivalente a 10 g em 100 mL, o que pode ser devido tanto a biomassa utilizada, quanto ao processo de produção empregado. Determinação de aminoácidos Neste trabalho os seguintes aminoácidos foram analisados nas três amostras de extrato pirolenhoso (EPEU, EPCC e EPAN): ácido aspártico, ácido glutâmico, serina, glicina, histidina, taurina, arginina, treonina, alanina, prolina, tirosina, valina, metionina, cistina, isoleucina, leucina, fenilalanina, lisina e hidroxiprolina. Entretanto, apenas a amostra de extrato pirolenhoso de eucalipto (EPEU) apresentou teores de glicina e histidina quantificáveis pela metodologia utilizada. Os demais aminoácidos avaliados apresentaram teores abaixo do limite de quantificação do método que foi de 0,01%. A glicina, encontrada nas amostras de EPEU, tem sido destacada como um importante aminoácido para agricultura capaz de promover maior absorção e translocação de nutrientes pelas plantas, devido a sua capacidade quelante.33,34 A histidina é um dos aminoácidos que desempenha um papel fundamental no crescimento e desenvolvimento das plantas.35 Embora os aminoácidos sejam uma fonte importante de nitrogênio (N) para algumas culturas, baixas concentrações, como as encontradas nas amostras de EP, apresentam função bioestimulante, tento em vista que as quantidades são muito pequenas para que os efeitos benéficos sejam atribuídos ao aumento da disponibilidade de N. Schiavon et al.36 demonstraram os efeitos bioestimulantes dos aminoácidos derivados de um hidrolisado de proteínas de alfafa. O hidrolisado apresentava um teor de nitrogênio total pelo método Kjeldahl igual a 2,28% e um conteúdo total de aminoácidos livres igual a 1,9%. Aplicado a taxas de 0,01 e 0,1 mg L-1, o hidrolisado resultou em maior crescimento da planta e acúmulo de açúcar nas folhas. Adicionalmente, a atividade de uma série de enzimas envolvidas no metabolismo do carbono (C) (malato desidrogenase, isocitrato desidrogenase e citrato sintase) e na redução e assimilação de N (nitrato redutase, nitrito redutase, glutamina sintetase, glutamato sintase, aspartato aminotransferase) foi significativamente induzida pelo fornecimento do hidrolisado às plantas. Tendo em vista que as quantidades normalmente aplicadas do EP na agricultura estão em torno de 1 a 10 mL L-1 de calda agrícola, os teores de aminoácidos estariam em concentrações aproximadas ao hidrolisado avaliado por Schiavon et al.36 como bioestimulante. A presença dos aminoácidos glicina (envolvido na quelação de minerais, melhorando a absorção destes)33,34 e histidina (com importante envolvimento na fotossíntese)37 podem contribuir com o efeito bioestimulante do EPEU. Determinação de ácidos húmicos e fúlvicos Todas as amostras de extrato pirolenhoso (EPEU, EPCC e EPAN) apresentaram maiores teores de ácidos fúlvicos (AF) em relação aos ácidos húmicos (AH). Os AF possuem menor ocorrência de unidades aromáticas e apresentam maiores teores de oxigênio e menores teores de carbono em relação aos AH.38 A amostra EPEU foi a que apresentou menores quantidades de AH e AF. As quantidades de AF nas amostras EPCC e EPAN foram semelhantes entre si (coeficiente de variação médio da análise < 15%). Tradicionalmente, as substâncias húmicas, que desempenham um papel importante na fertilidade e porosidade do solo, são produzidas a partir de resíduos orgânicos frescos após processos de decomposição prolongados no solo. Embora muito benéfico, o efeito da utilização dos resíduos orgânicos frescos como, por exemplo, estercos e resíduos de colheitas, é lento. Além do longo período requerido, outra desvantagem está relacionada às elevadas quantidades necessárias (50 a 200 t ha-1). Adicionalmente, alguns dos resíduos, como os de origem animal, podem ainda ser fontes de poluentes e microrganismos prejudiciais.39 Stankovikj et al.38 propuseram uma estrutura representativa para as substâncias húmicas pirolíticas presentes nos líquidos de pirólise. Essas substâncias húmicas consistem em um grupo de moléculas com uma grande variedade de massas molares, nas quais são encontradas unidades fenólicas, carboxílicas, carbonílicas e açúcares em estruturas altamente interligadas.38 De acordo com Piccolo et al.,39 as substâncias húmicas são capazes de formar complexos argilo-húmicos com componentes hidrofílicos orientados para o centro do agregado e componentes hidrofóbicos voltados para fora. Tais complexos aumentam a estabilidade do agregado, tornando o solo mais aerado, facilitando a penetração das raízes, aumentando a disponibilidade de água para as plantas, reduzindo a erosão e protegendo os solos dos efeitos desagregadores de agroquímicos aniônicos aplicados aos solos agrícolas. Tais observações estão em concordância com os resultados apresentados por Uthayakumar et al.,40 que mostraram que a aplicação do EP aumentou a porosidade, além de aumentar o teor de carbono do solo e solubilizar carbonatos indesejados. Outro benefício atribuído às substâncias húmicas está relacionado à sua atividade semelhante à auxina que estimula a H+-ATPase das membranas plasmáticas e promove o crescimento celular.41 Zandonadi et al.42 mostraram que os ácidos húmicos se comportam como auxinas exógenas, estimulando a emergência de raízes laterais. Adicionalmente, os autores demonstraram que tais efeitos no desenvolvimento radicular envolvem a sinalização do óxido nítrico. Isso porque, na presença de moléculas sequestrantes de óxido nítrico (NO), a estimulação da atividade da H+-ATPase e os efeitos no aumento das raízes laterais promovidos pelos ácidos húmicos são significativamente reduzidos. A expressão e atividade da H+-ATPase das membranas plasmáticas, leva a acidificação do apoplasto, que não apenas estimula o crescimento, como também está envolvida em muitas respostas fisiológicas das plantas.42 O aumento das raízes e dos teores de óxido nítrico também foi reportado por Zhong et al.43 na soja tratada com líquido de fumaça. Principais compostos identificados por cromatografia Pela metodologia cromatográfica utilizada, foram identificados, no total, 113 compostos diferentes nas amostras, sendo que 48 eram comuns a todas as amostras, independente da biomassa ou do forno utilizado na produção. Comparando os perfis cromatográficos das amostras (Figuras 2 e 3), percebe-se que as amostras de eucalipto (EPEU) e de acácia negra (EPAN) produzidas em fornos de alvenaria (fornos tradicionalmente usados na produção de carvão vegetal) apresentam um perfil semelhante e com menor intensidade de picos em relação à amostra de casca de coco carbonizada em forno metálico (EPCC) (Tabela 1S, disponível no Material Suplementar).
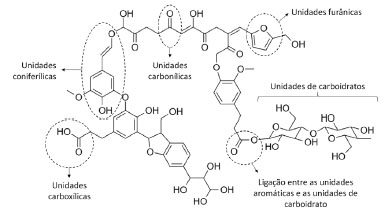 Figura 1. Representação esquemática da estrutura química para substância húmica pirolítica proposta por Stankovikj et al.38
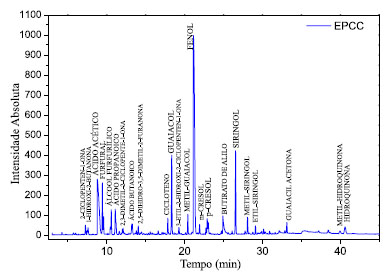 Figura 2. Cromatogramas com a identificação dos principais picos da amostra de EPCC - obtido a partir de casca de coco produzido no forno metálico
O perfil cromatográfico semelhante entre as amostras EPEU e EPAN provavelmente se deve ao fato de tanto o eucalipto quanto a acácia negra serem madeiras duras e apresentarem lignina do tipo guaiacil-siringil, com predomínio das unidades siringil,44,45 enquanto a casca de coco apresenta lignina do tipo p-hidroxifenil-guaiacil-siringil46 com predomínio das unidades guaiacil. Portanto, a quantidade de siringol e seus derivados (metil, etil e propil) é relativamente maior nas amostras EPEU e EPAN, quando comparada às da amostra EPCC. O perfil cromatográfico de compostos voláteis do EPCC no presente trabalho foi semelhante ao reportado por Said et al.47 para a pirólise da casca de coco acoplada a espectrometria de massas (Py-GC/MS). A amostra EPCC, produzida no forno metálico piloto, apresentou teores individuais de ácido propanóico, ácido butanóico e ácido pentanóico oito vezes superiores às amostras produzidas nos fornos de alvenaria (valores calculados a partir da área absoluta desses compostos nos cromatogramas - Figura 3).
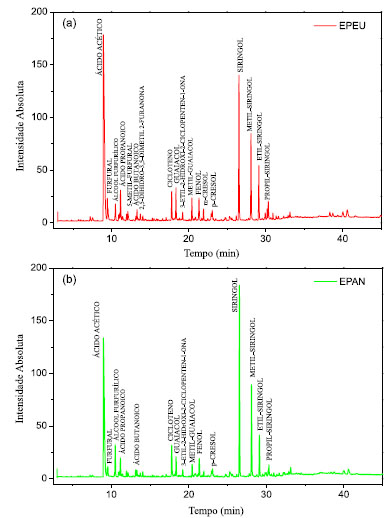 Figura 3. Cromatogramas com a identificação dos principais picos da amostra de EP: (a) de eucalipto produzido no forno de alvenaria (EPEU), (b) de acácia negra produzido no forno de alvenaria (EPAN)
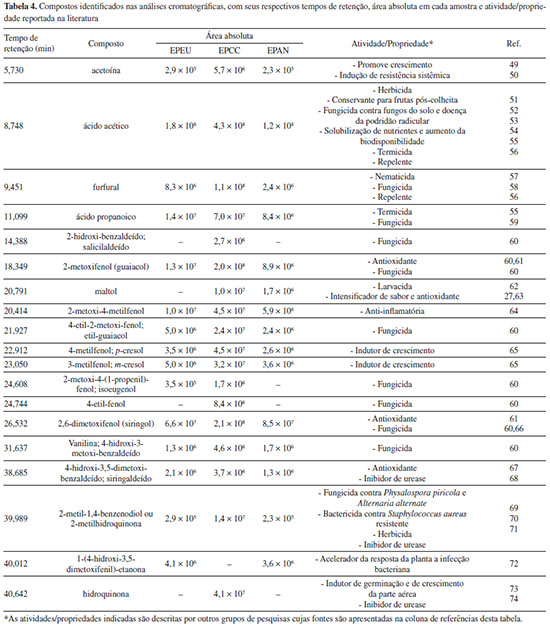
Conforme reportado por Theapparat et al.,48 em todas as amostras foram identificados compostos com diversas classes orgânicas (fenóis, ácidos carboxílicos, cetonas, ésteres, éteres etc.), sendo os ácidos e os fenóis os principais grupos identificados utilizando-se a metodologia aplicada no presente trabalho. A variedade de compostos presentes no EP, confere a ele diversas funcionalidades para uso na agricultura, conforme destacado na Tabela 4.
O ácido acético foi identificado na análise cromatográfica de todas as amostras (Tabela 4). Conforme já estabelecido na literatura,27 o ácido acético é o principal componente do EP e sua proporção em média varia entre 3-7% m/m, enquanto as frações fenólicas variam de 1-3%.48 São diversas as propriedades benéficas do ácido acético para agricultura, conforme apresentado na Tabela 4. Nos trabalhos realizados por Yatagai et al.,55 o ácido acético demonstrou ser um dos compostos termiticidas mais potentes do EP, embora vários outros ácidos (ácido propanoico e valérico) e compostos fenólicos (4-etil-2-metoxifenol; o-cresol; o-etil-fenol) também apresentem essa atividade.55 É sabido que os compostos fenólicos extracelulares desempenham funções importantes nas plantas, desde o reforço da parede celular até ações antibióticas e antioxidantes. De acordo com Baker et al.,75 as células de suspensão saudáveis de tabaco e batata têm pools extracelulares significativos de compostos fenólicos que atenuam o estresse oxidativo resultante, por exemplo, do ataque microbiano à planta. O ácido ascórbico e outros antioxidantes fenólicos no apoplasto, junto com as peroxidases, ajudam a regular o potencial redox do apoplasto. De acordo com os autores, é provável que os antioxidantes fenólicos reajam diretamente com a peroxidase e com as espécies de H2O2, enquanto o ácido ascórbico atue regenerando o composto fenólico oxidado. Esse fenômeno tem sérias implicações no que diz respeito aos mecanismos de reação das células vegetais a vários estímulos. Baker et al.72 identificaram a acetosiringona como um dos principais compostos fenólicos extracelulares produzidos pela suspensão de células vegetais de tabaco e demonstraram que este composto está envolvido na aceleração da resposta da planta a infecção bacteriana. A acetosiringona foi também encontrada nas amostras de eucalipto e acácia negra analisadas no presente trabalho. Muitos compostos fenólicos encontrados nas amostras de EP analisadas (Tabela 4) apresentam propriedades antioxidantes e antifúngicas reportadas na literatura, inclusive contra fungos filamentosos patogênicos importantes, como os dos gêneros Fusarium, Aspergillus e Penicillium.60 Entre os compostos fenólicos com propriedades fungicidas, destacam-se os seguintes: isoeugenol, 2-etilfenol, 4-etilfenol, 2-metoxi-4-metilfenol (4-metil-guaiacol), 4-etilguaiacol e salicilaldeído.60 Embora a atividade antifúngica e antimicrobiana do extrato pirolenhoso (EP) esteja normalmente associada aos derivados fenólicos,5,76-78 outros compostos também desempenham um papel importante nesta propriedade. O ácido propanoico encontrado nas três amostras analisadas, por exemplo, tem sido amplamente utilizado em produtos alimentícios como conservante, devido ao seu efeito inibitório sobre o crescimento de microrganismos.79 Nesse sentido, Yun e Lee79 revelaram que o ácido propanoico induz a morte celular de fungos por apoptose mediada por mitocôndrias. Adicionalmente, o furfural é um ingrediente ativo de pesticida que possui propriedades, não apenas fungicidas, mas também nematicidas.58 Ainda, uma patente chinesa (CN102458125B)80 refere-se ao uso de compostos de ciclopentanodiona como inseticidas, acaricidas e/ou fungicidas. Experimentos com rizobactérias do gênero Bacillus mostraram que os voláteis produzidos por essas bactérias eram responsáveis pelo aumento do crescimento49 e pela indução de resistência sistêmica50 nas plantas de Arabidopsis. Esses voláteis foram identificados como acetoína e 2,3-butanodiol. Nas mudas de Arabidopsis expostas a misturas dos voláteis acetoína e 2,3-butanodiol, a gravidade da doença (Podridão-mole) causada pelo patógeno bacteriano Erwinia carotovora subsp. carotovora, foi significativamente reduzida em comparação com mudas não expostas antes da inoculação do patógeno. A exposição aos compostos orgânicos voláteis e rizobactérias por apenas 4 dias foi suficiente para ativar resistência sistêmica induzida em mudas de Arabidopsis. A acetoína foi encontrada em todas as amostras de EP analisadas no presente trabalho (Tabela 4). A grande variabilidade e a atividade sinérgica dos diversos componentes do EP podem dificultar o desenvolvimento de resistência por parte dos microrganismos,81,82 o que torna o EP um produto ainda mais interessante para aplicação na proteção dos cultivos de interesse agrícola. Na indústria alimentícia, segundo Rozum,83 os aldeídos e cetonas alifáticos são responsáveis pela característica corante das fumaças líquidas conferida às carnes através da reação de Maillard, sendo o hidroxiacetaldeído o principal aldeído responsável por esse efeito. Por outro lado, o siringol e seus derivados são os principais responsáveis pelo sabor de defumado e propriedade antioxidante. Embora, o guaiacol, o furfural, o cicloteno, o maltol, as cetonas aromáticas e os aldeídos também desempenhem papéis importantes na composição geral do sabor e aroma conferido ao alimento. Wasserman84 demonstrou que a mistura dos três principais compostos (guaiacol, 4-metil-guaiacol e siringol) nas proporções encontradas no líquido de pirólise não é suficiente para fornecer o aroma defumado característico desejável. Inibição da urease in vitro dos extratos pirolenhoso e seus principais constituintes Após a caracterização, as amostras foram submetidas ao ensaio de inibição da urease in vitro. O efeito inibitório dos EPs sobre a atividade anti-ureolítica revelam um comportamento concentração dependente para a inibição da urease de Canavalia ensiforms (Figura 4). A partir das curvas de inibição em função das dosagens (Figura 4) foi possível calcular a concentração mínima para inibir 50% da urease (IC50), apresentada na Tabela 5.
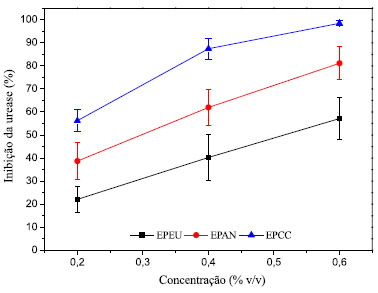 Figura 4. Curva concentração dos extratos pirolenhosos versus efeito inibitório in vitro da atividade anti-ureolítica da urease de Canavalia ensiforms
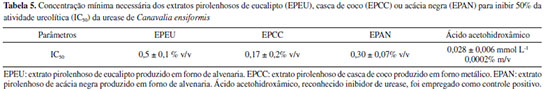
Os resultados in vitro de inibição da urease pelas amostras de EPs estudados mostraram-se promissores, embora, à primeira vista, sejam inferiores ao inibidor de referência (ácido aceto-hidroxâmico, Tabela 5). É valido destacar que o EP, um subproduto da produção de carvão vegetal, consiste em uma solução aquosa com centenas de compostos orgânicos e teor de umidade entre 80 e 90%. Dessa forma, descontando a porcentagem referente à água e outros compostos sem atividade, é provável que os compostos inibidores da urease presentes no EP tenham atividades ainda superiores ao ácido aceto-hidroxâmico. Os valores de IC50 encontrados para todas as amostras são praticamente equivalentes ou inferiores às dosagens mínimas normalmente aplicadas de EP na agricultura (0,5% do volume de calda, aproximadamente, 1 L de EP por hectare). A amostra EPCC, produzida no forno metálico, com carbonização mais rápida em relação ao forno de alvenaria, mostrou uma capacidade inibitória da urease superior às demais produzidas por pirólise lenta (EPEU e EPAN). Esta amostra (EPCC) também foi a que apresentou maior teor de substâncias húmicas (soma de ácidos húmicos e fúlvicos) e uma maior concentração de compostos identificados nas análises cromatográficas. Isso se explica porque em pirólises intermediárias, com menores tempos de residência em relação à pirolise lenta, como é o caso do processo produtivo da amostra EPCC, a clivagem de moléculas de maior massa molecular, provenientes da degradação térmica da biomassa, ocorre em menor extensão,85 o que justifica a maior concentração de substâncias húmicas. Nesse processo, os produtos líquidos são beneficiados, apresentando maiores teores de carbono orgânico, enquanto na pirólise lenta, a produção do carvão é favorecida. Ademais, no presente estudo foram também utilizadas biomassas precursoras diferentes, o que influencia na composição do EP. Vale destacar que estudos anteriores realizados pelos autores, ainda não publicados, indicaram que o processo produtivo teve uma maior influência sobre a composição do EP do que a biomassa precursora. Alguns dos compostos detectados por cromatografia nas amostras de EP apresentam atividade inibitória da urease já relatada na literatura, sendo eles o acetol,86 a hidroquinona,87 o siringaldeído68 e a 2-ciclopenten-1-ona,88 assim como as substâncias húmicas.89,90 O acetol, a 2-ciclopenten-1-ona e a hidroquinona estão presentes em maiores concentrações na amostra EPCC e podem estar contribuindo para o melhor desempenho desta amostra na inibição da urease (Tabela 5). O siringaldeído foi encontrado em todas as amostras, embora em baixas concentrações (Tabela 4). Vaughan e Ord89 avaliaram a atividade inibitória da urease de substâncias húmicas. Os experimentos foram realizados com a urease purificada de Bacillus pasteurii. Foram testados ácidos húmicos e fúlvicos extraídos de solo agrícola, além de cinco modelos sintéticos de ácidos húmicos (preparados a partir de cada um dos compostos fenólicos: catecol, guaiacol, pirogalol, resorcinol e ácido protocatecuico) e um modelo sintético de ácido fúlvico (preparado com ácido polimaleico). Com exceção do catecol, os compostos fenólicos utilizados no preparo dos ácidos húmicos não apresentaram atividade inibitória quando avaliados sozinhos. Os autores ainda avaliaram um ácido húmico tratado com baixo teor de cinza (0,12% p/p). Em pH 4,0, todas as substâncias húmicas testadas inibiram a atividade da urease de maneira concentração-dependente (0,1 a 100 μg mL-1). Na concentração de 10 μg mL-1 as nove amostras de substâncias húmicas promoveram inibições de 32-46%, enquanto na concentração 100 μg mL-1 as porcentagens de inibição foram de 69-83%. As substâncias húmicas modelo e com baixo teor de cinzas inibiram a atividade da urease na mesma extensão dos ácidos húmicos e fúlvicos extraídos do solo agrícola, indicando que a inibição da urease não foi devida aos componentes inorgânicos. Os autores também mostram que a porcentagem de inibição da urease produzida por substâncias húmicas é dependente do pH e tende a diminuir consideravelmente com o aumento do pH de 4 para 5. Ao comparar as amostras produzidas nos fornos de alvenaria, observa-se que a capacidade inibitória do extrato pirolenhoso de acácia negra (EPAN) foi superior ao do obtido a partir do eucalipto (EPEU), embora o perfil cromatográfico (Figura 2) de ambas seja relativamente semelhante. Tal fato pode indicar que parte dos compostos envolvidos na inibição da urease podem não ter sido identificada pelo método cromatográfico utilizado. A amostra EPAN também apresentou maior teor de ácidos húmicos e fúlvicos em relação a amostra EPEU, o que pode estar contribuindo para sua maior capacidade inibitória (Tabela 3), conforme também observado para amostra EPCC. É importante que os inibidores da urease para aplicação no solo, diferentemente dos inibidores para fins medicinais, tenham custos mais acessíveis, em função do grande volume necessário.91 Neste sentido, o EP se mostra uma excelente opção, tendo em vista seu baixo custo, biodegradabilidade,92 baixa ou nenhuma toxicidade,93 além dos demais benefícios conferidos ao solo e ao desenvolvimento das plantas.94 Existem poucos trabalhos que avaliaram o efeito do EP como um inibidor da urease, até a data desta publicação. Sendo que alguns trabalhos de aplicação do EP no solo indicam aumento da atividade desta enzima,95 enquanto outros mostram a inibição.96,97 Possivelmente, a existência de resultados controversos está relacionada ao fato do EP apresentar compostos inibidores em sua composição, mas também atuar como promotor do crescimento e da atividade microbiana do solo, conforme resultados reportados por Lu et al.,95 Levando consequentemente ao aumento das atividades enzimáticas microbiana. Embora os experimentos in vitro, como os apresentados no presente trabalho, sejam limitados por não representarem de forma fiel as condições reais de aplicação, eles apresentam como vantagem a capacidade de isolar o efeito inibitório do efeito promotor do crescimento microbiano, diferentemente dos experimentos conduzidos no solo. A irrigação com EP após aplicação da ureia, além de inibir a urease, mitiga a transformação do NH4+ em NH3 em decorrência da redução do pH98 e favorece a incorporação e o movimento do NH4+ para camadas mais profundas do solo, reduzindo consideravelmente as perdas por volatilização, além de contribuir para o aumento da fertilidade do solo, devido a presença dos ácidos húmicos e fúlvicos em sua composição.99
CONCLUSÃO A matéria prima utilizada e o processo de produção do EP são determinantes para a composição e quantidade dos componentes nesses extratos, bem como seu potencial para inibir a urease. O EP produzido a partir de casca de coco em forno metálico foi o mais potente quanto à inibição da urease, sendo a amostra oriunda de eucalipto produzida em forno de alvenaria, a menos eficiente. Embora já seja aplicado no solo e nas folhas por agricultores em diversas regiões do mundo, os benefícios do EP em associação a fertilizantes à base de ureia ainda não são amplamente conhecidos. O baixo custo, biodegradabilidade, não toxicidade, elevada solubilidade em água e alguns benefícios do EP às plantas tornam tais extratos elegíveis ao desenvolvimento de formulações de ureia mais eficientes e com menor impacto ambiental. O Brasil, como o maior produtor de carvão vegetal do mundo, possui um amplo potencial para fornecer EP para aplicação na agricultura tanto nacionalmente quanto internacionalmente, favorecendo um agronegócio mais sustentável. Tal prática proporcionará uma valorização deste subproduto oriundo da produção de carvão para fins de aumento da eficiência de fertilizantes nitrogenados.
MATERIAL SUPLEMENTAR O material suplementar desse trabalho está disponível em http://quimicanova.sbq.org.br/, na forma de arquivo PDF, com acesso livre.
AGRADECIMENTOS Os autores agradecem à Universidade Federal de Minas Gerais (UFMG) pela infraestrutura. Este trabalho foi viabilizado pela Rede para o Desenvolvimento de Novos Inibidores de Urease, que conta com o apoio financeiro da Coordenação de Aperfeiçoamento de Pessoal de Nível Superior - Brasil (CAPES, código financeiro 001), Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) e Fundação de Amparo à Pesquisa do Estado de Minas Gerais (FAPEMIG). L. V. M., V. M. D. P. e A. F. recebem bolsas de pesquisa do CNPq.
REFERÊNCIAS 1. Embrapa; Visão 2030 - O Futuro da Agricultura Brasileira, Brasília, 2018. [Link] acessado em junho 2023 2. United Nations; General Assembly Resolution A/RES/70/1, 2015. [Link] acessado em junho 2023 3. Brasil; Plano Nacional de Fertilizantes 2050 - Uma Estratégia para os Fertilizantes no Brasil, Brasília, 2021. [Link] acessado em junho 2023 4. Modolo, L. V.; da Silva, C. J.; Brandão, D. S.; Chaves, I. S.; J. Adv. Res. 2018, 13, 29. [Crossref] 5. Mahmud, K. N.; Yahayu, M.; Sarip, S. H. M.; Rizan, N. H.; Min, C. B.; Mustafa, N. F.; Ngadiran, S.; Ujang, S.; Zakaria, Z. A.; Sains Malays. 2016, 45, 1423. [Link] acessado em junho 2023 6. Benzon, H. R. L.; Lee, S. C.; Korean Journal of Plant Resources 2016, 29, 704. [Crossref] 7. Wang, Y.; Qiu, L.; Song, Q.; Wang, S.; Wang, Y.; Ge, Y.; Int. J. Mol. Sci. 2019, 20, 1. [Crossref] 8. Jamil, M.; Kanwal, M.; Aslam, M. M.; Khan, S. U.; Malook, I.; Tu, J.; Rehman, S.; Aust. J. Crop Sci. 2014, 8, 159. [Link] acessado em junho 2023 9. Steiner, C.; Das, K. C.; Garcia, M.; Förster, B.; Zech, W.; Pedobiologia 2008, 51, 359. [Crossref] 10. Hagner, M.; Tiilikkala, K.; Lindqvist, I.; Niemelä, K.; Wikberg, H.; Källi, A.; Rasa, K.; Waste Biomass Valorization 2020, 11, 1005. [Crossref] 11. Kiarie-Makara, M. W.; Yoon, H. S.; Lee, D. K.; Entomol. Res. 2010, 40, 97. [Crossref] 12. Jäger, A. K.; Rabe, T.; van Staden, J.; S. Afr. J. Bot. 1996, 62, 282. [Crossref] 13. Dissatian, A.; Sanitchon, J.; Pongdontri, P.; Jongrungklang, N.; Jothityangkoon, D.; Agrivita 2018, 40, 371. [Crossref] 14. Wang, Q.; Awasthi, M. K.; Ren, X.; Zhao, J.; Li, R.; Wang, Z.; Wang, M.; Chen, H.; Zhang, Z.; Waste Manage. 2018, 74, 221. [Crossref] 15. IBGE; Produção da Extração Vegetal e da Silvicultura, Rio de Janeiro, 2021. [Link] acessado em junho 2023 16. CGEE; Modernização da Produção de Carvão Vegetal no Brasil: Subsídios para Revisão do Plano Siderurgia, Brasília, 2015. [Link] acessado em junho 2023 17. https://www.embrapa.br/busca-de-solucoes-tecnologicas/-/produto-servico/33/beneficiamento-da-casca-de-coco-verde-para-a-producao-de-fibra-e-po, acessada em junho 2023. 18. Campos, A. D.; Processo de Coleta e Produção do Extrato Pirolenhoso para Uso Agrícola - Circular Técnica 178, Pelotas, 2018. [Link] acessado em junho 2023 19. MAPA; Manual de Métodos Analíticos Oficiais para Fertilizantes e Corretivos, Brasília, 2017. [Link] acessado em junho 2023 20. EMBRAPA; Manual de Métodos de Análise de Solo da Embrapa, 3ª ed.; Embrapa Solos: Brasília, 2017. [Link] acessado em junho 2023 21. Oasmaa, A.; Kuoppala, E.; Energy Fuels 2008, 22, 4245. [Crossref] 22. White, J. A.; Hart, R. J.; Fry, J. C.; J. Autom. Chem. 1986, 8, 170. [Link] acessado em junho 2023 23. Campos, A. D.; Informação Técnica sobre Extrato Pirolenhoso - Circular 177, Pelotas, 2018. [Link] acessado em junho 2023 24. Banel, A.; Zygmunt, B.; Water Sci. Technol. 2011, 63, 590. [Crossref] 25. Rover, M. R.; Brown, R. C.; J. Anal. Appl. Pyrolysis 2013, 104, 366. [Crossref] 26. Weatherburn, M. W.; Anal. Chem. 1967, 39, 971. [Crossref] 27. Theapparat, Y.; Chandumpai, A.; Faroongsarng, D.; Kasetsart J.: Nat. Sci. 2014, 48, 916. [Link] acessado em junho 2023 28. Mathew, S.; Zakaria, Z. A.; Appl. Microbiol. Biotechnol. 2015, 99, 611. [Crossref] 29. Wada, T.; Charcoal Handbook; Bureau of Labour and Economic Affairs: Tokyo, 1997. 30. Paulilo, M. T. S.; Viana, A. M.; Randi, A. M.; Fisiologia Vegetal, Universidade Federal de Santa Catarina: Florianópolis, 2015. [Link] acessado em junho 2023 31. Epstein, E.; Mineral Nutrition of Plants: Principles and Perspectives, 1st ed.; Wiley: New York, 1972. 32. Faquin, V.: Nutrição Mineral de Plantas; Curso de Pós-Graduação "Lato Sensu" (Especialização) a Distância, Universidade Federal de Lavras, Minas Gerais, Brasil, 2005. [Link] acessado em junho 2023 33. Souri, M. K.; Hatamian, M.; J. Plant Nutr. 2019, 42, 67. [Crossref] 34. Noroozlo, Y. A.; Souri, M. K.; Delshad, M.; Open Agric. J. 2019, 4, 164. [Crossref] 35. Ingle, R. A.; Arabidopsis Book 2011, 9, e0141. [Crossref] 36. Schiavon, M.; Ertani, A.; Nardi, S.; J. Agric. Food Chem. 2008, 56, 11800. [Crossref] 37. Onidas, D.; Stachnik, J. M.; Brucker, S.; Krätzig, S.; Gerwert, K.; Eur. J. Cell Biol. 2010, 89, 983. [Crossref] 38. Stankovikj, F.; McDonald, A. G.; Helms, G. L.; Olarte, M. V.; Garcia-Perez, M.; Energy Fuels 2017, 31, 1650. [Crossref] 39. Piccolo, A.; Pietramellara, G.; Mbagwu, J. S. C.; Geoderma 1997, 75, 267. [Crossref] 40. Uthayakumar, R.; Prabakar, G. A.; Azis, S. A.; Fractals 2011, 19, 401. [Crossref] 41. Halpern, M.; Bar-Tal, A.; Ofek, M.; Minz, D.; Muller, T.; Yermiyahu, U.; Adv. Agron. 2015, 130, 141. [Crossref] 42. Zandonadi, D. B.; Santos, M. P.; Dobbss, L. B.; Olivares, F. L.; Canellas, L. P.; Binzel, M. L.; Okorokova-Façanha, A. L.; Façanha, A. R.; Planta 2010, 231, 1025. [Crossref] 43. Zhong, Z.; Kobayashi, T.; Zhu, W.; Imai, H.; Zhao, R.; Ohno, T.; Rehman, S.; Uemura, M.; Tian, J.; Komatsu, S.; J. Proteomics 2020, 221, 103781. [Crossref] 44. Ramadevi, P.; Hegde, D. V.; Varghese, M.; Kamalakannan, R.; Ganapathy, S. P.; Gurumurthy, D. S.; J. Near Infrared Spectrosc. 2016, 24, 529. [Crossref] 45. Lupoi, J. S.; Singh, S.; Davis, M.; Lee, D. J.; Shepherd, M.; Simmons, B. A.; Henry, R. J.; Biotechnol. Biofuels 2014, 7, 1. [Crossref] 46. Rencoret, J.; Ralph, J.; Marques, G.; Gutiérrez, A.; Martínez, A. T.; Del Río, J. C.; J. Agric. Food Chem. 2013, 61, 2434. [Crossref] 47. Said, M.; John, G.; Mhilu, C.; Manyele, S.; J. Renewable Energy 2015, 2015, 1. [Crossref] 48. Theapparat, Y.; Chandumpai, A.; Leelasuphakul, W.; Laemsak, N.; Journal of Tropical Forest Science 2015, 27, 517. [Crossref] 49. Ryu, C. M.; Faragt, M. A.; Hu, C. H.; Reddy, M. S.; Wei, H. X.; Paré, P. W.; Kloepper, J. W.; Proc. Natl. Acad. Sci. U. S. A. 2003, 100, 4927. [Crossref] 50. Ryu, C. M.; Farag, M. A.; Hu, C. H.; Reddy, M. S.; Kloepper, J. W.; Paré, P. W.; Plant Physiol. 2004, 134, 1017. [Crossref] 51. Abouziena, H. F. H.; Omar, A. A. M.; Sharma, S. D.; Singh, M.; Weed Technol. 2009, 23, 431. [Crossref] 52. Venditti, T.; D'Hallewin, G.; Dore, A.; Molinu, M. G.; Fiori, P.; Angiolino, C.; Agabbio, M.; Commun. Agric. Appl. Biol. Sci. 2008, 73, 265. [Link] acessado em junho 2023 53. Abd-El-Kareem, F.; Arch. Phytopathol. Plant Prot. 2009, 42, 213. [Crossref] 54. Baziramakenga, R.; Simard, R. R.; J. Environ. Qual. 1998, 27, 557. [Crossref] 55. Yatagai, M.; Nishimoto, M.; Hori, K.; Ohira, T.; Shibata, A.; J. Wood Sci. 2002, 48, 338. [Crossref] 56. Hagner, M.; Kuoppala, E.; Fagernäs, L.; Tiilikkala, K.; Setälä, H.; Int. J. Environ. Res. 2015, 9, 53. [Crossref] 57. Ntalli, N. G.; Vargiu, S.; Menkissoglu-Spiroudi, U.; Caboni, P.; J. Agric. Food Chem. 2010, 58, 11390. [Crossref] 58. El-Mougy, N. S.; El-Gamal, N. G.; Mohamed, M. M. M.; Abdel-Kader, M. M.; J. Plant Prot. Res. 2008, 48, 93. [Crossref] 59. El-Mougy, N. S.; Abdel-Kader, M. M.; Plant Pathol. Bull. 2009, 18, 75. [Link] acessado em junho 2023 60. Zabka, M.; Pavela, R.; Chemosphere 2013, 93, 1051. [Crossref] 61. Li, Z.; Zhang, Z.; Wu, L.; Zhang, H.; Wang, Z.; Chem. Res. Chin. Univ. 2019, 35, 12. [Crossref] 62. Ali, S. I.; Venugopalan, V.; Nat. Prod. Res. 2019, 1, 1741. [Crossref] 63. Guo, N.; Li, C.; Liu, Q.; Liu, S.; Huan, Y.; Wang, X.; Bai, G.; Yang, M.; Sun, S.; Xu, C.; Shen, Z.; Food Funct. 2018, 9, 6287. [Crossref] 64. Ho, C. L.; Lin, C. Y.; Ka, S. M.; Chen, A.; Tasi, Y. L.; Liu, M. L.; Chiu, Y. C.; Hua, K. F.; PLoS One 2013, 8, 1. [Crossref] 65. Ichikawa, T.; Tomioka, H.; Shirakawa, N.; Iwane, Y.; JP55154903 1979. 66. Chen, S.; Dong, L.; Xu, J.; Li, X.; CN106538529 2016. 67. Bountagkidou, O. G.; Ordoudi, S. A.; Tsimidou, M. Z.; Food Res. Int. 2010, 43, 2014. [Crossref] 68. Ramsay, K. S. T.; Wafo, P.; Ali, Z.; Khan, A.; Oluyemisi, O. O.; Marasini, B. P.; Khan, I. A.; Bonaventure, N. T.; Choudhary, M. I.; Fitoterapia 2012, 83, 2004. [Crossref] 69. Zhang, Wei.; Ai, Qijun.; Wu, X.; Shipin Keji 2008, 1, 182. [Link] acessado em junho 2023 70. Li, Y.; Li, X.; Son, B. W.; Nat. Prod. Sci. 2005, 11, 136. [Link] acessado em junho 2023 71. Huang, J.; Putnam, A. R.; Werner, G. M.; Mishra, S. K.; Whitenack, C.; Weed Sci. 1989, 37, 123. [Crossref] 72. Baker, C. J.; Mock, N. M.; Whitaker, B. D.; Roberts, D. P.; Rice, C. P.; Deahl, K. L.; Aver'yanov, A. A.; Biochem. Biophys. Res. Commun. 2005, 328, 130. [Crossref] 73. Kamran, M.; Khan, A. L.; Ali, L.; Hussain, J.; Waqas, M.; Al-Harrasi, A.; Imran, Q. M.; Kim, Y. H.; Kang, S. M.; Yun, B. W.; Lee, I. J.; Front. Chem. 2017, 5, 1. [Crossref] 74. Bremner, J. M.; Douglas, L. A.; Soil Biol. Biochem. 1971, 3, 297. [Crossref] 75. Baker, C. J.; O'Neill, N. R.; Deahl, K.; Lydon, J.; Plant Physiol. Biochem. 2002, 40, 641. [Crossref] 76. Theapparat, Y.; Chandumpai, A.; Leelasuphakul, W.; Laemsak, N.; Journal of Tropical Forest Science 2015, 27, 517. [Crossref] 77. Wei, Q.; Ma, X.; Dong, J.; J. Anal. Appl. Pyrolysis 2010, 87, 24. [Crossref] 78. Ma, X.; Wei, Q.; Zhang, S.; Shi, L.; Zhao, Z.; J. Anal. Appl. Pyrolysis 2011, 91, 338. [Crossref] 79. Yun, J. E.; Lee, D. G.; FEMS Yeast Res. 2016, 16, 1. [Crossref] 80. Angelman, A.; Fischer, R.; Lyle, S.; Wooster, A.; CN102458125B 2010. [Link] acessado em junho 2023 81. Suresh, G.; Pakdel, H.; Rouissi, T.; Brar, S. K.; Fliss, I.; Roy, C.; Biotechnology Research and Innovation 2019, 3, 47. [Crossref] 82. Mattos, C.; Veloso, M. C. C.; Romeiro, G. A.; Folly, E.; J. Anal. Appl. Pyrolysis 2019, 139, 1. [Crossref] 83. Rozum, J. Em Encyclopedia of Meat Sciences; Dikeman, M.; Devine, C., eds.; Academic Press: New York, 2014, p. 315. [Crossref] 84. Wasserman, A. E.; J. Food Sci. 1966, 31, 1005. [Crossref] 85. Al-Haj Ibrahim, H.; Recent Advances in Pyrolysis, 1st ed.; IntechOpen: Londres, 2020. 86. Tanaka, T.; Kawase, M.; Tani, S.; Bioorg. Med. Chem. 2004, 12, 501. [Crossref] 87. Zhao, X.; Zhou, L.; Soil Biol. Biochem. 1991, 23, 1089. [Crossref] 88. Tanaka, T.; Kawase, M.; Tani, S.; Life Sci. 2003, 73, 2985. [Crossref] 89. Vaughan, D.; Ord, B. G.; Eur. J. Soil Sci. 1991, 42, 17. [Crossref] 90. Liu, X.; Zhang, M.; Li, Z.; Zhang, C.; Wan, C.; Zhang, Y.; Lee, D. J.; Bioresour. Technol. 2019, 290, 121767. [Crossref] 91. Kafarski, P.; Talma, M.; J. Adv. Res. 2018, 13, 101. [Crossref] 92. Hagner, M.; Lindqvist, B.; Vepsäläinen, J.; Samorì, C.; Keskinen, R.; Rasa, K.; Hyvönen, T.; Environ. Technol. Innovation 2020, 20, 101154. [Crossref] 93. Hagner, M.: Potential of the Slow Pyrolysis Products Birch Tar Oil, Wood Vinegar and Biochar in Sustainable Plant Protection: Pesticidal Effects, Soil Improvement and Environmental Risks; Doctoral Dissertation, University of Helsinki, Lahti, Finland, 2013. [Link] acessado em junho 2023 94. Cândido, N. R.; Pasa, V. M. D.; Vilela, A. O.; Campos, A. D.; de Fátima, A.; Modolo, L. V.; Sci. Total Environ. 2023, 881, 163519. [Crossref] 95. Lu, H.; Lashari, M. S.; Liu, X.; Ji, H.; Li, L.; Zheng, J.; Kibue, G. W.; Joseph, S.; Pan, G.; Eur. J. Soil Biol. 2015, 70, 67. [Crossref] 96. Lee, J. K.; Park, H. J.; Cha, S. J.; Kwon, S. J.; Park, J. H.; Environ. Pollut. 2021, 291, 118132. [Crossref] 97. Park, H. J.; Park, J. H.; J. Appl. Biol. Chem. 2017, 60, 173. [Crossref] 98. Win, K. T.; Toyota, K.; Motobayashi, T.; Hosomi, M.; Soil Sci. Plant Nutr. 2009, 55, 190. [Crossref] 99. Rose, M. T.; Patti, A. F.; Little, K. R.; Brown, A. L.; Jackson, W. R.; Cavagnaro, T. R.; Adv. Agron. 2014, 124, 37. [Crossref] |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access