Artigo
|
|
| Avaliação quantitativa de ácidos amargos, xanthohumol e óleos essenciais presentes em flores de diferentes cultivares de Humulus Lupulus L. produzidas na região nordeste do Brasil Quantitative evaluation of bitter acids, xanthohumol and essential oils present in flowers of different cultivars of Humulus lupulus L. grown in northeastern Brazil |
|
Samuel P. D. MarquesI,II,*; Maria T. S. TrevisanI; Robert W. OwenI; Ana M. A. SilvaI; Francisco M. G. NascimentoI; I. Departamento de Química Orgânica e Inorgânica, Universidade Federal do Ceará, 60451-970 Fortaleza - CE, Brasil Recebido em 15/03/2023 Todos os autores declaram que não há conflito de interesses. *e-mail: samuel.marques@ifce.edu.br Hop flowers contain chemical substances that are used to confer sensory properties to beer. Hop flower products have very high commercial value, but national production represents less than 2% of domestic consumption. In this work, flowers from different hop cultivars grown in northeast of Brazil (Rio Grande do Norte and Ceará) were analyzed to quantitate metabolites of industrial interest. Flowers from the initial and three consecutive harvests were collected, and bitter acids and xanthohumol were evaluated by HPLC-UV and essential oils by GC-MS. The cultivar Columbus was subjected to only 10% of the irrigation time during the third flowering phase to evaluate the effect of water stress on the formation of metabolites. Compounds were detected in appreciable quantities in all samples, and consecutive flowering of some cultivars showed a significant increase in total bitter acids with successive harvests. Plants subjected to water stress showed an abrupt decrease in the concentration of compounds. The cultivars evaluated by liquid and gas chromatography showed a significant concentration of bitter acids and essential oils within the expected range, and the chemical composition of the oils showed different compounds characteristic of hops. INTRODUÇÃO O lúpulo (Humulus lupulus L. ) é uma planta trepadeira e o gênero pertence à família das Canabiáceas, originária do sudeste asiático. É cultivada em larga escala, principalmente em países da Europa e nos Estados Unidos da América, devido ao fato de suas flores conferirem propriedades sensoriais à cerveja.1,2 São plantas com longo ciclo de vida e a maturação das mesmas implica na produção de flores com elevada qualidade.2 Nas flores, existem glândulas nas quais fica armazenada uma resina amarelada, denominada lupulina, que contém as substâncias de interesse industrial e responsáveis por conferir amargor (ácidos amargos), aroma (óleos essenciais) e estabilidade bacteriostática à bebida (substâncias polifenólicas).3,4 Os ácidos amargos (α e β) do lúpulo representam uma classe funcional caracterizada por intenso amargor e, em altas temperaturas, durante a produção de cervejas, sofrem reações de isomerização, gerando isômeros de maior solubilidade e amargor no mosto.1,5 Na lupulina, também são encontrados óleos essenciais, os quais, devido à sua elevada volatilidade e ao seu odor agradável, conferem diferentes aromas às inúmeras receitas cervejeiras.6 O prenilflavonoide xanthohumol é uma substância característica do lúpulo, com algumas propriedades terapêuticas já relatadas na literatura e elevado valor comercial em sua forma pura.7-9 As flores, também chamadas de cones, são comercializadas secas (embaladas à vácuo) e sob o formato de diferentes produtos, principalmente pellets ou extratos, e que possuem elevado valor de mercado. Estes precisam conter obrigatoriamente em suas embalagens, para comercialização, informações acerca dos teores de ácidos amargos (em g 100 g-1), rendimento extrativo (mL 100 g-1) e perfil sensorial dos óleos essenciais, pois cada cultivar possui concentrações específicas desses compostos, os quais irão conferir distintos sabores e aromas finais.1,2,4 Existem diferentes procedimentos de extração e análise cromatográfica para quantificação dos ácidos amargos e do xanthohumol disponíveis na literatura.10,11 Estudos recentes demonstram novas metodologias utilizando solventes mais verdes e volumes reduzidos, com validação científica atestada, seja por comparação com os métodos patenteados ou por estudos de dopagem e recuperação analítica.12,13 O mercado do lúpulo no Brasil é expressivo e seu consumo se dá por pequenas, médias e grandes indústrias cervejeiras, e produtores artesanais, sendo que mais de 98% deste material é importado.5,13 Dados do Ministério da Indústria e Comércio Exterior do Brasil (Comex Stat) mostram que, entre o biênio 2021-2022, foram importados mais de 150 milhões de dólares de flores de lúpulo trituradas ou em pellets, extratos e concentrados.14 De olho neste mercado, produtores rurais, investidores e órgãos do governo federal estão investindo no desenvolvimento de plantações de lúpulo em diferentes regiões do país, principalmente nas regiões Sul e Sudeste.1,15 Grandes empresas brasileiras do ramo cervejeiro, como AMBEV® (Lajes, SC) e o grupo Petrópolis® (Teresópolis, RJ), estão cultivando diferentes variedades de lúpulo em suas propriedades e em parceria com agricultores locais.16 Atualmente, já existe uma associação nacional de produtores (APROLUPULO®), viveiros com autorização do Ministério da Agricultura para a comercialização de mudas certificadas de diferentes cultivares importadas; e empresa fornecedora de máquinas para coleta e processamento automatizado das flores.17,18 O cenário científico acerca de estudos com esta variedade vegetal no Brasil vem tomando destaque nacional. Dessa forma, é patente a promoção de diferentes eventos científicos anuais, como o Encontro Brasileiro de Pesquisadores e Produtores de Lúpulo (ENBRALÚPULO), simpósios e congressos (Academia da Cerveja), além de grupos de pesquisas em diferentes Instituições de Ensino Superior público e privado, para embasar e atender às demandas que essa nova e promissora atividade apresenta. Apesar da recente ascensão no crescimento de plantações, os produtores enfrentam dificuldades em encontrar laboratórios especializados nas análises químicas, em comum acordo com métodos analíticos reconhecidos como os da American Society of Brewing Chemists (ASBC®, EUA) e European Brewery Convention (EBC), que possam atestar a qualidade do material produzido em solo nacional a custo acessível.19,20 O número de publicações disponíveis na literatura acerca da concentração dos compostos de interesse nas amostras produzidas no Brasil ainda é incipiente. Neste contexto, numa região inusitada - o semiárido nordestino - para plantação desta variedade vegetal oriunda de cultivos principalmente em regiões frias, plantações experimentais estão sendo desenvolvidas por um administrador rural em parceria com agricultores locais, no agreste do Rio Grande do Norte (Monte Alegre), no sertão e na serra Cearense (Quixadá e Guaraciaba do Norte). Em algumas destas plantações, as plantas produziram três floradas (safras) ao longo de um ano.15,21,22 Nesse sentido, este estudo avaliou a presença dos ácidos amargos, xanthohumol e óleos essenciais em flores de lúpulo de distintas cultivares, produzidas no agreste potiguar, no semiárido do Ceará e na Serra da Ibiapaba, buscando verificar a adaptação destas plantas aos locais de plantação e atestar sua qualidade.
PARTE EXPERIMENTAL Padrões, reagentes e materiais Água deionizada Milli-Q®. Metanol e acetonitrila (HPLC) foram adquiridos de Bio-Grade® (Durham, EUA) e ácido acético (HPLC) de Dinâmica® (Indaiatuba, São Paulo). Citrato dibásico de sódio hidratado (C6H6Na2O7⋅1.5H2O), citrato tribásico de sódio hidratado (C6H5Na3O7⋅2H2O), cloreto de sódio (NaCl), sulfato de magnésio anidro (MgSO4), etanol P. A. e tween 80 USP, de Sigma-Aldrich® (Saint Louis, EUA). Sulfato de cálcio anidro (Na2SO4) foi adquirido de Êxodo® (Sumaré, São Paulo). Extrato padrão de calibração internacional de lúpulo ICE-4 (mistura padrão de ácidos amargos, pureza 69,2%: (α1) cohumulona, (α2) n-humulona + adhumulona, (β1) colupulona e (β2) n-lupulona + adlupulona) foi obtido de Labor Veritas® (Zurique, Suíça), hexano grau CG e padrão xanthohumol de Merck Group KGaA® (Darmstadt, Alemanha). Lúpulos em pellets BarthHaas Group® (Nuremberg, Alemanha) das variedades Cascade (safra 2021) e Citra (safra 2021) foram adquiridos em loja de insumos cervejeiros (Fortaleza, Ceará). Aquisição do material botânico Todos os materiais vegetais das diferentes cultivares e safras analisados neste trabalho foram coletados em plantas adquiridas de fonte comercial, replicadas de mudas importadas com certificação e registro no Ministério da Agricultura, Pecuária e Abastecimento do Brasil (MAPA), doadas pelo viveiro Lúpulo Ninkasi® (Teresópolis, Brasil) ao produtor. Por se tratar de plantas certificadas pelo MAPA, não houve coleta e depósito de exsicata do material botânico. As flores (cones) de lúpulo das diferentes cultivares e safras avaliadas neste trabalho foram fornecidas e cultivadas durante o triênio 2019-2022, pelo administrador rural e servidor público aposentado, integrante da APROLÚPULO®, Armando Marques Junior, que desenvolve plantios experimentais no Rio Grande do Norte e em parceria com agricultores do Ceará. Cones de duas diferentes plantações de lúpulo localizadas num mesmo município do Rio Grande do Norte e de duas cidades do Ceará, foram avaliados ao longo do período supracitado, sendo as análises realizadas num intervalo compreendido entre 3-5 meses após cada colheita. Inicialmente, foram obtidos cones de primeira floração das cultivares Yakima Gold e Centennial, produzidas nos municípios de Monte Alegre (6º 04' 04" S 35º 19' 55" O, Sítio Arenã, RN), Quixadá (4º 58' 15" S 39º 0' 54" O, Fazenda Santa Helena, CE) e Guaraciaba do Norte (4º 10' 01" S 40º 44' 52" O, Sítio Carcará Orgânico, CE). O cultivo destas amostras no Rio Grande do Norte iniciou-se em abril de 2019 e no Ceará entre julho e setembro do mesmo ano, sendo os cones colhidos após 4-5 meses de plantio. Em Guaraciaba do Norte (CE) as plantas foram nutridas com adubação exclusivamente orgânica, enquanto nas demais propriedades foi utilizada adubação mista (orgânica e química). Flores das cultivares Cascade e Columbus, produzidas em Monte Alegre, RN (Sítio Arenã), foram obtidas durante três safras consecutivas (1ª, 2ª e 3ª florações), ao longo de um ano (2020-2021), para monitoramento dos compostos de interesse. Parte das amostras de Columbus foram submetidas a estresse hídrico severo a partir do início da terceira floração, tendo o seu tempo de irrigação por gotejamento diário reduzido em 90%, para avaliar/simular o efeito na qualidade dos cones produzidos em situações de seca, comuns no semiárido nordestino. As substâncias de interesse também foram quantificadas nos cones das cultivares Comet, Galena, Southern Cross, Cluster, Cascade e Zeus de primeira floração, cultivadas em outra propriedade rural (Fazenda Varela) localizada no município de Monte Alegre, entre agosto e dezembro de 2022. Essas amostras tiveram os seus óleos essenciais extraídos e analisados conforme descrição posterior. Na Fazenda Varela e em Guaraciaba do Norte, a estrutura de sustentação das plantas utilizada foi por treliça alta (simples e em V), com espaçamento de 1,0 e 3,3 metros entre as plantas e linhas, respectivamente. Nas outras plantações acima mencionadas, a estrutura de sustentação utilizada para o crescimento das diferentes cultivares foi o formato adaptado de torres, contendo 1 poste central (6,0 m de altura) e 8 plantas distribuídas em uma base circular com diâmetro de 3 m e espaçamento de 1,0 m. Não foi utilizada suplementação luminosa em nenhuma das plantações. Todas as amostras foram recebidas em embalagens metalizadas seladas a vácuo, com umidade entre 8 e 13% (m/m), sendo mantidas sob refrigeração (5 ºC) até o período de análises. Pellets comerciais das variedades Cascade e Citra, ambos da safra de 2021, foram adquiridos em loja de insumos cervejeiros na cidade de Fortaleza, para posterior comparação com os materiais produzidos na região Nordeste. As flores enviadas para análises foram obtidas da colheita do plantio de 30 a 60 plantas de cada uma das cultivares estudadas, nas diferentes localidades mencionadas, no qual o montante de flores colhidas passou por amostragem, antes do empacotamento e envio para as análises. A amostragem ocorreu de forma aleatória através da coleta de 4 subamostras (~ 400 g) de cada cultivar estudada que foram então homogeneizadas, embaladas e enviadas para análise. Extração de ácidos amargos e xanthohumol utilizando o método QuEChERS Os compostos de interesse das diferentes amostras de cones e pellets de lúpulo analisadas foram obtidos através de extração assistida por sal, utilizando o método QuEChERS descrito por Marques et al.13 A quantidade de 0,5 g das flores trituradas em processador de lâminas (Moulinex-DP700, França) foi inserida em tubos de centrifugação (50 mL) e adicionados 7,5 mL de água ultrapura (Milli-Q®) com auxílio de micropipeta (Gilson-P5000, França) sendo o sistema homogeneizado em vortex (Kasvi-K40/1020, Coreia do Sul) por um minuto. Após a agitação, as amostras permaneceram em repouso por 10 min, adicionando-se, após esse tempo, 10 mL do solvente extrator acetonitrila (ACN), sendo homogeneizadas em vortex por mais um minuto. Em seguida, inseriu-se nos tubos a mistura de sais (salting out) contendo: 6 g de MgSO4; 1,5 g de NaCl; 1,5 g de C6H5Na3O7.2H2O e 0,75 g de C6H6Na2O7⋅1.5H2O, para promover a separação da fase aquosa e do sobrenadante, o qual contém os compostos de interesse.13 As soluções sobrenadantes foram retiradas com micropipeta (Gilson-P1000, França) e acondicionadas em Eppendorfs (2 mL), diluídas em ACN (1:5-1:20), homogeneizadas em vortex e banho ultrassônico (Bandelin Sonorex-RK100, Alemanha). Após a homogeneização, as amostras foram centrifugadas (Eppendorf-5415R, Alemanha), por 5 min (13.000 rpm) à temperatura de 25 ºC e inseridas em vials para análises cromatográficas.13 As extrações foram realizadas em triplicata (n = 3) e seguindo o mesmo protocolo acima descrito, para todas as cultivares apresentadas neste trabalho, sendo analisadas individualmente por cromatografia líquida, conforme descrição a seguir. Nas extrações com os pellets comerciais, uma das extrações em triplicata (1 de 3) foi realizada com o dobro de massa vegetal (1,0 g) para averiguar o limite de solubilização do solvente extrator. Obtenção das curvas padrão e análises por cromatografia líquida de alta performance (HPLC-DAD) As curvas padrão de calibração para a quantificação dos ácidos amargos (α e β) foram obtidas a partir de sete soluções (n = 7) do extrato de calibração internacional de lúpulo (ICE-4) em diferentes concentrações (0,25-4 mg mL-1), enquanto, para o xanthohumol, foram preparadas seis soluções (n = 6) a partir do composto puro (0,006-0,18 mg mL-1), sendo ambos os padrões dissolvidos em ACN. As soluções foram analisadas por cromatografia líquida e os espectros de absorção UV-Vis de cada um dos picos cromatográficos foram inseridos na biblioteca espectral do equipamento, para posterior comparação com as amostras. As análises cromatográficas de todas as amostras (padrões e extrações) foram realizadas em cromatógrafo líquido de alta eficiência (Agilent 1260 Infinity, Alemanha) equipado com coluna de fase reversa C-18 (Agilent eclipse plus - 3,5 μm, 4,6 × 100 mm) e detector de arranjo de diodos (Agilent 1260 Infinity G1315D, 1260 DAD VL, Alemanha). Os eluentes foram metanol (A) e solução aquosa de ácido acético a 2% (B), 35 min de corrida cromatográfica com o seguinte perfil de gradiente: 75% A (0-5 min), 100% A (5-15 min), 75% A (15-35 min). A taxa de vazão de solvente foi de 1 mL min-1 e os volumes de injeção de 10 μL.13 O cromatógrafo foi programado para detecção dos compostos de interesse em quatro diferentes comprimentos de onda (254, 278, 326 e 340 nm), nos quais os α-ácidos, β-ácidos e xanthohumol foram quantificados nos comprimentos de onda de 326, 278 e 340 nm, respectivamente, sendo esta escolha baseada na análise dos espectros de absorção UV-Vis e dos valores dos coeficientes de determinação (R2) obtidos nas curvas de calibração. As curvas padrão de calibração, as equações de reta, os tratamentos estatísticos, os desvios padrão relativo (% RSD) e os cálculos das concentrações dos compostos (em g 100 g-1) foram realizados usando o software Microsoft Excel 365.23 Os parâmetros limite de detecção (LD) e limite de quantificação (LQ), foram determinados a partir das curvas de calibração dos padrões, obtendo a partir dessas os valores de desvio-padrão do intercepto (Sa) e o coeficiente angular da curva analítica (b), conforme descrito por Pontes et al.24 O limite de detecção foi obtido a partir da Equação 1:  A equação matemática para determinação do limite de quantificação é apresentada a seguir (Equação 2):  Análise estatística Os dados analíticos foram obtidos em triplicata e tratados utilizando análise de variância (ANOVA) com múltiplos fatores e as médias foram comparadas utilizando teste de Tukey com 95% de confiança. Todos os dados foram tratados utilizando Microsoft Excel 365.23 Obtenção dos óleos essenciais (hidrodestilação) Os óleos essenciais das cultivares Comet, Galena, Southern Cross, Cluster, Cascade e Zeus coletados na Fazenda Varela (RN) em 2022, foram obtidos por meio de hidrodestilação (n = 1), conforme procedimento descrito por Santos Filho et al. ,25 com adaptações. Adicionou-se 50 g dos cones de lúpulo em balão de destilação (2 L) aferido até metade de seu volume com água deionizada (≈ 1,30 L). O sistema foi acoplado a extrator Clevenger e mantido em funcionamento por 4 h. Os óleos obtidos foram avaliados quanto ao seu volume (mL 100 g-1), coletados, secos em Eppendorfs (2 mL) contento sulfato de sódio anidro sólido, acondicionados em vials âmbar hermeticamente fechados e mantidos a 4 ºC até o período de análises. Análises dos óleos essenciais por cromatografia gasosa e espectrometria de massas (CG-EM) O processo de preparação dos óleos essenciais e análises por cromatografia gasosa acoplada a espectrometria de massas (CG-EM) foram realizados de acordo com metodologia descrita por Adams26 e adaptada por Santos Filho et al.25 Inicialmente, foram preparadas soluções de cada óleo (100 mg mL-1), diluídos em etanol P. A. (50%), tween 80 USP (1%) e água deionizada (49%). Dez microlitros de cada uma dessas misturas foram diluídos em 990 μL de hexano grau CG e posteriormente injetadas em triplicata (n = 3) no equipamento. A caracterização química dos óleos foi conduzida em equipamento Agilent GC-7890B/MSD5977A-quadrupolo, 70 eV, equipado com coluna metilpolissiloxano HP-5MS (30 m × 0,25 mm × 0,25 μm; Agilent, Santa Clara, CA, EUA). O tempo de corrida cromatográfica foi de 34,5 min, sendo a temperatura inicial do forno de 70 ºC, com a seguinte rampa de aquecimento: 4 ºC min-1 até 180 ºC, 14 ºC min-1 até 250 ºC, mantidos até o final da corrida. Utilizou-se gás hélio (fluxo de 1,00 mL min-1, 8,8 psi), com velocidade linear constante (36,8 cm s-1) e 1 μL de volume de injeção. A temperatura da fonte de íons foi de 150 ºC, interface 280 ºC, injetor 250 ºC, com intervalo de varredura de massas entre 40-600 m z-1. Os índices de retenção dos constituintes químicos dos óleos essenciais de lúpulo, foram calculados em relação a injeção de uma mistura de padrões contendo uma série homóloga de alcanos (C7-C30) em coluna HP-5MS.25 A identificação dos constituintes químicos foi realizada por comparação dos espectros obtidos com os do Instituto Nacional de Padrões e Tecnologia (NIST) e dados da literatura.26 A concentração relativa (%) de cada constituinte foi calculada pelo quociente entre as áreas de pico de cada substância pela área total integrada. Os valores de desvio padrão relativo (% RSD) foram calculados com base nos valores das medidas cromatográficas realizadas em triplicata para cada amostra usando o software Microsoft Excel 365.23
RESULTADOS E DISCUSSÃO Análise quantitativa de ácidos amargos e xanthohumol nas flores de lúpulo avaliadas utilizando cromatografia líquida (HPLC-DAD) A Figura 1 apresenta os cromatogramas obtidos para as soluções dos padrões utilizados na construção das curvas de calibração do xanthohumol e dos ácidos amargos (ICE-4), e das extrações de algumas das cultivares (em 340 nm) avaliadas e pellet comercial. É possível observar que o método cromatográfico aplicado permitiu a separação e identificação satisfatória dos compostos de interesse, considerando os comprimentos de onda avaliados. O xanthohumol (1) apresenta pico único em seu cromatograma com tempo de retenção próximo a 6 min. No padrão internacional ICE-4, os ácidos amargos - (2) cohumulona-α1, (3) n-humulona + adhumulona-α2, (4) colupulona-β1 e (5) n-lupulona + adlupulona-β2 - aparecem com picos de elevada intensidade em tempos de retenção compreendidos entre 13 e 16 min, respectivamente. Os cromatogramas evidenciam um perfil químico muito característico e similar em todas as amostras, independentemente da localidade de produção, demonstrando a presença dos ácidos amargos e do xanthohumol como constituintes majoritários nesta parte da planta e nos mesmos tempos de retenção observados para os padrões, além da presença de outras substâncias em diferentes tempos de retenção. Perfil idêntico foi verificado nas demais cultivares avaliadas neste trabalho e discutidas posteriormente.
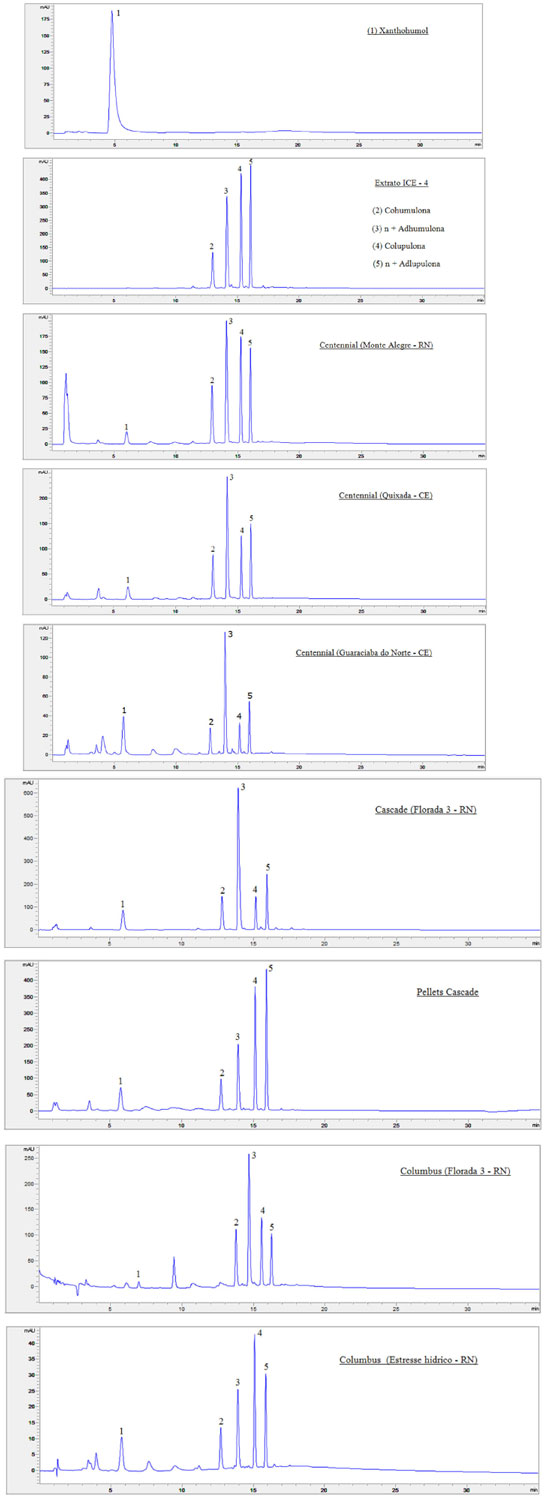 Figura 1. Cromatogramas obtidos por HPLC-DAD (coluna C-18) registrados em 340 nm das soluções padrão de xanthohumol, ácidos amargos (ICE-4), amostras e pellet comercial (Cascade)
Os espectros de absorção (UV-Vis) para os cinco picos identificados nos cromatogramas das amostras demonstram as faixas de absorção características dos ácidos amargos e do xanthohumol (Figura 2), correspondendo aos dados publicados na literatura e também aos espectros das soluções padrões utilizadas nas curvas padrão de calibração, que foram inseridos na biblioteca espectral do equipamento.12,13 Em todas as análises cromatográficas realizadas, os espectros foram comparados com os espectros das soluções padrões, confirmando a presença dessas substâncias nas amostras. Conforme relatado na literatura, os espectros dos ácidos amargos são muito semelhantes entre si devido à presença do mesmo grupo cromóforo.13
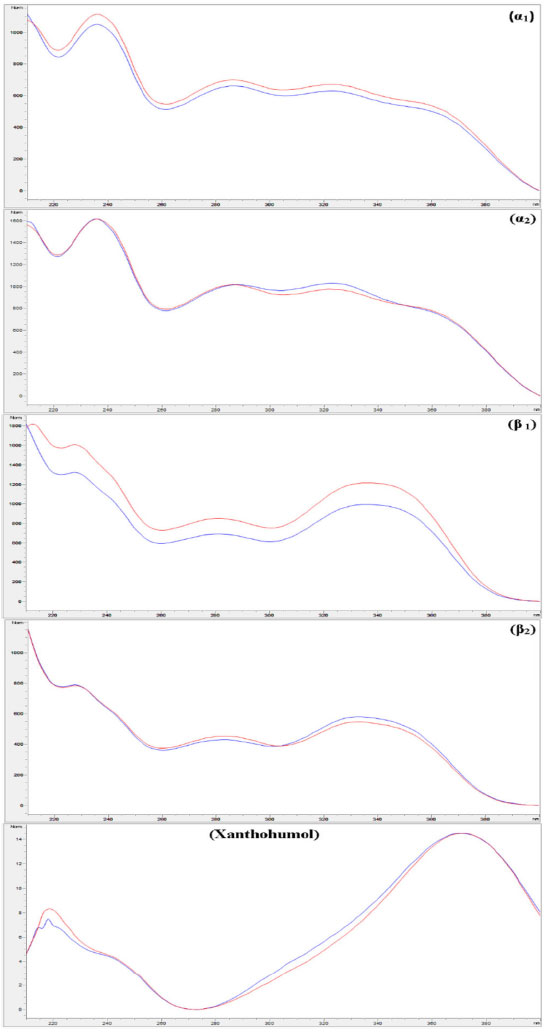 Figura 2. Sobreposição dos espectros de absorção (UV-Vis) obtidos para os picos correspondentes nos extratos de lúpulo (linha azul) com as soluções padrão cadastradas na biblioteca espectral do HPLC (linha vermelha)
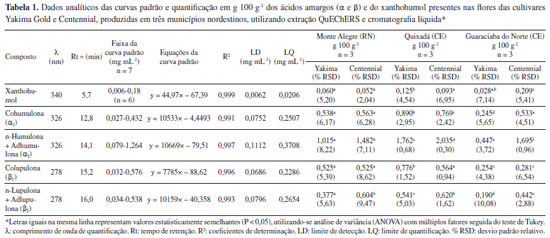
A Tabela 1 apresenta os dados analíticos e as quantificações dos ácidos amargos e do xanthohumol determinadas por HPLC-DAD nos cones das cultivares Yakima Gold e Centennial de primeira floração, em três diferentes plantações cultivadas no Rio Grande do Norte e no Ceará entre 2019-2020. As curvas padrão de calibração para os α-ácidos (324 nm), β-ácidos (278 nm) e xanthohumol (340 nm) demonstraram bons parâmetros analíticos para quantificação destas substâncias nos comprimentos de onda avaliados, considerando os valores dos coeficientes de determinação obtidos a partir das soluções padrão (R2 > 0,99) e os parâmetros LD e LQ calculados, que estão compreendidos dentro das faixas de concentração utilizadas. Os teores estão expressos sob forma de média (em g 100 g-1) das três extrações realizadas (n = 3) em todas as amostras avaliadas, com seus respectivos valores de desvio padrão relativo (% RSD) e dados estatísticos de comparação de médias entre as amostras com 95% de confiança (ANOVA/Tukey).
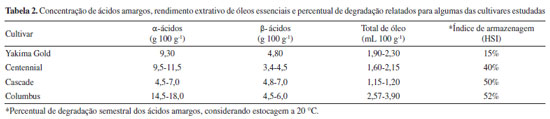
A Tabela 2 apresenta as faixas de concentração dos ácidos amargos, rendimento extrativo dos óleos essenciais e os índices de armazenagem (HSI), de algumas das cultivares analisadas neste trabalho. Os dados foram utilizados como referência para discussão dos resultados e obtidos no portifólio-analítico disponível no site do grupo Barth Haas® e no software de elaboração de receitas cervejeiras BeerSmith3® (versão 3.2.7).27
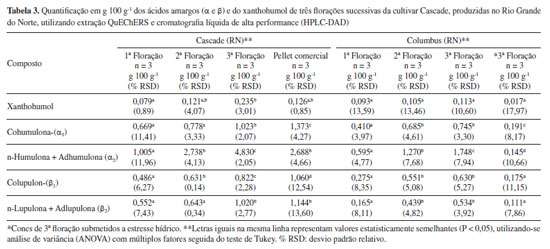
Conforme indicado na Tabela 2, as variedades Yakima Gold e Centennial apresentam teores de α-ácidos totais (αtotal = α1 + α2) entre 9,3 e 11,5 g 100 g-1, e para β-ácidos totais (βtotal = β1 + β2), entre 3,4 e 4,8 g 100 g-1, sendo consideradas variedades de amargor de moderado a alto. Conforme demonstrado na Figura 1, foi possível realizar a quantificação dos ácidos amargos e do xanthohumol em todas as amostras analisadas. Os α-ácidos se formaram em maior quantitativo do que os β-ácidos e a cultivar Centennial foi a que apresentou os maiores valores de αtotal, independentemente da plantação de origem. Os teores de αtotal para Yakima Gold variaram de 0,692 a 2,652 g 100 g-1 e a amostra oriunda do cultivo em Quixadá teve maior quantitativo entre todas as plantações. Nesta, os valores de αtotal representaram 28% do valor de referência, já em sua primeira floração; porém, a proporção α1/αtotal se mostrou levemente acima do esperado para esta variedade.28 A cultivar Centennial apresentou valores de αtotal entre 2,045 e 2,804 g 100 g-1, sendo os resultados das diferentes plantações, estatisticamente semelhantes para maioria das substâncias e inferiores ao mínimo esperado para esta cultivar. A proporção α1/αtotal se mostrou muito similar entre todas as plantações (24-27%), estando dentro do esperado para esta variedade.28 Os teores de xanthohumol variaram de 0,028 a 0,209 g 100 g-1, sendo o resultado mais expressivo obtido para a cultivar Centennial oriunda do município de Guaraciaba do Norte (CE). Apesar dos ácidos amargos totais entre as amostras, não apresentarem no geral, diferença estatística significativa nas concentrações, o cultivo com adubação exclusivamente orgânica na serra da Ibiapaba (CE), segundo o produtor, propiciou aumento de aproximadamente 10% na produtividade dos cones de ambas as variedades em relação as demais plantações. Os dados de desvio padrão relativo (% RSD) variaram de 0,3 a 10,08, indicando boa precisão analítica nas extrações realizadas em triplicata, para as análises de cada cultivar. Desta forma, os resultados apontam que, em sua primeira floração, as plantas cultivadas nos estados do Rio Grande do Norte e do Ceará se mostraram em processo de adaptação às regiões de plantio já que as quantidades de ácidos amargos foram inferiores ao mínimo esperado para todas as cultivares. Dados da literatura apontam que os teores de ácidos amargos nas flores de lúpulo tendem a aumentar durante os três anos de idade da planta, mantendo-se estáveis por até 20 anos, desde que fornecidas as condições adequadas de cultivo.29 Ressalta-se que a baixa quantidade de ácidos amargos e dos óleos essenciais encontrados nos primeiros anos de cultivo é esperada, conforme dados da literatura, sendo o lúpulo denominado tecnicamente em língua inglesa por "baby hop".30,31 Em publicação recente, Leles et al. 32 demostraram resultados significativos de α-ácidos já na primeira floração, utilizando espectrofotometria para quantificação e o cultivo das plantas com suplementação luminosa no estado do Paraná. A Tabela 3 apresenta os resultados para quantificação de ácidos amargos e xanthohumol (g 100 g-1) das cultivares Cascade e Columbus, produzidas no Rio Grande do Norte, ao longo de três floradas consecutivas, do estresse hídrico e de pellet comercial (Cascade), com dois anos de estocagem (safra 2021).
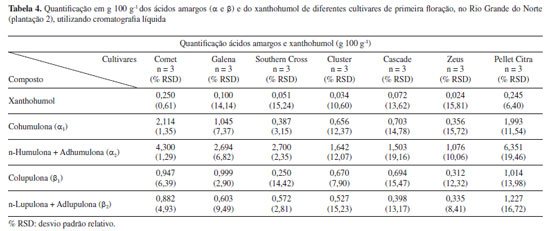
Os valores relativos à primeira floração para a cultivar Cascade, são muito similares aos valores das cultivares anteriores, segundo os quais αtotal e βtotal representam aproximadamente 30% do relatado na Tabela 2. Ao se analisar o resultado quantitativo da segunda floração, nota-se aumento no teor de αtotal (3,511 g 100 g-1), porém apenas α2 (n + adhumulona) e β1 (colupulona) apresentaram crescimento com significância estatística. Na terceira floração, verifica-se aumento na concentração de todas as substâncias em relação às floradas anteriores, sendo inclusive o teor de αtotal na amostra cultivada no Rio Grande do Norte (5,655 g 100 g-1) superior ao teor encontrado no pellet comercial (4,061 g 100 g-1), avaliado nas mesmas condições analíticas, porém contendo aproximadamente dois anos de armazenamento. Diferentes trabalhos relatam a degradação de ácidos amargos nas flores de lúpulo e de seus isomerizados na cerveja em função do tempo de estocagem, seja por suscetibilidade ao oxigênio ou ação da temperatura.33-35 A cultivar Cascade por exemplo, segundo dados do Beer Smith3®, sofre degradação de 50% dos teores de α-ácidos a cada 6 meses, se estocado a 20 ºC. Os fabricantes indicam a estocagem do lúpulo em temperaturas entre 0-5 ºC, na ausência de luz, de forma a minimizar esta degradação. No que se refere aos teores de xanthohumol, não se observa diferença estatística relevante entre todas as florações e o pellet comercial. As extrações realizadas com o dobro da massa dos pellets (1,0 g) apresentaram valores de área praticamente iguais ao dobro das extrações com 0,5 g, demonstrando que o limite de solubilização do solvente extrator não foi atingido. As proporções α1/αtotal desta cultivar foram dentro da faixa esperada (31-40%) para esta variedade em todas as florações e também no pellet comercial.28 Desta forma, evidencia-se que, com a sucessão das colheitas desta cultivar na região de plantio, o material vegetal apresentou qualidade superior à do pellet comercial, o que demonstra, em termos de concentração das substâncias de interesse, uma boa viabilidade econômica para o desenvolvimento desta cultivar nesta área de plantio. Adicionalmente, ressalta-se que as três florações foram obtidas em apenas 12 meses de cultivo, indicando a possibilidade de três safras anuais, propiciando, desta forma, maior produtividade e renda para agricultores locais. Porém, ressalta-se que o lúpulo é uma planta com ciclo de vida longo e, desta forma, os dados não permitem avaliar o efeito das três safras anuais na sua longevidade, considerando que, em grande parte das plantações, é obtida apenas uma ou duas florações anuais. A Tabela 3 também apresenta as concentrações dos ácidos amargos e do xanthohumol (g 100 g-1) para a cultivar Columbus (Monte Alegre, RN), monitorada ao longo de três florações consecutivas, porém com parte das plantas submetidas a estresse hídrico durante a produção da terceira safra. De maneira diferente da cultivar Cascade, não se percebe aumento significativo nas concentrações de ácidos amargos totais entre as florações e que mesmo na terceira floração, os valores ainda estão distantes da faixa relatada para esta variedade, que é considerada de elevado amargor (αtotal 14,0-8,0 g 100 g-1). As quantidades de xanthohumol são estatisticamente idênticas em todas as florações e até mesmo no estresse hídrico. Uma drástica redução na concentração de todas as substâncias é verificada após as plantas serem submetidas ao racionamento de água em sua terceira safra consecutiva (estresse hídrico), bem como na produtividade dos cones, demonstrando a importância da reserva hídrica necessária para a produção de flores com qualidade. Portanto, os dados indicam mais uma vez que a concentração dos compostos de interesse da indústria cervejeira (ácidos amargos) tende a aumentar ao longo da maturação das plantas e que o fornecimento de irrigação em quantidade adequada é de suma importância para que as plantas consigam produzir flores com qualidade comercial. Considerando-se que a região Nordeste possui inúmeras áreas com escassez de água, os dados apontam para o desenvolvimento de plantações apenas em locais que contenham reserva hídrica suficiente, tendo em vista que a planta necessita de quantidade significativa de água para o seu desenvolvimento, principalmente durante o processo de produção das flores, e que são necessárias florações sucessivas para se obterem cones com elevada concentração dos ácidos amargos. Segundo Souza,30 em países do hemisfério norte com clima árido e médias de temperaturas inferiores à do Brasil, o consumo hídrico da planta varia de 700 a 800 mm durante o ciclo de produção. Nakawuka et al. 36 demonstraram que o estresse hídrico de até 40% em cultivares de Willamette não provocou alteração significativa nos valores de ácidos amargos, porém reduziram a produtividade das plantas. A Tabela 4 mostra os resultados da quantificação dos ácidos amargos (α e β) e do xanthohumol para uma segunda plantação desenvolvida no município de Monte Alegre (Fazenda Varela), na qual foram implantadas novas cultivares, utilizando sistema de produção mais atualizado. Novamente foi possível observar a formação dos ácidos amargos e do xanthohumol em todas as amostras analisadas, em quantidades inferiores aos valores de referência para estas cultivares.
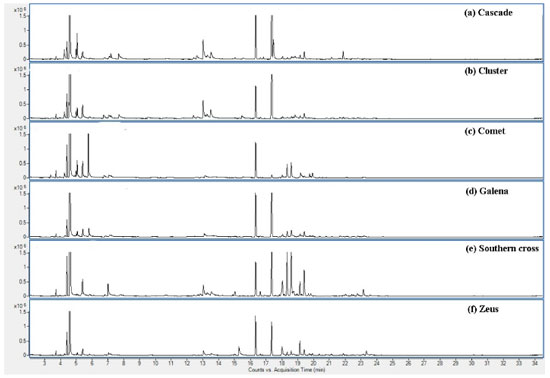
A cultivar Comet apresentou expressiva quantidade de αtotal (6,414 g 100 g-1) e βtotal (1,829 g 100 g-1), correspondendo a 69% e 60%, respectivamente, do esperado para estas substâncias numa planta já em estado de maturação.28 As cultivares Galena e Southern Cross também revelaram representativos teores de αtotal, 3,739 e 3,087 g 100 g-1, respectivamente, demonstrando serem variedades com elevado potencial de desenvolvimento nesta área, considerando os resultados obtidos para sua primeira floração. As demais cultivares (Cluster, Cascade e Zeus), apresentaram valores de αtotal entre 1,432 e 2,298 g 100 g-1 e βtotal entre 0,647 e 1,197 g 100 g-1. Curiosamente, as cultivares que apresentaram maiores valores de ácidos amargos totais (αtotal + βtotal) também foram as que possuíam maiores quantitativos de xanthohumol (Comet e Galena). A Tabela 4 também apresenta os dados quantitativos para uma amostra de pellet comercial (Citra®) contendo dois anos de estocagem e submetida às mesmas condições analíticas das flores. A embalagem indica um teor de αtotal igual a 12,4 g 100 g-1 e, para βtotal, uma faixa de 3,5 a 4,5 g 100 g-1, sendo a proporção α1/αtotal de 22 a 24%. Os resultados confirmam a ocorrência de aproximadamente 67% da concentração relatada no rótulo para os ácidos amargos, considerando o método de extração aplicado, demonstrando o efeito da estocagem na degradação dos compostos de interesse. A proporção α1/αtotal coaduna com a informação indicada no rótulo (23,9%). Ao se compararem esses resultados com a cultivar Comet de primeira floração, nota-se que ela possui 77% da composição de αtotal presente nos pellets. Isto demonstra que, devido ao fato de os pellets importados chegarem ao mercado brasileiro já com um tempo significativo de degradação dos compostos em função da estocagem, o lúpulo produzido em território nacional, devido à possibilidade de sua utilização de forma mais fresca, pode já competir com o produto importado, mesmo em plantas ainda em desenvolvimento da maturação. Análises dos óleos essenciais por cromatografia gasosa acoplada à espectrometria de massas (CG-EM) Os dados de CG-EM revelam a identificação de 33 substâncias químicas distintas nos óleos essenciais das seis diferentes cultivares avaliadas (Comet, Galena, Southern Cross, Cluster, Cascade e Zeus). Os cromatogramas (Figura 3) demonstram que o método aplicado permitiu a separação e identificação satisfatória de terpenos alifáticos, alicíclicos e diferentes compostos oxigenados, como ésteres, álcoois, cetona e epóxidos, sem a presença de compostos sulfurados. Também foi possível observar a presença de substâncias muito características dos óleos essenciais de lúpulo, como: mirceno, humuleno, cariofileno, cadinenos, limoneno, linalol e epóxidos de humuleno.1,2,25 Os dados completos de identificação e quantificação das substâncias encontradas em cada cultivar estão apresentados no material suplementar (Tabela 1S). Grande parte das substâncias identificadas é comum a todas as cultivares, porém Cluster apresentou uma variedade de substâncias de menor complexidade em seu óleo essencial, em relação às demais.
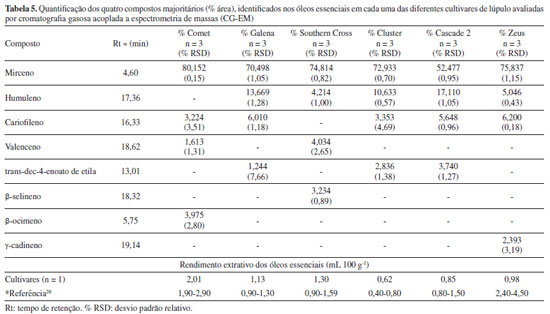
A Tabela 5 apresenta os constituintes majoritários dos óleos essenciais de cada uma das cultivares, bem como os rendimentos extrativos dos óleos (em mL 100 g-1 de flores) obtidos por hidrodestilação. É possível verificar que os quatro constituintes majoritários das seis diferentes cultivares avaliadas são representados por apenas oito substâncias distintas, indicando um perfil similar em relação às substâncias químicas majoritárias presentes. Mirceno aparece como o constituinte majoritário em todas as cultivares, em teores elevados (52,4-80,15%), o que coaduna com diferentes relatos da literatura, nos quais indicam que esta substância merece destaque, pois costuma ser o composto majoritário encontrado, chegando a constituir 60% do total do óleo, remetendo a aromas herbáceos e de lúpulo fresco.1,2,37 Humuleno e cariofileno também aparecem como constituintes em quase todas as cultivares.
Portanto, todas as cultivares apresentaram as principais substâncias características dos óleos essenciais de lúpulo e dentro de quantitativos já relatados para esta variedade vegetal. Verifica-se também a presença de hidrocarbonetos sesquiterpênicos, pouco comuns ou nunca relatados em óleos de lúpulo destas cultivares, como: yangleno, valenceno, guaia-3,9-dieno,10s,11s-himachala-3(12),4-dieno e selina-3,7(11)-dieno. Estas composições podem conferir características sensoriais específicas aos óleos, adquiridas devido à adaptação da planta à região de plantio. Os rendimentos extrativos por hidrodestilação mostraram resultados satisfatórios para praticamente todas as amostras, considerando que apenas a cultivar Zeus não conseguiu produzir a quantidade mínima de óleo esperada. Portanto, os dados apontam que as amostras produzidas nesta localidade, além de produzirem óleos em quantidade significativa já em sua primeira floração, apresentam constituintes que podem diferenciá-los das amostras comerciais.
CONCLUSÕES Todas as amostras produzidas na região Nordeste apresentaram, em sua constituição química, os principais compostos de interesse industrial independentemente do estado de maturação das plantas ou do município de cultivo. À medida que os ciclos de floração das plantas se sucederam, foi possível observar o aumento gradual na concentração dos ácidos amargos, sendo que a terceira safra da cultivar Cascade já apresentou teores de ácidos amargos dentro da faixa esperada para uma planta madura e inclusive superiores aos do pellet comercial avaliado, indicando ser uma variedade promissora para esta região de cultivo, considerando ainda que estas safras foram obtidas apenas em um ano após início do plantio. O estresse hídrico a que foi submetida a cultivar Columbus promoveu uma redução acentuada na qualidade do material produzido, o que mostra ser inviável a produção de lúpulo em regiões com escassez de água. As cultivares Comet, Southern Cross e Galena produziram elevados teores de αtotal e óleos essenciais já em sua primeira floração, demonstrando novamente o potencial para o desenvolvimento destas cultivares na região Nordeste. Nota-se que este é o primeiro relato na literatura contendo os teores de ácidos amargos, xanthohumol e caracterização dos óleos essenciais apresentados para flores de lúpulo cultivadas nesta região.
MATERIAL SUPLEMENTAR A Tabela 1S apresenta todas as substâncias identificadas nos óleos essenciais das cultivares de lúpulo avaliadas por cromatografia gasosa (CG-EM), estando disponível em http://quimicanova.sbq.org.br no formato pdf, com livre acesso.
AGRADECIMENTOS À Fundação Cearense de Apoio ao Desenvolvimento Científico e Tecnológico (FUNCAP) e ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq). Ao produtor A. M. Junior pelo fornecimento do material vegetal.
REFERÊNCIAS 1. Durello, R. S.; Silva, L. M.; Bogsz Junior, S.; Quim. Nova 2019, 42, 900. [Crossref] 2. Hieronymus, S.; For The Love of Hops: The Practical Guide to Aroma, Bitterness and the Culture of Hops, 1st ed.; Brewers Publications: Boulder, 2012. 3. Ting, P. L.; Ryder, D. S.; J. Am. Soc. Brew. Chem. 2017, 75, 161. [Crossref] 4. Daniels, R.; Designing Great Beers: The Ultimate Guide to Brewing Classic Beer Styles, 1st ed.; Brewers Publication: Boulder, 1998. 5. Arruda, T. R.; Pinheiro, P. F.; Silva, P. I.; Bernardes, P. C.; LWT 2021, 141, 1. [Crossref] 6. Lafontaine, S.; Varnum, S.; Roland, A.; Delpech, S.; Dagan, L.; Vollmer, D.; Kishimoto, T.; Shellhammer, T.; Food Chem. 2019, 278, 228. [Crossref] 7. Silva, G. V. A.; Arend, G. D.; Zielinski, A. A. F.; Di Luccio, M.; Ambrosi, A.; Food Chem. 2023, 404, 1. [Crossref] 8. Kontek, B.; Jedrejek, D.; Oleszek, W.; Olas, B.; Ind. Crops Prod. 2021, 161, 1. [Crossref] 9. Stevens, J. F.; Page, J. E.; Phytochemistry 2004, 65, 1317. [Crossref] 10. Salviati, E.; Sommella, E.; Carrizzo, A.; Di Sarno, V.; Bertamino, A.; Venturini, E.; Vecchione, C.; Campiglia, P.; J. Pharm. Biomed. Anal. 2021, 201, 1. [Crossref] 11. Kao, T. H.; Wu, G. Y.; Food Chem. 2013, 141, 1218. [Crossref] 12. Sartori, L. O.; Souza, A. A.; Bragagnolo, F. S.; Fortuna, G. C.; Bonfim, F. P. G.; Sarnighausen, V. C. R.; Carneiro, R. L.; Funari, C. S.; Food Chem. 2022, 373, 1. [Crossref] 13. Marques, S. P. D.; Owen, R. W.; Silva, A. M. A.; Alves Neto, M. L.; Trevisan, M. T. S.; Food Chem. 2022, 388, 1. [Crossref] 14. http://comexstat.mdic.gov.br/pt/geral/53543, acessada em agosto 2023. 15. Creuz, A.; Kretzer, S. G.; Lúpulo no Brasil: Perspectivas e Realidades, 1ª ed.; MAPA/SAF: Brasília, 2022. 16. https://www.epagri.sc.gov.br/index.php/2022/02/25/santa-catarina-preve-safra-de-10-toneladas-de-lupulo/, acessada em agosto 2023. 17. https://www.aprolupulo.com.br/, acessada em agosto 2023. 18. https://www.lupulosninkasi.com/, acessada em agosto 2023. 19. https://www.asbcnet.org/Methods/HopsMethods/pages/default.aspx, acessada em agosto 2023. 20. https://brewup.eu/ebc-analytica/hops-and-hop-products/and-acids-in-hops-and-hop-products-by-hplc7/7.7, acessada em agosto 2023. 21. https://guiadacervejabr.com/brasil-produtor-lupulo-america-do-sul-avalia-aprolupulo, acessada em agosto 2023. 22. Lima, F. S. S.; Marques, S. P. D.; Trevisan, M. T. S.; Resumos do 2º Encontro Brasileiro de Pesquisadores e Produtores de Lúpulo, Botucatu, Brasil, 2021. [Link] acessado em agosto 2023 23. Microsoft Excel 365, version 2306, Microsoft; Redmond, WA, USA, 2023. 24. Pontes, A. C. F. B.; Pontes, T. P. A.; Cavalcante, N. G. S.; Sousa Junior, F. L.; Silva, F. O. N.; Pontes, D. L.; Quim. Nova 2023, 46, 336. [Crossref] 25. Santos Filho, L. G. A.; Reis, R. B.; Souza, A. S. Q.; Canuto, K. M.; Brito, E. S.; Castro, K. N. C.; Pereira, A. M. L.; Diniz, F. M.; An. Acad. Bras. Cienc. 2023, 95, 1. [Crossref] 26. Adams, R. P.; Identification of Essential Oil Components by Gas Chromatography/Mass Spectrometry, 4th ed.; Allured Publishing: Chicago, 2007. 27. https://www.barthhaas.com/hops-and-products/hop-varieties-overview, acessada em agosto 2023. 28. https://www.hopslist.com, acessada em agosto 2023. 29. Donner, P.; Pokorný, J.; Ježek, J.; Krofta, K.; Patzak, J.; Pulkrábek, J.; Plant, Soil Environ. 2020, 66, 41. [Crossref] 30. Souza, F. G. G. : Determinação da Evapotranspiração da Cultura e Coeficiente de Cultivo do Lúpulo em Diferentes Texturas de Solo; Tese de Doutorado, Universidade Estadual Paulista Júlio de Mesquita Filho, Botucatu, Brasil, 2021. [Link] acessado em agosto 2023 31. https://www.dpi.nsw.gov.au/agriculture/horticulture/other/hops-a-guide-for-new-growers, acessada em agosto 2023. 32. Leles, N. R.; Sato, A. J.; Rufato, L.; Jastrombek, J. M.; Marques, V. V.; Missio, R. F.; Fernandes, N. L. M.; Roberto, S. R.; Plants 2023, 12, 1. [Crossref] 33. Taniguchi, Y.; Matsukura, Y.; Ozaki, H.; Nishimura, K.; Shindo, K.; J. Agric. Food Chem. 2013, 61, 3121. [Crossref] 34. Caballero, I.; Blanco, C. A.; Porras, M.; Trends Food Sci. Technol. 2012, 26, 21. [Crossref] 35. Kappler, S.; Krahl, M.; Geissinger, C.; Becker, T.; Krottenthaler, M.; J. Inst. Brew. 2010, 116, 332. [Crossref] 36. Nakawuka, P.; Peters, T. R.; Kenny, S.; Walsh, D.; Ind. Crops Prod. 2017, 98, 82. [Crossref] 37. Trevisan, M. T. S.; Valdivia, A. C. R.; Scheffer, J. J. C.; Verpoorte, R.; Biotechnol. Lett. 1997, 19, 207. [Crossref] |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access