Educação
|
|
| Modelos e eletronegatividade: uma proposta de sequência didática para o ensino de química Models and electronegativity: a proposal of didactic sequence for chemistry teaching |
|
Joana Souza Oliveira Galavotti; Luís Felipe Bricks Bim; Marco Aurélio Cebim*
Departamento de Química Analítica, Físico-Química e Inorgânica, Instituto de Química, Universidade Estadual Paulista Júlio de Mesquita Filho, 14800-060 Araraquara - SP, Brasil Recebido em 24/02/2023 *e-mail: marco.cebim@unesp.br Electronegativity is a useful chemical bonding property related to determining the polarity of molecules and formation of partial charges. In the 1930s, Linus Pauling studied the differences between theoretical and experimental binding energy values when he established that ionic contributions in covalent bonds were pertinent to elucidate these differences. The association of the nature of the elements present in the chemical bond with the discordance of results led to the quantitative determination of electronegativity, creating the first scale of this property. In addition, other scales were developed, such as by Robert Mulliken (1934), Albert Allred and Eugene Rochow (1958) and Leland Allen (1989). Although present in undergraduate Chemistry courses, the teaching of electronegativity is little explored in the literature and treated in a fragmented way in many materials. In this way, a didactic sequence is proposed for the approach of electronegativity and the scales designed by Pauling, Mulliken, Allred, Rochow and Allen directed to the first year of undergraduate in Chemistry. For a dynamic study of electronegativity models along with historical basement, modelling-based teaching is used so that students can assess scope, limitations and be able to participate in the creation of a model. INTRODUÇÃO O desenvolvimento da teoria de ligação química, através do modelo do átomo cúbico, por Gilbert Newton Lewis, em 1916, permitiu a compreensão da maneira como átomos se ligam para formar substâncias e compostos, sendo considerada uma teoria abrangente por envolver todos os tipos de ligação química. A ligação química surge do princípio de compartilhamento de um par eletrônico entre dois núcleos atômicos.1 Através dos seus postulados, Lewis indicou que o átomo é formado por um caroço (que contém os elétrons mais internos) e por uma camada externa.2 Durante uma transformação química, o número de elétrons da camada externa, a camada de valência, pode variar entre 0 a 8. A representação dos elétrons dispostos na camada de valência é dada pelo modelo do átomo cúbico em os elétrons são arranjados em cubos concêntricos.2 Os elétrons das camadas mais internas não são representados enquanto os elétrons da camada de valência são colocados nos vértices e as arestas que os conectam representam a ligação química.2 O princípio do compartilhamento de um par eletrônico entre dois núcleos atômicos foi essencial para a proposta de eletronegatividade, feita em 1932, por Linus Pauling.3 Pauling foi responsável por propor a primeira escala de eletronegatividade, sendo tais valores amplamente divulgados em materiais de consulta.4 Dentre esses materiais, os livros didáticos para o Ensino Superior, de forma geral, costumam trazer o tema da eletronegatividade de forma descontextualizada e a-histórica, desconsiderando outras escalas além da elaborada por Pauling.4 Essa forma de abordagem se estende de maneira mais acentuada quando se considera os livros didáticos para o Ensino Fundamental.4 Mesmo presente nos cursos de graduação em Química, a eletronegatividade não é um dos assuntos mais abordados na área de Ensino em Química. Em consulta aos periódicos nacionais Ciência & Educação,Ensaio Pesquisa em Educação em Ciências, Investigações em Ensino de Ciências (IENCI), Química Nova na Escola (QNESC), Revista Brasileira de Ensino de Química e Revista Brasileira de Pesquisa em Educação em Ciências, todos vinculados ao campo do Ensino em Química, no período de 2010 a 2020, notou-se que a eletronegatividade não foi o foco dos trabalhos publicados. Em dois materiais que mencionavam a eletronegatividade havia outro objeto de estudo em que tal propriedade poderia ser trabalhada junto aos alunos em determinada atividade. Tal resultado é coerente com a percepção de que, nos mesmos periódicos, são publicados com maior frequência no período especificado obras conectadas à formação de professores e à experimentação. Dessa forma, sendo a eletronegatividade uma propriedade relevante e altamente difundida para o entendimento do comportamento químico de átomos e moléculas, constituindo o conteúdo programático dos cursos de graduação em Química pela abordagem das propriedades periódicas e considerando que há espaço para se tratar desse assunto na literatura, como abordá-la para um curso de graduação em Química? Pensando nesse questionamento, uma sequência didática sobre Eletronegatividade foi elaborada pelos autores com o intuito de fornecer uma proposta de abordagem do assunto a partir de quatro escalas dessa propriedade. As escalas de eletronegatividade selecionadas foram a de Linus Pauling, Robert Mulliken, Albert Allred e Eugene Rochow, e Leland Allen. Devido à importância da História da Ciência para a contextualização do tema e formação profissional, é interessante destacar a aproximação de Linus Pauling e Gilbert N. Lewis e, consequentemente, as principais ideias ligadas a cada uma das escalas. O Ensino Fundamentado em Modelagem (EFM) é usado como metodologia de ensino na sequência didática. Desse modo, a sequência didática priorizou o reconhecimento das escalas como modelos de entendimento do fenômeno eletronegatividade, os aspectos históricos que circundam o desenvolvimento da temática, o destaque a escalas de eletronegatividade pouco abordadas e, consequentemente, menos reconhecidas pelos estudantes de Química e a modelagem quanto à escala de Pauling. Ligação química Em 1916, Gilbert N. Lewis2 propôs que a ligação química corresponde ao compartilhamento de um par eletrônico a partir do modelo de átomo cúbico. Nesse modelo, os elétrons de valência se encontram dispostos nos vértices de um átomo cúbico em que as arestas representam as ligações químicas formadas.2 A definição da ligação química por esse modelo permitiu a distinção de termos usados na época como sinônimos.1 O contato de Pauling com as ideias de Lewis partiu da leitura do trabalho intitulado The Atom and The Molecule,2 publicado no Journal of the American Chemical Society em 1916.5 Esse contato partia do acesso aos periódicos proporcionado pela biblioteca de Química do Oregon Agricultural College.5 Algum tempo depois, Pauling conheceu Lewis em Berkeley, na Califórnia, e em 1929 passou a ministrar aulas no mesmo local, o que resultou em outros encontros e conversas importantes sobre temas da Química, dentre eles, a ligação química.5 Lewis também foi responsável por discutir o caráter iônico em ligações covalentes a partir do deslocamento do par eletrônico entre átomos diferentes.5 Mais tarde, após as considerações feitas por Pauling, esse deslocamento da densidade eletrônica é compreendido como uma promoção pela diferença da propriedade eletronegatividade dos átomos. Escala de eletronegatividade por Pauling (1932) Pauling3 propôs um conceito quantitativo para eletronegatividade e elaborou a primeira escala dessa propriedade em 1932. Para isso, partiu da observação das medidas experimentais de energia de ligação de moléculas diatômicas heteronucleares.6 O valor teórico da energia de ligação esperado para uma molécula diatômica heteronuclear (AB) seria dado pela energia média de ligação entre moléculas diatômicas homonucleares (A2 e B2), entretanto as medidas experimentais demonstravam valores maiores (Equação 1). Como explicar essa diferença? 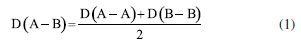 A diferença é consequência do caráter iônico em ligações covalentes promovido pela diferença de eletronegatividade de cada átomo.6 Se cada átomo possui uma capacidade diferente em atrair os elétrons da ligação, então há contribuições mais ou menos relevantes entre as estruturas canônicas de ressonância formadas. Essa discussão sobre as composições estruturais e a natureza das ligações para a formação de uma molécula envolveu os orbitais atômicos mais estáveis.6 Disto, partiram as contribuições do tipo A:B, A+B- e A-B+ que conduzem aos comportamentos puramente iônicos e com alta capacidade de deformação dos íons ou puramente covalentes, ampliando o estudo das estruturas químicas feito por Slater e utilizado por Pauling6 que corrigiu a proposta anterior através do acréscimo de um excesso de energia representado por um ∆ como segue a Equação 2: 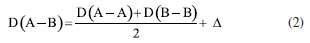 Desse modo, Pauling associou ao Δ introduzido o módulo da diferença ao quadrado da eletronegatividade, à qual é representada pele letra grega "chi" χ, dos elementos genéricos A e B (|χA - χB|2)junto a uma constante de proporcionalidade (c) como visto na Equação 3, afinal as discrepâncias da propriedade intrínseca eletronegatividade dos elementos químicos resultavam nas diferentes contribuições iônicas sob as ligações covalentes dando-lhes valores experimentais maiores que o esperado.6 Dessa maneira, os valores de ∆ serviram como base da criação da escala de eletronegatividade.6  Rearranjando matematicamente a Equação 2 de forma a se isolar o Δ, tem-se a Equação 4: 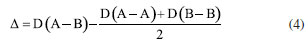 Esperava-se que ∆ assumisse valores positivos já que a energia de ligação de AB seria maior ou igual à média aritmética de A2 e B2, porém isso nem sempre acontecia.6 Nos hidretos alcalinos (MH), se esperava que as ligações tivessem algum caráter iônico do tipo M+H- e Δ aderisse a valores positivos, entretanto a diferença era negativa.6 A partir de um tratamento com respaldo da mecânica quântica, a média que melhor definiria a energia de ligação real, seria dada pela média geométrica e, consequentemente, os valores de ∆ seriam sempre positivos (Δ') (Equação 5).6 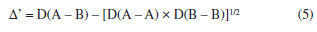 O rearranjo da equação anterior em termos de χ fornece a Equação 6: 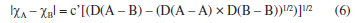 em que:  Dessa forma, pensando na média geométrica, o módulo do quadrado da diferença de eletronegatividades assume a forma da Equação 8. A raiz quadrada de ∆' satisfazia uma relação linear para descrição da diferença de eletronegatividades entre átomos diferentes com base em dados termodinâmicos. Assim, a diferença de eletronegatividade podia ser comparada e determinada através da Equação 9 tomando como base de referência o hidrogênio e/ou o flúor.6 Devido a facilidade em estabelecer ligações químicas com os mais diversos elementos, o hidrogênio exerceu um papel como um padrão de referência para a eletronegatividade e o flúor se estabeleceu como o elemento químico de maior eletronegatividade.6 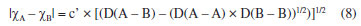 A constante c' assume o valor 0,18 indicado em literatura,6 assim a Equação 8 pode ser reescrita como: 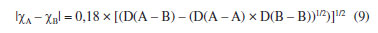 Escala de eletronegatividade por Mulliken (1934) A determinação da eletronegatividade de Robert Sanderson Mulliken7 em 1934 partiu da descrição de função de onda para uma molécula do tipo AB (ψAB) conforme a Equação 10. 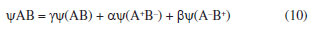 Mulliken analisou os coeficientes junto as contribuições iônicas para a molécula AB e percebeu que as contribuições em energia das partes iônicas (A+B- e A-B+), provavelmente, não demandariam a mesma quantidade em energia para a formação das entidades com densidades de carga diferentes, pois deveria haver um adicional das forças repulsivas atuantes para as duas situações.7 Todavia, assumindo que para grandes distâncias entre os núcleos (r), as energias de formação das contribuições iônicas seriam iguais, Mulliken propôs a eletronegatividade em função das propriedades primeira energia de ionização (EI) e afinidade eletrônica (AE), conforme a Equação 11, de maneira a ser demonstrada empiricamente.7  A afinidade eletrônica corresponde a diferença de energia entre o estado fundamental do elemento neutro e o estado mais baixo do ânion correspondente, sendo que o átomo e o íon devem estar em fase gasosa e isolados8 como representado pela Equação 12:  A afinidade eletrônica varia na tabela periódica de acordo com a carga nuclear efetiva de cada elemento e a estabilidade desse em receber um elétron.9 Assim, os halogênios possuem altos valores de afinidade eletrônica enquanto metais alcalino terrosos apresentam baixa afinidade eletrônica. A energia de ionização depende da carga nuclear efetiva e da estabilidade adquirida pelo elemento para formação do cátion.10 Essa propriedade é definida como a energia mínima necessária para remoção de um elétron de um sistema atômico (átomo ou íon monoatômico) gasoso, isolado e no estado fundamental, sendo representada pela Equação 13 ao considerar a primeira energia de ionização de um átomo neutro (X).8  Elementos com alta afinidade eletrônica possuem a tendência de apresentar altos valores de energia de ionização para formação dos cátions correspondentes. Ambas as propriedades podem ser expressas em elétron-volt (eV) para um sistema atômico isolado ou em quilojoules por mol (kJ mol-1).9 Ao propor uma escala com base nas propriedades periódicas, Mulliken trouxe a ideia de uma eletronegatividade intrínseca ao elemento, sendo independente do estabelecimento de uma ligação química. Portanto, essa escala estima valores de eletronegatividade para os gases nobres e para elementos em diferentes estados de oxidação. Escala de eletronegatividade para Allred e Rochow (1958) Em 1958, Albert Allred e Eugene Rochow11 propuseram uma escala de eletronegatividade baseada na força de atração nuclear entre o núcleo e o elétron. As cargas elétricas são tratadas como cargas pontuais para estimar a força de atração (F) exercida pelo núcleo em relação ao elétron por uma distância equivalente ao raio covalente (r), (e) é a carga do elétron e Zef representa a carga experimentada pelo elétron a partir da interação com o núcleo - a carga nuclear efetiva,11 sendo menor que a carga nuclear real por conta das repulsões elétron-elétron que promovem o efeito de blindagem (Equação 14).  A força de atração determinada atua como uma medida da extensão em que um átomo em uma molécula atrai os elétrons, portanto trata-se de uma medida da eletronegatividade absoluta de um átomo.11 A blindagem é mensurada através da constante de blindagem (σ) por meio das regras de Slater.12 Cada elétron possui uma constante de blindagem diferente em cada subnível particular.13 Desse modo, as regras de Slater foram formuladas para obtenção dos valores médios das constantes de blindagem para cada tipo de elétron.13 A Zef é então determinada a partir da diferença entre o número atômico Z e a constante de blindagem (σ). A Equação 14 foi linearizada por Allred e Rochow11 tomando a forma da Equação 15, para poder ser comparada com a escala de Pauling, fornecendo naquela época valores de eletronegatividade para 44 elementos químicos.11 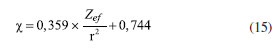 Escala de eletronegatividade por Allen (1989) Em 1989, Leland Allen14 definiu a eletronegatividade, para elementos representativos, como a energia média monoeletrônica dos elétrons de valência no estado fundamental. Representada por ∈s a energia da configuração de valência e Ns o número de elétrons (s) e por ∈p e Np, a energia da configuração e o número de elétrons desta configuração, a energia média das configurações de valência pode ser escrita como na Equação 16.14 O cálculo da energia (E) de um elétron parte da diferença de energia média total de um átomo no estado fundamental e um átomo ionizado isolado.14 Os gases nobres e os halogênios se mantêm como os mais eletronegativos da tabela periódica. 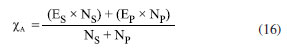 De forma similar, determina-se a eletronegatividade para metais de transição, como segue a Equação 17, em que Nd corresponde ao número de elétrons d.15 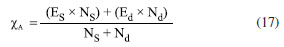
PERCURSO METODOLÓGICO O planejamento é uma ação inerente ao homem que no uso de sua razão pensa sobre seus movimentos no passado, presente e futuro e o planejar foi uma realidade que acompanhou a trajetória histórica da humanidade.16 De forma geral, o planejamento é definido por Martinez e Oliveira Lahone17 como um processo de previsão de necessidades e racionalização de emprego dos meios materiais e dos recursos humanos disponíveis, a fim de alcançar objetivos concretos, em prazos determinados e em etapas definidas, a partir do conhecimento e avaliação científica da situação original. Essa descrição não é específica para um planejamento típico, porém traz elementos essenciais para a compreensão de características necessárias a um planejamento. Todo planejamento requer o conhecimento da realidade e de suas necessidades, tendências e urgências.16 Além disso, para atender ao fim esperado, os objetivos devem ser claros e os meios para a sua realização devem ser definidos e viáveis.16 Deve haver o estabelecimento de critérios e princípios de avaliação e prazos e etapas para execução. Assim, o ato de planejar requer definir o que se deseja alcançar para a partir de então, selecionar os meios e avaliar o que se pretende atingir.16 Ao levar a ação de planejar para a área educacional o uso de um planejamento proporciona a valorização integral do homem, ou seja, a possibilidade de uma formação libertadora e consciente, assim todo o processo educacional requer um planejamento.16 O planejamento deve ser o instrumento direcional de todo o processo educacional, seja em termos nacionais, estaduais, escolares ou relativo às disciplinas e aos conteúdos.16 É o planejamento que possui condições de determinar e indicar prioridades, recursos e meios para a conquista de metas, entretanto não deve ser confundido como uma planificação de atividades.16 Antoni Zabala18 trata das relações de atividade junto a prática educativa. Ao tratar da prática educativa, Zabala defende que a complexidade do processo educativo não permite o fácil reconhecimento dos fatores que o constituem, sendo uma prática fluida e que expressa valores, hábitos e ideias. Ao assumir um aspecto dinâmico para o processo educativo, Zabala explica que os processos educacionais não podem ser resumidos ao momento da aula, mas que devem incluir o preparo anterior e posterior de toda a prática.18 Durante o processo educacional, o planejamento, a aplicação e a avaliação são inseparáveis da atuação docente.18 A atuação docente deve levar em conta as intenções de uma intervenção, as previsões e avaliação dos resultados. Partindo de uma visão processual da prática educativa o planejamento, a aplicação e a avaliação estão estritamente vinculados e a unidade elementar que possui todas essas variáveis é a atividade.18 Durante a intervenção pedagógica no processo de ensino e aprendizagem, ocorrem atividades que envolvem interações entre estudantes, entre estudantes e professores, uso de determinados recursos, atividades avaliativas e estimativa de tempo com o intuito de alguma finalidade educacional.18 As atividades ainda adquirem diferentes valores conforme são aplicadas. Assim, o autor explica que o trabalho em grupo possui uma posição educativa diferente de uma leitura individual, por exemplo. A escolha das atividades, a ordem em que serão aplicadas e as relações entre elas, determinam de forma significativa as características do ensino.18 Dessa maneira, o valor que as atividades adquirem ao longo do processo da prática educativa levaram às sequências didáticas. Por Zabala,18 se compreendem como sequências didáticas "um conjunto de atividades ordenadas, estruturadas e articuladas para a realização de certos objetivos educacionais, que têm um princípio e um fim conhecidos tanto pelos professores como pelos alunos". Nesse sentido, este trabalho traz uma proposta de sequência didática (SD) sobre eletronegatividade com enfoque em quatro interpretações dessa propriedade direcionada aos cursos de graduação em Química. A sequência didática norteadora do trabalho partiu de Antoni Zabala e como metodologia de ensino, foi escolhido o Ensino Fundamentado em Modelagem (EFM). O EFM é baseado em atividade de modelagem que envolve o entendimento sobre modelos. Um modelo corresponde a uma representação parcial de uma entidade, elaborado com um, ou mais, objetivo(s) específico(s) e que pode ser modificado.19 A utilização de modelos na Ciência objetiva a simplificação de entidades complexas e a visualização das abstratas, possibilitando a comunicação de ideias.19 Além do mais, os modelos auxiliam interpretações de experimentos e atuam como medidores entre a realidade modelada e as teorias, fundamentando a elaboração de explicações e previsões. Devido ao caráter representativo, um modelo pode ser modificado à medida que o conhecimento sobre a realidade é alterado e novas proposições se tornam mais adequadas.19,20 A criação de um modelo é ligada a um processo dinâmico, o qual, é conhecido como modelagem. Justi19 sugere quatro etapas fundamentais para a modelagem: elaboração, expressão, teste e identificação de abrangências e limitações. A etapa de elaboração é o momento em que o indivíduo começa a construir mentalmente o seu modelo, realizando ligações entre o conhecimento e as informações disponíveis para posteriormente apresentá-lo a outros pares.19 A etapa de expressão expõe esse modelo de forma concreta, verbal, matemática, visual ou gestual. Na forma concreta são utilizados materiais que personificam um modelo tridimensional enquanto a verbal retrata de forma falada e/ou escrita. A matemática usa equações como modo de interpretação, enquanto a gestual é produzida por gestos corporais. A visual explica o modelo por meio de representações bidimensionais como tabelas e gráficos.19 Esses modos podem ser combinados para expressão dos modelos. A fase de testes provoca a reconsideração, mas cabe destacar que o modelo construído não precisa ser igual ao científico.19 Logo, a modelagem dá ênfase ao processo de construção de modelos o que permite a vivência de execução/aprender Ciências. A identificação de abrangências e limitações conduz a novas reformulações e conclusões que podem, até mesmo, induzir a outras teorias e modelos. A sequência didática traz a modelagem em duas oportunidades. A primeira, trabalha com propriedades químicas dos halogênios e a segunda com a escala de eletronegatividade elaborada por Linus Pauling. Em vista de todo o conteúdo químico já trabalhado, os alunos seriam questionados quanto ao comportamento dos halogênios em relação às temperaturas de ebulição e fusão no segundo momento da SD. Dessa maneira, como poderiam relacionar os conceitos químicos e explicar a seguinte questão: "As temperaturas de fusão (TF) e ebulição (TE) das moléculas diatômicas F2, Cl2, Br2 e I2 se comportam de forma crescente ou decrescente?". Esses compostos, em temperatura ambiente, encontram-se em estados físicos diferentes: flúor e cloro são gases, bromo é líquido enquanto o iodo é sólido. A tratativa dessa questão traz o tamanho dos átomos, a quantidade de elétrons e a capacidade de deformação das nuvens eletrônicas. O estabelecimento de relações é parte constante na Química e, através do contexto dos halogênios, se pretende explorar a modelagem. A expressão desses modelos é livre para permitir um modo verbal como exteriorização ou ainda visual e/ou matemático. Os testes dependem dos modelos formulados para que ao final da atividade seja possível discutir as abrangências e dificuldades encontradas durante o processo. A modelagem quanto à escala de eletronegatividade por Pauling - apresentada no terceiro momento da SD - ocorre após uma abordagem histórica e explicações quanto ao que essa propriedade se refere. Anterior a isso, os questionários seriam lidos e aproveitados pelo docente como um diagnóstico prévio. Assim, partindo do questionamento "Como se pode determinar a energia de ligação de uma molécula AB (molécula heteronuclear) partindo de A2 e B2 (moléculas homonucleares)?" os estudantes poderiam construir seus modelos.
RESULTADOS E DISCUSSÃO Sequência didática A sequência didática nomeada como "Eletronegatividade e seus significados" abrange quatro das escalas já desenvolvidas para essa propriedade, sendo elas: a de Linus Pauling, Robert Mulliken, Albert Allred, Eugene Rochow e Leland Allen. A SD foi dividida em 5 momentos que serão explorados adiante. Primeiro momento - a tabela periódica e suas propriedades No primeiro momento são apresentados o objetivo geral da SD e o objetivo vinculado a primeira aula. Como a modelagem se fará presente na SD, sugere-se uma discussão sobre o que são modelos e a utilização de imagens que favoreçam a compreensão desse meio de representação como, por exemplo, a esquematização das moléculas de DNA em dupla hélice sugerida por James D. Watson e Francis H. Crick tanto difundidas hoje em dia a partir do trabalho da química inglesa Rosalind Franklin com a difração por meio de raios X e cálculos matemáticos. A eletronegatividade é uma propriedade periódica de ligação química e seus valores podem ser encontrados em tabelas periódicas. A classificação dos elementos químicos em uma tabela permite a organização e a previsão de comportamentos químicos, sendo interessante discutir minimamente sua história na introdução da SD. Dessa maneira, se propõe como exemplo a leitura prévia do artigo "Alguns Aspectos Históricos da Classificação Periódica dos Elementos Químicos" de Mário Tolentino, Romeu Rocha-Filho e Aécio Pereira Chagas.21 Em sala, o professor pode destacar alguns trechos desse trabalho com os alunos, evidenciando a construção da Ciência como fruto de um trabalho humano, coletivo e sujeito a modificações. A classificação da tabela periódica auxilia no entendimento da energia de ionização e da afinidade eletrônica que aparecerão na escala de Mulliken, logo é interessante relembrar com os alunos o que são essas propriedades. Por fim, um questionário seria disponibilizado aos alunos para que respondessem, em sala de aula, algumas questões, conforme se encontram na Tabela 1. O questionário direcionado ao diagnóstico de como a propriedade eletronegatividade é compreendida pelos estudantes segue um formato de questões do tipo abertas a fim de dar ampla liberdade ao respondente na descrição das respostas.22 O questionário contém quatro questões ordenadas de forma sequencial em que uma questão é conectada à antecessora. Tais questões são dissertativas, permitindo que os estudantes expliquem com as próprias palavras e de forma livre o que compreendem sobre o assunto.

Desses questionamentos espera-se conhecer a maneira como os alunos interpretam a eletronegatividade, constituindo um meio para identificação de dificuldades já que, em literatura, há citação de algumas concepções alternativas, como a confusão da tendência periódica de eletronegatividade com tamanho do átomo,23 a atribuição de eletronegatividade como o número de elétrons de valência,23 o pensamento de que não há influência da eletronegatividade na posição do par de elétrons compartilhados23 e a capacidade da ligação covalente ter eletronegatividade muito diferente.24 Essas concepções reforçam o quão importante é conhecer o que o aluno traz consigo sobre a temática para que a aula seja desenvolvida de modo a não fortalecer essas concepções. Segundo momento - halogênios: características principais e discussão Para contextualizar a abordagem da eletronegatividade ao longo da SD parte-se dos elementos da família 17 (7A), os halogênios, destacando algumas características principais da família. O comportamento das temperaturas de fusão e ebulição das moléculas diatômicas homonucleares de flúor, cloro, bromo e iodo remete à polarizabilidade dos elementos, a qual promove a diferenciação dos valores de fusão e ebulição nessas moléculas apolares. A temperatura de ebulição é analisada por meio de uma função da energia de interação molecular U(r) como demonstrado na Equação 18 em que r representa a distância entre duas moléculas semelhantes, µ corresponde ao momento de dipolo, T é a temperatura, kB a constante de Boltzmann, hν0 equivale a energia no ponto zero que pode ser aproximada a energia de ionização e a é a polarizabilidade que depende do número de elétrons.25 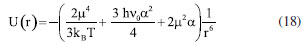 O primeiro, segundo e terceiro termo do lado direito da equação retratam as interações do tipo dipolo-dipolo, forças de dispersão (dipolo induzido-dipolo induzido) e forças de indução (dipolo-dipolo induzido), respectivamente.25 O segundo termo é significativo na análise de moléculas apolares e a identificação de polaridade depende da eletronegatividade.9 Um dipolo instantâneo pode se formar em uma molécula distorcendo a nuvem eletrônica de outra molécula próxima. Um novo rearranjo desse dipolo instantâneo provoca, novamente, uma reorientação dos dipolos formados no sistema molecular vizinho, gerando uma atração entre ambas. A essas interações se dá o nome de interações de London.9 As interações de London dependem da polarizabilidade. Essa propriedade indica a facilidade de deformação de uma nuvem eletrônica sob aproximação de um campo elétrico. Um átomo com alta capacidade de ser polarizável é aquele com um significativo número de elétrons, o que lhe confere um caráter volumoso e uma maior dificuldade dos elétrons mais externos em interagirem com a carga nuclear efetiva.9 Desse modo, as moléculas com átomos facilmente polarizáveis apresentam um número de elétrons apreciável para distorção, fortalecendo as interações de London.9 A energia que descreve as interações de London depende da polarizabilidade e da distância - conforme o termo apontado. Assim, ao analisar as moléculas do tipo X2 se nota que o maior número de elétrons em cada elemento químico aumenta a polarizabilidade e, consequentemente, as interações de London são mais fortes resultando em maiores temperaturas de fusão e ebulição. Dessa maneira, se propõe que os alunos modelem sobre esse comportamento, relacionando as propriedades periódicas e os conhecimentos químicos adquiridos ao longo de sua formação. As relações a serem construídas constituem uma tratativa inicial de modelar, promovendo discussões acerca de assuntos que, até então, teriam sido abordados, como as moléculas, forças intermoleculares e propriedades periódicas. Porém, não se espera que haja a determinação da Equação 18, visto que, a complexidade específica deste ponto foge ao intuito da proposta. Assim, é de interesse tratar os halogênios sob essa perspectiva para introduzir o processo de modelagem e promover, ao longo da atividade, o papel que a propriedade eletronegatividade tem na determinação da polaridade. A análise única sob o ponto de vista da polaridade não permite a explicação científica da diferenciação das temperaturas ao contrário das relações a serem estabelecidas. Uma tabela com dados de temperatura de fusão (TF) e ebulição (TE) das moléculas F2, Cl2, Br2 e I2 é exibida, conforme a Tabela 2. Podem ser elaborados gráficos, desenhos, fluxogramas que expliquem a associação da polarizabilidade, polaridade, eletronegatividade, raios atômicos e número de elétrons. Já a expressão do teste pode ser feita de modo verbal. Sugere-se o uso da plataforma Avogadro,26 de licença gratuita para uso, para o desenho das moléculas e visualização do mapa de potencial eletrostático. Essas representações facilitam a compreensão de nível abstrato e promovem o manejo com modelos. A atividade de modelagem deverá ser feita em grupos.

Terceiro momento - expandindo o que conhecemos sobre eletronegatividade As respostas dadas ao questionário no primeiro momento podem ser socializadas com a sala a fim de que todos tenham contato com as ideias prévias dos colegas a partir da intermediação docente. O docente pode aproveitar essas respostas para destacar as escalas que pretende abordar. A eletronegatividade é compreendida como a tendência de um átomo em atrair a densidade de elétrons e, consequentemente, polarizar a ligação química.3 Essa definição coloca a eletronegatividade como uma propriedade de ligação química, podendo ser calculada a partir de diferentes parâmetros. Antes de abordar as escalas, o professor pode explicar aos alunos que a eletronegatividade é datada desde 1819 por conta de Jacob Jöns Berzelius e seus estudos eletroquímicos.3 Através desses, o cientista chamou os elementos como eletronegativos pelo seu acúmulo ao redor do polo negativo de uma pilha,28 criando um conceito qualitativo para a eletronegatividade. Pauling usou dados termodinâmicos para a proposta de um conceito quantitativo de eletronegatividade. A construção do que vem a ser a eletronegatividade foi possível devido ao desenvolvimento da ligação química por Gilbert N. Lewis.3 Aspectos históricos podem ser explorados através do artigo G. N. Lewis and the Chemical Bond de Linus Pauling.5 Desse trabalho o docente pode destacar as passagens que demonstram o contato de Pauling com as ideias de Lewis, a contribuição de Irving Langmuir e os seus próprios questionamentos e vivências transcritas. A intenção é que os alunos percebam as relações de ciência sendo construídas através de muito estudo, conhecimento de outros trabalhos, contatos com outros profissionais, superando a visão de criações geniais e individuais. É com base na proposta termodinâmica de Pauling que os estudantes podem modelar divididos em grupos. A atividade de modelagem surge do questionamento: "Como determinar a energia de ligação de AB (molécula diatômica heteronuclear) partindo de A2 e B2 (moléculas diatômicas homonucleares)?". A elaboração do modelo deve vir acompanhada de uma equação sendo essa expressa em modo matemático e verbal. O teste do modelo parte da diferença dos valores teóricos e experimentais da energia de ligação. Os valores experimentais são, geralmente, maiores que os teóricos por conta das contribuições iônicas em ligações covalentes o que exige um fator de correção, D. As contribuições interligam-se à natureza dos átomos. Conforme os átomos tornam-se diferentes em moléculas diatômicas heteronucleares, são formadas cargas parciais. A partir do fator de correção proposto por Pauling é calculada a eletronegatividade de um elemento tomando como base a eletronegatividade do hidrogênio (cH). No teste do modelo, os alunos teriam valores de energia de ligação de moléculas do tipo HX e X2 em que X representa os halogênios. Na etapa "Identificação de abrangências e limitações" os estudantes podem apontar como limitações a escala relativa com base no hidrogênio, a necessidade de se partir de átomos diferentes para construção da escala e o uso da energia de ligação que, de certa forma, acaba por excluir vários elementos da família 18 - os gases nobres. Como vantagem, há boa disponibilidade de dados de energia de ligação em literatura29 o que facilita a determinação da eletronegatividade. Ao final da atividade, uma exposição sobre como foi formulada a equação que define o módulo da diferença de eletronegatividades seria realizada e utilizada na aplicação de cálculos de eletronegatividade para os halogênios por meio de um editor de planilhas, como LibreOffice Calc,30 Microsoft Excel31 ou Origin.32 Quarto momento - a importância da eletronegatividade e a visão de Mulliken sobre tal propriedade No início desse momento recomenda-se que haja um breve resgate da formulação da eletronegatividade. Com isso deve ser destacado que a eletronegatividade surge como uma manifestação da natureza de átomos diferentes em ligação o que promove o compartilhamento desigual dos pares de elétrons entre dois núcleos. O conceito de ressonância e as possíveis formas canônicas de ressonância de uma molécula auxiliam na visualização do processo. Desse modo, o professor pode utilizar as moléculas formadas pelos halogênios como exemplo para ressonância e indicação de cargas parciais (d+ e d-), dando destaque as simbologias usadas na exposição. O docente pode usar os ácidos halogenados trabalhados em exemplos anteriores para demonstrar uma classificação geral de ligações predominante iônicas ou covalentes com base na diferença de eletronegatividade (Dc) entre os átomos. Em seguida, é interessante questionar os alunos acerca da importância da eletronegatividade, inserindo na discussão a polaridade de ligações químicas e polaridade de espécies químicas. Com isso, diversas moléculas e geometrias moleculares podem ser trabalhadas a fim de determinar a polaridade da entidade química. Além da polaridade, a eletronegatividade pode ser usada como um dos parâmetros a serem observados na comparação de acidez entre espécies classificadas como ácidos. Os hidrácidos HF, HCl, HBr e HI podem servir de exemplo e conduzir a equivocada classificação do HF como ácido mais forte em comparação aos demais. Entretanto, os próprios dados de energia de ligação dessas espécies demonstram o quão difícil é a separação entre os átomos de hidrogênio e flúor, caracterizando-o como um ácido fraco. Isso ocorre devido à importância de não analisar esse fator isoladamente, mas em conjunto com a sobreposição dos orbitais formadores dos ácidos e as suas forças intermoleculares. Um gráfico como o da Figura 1 pode ser utilizado para auxiliar a visualização do comportamento ácido e a leitura desse modo de representação. A correlação entre pKa e energia de ligação expressa no gráfico parte da força de acidez junto à dificuldade de quebrar uma ligação. Um ácido forte, perante a definição de Bronsted-Lowry, é aquele que possui um grau de liberação de prótons relativamente alto, logo a energia de ligação entre o próton e a molécula não deve ser elevada. Essa energia de ligação envolve a sobreposição efetiva dos orbitais envolvidos na ligação química. Então, pensar no HF como um ácido forte levando apenas em consideração a alta tendência de atração da densidade eletrônica pelo flúor é uma forma equivocada por não relacionar outros fatores.
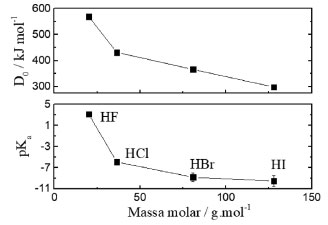 Figura 1. Comparativo entre a energia de ligação e o pKa de hidrácidos dos halogênios (fonte: obra do autor; dados de pKa extraídos de Dean)29
Como ponto de partida para a eletronegatividade de Robert Mulliken, o professor pode exibir um gráfico com a eletronegatividade de elementos químicos com base na média entre a energia de ionização (EI) e a afinidade eletrônica (AE), Figura 2. Disso, o professor deve questionar aos alunos o que mais lhe chamam a atenção. Espera-se que percebam a presença dos gases nobres nessa escala. Na escala de Mulliken a eletronegatividade é uma propriedade intrínseca ao elemento, pois depende da afinidade eletrônica e da energia de ionização, sendo simbolizada por cM. Por meio da escala de Mulliken é possível determinar a eletronegatividade para elementos em diferentes estados de oxidação. Ademais, a escala permite estimar os átomos mais e menos eletronegativos da tabela periódica com base na análise da EI e da AE. Elementos que demandem altas primeiras energias de ionização e baixa disposição para receber um elétron tendem a ser mais eletronegativos.
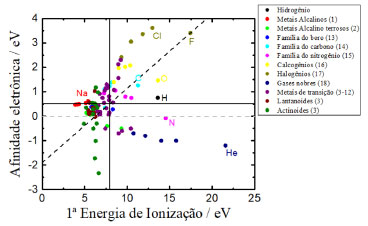 Figura 2. Relação entre a energia de ionização e a afinidade eletrônica. As linhas cheias, horizontal e vertical, representam os valores médios da afinidade eletrônica (AE) e da 1ª energia de ionização (EI) dos elementos da tabela periódica. A linha tracejada representa a equação (fonte: obra do autor; dados extraídos de Haynes et al.)8
Quinto momento - as propostas de eletronegatividade feitas por Allred-Rochow e Allen Após um resgate das interpretações de eletronegatividade para Pauling e Mulliken, dá-se andamento rumo à finalização da SD. O quinto momento traz escalas de eletronegatividade pouco conhecidas e se sugere uma aula expositiva dialogada para esse assunto. A escala de Allred-Rochow11 parte da força de atração eletrostática para determinação da eletronegatividade e dos parâmetros raio covalente e carga nuclear efetiva. A carga nuclear efetiva é calculada através das regras de Slater. O professor pode apresentar essas regras aos alunos e aplicá-las a parte dos halogênios, deixando que a outra parte seja realizada pelos discentes. O uso das regras de Slater nesse momento colabora para o reforço de conceitos como blindagem e carga nuclear efetiva. Em posse dos valores de raio covalente desses elementos, é possível calcular e comparar a eletronegatividade dos elementos.11 Em 1989, Leland Allen14 formulou uma escala com base na energia média monoeletrônica dos elétrons de valência no estado fundamental. Devido às várias energias encontradas para cada estado do átomo, essa escala seria abordada de forma expositiva dialogada para conhecimento dos alunos, sem envolvimento de cálculos. Por fim, o docente deve aplicar novamente o questionário sendo esse uma forma de avaliação dos estudantes. Assim, o professor pode perceber os avanços e as dificuldades ao longo do processo.
CONCLUSÕES Trabalhada nas aulas de Química do Ensino Superior, a eletronegatividade é uma importante propriedade para o estudo das ligações químicas. Pouco abordada em literatura da área de Ensino, a eletronegatividade costuma ser tratada de forma desvinculada do seu desenvolvimento histórico. Com isso, a apresentação e o aprofundamento das diversas escalas de eletronegatividade acabam sendo prejudicados, contribuindo para uma formação acadêmica e pessoal mais fragmentada. Logo, o indivíduo é inclinado a possuir limitações nas interpretações, no entendimento da construção científica e nas aplicações para tal propriedade. A abordagem histórica permite uma visão de Ciência mais plural com o reconhecimento das contribuições de vários profissionais para o desenvolvimento científico. Além do que, há a humanização dos desdobramentos científicos, pois entende-se o conhecimento atual como fruto de um processo dinâmico que se vincula ao contexto histórico da época e aos interesses pessoais dos envolvidos. Consequentemente, uma exploração do tema de forma menos superficial permite superar as restrições de identificação e distinção das escalas de eletronegatividade, favorecendo o entendimento de possíveis aplicações. Da primeira citação de eletronegatividade feita por Jöns Jacob Berzelius até os dias atuais, surgiram várias escalas que buscaram quantificar essa propriedade. As escalas de eletronegatividade presentes neste trabalho são a de Linus Pauling (1932), Robert Mulliken (1934), Albert Allred e Eugene Rochow (1958) e Leland Allen (1989). Baseadas em parâmetros distintos buscam quantificar a eletronegatividade, atribuindo interpretações que podem ou não remeter a presença de ligação química e possuem vantagens e desvantagens de acordo com a quantidade de dados disponíveis e a finalidade a que se propõe. Consequentemente, as escalas de eletronegatividade podem ser tratadas como modelos que representam uma entidade química a partir de teorias químicas vigentes e dados experimentais. No contexto descrito, esse trabalho propõe a abordagem de uma sequência didática sobre eletronegatividade de forma a explorar e valorizar as escalas anteriormente citadas junto ao reconhecimento histórico. Na elaboração da sequência didática foi utilizado o Ensino Fundamentado em Modelagem como metodologia de ensino a fim de promover um melhor entendimento do que são os modelos e para que servem, dando um aporte a compreensão do desenvolvimento das escalas como modelos, além de proporcionar a atividade de modelagem. Com a modelagem se espera fomentar as discussões e dúvidas entre os pares, fazendo-os relacionar o conhecimento químico que possuem para que possam propor um modelo. A partir disso, podem surgir novos questionamentos durante os testes e conclusões. Dessa forma, se espera que este trabalho contribua com o campo de Ensino em Química ao propor uma sequência didática para abordagem da eletronegatividade, constituindo um material de consulta que a traz como tema central ao tratar suas escalas como modelos. Cada escala lida com a realidade em consonância com as informações disponíveis para àquela época e a finalidade de uso, logo não há um modelo que seja melhor ou pior que o outro, mas há modificações. As interpretações advindas da propriedade eletronegatividade se somam ao exposto pela modelagem, agregando no entendimento das relações existentes no estudo da Química, como no comportamento químico das moléculas amplamente estudado para aplicações.
MATERIAL SUPLEMENTAR Alguns quadros utilizados neste trabalho estão disponíveis em http://quimicanova.sbq.org.br/, na forma de arquivo PDF, com acesso livre.
AGRADECIMENTOS O presente trabalho foi realizado com apoio da Coordenação de Aperfeiçoamento de Pessoal de Nível Superior - Brasil (CAPES) - Código de Financiamento 001. Ao Instituto de Química, CNPq e FAPESP.
REFERÊNCIAS 1. Filgueiras, C. A. L.; Quim. Nova 2016, 39, 1262. [Crossref] 2. Lewis, G. N.; J. Am. Chem. Soc. 1916, 38, 762. [Crossref] 3. Tantardini, C.; Oganov, A. R.; Nat. Commun. 2021, 12, 1. [Crossref] 4. dos Santos, C. M. A.; da Silva, R. A. G.; Wartha, E. J.; Quim. Nova 2011, 34, 1846. [Crossref] 5. Pauling, L.; J. Chem. Educ. 1984, 61, 201. [Crossref] 6. Pauling, L.; The Natural of the Chemical Bond and the Structure of Molecules and Crystals: An Introduction to Modern Structural Chemistry, 3rd ed.; Cornell University Press: New York, 1960. 7. Mulliken, R. S.; J. Chem. Phys. 1934, 2, 782. [Crossref] 8. Haynes, W. M.; Lide, D. R.; Bruno, T. J.; CRC Handbook of Chemistry and Physics, 97th ed.; CRC Press: Boca Raton, 2017. 9. Atkins, P.; Jones, L.; Princípios de Química: Questionando a Vida Moderna e o Meio Ambiente, 5ª ed.; Bookman: Porto Alegre, 2012. 10. Mahan, B. H.; Myers, R. J.; Química: Um Curso Universitário, 4ª ed.; Edgarg Blücher: São Paulo, 1995. 11. Allred, A. L.; Rochow, E. G.; J. Inorg. Nucl. Chem. 1958, 5, 264. [Crossref] 12. Duarte, H. A.; Quim. NovaEsc. 2003, 17, 22. [Link] acessado em Agosto 2023 13. Miessler, G. L.; Fischer, P. L.; Tarr, D. A.; Química Inorgânica, 5ª ed.; Pearson: São Paulo, 2014. 14. Allen, L. C.; J. Am. Chem. Soc. 1989, 111, 9003. [Crossref] 15. Mann, J. B.; Meek, T. L.; Knight, E. T.; Capitani, J. F.; Allen, L. C.; J. Am. Chem. Soc. 2000, 122, 5132. [Crossref] 16. Menegolla, M.; Sant'Anna, I. M.; Por que Planejar? Como Planejar?: Currículo, Área, Aula, 14ª ed.; Vozes: Petrópolis, 2005. 17. Martínez, M. J.; Oliveira Lahone, C. E.; Planejamento Escolar, 2ª ed.; Saraiva: São Paulo, 1978. 18. Zabala, A.; A Prática Educativa, Penso: Porto Alegre, 1998. 19. Justi, R. Em Ensino de Química em Foco; dos Santos, W. L. P.; Maldaner, O. A. , eds.; Unijuí: Ijuí, 2010, cap. 8. 20. Vosniadou, S. Em Model-Based Reasoning; Magnani, L.; Nersessian, N. J. , eds.; Springer: Boston, 2002. 21. Tolentino, M.; Rocha-Filho, R. C.; Chagas, A. P.; Quim. Nova 1997, 20, 103. [Crossref] 22. Gil, A. C.; Métodos e Técnicas de Pesquisa Social, 6ª ed.; Atlas: São Paulo, 2009. 23. Burrows, N. L.; Mooring, S. R.; Chem. Educ. Res. Pract. 2015, 16, 53. [Crossref] 24. Luxford, C. J.; Bretz, S. L.; J. Chem. Educ. 2014, 91, 312. [Crossref] 25. Glazier, S.; Marano, N.; Eisen, L.; J. Chem. Educ. 2010, 87, 1336. [Crossref] 26. Hanwell, M. D.; Curtis, D. E.; Lonie, D. C.; Vandermeersch, T.; Zurek, E.; Hutchison, G. R.; Avogadro: An Open-Source Molecular Builder and Visualization Tool, version 1.2.0; USA, 2012. 27. Rodgers, G. E.; Química Inorgânica: Introducción a la Química de Coordinación, del Estado Sólido y Descriptiva; McGraw-Hill: New York, 1994. 28. Russell, C. A.; Ann. Sci. 1963, 19, 127. [Crossref] 29. Dean, J. A.; Lange's Handbook of Chemistry, 15th ed.; McGraw-Hill Inc. : New York, 1999. 30. LibreOffice Calc, version 7.5.0; The Document Foundation, GER, 2022. 31. Microsoft Excel, version 2112; Microsoft, Redmond, WA, USA, 2022. 32. Origin Lab, version 9.3; OriginLab Corporation, Northampton, MA, USA, 2016. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access





