Artigo
|
|
| Uso de agentes complexantes para o aumento na produção direcionada de ciclodextrinas por enzima comercial toruzyme® Use of complexing agents for increased targeted production of cyclodextrins by commercial enzyme toruzyme® |
|
Maria F. A. AguiarI; Vanderson C. FenelonI; Juliane H. MiyoshiI; Nathalia M. ValérioI; CamilaS. MangolimII; Graciette MatioliI*
I. Departamento de Farmácia, Universidade Estadual de Maringá, 87020-900 Maringá - PR, Brasil Recebido em 12/04/2023; *e-mail: gmatioli@uem.br Cyclodextrins (CDs) are cyclic oligosaccharides, products of the intramolecular transglycosylation reaction promoted by the enzyme cyclomaltodextrin glucanotransferase (CGTase). The most commonly produced CDs are α-CD, α-CD and γ-CD, composed of 6, 7 and 8 glucose molecules, respectively. They form non-covalent inclusion complexes with several molecules, increasing their stability and/or solubility. Due to the importance of CDs and the various industrial applications, this work aimed to use the commercial enzyme Toruzyme® to obtain CDs and direct its production to α-CD or α-CD through the use of ethanol and complexing agents in the reaction medium. The reaction medium added with ethanol and cyclohexanecarboxylic acid directed the production to α-CD, reaching 47.09 mg mL-1 of this molecule. The production medium containing ethanol and stearic acid proved to be more advantageous for the production of α-CD and, after 48 h of reaction, the production of α-CD reached 19.57 mg mL-1, a value six times greater than that of amount of α-CD produced. With this study it was possible to prove that with the use of ethanol and complexing agents in the reaction medium it is possible to direct the production of a certain CD and, thus, make different CGTases economically viable for industrial use. INTRODUÇÃO As ciclodextrinas (CDs) são oligossacarídeos cíclicos, formadas por unidades de glicopiranoses, unidas por ligações glicosídicas a-1,4. Existem três principais tipos de moléculas de CD compostas por 6, 7 e 8 moléculas de glicose denominadas α-CD, α-CD e γ-CD, respectivamente. Estas moléculas diferenciam-se no tamanho, diâmetro e volume da cavidade do anel, e na solubilidade em água.1-3 A estrutura tridimensional das CDs se assemelha a um cone truncado, no qual as hidroxilas das unidades de glicose ficam orientadas para a parte exterior do cone, enquanto os carbonos e oxigênios etéreos das unidades de glicose ficam voltados para cavidade do mesmo.3 Este formato ocorre pelo fato de na porção estreita externa do cone se localizarem as hidroxilas primárias, enquanto na porção larga externa se encontram as hidroxilas secundárias.4 Em solução aquosa, o interior das CDs é preenchido por moléculas de água em uma interação polar-apolar energeticamente desfavorável, as quais são substituídas facilmente por moléculas menos polares do que a água.5 Portanto, ocorre a substituição das moléculas de água que possuem uma entalpia elevada, por moléculas apolares de entalpia menor, promovendo um aumento de entropia e redução da energia total do sistema.4 Desta forma, as CDs são capazes de interagir no interior de sua cavidade hidrofóbica com uma grande variedade de moléculas hóspedes para formar complexos de inclusão não covalentes.2 O que promove uma alteração nas propriedades físicas e químicas da molécula hospedada no interior da CD.4 Pode ocorrer o aumento da solubilidade em água da molécula hóspede, a redução da volatilidade, o aumento da estabilidade, além da capacidade de mascarar sabores desagradáveis. Esta e outras propriedades, bem como a possibilidade de serem usadas para liberação controlada de fármacos, fazem as CDs terem aplicações no campo farmacêutico, alimentício, têxtil, entre outros.3-7 No campo farmacêutico, as CDs podem ser usadas para reduzir a cristalinidade do fármaco por complexação ou dispersão sólida com elas, o que leva a uma melhora na solubilidade do fármaco.8 As CDs promovem uma redução da irritação causada por fármacos, por aumentar a solubilidade do fármaco e, assim, aumentar a eficácia e potência deste, reduzir a entrada indesejada do medicamento em células de tecidos não direcionados, reduzindo os efeitos colaterais do medicamento sem perda drástica dos seus benefícios terapêuticos.2,9,10 Assim, devido a ampla utilização das CDs e as vantagens relacionadas a sua utilização, principalmente no campo farmacêutico, um número considerável de artigos, livros e capítulos de livros são publicados sobre estas moléculas,11-13 o que tem favorecido as indústrias farmacêuticas a terem mais referências bibliográficas, facilitando o uso das CDs nas formulações de fármacos. A produção das CDs é realizada a partir de amido ou derivados deste, usando a enzima ciclomaltodextrina glucanotransferase (CGTase, EC 2.4.1.19).6,14 As CGTases são extracelulares, monoméricas e produzidas por uma variedade de microrganismos, como por exemplo, Klebsiella oxytoca, Klebsiella pneumoniae, Micrococcus lutens, Clostridium spp., Thermoanaerobacter spp., Thermoanaerobacterium thermosulfurigenes, Anaerobranca gottschalkii, Paenibacillus macerans (antigamente denominado como Bacillus macerans), e algumas espécies de Bacillus.6,14,15 As CGTases possuem importância industrial por serem a única classe de enzimas e capazes de converter amido e outros substratos relacionados em CDs por meio de reações de transglicosilação intramolecular (ciclização). Estas enzimas também promovem reações de transglicosilação intermolecular (acoplamento e desproporcionamento) e em um menor grau, reações de hidrólise.7 As CGTases em geral produzem uma mistura de CDs, incluindo principalmente α-CD, α-CD e γ-CD, e são classificadas em a-CGTase, b-CGTase e γ-CGTase, de acordo com a principal CD produzida pela enzima.14 A enzima comercial Toruzyme®, por exemplo, inicialmente produz níveis semelhantes de α-CD e α-CD, entretanto, se a reação for por um tempo prolongado, a α-CD se torna o produto principal. Sendo assim, a quantidade e o tipo de CD formada dependem da origem da CGTase, do substrato, do agente complexante e das condições de reação.15,16 Devido fato de as CGTases, em geral, produzirem uma mistura de CDs, há a necessidade de métodos de separação e purificação das CDs. A alta solubilidade em água da α-CD e da γ-CD torna o procedimento de separação destas moléculas de alto custo para aplicação industrial.15,17,18 Um exemplo que demonstra como a separação das moléculas encarece o produto final é o fato do amido de mandioca, matéria-prima para produção de CDs, custar no mercado na faixa de US$4,75/kg,19 enquanto que, segundo a empresa Cyclolab Co., Ltd. (Budapeste, Hungria), o quilograma da α-CD, α-CD e γ-CDs para uso industrial alcança valores de US$470,00;20 80,0021 e 690,00,22 respectivamente. Uma forma de diminuir o custo de produção das CDs é tentar tornar a produção da enzima seletiva para a molécula desejada e aumentar o seu rendimento.14 Desde o século XX sabe-se que isso é possível ao adicionar agentes complexantes, como solventes orgânicos. Quando, por exemplo, um agente complexante seletivo para α-CD é adicionado no meio reacional, ele forma um complexo de inclusão insolúvel ou altamente estável com a α-CD produzida no meio, ocorrendo uma redução do efeito de inibição do produto sobre a reação enzimática e, consequentemente, a enzima ao invés de diminuir a produção de α-CD e aumentar a produção de α-CD e γ-CD, ela passa a produzir ainda mais α-CD. Considerando que este processo tem sido usado para produzir CDs numa escala industrial, há grande interesse em encontrar agentes complexantes seletivos e eficazes.14,17 Alguns autores demonstraram que ao adicionar glicirrizina em um meio reacional contendo a CGTase de Bacillus firmus cepa 37, houve um aumento da produção de γ-CD pela enzima. Como a glicirrizina tem a propriedade de se complexar 100% com a γ-CD, a seletividade para a produção de γ-CD aumentou cerca de 60%.23 Outro estudo comprovou que o uso de etanol em meio reacional contendo CGTase comercial Toruzyme®, aumentou a produção de α-CD, estrutura representada na Figura 1, e o rendimento de α-CD quase triplicou.24 Também já foi comprovado que a adição de acetonitrila, etanol e tetraidrofurano favoreceram a produção de α-CD pela CGTase de Thermoanaerobacter sp.25
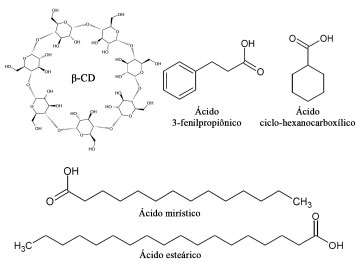 Figura 1. Estruturas químicas da β-CD, do ácido 3-fenilpropiônico, ácido ciclo-hexanocarboxílico, ácido mirístico, e ácido esteárico
Para a escolha do agente complexante adequado é necessário que este tenha uma alta seletividade para um único tipo de CD. Por exemplo, os ácidos graxos 3-fenilpropiônico e ciclo-hexanocarboxílico, ambos também representados na Figura 1, possuem uma seletividade de 100% para α-CD sendo, portanto, ótimos candidatos para aumentar a produção desta CD.26 Estes mesmos autores demonstraram que os ácidos graxos ácido mirístico e o ácido esteárico (Figura 1) possuem 100% de seletividade para α-CD. Devido à importância das CDs e as diversas aplicações industriais e, considerando que o direcionamento na reação enzimática da enzima para a produção de CDs pode ser favorável para reduzir os custos e facilitar sua aplicação, este trabalho teve por objetivo verificar a possibilidade de aumentar a seletividade e o rendimento da produção de α-CD e α-CD pela enzima comercial Toruzyme®, utilizando o ácido 3-fenilpropiônico e o ácido ciclo-hexanocarboxílico no meio reacional para produção de α-CD, bem como ácido mirístico e ácido esteárico para produção de α-CD.
PARTE EXPERIMENTAL Produção de CDs pela enzima Toruzyme® na presença e na ausência de etanol 10% O método da produção de CDs pela enzima comercial foi baseado em uma metodologia já publicada.24 A produção se deu em um reator de vidro encamisado contendo um meio de produção com 15% (p v-1) de amido de mandioca comercial, juntamente com 0,1% da enzima Toruzyme®, e a reação aconteceu a 65 °C em agitação constante. Nos tempos 0, 3, 6, 12, 24, 36, 48, 60, 72, 96, 120, 144 e 168 h de produção uma alíquota de 1 mL foi retirada do meio reacional e transferida para um tubo de 10 mL. Junto a esta amostra, foi adicionado 1 mL de HCl 20 mmol L-1 e deixado em ebulição durante 10 min, com a finalidade de se inativar a enzima. Em seguida, foram adicionados 2 mL de água tamponada (água deionizada com 10% de tampão citrato 10 mmol L-1 pH 6,0), e este material foi centrifugado a 9500 xg, a 40 °C durante 20 min. O sobrenadante foi separado para quantificar as CDs. Outro ensaio foi realizado conforme descrito acima, contudo, o meio de produção continha 10% de etanol 99,5%. Influência dos agentes complexantes de β-CD na produção de CDs Este ensaio foi feito de forma semelhante ao citado anteriormente, porém com a adição dos agentes complexantes ácido ciclo-hexanocarboxílico e ácido 3-fenilpropiônico no meio reacional, e foi baseado em trabalhos já publicados.23,26 Para cada agente complexante de α-CD foi realizado um ensaio de produção que se deu em reator encamisado, com temperatura controlada por um banho, contendo o meio reacional com etanol 10%, o agente complexante e a enzima. Nos tempos 0, 3, 6, 12, 24, 36, 48, 60, 72, 96, 120, 144 e 168 h de reação, foi retirada uma alíquota de 1,0 mL, a enzima foi desativada com ebulição durante 10 min na presença de HCl 20 mmol L-1. Esta mistura foi diluída na proporção 1:6 e centrifugada a 9500 xg, 40 °C durante 20 min. O sobrenadante foi separado para quantificar a α-CD produzida, pelo método espectrofotométrico. A concentração necessária de agente complexante foi determinada usando como base alguns estudos científicos já publicados.27,28 A partir destes estudos, determinou-se a concentração necessária de agente complexante suficiente para dar suporte à enzima durante uma produção de CDs em 168 h. Os cálculos partiram de ensaios previamente realizados de produção de α-CD, na presença de etanol 10%, por 24 h, os quais resultaram num valor de 13,032 mmol L-1. A concentração necessária dos agentes complexantes para dar suporte a enzima durante a produção foi feita baseando-se na Equação 1: 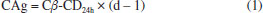 onde, CAg é a concentração molar de agente que deve ser adicionado no meio de produção; Cα-CD24h é a concentração molar de α-CD produzida em 24 h na presença de etanol 10%, no caso, 13,032 mmol L-1; e d é o número de dias que a enzima permanece em produção, sendo neste estudo considerado 7 dias. Utilizando o valor encontrado de CAg e conhecendo a massa molar dos agentes complexantes de α-CD, foram realizados cálculos para verificar a concentração dos mesmos, em p v-1, que deveria ser usada. Como a massa molar do ácido 3-fenilpropiônico é de 150,2 g mol-1, a concentração usada do ácido 3-fenilpropiônico foi determinada em 1,17% (p v-1). Já a concentração de ácido ciclo-hexanocarboxílico foi de 1,0% (p v-1). Influência dos agentes complexantes de α-CD na produção de CDs Este ensaio seguiu a metodologia do item anterior, contudo os agentes complexantes utilizados foram o ácido esteárico, de pureza 48,6%, e o ácido mirístico, de pureza 98%. As concentrações destes agentes foram determinadas após a utilização da Equação 1, sendo que com o resultado dos cálculos foi usado 1,89% (p v-1) de ácido mirístico e 2,36% (p v-1) de ácido esteárico. Descomplexação do ácido esteárico e ácido mirístico da α-CD A separação dos agentes complexantes da α-CD foi realizada separando alíquotas de 2 mL do meio de produção contendo estes agentes, com seu posterior congelamento e liofilização. Após a liofilização, o pó foi ressuspendido com etanol P.A. na proporção 2:5. Em seguida, as alíquotas foram centrifugadas a 15 ºC, 4000 xg durante 5 min. Por fim, os sobrenadantes contendo os ácidos graxos foram descartados e aos precipitados, que continham amido e as CDs produzidas, foram adicionados 2 mL de água deionizada. Em seguida, estes materiais foram centrifugados a 9500 xg, a 40 °C durante 20 min. Os sobrenadantes, contendo as CDs produzidas, foram congelados até o momento de ser feita a quantificação em cromatografia líquida de alta eficiência (CLAE). Determinação espectrofotométrica de β-CD A concentração de β-CD foi medida pela descoloração de uma solução reagente contendo fenolftaleína em meio básico e, esta descoloração aconteceu após a complexação da fenolftaleína com a β-CD presente na amostra. A solução foi lida em 550 nm. A quantificação foi realizada de acordo com a Teoria da Complexação,29 que leva em consideração a constante de equilíbrio (Kβ-CD), a concentração da solução de fenolftaleína (a = 0,05 mmol L-1), a absorbância das amostras (ABS) e de uma solução isenta de β-CD (ABS0). A equação para calcular a concentração de β-CD está demonstrada a seguir, na Equação 2: 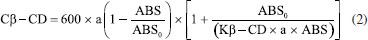 Após realizado os cálculos conforme a Equação 2, os valores encontrados foram multiplicados por 1,135 para converter a concentração de β-CD em mmol L-1 para mg mL-1. Determinação de CDs por cromatografia líquida de alta eficiência (CLAE) As concentrações de α-CD, β-CD e γ-CD produzidas nos diferentes ensaios foram determinadas por CLAE. Utilizou-se o cromatógrafo líquido Waters 2695 (Varian) equipado com detector de índice de refração Waters 2414, coluna aminopropilsilano (SGE) com tamanho de partícula 5 µm, comprimento 25 cm e diâmetro interno 4,6 mm. O desenvolvimento se deu por eluição isocrática, utilizando como fase móvel uma solução de acetonitrila e água (70:30) e um fluxo de 1,0 mL min-1 à temperatura ambiente (25 °C). Os padrões e as amostras foram filtrados em membrana de 0,45 µm. Curvas analíticas foram construídas para α-CD, β-CD e y-CD em diferentes faixas de concentração. Os resultados da área dos picos de cada CD em função da concentração no padrão foram ajustados por regressão linear. Análises estatísticas Os resultados de rendimento de CDs foram avaliados por meio de análise de variância (ANOVA), e as médias comparadas por meio do teste de Tukey ao nível de 5% de significância.
RESULTADOS E DISCUSSÃO Influência dos agentes complexantes na produção de β-CD A Figura 2 apresenta o gráfico da produção de β-CD a 65 ºC, 15% de amido de mandioca, 0,1% de enzima comercial Toruzyme®, 168 h de reação.
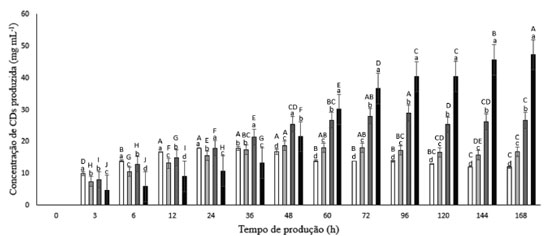 Figura 2. Produção de b-CD a 65 ºC, 15% de amido de mandioca, 0,1% de enzima comercial Toruzyme®, 168 h de reação, na ausência de etanol (  ), na presença de etanol 10% ( ), na presença de etanol 10% ( ), na presença de etanol 10% e do ácido 3-fenilpropiônico ( ), na presença de etanol 10% e do ácido 3-fenilpropiônico ( ), na presença de etanol 10% e ácido ciclo-hexanocarboxílico ( ), na presença de etanol 10% e ácido ciclo-hexanocarboxílico ( ). As letras de a até d correspondem ao teste de Tukey realizado analisando a variação do meio em cada tempo de produção; já as letras de A até G, correspondem ao teste de Tukey realizado analisando a variação do tempo em cada meio de produção. ). As letras de a até d correspondem ao teste de Tukey realizado analisando a variação do meio em cada tempo de produção; já as letras de A até G, correspondem ao teste de Tukey realizado analisando a variação do tempo em cada meio de produção.
Em 24 h a produção de β-CD sem a presença de etanol resultou em 17,77 mg mL-1, enquanto na presença deste solvente a produção teve uma queda de 13,5%, resultando numa concentração de 15,38 mg mL-1. Entretanto, depois de 36 h de produção, o perfil de produção de β-CD inverteu, sendo que o pico da produção desta CD na presença do solvente ocorreu no tempo 48 h, com uma concentração de 18,49 mg mL-1, 4,1% maior do que o pico de produção de β-CD na ausência de etanol. A concentração de β-CD produzida no meio contendo etanol se manteve relativamente estável a partir de 96 h de produção, permanecendo maior que a concentração desta CD quando produzida em um meio isento de etanol. A partir 36 h de produção de CDs o meio reacional contendo 10% de etanol e o ácido 3-fenilpropiônico produziu mais β-CD do que os meios sem agentes complexantes, tendo seu pico de produção no tempo 96 h, e a produção desta CD alcançou o valor de 28,73 mg mL-1. Neste mesmo tempo, o meio contendo somente a enzima e o substrato produziu 13,64 mg mL-1 de β-CD, ou seja, uma produção de β-CD 52,5% menor quando comparada com a produção contendo o etanol e o ácido 3-fenilpropiônico. Apesar do meio reacional contendo etanol 10% e o ácido ciclo-hexanocarboxílico ter produzido menos β-CD do que os demais nas primeiras 36 h, quando a reação alcançou o tempo 60 h, sua produção ultrapassou a de todos os outros ensaios, tendo seu pico de concentração de β-CD no tempo de 168 h, no qual a concentração desta molécula chegou a 47,09 mg mL-1, enquanto o meio que continha apenas a enzima e o substrato atingiu uma produção de 11,79 mg mL-1 de β-CD, ou seja, a produção de β-CD no meio com o agente complexante foi aproximadamente quatro vezes maior do que o meio que continha somente a enzima e o substrato. Este resultado foi mais vantajoso do que o encontrado na literatura para os agentes complexantes dimetilsulfóxido e álcool tert-butílico, os quais aumentaram em 16% e 19%, respectivamente, a produção de β-CD produzida pela CGTase de Thermoanaerobacter sp.25 A baixa influência do ácido ciclo-hexanocarboxílico no início da reação, quando comparada com a influência do ácido 3-fenilpropiônico, pode ter sido devido aquele agente complexante ser menos solúvel que este. Estudos demonstraram que a força da ligação entre o ácido ciclo-hexanocarboxílico e CD é maior do que a força de ligação entre esta molécula e o ácido 3-fenilpropiônico,27 o que justifica, nesta pesquisa, o fato da presença do ácido ciclo-hexanocarboxílico resultar em maior produção de β-CD. Produção de CDs pela Toruzyme® na ausência e na presença de etanol 10% - determinação por CLAE A Figura 3 apresenta gráficos da produção de CDs durante 168 h, na presença e ausência de etanol. As determinações foram feitas por meio de CLAE.
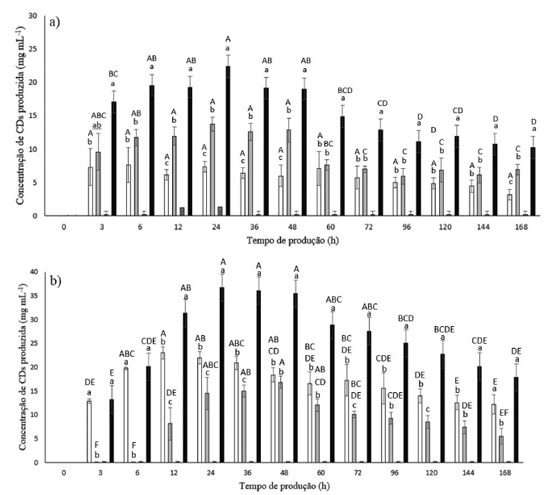 Figura 3. Produção de α-CD (  ), β-CD ( ), β-CD ( ), γ-CD ( ), γ-CD ( ) e total de CDs ( ) e total de CDs (
A Figura 3(a) mostra que na ausência de etanol a CD produzida predominan temente foi a β-CD, sendo que a concentração desta teve o seu pico em 24 h de produção, atingindo 13,71 mg mL-1 de β-CD. Com 72 h de ensaio a produção reduziu para metade (6,97 mg mL-1 de β-CD) e se manteve praticamente estável até o final do ensaio. Neste mesmo meio de produção, a concentração da α-CD teve o seu pico em 24 h de reação, com uma produção de 7,31 mg mL-1, o qual se manteve praticamente constante até o final do ensaio. No pico de produção de β-CD no tempo de 24 h, esta foi aproximadamente duas vezes maior que a produção de α-CD. Portanto, a enzima comercial neste meio de produção, produziu mais β-CD, principalmente nas 72 h iniciais de ensaio. Entretanto, ao avaliar a Figura 3(b), é evidenciado que o perfil de produção da enzima foi alterado na presença de etanol 10%, pois na presença deste solvente a CD que passou a ser produzida predominantemente foi a α-CD, a qual teve o seu pico de concentração em 12 h de reação (23,03 mg mL-1 de α-CD). A produção de β-CD também foi maior em relação ao meio na ausência de etanol, entretanto, o ápice da sua concentração se deu depois de 48 h de reação com uma produção de 16,84 mg mL-1 de β-CD. É importante ressaltar que, no tempo em que houve o pico de concentração da α-CD, a concentração de β-CD era de 8,13 mg mL-1, ou seja, no meio reacional havia quase 3 vezes mais α-CD do que β-CD. Este aumento da produção de α-CD sem um acréscimo significativo da produção de β-CD está de acordo com o que já foi demonstrado por alguns autores.24 Os dados apresentados por estes autores demonstraram que a presença de etanol 10%, após 12 h de reação, levou a um aumento na concentração de α-CD de cerca de 20 mg mL-1, sendo que a concentração de β-CD aumentou menos que 5 mg mL-1. Analisando as Figura 3(a) e 3(b) identifica-se um aumento de CD total no meio contendo etanol 10% em relação ao meio na ausência deste solvente. Autores já mostraram que o etanol promove uma redução da atividade de água no sítio ativo da enzima, impedindo que esta realize reações hidrolíticas e reações reversas, evitando, desta forma, a decomposição de CDs recém-formadas.30 Em ambos os ensaios (Figura 3(a) e 3(b)) foi verificado que a produção da γ-CD foi insignificante. Produção de CDs pela Toruzyme® na presença dos agentes complexantes para α-CD - determinação por CLAE A Figura 4 apresenta um gráfico de produção de CDs durante 168 h na presença do ácido mirístico e na presença do ácido esteárico.
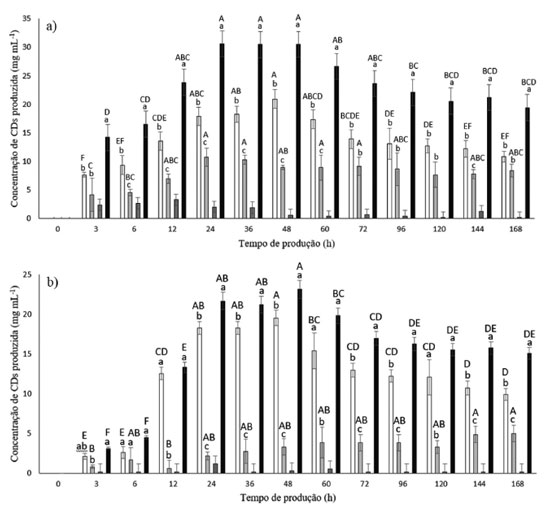 Figura 4. Produção de α-CD (  ), β-CD ( ), β-CD ( ), γ-CD ( ), γ-CD ( ) e total de CDs ( ) e total de CDs (
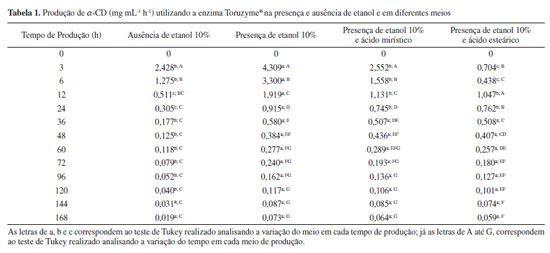
A Figura 4(a) demonstra que a CD que teve a concentração mais predominante no meio foi a α-CD, sendo que a sua concentração chegou ao máximo em 48 h de ensaio, atingindo o valor de 20,93 mg mL-1 de α-CD. A concentração de β-CD chegou ao seu ápice em 24 h de reação, alcançando o valor de 10,72 mg mL-1, e após este tempo a concentração de β-CD deu uma queda estatisticamente pouco significativa, comprovado pelo teste de Tukey, e permaneceu consideravelmente estável durante todo o restante do ensaio. Apesar do meio de produção contendo ácido mirístico precisar do dobro do tempo de reação para alcançar o ápice da concentração de α-CD em relação ao tempo necessário para chegar à concentração máxima de β-CD, a quantidade de α-CD neste tempo foi 95% maior do que a quantidade de β-CD no seu ápice. É importante ressaltar que no momento em que houve o pico da concentração de α-CD, a concentração de β-CD era de 8,96 mg mL-1, ou seja, no meio reacional tinha 2,3 vezes mais α-CD do que β-CD. Na Figura 4(b) é notável a produção de α-CD, a qual na presença do ácido esteárico, foi muito maior que as demais, sendo que a sua concentração chegou ao ápice no tempo 48 h (19,57 mg mL-1 de α-CD), assim como no meio contendo o ácido mirístico. Também é importante evidenciar que no momento do pico de produção de α-CD, o meio reacional apresentava 3,31 mg mL-1 de α-CD, ou seja, a quantidade de α-CD em 48 h foi quase 6 vezes maior do que a quantidade de β-CD no mesmo tempo, uma diferença mais significativa do ocorrido para os outros meios de produção. Na literatura foi relatado que o uso do 1-decanol, o qual é o agente complexante mais utilizado na produção de α-CD pela a-CGTase de K. pneumoniae M5al, levou a um aumento de 50% do rendimento.17 Também na Figura 4(b) foi observado que o perfil de produção da β-CD durante todo o período de 168 h foi crescente, diferente do que aconteceu no meio que continha o ácido mirístico (Figura 4(a)). Neste experimento, a concentração de β-CD no tempo final de ensaio (168 h) chegou ao valor de 5,00 mg mL-1, enquanto que na presença do ácido mirístico foi de 8,40 mg mL-1 de α-CD, ou seja, a produção de β-CD foi mais vantajosa na presença do ácido mirístico do que na presença do ácido esteárico. Uma última análise a se fazer em relação à Figura 4(b) é o fato de que a concentração de γ-CD permaneceu, durante todo o tempo, insignificante. A maior produção de α-CD e em menor tempo (12 h) foi verificada no meio com etanol 10% e sem a presença de agentes complexantes. Isto ocorreu quando o ensaio foi realizado em 168 h nos diferentes meios de produção e com 0,1% da enzima comercial Toruzyme®, entretanto, os meios reacionais que continham os agentes complexantes e etanol apresentaram maior produção de α-CD ao longo das 168 h, do que aquele em que havia a ausência de etanol (Figura 1S, material suplementar). Apesar da concentração de α-CD nos meios contendo agentes complexantes ser menor do que a concentração no meio com etanol 10%, o meio contendo etanol e o ácido esteárico foi considerado o mais indicado, uma vez que a diferença entre a concentração de α-CD e α-CD, no pico da produção de α-CD (em 48 h), na presença de ácido esteárico (Figura 4(b)) foi quase 6 vezes maior do que a diferença de concentração dessas duas moléculas no meio contendo somente etanol, na qual a concentração de α-CD foi apenas 1,5 vezes maior que a concentração de α-CD, conforme já exposto anteriormente. Portanto, o perfil de produção e as quantidades de α-CD na presença dos agentes complexantes não tiveram uma variação significativa, ficando mais evidente entre eles a diferença na relação de produção entre α-CD e α-CD. O custo de produção de CDs pode ser reduzido quando metodologias de seletividade da enzima são utilizadas e a molécula desejada passar a ser produzida em uma maior quantidade, facilitando sua separação.17,31 Portanto, não é possível escolher um meio reacional para produção de CDs somente pela quantidade de moléculas produzidas, é preciso avaliar a seletividade da produção, visto que o processo de separação também encarece o produto. E nesse quesito, o meio reacional contendo ácido esteárico foi o mais eficiente. Produção de α-CD e β-CD pela enzima Toruzyme® na presença e ausência de etanol e em diferentes meios Ao verificar as Tabelas 1 e 2, em 3 h de produção, em um meio de reação ausente de etanol, a enzima produziu no máximo 2,428 mg mL-1 h-1 de α-CD e 3,245 mg mL-1 h-1 de α-CD. Porém, é possível observar que enquanto a produção de α-CD teve uma queda de em torno 0,95 mg mL-1 h-1 em 6 h de reação, a produção de α-CD teve uma queda de 1,15 mg mL-1 h-1. Desta forma, em um meio reacional comum, contendo somente enzima e substrato, a produção de α-CD pela enzima Toruzyme® passa a ser maior do que a de α-CD, quando a reação é estendida por maior tempo.
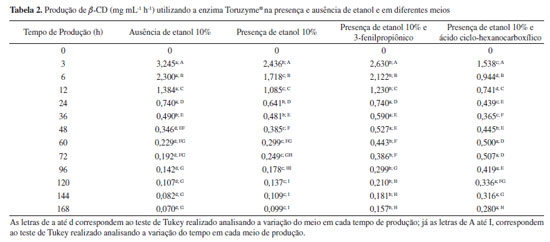
Apesar de ter sido constatado que o meio de escolha para a produção de α-CD ser aquele que contém ácido esteárico, como já mencionado anteriormente, a Tabela 1 mostra que o melhor meio reacional é aquele com etanol 10%. Isto comprova, mais uma vez, a importância de considerar a seletividade da enzima na presença de agentes complexantes e/ou solventes. Ao analisar a Tabela 2 foi verificado que, para um ensaio de 168 h, o meio que demonstrou uma maior efetividade foi aquele contendo o ácido ciclo-hexanocarboxílico, ou seja, este agente complexante foi o mais adequado para promover a seletividade da enzima em favor da produção de α-CD. Considerando que a α-CD apresenta baixa solubilidade em comparação a α-CD, a separação desta molécula é bastante simples e de custo reduzido. Com a análise das Tabelas 1 e 2 foi possível verificar que a enzima Toruzyme® direcionou mais sua produção para α-CD do que α-CD, mesmo quando usado os agentes complexantes. Isto significa que os agentes complexantes para α-CD demonstraram maior efeito seletivo na produção de CDs.
CONCLUSÕES Para a quantificação das CDs por CLAE se faz necessária a separação das mesmas dos agentes complexantes utilizados nos ensaios. Para os complexos realizados com a α-CD foi possível a descomplexação utilizando solventes, contudo, o mesmo não foi possível para os complexos realizados entre α-CD e seus agentes complexantes. Neste último caso, a única possibilidade de quantificação das CDs produzidas foi por meio de método espectrofotométrico, uma vez que não foi encontrado na literatura informações suficientes para realizar uma metodologia de descomplexação da α-CD dos agentes complexantes utilizados nesta pesquisa. Estudos estão sendo realizados com este propósito. O uso de agentes complexantes proporcionou um aumento da produção de α-CD e de α-CD, bem como demonstrou a capacidade destes se complexarem com as CDs correspondentes. Portanto, este estudo corroborou com as informações encontradas em revisões de literatura e, ainda, complementou com resultados de ensaios que demonstraram que o uso do ácido esteárico e do ácido mirístico é bastante eficiente no aumento da produção de α-CD pela enzima Toruzyme®, porém, esta enzima se mostrou mais sensível aos agentes complexantes para α-CD do que aqueles para α-CD. O uso dos agentes complexantes como ácido 3-fenilpropiônico e do ácido ciclo-hexanocarboxílico, juntamente com a utilização de etanol 10% em um meio reacional, mostrou ser eficaz para uma maior produção de α-CD. Enquanto o ácido ciclo-hexanocarboxílico foi o agente que estimulou em menor escala a produção de α-CD nas primeiras horas de reação, para uma produção de longa duração ele se mostrou mais eficiente, ao contrário do ácido 3-fenilpropiônico, que se mostrou muito eficiente para uma produção em menor tempo de reação. Já em relação à produção de α-CD, o meio reacional de escolha foi o que continha etanol 10% e o ácido esteárico, num tempo de produção de 48 h, uma vez que foi o que demonstrou uma maior diferença na relação α-CD/α-CD. Desta forma, conclui-se que diversas CGTases podem se tornar economicamente viáveis e com possibilidade de uso industrial com o emprego de etanol e agentes complexantes no meio reacional.
MATERIAL SUPLEMENTAR O material suplementar desse trabalho, Figura 1S, está disponível em http://quimicanova.sbq.org.br/, na forma de arquivo PDF, com acesso livre.
AGRADECIMENTOS Os autores agradecem ao CNPq, Fundação Auracária e a CAPES pelo financiamento da pesquisa e aos demais pesquisadores integrantes da equipe do Laboratório de Biotenologia Enzimática (LaBE), da Universidade Estadual de Maringá (UEM).
REFERÊNCIAS 1. Del Valle, E. M. M.; Process Biochem. 2004, 39, 1033. [Crossref] 2. Challa, R.; Ahuja, A.; Ali, J.; Khar, R. K.; AAPS PharmSciTech 2005, 6, 329. [Crossref] 3. Jambhekar, S. S.; Breen, P.; Drug Discovery Today 2016, 21, 356. [Crossref] 4. Lyra, M. A. M.; Alves, L. D. S.; Fontes, D. A. F.; Soares-Sobrinho, J. L.; Rolim-Neto, P. J.; Rev. Cienc. Farm. Basica Apl. 2010, 31, 117. 5. Andreaus, J.; Dalmolin, M. C.; de Oliveira Junior, I. B.; Barcellos, I. O.; Quim. Nova 2010, 33, 929. [Crossref] 6. Buschmann, H. J.; Schollmeyer, E.; J. Cosmet. Sci. 2002, 53, 185. 7. Biwer, A.; Antranikian, G.; Heinzle, E.; Appl. Microbiol. Biotechnol. 2002, 59, 185. [Crossref] 8. Serni, U.; Eur. J. Rheumatol. Inflammation 1993, 12, 47. [Link] acessado em setembro de 2023 9. Nicolazzi, C.; Venard, V.; Le Faou, A.; Finance, C.; Antiviral Res. 2002, 54, 121. [Crossref] 10. Aguiar, U. N.; Lima, S. G.; Rocha, M. S.; Freitas, R. M.; Oliveira, T. M.; Silva, R. M.; Moura, L. C. B.; Almeida, L. T. G.; Quim. Nova 2014, 37, 50. [Crossref] 11. Mura, P.; J. Pharm. Biomed. Anal. 2014, 101, 238. [Crossref] 12. Tang, W.; Zou, C.; Da, C.; Cao, Y.; Peng, H.; Carbohydr. Polym. 2020, 240, 116321. [Crossref] 13. Barreto, L.; Cunha Filho, M.; Lat. Am. J. Pharm. 2008, 27, 629. [Crossref] 14. Li, Z.; Wang, M.; Wang, F.; Gu, Z.; Du, G.; Wu, J.; Chen, J.; Appl. Microbiol. Biotechnol. 2007, 77, 245. [Crossref] 15. Rather, M. Y.; Ara, K. Z. G.; Karlsson, E. N.; Adlercreutz, P.; Process Biochem. 2015, 50, 722. [Crossref] 16. Novozymes A/S; Starch Application Sheet 2005. 17. Li, Z.; Chen, S.; Gu, Z.; Chen, J.; Wu, J.; Trends Food Sci. Technol. 2014, 35, 151. [Crossref] 18. Leemhuis, H.; Kelly, R. M.; Dijkhuizen, L.; Appl. Microbiol. Biotechnol. 2010, 85, 823. [Crossref] 19. Cepea, https://www.cepea.esalq.usp.br/br/indicador/mandioca.aspx, acessada em agosto 2023. 20. CycloLab, https://cyclolab.hu/products/nonionic_cyclodextrins-c11/alphacyclodextrin-p59/, acessada em agosto 2023. 21. CycloLab, https://cyclolab.hu/products/nonionic_cyclodextrins-c11/betacyclodextrin-p60/, acessada em agosto 2023. 22. CycloLab, https://cyclolab.hu/products/nonionic_cyclodextrins-c11/gammacyclodextrin-p61/, acessada em agosto 2023. 23. Matioli, G.; Zanin, G. M.; Moraes, F. F.; Appl. Biochem. Biotechnol. 2000, 84, 955. [Crossref] 24. Calsavara, L. P. V.; da Cunha, A. R. D.; Balbino, T. A.; Zanin, G. M.; de Moraes, F. F.; Appl. Microbiol. Biotechnol. 2011, 165, 1485. [Crossref] 25. Blackwood, A. D.; Bucke, C.; Enzyme Microb. Technol. 2000, 27, 704. [Crossref] 26. Tsuchiyama, Y.; Yamamoto, K.; Asou, T.; Okabe, M.; Yagi, Y.; Okamoto, R.; J. Ferment. Bioeng. 1991, 71, 407. [Crossref] 27. Grade, A.; Rüdiger, V.; Schneider, H. J.; Connors, K. A.; J. Pharm. Sci. 1997, 86, 236. [Crossref] 28. Bekers, O.; Utijtendaal, E. V.; Beijen, J. H.; Bult, A.; Underberg, W. J. M.; Drug Dev. Ind. Pharm. 1991, 17, 1503. [Crossref] 29. Tardioli, P. W.; Zanin, G. M.; Moraes, F. F.; Enzyme Microb. Technol. 2006, 39, 1270. [Crossref] 30. Fenelon, V. C.; Aguiar, M. F. A.; Miyoshi, J. H.; Martinez, C. O.; Matioli, G.; Bioprocess Biosyst. Eng. 2015, 38, 1291. [Crossref] 31. Pinheiro, K. H.; do Nascimento, L. B.; Fenelon, V. C.; Barão, C. E.; Matioli, G.; de Moraes, F. F.; Bioprocess Biosyst. Eng. 2017, 40, 1305. [Crossref] |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access