Artigo
|
|
| Adsorção de azul de metileno utilizando carvão ativado preparado a partir da casca do tamboril (Enterolobium contortisiliquum) Adsorption of methylene blue using activated charcoal prepared from the peels of monkfish (Enterolobium contortisiliquum) |
|
Francisco A. SilvaI*; Leonardo B. CantanhedeII; Izaías Santos MarquesI; Gilvan Pereira de FigueredoI
I. Instituto Federal de Educação, Ciência e Tecnologia do Maranhão, 65030-005 São Luíz − MA, Brasil Recebido em 01/04/2023; *e-mail: alves.12av@gmail.com Contamination of natural resources by dyes present in industrial effluents causes serious impacts to the environment. Research on efficient methods to remove these contaminants has intensified in recent years. A promising method is adsorption, as it uses effective and low-cost adsorbents, such as biomass. In this study, the adsorptive capacity of carbon chemically activated with phosphoric acid (H3PO4) obtained from monkfish (Enterolobium contortisiliquum) shells was investigated for the removal of methylene blue (MB) dye in aqueous medium. UV-Visible was used to quantify the dye removed from the experimental batch method. Adsorption tests at different temperatures suggest that the Langmuir isotherm model (R2 = 0.9967) and the pseudo-second order kinetic model better fit the experimental data. The negative values of ΔHads and ΔGads express that the adsorption dynamics is exothermic and spontaneous. The positive value of ΔSads suggests an increase in disorder at the solid-solution interface during the process. Under these conditions, TCA (monkfish activated charcoal) presented a qe of 525.15 mg g-1, reaching a removal percentage of 82.67%. The treatment carried out to obtain activated carbon allowed the SEM, BET and FT-IR analyses to reveal a porous surface with the presence of micro and mesopores and acid groups on the TCA surface. INTRODUÇÃO Ao longo dos anos a indústria de corantes vem desenvolvendo um papel significativo na economia moderna. É vasta a aplicação dos corantes no setor industrial, que compreende desde pigmentação de fibras têxteis para a confecção de vestuário, até a indústria alimentícia, na coloração de alimentos ou bebidas. Entretanto a produção têxtil tem se destacado, negativamente, na utilização de corantes pelo ponto de vista de contaminação de efluentes por resíduos oriundos de produtos perigosos e tóxicos.1 Atualmente, os órgãos de proteção ambiental têm se mostrado preocupados com descarte inadequado desses pigmentos em leitos de rios e lagos promovendo a contaminação da fauna e flora daquele ambiente.2 A baixa degradabilidade e alta solubilidade em água dos efluentes industriais confere aos corantes um potencial contaminante durante o processo de pigmentação nas indústrias, como é o caso da indústria têxtil. Essa contaminação é devida, principalmente, ao descarte inadequado de rejeito de corantes nos efluentes dessas indústrias, podendo causar sérios danos à saúde humana, inclusive o câncer.3 Os impactos causados ao meio ambiente pela emissão desajustada de poluentes, embora em pequena quantidade, são de difícil reversibilidade, pois ao longo do tempo vão se acumulando na cadeia alimentar.4 Assim, diante dessa problemática, se faz necessário uma ação preventiva de forma eficaz a curto, médio e longo prazo que pode ser alcançada através do estudo de métodos, processos ou estratégias que possam reduzir os resíduos gerados pela contaminação indesejável de corantes ao ambiente.5 São vários os métodos químicos utilizados para a remoção de contaminantes em sistemas aquáticos, como a precipitação química, floculação, ozonização, entre outros.1 Assim, a busca por tecnologias apropriadas de tratamento que possibilitem a remoção de corantes em efluentes industriais tem recebido grande atenção nos últimos anos, tornando-se uma das prioridades dentro da comunidade acadêmica da área de química de materiais.3 No entanto, esses métodos ainda estão muito distantes da realidade de muitas indústrias, principalmente, de pequeno e médio porte, devido ao seu alto custo de implementação. Assim, dentre as diversas metodologias aplicadas à remoção de contaminantes industriais, a adsorção vem se mostrando uma técnica muito versátil e, dependendo do tipo de adsorvente, bastante viável economicamente.6 No processo de adsorção sólido/líquido ocorre a transferência de massa de um soluto que esteja presente na fase líquida para uma superfície porosa na fase sólida. Ou seja, a adsorção é um processo de interfaces a qual é criada uma camada do adsorvato na superfície do material adsorvente.7 Existe, atualmente, grande variedade de adsorventes alternativos utilizados na remoção de contaminantes industriais, como corantes e metais, com um destaque àqueles disponíveis na natureza, como biomassas,8 latossolos,9 argilas,10 silicatos11 e carvões ativados obtidos a partir de materiais lignocelulósicos.4,12 Em razão do alto custo de materiais sintéticos e considerando a enorme quantidade de efluente, normalmente produzido pelo setor industrial, pesquisas têm sido recentemente direcionadas para adsorventes alternativos, também chamados de adsorventes de baixo custo ou não convencionais. Estes adsorventes têm sido investigados em escala laboratorial para o tratamento de efluentes com diferentes graus de eficiência.13 Portanto, a busca por adsorventes que tenham grande capacidade adsortiva, grande área superficial específica, alta resistência mecânica e que sejam de baixo custo, tem sido um desafio para os pesquisadores na área da química de materiais.14 Nesse contexto, considera-se uma alternativa inovadora para o tratamento de efluentes industriais contaminados, a utilização de carvões ativados quimicamente provenientes de materiais lignocelulósicos, pois a presença de grupos polares na sua composição lhe confere uma considerável capacidade de troca catiônica.15 É importante considerar ainda, que os materiais lignocelulósicos utilizados no preparo dos carvões ativados, além de apresentar essas características, possuem grande disponibilidade na natureza.12 O estado do Maranhão dispõe de uma grande quantidade de materiais lignocelulósicos que podem ser utilizados como material precursor para a produção de carvão ativado. O tamboril (Enterolobium contortisiliquum), por exemplo, que é uma espécie pertencente à família Leguminosae Mimosoideae. Sua nomenclatura usual varia de acordo com a região podendo ser chamada de tamboril, orelha-de-macaco, timbaúva, orelha-de-negro, timbaúba, tambori, timbó, tambaré, ximbó e pacará.16 É uma árvore fibrosa, característica que lhe confere como um potencial adsorvente. Essa árvore é de origem brasileira, ocorrendo no Pará, Maranhão e Piauí até o Mato Grosso do Sul e Rio Grande do Sul, nas florestas pluviais e semidecídua. Sua aplicação é restrita a utilização de sua árvore para a fabricação de barcos e de canoas de tronco inteiro, compensados, brinquedos, armações de móveis, miolo de portais, e caixotaria em geral, pois proporciona um manejo simples e fácil acabamento.17 Neste trabalho foi sintetizado, caracterizado e avaliada a capacidade adsortiva do carvão ativado a partir das cascas do fruto do tamboril frente ao corante azul de metileno em meio aquoso.
PARTE EXPERIMENTAL Reagentes Todos os produtos químicos utilizados neste estudo eram de pureza analítica e foram usados diretamente sem tratamento adicional. O ácido fosfórico (H3PO4 85% PA ACS) foi adquirido pela Synth, o corante azul de metileno foi adquirido pela Dinâmica. Para os procedimentos de titulação, soluções padronizadas de NaHCO3 (Synth), Na2CO3 (Synth), NaOH (Merck) e HCl (Synth) foram preparadas no mesmo dia a partir de água destilada e fervida (para eliminar carbonatos). Síntese dos carvões ativados As cascas dos frutos do tamboril foram lavadas, secas e trituradas. Em seguida, 20 g do material lignocelulósico foi colocado em contato com uma solução de ácido fosfórico (H3PO4, 40% em massa) por um período de 24 h na proporção em massa de ácido/tamboril de 2,75/1. Posteriormente, o material foi seco e pirolisado nas temperaturas de 350, 450 e 500 °C variando o tempo de pirólise entre 1 e 3 h. Em seguida o material foi lavado e seco a 80 °C por 24 h. Na sequência, foi realizada a classificação granulométrica para tamanho de grão entre 53 µm e 150 µm, obtendo assim um material de pó fino e uniforme, denominado de TCA.12 Análise termogravimétrica (TGA/DTG) A degradação térmica do precursor foi analisada por TGA/DTG, realizada em uma termobalança Shimadzu modelo TGA-51, com fluxo de 100 mL min-1 de ar sintético e 50 mL min-1 de argônio como gás de purga. Nas análises aqui ressaltadas foram utilizados cadinhos de alumina, razão de aquecimento de 10 °C min‑1, massa da amostra de 20,00 ± 0,50 mg, partindo da temperatura ambiente e progredindo até 600°C. Teor de cinzas e umidade A quantidade de matéria inorgânica do precursor foi analisada pelo método ASTM D 2866-94 (teor de cinzas) e a quantidade de água presente no material adsorvente preparado foi determinada pelo método ASTM D 2876-94 (teor de umidade). Fisissorção de N2 O método de análise BET permite obter dados fundamentais sobre a área superficial específica e porosidade do carvão ativado. A análise foi realizada a partir dos dados de adsorção em etapa gasosa através de um Microporosímetro modelo, Anton Paar QuantaTec conectado a um microcomputador, no qual a amostra havia sido desgaseificada, a vácuo, a 300 °C. A técnica consiste na adsorção de N2 a 77 K fundamentado nos trabalhos de BET - Brunauer, Emmett e Teller.12 Microscopia eletrônica de varredura (MEV) A morfologia dos grãos do carvão ativado preparado foi determinada por microscopia eletrônica de varredura (MEV - MEV FEG - field emisson gun) de extrema resolução que permite resolução sub-nanométrica, realizada no Laboratório de Caracterização Estrutural (LCE) do Departamento de Engenharia de Materiais (DEMa) da Universidade Federal de São Carlos. Para obter as micrografias do material adsorvente, as amostras foram montadas sobre uma plataforma de alumínio, utilizando-se uma fita dupla face, as condições utilizadas na análise foram: resolução nominal de 500 e 1550× com voltagem de aceleração de feixe de 15 kV. Determinação dos grupos funcionais - titulação de Boehm O método de Boehm utilizado configura-se no uso de reações químicas orgânicas para caracterização dos grupos funcionais presentes na superfície do TCA, como grupos fenólicos, carboxílicos e lactonas.18 Para neutralizar os grupos carboxílicos, lactônicos e fenólicos este método utiliza uma solução de hidróxido de sódio (NaOH), solução de carbonato de sódio (Na2CO3) para neutralizar grupos lactônicos e carboxílicos, já a solução de bicarbonato de sódio (NaHCO3) para neutralizar apenas grupos carboxílicos.19 As soluções de NaOH, HCl, Na2CO3 e NaHCO3 foram preparadas e padronizadas na concentração de 0,1 mol L-1 para aplicação do método. Foi pesado 0,5 g do TCA posto em contato com 50 mL de cada solução padrão em 4 Erlenmeyers sob agitação por 24 h. Em seguida, as soluções foram filtradas e retiradas alíquotas de 10 mL do filtrado e realizadas as titulações. O número de sítios relacionados ao conjunto de grupos orgânicos de caráter ácido ou básico foram calculados a partir dos dados obtidos.19 Análise de espectroscopia vibracional no infravermelho A análise espectrométrica na região do infravermelho foi utilizada como uma análise complementar ao método de Boehm. Os espectros no infravermelho com transformada de Fourier (FT-IR) do carvão produzido a partir das cascas do tamboril foram obtidos utilizando um espectrofotômetro Shimadzu (IR-Prestige-21). Os espectros possuem resolução de 2 cm-1 variando entre 400 e 4000 cm-1. Estas análises foram realizadas com uma mistura composta por 1% em peso de amostra com 99% em peso de brometo de potássio (KBr 99%, Sigma-Aldrich).20 Os espectros foram medidos com acumulação de 45 varreduras e resolução de 2 cm-1. Determinação do ponto de carga zero pHpcz O pHpcz refere-se ao pH em que a superfície do carvão possui carga neutra. Foi empregada a metodologia "experimento dos 11 pontos".21 O experimento consistiu em fazer a mistura de 50 mg do TCA em 50 mL de solução aquosa de cloreto de sódio (NaCl) a 0,1 mol L-1 sob 11 diferentes condições de pH inicial (2 a 12), utilizando as soluções de HCl e NaOH a 1,0 mol L-1, após 48 h de equilíbrio mediu-se o pH. Construindo o gráfico de pH final versus pH inicial, o pHpcz corresponde à faixa onde o pH final se mantém constante, independentemente, do pH inicial, assim a superfície comporta-se como um tampão.21 Efeito do pH Para verificar a influência do pH na adsorção do corante azul de metileno o estudo foi conduzido pelo método de batelada a 27 °C. As massas de 30 mg do carvão ativado foram colocadas em Erlenmeyers com a solução de azul de metileno na concentração de 1122 mg L-1. Os pH avaliados foram 2, 3, 7, 11 e 12, com tempos de contato de 5 min e agitação constante. Para correção pH, foram utilizadas soluções de NaOH e HCl 0,1 mol L-1.18 Avaliação da capacidade adsortiva A quantificação do corante azul de metileno foi determinada inicialmente com a construção de uma curva analítica, seguida da variação da massa (5 a 100 mg) para investigar a massa do adsorvente ideal para o processo adsortivo. A quantidade adsorvida foi calculada pela Equação 1.22 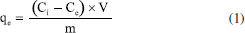 onde, qe é a quantidade de corante adsorvido, dada em mg de adsorvato por grama de adsorvente no equilíbrio; Ci é a concentração inicial do adsorvato (mg L-1); Ce é a concentração de corante no equilíbrio (mg L-1); V é o volume da solução (L); m é a massa do adsorvente, carvão ativado (g).22 Para cada 30 mg de TCA foi adicionado 20 mL da solução de azul de metileno em uma concentração de 1122 mg L-1, pH 5,5 (natural). A remoção do corante foi quantificada por espectrofotometria de absorção do ultravioleta na região do visível, a 664 nm (espectrofotômetro Shimadzu UV-Vis, modelo UVmini-1240 com faixa espectral de 190 ~ 1100 nm).23 Isotermas de adsorção Para a construção das isotermas foram realizadas soluções aquosas de azul de metileno na faixa de concentração de 748 e 3.831,19 mg L-1. A massa de 30 mg do carvão ativado (TCA) foi adicionada a 20 mL da solução de azul de metileno no pH 5,5 e mantido a 500 rpm por 120 min. Os dados experimentais foram ajustados aos modelos de isotermas propostos por Langmuir e Freundlich. O modelo de Langmuir determina o processo de adsorção homogêneo em superfícies sólidas que acontecem em reação de adsorção com interações fortes adsorvente/adsorvato em monocamacada. Já o modelo de Freundlich refere-se a processos adsortivos em superfícies heterogêneas, apresentando uma relação exponencial entre o substrato livre e o adsorvido.24 Modelos de isotermas de Langmuir e Freundlich Para obtenção das isotermas de adsorção os dados experimentais foram ajustados aos modelos de Langmuir e Freundlich. O modelo de Langmiur determina o processo de adsorção em superfícies sólidas que ocorrem em reaçao com fortes interações. Já o modelo de Freundlich refere-se a processos adsortivos em superfícies heterogêneas, apresentado uma relação exponencial entre o substrato livre e o adsorvido. Os parâmetros desses modelos foram obtidos através das equações: Langmuir (Equação 2);25 (Equação 3)26 e Freundlich (Equação 4).27 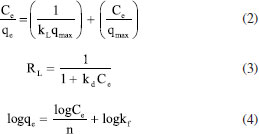 onde kL é a constante de Langmuir relacionada à energia de interação no processo adsortivo adsorvato/adsorvente (L mg-1) e Ce é concentração em equilíbrio (mg L-1 ). RL é o fator de separação, quando o valor de RL é estimado entre 0 e 1 a reação de adsorção é favorável. Para RL > 1 a adsorção não é favorável, quando RL = 1, a adsorção é linear para RL = 0 tem-se uma adsorção irrevogável.11 O qe é a quantidade de corante adsorvido no equilíbrio; kf é a constante de equilíbrio de Freundlich e n é o parâmetro que sugere o favorecimento da reação que tem sua isoterma adequada de acordo com modelo de isoterma de Freundlich.27 Modelos cinéticos de pseudoprimeira ordem, pseudossegunda ordem e mecanismo de difusão intrapartícula A cinética de adsorção foi revelada ajustando os dados experimentais aos modelos cinéticos de pseudoprimeira ordem, pseudossegunda ordem e ao mecanismo de difusão intrapartícula. Os parâmetros cinéticos foram calculados pelas equações: pseudoprimeira ordem (Equação 5);12 pseudossegunda ordem (Equações 6)25 e difusão intrapartícula (Equação 8).26 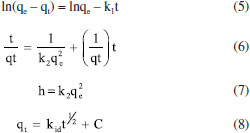 onde, k1 (min-1) é a constante de primeira ordem, qe (mg g-1) e qt (mg g-1) são as quantidades de espécies adsorvidas pelo adsorvente em equilíbrio e em qualquer tempo, respectivamente. O valor da constante de velocidade da adsorção pode ser determinado através do coeficiente angular da reta. Já k2 (g mg-1 min-1) é a constante de velocidade para o modelo pseudossegunda ordem, o h (mg g-1 min-1) é a velocidade de adsorção inicial e kid (mol g-1 min-1/2) é a constante de velocidade de difusão intrapartícula, C é o valor da intersecção da reta com o eixo qt (mg g-1).12,25 Parâmetros termodinâmicos Os parâmetros termodinâmicos foram determinados a partir de ensaios adsortivos em diferentes temperaturas 15, 25, 35 e 45 °C. Soluções contento azul de metileno em pH = 5,5 na faixa de concentração entre 748 e 3.831,19 mg L-1 com volume final de 20 mL em balões de 50 mL de duas bocas cada. Foram adicionadas ao sistema uma massa de 30 mg do carvão ativado na melhor condição (TCA). As Equações 9,12 10,26 e 1126 foram utilizadas para calcular os parâmetros termodinâmicos. 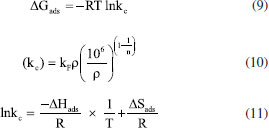 onde, a variação da energia livre de Gibbs de adsorção é representada por ΔGads; R é a constate universal dos gases; a temperatura (em Kelvin); ΔHads é a variação de entalpia e ΔSads a variação de entropia de adsorção; kc é a constante termodinâmica; kf é a constante de Freundlich (mg g-1), r é a densidade da água (1,0 g mL-1) e n é o fator de heterogeneidade.
RESULTADOS E DISCUSSÃO Síntese dos carvões ativados A síntese do carvão considerou a variação da proporção em massa de H3PO4 para tamboril, assim como a variação da temperatura e o tempo de pirólise possibilitou a seleção da melhor condição de preparo, na qual a melhor proproção em massa foi de 2,75/1 com temperatura e tempo de tratamento térmico de 350 °C e 3 h, respectivamente. Assim denominou-se o carvão sintetizado para as análises adsortivas de TCA. Análise termogravimétrica A análise térmica possibilitou a investigação do comportamento dos materiais lignocelulósicos em função da temperatura. Através da curva da análise termogravimétrica (TGA) pôde-se selecionar a temperatura de pirólise da matéria-prima para a produção do carvão ativado. A Figura 1(c) apresenta o comportamento térmico da amostra das cascas do fruto do tamboril. As perdas iniciais referem-se à umidade presente e a alguns compostos voláteis (0 a 150 °C). Entre as temperaturas de 150 e 320 °C ocorre a primeira perda de massa significativa em razão da degradação de hemicelulose e celulose que ocorre em temperaturas baixas, e a segunda corresponde à degradação de lignina e pequenas quantidades de celulose. A lignina é mais resistente, por isso se degrada em altas temperaturas.23 Nota-se que a perda de massa das amostras a 300 °C ou superior são semelhantes, com isso, a temperatura de pirólise ideal das amostras é em torno de 350 °C.28 A casca do tamboril apresentou um total de 36,32% de aproveitamento em massa e teor de cinzas de 1,86% (ASTM D 2866‑94). O rendimento obtido foi, relativamente, próximo àquele obtido na literatura para materiais carbonáceos em condições similares de tratamento térmico.6,29 As cinzas representam os compostos minerais presentes na matéria orgânica após passar pelo processo de pirólise. Geralmente, são constituídas por óxidos, sulfatos ou carbonatos de ferro, potássio, cálcio, sódio, magnésio e alumínio.30,31
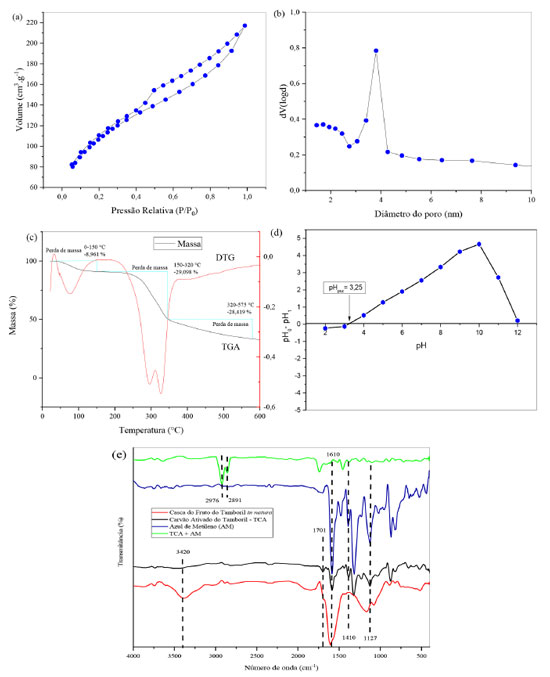 Figura 1. (a) Isoterma de adsorção/dessorção de N2 do TCA; (b) distribuição do diâmetro de poros do TCA; (c) curva TGA/DTG das cascas do fruto do tamboril triturado in natura; (d) pH do ponto de carga zero do TCA, T = 27 °C, massa do adsorvente 50 mg e tempo de contato 300 min; (e) espectro de FT-IR das cascas do fruto do tamboril in natura, TCA e TCA + AM. Amostras preparadas em pastilha de KBr a 1% (m/m)
Fisissorção de N2 A análise de fisissorção de nitrogênio pelo método de BET revelou estrutura porosa do TCA com área superficial específica de 388,46 m2 g-1, o volume total de poros de 0,33 cm3 g-1, volume de microporos de 0,15 cm3 g-1 e diâmetro médio dos poros de 1,44 nm. A Figura 1(a) exibe a isoterma de adsorção/dessorção de nitrogênio para o TCA com isoterma reversível tipo IV, com histerese H4. Os adsorventes porosos apresentam isoterma tipo IV, que configura condensação capilar.30 A histerese H4 é, frequentemente, encontrada em adsorventes com micro e mesoporos mesclados. O efeito de condensação capilar promove o preenchimento de moléculas de nitrogênio nos canais mesoporosos quando em menor pressão atmosférica. Dessa forma, a adsorção em mesoporos foi detectada a uma pressão relativa (P/P0) entre 0,50 a 0,90. Observa-se ainda que em pressão relativa acima de 0,90 sugere adsorção em multicamada através de macroporos. A Figura 1(b) ilustra os poros do TCA, que em sua maioria, foram distribuídos em torno de 3,5 nm corroborando com os resultados das isotermas de adsorção/dessorção de nitrogênio que a média dos poros do TCA foram, principalmente, mesoporosos (2 a 50 nm).12,30 Determinação dos grupos funcionais pelo método de Boehm Os grupos contendo oxigênio presentes na superfície dos carvões ativados são fundamentais para a química de superfície desses materiais, uma vez que, determinam a carga de superfície, hidrofobicidade e sua densidade eletrônica das camadas de grafite.32 A Tabela 1 apresenta os grupos funcionais presentes na superfície do TCA. A utilização do agente ativante ácido fosfórico (H3PO4) foi determinante para predominância de grupos ácidos na superfície do carvão ativado. A partir dos dados obtidos pelo método de Boehm constatou-se a presença de grupos carboxílicos (0,27 mEq g-1) com maior incidência de grupos lactônicos (2,18 mEq g-1) e fenólicos (1,41 mEq g-1) em comparação com grupos básicos (0,02 mEq g-1) na superfície do carvão.
Espectroscopia na região do infravermelho FT-IR A Figura 1(e) ilustra o espectro de FT-IR do tamboril in natura, do TCA e do TCA + AM. O espectro do tamboril in natura revela uma banda intensa em 3420 cm-1 e outra em 1610 cm-1, característica de vibração de estiramento O−H da hidroxila em grupos funcionais típico de biomassas (lignina, celulose e hemicelulose) e vibrações de estiramento do anel aromático C=C, respectivamente.27,30 Em contraste, no espectro do carvão ativado essa banda diminui sua intensidade devido à remoção da água absorvida no precursor, bem como compostos iniciais.27 Observa-se a presença de grupos fenólicos no espectro do TCA detectados na banda em 1410 cm-1 referente a deformação de O−H. Assim como, a presença de grupos carboxílicos observados na banda 1710 cm-1 (estiramentos C=O).12 Estas informações são concordantes com o método de Boehm, que detectou alta intensidade de grupos fenólicos e lactonas. A presença da banda em 1127 cm-1 pode indicar vibrações de estiramento P−O de fosfato de ésteres ou vibrações simétricas de cadeias de polifosfatos (P−O−P), podendo ser atribuído à ativação química com H3PO4, onde são comumente encontrados grupos de fósforo na superfície do carvão ativado.12,27 O carvão ativado analisado após a adsorção do corante azul de metileno apresentou dois novos picos em 2976 e 2891 cm-1 referentes às vibrações de alongamento simétricas ou assimétricas da ligação C−H e -CH3, respectivamente. Isso pode sugerir que ocorreram interações intermoleculares entre os cátions do corante AM e os grupos oxigenados da superficie do TCA formando compostos com predominância destes arranjos moleculares e consequente diminuição de intensidade das bandas referentes a esses grupos oxigenados.30 Ponto de carga zero - pHpcz O pH no ponto de carga zero representa valores constantes, assim que o sistema alcança o equilíbrio, apontando que a superfície do carvão ativado descreve o comportamento de um tampão. A Figura 1(c) apresenta o gráfico que indicou que o pHpcz na superfície do TCA foi de 3,25. Quando o valor de pH estiver abaixo deste valor as cargas superficiais do material adsorvente serão positivas, por outro lado, valores acima deste, a superfície terá cargas negativas, como a solução de trabalho de AM apresenta pH (5,5), portanto acima do pHpcz, essa configuração favorece a interação a entre os cátions do AM e a superfície carregada negativamente do TCA, permitindo maior eficiência do processo adsortivo, sem a necessidade de uso de solução tampão para ajuste do pH.8,33 Microscopia eletrônica de varredura A Figura 2 apresenta as micrografias com as morfologias do precursor in natura, do carvão in natura e do TCA que mostram uma superfície fibrosa para o precursor in natura, típico de biomassas. Observa-se morfologia na forma placas com tamanhos variados para o carvão in natura. Já o TCA apresenta partículas dispersas numa superfície irregular com aspecto de material poroso.23 Os efeitos das etapas de ativação e pirólise do material precursor podem ser observadas nas micrografias apresentadas. Como tem sido reportado, a literatura apresenta resultados alinhados a este estudo.12,18
 Figura 2. Micrografia obtida por microscopia eletrônica de varredura: (a) da casca do fruto do tamboril in natura, nível de magnificação, 5000 ×;
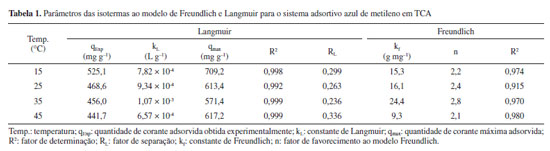
Adsorção do corante azul de metileno Isotermas de adsorção A Figura 3(c) apresenta a curva da isoterma de adsorção para diferentes temperaturas a partir de um gradiente da concentração do corante azul de metileno. A curva de isoterma obtida corresponde a uma isoterma de adsorção favorável, pois sugere que a massa do corante removido por unidade de massa do adsorvente é significativa para uma pequena massa de adsorvente utilizada.24
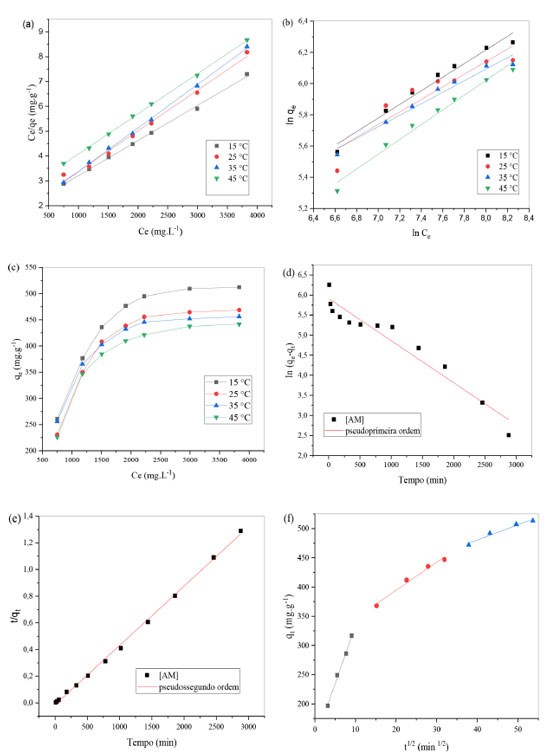 Figura 3. (a) Modelo de Langmuir; (b) Freundlich e (c) isoterma de adsorção do corante AM em TCA. [AM] = 374 e 3.831,19 mg L-1, T = 15, 25, 35 e 45 °C, massa do adsorvente 30 mg, tempo de contato de 120 min e pH 5,5; (d) modelo cinético pseudoprimeira ordem, pseudossegunda ordem; (e) edifusão intrapar
As Figuras 3(a) e 3(b) apresentam os resultados das adequações dos dados experimentais aos modelos de isotermas de Langmuir e Freundlich, respectivamente. A partir das equações lineares dos modelos de Langmuir e Freundlich obtidas com a adequação dos dados experimentais, pôde-se obter os parâmetros das isotermas do sistema adsortivo corante azul de metileno frente ao TCA, associados aos dois modelos ajustados. A Tabela 1 apresenta os parâmetros obtidos a partir do ajuste dos dados experimentais aos modelos de isotermas propostos por Langmuir e Freundlich. Os dados obtidos sugerem que o processo adsortivo se ajusta melhor ao modelo de Langmuir. De acordo com o RL, parâmetro de equilíbrio, que permite prever se a adsorção é favorável ou desfavorável, apresentaram valores favoráveis (Tabela 1). Outro parâmetro importante a se destacar é o qmax que determina a capacidade máxima de remoção, que prevê a saturação do adsorvente, se encontram próximos aos observados experimentalmente, corroborando com a hipótese de melhor ajuste ao modelo de Langmuir.5,12 Cinética de adsorção As Figuras 3(d), 3(e) e 3(f) apresentam os modelos cinéticos de pseudoprimeira ordem, pseudossegunda e difusão intrapartícula, respectivamente, ajustados a partir dos dados experimentais. Os parâmetros do estudo cinético para o modelo de pseudossegunda ordem se distanciaram mais da linearidade quando comparados com os modelos de pseudoprimeira ordem. A Tabela 2 expõe os valores dos coeficientes de correlação e das constantes de velocidade para os modelos cinéticos de pseudoprimeira ordem, pseudossegunda ordem e o modelo de difusão intrapartícula. A cinética do processo de adsorção se ajustou melhor ao modelo de pseudossegunda ordem (R2 = 0,999). O mecanismo de difusão intrapartícula, que relaciona a quantidade adsortiva em um dado tempo com a raiz quadrada do tempo demostra o envolvimento de estágios multilineares para a remoção de azul de metileno pelo TCA. O 1º estágio representa a difusão do filme pela qual as moléculas de azul de metileno se difundem por meio do filme líquido, seguido da rápida atração pela superfície externa do TCA. No 2º estágio as moléculas de azul de metileno movem-se para os poros na superfície interna do TCA. O equilíbrio de adsorção ocorre no 3º estágio, o qual apresenta a constante de difusão intrapartícula mais baixa indicando que a difusão intrapartícula não é a única etapa limitante da velocidade de adsorção.12 Estudos presentes na literatura corroboram com esse resultado.12,30
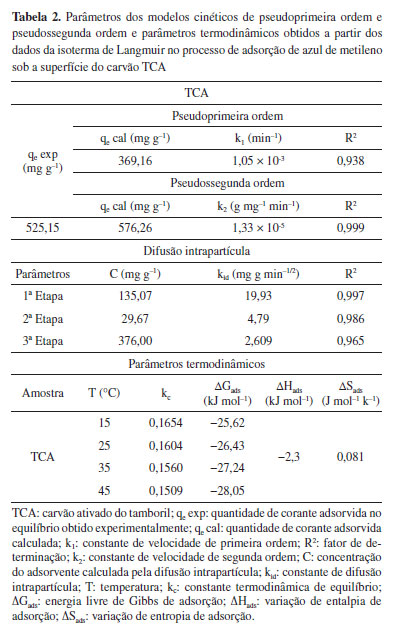
Parâmetros Termodinâmicos A Tabela 2 apresenta os parâmetros termodinâmicos obtidos a partir dos testes de adsorção. A regressão linear foi utilizada para determinar os parâmetros. ΔHads, ΔSads obtidos a partir da inclinação e da interceptação, respectivamente.34 A variação de energia livre de padrão foi calculada pela relação ΔGads = ΔHads - T ΔSads. O valor negativo relacionado à variação de entalpia de adsorção (ΔHads) igual a -2,3 kJ mol-1 revela que que o processo de adsorção é de natureza exotérmica e espontâneo com valores de ΔGads menores que zero para todas as temperaturas estudadas.35 Além disso, o valores de ΔHads são menores que 40 kJ mol-1, sugerindo que o processo adsortivo AM na superfície do TCA é principalmente de caráter físico.11,36 O valor positivo da entropia de adsorção (ΔSads) indica que houve um aumento da aleatoriedade na interface sólido-solução durante adsorção.27 Na literatura encontra-se um estudo adsortivo com o mesmo biomaterial. No entanto, o autor ativou o precursor com KOH e obteve baixo valor da capacidade máxima adorvida (qmax = 1,983 ± 0.04 mg g−1). Já os ajustes aos modelos de isotermas e cinéticos foram semelhantes aos deste trabalho.37
CONCLUSÕES O carvão ativado preparado com cascas do fruto do tamboril, utilizando ácido fosfórico como agente químico ativante apresentou relevante área superficial específica de 388,46 m2 g-1, estrutura porosa com micro e meso poros e grupos ácidos superficiais. Foi submetido à investigação de seu potencial adsortivo frente ao corante azul de metileno obtendo significativa capacidade adsortiva de AM (qexp = 525,15 mg g-1), devido a considerável concentração de grupos funcionais ácidos na superfície do carvão. Além de se ajustar melhor à isoterma de Langmuir e a cinética de pseudossegunda ordem com o mecanismo de difusão intrapartícula não sendo a etapa limitante da velocidade de adsorção. Os valores negativos de ΔHads e ΔGads expressam que a dinâmica de adsorção é exotérmica e espontânea, respectivamente. O valor positivo de ΔSads sugere um aumento da desordem na interface sólido-solução durante o processo.
AGRADECIMENTOS Ao Programa de Pós-graduação em Químca do IFMA (Instituto Federal de Educação, Ciência e Tecnologia do Maranhão) por oportunizar o curso e fomentar o trabalho através do financiamento (Edital PRPGI N° 94/2020). Ao IFMA Campus Codó pelas instalações laboratoriais. Ao Laboratório de Caracterização Estrutural (LCE)DEMa da Universidade Federal de São Carlos - SP e ao Grupo de Pesquisa GEIC (Grupo de Estudo de Catálise e Inorgânica do Maranhão) pelo apoio.
REFERÊNCIAS 1. Sakr, F.; Alahiane, S.; Sennaoui, A.; Dinne, M.; Bakas, I.; Assabbane, A.; Mater. Today: Proc. 2020, 22, 93. [Crossref] 2. Azari, A.; Nabizadeh, R.; Nasseri, S.; Mahvi, A. H.; Mesdaghinia, A. R.; Chemosphere 2020, 250, 126238. [Crossref] 3. Ali, A. F.; Kovo, A. S.; Adetunji, S. A.; J. Encapsulation Adsorpt. Sci. 2017, 07, 95. [Link] acessado em julho 2023 4. Shooto, N. D.; Thabede, P. M.; Bhila, B.; Moloto, H.; Naidoo, E. B.; J. Environ. Chem. Eng. 2020, 8, 103557. [Crossref] 5. Ho, S.; Journal of Geoscience and Environment Protection 2020, 08, 120. [Link] acessado em julho 2023 6. Bispo, M. D.; Schneider, J. K.; Oliveira, D. S.; Tomasini, D.; MacIel, G. P. S.; Schena, T.; Onorevoli, T.; Bjerk, B.; Jacques, T. R.; Krause, R. A.; Caramão, L. C.; Caramão, E. B.; Bastos, E.; J. Environ. Chem. Eng. 2018, 6, 2743. [Crossref] 7. Santos-Clotas, E.; Cabrera-Codony, A.; Ruiz, B.; Fuente, E.; Martín, M. J.; Bioresour. Technol. 2019, 275, 207. [Crossref] 8. Mamaní, A.; Ramírez, N.; Deiana, C.; Giménez, M.; Sardella, F.; J. Environ. Chem. Eng. 2019, 7, 103148. [Crossref] 9. Mouta, E. R.; Melo, W. J.; Soares, M. R.; Alleoni, L. R. F.; Casagrande, J. C.; Rev. Bras. Cienc. Solo 2008, 32, 1033. [Link] acessado em julho 2023 10. Elmoubarki, R.; Mahjoubi, F. Z.; Tounsadi, H.; Moustadraf, J.; Abdennouri, M.; Zouhri, A.; El Albani, A.; Barka, N.; Water Resour. Ind. 2015, 9, 16. [Crossref] 11. Sun, Z.; Srinivasakannan, C.; Liang, J.; Duan, X.; Ceram. Int. 2019, 45, 4590. [Crossref] 12. Han, Q.; Wang, J.; Goodman, B. A.; Xie, J.; Liu, Z.; Powder Technol. 2020, 366, 239. [Crossref] 13. Mashkoor, F.; Nasar, A.; J. Magn. Magn. Mater. 2020, 500, 166408. [Crossref] 14. Patra, C.; Gupta, R.; Bedadeep, D.; Narayanasamy, S.; Environ. Pollut. 2020, 266, 115102. [Crossref] 15. Liu, J.; Hu, C.; Huang, Q.; Bioresour. Technol. 2019, 271, 487. [Crossref] 16. Siqueira, S. L.; Silva, A. T.; Vicalvi, M. C. V.; Araujo, R. O.; Sena, K. E.; Albuquerque, J. F.; Resumos do 54o Congresso Brasileiro de Química, Natal, Brasil, 2014. [link] acessado em agosto 2023 17. Lima, J. P.; Alvarenga, G.; Rosa, G.; Lopes, T. J.; Blucher Chemical Engineering Proceedings 2017, 1, 306. [Link] acessado em julho 2023 18. Mendonça, J. C.; Cantanhede, L. B.; Rojas, M. O. A. I.; Rangel, J. H. G.; Bezerra, C. W. B.; Water Supply 2021, 22, 481. [Link] acessado em julho 2023 19. Boehm, H. P.; Carbon 2002, 40, 145. [Link] acessado em julho 2023 20. Mopoung, S.; Moonsri, P.; Palas, W.; Khumpai, S.; Sci. World J. 2015, 2015, 1. [Link] acessado em julho 2023 21. Robles, J.; Regalbuto, J.; Prog. Rep. 2004, 14, 1. [Link] acessado em agosto 2023 22. Obaid, A. A.; Al-Masri, M.; Deghles, A.; Taha, N.; Jodeh, S.; Smail, R.; Am. J. Anal. Chem. 2019, 10, 38. [Link] acessado em julho 2023 23. Silva, L. V.; López-Sotelo, J. B.; Guimarães, A. C.; Hernández-Navarro, S.; Sánchez-Báscones, M.; Navas-Gracia, L. M.; Martín-Ramos, P.; Martín-Gil, J.; J. Environ. Manage. 2015, 155, 67. [Link] acessado em julho 2023 24. Wang, J.; Guo, X.; Chemosphere 2020, 258, 127279. [Crossref] 25. Corda, N. C.; Kini, M. S.; MATEC Web Conf. 2018, 144, 1. [Link] acessado em julho 2023 26. Supong, A.; Bhomick, P. C.; Karmaker, R.; Ezung, S. L.; Jamir, L.; Sinha, U. B.; Sinha, D.; Appl. Surf. Sci. 2020, 529, 147046. [Crossref] 27. Silva, M. C.; Spessato, L.; Silva, T. L.; Lopes, G. K. P.; Zanella, H. G.; Yokoyama, J. T. C.; J. Mol. Liq. 2021, 324, 114771. [Crossref] 28. Tran, H. N.; You, S. J.; Chao, H. P.; J. Environ. Chem. Eng. 2016, 4, 2671. [Link] acessado em julho 2023 29. Santos, M. L.; Lima, O. J.; Nassar, E. J.; Ciuffi, K. J.; Calefi, P. S.; Quim. Nova 2011, 34, 507. [Link] acessado em julho 2023 30. Zhang, Z.; Xu, L.; Liu, Y.; Feng, R.; Zou, T.; Zhang, Y.; Kang, Y.; Zhou, P.; Microporous Mesoporous Mater. 2021, 315, 10904. [Crossref] 31. Borges, W. M. S.; Arantes, A. C. C.; Bianchi, M. L.; Resende, E. C.; Guerreiro, M. C.; Perígolo, D. M.; Boari, P. V.; Rev. Virtual Quim. 2015, 7, 1952. [Link] acessado em julho 2023 32. Velo-Gala, I.; López-Peñalver, J. J.; Sánchez-Polo, M.; Rivera-Utrilla, J.; Carbon 2014, 67, 236. [Link] acessado em julho 2023 33. Ranjbari, A.; Demeestere, K.; Verpoort, F.; Kim, K. H.; Heynderickx, P. M.; Chem. Eng. J. 2021, 431, 133349. [Crossref] 34. Silva, F. N.: Investigação da Seletividade e da Termodinâmica de Adsorção de Cr(VI) de Águas Residuárias por Nanoadsorventes Magnéticos do Tipo CoFe2O4@γ-Fe2O3; Dissertação de Mestrado, Universidade de Brasília, Brasília, Brasil, 2018. [Link] acessado em agosto 2023 35. Santos, R.; Silva, E. F. M.; Simões, T. B.; Oliveira, E. D. C.; Ribeiro, A. T. S.; Araújo, I. R. S.; Almeida, L. C.; Resumos do 20o Congresso Brasileiro de Catálise, São Paulo, Brasil, 2019. [Link] acessado em agosto 2023 36. Dotto, G.; Vieira, M.; Gonçalves, J.; Pinto, L.; Quim. Nova 2011, 34, 1193. [Link] acessado em julho 2023 37. Alvarenga, G.; Lima, J. P.; Goszczynski, A. C. F.; Environ. Sci. Pollut. Res. 2020, 27, 27893. [Crossref] |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access