Artigo
|
|
| Monitoramento de trihalometanos (THMS) e da qualidade da água para abastecimento público da cidade de Cavalcante, Goiás Monitoring of trihalomethanes (THMS) and water quality for public supply in the city of Cavalcante, Goiás |
|
Dalila Kênia OliveiraI; Larissa Queiroz SilvaII; Núbia Natália de BritoII,*
I. Saneamento de Goiás S. A. (SANEAGO), 74093-020 Goiânia - GO, Brasil Recebido em: 25/04/2023 *e-mail: nubiabrito@ufg.br Trihalomethanes (THMs) are organohalogens compounds formed from the reaction between free residual chlorine and natural matter organic (humic substances) present in raw water from surface sources. This study aimed to evaluate the formation of THMs resulting from the application of chlorine for disinfection, in the water treating process for public supply in the city of Cavalcante, GO, located in the region of Chapada dos Veadeiros (Brazil). The results of physical-chemical analyses apparent color, turbidity, pH, free residual chlorine, consumed oxygen, hardness, total alkalinity and THMs demonstrated a positive and strong correlation between the formation of THMs and the hardness of treated water, as well as the chlorine consumed during disinfection process. It was observed an increase in apparent color, turbidity and consumed oxygen in the rainy season. These parameters indicate the presence of organic matter and that present a positive and moderate correlation with the formation of THMs. INTRODUÇÃO A água ingerida pelo homem é um dos meios que mais podem veicular organismos patogênicos. Ao longo da história várias infecções, tais como cólera, febre tifóide, hepatite infecciosa, leptospirose, entre outras, dispersaram-se através da água consumida, causando a morte de inúmeras pessoas.1 No Brasil e em muitos países do mundo, as estações de tratamento de água (ETA) utilizam o cloro, em suas diversas formas, como préoxidante e desinfetante, tendo em vista, a eficiência do processo de cloração na destruição de vírus e bactérias nocivas, eliminando o risco sanitário e produzindo um residual estável a um baixo custo. No entanto, o cloro (utilizado principalmente na forma de NaOCl), é o principal agente que na presença de matéria orgânica, inclusive de origem natural, tais como: substâncias húmicas e/ou ácidos fúlvicos pode formar os THMs (trihalometanos). Os THMs são os contaminantes orgânicos mais difundidos em água potável com potencial cancerígeno e mutagênico, quando ingerido em grandes quantidades.2,3 Os trihalometanos (THMs) são um grupo de compostos orgânicos voláteis (COVs) classificados como subprodutos de desinfecção. Eles foram identificados pela primeira vez em 1974 e são formados durante a cloração da água. Sua fórmula geral é CHX3, onde X pode ser qualquer halogênio ou uma combinação de halogênios. Caso bromo ou iodo também estejam presentes na água, outros nove THMs podem ser formados: bromodiclorometano (CHBrCl2); dibromoclorometano (CHBr2Cl); tribromometano (CHBr3); dicloroiodometano (CHCl2I); bromocloroiodometano (CHBrClI); clorodi-iodometano (CHClI2); dibromoiodometano (CHBr2I); bromodi-iodometano (CHBrI2); e triodometano (CHI3).4,1 O bromo tem vantagens sobre o cloro nas reações de substituição com os compostos orgânicos, mesmo que o cloro esteja presente em excesso quando comparado com o bromo inicial.3,5 A taxa e o grau de formação de THMs aumentam à medida que a concentração de cloro, ácido húmico, temperatura, pH e concentração de íons brometo aumentem também. O clorofórmio é o principal produto de desinfecção encontrado em água clorada. O padrão de concentração de água clorada com possível formação de THMs é: clorofórmio > bromodiclorometano > dibromoclorometano > bromofórmio.4 Embora a cloração da água potável forneça muitas vantagens, os THMs continuam a ser uma preocupação para a saúde humana. A Agência Internacional de Pesquisa sobre o Câncer (IARC) classificou o clorofórmio e o bromodiclorometano como possíveis cancerígenos para humanos (Grupo 2B).4 Dentro desse contexto, as principais vias de exposição à THMs ocorrem através de inalação, contato dérmico e ingestão, assim sendo, os seres humanos são expostos aos THMs principalmente por meio da ingestão direta de água da torneira, por inalação de compostos voláteis e absorção dérmica durante o banho e natação em piscinas cloradas.6,7 Há relatos na literatura que estabelecem uma relação entre a exposição aos THMs, mais especificamente a crônica, e seus efeitos adversos, uma vez que, após a absorção, esses elementos tendem à bioacumulacão no organismo, causando citotoxicidade, genotoxicidade e mutagenicidade. Por isso, são frequentemente relatados na literatura como potenciais carcinogênicos, possuindo uma estreita relação com o câncer de bexiga e eventualmente, mas com uma prevalência menor, com câncer de colón, reto e pâncreas.6,7 Chiu et al.,8 estudaram em água para abastecimento público a relação de cálcio e magnésio na formação e THMs e as possibilidades do surgimento de câncer no pâncreas pela exposição à trihalometanos, sendo possível observar relação na formação de THMs e concentração de magnésio na água e que a correlação entre THMs e risco de câncer de pâncreas pode ser influenciado pela concentração de magnésio na água potabilizada, embora mais estudo sobre o assunto deva ser explorado. Compreender as implicações para a saúde pública dessa problemática emergente é crucial para o desenvolvimento de planos de segurança hídrica; mais eficazes, sendo assim este trabalho teve como objetivo principal o monitoramento de trihalometanos (THMs) e da qualidade da água para abastecimento público da cidade de Cavalcante, GO.
PARTE EXPERIMENTAL Sistema de tratamento da água de Cavalcante, GO O sistema de abastecimento público estudado pertence ao município de Cavalcante, localizado ao norte do estado de Goiás, às margens da GO-241, inserido na mesorregião Norte Goiano e na microrregião Chapada dos Veadeiros. A população atendida pelo sistema é de 5.028 habitantes, com uma vazão média de 46 m3 h-1, segundo dados fornecidos pela operadora do sistema, Companhia de Saneamento do estado de Goiás (SANEAGO). O clima no município é tropical, com temperatura média de 23,1 °C. O período chuvoso compreende os meses de dezembro a março e os meses mais secos estão entre abril e setembro, com pluviosidade média anual de 1895 mm.9 A estação de tratamento de água (ETA) foi projetada e construída no início da década de 1990, utilizando a tecnologia de dupla filtração para tratamento, alimentada por captação superficial no Rio das Pedras. Localizado no Parque Estadual da Chapada dos Veadeiros, uma das áreas mais importantes de conservação do Planalto Central do Brasil, o manancial de abastecimento sofre pouca influência de ações antrópicas, e possui mata ciliar preservada. O tratamento consiste na aplicação do coagulante sulfato de alumínio (Al2(SO4)3), na tubulação de chegada de água bruta na área da ETA, e a mistura rápida é promovida no interior da tubulação de adução ao sistema de filtração. Após a coagulação, a água é conduzida à filtração ascendente e em seguida à filtração descendente, posteriormente, o processo de desinfecção é realizado no tanque de contato com adição de cloro gasoso (Cl2); para fluoretação é aplicado o ácido fluossilícico; e para correção do pH é adicionada cal hidratada (Ca(OH)2). Análises realizadas O monitoramento da água bruta e tratada é de responsabilidade da Companhia de Saneamento do Estado de Goiás (SANEAGO), operadora do sistema. A frequência e os parâmetros a serem monitorados são estabelecidos por meio da Portaria de Potabilidade No. 888, publicada em 4 de maio de 2021, elaborada pelo Ministério da Saúde, que dispõe sobre os procedimentos de controle e vigilância da qualidade da água para consumo humano e padrões de potabilidade.10 Os valores de parâmetros da qualidade da água foram estudados entre os anos de 2015 a 2021 para água bruta e tratada. Para representar o período de seca foram analisados os dados dos meses de: abril, maio, junho, julho, agosto e setembro. Para o período de chuva foram analisados os dados dos meses de: outubro, novembro, dezembro, janeiro, fevereiro e março. As coletas de água bruta foram realizadas na chegada da ETA onde existe uma torneira específica para coleta de água bruta. As amostras de água tratada foram coletadas na ETA, na saída do tanque de contato, onde são adicionados o cloro e o flúor. Os parâmetros ambientais escolhidos para avaliação do estudo representam as variáveis envolvidas direta e/ou indiretamente na formação de THMs, tais como: cor aparente, turbidez, pH, cloro residual livre, oxigênio consumido, dureza, alcalinidade total e trihalometanos totais; compreendendo um total de 49 amostras de água bruta e 660 amostras de água tratada. As análises foram realizadas no Laboratório Regional de Águas de Campos Belos e Laboratório Central de Águas da SANEAGO e disponibilizadas/autorizadas para estudo conforme ofício 5711/2022. Todas as análises foram realizadas conforme Standard Methods for the Examination of Water and Wastewater, 23rd edition.11 O estudo e manipulação dos dados foram realizados no Laboratório de Tratamento de Águas Residuárias - Labtar, localizado no Instituto de Química da Universidade Federal de Goiás (UFG). Estudo estatístico No tratamento estatístico dos dados foram calculados os principais parâmetros da estatística descritiva: médias aritméticas, máximo, mínimo, desvio padrão; bem como, a aplicação de correlações lineares. Os dados foram agrupados por ponto de amostragem, período chuvoso e período de seca. Para evidenciar correlações significativas entre as variáveis físico-químicas e a formação de THMs foi aplicado o teste de correlação de Pearson. As correlações foram definidas como fracas (0,00 < R < 0,39), moderadas (0,40 < R < 0,69) e fortes (0,70 < R < 1,00).2,12,13
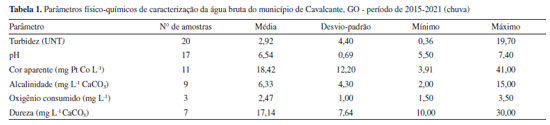
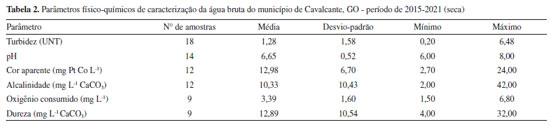
RESULTADOS E DISCUSSÃO Caracterização da água bruta Diversos fatores intervêm no desempenho das estações de tratamento de água, destacando-se as características da água bruta, parâmetros hidráulicos relacionados aos processos, a acurácia da operação e as metas de qualidade da água tratada. Sabe-se que falhas no tratamento podem comprometer a qualidade da água tratada e expor a comunidade a diversos riscos relacionados à saúde. Dentre estes fatores, as características da água bruta ocupam posição de relevância na qualidade da água tratada.14 Nas Tabelas 1 e 2 podem ser visualizadas as características da água bruta do município de Cavalcante, GO em épocas de chuva e seca.
Embora seja difícil instituir parâmetros acerca da qualidade das águas naturais para tratabilidade, a resolução do Conselho Nacional de Meio Ambiente (CONAMA) No. 357 de 2005 estabelece condições e padrões de qualidade necessários ao atendimento dos usos preponderantes da água.15 Para águas destinadas ao abastecimento público (tratamento convencional) são estabelecidos valores limítrofes para diversos parâmetros físico-químicos e biológicos, destacando-se entre os parâmetros físicos de turbidez até 100 UNT e cor verdadeira até 75 mg Pt Co L-1.
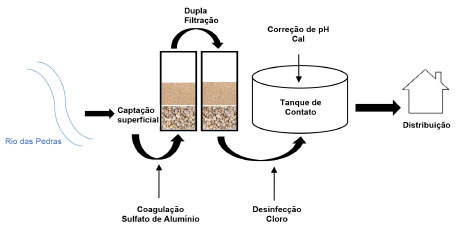 Figura 1. Sistema de tratamento de água de Cavalcante, GO (fonte: elaborado pelo autor)
A turbidez de uma amostra de água é indicadora da presença de sólidos em suspensão totais, que podem ser de origem natural (partículas do solo como areia, silte e argila ou micro-organismos) ou serem originárias de atividades antropogênicas, como resíduos domésticos e industriais. Valores superiores a 5 UNT podem comprometer a etapa de desinfecção da água, uma vez que os microorganismos presentes tendem a se associar às partículas em suspensão, dificultando a ação do desinfetante.16 A água bruta de Cavalcante, GO, apresentou valores de turbidez entre 0,20 e 19,70 UNT, o que corrobora com as características do manancial de captação de água. O manancial está presente em área de preservação, sofre pouca influência antrópica e pouca variação entre os períodos de seca e chuva. Nas Figuras 2a e 2b pode-se observar a área e poço de captação de água bruta, sendo uma região bastante preservada, rica em vegetação e localizada no interior do Parque Nacional da Chapada dos Veadeiros.
 Figura 2. (a) Localização da captação e ETA de Cavalcante (fonte: imagem Google Earth, maio/2022); (b) poço de captação de água bruta de Cavalcante no Rio das Pedras
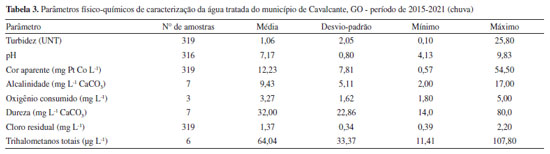
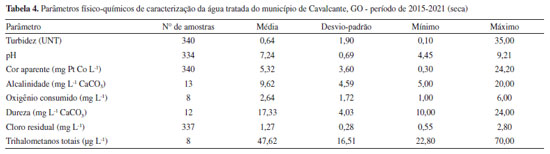
Segundo Libânio,17 a cor verdadeira é produzida pela reflexão da luz em partículas minúsculas denominadas coloides, finamente dispersas e de dimensão inferior a 10 µm, de origem predominantemente orgânica. A cor está normalmente associada à presença de ácidos húmicos e taninos, originados da decomposição de compostos orgânicos naturais, oriundos da degradação de plantas e animais. Neste estudo foi avaliado o parâmetro cor aparente, que se difere da cor verdadeira por sofrer influência de partículas suspensas na amostra. Para avaliação da cor verdadeira é necessário centrifugar a amostra e remover os sólidos suspensos totais, no entanto, a cor aparente é muita utilizada na rotina de monitoramento das estações de tratamento de água. Sendo assim, a cor aparente média do período em estudo foi de 15,70 mg Pt Co L-1, com valores máximos no período chuvoso, chegando a 41,00 mg Pt Co L-1. Corpos d'água de cor naturalmente escura ocorrem em regiões ricas em vegetação e, consequentemente, de solos menos erodíveis. Assim como os valores de cor se correlacionam com a concentração de carbono orgânico dissolvido presente no ambiente aquático, o oxigênio consumido (OC) é outro importante indicador, que se baseia na concentração de oxigênio requerido para a oxidação da matéria orgânica biodegradável e não biodegradável. Muito útil para avaliar alterações de qualidade na água a ser tratada, e indicar a efetividade do processo do tratamento aplicado à água.18 Analisando as Tabelas 1 e 2, observa-se que as amostras estudadas apresentam níveis de OC abaixo de 5,00 mg L-1, com valor máximo observado no período de seca de 6,80 mg L-1. A alcalinidade da água é representada pela presença dos íons hidroxila, carbonato e bicarbonato, e juntamente com o pH, assumem importante papel no processo de coagulação e eficiência do tratamento. Durante o período da pesquisa, o valor de pH foi de 6,60 e a alcalinidade natural variou de 2,00 a 42,00 mg L-1 de CaCO3. A resolução CONAMA No. 357,15 estabelece a faixa de pH entre 6 a 9 e de acordo com a FUNASA16 a maioria das águas naturais apresentam valores de alcalinidade na faixa de 30 a 500 mg L-1 de CaCO3, caracterizando a água bruta de Cavalcante, GO, como água de baixa alcalinidade. A dureza é um parâmetro químico que indica a concentração de cátions multivalentes em solução na água, sobretudo de cálcio (Ca+2) e magnésio (Mg+2), podendo ser de origem natural por contato da água com o solo. A dureza média, no período estudado, foi de 15,01 mg L-1 CaCO3 e máxima de 32,00 mg L-1 CaCO3, classificando a água do manancial, segundo Richter,19 como mole ou branda (< 50 mg L-1 de CaCO3). Águas com dureza > 180 mg L-1 de CaCO3 podem apresentar sabor desagradável e causar incrustações na rede de distribuição. Em seus estudos, Oliveira et al.,2 verificaram uma correlação positiva e diretamente proporcional entre a dureza e a formação de THMs. Navalon et al.20 demonstraram, em seus estudos, que os íons Ca2+ e Mg2+ podem contribuir para o aumento da formação de THMs. Essa constatação foi verificada por meio de ensaios, onde os autores adicionaram diferentes concentrações de cálcio e magnésio e observaram o aumento proporcional a estes, na formação de THMs. Portanto, a presença dos íons de cálcio e magnésio pode favorecer a reação de formação de THMs. Caracterização da água tratada A tecnologia de tratamento utilizada na ETA de Cavalcante é do tipo dupla filtração, englobando as etapas de coagulação, seguida de filtração ascendente e descendente, desinfecção, fluoretação e correção do valor de pH. De acordo com Kawamura21 a dupla filtração é indicada para águas com turbidez < 50 UNT, cor aparente < 50 mg Pt Co L-1 e Escherichia coli < 103 NMP 100 mL-1, o que corrobora com os resultados de água bruta do manancial estudado, que apresentou concentração média de Escherichia coli 193 NMP 100 mL-1, turbidez máxima 19,70 UNT e cor aparente máxima 42,00 mg Pt Co L-1 (Tabelas 1 e 2). Segundo os resultados das análises de água bruta o manancial pode ser classificado como Classe 1, conforme resolução CONAMA No. 357 de 2005.15 A nova Portaria de Potabilidade No. 888 de 2021 do Ministério da Saúde10 estabelece que após filtração rápida (tratamento completo ou filtração direta) deve-se obter em 95% das amostras o valor máximo permitido (VMP) de 0,5 UNT para turbidez. Entre as 659 amostras analisadas, 43% apresentaram valores superiores a 0,5 UNT, e os maiores índices de não conformidades foram registrados no período chuvoso (Tabelas 3 e 4).
Oliveira et al.,14 avaliaram a eficiência de 20 estações de tratamento, considerando os resultados de cor e turbidez. O estudo evidenciou que as estações apresentaram melhor desempenho no período de seca, e apenas uma estação obteve a meta de 95% das amostras com turbidez < 0,5 UNT. As três estações de tratamento de água com os piores índices de atendimento à meta de turbidez, todas operavam com sobrecarga e tais condições parecem interferir no desempenho das estações de menor porte, localizadas em pequenos municípios onde a operação tenderia a ser menos acurada. Vale ressaltar que a ETA de Cavalcante foi projetada em 1990 para tratar uma vazão afluente de 7,5 L s-1 e atualmente recebe uma vazão de 15 L s-1. Para cor aparente o valor máximo permitido (VMP) determinado pela Portaria do Ministério da Saúde No. 888 de 202110 é de 15 mg Pt Co L-1, e de acordo com as Tabelas 3 e 4 o valor médio, no período estudado, foi de 8,78 mg Pt Co L-1. Os resultados não conformes representaram 10% das amostras analisadas. A cor aparente média no período chuvoso (12,23 mg Pt Co L-1) teve aumento percentual de 56% quando comparada ao período de seca (5,32 mg Pt Co L-1). No que se refere à concentração de oxigênio consumido não houve redução do valor desse parâmetro quando comparado à água bruta (Tabelas 1 e 2) e água tratada (Tabelas 3 e 4), considerando sua correlação com a concentração de matéria orgânica na água, pode-se inferir que o tratamento não está apresentando boa eficiência para remoção de material orgânico dissolvido. Em seus estudos, Guerra et al.,22 evidenciaram que a incorporação da pré-oxidação com peróxido de hidrogênio nos processos de purificação é uma alternativa viável para a remoção de matéria orgânica não húmica ou hidrofílica, de difícil remoção por processos convencionais; e principal responsável pela formação de subprodutos da desinfecção como os THMs. A etapa de desinfecção é um processo que usa um agente químico ou não químico e que tem por objetivo a inativação de micro-organismos patogênicos presentes na água, incluindo bactérias, protozoários e vírus.23 Na ETA de Cavalcante é utilizado cloro gasoso para o processo de desinfecção, mantendo o cloro residual livre na saída do tanque de contato entre 0,2 e 2,0 mg L-1. Para controle da eficiência da desinfecção é realizado o monitoramento de coliformes totais e Escherichia coli na água tratada, conforme orientações da Portaria de Potabilidade. A presença destes micro-organismos são indicadores de contaminação com fezes humanas e/ou esgoto sanitário. Durante o período de amostragem em 100% (659) das amostras de água tratada avaliadas não foram detectadas a presença de Escherichia coli e coliformes totais, o que corrobora com um processo de desinfecção eficiente. Embora a cloração da água potável forneça muitas vantagens, os THMs continuam a ser uma preocupação para a saúde humana. A correlação entre a concentração de cloro residual livre e a formação de THMs é dada por Delpha e Rodriguez,24 os quais mencionam que "quanto maior a dosagem de cloro, maior será a probabilidade de formação de THMs em uma dada massa de água que abrigue seus precursores orgânicos". Dados estes que foram observados na ETA de Cavalcante, onde o consumo de cloro foi 35% maior durante o período chuvoso, e como pode ser observada na Figura 3, em todas as amostras analisadas a concentração de THMs foi superior durante as chuvas.
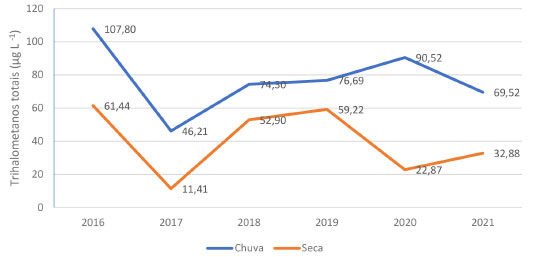 Figura 3. Concentração de trihalometanos totais em água tratada, período de chuva versus período de seca (fonte: elaborado pelo autor)
Os trihalometanos formados em maior proporção são: clorofórmio (CHCl3), bromodiclorometano (CHBrCl2), dibromoclorometano (CHBr2Cl) e o bromofórmio (CHBr3) e são chamados de trihalometanos totais. Segundo Shariati-Rad e Fattahi25 o nível máximo do contaminante clorofórmio (CHCl3) é de 300 µg L-1 em amostra de água para consumo humano. Para bromodiclorometano (CHBrCl2) o máximo permitido em água para consumo seria de 60 µg L-1.26 Para dibromoclorometano (CHBr2Cl) e o bromofórmio (CHBr3) os padrões internacionais permitem um máximo de 100 µg L-1 de cada composto, conforme citado por Salari et al.27 Considerando que a legislação brasileira de potabilidade estabelece como valor limítrofe a concentração de 100 µg L-1 (THMs), apenas uma amostra (7%) apresentou valor superior ao limite máximo estabelecido. Diferenças entre o período chuvoso e seco foram evidenciadas, e aumento percentual de 34% da concentração média de THMs durante as chuvas, caracterizando o período com o maior potencial de formação de trihalometanos. Segundo Lee et al.,28 além de períodos de chuva a matéria orgânica de origem natural (MON) é potencialmente mais lixiviada e, portanto, mais disponível para reação com cloro residual livre e consequentemente formação de THMs. Correlação entre as variáveis físico-químicas da água tratada e a formação de THMs Considerando que a turbidez, cor aparente e oxigênio consumido são indicadores da presença de substâncias orgânicas, oriundas da degradação da matéria orgânica vegetal (substâncias húmicas) e/ou antropogênica e sabendo que estas substâncias em contato com o cloro podem dar origem aos THMs, a correlação moderada, encontrada neste estudo, reforça a importância do monitoramento de tais parâmetros para o controle na formação de subprodutos da desinfecção (Tabela 5).
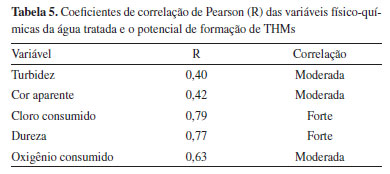
O cloro é aplicado na água tratada com o objetivo de destruição de micro-organismos (desinfecção). No entanto, devido ao seu alto poder oxidante, quando há contato entre o cloro e a matéria orgânica presente, a oxidação desta se inicia e em consequência à reação de formação dos THMs, e esta irá continuar enquanto houver reagente disponível (cloro e/ou material orgânico).23 Cloro consumido é a medida de cloro que foi consumido durante o processo de desinfecção, medido pela diferença entre o cloro dosado e o cloro residual na saída do tanque de contato. A correlação de Pearson forte (R 0,79) entre o cloro consumido e a formação de THMs demonstra claramente o impacto da ação oxidante do cloro sobre a formação de subprodutos da desinfecção. Sobre correlações lineares, Serajuddin et al.29 afirmaram que as mesmas com valores de R2 acima de 0,45 são moderadas e adequados para avaliações rápidas. Na Figura 4 pode ser visualizado o R2 e a equação da reta do monitoramento trihalometanos versus cloro consumido.
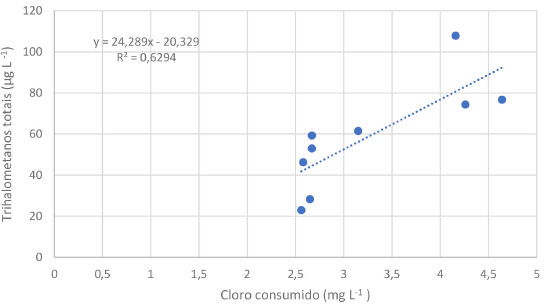 Figura 4. Gráfico trihalometanos versus cloro consumido (fonte: elaborado pelo autor)
A dureza possui coeficiente de correlação de Pearson de R 0,77 indicando correlação forte e positiva, ou seja, a formação de THMs é diretamente proporcional ao aumento de dureza na água. Navalon et al.,20 evidenciaram que a concentração de íons Ca2+ e Mg+2, responsáveis pela dureza de águas naturais, pode favorecer a reação de formação de THMs. Considerando as Tabelas 1,2,3,4 é possível observar que a dureza da água tratada é superior à da água bruta e este fato pode estar relacionado à adição de cal hidratada - Ca(OH)2 na água tratada (mas que ainda apresenta algum teor de matéria orgânica), para correção dos valores de pH. O cálcio tem uma alta tendência a formar complexos estáveis com grupos funcionais contendo oxigênio tais como grupos carboxílicos levando a um aumento da complexação do cálcio com a matéria orgânica de origem natural (MON) tanto aquosa quanto adsorvida.30 Essa dureza, bem como a alcalinidade, pode favorecer a disponibilização da MON hidrofílica para reação com cloro e consequente formação de THMs.31
CONCLUSÃO O efeito do processo de desinfecção pode variar conforme as características da água bruta, por isso o estudo deve ser avaliado para cada fonte de água específica. Dentro desse contexto, pode-se concluir que para águas com alto teor de matéria orgânica dissolvida, dureza e alcalinidade há uma possibilidade de maior formação de THMs e que períodos chuvosos demonstraram maior consumo de cloro no processo de desinfecção, bem como maior possibilidade de formação de THMs. Importante destacar também que de acordo com os resultados de oxigênio consumido é possível inferir a necessidade de uma melhoria nas tecnologias de tratamento utilizadas atualmente, e estudos visando outras formas de desinfecção, como radiação ultravioleta (UV), seriam interessantes, uma vez que o uso do cloro demostrou contribuir fortemente para a formação dos THMs.
AGRADECIMENTOS Os autores agradecem ao Instituto de Química da Universidade Federal de Goiás (UFG) e a empresa de Saneamento Básico do Estado de Goiás (SANEAGO) pelo suporte técnico.
REFERÊNCIAS 1. Silva, B. H. L.; Melo, M. A. B.; Quim. Nova 2015, 38, 309. [Crossref] 2. Oliveira, R. R.; Araújo, A. L. C.; Duarte, M. A. C.; Eng. Sanit. Ambiental 2020, 25, 315. [Crossref] 3. Hernandez, M. R.; Ismail, N.; Drouillard, K. G.; Macisaac, H. J.; Bull. Environ. Contam. Toxicol. 2017, 99, 194. [Crossref] 4. Pavón, J. L. P.; Martín, S. H.; Pinto, C. G.; Cordero, B. M.; Anal. Chim. Acta 2008, 629, 6. [Crossref] 5. Boudenne, J. L.; Parinet, J.; Demelas, C.; Manasfil, T.; Coulomb, B.; J. Environ. Sci. 2017, 58, 262. [Crossref] 6. Marne, A. Z.; Vinyals, G. G.; Alguacil, J.; Villanueva, C. M.; Maule, M.; Gracia-Lavedan, E.; Momoli, F.; Krewski, D.; Mohipp, C.; Petridou, E.; Bouka, E.; MerlettiI, F.; MiglioreI, E.; Piro, S.; Ha, M.; Mannetje, A.; Eng, A.; Aragones, N.; Cardis, E.; Environ. Res. 2021, 200, 111392. [Crossref] 7. Affornalli, B. A.; Macetti, N. M.; Marques, C. M.; de Andrade, D. P.; Mello, R. G.; Rev. Bras. Cancerol. 2021, 67, 1. [Crossref] 8. Chiu, H. F.; Tsai, S.; Wuc, T. N.; Yang, C. Y.; Environ. Res. 2010, 110, 513. [Crossref] 9. Climate Data, https:/pt.climate-data.org/america-do-sul/brasil/goias/cavalcante-43209/, acessado em Julho 2022. 10. Ministério da Saúde, Portaria GM/MS No. 888 de 04 de maio de 2021, Dispõe sobre os Procedimentos de Controle e de Vigilância da Qualidade da Água para Consumo Humano e seu Padrão de Potabilidade; Diário Oficial da União (DOU), Brasília, No. 85, de 07/05/2021, p. 127. [Link] acessado em Julho 2022 11. Baird, R. B.; Eaton, A. D.; Rice, E. W.; Standard Methods for the Examination of Water and Wastewater, 23rd ed.; APHA: New York, 2017. 12. Arantes, A. S. G.; Mendes, A. M.; Azeredo, W. A.; Brito, N. N.; International Journal of Lakes and Rivers 2013, 6, 69. [Link] acessado em Outubro 2023 13. Budeiz, V.; Aguiar, A.; Period. Tche Quim. 2020, 17, 80. [Link] acessado em Outubro 2023 14. Oliveira, M. D.; Bianchi, D. P. Z.; Fonseca, J. F. R.; Gorza Júnior, N. A.; Libânio, M.; Eng. Sanit. Ambiental 2021, 26, 613. [Crossref] 15. Conselho Nacional do Meio Ambiente (CONAMA); Resolução No. 357 de 17 de março de 2005, Dispõe sobre a Classificação dos Corpos de Água e Diretrizes Ambientais para o seu Enquadramento, bem como Estabelece as Condições e Padrões de Lançamento de Efluentes, e dá Outras Providências; Diário Oficial da União (DOU), Brasília, No. 53, de 18/03/2005, p. 58. [Link] acessado em Março 2022 16. Fundação Nacional de Saúde (FUNASA); Manual de Controle de Qualidade da Água para Técnicos que Trabalham em ETAs; FUNASA: Brasília, 2014. [Link] acessado em Julho 2022 17. Libânio, M.; Fundamentos de Qualidade e Tratamento de Água, 3a ed.; Átomo: Campinas, 2010. 18. Macêdo, J. A. B.; Métodos Laboratoriais de Análises Físico-Químicas e Microbiológica, 2a ed.; CRQ-MG: Belo Horizonte, 2003. 19. Richter, C. A.; Água: Métodos e Tecnologia de Tratamento, 1a ed.; Blucher: São Paulo, 2009. 20. Navalon, S.; Alvaro, M.; Garcia, H.; J. Hazard. Mater. 2009, 169, 901. [Crossref] 21. Kawamura, S.; Integrated Design and Operation of Water Treatment Facilities, 2nd ed.; John Wiley and Sons: New Jersey, 2000. 22. Guerra, M. F.; Rodriguez, D. C.; Mesa, G. A. P.; Prod. + Limpia 2016, 11, 55. [Link] acessado em Outubro 2023 23. Di Bernardo, L.; Dantas A. D. B.; Métodos e Técnicas de Tratamento de Água, 2a ed.; Rima: São Carlos, 2005. 24. Delpha, I.; Rodriguez, M. J.; Chemosphere 2017, 166, 453. [Crossref] 25. Shariati-Rad, M.; Fattahi, F.; Anal. Chim. Acta 2020, 1100, 208. [Crossref] 26. Schoedhury, S.; Champagne, P.; Mclellan, P. J.; Water Res. 2010, 44, 2349. [Crossref] 27. Salari, A.; Khanzadi, S.; Rezaei, Z.; J. Adv. Environ. Health Res. 2018, 6, 202. [Crossref] 28. Lee, M.; Ok, Y. S.; Hur, J.; Environ. Pollut. 2018, 242, 1912. [Crossref] 29. Serajuddin; Chowdhury, A. I.; Ferdous, T.; International Journal of Research Granthaalayah 2018, 6, 278. [Crossref] 30. Sadrnourmohamadi, M.; Gorczyca, B.; Water Res. 2015, 73, 171. [Crossref] 31. Iriarte-Veslasco, U.; Alvarez-Uriarte, J. I.; Gonzales-Velasco, J. R.; Sep. Purif. Technol. 2007, 55, 368. [Crossref] |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access