Artigo
|
|
| Perfil volátil do Coffea arabica e Coffea canephora var. conilon por SHS-GC-MS e quimiometria Volatile profile of Coffea arabica and Coffea canephora var. conilon by SHS-GC-MS and chemometrics |
|
Marcos Valério Vieira LyrioI; Pedro Henrique Pereira da CunhaI; Danieli Grancieri DebonaI; Bárbara Zani AgnolettiI; Roberta Quintino FrinhaniI; Emanuele Catarina da Silva OliveiraII; Paulo Roberto FilgueirasI; Lucas Louzada PereiraII; Eustáquio Vinicius Ribeiro de CastroI,*
I. Departamento de Química, Universidade Federal do Espírito Santo (UFES), 29075-910 Vitória - ES, Brasil Recebido em: 16/06/2023 *e-mail: eustaquiovinicius@uol.com.br The volatile composition of coffee exerts a substantial influence on its quality, as it defines the characteristics of the beverage. However, these compounds are influenced by factors within the coffee production chain, such as botanical origin, geography, processing methods, and roasting. Consequently, the identification of such compounds becomes a vital tool for characterizing coffees to these factors. In this context, gas chromatography with headspace extraction is widely used for aroma analysis, providing a composition closer to consumer perception. Headspace extraction offers speed, simplicity, minimal sample preparation, and no need for solvents. In this study, static headspace extraction (SHS) coupled with gas chromatography-mass spectrometry (SHS-GC-MS) was employed to establish the chemical profile of volatile compounds in Coffea arabica and Coffea canephora var. conilon and determine discriminants between the species. A total of 97 compounds, belonging to 17 chemical classes, were identified. The chemometric analysis highlighted furans, phenols, and carboxylic acids as key differentiating classes. Notably, furfuryl alcohol, acetic acid, 4-vinylguaiacol, N-acetyl-4(H)-pyridine, and N-furfurylpyrrole emerged as crucial volatile compounds. The variable selection using Fisher weight applied directly in the chromatograms, produced models consistent with relative area data, with furfuryl alcohol and 4-vinylguaiacol regions being particularly influential in differentiation. INTRODUÇÃO A produção mundial de café no ano-safra de 2021/2022 foi estimada em 167,2 milhões de sacas de 60 kg. Desse montante, 50,38 milhões são oriundas do Brasil, cuja produção se divide entre as espécies Coffea arabica (64%) e Coffea canephora (36%).1,2 Considerando a produção total de café do país, o estado do Espírito Santo se destaca como o segundo maior produtor nacional, sendo responsável por 30% da produção.3 Nesse contexto, a espécie C. arabica possui maior destaque e valor agregado no mercado internacional. Suas plantas são cultivadas em regiões montanhosas, onde as temperaturas são amenas. Quimicamente sua composição apresenta maior quantidade de açúcares, resultando em maior acidez após a torra e na formação de furanos responsáveis pelos atributos que remetem a doçura e caramelo na bebida.4 Por sua vez, o C. canephora possui grãos menores, cujas plantas suportam climas mais quentes, cultivo em regiões de baixa altitude e apresentam maior resistência a doenças. A composição química dessa espécie apresenta maior quantidade de ácidos clorogênicos e cafeína em comparação ao arábica.5 No entanto, são as características sensoriais díspares que evidenciam a distinção entre as duas espécies, isto é, o C. arabica apresenta maior doçura e acidez com notas de melaço e chocolate, enquanto o C. canephora possui corpo e aroma mais intenso, com notas de cereais.6 As diferenças sensoriais e de precificação entre tais cafés tem incentivado a popularidade e o consumo de C. canephora nos últimos anos, isso acontece porque essa espécie apresenta preço mais acessível e características positivas para ser usado como base de blends com C. arabica na produção de café solúvel ou de cafés individuais sem que perca a qualidade.7 A identidade de um café não é somente descrita pela origem botânica, mas também se refere a origem geográfica e as condições ambientais, dessa forma são necessários métodos que auxiliem na obtenção de informações sobre o perfil químico para a discriminação desses cafés.8 A qualidade do café, seja ele puro ou blend, está ligada a diversos compostos químicos que conferem ao produto final suas características sensoriais (cor, aroma e sabor). Dentre esses compostos destacam-se os voláteis.9 A abundância dos compostos presentes no café depende do processo de torrefação e da composição dos seus antecessores não-voláteis do grão cru, os quais são influenciados por diversos fatores como: variações genéticas, geografia, clima, processos fermentativos, entre outros. Portanto, a compreensão da relação dos compostos voláteis com o aroma e sabor do café contribui para compreenção dos resultados em prol da qualidade.9 Dessa forma, a extração por headspace estático (SHS) junto a cromatografia gasosa acoplada a espectrometria de massas (SHS GC-MS) consolida-se como uma das técnicas mais utilizadas para identificação de compostos voláteis no café, uma vez que a composição extraída está mais próxima da percebida pelo consumidor.10 Essas técnicas de extração são rápidas, simples, com mínimo preparo de amostras e dispensam o uso de solventes. Além disso, esses métodos indiretos de amostragem são interessantes quando pretende-se analisar compostos de baixa massa molecular em matrizes sólidas complexas. Em contrapartida, demandam maior atenção no controle das condições instrumentais, como a temperatura e tempo de aquecimento.11,12 Em vista disso, o SHS-GC-MS vem sendo explorado com foco no desenvolvimento de metodologias para avaliação da composição volátil do café. Sanz et al.,13 estudando as condições de temperatura e tempo de aquecimento por SHS, concluíram que temperaturas maiores aumentam a capacidade de extração dos voláteis. De semelhante modo, os autores verificaram que o aumento do tempo também favorece a extração, porém de maneira irregular, dependendo da classe química analisada. Nesse contexto, a quimiometria contribui ativamente quando se pretende criar relações entre a composição química e os parâmetros da cadeia produtiva, sendo especialmente útil em estudos de previsão dos atributos sensoriais ou avaliação dos processos industriais na qualidade final do produto. Devido à complexidade do perfil cromatográfico do café, formado por vários compostos químicos, os métodos quimiométricos se tornam ferramentas indispensáveis para a extração de informações dos dados. Entre as ferramentas disponíveis para tal finalidade, estão inclusos métodos de reconhecimento de padrões, como a análise de componentes principais (PCA), análise hierárquica de clusters (HCA) e análise discriminante linear (LDA), além dos métodos de calibração lineares e não-lineares, como o mínimos quadrados parciais (PLS) e a regressão por vetores de suporte (SVR).14 Thammarat et al.15 utilizaram a SHS-GC-MS para propor uma metodologia útil para a autenticação e controle de qualidade do café Elephant dung. Por meio do perfil volátil os autores aplicaram a PCA e HCA para identificar os principais discriminantes químicos desse tipo de café. Além disso, essa técnica de extração vem sendo utilizada na avaliação do efeito do tratamento de ultrapasteurização (UHT) na estabilidade da bebida café;16 efeito das condições de armazenamento (temperatura e embalagem) na composição volátil do café;17 na caracterização e estudo do aroma de cafés expressos oriundos de diferentes variedades botânicas e tipos de torra;11 e no estudo da contribuição da composição volátil para a atividade antioxidante do café.18 Em complemento, segundo uma revisão abrangente da literatura por Pua et al.,14 entre 2000-2021 apenas 32 trabalhos foram publicados sobre avaliação da composição volátil do café por SHS (12,6% dos trabalhos selecionados) contra 170 trabalhos utilizando microextração em fase sólida (SPME, do inglês, solid-phase microextraction), representando 66,9% das publicações. Sendo assim, apesar do SHS ser a segunda técnica de extração mais utilizada na literatura, ainda é pouco explorada quando comparada ao SPME. O SHS apresenta capacidade de capturar compostos de baixa massa molecular e altamente voláteis. Essa técnica de extração é capaz de fornecer uma amostragem representativa do headspace, sendo útil na análise direta do aroma do café em pó. Contudo, a principal desvantagem do SHS é a menor sensibilidade em comparação à outras técnicas, como o SPME, visto que o SHS não possui capacidade de pré-concentração dos analitos; de modo a limitar a capacidade de detecção de compostos menos voláteis.19,20 Apesar dessas limitações, Sanz et al.13 reportaram 122 compostos no café, sendo eles pertencentes as classes dos ácidos carboxílicos, álcoóis, aldeídos, cetonas, ésteres, fenóis, furanos, lactonas, oxazóis, pirazinas, piridinas, pirróis, tiazóis e tiofenos. Já Thammarat et al.15 reportaram 78 compostos divididos em 13 classes químicas. Em relação ao SPME, Caporaso et al.4 identificaram 50 compostos, Dong et al.21 reportaram 133 compostos divididos em 11 classes químicas e, por fim Zhang et al.22 identificaram 62 compostos. De maneira geral, analisando as principais publicações envolvendo SHS e SPME para análise de voláteis, percebe-se certa similaridade nos perfis qualitativos reportados nessas publicações, indicando aplicabilidade de ambas as técnicas na análise de cafés. No tratamento de dados cromatográficos comumente utiliza-se as áreas relativas dos picos nos modelos quimiométricos. No entanto, existem abordagens baseadas na análise direta dos cromatogramas onde é necessário que inicialmente sejam aplicadas ferramentas de correção. Os cromatogramas sofrem com desalinhamento dos tempos de retenção causado por variações instrumentais (temperatura, fluxo, etc.), mistura ineficiente da fase móvel, degradação da fase estacionária e interação entre analitos, afetando a qualidade dos modelos quimiométricos.23,24 Em vista disso, inúmeros métodos foram desenvolvidos para tal finalidade, como o alignDE,23 deformação otimizada de correlação (COW, correlation optimised warping),25 distorção de tempo paramétrica (PTW, parametric time warping),26 algoritmo de deslocamento otimizado de correlação de intervalo (icoshift, interval correlation optimised shifting algorithm),24 alinhamento de pico usando mapeamento de conjunto reduzido (PARS, peak alignment using reduced set mapping)27 entre outros. Dessa forma a escolha do método de alinhamento deve ser avaliada com cuidado, respeitando a matriz de estudo e as vantagens de cada método.28 Em especial, o icoshift vem sendo utilizado no alinhamento de espectros de ressonância magnética nuclear de cafés.29 Além disso, a aplicação do COW e icoshift em dados cromatográficos de café apresentam comportamentos próximos para os casos estudados, consolidando-se como os métodos mais utilizados para o alinhamento de picos.30 Contudo, para Tomasi et al.24 o icoshift demonstrou ser mais eficiente no pré-tratamento dos cromatogramas de amostras de óleos vegetais. Em resumo, o icoshift apresentou melhor desempenho que o COW em termos do tempo de processamento computacional significativamente menor e melhor qualidade no alinhamento dos picos. Diante disso, o presente estudo visa determinar o perfil químico de voláteis de cafés da espécie C. arabica e C. canephora var. conilon do estado do Espírito Santo, Brasil por meio da técnica SHS GC MS visando identificar os compostos que descrevem cada espécie por meio de uma abordagem quimiométrica. Além disso, visou-se comparar o uso das áreas relativas e dos cromatogramas alinhados pelo algoritmo icoshift, bem como o uso de seleção de variáveis por análise discriminante de Fisher.
PARTE EXPERIMENTAL Amostras No total, 30 amostras de C. arabica e C. canephora, oriundas de 10 regiões diferentes do estado do Espírito Santo, foram submetidas ao processamento natural e secas até os grãos atingirem 12% de umidade. As amostras utilizadas foram avaliadas como especiais, por análise sensorial, conforme protocolo SCA - Specialty Coffee Association.31 Após secos, foram removidos e descartados todos os grãos defeituosos segundo a metodologia COB - Classificação Oficial Brasileira.32 Para o C. arabica os grãos foram separados em peneiras 16 acima e para o C. canephora foram separados em peneiras 13 acima, para serem submetidos ao processo de torrefação conforme metodologia SCA - Specialty Coffee Association.31 As amostras de café foram torradas em um torrador modelo TP2 da marca Probat seguindo o monitoramento dos discos Agtron-SCA. Assim, o ponto de torra dessas amostras ficou entre as cores determinadas pelos discos # 65 e # 55 (torra média).31,33 Todas as amostras foram torradas entre 8 e 10 min, respeitando as características específicas da origem de cada espécie de café.31 Os grãos foram armazenados em embalagens laminadas de polietileno e depositados em ambiente com temperatura controlada de -5 °C. Preparo de amostras Os grãos de café torrados foram moídos na escala de granulometria # 25 do moedor Sette 30 (Baratza, EUA). Em seguida, procedeu-se a homogeneização e quarteamento do pó. Para extração dos voláteis, 3 g de café moído foram pesados e transferidos para um frasco de headspace de 20 mL, que foi selado com tampa metálica e septo de silicone. Os frascos foram aquecidos a 95 °C por 15 min no sistema autoamostrador AOC-5000 (Shimadzu, Japão). Análise dos compostos voláteis Utilizando uma seringa para headspace de 2,5 mL (Hamilton®, EUA), aquecida a 100 °C, 1 mL da fração volátil foi coletada e injetada no sistema GCMS-QP2010 Ultra (Shimadzu, Japão). Os compostos foram separados em colunas capilares de sílica fundida VB-WAX (30 m; 0,32 mm e 0,25 μm) e VB-5 (30 m; 0,32 mm e 0,25 μm), ambas da Valco Bond (Valco Instruments, EUA). O gás de arraste utilizado foi hélio, com uma vazão de 1,5 mL min-1. O injetor foi operado a 240 °C no modo splitless. A programação da coluna iniciou-se em 40 °C, com taxa de aquecimento de 4 °C min-1 até atingir a temperatura de 120 °C. Em seguida, a taxa de aquecimento foi aumentada para 10 °C min-1, até a temperatura de 230 °C, a qual foi mantida por 8 min. O espectrômetro de massas operou no modo de ionização por elétrons a 70 eV, com uma faixa de massas de m/z 35 300, intervalo de aquisição de 0,03 s e corte de solvente de 2,5 min. A identificação foi realizada pela comparação dos espectros de massas experimentais com os obtidos nas bibliotecas espectrais (NIST11 e WILEY7) e cálculo do índice de retenção linear (LRI). O cálculo do LRI foi determinado para cada pico de acordo com Van Den Dool e Kratz,34 no qual se utilizou o tempo de retenção de uma série de n-alcanos (C8-C40) na mesma programação de temperatura da coluna configuradas para as análise das amostras. Os resultados do LRI foram comparados com os valores disponíveis na literatura para colunas polares de polietilenoglicol (tipo wax), não-polares do tipo (5%-fenil)-95%-metilpolisiloxano ou fases estacionárias equivalentes (Tabela 1S, material suplementar). Os picos do cromatograma de íons totais (TIC) foram integrados e os resultados foram expressos em termos de abundância (%) de todos os compostos identificados, ou seja, em termos da área relativa. Essa abordagem semiquantitativa fornece informações sobre a quantidade relativa de um composto específico em relação aos outros compostos presentes na amostra, assumindo que todos os compostos possuem a mesma eficiência de ionização (fator de resposta igual a 1). Embora não forneça valores absolutos de concentração dos compostos, a informação disponível é uma aproximação da quantidade dos analitos que eluiram pela coluna, visto que a área de um pico é proporcional a massa eluida. Essa abordagem é amplamente aplicada em análises quimiométricas para a identificação de tendências, agrupamentos ou relações complexas entre as amostras, sendo útil na construção de modelos de classificação e na predição de parâmetros com base nos perfis cromatográficos. Análises quimiométricas Os cromatogramas originais foram organizados em uma matriz de formato X(30,71000) onde cada variável corresponde a intensidade em determinado tempo de retenção. Logo após, estes cromatogramas foram alinhados utilizando o algorítmo icoshift e pré-processados por variação normal padrão (SNV). A análise discriminante de Fisher foi utilizada como seleção de variáveis, de forma a encontrar as regiões dos cromatogramas pré-processados responsáveis por melhor separar as espécies. Além disso, utilizou-se as áreas relativas (abundância) dos picos integrados no TIC (total ion chromatogram), para os compostos individuais e classes químicas, as quais foram previamente autoescalonadas. O estudo dos padrões no conjunto de dados foi realizado por meio da análise de componentes principais (PCA) visando identificar os compostos responsáveis por distinguir as espécies botânicas abordadas. Para isso, os dados autoescalonados referente as áreas relativas dos compostos e os cromatogramas foram submetidos a PCA. As espécies foram avaliados por meio da estatística t de Student visando encontrar compostos ou classes químicas estatisticamente diferentes em termos das abundâncias dos compostos identificados. O coeficiente de correlação de Pearson foi empregado com finalidade de se determinar o grau e a direção de correlação dentro das classes e entre os compostos. O processamento e análise dos dados foram realizados no Matlab® versão R2013a (MathWorks, EUA),35 Excel® versão 2019 (Microsoft, EUA)36 e RStudio 2022.02.3 (RStudio, EUA).37
RESULTADOS E DISCUSSÃO Análise por SHS-GC-MS A Figura 1 representa um TIC típico para os cafés C. arabica e C. canephora var. conilon. Nota-se que o perfil cromatográfico apresenta características distintas entre as duas espécies. No total foram identificados 97 compostos distribuídos em 17 classes (Tabela 1S), compreendendo 16 pirazinas, 14 furanos, 12 cetonas, 10 ácidos carboxílicos, 9 pirróis, 8 furanonas, 6 ésteres, 5 álcoois, 4 fenóis, 3 piranonas, 3 piridinas, 2 anidridos, 1 pirimidina, 1 tiazól, 1 tiofeno, 1 tiol e 1 xantina.
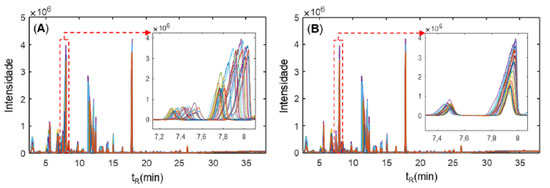
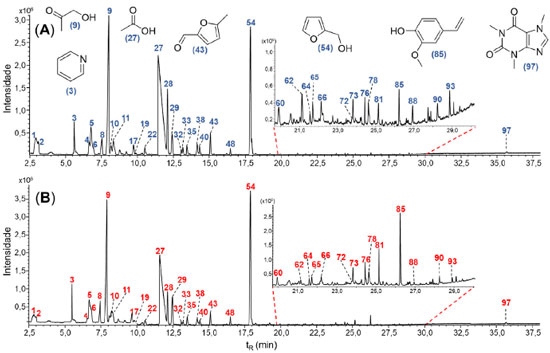 Figura 1. TIC típico para as espécies de cafés analisadas. (A) Coffea arabica e (B) Coffea canephora var. conilon. A ordem de eluição dos principais compostos estão marcados na figura e podem ser consultados na Tabela 1S (material suplementar)
Com base nos gráficos boxplot da distribuição das classes dos compostos voláteis, para os cafés C. arabica e C. canephora var. conilon (Figura 2), os ácidos carboxílicos, furanos e cetonas, são as classes mais abundantes, respondendo por 83,5% da fração volátil extraída. As demais 13 classes, mesmo estando em maior número, respondem ao todo por 16,5% da abundância total.
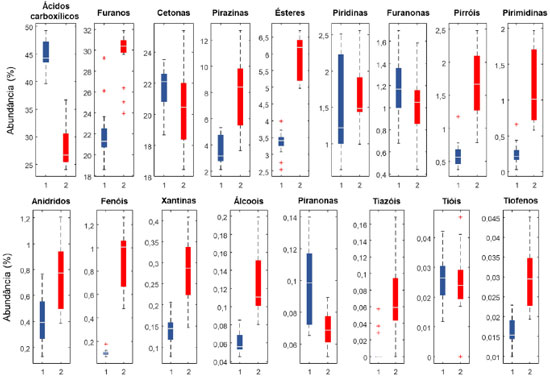 Figura 2. Gráfico boxplot da distribuição das classes dos compostos voláteis em ordem de abundância. As linhas horizontais indicam a mediana, as linhas tracejadas indicam os valores máximos e mínimos, e os sinais de "+" indicam possíveis outliers. 1: Coffea arabica e 2: Coffea canephora
Segundo os resultados da estatística t de Student, em um nível de confiança de 95%, a abundância relativa dos compostos da classe das cetonas, piridinas, furanonas e tióis são semelhantes, enquanto as demais classes se diferenciam estatisticamente. Em termos de compostos, 69 dos 97 identificados possuem abundâncias estatisticamente diferentes. As abundâncias relativas para os compostos individuais e os resultados do teste T encontram-se na Tabela 2S. Portanto, fica evidente a disparidade nos níveis de abundância dos compostos entre as espécies de cafés. No intuito de determinar os principais discriminantes do C. arabica e C. canephora var. conilon, a análise de componentes principais foi empregada de forma complementar a estatística t de Student, visando reduzir a dimensionalidade do conjunto de dados, possibilitando sua representação gráfica, identificação das características peculiares ao conjunto e o reconhecimento da contribuição das variáveis na separação. Está representado na Figura 3A o gráfico de scores das componentes principais 1 e 2, explicando 59,01 e 12,48% da variância do conjunto de dados, respectivamente. Nota-se que a discriminação das espécies ocorreu ao longo da componente 1 (PC1) com tendência de separação no sentido PC1 positivo para cafés C.canephora e PC1 negativo para o C. arabica.
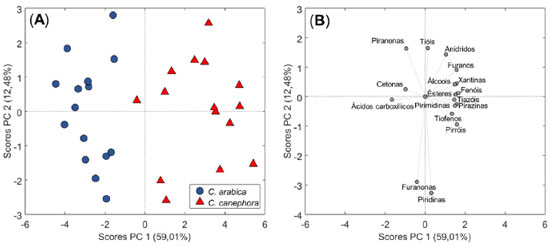 Figura 3. Gráfico de (A) scores e (B) loadings da PCA em termos da abundância relativa das classes de compostos
A Figura 3B expressa a contribuição de cada classe na separação dos cafés. As classes dos anidridos, furanos, álcoois, fenóis, xantinas, ésteres, tiazóis, pirazinas, pirimidinas, tiofenos e pirróis contribuíram para separação no sentido PC1 positivo, os quais são mais abundantes na espécie C. canephora (Figura 2). Um menor número de classes contribuiu para a separação do C. arabica, tais como os ácidos carboxílicos e cetonas. Os tióis, furanonas e piridinas apresentaram pouca contribuição no sentido de PC1, principalmente pelo fato de serem estatisticamente semelhantes entre as espécies. As classes com maiores capacidades de separação foram os ácidos carboxílicos e fenóis. Pela ótica dos compostos individuais, a Figura 1S(A) apresenta os scores das componentes PC1 e PC2, explicando 42,19 e 12,98% da variância do conjunto de dados, respectivamente. Nota-se de maneira análoga a separação com abundância de classes que a discriminação das espécies ocorreu ao longo da componente 1 (PC1), com tendência de separação no sentido PC1 positivo para cafés C. canephora e PC1 negativo para o C. arabica. Dentre a contribuição das variáveis, segundo a Figura 1S(B), 23 dos 97 compostos identificados contribuem para a separação do C. arabica. Entre eles estão 7 dos 10 ácidos carboxílicos identificados, em especial o ácido acético (composto de maior peso), além de cetonas, furanonas, piranonas, alguns furanos e anidridos de menor abundância. Para a separação do C. canephora a maioria dos compostos presentes na matriz de dados foram contribuintes em PC1 positivo, tais como a classe dos furanos, em especial o álcool furfurílico (composto de maior peso), conforme apresentado na separação por classes na Figura 2. Os 5 principais responsáveis pela separação das espécies foram o álcool furfurílico, ácido acético, 4-vinilguaiacol, N-acetil-4(H)-piridina e N-furfurilpirrol. Os demais compostos estão listados, em ordem de contribuição, na Tabela 3S. No intuito de verificar se os cromatogramas possuem mais informações do que as áreas relativas dos picos são capazes de explicar, procedeu-se a análise utilizando o cromatograma inteiro. Contudo, nota-se a necessidade de etapas de pré-tratamento para a correção de deslocamentos horizontais, Figura 4A. Assim, conforme Figura 4B em sua região ampliada, destaca-se o efeito do pré-tratamento dos cromatogramas para a correção dos desvios horizontais utilizando o algoritmo icoshift, antes da construção da PCA. Tal ferramenta foi inicialmente introduzida por Savorani et al.38 para o alinhamento de espectros de ressonância magnética nuclear. Contudo, também foi proposto posteriormente, pelos mesmos autores, para o alinhamento de dados cromatográficos.24 Segundo Hovell et al.39 a escolha do método de alinhamento foi um fator que influenciou na determinação dos picos discriminantes entre o C. arabica e o C. canephora var. robusta, avaliados com base na composição volátil obtida por destilação a vapor e extração simultâneas.
De acordo com os gráficos de scores da PCA, Figura 5A, nota-se que as componentes PC1 e PC3, explicando 58,4 e 7,7% da variância do conjunto de dados, respectivamente, são capazes de destacar a tendência de separação no sentido positivo de PC1 para cafés C. canephora e PC1 negativo para o C. arabica. De maneira análoga a separação por classes utilizando as áreas relativas dos picos, a primeira componente (PC1) é capaz de prover a separação das espécies e explicam valores próximos de variância (~ 58%). Em relação ao gráfico de loadings, Figura 5C, destaca-se a contribuição dos picos correspondentes a metilpirazina (tR = 6,81 min), álcool furfurílico (tR = 17,91 min) e 4-vinilguaiacol (tR = 26,23 min) para separação das amostras de C. canephora. Em contra partida, o pico da 1-hidroxi-2-propanona (tR = 7,98 min) e do ácido acético (tR = 11,46 min) contribuiram no sentido que separa a espécie C. arabica.
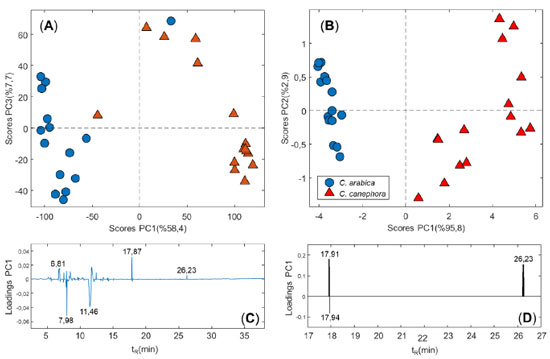 Figura 5. Gráfico de scores (A)-(B) e loadings (C)-(D) para os cromatogramas sem e com seleção por peso de Fisher, respectivamente
No intuito de melhorar a separação entre as duas espécies aplicou-se a análise discriminante de Fisher como seleção de variáveis, de modo a encontrar as regiões do cromatograma que maximizassem a separação entre as espécies e minimizassem a separação entre amostras de uma mesma espécie. Conforme observa-se na Figura 2S, nota-se que a análise selecionou regiões contendo os compostos álcool furfurílico (tR = 17,91 min), ácido 3-metil-butanóico (tR = 17,94 min) e 4-vinilguaiacol (tR = 26,23 min). De acordo com o gráfico de scores, Figura 5B, é possível notar uma melhor separação dos cafés C. arabica no sentido PC1 < 0 (2° e 3° quadrantes), enquanto que os cafés C. canephora situaram-se no sentido PC1 > 0 (1° e 4° quadrantes). Ademais, um aumento da variância explicada por PC1 (95,8%) foi percebido, visto que a seleção de variáveis resultou em regiões que permitem maximizar a separação entre as espécies. Em relação ao gráfico de loadings, Figura 5D, os picos do álcool furfurílico e 4-vinilguaiacol contribuíram para separação em PC1 > 0, enquanto que e o ácido 3-metil-butanóico contribuiu no sentido PCI < 0. Tal comportamento está em concordância com os resultados discutidos anteriormente na análise utilizando as áreas relativas dos picos. Ácidos carboxílicos Os resultados expostos na Figura 2 demostram que os ácidos carboxílicos foram mais abundantes na fração volátil de cafés da espécie C. arabica (44,9 ± 2,6%) (média ± desvio padrão), em comparação com a fração do C. canephora var. conilon (28,2 ± 3,6%). O principal ácido identificado para ambas as espécies foi o ácido acético, sendo que a maioria dos outros ácidos apresentaram área relativa inferior a 0,1%. É reportado que grãos torrados de C. arabica apresentam maior abundância de ácido acético quando comparado ao C. canephora.4 Os ácidos carboxílicos de baixa massa molecular presentes nos cafés são, em maioria, compostos responsáveis por atribuir acidez a bebida, um parâmetro sensorial importante para a apreciação do consumidor.40 Furanos Os furanos são compostos reconhecidos no aroma e sabor de bebidas e alimentos por promoverem atributos sensoriais positivos. Essa classe é uma das mais abundantes dentre a fração volátil do café e possui descritores sensoriais responsáveis pela sensação de caramelo, açúcar queimado, maltado e pão.40 Os resultados da análise por SHS-GC-MS expressam que a classe dos furanos é mais abundante nos cafés C. canephora var. conilon (29,6 ± 2,4%), em relação ao C. arabica (22,1 ± 2,7%). Apesar da maior expressão dessa classe, nem todos os compostos foram superiores para a espécie C. canephora. Segundo a literatura maiores abundâncias de álcool furfurílico são geralmente encontradas no C. arabica quando comparado com cafés C. canephora var. robusta,4 contudo essa mesma relação não foi observada em cafés da variedade conilon, uma vez que os resultados obtidos estão mais próximos do trabalho de Mondello et al.,10 onde a espécie C. canephora estudada apresentou maiores teores de furanos (álcool furfurílico, furfural e 5-metil-2-furanocarboxaldeído). Forte correlação de Pearson positiva (Figura 3S) é observada entre os compostos pertencentes a classe dos furanos. O furfural está correlacionado com 5-metil-2-furanocarboxaldeído (ρ = 0,845) e com 5-HMF (ρ = 0,793); o álcool furfurílico se correlaciona com N-furfurilpirrol (ρ = 0,916) e 1-furfuril-2-formilpirrol (ρ = 0,827); e o N-furfurilpirrol correlaciona-se com o 1-furfuril-2-formilpirrol (ρ = 0,846). A correlação entre as classes é, de certa forma, esperada justamente pelo fato destes compostos serem formados pelas mesmas reações. Cetonas As cetonas de baixa massa molar são compostos abundantes no café e estão presentes nas formas alifáticas ou cíclicas, porém, são perdidas ao longo do processo de armazenamento em temperatura ambiente.13,17 Sensorialmente, devido ao baixo limite de detecção olfatométrico, este grupo é responsável por grande parte da composição do aroma do café e traz notas de manteiga, creme e caramelo. Em especial, os principais contribuintes para essa classe são a 2,3-butanodiona e a 2,3-pentanodiona.40,41 Dentre os caminhos do segundo estágio da reação de Maillard, a conversão do 2,3-enediol leva a formação de intermediários α-dicarbonílicos, como 2,3-butanodiona, que podem posteriormente participar da degradação de Strecker.42 Dentre as atribuições por classe, as cetonas foram estatisticamente iguais (pvalue = 0,125), segundo a estatística t de Student, para ambas as espécies botânicas. O C. arabica apresentou maior abundância para o composto 1-hidroxi-2-propanona (16,5 ± 1,9%), em acordo com o reportado na literatura.4 Por outro lado, o C. canephora var. conilon obteve valores maiores para o composto 3-hidroxi-2-butanona (3,45 ± 0,17%), normalmente reportado como mais abundante em cafés da espécie C. arabica, assim como a 2,3-pentanodiona que, neste estudo, não apresentou diferença estatística entre as duas espécies (pvalue = 0,278).4,18,19 Pirazinas As pirazinas são compostos originados da torra de diversos alimentos. No café elas são abundantes e fornecem atributos sensoriais importantes, como nozes, avelã, frutado, floral, terra, torrado e amendoim.40,41 Essa classe contém compostos de impacto positivo significativo nos atributos sensoriais e representam grande parte dos potenciais odorizantes do café, podendo ser correlacionadas com alguns modelos de predição de atributos sensoriais, tais como amadeirado e nozes.4,43 As amostras de C. canephora var. conilon apresentaram abundância total de pirazinas 2,18 vezes superior à encontrada nos cafés C. arabica (7,9 ± 2,6% e 3,6 ± 1,2%, respectivamente). Nessa classe, 13 dos 16 compostos identificados foram estatisticamente mais abundantes no C. canephora. Essa observação está em concordância com a literatura, visto que os compostos 2-metilpirazina, 2,6-dimetilpirazina, 2,5-dimetilpirazina, etilpirazina e 2-etil-5 metilpirazina são mais abundantes no C. canephora.4,10 A correlação de Pearson (Figura 3S) foi examinada entre compostos pertencentes a classe das pirazinas. A 2,5-dimetilpirazina está positivamente correlacionada com 2,3-dimetilpirazina (ρ = 0,873), 2-etil-6-metilpirazina (ρ = 0,957), 2-etil-5-metilpirazina (ρ = 0,826), 2-etil-3,5-metilpirazina (ρ = 0,790) e 2-acetil-6-metilpirazina (ρ = 0,874). O composto 2,3-dimetilpirazina correlaciona-se com a 2-etil-6-metilpirazina (ρ = 0,884) e 2-etil-3,5 metilpirazina (ρ = 0,786). A 2-acetil-6-metilpirazina correlaciona-se com o composto 2-etil-6-metilpirazina (ρ = 0,847) e 2-etil-5 metilpirazina (ρ = 0,856). A forte correlação indica dependência entre os compostos voláteis que pode ser explicada pela origem comum dada por meio da reação de Maillard.4 Ésteres Os compostos voláteis derivados dos ésteres estão presentes em grãos crus e torrados contribuindo para a formação de notas sensoriais frutadas, apresentando grande influência na qualidade final do café. Os ésteres podem ser gerados pela reação de condensação entre ácidos graxos e álcoois.40 Ésteres são significativamente mais abundantes em cafés da espécie C. arabica quando comparado com C. canephora var. robusta.18,19 Contudo, nas amostras estudadas, maior abundância foi observada para o C. canephora var. conilon (5,93 ± 0,61%), em contraste com o C. arabica (3,34 ± 0,36%). Cinco dos seis ésteres identificados possuem abundância estatisticamente diferente entre as espécies. O principal éster foi o 1-(acetiloxi)-2-propanona, mais abundante no conilon, indo em contradição aos dados reportados para o café robusta.4,18,19 Este composto possui atributos positivos de frutado e amanteigado.40 Piridinas As piridinas representam características sensoriais de queimado, esfumaçado e nozes. Esta classe faz parte dos compostos heterocíclicos nitrogenados, onde estão incluídas as classes dos pirróis e pirazinas.40 Sua concentração aumenta regularmente à medida que o nível de torra se torna mais intenso, isto é, torras mais escuras resultam em maiores quantidades de piridinas.42,44 Apesar de estudos prévios relatarem que o C. canephora var. robusta apresenta maiores quantidades de piridinas em comparação ao C. arabica,18 o oposto foi observado por Sanz et al.,19 onde misturas contendo majoritariamente C. arabica apresentaram maiores quantidades de piridinas. No entanto, o perfil obtido nesse presente estudo demonstra que a abundancia da classe das piridinas não se diferencia estatisticamente entre as espécies estudadas (pvalue = 0,538). Furanonas Em relação a classe das furanonas, as espécies de cafés estudadas apresentaram abundâncias estatisticamente iguais (pvalue = 0,144). Os compostos desta classe são responsáveis pela formação dos atributos sensoriais doce, caramelo e amanteigado,40,45 os quais a 2,5-dimetil-4-hidroxi-3(2H)-furanona é considerada um potencial odorizante no café.46 O segundo composto mais abundante na classe das furanonas, o dihidro-2-metil-3(2H)-furanona, apresentou diferença significativa entre as espécies, sendo mais abundante no C. arabica (0,35 ± 0,26%) quando comparado ao C. canephora var. conilon (0,106 ± 0,071%), os quais estão em concordância com a literatura.18,19 Nenhuma correlação de Pearson expressiva foi observada entre os compostos desta classe. Pirróis A abundância total dos pirróis foi maior em cafés da espécie C. canephora var. conilon (1,36 ± 0,56%), em comparação com o C. arabica (0,60 ± 0,21%). Oito dos nove compostos identificados possuem abundâncias estatisticamente diferentes e superiores para o conilon, sendo o pirrol o composto majoritário para ambas as espécies. A relação entre os pirróis e furanos, observada por meio da correlação de Pearson (ρ = 0,747), é justificada, pois outro caminho para a formação dos pirróis é a reação de um furano (com uma carbonila na posição 2) com uma amina ou aminoácido.47 Segundo a literatura, as áreas relativas dos pirróis são significativamente superiores em misturas onde o café robusta é majoritário,19 sendo os compostos dessa classe apontados como potenciais discriminantes entre as espécies de cafés.39 Há uma boa correlação de Pearson entre alguns compostos derivados dos pirróis. O composto pirrol está positivamente correlacionado com o 2-metilpirrol (ρ = 0,880), 2-acetil-1-metilpirrol (ρ = 0,826), 2-acetilpirrol (ρ = 0,836) e indol (ρ = 0,812). Fenóis A classe dos fenóis foi a que apresentou maior diferença de abundância média entre as espécies, sendo a área relativa desta classe para o C. canephora var. conilon (0,91 ± 0,24%), 8,79 vezes superior à área do C. arabica (0,103 ± 0,025%). Em termos de compostos individuais, todos os fenóis identificados são mais abundantes na espécie C. canephora, sendo o 4-vinilguaiacol o composto majoritário para ambos os tipos de cafés. Os voláteis fenólicos podem ser utilizados como discriminantes entre espécies de café visto que cafés da espécie C. canephora apresentam quantidades superiores desses compostos quando comparado ao C. arabica.4,10,39 Alta correlação de Pearson (Figura 3S) foi obtida entre o 2-metoxifenol e os compostos: fenol (ρ = 0,927), 4-etilguaiacol (ρ = 0,971) e 4-vinilguaiacol (ρ = 0,907). A degradação do ácido 5-feruoilquinico origina os fenólicos voláteis devido a hidrólise, polimerização e oxidação desses ácidos. A formação do fenol, 2-metoxifenol e 4-vinilguaiacol está relacionada a degradação do ácido ferúlico (produto da degradação do ácido 5-feruoilquinico).4,48 Álcoois Os álcoois estão dentre os compostos presentes na composição volátil do café.9 Esses compostos são produtos da degradação oxidativa de lipídios, ou podem ser formados como resultado do metabolismo de culturas fermentativas que produzem álcoois de cadeias maiores.49,50 Todos os álcoois foram estatisticamente mais abundantes nos cafés da espécie C. canephora var. conilon. Piranonas Em relação a classe das piranonas, é reportado que a abundância do maltol (3-hidroxi-2-metilpiran-4-ona) é maior em amostras de C. arabica quando comparado com o C. canephora var. robusta,51 contudo os resultados obtidos mostraram que a abundância deste composto não se diferencia estatisticamente entre as espécies C. arabica e C. canephora var. conilon (0,0176 ± 0,006%) e (0,0174 ± 0,008%), respectivamente. Foi observado que apenas o composto 2,3-dihidro-5-hidroxi-6-metil-4H-piran-4-ona é significativamente diferente entre as espécies de cafés estudadas. Compostos sulfurados Os compostos sulfurados estão dentre os mais importantes para a composição sensorial do café.45 O tiazóis, tiofenos e tióis possuem notas sensoriais remetendo a frutas, nozes, verde, repolho e sulfuroso.40 A etapa de degradação de Strecker é fundamental para a formação dos atributos sensoriais do café, pois origina rotas de formação de compostos sulfurados e/ou nitrogenados. Caso o aminoácido seja sulfurado, como a cisteína, a degradação de Strecker pode levar a formação de compostos da classe dos tiazóis e tióis, bem como outros subprodutos, como o sulfeto de hidrogênio (H2S), gás amônia (NH3), acetaldeído e compostos carbonílicos. Estes produtos são reativos e podem preceder vários compostos voláteis através da reação entre si e/ou com outros produtos voláteis da reação de Maillard, como furanos e furanonas, resultando em derivados furânicos com substituintes sulfurados,42 como o 2-tiofenometanol. Das três classes de compostos, apenas o composto tiazol (4-metiltiazol) e o tiofeno (2-tiofenometanol) foram estatisticamente diferentes entre as duas espécies, os quais ambos foram superiores nas amostras de C. canephora var. conilon. Segundo reportado por Ludwig et al.,18 o 4-metiltiazol foi detectado apenas em amostras de C. canephora var. robusta. Este composto possui atributos sensoriais de frutado, nozes, verde e carne.40 O 2-tiofenometanol é reportado como mais abundante em amostras de C. arabica e possui propriedades de salgado e sulfuroso.40 Demais classes Os anidridos são produtos da desidratação de ácidos carboxílicos49 e alguns, tais como a 2,5-furanodiona (anidrido maleico), são sensíveis a armazenagem prolongada e atuam como marcadores de torras claras. Alguns anidridos possuem atributos sensoriais de queimado e bordo.40,52 Segundo a estatística t-Student, os anidridos são estatisticamente diferentes entre as duas espécies botânicas estudadas, e mais abundantes em amostras de C. canephora. Adicionalmente, a cafeína, ou 1,3,7-trimetilxantina, é um composto presente em várias bebidas como chás e cafés. Esse composto é termicamente estável, ou seja, não se degrada durante a torra e atua na contribuição do atributo amargor. Quando comparado as espécies, o C. canephora é a que apresenta maiores teores de cafeína.5,40 Os resultados obtidos por SHS-GC-MS indicaram que o C. canephora var. conilon apresenta em média o dobro de cafeína em relação ao C. arabica (0,282 ± 0,078% e 0,140 ± 0,032%, respectivamente). Uma correlação positiva foi observada entre as xantinas e os fenóis (ρ = 0,851), furanos (ρ = 0,802) e pirazinas (ρ = 0,797). Em resumo a todas as informações apresentadas a respeito das classes e compostos, a Tabela 1 resume os principais atributos sensoriais atribuidos a cada classe química.

Correlação entre as classes de compostos Em termos de classes, segundo a Figura 6, os furanos estão positivamente correlacionados com a classe dos álcoois (ρ = 0,803), ésteres (ρ = 0,858), fenóis (ρ = 0,861) e pirazinas (ρ = 0,802), ou seja, maiores teores de furanos significam maiores teores dessas classes. Os furanos apresentam uma correlação antagônica com a classe dos ácidos carboxílicos, ou seja, o aumento de furanos indica diminuição de ácidos carboxílicos.
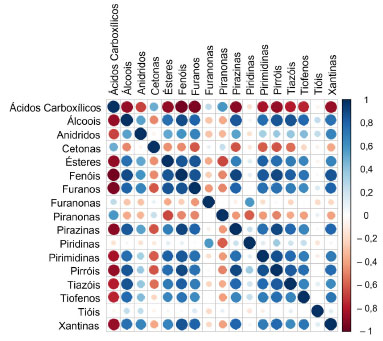 Figura 6. Gráfico de correlação de Pearson entre as classes de compostos
Os ácidos carboxílicos estão em forte antagonismo com praticamente todas as classes, e apresentam baixa correlação positiva com a classe das piranonas (ρ = 0,584) e cetonas (ρ = 0,493). Álcoois estão positivamente correlacionados com a classe dos pirróis (ρ = 0,858), pirazinas (ρ = 0,844) e tiazóis (ρ = 0,869). Fenóis se correlacionam com pirróis (ρ = 0,908) e ésteres (ρ = 0,855); e pirróis correlacionam-se com as pirazinas (ρ = 0,904) e pirimidinas (ρ = 0,807). As piridinas apresentam baixa correlação com quase todas as classes, enquanto que a cafeína apresenta boa correlação positiva com quase todas, com excessão dos ácidos carboxílicos. Dessa forma, com base nas amostras estudadas, fica evidente que cafés com maior abundância de ácidos carboxílicos tendem a apresentar menor teor das demais classes na fração volátil.
CONCLUSÕES A técnica SHS-GC-MS somada com a análise de componentes principais são ferramentas eficientes para a determinação do perfil químico volátil das espécies C. arabica e C. canephora var. conilon. Ao todo foram identificados 97 compostos, divididos em 17 classes químicas, sendo 69 deles estatisticamente diferentes entre as espécies em termos de abundância relativa, segundo a estatística t de Student. O conilon apresenta maior abundância de anidridos, furanos, álcoois, fenóis, xantinas, ésteres, tiazóis, pirazinas, pirimidinas, tiofenos, pirróis e piridinas, enquanto o arábica é mais abundante nas classes dos ácidos carboxílicos, cetonas, piranonas e furanonas. As principais classes discriminantes entre as espécies foram os ácidos carboxílicos, fenóis e furanos. Já os principais compostos foram o álcool furfurílico, ácido acético, 4-vinilguaiacol, N-acetil-4(H)-piridina e N-furfurilpirrol. Nos modelos utilizando regiões do cromatograma, obteve-se resultados comparáveis com os obtidos a partir das áreas relativas (abundância), sendo, portanto, essa uma abordagem alternativa ao processo de integração, minimizando as etapas de tratamento de dados. A seleção por discriminante de Fisher resultou em regiões contendo álcool furfurílico e o 4-vinilguaiacol, os quais foram descritos como os principais discriminantes entre as espécies C. arabica e C. canephora var. conilon.
MATERIAL SUPLEMENTAR Os gráficos de scores e loadings da PCA em termos da abundância dos compostos (Figura 1S), regiões selecionadas pela análise discriminante de Fisher (Figura 2S), gráfico de correlação de Pearson para os compostos (Figura 3S), tabela com os compostos identificados e seus respectivos índices de retenção linear (Tabela 1S), áreas relativas dos compostos e classes identificadas (Tabela 2S) e lista dos principais compostos responsáveis pela separação das espécies (Tabela 3S) estão disponíveis em http://quimicanova.sbq.org.br, na forma de arquivo PDF, com acesso livre.
AGRADECIMENTOS Os autores agradecem ao Coffee Design Group, LabPetro/UFES, LAPC/IFES-PRPPG No. 12/2021, ao Consórcio Pesquisa Café, a EMBRAPA Café (10.18.20.056.00.00 e 23068.068244/2019 29), CAPES, FAPES (989/2022 P: 2022-MGX0Z; 442/2021; 691/2022 P: 2022-2DRM4; 1036/2022 P: 2022-VZ8G9; 343/2023 P: 2023 6SJG7) e CNPq (308674/2019-7; 409700/2022-3; 305459/2020 1) pelo apoio e promoção desta pesquisa.
REFERÊNCIAS 1. International Coffee Organization (ICO), https://www.ico.org/pt/Market-Report-21-22-p.asp, acessado em Outubro 2023. 2. Empresa Brasileira de Pesquisa Agropecuária (EMBRAPA), https://www.embrapa.br/busca-de-noticias/-/noticia/73940564/producao-de-cafe-arabica-corresponde-a-64-e-cafe-conilon-a-36-da-safra-total-dos-cafes-do-brasil-em-2022, acessado em Outubro 2023. 3. Instituto Capixaba de Pesquisa Assistência Técnica e Extensão Rural (Incaper), https://incaper.es.gov.br/cafeicultura, acessado em Outubro 2023. 4. Caporaso, N.; Whitworth, M. B.; Cui, C.; Fisk, I. D.; Food Res. Int. 2018, 108, 628. [Crossref] 5. Preedy, V. R.; Coffee in Health and Disease, 1st ed.; Academic Press: London, 2014. 6. Pereira, L. L.; Moreli, A. P.; Moreira, T. R.; Caten, C. S. T.; Marcate, J. P. P.; Debona, D. G.; Guarçoni, R. C.; Agric. Sci. 2019, 10, 395. [Crossref] 7. Campuzano-Duque, L. F.; Herrera, J. C.; Ged, C.; Blair, M. W.; Agronomy 2021, 11, 2550. [Crossref] 8. Rubayiza, A. B.; Meurens, M.; J. Agric. Food Chem. 2005, 53, 4654. [Crossref] 9. Sunarharum, W. B.; Williams, D. J.; Smyth, H. E.; Food Res. Int. 2014, 62, 315. [Crossref] 10. Mondello, L.; Costa, R.; Tranchida, P. Q.; Dugo, P.; Presti, M. L.; Festa, S.; Fazio, A.; Dugo, G.; J. Sep. Sci. 2005, 28, 1101. [Crossref] 11. Maeztu, L.; Sanz, C.; Andueza, S.; de Peña, M. P.; Bello, J.; Cid, C.; J. Agric. Food Chem. 2001, 49, 5437. [Crossref] 12. Kolb, B.; Ettre, L. S.; Static Headspace-Gas Chromatography, 2nd ed.; Wiley: Hoboken, 2006. 13. Sanz, C.; Ansorena, D.; Bello, J.; Cid, C.; J. Agric. Food Chem. 2001, 49, 1364. [Crossref] 14. Pua, A.; Goh, R. M. V.; Huang, Y.; Tang, V. C. Y.; Ee, K. H.; Cornuz, M.; Liu, S. Q.; Lassabliere, B.; Yu, B.; Food Chem. 2022, 388, 132971. [Crossref] 15. Thammarat, P.; Kulsing, C.; Wongravee, K.; Leepipatpiboon, N.; Nhujak, T.; Molecules 2018, 23, 1910. [Crossref] 16. Sopelana, P.; Pérez-Martínez, M.; López-Galilea, I.; de Peña, M. P.; Cid, C.; Food Res. Int. 2013, 50, 682. [Crossref] 17. Bröhan, M.; Huybrighs, T.; Wouters, C.; Van der Bruggen, B.; Food Chem. 2009, 116, 480. [Crossref] 18. Ludwig, I. A.; Sánchez, L.; De Peña, M. P.; Cid, C.; Food Res. Int. 2014, 61, 67. [Crossref] 19. Sanz, C.; Maeztu, L.; Zapelena, M. J.; Bello, J.; Cid, C.; J. Sci. Food Agric. 2002, 82, 840. [Crossref] 20. Jelen, H. H. Em Handbook of Sample Preparation; Pawliszyn, J.; Lord, H. L., eds.; Wiley: Hoboken, 2011. 21. Dong, W.; Hu, R.; Long, Y.; Li, H.; Zhang, Y.; Zhu, K.; Food Chem. 2019, 272, 723. [Crossref] 22. Zhang, K.; Cheng, J.; Hong, Q.; Dong, W.; Chen, X.; Wu, G.; Zhang, Z.; LWT--Food Sci. Technol. 2022, 161, 113317. [Crossref] 23. Zhang, Z.; Chen, S.; Liang, Y.; Talanta 2011, 83, 1108. [Crossref] 24. Tomasi, G.; Savorani, F.; Engelsen, S. B.; J. Chromatogr. A 2011, 1218, 7832. [Crossref] 25. Nielsen, N. V.; Carstensen, J. M.; Smedsgaard, J.; J. Chromatogr. A 1998, 805, 17. [Crossref] 26. Eilers, P. H. C.; Anal. Chem. 2004, 76, 404. [Crossref] 27. Torgrip, R. J. O.; Aberg, M.; Karlberg, B.; Jacobsson, S. P.; J. Chemom. 2004, 17, 573. [Crossref] 28. Bloemberg, T. G.; Gerretzen, J.; Lunshof, A.; Wehrens, R.; Buydens, L. M. C.; Anal. Chim. Acta 2013, 781, 14. [Crossref] 29. Agnoletti, B. Z.; Gomes, W. S.; Oliveira, G. F.; Cunha, P. H.; Nascimento, M. H. C.; Cunha Neto, A.; Pereira, L. L.; Castro, E. V. R.; Oliveira, E. C. S.; Filgueiras, P. R.; Microchem. J. 2022, 182, 107966. [Crossref] 30. Kumar, K.; Anal. Methods 2018, 10, 190. [Crossref] 31. Specialty Coffee Association (SCA), https://sca.coffee/research/protocols-best-practices, acessado em Outubro 2023. 32. Ministério da Agricultura Pecuária e Abastastecimento; Instrução normativa No. 8, de 11 de junho de 2003; Regulamento Técnico de Identidade e de Qualidade para a Classificação do Café Beneficiado Grão Cru, Diário Oficial da União (DOU), Brasília, Brasil, 2003. [Link] acessado em Outubro 2023 33. Organização Internacional do Café, http://www.ico.org/documents/pscb-123-p-robusta.pdf, acessado em Outubro 2023. 34. Van Den Dool, H.; Kratz, P. D.; J. Chromatogr. A 1962, 11, 462. [Crossref] 35. Matlab®, version R2013a; The MathWorks Inc., Natick, MA, USA, 2013. 36. Excel®, v. 2019; Microsoft, Redmond, WA, USA, 2019. 37. RStudio, v. 2022.02.3; RStudio, Boston, MA, USA, 2022. 38. Savorani, F.; Tomasi, G.; Engelsen, S. B.; J. Magn. Reson. 2010, 202, 190. [Crossref] 39. Hovell, A. M. C.; Pereira, E. J.; Arruda, N. P.; Rezende, C. M.; Anal. Chim. Acta 2010, 678, 160. [Crossref] 40. Flament, I.; Coffee Flavor Chemistry, 1st ed.; Wiley: Chichester, 2001. 41. Amanpour, A.; Selli, S.; J. Food Process. Preserv. 2016, 40, 1116. [Crossref] 42. Mottram, D. S. Em Flavours and Fragrances; Berger, R. G., ed.; Springer: New York, 2007, cap. 12. 43. Bressanello, D.; Liberto, E.; Cordero, C.; Sgorbini, B.; Rubiolo, P.; Pellegrino, G.; Ruosi, M. R.; Bicchi, C.; J. Agric. Food Chem. 2018, 66, 7096. [Crossref] 44. Moon, J. K.; Shibamoto, T.; J. Agric. Food Chem. 2009, 57, 5823. [Crossref] 45. Czerny, M.; Mayer, F.; Grosch, W.; J. Agric. Food Chem. 1999, 47, 695. [Crossref] 46. Sanz, C.; Czerny, M.; Cid, C.; Schieberle, P.; Eur. Food Res. Technol. 2002, 214, 299. [Crossref] 47. Hwang, H. I.; Hartman, T. G.; Ho, C. T.; J. Agric. Food Chem. 1995, 43, 2917. [Crossref] 48. Dorfner, R.; Ferge, T.; Kettrup, A.; Zimmermann, R.; Yeretzian, C.; J. Agric. Food Chem. 2003, 51, 5768. [Crossref] 49. Moreira, R. F. A.; Trugo, L. C.; de Maria, C. A. B.; Quim. Nova 2000, 23, 195. [Crossref] 50. Pereira, G. V. M.; Carvalho Neto, D. P.; Magalhães Júnior, A. I.; Vásquez, Z. S.; Medeiros, A. B. P.; Vandenberghe, L. P. S.; Soccol, C. R.; Food Chem. 2019, 272, 441. [Crossref] 51. Ryan, D.; Shellie, R.; Tranchida, P.; Casilli, A.; Mondello, L.; Marriott, P.; J. Chromatogr. A 2004, 1054, 57. [Crossref] 52. Somporn, C.; Kamtuo, A.; Theerakulpisut, P.; Siriamornpun, S.; Int. J. Food Sci. Technol. 2011, 46, 2287. [Crossref] |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access