INTRODUÇÃO
O abacaxi (Ananas comosus L., Merr. var. comosus) é uma das frutas tropicais mais populares do mundo, e o Brasil é um dos principais países produtores.1 Está entre as quatro principais frutas tropicais produzidas mundialmente e sua comercialização vem se expandindo nos principais mercados nacionais e internacionais com perspectiva de crescer 1,9% ao ano, atingindo 31 milhões de toneladas em 2028.2,3
O abacaxizeiro é infectado por diversos patógenos que causam doenças, responsáveis por perdas significativas na produção.3-5 Entre as doenças principais, a fusariose causada pelo fungo Fusarium guttiforme é a mais destrutiva, podendo causar perdas médias de 30% nos frutos e de 15 a 20% nas mudas. Nessa doença ocorre o apodrecimento da polpa do fruto que fica sem valor comercial e impróprio para o consumo.4,6
A doença ocorre apenas na América do Sul, sendo uma doença de quarentena para vários países produtores de frutas onde o fungo ainda não foi relatado e, além de ser limitante para a produção de abacaxi, é uma ameaça à saúde humana, devido à produção da micotoxina beauvericina (BEA).4,6
As micotoxinas são um grupo estruturalmente diverso de compostos principalmente de baixo peso molecular. Suas estruturas variam de anéis heterocíclicos simples a anéis arranjados irregularmente e seus pesos moleculares são geralmente inferiores a 1000 Da. Portanto, eles não induzem nenhuma resposta no sistema imunológico humano.7 A ingestão desses compostos pode causar doenças crônicas, morbidade e morte e reduzir a resistência a patógenos. A maioria das micotoxinas é estável durante o processamento de alimentos, e estas são geralmente resistentes a mudanças químicas e térmicas. Podem chegar ao ser humano através de produtos de origem animal, no caso de os animais terem ingerido alimentos contaminados.8 O potencial tóxico de muitos desses compostos permanece pouco caracterizado, o que dificulta a estimativa de níveis seguros em alimentos para animais e humanos.9
A ingestão de alimentos contaminados com micotoxinas pode levar a efeitos adversos em animais e humanos relacionados à imunodeficiência ou câncer, bem como danos permanentes ao rim, intestino, sistema nervoso ou sistema imunológico.10
A beauvericina (BEA) (CAS 26048-05-5; PM 783.957; C45H57N3O9) é uma micotoxina emergente, quimicamente, é descrita como um hexadepsipeptídeo cíclico, que foi isolado pela primeira vez da cultura do fungo entomopatogênico de solo Beauveria bassiana.11,12 É sintetizada por várias espécies de Fusarium, parasitas de grãos de cereais importantes, como milho, trigo, arroz e cevada.12,13
Ainda não há uma resposta clara sobre se o consumo a longo prazo e em baixa dosagem pode causar danos aos seres humanos e à saúde animal.14
BEA causa citotoxicidade em várias linhagens celulares e é capaz de produzir estresse oxidativo molecular. É genotóxica (produz fragmentação de DNA, aberrações cromossômicas e micronúcleos) e causa apoptose com o envolvimento da via mitocondrial. A ação tóxica primária de BEA está relacionada às suas propriedades ionofóricas que perturbam o equilíbrio iônico fisiológico e o pH, formando estruturas diméricas transportando íons monovalentes através das membranas celulares.15
Um relatório recente publicado pela Autoridade Europeia para a Segurança dos Alimentos (EFSA) concluiu que, embora a exposição aguda à beauvericina não seja atualmente ainda considerada um risco significativo para a saúde humana, a falta de dados de toxicidade impossibilita a conclusão da ocorrência e do risco potencial causado pela sua exposição crônica.9,16
A beauvericina está atualmente sob investigação da Autoridade Europeia para a Segurança dos Alimentos visto que ainda não está regulamentada devido à falta de dados disponíveis da ocorrência e toxicidade.16,17
Devido à complexidade de suas estruturas químicas, as micotoxinas apresentam um grande desafio analítico. A análise é essencial para determinar a extensão da contaminação, para análise de riscos, confirmação do diagnóstico de micotoxicoses e para monitorar estratégias de mitigação de micotoxinas, bem como otimizar os sistemas de produção e armazenamento.18 A detecção frequente de micotoxinas é em parte resultado do desenvolvimento contínuo de métodos analíticos sensíveis com baixos limites de detecção (LODs).19,20 As micotoxinas em concentrações muito baixas, a coexistência de muitas micotoxinas na mesma matriz e as diferentes estruturas químicas dão origem a dificuldades adicionais na identificação por técnicas analíticas.21
As técnicas cromatográficas possuem bom desempenho na detecção e quantificação de micotoxinas. Destacam-se a cromatografia líquida de alta eficiência (CLAE ou HPLC - high performance liquid cromatography), acoplada a vários detectores como fluorescência, arranjo de diodos, UV, espectrometria de massas (MS) e espectrometria de massas no modo tandem (MS/MS), têm sido ferramentas poderosas para analisar e detectar as principais micotoxinas. Como desvantagens das técnicas de HPLC pode-se apontar que, o pré-tratamento da amostra pode ter protocolos de preparo que necessitem de tempo prolongado, muitas vezes é necessário um analista experiente para operar o equipamento, a instrumentação tem custo elevado, e pode ser necessário um tempo considerável para o processamento dos resultados.21 Apesar disso, HPLC continua sendo uma análise moderna das micotoxinas empregando vários adsorventes, dependendo da estrutura física e química da micotoxina.22
Além de HPLC, a técnica de MS é uma poderosa ferramenta analítica mais amplamente utilizada em áreas como análise farmacêutica, ambiental, alimentos e em ciências biológicas e médicas. A razão do sucesso da MS em todos esses campos é a sensibilidade fornecida pela técnica (podem ser detectadas quantidades extremamente baixas de, por exemplo, poluentes ou metabólitos), a seletividade (mesmo compostos com estruturas altamente semelhantes podem ser distinguidos) e os recursos de identificação (informação estrutural para confirmação de compostos conhecidos e identificação de novos compostos) da técnica.23 Dentro das fontes de ionização por MS, destaca-se a matrix-assisted laser desorption/ionization (MALDI), que tem como vantagem a simplicidade na preparação das amostras e é considerada ideal para análises simultâneas, rápidas e de alto rendimento, inclusive no estudo de misturas complexas. Além disso, em comparação com a fonte ESI, MALDI não é tão suscetível à supressão iônica, o que potencializa sua aplicação na análise direta dos produtos à base de plantas.24
O objetivo desse trabalho é aplicar uma metodologia de detecção da beauvericina em frutos de abacaxi, usando as técnicas de HPLC DAD e MALDI-FT-ICR MS (espectrometria de massas de ressonância ciclotrônica de íons por transformada de Fourier combinado com a fonte de matrix-assisted laser desorption/ionization), avaliar um substrato com potencial de crescimento do fungo e possibilitar a produção e detecção da micotoxina em diferentes isolados do fungo.
Como não existem ainda dados disponíveis, a demanda crescente para a certificação de alimentos seguros requer estudos de métodos de detecção, visto que a contaminação, ainda que não seja visível, é real e pode trazer riscos para a saúde. No caso do abacaxi, após evidenciada a importância da produção mundial, é necessário que seja estudada a presença da beauvericina e que esteja disponível uma metodologia precisa de detecção, visto que além de alimento para seres humanos, seus resíduos culturais servem de alimentação para animais, que além de serem contaminados podem ter contaminados os seus subprodutos.
METODOLOGIA
Foram analisados nove tratamentos ((i) padrão de beauvericina - BEA (diluído 1 mg mL-1); (ii) tecido de abacaxi inoculado com F. guttiforme, que representa a parte visivelmente lesionada do fruto; (iii) tecido de abacaxi inoculado com F. guttiforme + padrão BEA (diluído 1 mg mL-1); (iv) tecido de abacaxi sadio, que representa a parte visivelmente sadia do abacaxi inoculado com F. guttiforme; (v) tecido de abacaxi sadio + padrão BEA (diluído 1 mg mL-1); (vi) substrato arroz inoculado com F. guttiforme; (vii) substrato arroz inoculado com F. guttiforme + padrão BEA (diluído 1 mg mL 1); (viii) substrato arroz sem F. guttiforme; (ix) substrato arroz + padrão BEA (diluído 1 mg mL 1)), utilizando o delineamento experimental inteiramente casualizado com três repetições, analisadas separadamente, para cada tratamento.
Amostras com e sem micotoxinas foram usadas como material em branco para o estudo de validação das análises. Dois métodos analíticos (HPLC-DAD e MALDI FT-ICR MS) foram utilizados para detectar a presença de beauvericina nas amostras de abacaxi e substrato de arroz.
Fungo Fusarium guttiforme
Usou-se como referência o fungo Fusarium guttiforme (E514) pertencente ao Laboratório de Fitopatologia do Instituto Capixaba de Pesquisa, Assistência Técnica e Extensão Rural (INCAPER), que previamente havia sido identificado como portador do gene da beauvericina. O isolamento, a cultura monospórica e a caracterização morfológica foram realizados de acordo com o protocolo descrito para as espécies de Fusarium,13 sendo preservado em microtubos e armazenado a 4 °C no escuro. A cultura do isolado foi feita em placas de Petri contendo meio de cultura batata dextrose ágar (BDA), incubada a 28 °C, com fotoperíodo de 12 h, por um período de 7 dias. Destas culturas foi preparada uma suspensão de conídios que foram inoculados em frutos de abacaxi e em substrato de arroz.
Amostras de abacaxi
Foram usados neste trabalho frutos de abacaxi comercializados no mercado local, da cidade de Vila Velha, ES, Brasil. Os frutos foram inoculados com um isolado de F. guttiforme (E-514) e as amostras para as análises químicas, foram retiradas dos frutos após a inoculação. Foram obtidas para análise amostras do tecido lesionado (infectado pelo fungo) e da parte do fruto sem sintomas de infecção considerado tecido sadio.
As partes visivelmente lesionadas foram consideradas nos tratamentos como amostras inoculadas com F. guttiforme, enquanto as partes visivelmente sadias do fruto, para fins de análise, foram consideradas sadias, conforme descrito no detalhamento dos tratamentos.
Frutos de abacaxi da cv. Pérola, suscetível à fusariose, originalmente sadios, no estádio de maturação 2, ou seja, quando aproximadamente a metade do fruto estava com a casca amarela, foram inoculados com discos de 5 mm de diâmetro da cultura pura de F. guttiforme (E514), inseridos em seis orifícios de 5 mm de diâmetro previamente feitos nos frutos. Os frutos inoculados foram mantidos separados em câmara úmida por 14 dias para o desenvolvimento dos sintomas. Após esse período, foram coletadas amostras de tecido das regiões da polpa com a lesão (descrito nesse trabalho como abacaxi inoculado com F. guttiforme) e da parte sadia do fruto inoculado com F. guttiforme (descrito nesse trabalho como abacaxi sadio) (Figura 1). As amostras foram acondicionadas a -80 °C antes da extração para a análise no HPLC, Agilent Technologies 1260 Infinity (Palo Alto, CA, EUA).
 Figura 1.
Figura 1. (a) Frutos de abacaxi da cv. Pérola. (b) Corte longitudinal de fruto 14 dias após inoculação com F. guttiforme (E - 514), mostrando as lesões causadas pela infecção do fungo (fonte: autor)
Substrato de arroz
Como substrato para crescimento do fungo e detecção da micotoxina in vitro pelo isolado do fungo, foi utilizado arroz comercializado no supermercado no Brasil, para verificar a produção de BEA do fungo em cultura pura e na ausência do abacaxi.
Foi feita uma adaptação da metodologia descrita anteriormente,25-27 usando uma suspensão de 106 conídios mL-1 do fungo F. guttiforme repicado para erlenmeyers contendo arroz/água na proporção de 60 wt.% de água (75 g) para 50 g de arroz branco, com três repetições. Após 7 dias de crescimento em incubadora com fotoperíodo de 12 h, a 28 °C, as amostras foram acondicionadas a 8 °C, e em seguida, as culturas foram secas em temperatura ambiente (estufa de circulação a 28 °C) por 48 h. Após esse período, iniciou-se a extração para análise da micotoxina em HPLC.
Preparo das amostras para análise química
O preparo das amostras foi realizado usando como referência o trabalho de Stępień et al.27
Um sistema Mili-Q (Milipore®, Bedford, MA, EUA) foi usado para fornecer água para os experimentos. O padrão de massa certificado de beauvericina (> 97% HPLC) foi adquirido da Sigma-Aldrich (PCode 102284458; CAS 26048-05-5; PM 783,95 g mol-1).
Os demais reagentes utilizados; acetonitrila, clorofórmio, diclorometano, metanol, 2-propanol e heptano, foram adquiridos da Dinâmica Química Contemporânea Ltda. (Indaiatuba, SP, Brasil), todos com grau de pureza para HPLC.
Preparação de amostras de abacaxi e substrato de arroz
Das amostras de tecido dos frutos de abacaxi foi extraído o suco a fim de determinar o teor de micotoxinas in natura. Para o preparo do suco, a polpa da fruta madura, após o período de 14 dias de inoculação do fungo, de acordo com cada tratamento estabelecido, foi cortada em pedaços, acondicionada em tubos falcon de 50 mL e congelada a -80 °C; após esse processo foi descongelada, triturada em um gral de ágata com o auxílio de um pistilo, misturada até a obtenção de um suco e centrifugada a 11.000 × g, e 6 °C para a recuperação do suco límpido. Após a filtração, o suco foi usado para o protocolo de extração de micotoxinas, de acordo com a metodologia desenvolvida por Stępień et al.27
Foi utilizado 2 mL do suco preparado como descrito acima, que foi desengordurado duas vezes com 25 mL de heptano. A camada inferior foi evaporada em rotaevaporador a 60 °C até à secura e o resíduo resultante subsequentemente dissolvido em 50 mL de metanol:água (55:45, v/v %) e extraído duas vezes com 25 mL de diclorometano (CH2Cl2). A fase contendo diclorometano (contendo BEA) foi evaporada em rotaevaporador (SL-126, Solab) a 100 °C até à secura e purificada de acordo com o método descrito por Kostecki et al.25
O extrato evaporado contendo BEA foi dissolvido em 1mL de metanol, e 0,5 mL foi aplicado no topo de uma coluna contendo 2 g de sílica gel 60 (200 ± 400 mesh, Aldrich), ativada por 2 h a 110 °C. A coluna foi pré-condicionada com 5 mL de clorofórmio e 2-propanol (CHCl3:2-propanol), (95:5, v/v %). O extrato na coluna foi lavado com o mesmo solvente (3 mL, CHCl3:2-propanol, (95:5, v/v %)) e depois a BEA foi eluída com outra porção de 5 mL do mesmo solvente (CHCl3:2-propanol), (95:5, v/v %). A BEA foi detectada usando o equipamento HPLC, Agilent Technologies 1260 Infinity (Palo Alto, CA, EUA).
Para as amostras do substrato de arroz, usou-se 15 g de arroz previamente inoculado, que foi homogeneizado com 75 mL de acetonitrila:metanol:água (16:3:1, v/v/v %) e filtrado em papel de filtro Whatman nº 4. O filtrado foi desengordurado duas vezes com 25 mL de heptano. A camada inferior foi evaporada até à secura e o resíduo resultante subsequentemente dissolvido em 50 mL de metanol:água (55:45, v/v %) e extraído duas vezes com 25 mL de diclorometano. A fase CH2Cl2 (contendo BEA) foi evaporada até à secura e purificada de acordo com o método descrito por Kostecki et al.25
O extrato evaporado contendo BEA foi dissolvido em 1 mL de metanol, e 0,5 mL foi aplicado no topo de uma coluna contendo 2 g de sílica gel 60 (200 ± 400 mesh, Aldrich), ativada por 2 h a 110 °C. A coluna foi pré-condicionada com 5 mL de clorofórmio e 2-propanol (CHCl3:2-propanol), (95:5, v/v). O extrato na coluna foi lavado com o mesmo solvente (3 mL, CHCl3:2-propanol, (95:5, v/v)) e depois a BEA foi eluída com outra porção de 5 mL do mesmo solvente (CHCl3:2 propanol), (95:5, v/v). A BEA foi detectada usando o equipamento HPLC, Agilent Technologies 1260 Infinity (Palo Alto, CA, EUA).
Detecção da beauvericina
HPLC-DAD
Para a análise em HPLC-DAD, todas as amostras preparadas em propanol e clorofórmio, foram evaporadas em capela de exaustão por 5 h e após completa evaporação foram ressuspendidas em 50:50 v/v % de H2O:ACN (500 μL), para que as mesmas amostras pudessem ser analisadas posteriormente no MALDI-FT-ICR MS. O padrão de BEA foi diluído em água ultrapura e acetonitrila na mesma proporção 50:50.
As amostras a que foram adicionados o padrão de beauvericina (diluído 100 μL em 900 μL água/ACN = 1 mg mL-1), foram preparadas usando-se 200 μL da amostra para 20 μL do padrão diluído, com essas proporções, a concentração do padrão após adicionado às amostras foi de 0,1 mg mL-1.
Para a detecção da BEA, foi utilizada a metodologia descrita por Stępień et al.,27 usando-se um cromatógrafo HPLC, Agilent Technologies 1260 Infinity (Palo Alto, CA, EUA), que consiste de uma bomba utilizada no modo isocrático, um injetor automático e um detector de arranjo de diodos (DAD). O equipamento foi controlado pelo software Agilent Open LAB Chromatography Data System®. A separação cromatográfica foi realizada usando uma coluna Phenomenex Gemini C18 110 A (250 mm × 4.6 mm, 5 μm) com controle de temperatura (25 °C). As condições de HPLC para BEA incluíram uma taxa de fluxo constante de 1,0 mL min-1, acetonitrila:água (85:15, v/v %) que foi usada como fase móvel, volume de injeção foi 10 μL e comprimento de onda 205 nm.
MALDI(+)FT-ICR MS
As análises de MALDI-FT-ICR MS foram feitas em um espectrômetro de massas de alta resolução modelo 9.4 T Solarix, Bruker Daltonics (Bremen, Germany), equipado com um laser smartbeam II (355 nm), usando o modo positivo para detecção de íons, MALDI(+). Todos os espectros foram calibrados externamente usando uma solução de arginina (m/z 200-1500).
A técnica de MALDI(+)MS foi utilizada para detectar BEA nas amostras preparadas de arroz e abacaxi. Para isso, foram selecionadas todas as amostras dos nove tratamentos, resultando em um total de 25 análises por MALDI-FT-ICR MS.
Cerca de 2 μL de cada produto da extração foi individualmente depositado na placa MALDI, para posterior adição do reagente matricial ácido α-ciano-4-hidroxicinâmico (CHCA) na concentração de 10 mg mL-1 (H2O:MeOH) (1:1 v/v %) e 0,1% de ácido fórmico. Por fim, após a evaporação do solvente e cristalização da matriz, a placa MALDI foi digitalizada e inserida no analisador FT-ICR MS.
Os espectros de massas foram adquiridos no modo de ionização positivo, na faixa de massa entre m/z 200 e 1500, e os demais parâmetros experimentais foram: frequência do laser: 200 Hz; plate offset: -100,0 V; deflector plate: -210.0 V; laser shots: 100; foco do laser: small; scans: 16, e modo do laser: enable random walk. A intensidade do laser foi 30% no abacaxi sadio e no inoculado com F. guttiforme, e também no arroz sadio e inoculado com F. guttiforme.
Nas análises de MS, a precisão de massa28 foi determinada a partir do erro de massa representado pela equação (erro = ((Mmedido - Mteórico)/Mteórico) × 106), e o valor de double bond equivalent (DBE)29 calculado com a Equação (1):
onde, I representa átomos monovalentes, como o hidrogênio, cloro, bromo e iodo; III átomos trivalentes, por exemplo nitrogênio e fósforo; e IV representa os átomos tetravalentes, como o carbono, na fórmula molecular.
RESULTADOS E DISCUSSÃO
HPLC-DAD
As análises das amostras de abacaxi com o HPLC-DAD evidenciaram a detecção da beauvericina conforme demonstrado na Figura 2. No tempo de retenção de 6,1 min, as amostras dos diversos tratamentos contendo a BEA permitiram a detecção da micotoxina, e são descritos a seguir: padrão de BEA (representado pela cor azul, diluído a 1 mg mL-1), abacaxi inoculado com F. guttiforme (representado pela cor vermelha), tecido de abacaxi inoculado com F. guttiforme adicionado do padrão (representado pela cor verde, adição de padrão 0,1 mg mL-1), tecido sadio de abacaxi adicionado do padrão (representado pela cor preta, adição de padrão 0,1 mg mL-1). Na amostra do tecido de abacaxi sadio (parte sadia do fruto inoculado com F. guttiforme) (representado pela cor rosa) não se detectou a BEA (t = 6,1 min). A intensidade do pico da BEA no abacaxi inoculado com F. guttiforme (representado pela cor vermelha) mostrou-se mais intensa do que nas demais amostras, enquanto que as amostras de tecido dos frutos de abacaxi sadio e de abacaxi inoculado com F. guttiforme dopados com BEA (representados respectivamente pelas linhas preta e verde) mostraram áreas de absorção similares.
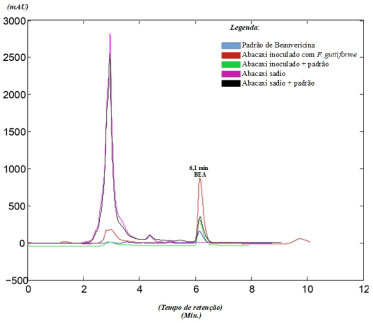 Figura 2.
Figura 2. Cromatogramas produzidos pela técnica de HPLC-DAD contendo: padrão de BEA (representado pela cor azul, diluído a 1 mg mL
-1), abacaxi inoculado com F. guttiforme (representado pela cor vermelha), abacaxi inoculado com F. guttiforme dopado com BEA (representado pela cor verde, adição de padrão 0,1 mg mL
-1), abacaxi sadio (representado pela cor rosa), abacaxi sadio dopado com o padrão de BEA (representado pela cor preta, adição de padrão 0,1 mg mL
-1)
Considerando os resultados obtidos pode-se concluir que os isolados de Fusarium guttiforme usados neste trabalho produziram beauvericina. Em estudo recente para avaliar genótipos e a produção de beauvericina e fumonisinas (outro tipo de micotoxina produzida por Fusarium), Fumero et al.30 concluíram que 75% das cepas de F. temperatum analisadas no experimento podiam produzir BEA, mas nenhuma das cepas de F. subglutinans teria a mesma característica.
Na Tabela 1 estão descritos os resultados das análises por HPLC DAD de todos os tratamentos de abacaxi e arroz. No tempo de retenção 6,1 min, com variação de até 0,05 min, onde é expresso o sinal da BEA, podemos verificar que houve a detecção da micotoxina nas amostras, ou seja, em todos os tratamentos onde houve a inoculação do F. guttiforme e nos tratamentos onde houve a adição de padrão. Nos tratamentos de amostras de tecido de abacaxi sadio e do substrato de arroz sem o fungo, no tempo de retenção 6,1 min (referente ao sinal da BEA) não houve detecção de pico, estando o valor ausente e sinalizado na tabela com "-".
MALDI(+)FT-ICR MS
As amostras de tecido de abacaxi e de substrato de arroz (sadios e inoculados com F. guttiforme), com e sem adição de padrão de BEA também foram analisadas pela técnica MALDI-FT-ICR MS. O modo positivo de ionização foi escolhido, MALDI(+), pois o padrão monitorado possui em sua estrutura química pares de elétrons disponíveis (bases de Lewis).
Abacaxi
A partir dos espectros de MALDI(+)MS adquiridos, foi observado que em todas as amostras analisadas o sinal correspondente à BEA (M = C45H57N3O9, PM = 783.9 Da) foi detectado na forma de íon sodiado ([C45H57N3O9+Na]+, m/z 806,39814, Figura 3a), DBE = 19 (devido ao seus três anéis aromáticos (DBE = 12), ligação C=O dos três grupos ésteres (DBE = 3), três grupos amidas (DBE = 3), e um anel central (DBE = 1)). Além disso, em todos os casos, erros de massas inferiores a 1 ppm foram observados, provando a altíssima resolução do analisador FT-ICR MS, Tabela 2.
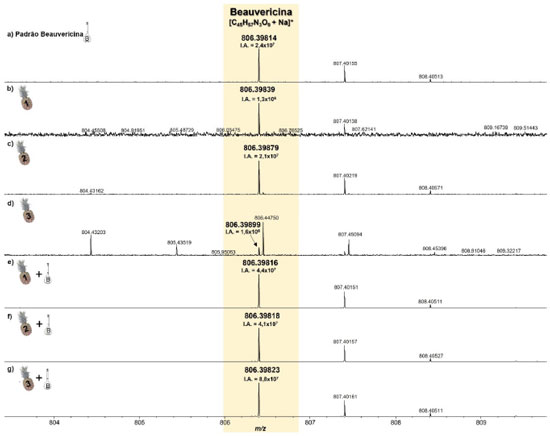 Figura 3.
Figura 3. Espectros de MALDI(+)MS do padrão da BEA (a), e das amostras do tecido de abacaxi inoculado com F. guttiforme sem padrão (b-d) e com o padrão de BEA (e-g) (fonte: autor)
Na Tabela 2 seguem as informações referentes à molécula estudada (BEA) - [C45H57N3O9+Na]+, bem como a relação massa/carga (m/z) medida, a intensidade absoluta (IA), a intensidade relativa (I%), a resolução de massas (Res), o erro de massas, medido em ppm, e o DBE. Nessa tabela podemos perceber que em todas as amostras, o sinal referente à molécula da beauvericina foi detectado, inclusive nas amostras não infectadas, ou seja, coletadas de partes visivelmente sadias do fruto inoculado.
Inicialmente, nas análises de abacaxi inoculado com F. guttiforme, Figuras 3b-3d, foi possível observar a variação da intensidade absoluta (IA) do sinal referente ao íon [BEA + Na]+ de 2,4 × 107 a 1,3 × 106, maior a menor intensidade entre as amostras infectadas, respectivamente. Após a adição de alíquotas do padrão de BEA, na concentração de 0,1 mg mL-1, houve um perceptível aumento na IA deste mesmo sinal, variando de 8,8 × 107 a 4,1 × 107, maior a menor valor entre as amostras contaminadas com a adição do padrão, respectivamente. Isso representa um aumento percentual de 3.183,9% (Figuras 3b e 3e), 91,7% (Figuras 3c e 3f), e 5.189,3% (Figuras 3d e 3g) dos valores de IA para essas amostras, confirmando que após a adição do padrão de BEA todas as amostras tiveram a intensidade absoluta aumentada.
De forma semelhante, nas análises de abacaxi sadio, isto é, região do abacaxi que não apresentava visualmente lesão causada pela fusariose é possível observar a manifestação do depsipeptídeo BEA. Ele também foi detectado como íon sodiado, [BEA + Na]+, Figuras 4b 4d, onde todos os erros de massa inferiores a 1 ppm, Tabela 2, e valores de IA variando de 2,4 × 107 a 4,3 × 105, respectivamente, foram observados. As amostras sadias nas quais adicionou-se alíquotas do padrão de BEA, na concentração de 0,1 mg mL-1, também apresentaram aumento na IA deste mesmo sinal, variando de 3,1 × 108 a 1,5 × 107, maior a menor valores entre as amostras com a parte sadia acrescidas do padrão, respectivamente. Isso representa um aumento percentual de 1019,2% (Figuras 4b e 4e), 3439,6% (Figuras 4c e 4f), 1,5% (Figuras 4d e 4g) dos valores de IA para essas amostras, indicando além do aumento da IA após a adição do padrão de BEA, a possível detecção de BEA nas partes não perceptíveis do fruto, asseverando a eficiência e sensibilidade da técnica de MALDI FT ICR MS. Logo, devido à sensibilidade do equipamento e sua altíssima exatidão de massas, mesmo as amostras das partes sadias do abacaxi, apresentaram o sinal correspondente à molécula da BEA.
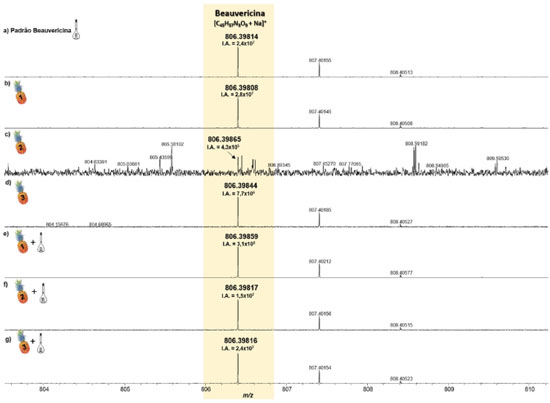 Figura 4.
Figura 4. Espectros de MALDI(+)-FT-ICR MS do padrão da BEA (a), e das amostras do tecido de abacaxi não inoculado com F. guttiforme (b-d) comparadas às dopadas com o padrão de BEA (e-g) (fonte: autor)
Arroz
A partir dos espectros de massas obtidos, foi observado que em todas as amostras analisadas o sinal correspondente à BEA (M = C45H57N3O9, PM = 783,9 Da) foi detectado na forma de íon sodiado ([C45H57N3O9+Na]+, m/z 806,39814, Figura 5a), DBE = 19, Tabela 3.
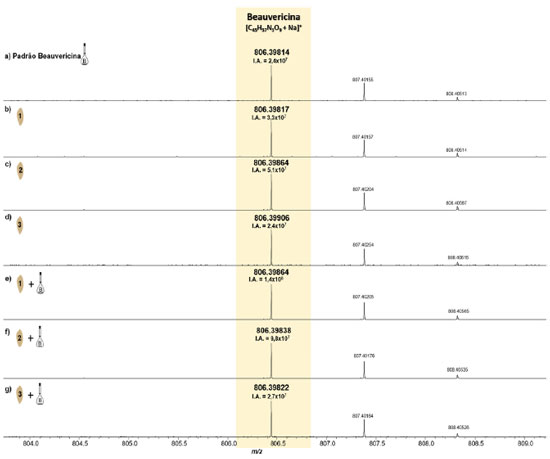 Figura 5.
Figura 5. Espectros de MALDI(+)-FT-ICR MS do padrão da BEA (a), das amostras do substrato de arroz inoculado com F. guttiforme (b-d) e inoculado com F. guttiforme e dopado com BEA (e-g) (fonte: autor)
Na Tabela 3 seguem as informações referentes à molécula estudada (BEA) - [C45H57N3O9+Na]+, bem como a relação massa/carga (m/z) medida, a intensidade absoluta (IA), a intensidade relativa (I%), à resolução de massas (Res), o erro de massas, medido em ppm, e o DBE. Nessa tabela podemos perceber que em todas as amostras o sinal referente à molécula da beauvericina foi detectado, inclusive nas amostras sem F. guttiforme.
Inicialmente nas análises das amostras do substrato de arroz inoculado com F. guttiforme, Figuras 5b-5d, foi possível observar a variação da intensidade absoluta (IA) do sinal referente ao íon [BEA + Na]+ de 5,1 × 107 a 2,4 × 107, respectivamente. Após a adição de alíquotas do padrão de BEA, na concentração de 0,1 mg mL-1, houve um perceptível aumento na IA deste mesmo sinal, variando de 1,4 × 108 a 2,7 × 107, entre as amostras contaminadas com a adição do padrão, respectivamente. Isso representa um aumento percentual de 337% (Figuras 5b e 5e), 94% (Figuras 5c e 5f), e 10,5% (Figuras 5d e 5g) dos valores de IA para essas amostras, confirmando que após a adição do padrão de BEA todas as amostras tiveram a intensidade absoluta aumentada.
Nas análises do substrato de arroz sem o fungo, também foi detectado o sinal correspondente ao composto monitorado na forma de íon sodiado, [BEA + Na]+, Figuras 6b-6d, onde todos com erros de massa inferiores a 2 ppm, Tabela 2, e valores de IA variando de 3,8 × 105 a 1,4 × 107, entre as amostras do substrato de arroz sem o fungo. As amostras do substrato de arroz sem o fungo que foram adicionadas alíquotas do padrão de BEA, na concentração de 0,1 mg mL-1, também apresentaram aumento na IA deste mesmo sinal, variando de 1,1 × 107 a 2,4 × 107.
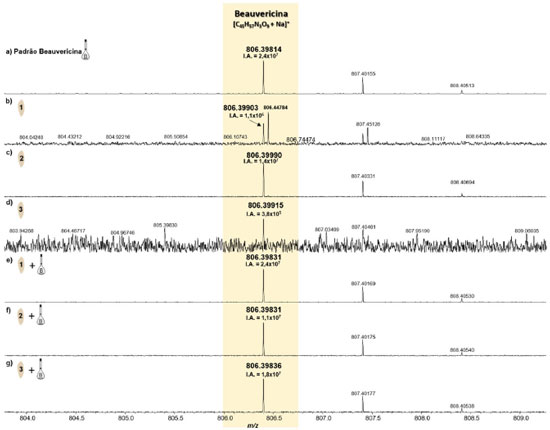 Figura 6.
Figura 6. Espectros de MALDI(+)-FT-ICR MS do padrão da BEA (a), e das amostras do substrato de arroz sem o fungo (b-d) e dopado com o padrão de BEA (e-g) (fonte: autor)
A Tabela 4 apresenta um comparativo entre os resultados obtidos nas análises de abacaxi e arroz por HPLC-DAD e por MALDI(+)FT-ICR MS. Nas análises por HPLC-DAD, das três amostras do abacaxi inoculado com F. guttiforme, em apenas uma amostra foi detectada a presença da BEA, enquanto nas três amostras do abacaxi inoculado com F. guttiforme + a adição do padrão BEA (adição de padrão 0,1 mg mL-1), em todas foram detectados os sinais referentes à BEA. Nas amostras de abacaxi não infectado com F. guttiforme (sadio), referente às partes visivelmente sadias do fruto previamente inoculado, em nenhuma das três amostras analisadas a micotoxina foi detectada, enquanto nas três amostras do tecido de abacaxi não infectado (sadia) dopadas com o padrão BEA (adição de padrão 0,1 mg mL-1), em todas houve a detecção de BEA.
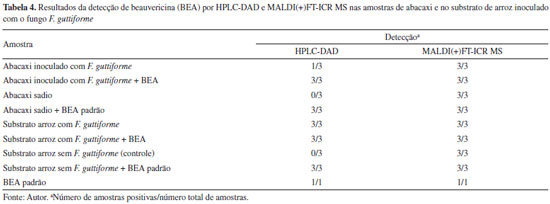
Nas análises das amostras do substrato de arroz por HPLC-DAD, das três amostras inoculadas com F. guttiforme e as três inoculadas com F. guttiforme + adição do padrão de BEA (adição de padrão 0,1 mg mL-1), em todas foi identificada a presença da micotoxina. No entanto, no substrato de arroz sem F. guttiforme (controle), em nenhuma das três amostras foi detectada a presença da micotoxina. Nas três amostras do substrato de arroz sem F. guttiforme dopadas com BEA (adição de padrão 0,1 mg mL-1) foi detectada a presença da micotoxina. Diferentemente do que foi observado por MALDI(+) MS, que apresentou detecção de BEA em todas as amostras de arroz e de abacaxi, inclusive nas amostras sadias. O padrão de BEA foi detectado tanto pelo HPLC-DAD como pelo MALDI(+)FT-ICR MS.
Os resultados mostraram que a detecção pelo HPLC-DAD foi satisfatória, mas com sua sensibilidade limitada para a detecção da micotoxina nas amostras sadias. Pelo método usado com o MALDI FT-ICR MS, foi detectada a presença da BEA em todas as amostras, inclusive nas amostras do tecido visivelmente sadio do fruto inoculado e de controle negativo do arroz, possivelmente pela sua alta sensibilidade de detecção (Tabela 4). No entanto, estes resultados nas amostras dos frutos infectados são sugestivos de que os frutos infectados não poderão ser usados para aproveitamento industrial ou consumo, mesmo retirando a parte lesionada. Com relação à detecção da micotoxina pelo método MALDI FT-ICR MS, nas amostras do substrato de arroz sem o fungo, ainda que com intensidades muito baixas, há o indicativo de que as amostras sem o fungo podem estar contaminadas pela BEA originalmente, ou seja, pode ter havido contaminação ainda na fase de produção ou armazenamento do grão, visto que essa micotoxina é sintetizada por outras espécies de Fusarium, parasitas de grãos de cereais importantes, como milho, trigo, arroz e cevada como referenciado neste trabalho, todavia estudos e testes complementares são necessários.
CONCLUSÕES
A espécie de referência Fusarium guttiforme (E514) utilizada na inoculação para a verificação da produção e detecção da BEA mostrou que produz a micotoxina beauvericina (BEA). Nas análises por HPLC-DAD e MALDI FT-ICR MS, pôde-se constatar que nas amostras de tecido colonizado naturalmente pelo fungo e nas amostras dopadas com BEA foi detectada a micotoxina. Entretanto, nos tecidos sadios dos frutos inoculados, onde não era visível nenhuma característica de colonização do fungo, apesar de por HPLC-DAD não ser detectada a presença da micotoxina em nenhuma amostra, quando as amostras foram analisadas por MALDI FT-ICR MS, houve a detecção da micotoxina, ou seja, mesmo se retirando a parte visivelmente lesionada, a parte aparentemente sadia pode estar contaminada, o que compromete o aproveitamento de frutos com fusariose, ainda que as lesões sejam em áreas específicas. A sensibilidade de MALDI FT-ICR MS foi mais apurada na detecção da micotoxina em amostras de tecido não infectado. Os resultados obtidos são relevantes na contribuição de dados referentes a detecção da micotoxina, para a criação de legislação sobre a regulamentação de limites da beauvericina. Conforme pode ser observado nos resultados, o arroz também é um substrato importante para o desenvolvimento de F. guttiforme e consequente produção de BEA, e pode estar sendo comercializado com a micotoxina. Por não haverem limites estabelecidos para a quantidade permitida e seus efeitos na saúde dos consumidores, torna-se necessário otimizar e padronizar a metodologia de detecção e quantificação, bem como a realização de testes de toxicidade para efeitos maléficos aos consumidores e animais.
AGRADECIMENTOS
Os autores agradecem à CAPES (código financeiro 001), à FAPES e ao CNPq pelo suporte financeiro. Os autores também gostariam de agradecer ao INCAPER, ao Núcleo de Competências em Química do Petróleo e ao Laboratório Multiusuário de Petroleômica e Forense/LabPetro pelo uso de suas instalações, e ao Centro Multiusuário para o Desenvolvimento Tecnológico e Inovação de Vila Velha, IFES. A todas as pessoas e instituições que direta ou indiretamente contribuíram para a elaboração desta publicação e que não foram mencionadas acima. A todos aqueles que contribuíram e compreenderam a importância da divulgação destas informações para a agricultura e agroindústria.
REFERÊNCIAS
1. Mello, B. L. B.: Avaliação Nutricional da Silagem dos Restos Culturais do Abacaxizeiro para Alimentação de Bovinos em Diferentes Planos Nutricionais; Tese de Doutorado, Universidade Estadual do Norte Fluminense Darcy Ribeiro, Campos dos Goytacazes, Rio de Janeiro, Brasil, 2016. [Link] acessado em de Novembro 2023
2. Food and Agriculture Organization of the United Nations (FAO); Medium Term Outlook: Prospects for Global Production and Trade in Bananas and Tropical Fuits 2019 to 2028, Rome, Italy, 2020. [Link] acessado em Novembro 2023
3. Galeano, E. A. V.; Ventura, J. A.; Caetano, L. C. S.; Arantes, S. D.; Vinagre, D. O. V. B.; Piassi, M.; Cadeia Produtiva do Abacaxi no Espírito Santo; Incaper: Vitória, 2022. [Crossref]
4. Ventura, J. A.; Zambolim, L. Em Controle de Doenças de Plantas Fruteiras; Zambolim, L.; do Vale, F. X. R.; Monteiro, A. J. A.; Costa, H., eds.; UFV: Viçosa, 2002, cap. 8.
5. Matos, A. P.; Junghans, D. T.; Andrade, E. C.; Meissner Filho, P. E. Em Impactos das Mudanças Climáticas sobre Doenças de Importantes Culturas no Brasil; Ghini, R.; Hamada, E.; Bettiol, W., eds.; Embrapa Meio Ambiente: Jaguariúna, 2011.
6. Barral, B.; Chillet, M.; Doizy, A.; Grassi, M.; Ragot, L.; Léchaudel, M.; Durand, N.; Rose, L. J.; Viljoen, A.; Schorr-Galindo, S.; Toxins 2020, 12, 339. [Crossref]
7. Křízová, L.; Dadáková, K.; Dvořáčková, M.; Kasparovský, T.; Toxins 2021, 13, 32. [Crossref]
8. Garcia, S. N. J.; Mier, L. G.; Trejo, J. F. G.; Gomez, X. S. R.; Gonzales, R. G. G.; Perez, A. A. F. Em Fusarium Mycotoxins and Metabolites that Modulate Their Production; Askun, T., ed.; IntechOpen: London, 2018, cap. 3. [Crossref]
9. Svingen, T.; Hansenn, N. L.; Taxvig, C.; Vinggaard, A. M.; Jensen, U.; Rasmussen, P. H.; Environ. Toxicol. 2016, 32, 1658. [Crossref]
10. Castell, A.; Arroyo-Manzanares, N.; Campillo, N.; Torres, C.; Fenoll, J.; Viñas, P.; Microchem. J. 2023, 185, 108192. [Crossref]
11. Tang, C. Y.; Chen, Y. W.; Jow, G. M.; Chou, C. J.; Jeng, C. J.; Chem. Res. Toxicol. 2005, 18, 825. [Crossref]
12. Albonico, M.; Schutz, L. F.; Caloni, F.; Cortinovis, C.; Spicer, L. J.; Toxicon 2017, 128, 38. [Crossref]
13. Leslie, J. F.; Summerell, B. A.; The Fusarium Laboratory Manual; Blackwell Publishing: Iowa, 2006.
14. Wu, Q.; Patocka, J.; Nepovimova, E.; Kuca, K.; Front. Pharmacol. 2018, 9, 1. [Crossref]
15. Mallebrera, B.; Prosperini, A.; Font, G.; Ruiz, M. R.; Food Chem. Toxicol. 2018, 111, 537. [Crossref]
16. EFSA Panel on Contaminants in the Food Chain; EFSA J. 2014, 12, 3802. [Crossref]
17. Hickert, S.; Gerding, J.; Ncube, E.; Hübner, F.; Flett, B.; Cramer, B.; Humpf, H. U.; Mycotoxin Res. 2015, 31, 109. [Crossref]
18. Nesic, K.; Ivanovic, S.; Nesic, V.; Rev. Environ. Contam. Toxicol. 2014, 228, 101. [Crossref]
19. Stanciu, O.; Juan, C.; Miere, D.; Loghin, F.; Mañes, J.; Toxins 2017, 9, 189. [Crossref]
20. Fraeyman, S.; Meyer, E.; Devreese, M.; Antonissen, G.; Demeyere, K.; Haesebrouck, F.; Croubels, S.; Food Chem. Toxicol. 2018, 121, 566. [Crossref]
21. Agriopoulou, S.; Stamatelopoulou, E.; Varzakas, T.; Foods 2020, 9, 518. [Crossref]
22. Rai, M. K.; Bonde, S. R.; Ingle, A. P.; Gade, A. K.; J. Pharm. Educ. Res. 2012, 3, 22. [Link] acessado em Novembro 2023
23. Bjarnholt, N.; Li, B.; D'alvise, J.; Janfelt, C.; Nat. Prod. Rep. 2014, 31, 818. [Crossref]
24. Hoffmann, E.; Stroobant, V.; Mass Spectrometry: Principles and Applications, 3rd ed.; John Wiley & Sons: London, 2007.
25. Kostecki, M.; Wiśniewska, H.; Perrone, G.; Ritieni, A.; Goliński, P.; Chełkowski, J.; Logrieco, A.; Food Addit. Contam. 1999, 16, 361. [Crossref]
26. Moretti, A.; Mulé, G.; Ritieni, A.; Láday, M.; Stubnya, V.; Hornok, L.; Logrieco, A.; Int. J. Food Microbiol. 2008, 127, 312. [Crossref]
27. Stępień, L.; Koczyk, G.; Waśkiewicz, A.; J. Appl. Genet. 2013, 54, 367. [Crossref]
28. Kill, J. B.: O que são Designer Drugs? Explorando a sua Composição Química por Espectrometria de Massas; Dissertação de Mestrado, Universidade Federal do Espírito Santo, Vitória, Brasil, 2016. [Link] acessado em Novembro 2023
29. Lecoeur, M.; Vérones, V.; Vaccher, C.; Bonte, J. P.; Lebegue, N.; Goossens, J. F.; Eur. J. Pharm. Sci. 2012, 45, 559. [Crossref]
30. Fumero, V.; Villani, A.; Susca, A.; Haidukowski, M.; Cimmarusti, M. T.; Toomajian, C.; Leslie, J. F.; Chulze, S. N.; Moretti, A.; Applied and Enviromental Microbiology 2020, 86, 1. [Crossref]