Educação
|
|
| As chalconas no ensino da química orgânica experimental no contexto da Química Verde Chalcones in teaching experimental organic chemistry in the context of Green Chemistry |
|
Mariana Falcão Lopes P. CarlosI; Aurea EchevarriaI,*
I. Instituto de Química, Universidade Federal Rural do Rio de Janeiro, 23890-000 Seropédica - RJ, Brasil Recebido em: 31/08/2023 *e-mail: echevarr@ufrrj.br The article presents the importance of practice in teaching Organic Chemistry in higher education, in addition to doing it following the methods of Green Chemistry, in view of how chemistry is seen as a "villain" due to dangerous reactions and incorrect waste disposal toxic. In this work, three chalcones with different substituents were synthesized: an electron donor (OCH3), an electron withdrawer (NO2) and the unsubstituted one, through 4 different methodologies, the first being the traditional methodology (methodology A) and the following methodologies ecofriendly alternatives. Methods B and C through maceration (without solvent), modifying only the support (BaO and Al2O3, respectively) and finally (methodology D) through microwave irradiation. Method C proved to be as efficient as the traditional one, with the advantage of being carried out without solvent and in a shorter reaction time and could be a replacement for the traditional method. INTRODUÇÃO Chalconas e sua importância Chalconas (1,3-diaril-2-propen-1-onas) são produtos naturais que pertencem a classe dos flavonoides e estão presentes em inúmeras espécies vegetais. São cetonas α,β-insaturadas, onde tanto o fragmento oriundo da carbonila quanto o fragmento olefínico estão ligados a anéis aromáticos e, na natureza estão, geralmente, substituídos por grupos hidroxila ou metoxila. A Figura 1 mostra a estrutura básica das chalconas que podem apresentar os isômeros trans e cis, sendo mais estável o isômero trans. As chalconas podem ser também sintéticas contendo grupos arila, tiofeno, bifenila ou piridina, entre outros. Diferentes grupos doadores ou aceptores de elétrons podem estar ligados aos anéis aromáticos em posições diversas, o que leva a mudanças nas propriedades químicas e físicas dessas moléculas.1
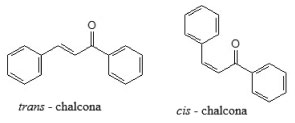 Figura 1. Estrutura básica das chalconas em suas formas isoméricas trans e cis
As primeiras estruturas chalcônicas foram sintetizadas em laboratório em meados de 1800, e seu isolamento de espécies vegetais ocorreu a partir de 1910. Essas estruturas estão presentes em várias plantas dicotiledôneas, algumas monocotiledôneas, pteridófitas e gimnospermas, mas são bio-sintetizadas como componentes principais nas famílias Asteraceae, Moraceae, Fabaceae e Aristolochiaceae.2 O potencial biológico desses compostos vem sendo explorado desde a década de 40, mas somente na década de 70 pesquisadores tiveram maior interesse pelo fato das chalconas terem demonstrado atividades antitumoral e antiparasitária.3 Por esse motivo, as chalconas sintéticas têm sido investigadas devido à flexibilidade e facilidade na sua obtenção. Dessa forma, muitas rotas sintéticas foram relatadas para a síntese dessas substâncias, sendo a mais clássica e geral a reação de condensação de Claisen-Schmidt em meio básico.4 Essa reação ocorre através da mistura de um aldeído e acetofenona em meio básico com agitação magnética em temperatura ambiente. Esse método é de fácil execução e possibilita a rápida obtenção da chalcona.5 Chalconas e seus derivados, naturais ou sintéticos, são substâncias de grande interesse químico-farmacológico e tem recebido atenção devido, sobretudo, a sua estrutura relativamente simples e a diversidade de atividades farmacológicas que apresentam, dentre as quais pode-se citar: atividade antioxidante, antinociceptiva, anticonvulsivante, anti-inflamatória e anti-Alzheimer (Figura 2).6-10
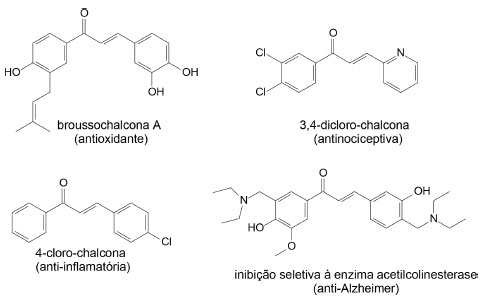 Figura 2. Estruturas de chalconas com atividade antioxidante, antinociceptiva, anti-inflamatória e anti-Alzheimer6-10
Além da importância biológica esses compostos também são utilizados em outras áreas da química, Chaouiki et al.11 estudaram a atividade anticorrosiva frente ao aço carbono em meio ácido de três derivados de chalconas que apresentaram alta eficiência (Figura 3).
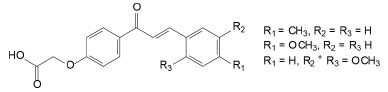 Figura 3. Estrutura molecular de chalconas com efeito anticorrosivo frente ao aço carbono em meio ácido11
O papel da Química Verde Atualmente, um dos grandes desafios dos químicos é suprir as necessidades da sociedade por novos produtos, mas, sem esquecer os aspectos ambientais. A química tem cumprido papel importante com a introdução de inúmeros produtos essenciais à humanidade. No entanto, considerando a melhoria da qualidade de vida atual e no futuro, a necessidade de novas metodologias mostra-se com extrema urgência.12 A Química Verde está fundamentada em 12 princípios: 1º prevenção; 2º economia de átomos; 3º reações com compostos de menor toxidez; 4º desenho de produtos seguros; 5º solventes e auxiliares mais seguros; 6º busca pela eficiência da energia; 7º uso de fontes renováveis de matéria-prima; 8º evitar a formação de derivados; 9º catálise; 10º desenho para a degradação; 11º análise em tempo real para a prevenção da poluição e 12º química intrinsicamente segura para a prevenção de acidentes.13 Assim, os conceitos da Química Verde envolvem a continuidade do desenvolvimento científico, tecnológico e social, diminuindo os danos causados ao meio ambiente, o que requer uma nova conduta química para o aprimoramento dos processos, com o objetivo fundamental da geração cada vez menor de resíduos e efluentes tóxicos, o não uso de solventes tóxicos, de matérias primas biodegradáveis, bem como da menor produção de gases indesejáveis ao meio ambiente.14,15 A importância da prática no ensino de química orgânica experimental O ensino tradicional da química orgânica é realizado de maneira que os alunos saibam inúmeras fórmulas, memorizem reações e propriedades, mas sem relacioná-las com a ocorrência das substâncias orgânicas presentes nas espécies naturais que existem em seu meio. Essa forma de ensino leva a um grande desinteresse e, isso se deve, principalmente, a falta de atividades experimentais que possam relacionar a teoria e a prática. Trabalhar com as substâncias orgânicas, aprender a observar um experimento cientificamente, visualizar de forma que cada aluno descreva o que observou durante a reação, isto sim leva a uma aprendizagem adequada e com maior interesse.16 Uma discussão muito apropriada sobre a função do trabalho experimental no ensino de ciências foi feita por Hodson, citado por Nyhof-Young17 que em seu artigo o autor chama atenção para três aspectos: (i) a proposta do experimento; (ii) o procedimento experimental; (iii) os resultados obtidos. Cada um desses aspectos apresenta determinada relevância. A proposta do experimento é importante no ensino e compreensão do método científico, já o procedimento experimental pode aumentar a motivação dos alunos e ensinar-lhes as tarefas manipulativas e, por fim, a discussão dos resultados contribui para a aprendizagem dos conceitos científicos.18 Existem algumas formas de organizar as aulas experimentais no ensino de química, um dos artifícios que pode ser utilizado é a elaboração de Planos Orientadores, nos quais a intenção é auxiliar os professores no desenvolvimento da atividade prática proposta. Esses planos são constituídos por um seguimento de atividades, as quais incluem verificação dos conceitos prévios, elaboração de hipóteses pelos estudantes, onde se apresenta a situação problema, propostas de questões para discussão em sala, entre outros, o que vai caracterizar a abordagem como investigativa.19 Para que o planejamento ocorra conforme proposto se faz necessário garantir algumas características, como por exemplo, o objetivo do experimento deve ser claro para que a atividade não se torne apenas uma atividade demonstrativa, ou seja, que faça o estudante propor soluções para problemas, raciocinar, argumentar e discutir/criticar os resultados obtidos. O que faz com que a aplicação da prática seja um espaço de diálogo, entre professor e estudante e entre os próprios estudantes, visando o aprofundamento dos conceitos de química orgânica de forma colaborativa.19 Um outro ponto a salientar é o uso de uma metodologia mais fundamental da pesquisa: o questionamento reconstrutivo, que se faz através do diálogo oral e escrito. Além do incentivo a discussão, o exercício da escrita também deve ser exercitado, pois dessa forma constrói-se a capacidade de argumentação. É preciso que os alunos sejam incentivados a construir um texto, de elaboração própria, o que pode ser feito através da escrita de relatório após uma aula experimental, por exemplo. Uma vez que esse processo de leitura e de escrita também favorece o desenvolvimento de outra característica essencial da pesquisa que é a socialização do argumento. Essas são algumas das vantagens onde o emprego da experimentação no ensino de química pode contribuir para o desenvolvimento do aluno, tanto profissional quanto pessoal.20 Aulas em laboratórios são fundamentais para uma aprendizagem significativa, onde os conceitos científicos poderão ser aplicados no cotidiano de cada aluno. As atividades experimentais permitem ao estudante uma compreensão de como a Química se constrói e se desenvolve, presencia a reação ao "vivo e a cores". Deve-se considerar que as atividades experimentais fazem parte de um processo global que supera a comprovação de teorias e pode favorecer ressignificações do mundo e uma postura crítica frente a sociedade.21 Dessa forma, as aulas experimentais podem ser empregadas com diversos objetivos e fornecer inúmeras e importantes contribuições no ensino e aprendizagem de ciências, destacando-se no âmbito da química. Podendo-se citar algumas das possíveis contribuições das atividades experimentais propostas nesse trabalho, para melhorar o ensino e aprendizagem de ciências, como: motivar e despertar a atenção dos alunos, desenvolver a capacidade de trabalhar em grupo, aprimorar a capacidade de observação e registro de informações; aprender a analisar dados e propor hipóteses para os fenômenos e aprender conceitos científicos.22 Em função dos cenários acima relatados e da importância do envolvimento com o desenvolvimento de experimentos e estratégias no âmbito da Química Verde para o ensino experimental de química orgânica na graduação ou ensino médio técnico, este trabalho tem como objetivo apresentar uma proposta com três metodologias alternativas da reação de Claisen-Schimdt para a obtenção de chalconas, compostos tão importantes em diferentes áreas da química, fundamentadas na Química Verde.
PARTE EXPERIMENTAL Materiais e equipamentos Os equipamentos utilizados foram: banho de ultrassom da marca Ultra Cleaner, 1400 A, estufa de aquecimento marca Qualicen, aparelho de ponto de fusão da marca Farma-Biovera PF 1500 e reator de micro-ondas marca CEM. Os reagentes e solventes utilizados foram todos de grau analítico e não foram purificados previamente: acetofenona, benzaldeído, 4-nitrobenzaldeído, 4-metóxibenzaldeído (todos da Sigma-Aldrich), hidróxido de sódio, óxido de bário, alumina, resina Amberlist (todos da Merck), etanol (95%, Neon) e água destilada. Procedimentos de síntese A síntese das chalconas foi realizada através de quatro diferentes procedimentos denominados metodologias A, B, C e D. Metodologia A (tradicional: condensação de Claisen-Schmidt)3 Em frasco de Erlenmeyer de 125 mL, adicionou-se 25 mL de solução aquosa de hidróxido de sódio a 10% (m/v), 15 mL de etanol e 0,05 mol de acetofenona. Resfriou-se a mistura em banho de gelo, sob agitação magnética e, foram adicionados 0,05 mol do aldeído correspondente. A temperatura do meio reacional foi mantida entre 25-30 °C por 2 h, com agitação magnética constante. Deixou-se a mistura na geladeira por 24 h e os cristais foram coletados em funil de Buchner. Após a filtração os cristais foram lavados com água destilada gelada até a neutralização e deixou-se secar a temperatura ambiente. Metodologia B (maceração usando BaO como catalisador) Colocou-se em cápsula de porcelana 0,08 mol de óxido de bário, em estufa por 2 h, para ativá-lo e então proceder à síntese. Em um almofariz foram adicionados 0,04 mol de acetofenona, 0,04 mol do aldeído e 0,08 mol de óxido de bário (ativado), com auxílio de um pistilo a mistura de sólidos foi macerada por 30 min. Foi observada mudança de coloração da mistura que indicava o progresso da reação. Logo após, adicionou-se água destilada gelada, e gotas de HCl concentrado para neutralizar o meio reacional. Filtrou-se o sólido resultante a vácuo e, lavou-se com água destilada gelada. Metodologia C (maceração usando Al2O3 como catalisador)23 Colocou-se em cápsula de porcelana 0,08 mol de óxido de alumínio, em estufa por 2 h, para ativá-lo e então proceder à síntese. Em um almofariz adicionou-se 0,04 mol de acetofenona, 0,04 mol do aldeído e 0,08 mol de óxido de alumínio, com auxílio de um pistilo macerou-se por 30 min. Foi observada mudança de coloração da mistura que indicava o progresso da reação. Após finalização da reação, foi adicionada água destilada gelada e, neutralizou-se com gotas de HCl concentrado. Filtrou-se o sólido resultante a vácuo, que foi lavado com água destilada gelada. Metodologia D (irradiação por micro-ondas)24 Em balão de fundo redondo de 25 mL foram adicionados 0,02 mol de acetofenona, 0,02 mol do aldeído, 4 gotas de NaOH (10% m/v) e 15 mL de etanol. A mistura foi colocada no reator de micro-ondas por 15 min, em refluxo. Posteriormente, verteu-se o conteúdo da reação para um béquer e colocou-se na geladeira para precipitação. Filtrou-se o precipitado a vácuo que foi lavado com água destilada gelada até a neutralização. Purificação As chalconas obtidas através de todas as metodologias foram purificadas por recristalização em etanol a quente (cerca de 5 mL para cada grama de produto), os cristais obtidos foram filtrados a vácuo e secos em estufa. Após a secagem pesou-se para calcular os rendimentos e determinar os pontos de fusão.
RESULTADOS E DISCUSSÃO Esse trabalho visa um estudo de caso experimental, que poderá ser aplicado a alunos tanto de graduação quanto do ensino médio técnico. Um dos objetivos a alcançar é trabalhar a diversificação de reações, mostrando aos alunos que é possível obter o mesmo produto de interesse de diferentes formas e aplicar isso dentro do contexto da Química Verde. Dessa forma, foram sintetizadas três chalconas considerando-se a diferença na natureza eletrônica dos substituintes: uma chalcona não-substituída (H-CHAL), uma que apresenta um grupo retirador de elétrons, a 4-nitrochalcona (NO2-CHAL) e uma chalcona com um grupo doador de elétrons, a 4-metóxichalcona (OCH3-CHAL). Os grupos substituintes foram utilizados para diferenciar a reatividade na formação desses produtos. Para o estudo da síntese das chalconas foram utilizadas quatro metodologias (A-D) descritas anteriormente na parte experimental, sendo que primeiramente realizou-se o método clássico para obtenção de chalconas, a metodologia de Claisen-Schimdt,3 levando em consideração que o aluno já possui uma base teórica do estudo de reações orgânicas com compostos carbonílicos. Mas, mesmo assim, é importante, antes do início do procedimento prático, realizar uma revisão do conceito de reação de condensação aldólica para que os alunos relembrem esse conteúdo, entendendo melhor o processo. A metodologia A foi a metodologia base para comparação com as demais. Assim, os alunos terão alguns parâmetros para compararem com as outras metodologias. Primeiramente, será realizada a comparação do tempo de reação, do rendimento bruto, e, posteriormente será realizada a purificação dos produtos, calculados os rendimentos dos produtos purificados e, determinados os pontos de fusão. As chalconas assim obtidas não são inéditas e os pontos de fusão foram comparados com os relatados na literatura, a Figura 4 mostra a reação geral realizada com as metodologias A-D.
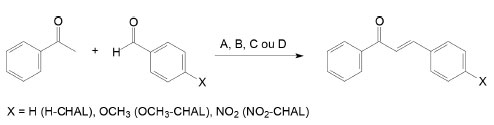 Figura 4. Reação geral utilizada para a preparação das chalconas. Metodologia A: tradicional refluxo térmico; metodologia B: maceração com BaO; metodologia C: maceração como Al2O3; metodologia D: irradiação por micro-ondas
Na metodologia tradicional3 (metodologia A) a reação ocorreu através da condensação de Claisen-Schmidt em meio básico, utilizando etanol como solvente a temperatura ambiente. Utilizando se essa metodologia obtiveram-se os produtos desejados com rendimentos satisfatórios, como pode ser visto na Tabela 1, após 90 min de reação, sendo necessário deixar a solução em geladeira por 24 h, após a neutralização do meio da reação, para melhor precipitação do produto. Importante ressaltar que nessa metodologia não existe a necessidade de nenhum procedimento prévio, portanto sugere-se que essa seja a primeira de 3 aulas experimentais.
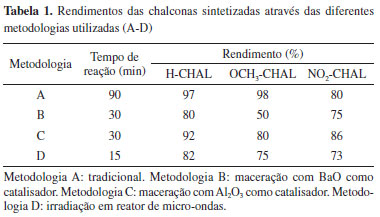
Na aula experimental seguinte podem ser realizadas as reações via mecanoquímica (maceração), correspondendo às metodologias B e C. Nessas reações foram utilizados dois suportes distintos (óxido de bário e alumina) e os processos ocorreram na ausência de solvente orgânico, sendo realizadas em 30 min. Importante destacar, que nessas metodologias tanto o óxido de bário quanto o óxido de alumínio precisaram ser previamente secos em estufa de aquecimento, por um período de 2 h, com o intuito de ativá-los e dessa forma auxiliar na evolução da reação, portanto essa parte deverá ser realizada anteriormente, ou seja, os alunos deverão ter acesso aos suportes já ativados. Na metodologia B foi possível a obtenção dos produtos de interesse de forma satisfatória e com bons rendimentos, na faixa de 50-80%. Já ao utilizar a alumina (metodologia C) obtiveram-se os melhores resultados, com a formação dos produtos desejados em altos rendimentos, na faixa de 80-92% (ver Tabela 1). É importante destacar que o uso da alumina como suporte foi baseado na literatura com modificações, pois os autores utilizam metanol como solvente e o óxido de alumínio ligado ao fluoreto de potássio (KF-Al2O3) como catalisador, além de KOH, e irradiação em banho de ultrassom.25 Essas metodologias devem ser trabalhadas juntas, na mesma aula, como a duração da reação é de 30 min os alunos podem ser agrupados, onde cada grupo realizaria uma das metodologias e, depois realiza se a comparação de resultados. Frente a metodologia A essas duas apresentam as vantagens de possuírem um menor tempo de reação, com uma redução de 60 min, e a não necessidade da utilização de solvente orgânico para sua realização, e nem a utilização de energia elétrica, sendo utilizada a força física para poder promover a interação entre os reagentes. Outro ponto importante é que a pessoa que está macerando consegue observar visualmente a mudança no sistema reacional, observando a formação de precipitado ou a mudança de coloração (dependendo do substituinte a coloração muda) e vendo a reação acontecer, diferentemente da metodologia A. Porém, um ponto importante para ressaltar com os alunos é a diferença dos suportes usados, deve-se informar que os compostos de bário são menos desejáveis que os de alumínio, devido a maior toxicidade dos primeiros. Outro fator importante é que como essa reação não faz uso de solvente orgânico ela está mais adequada aos princípios da Química Verde do que a primeira metodologia, ou seja, já é gerado menos resíduo que a anterior. Para separação dos produtos dos suportes, adicionou-se água gelada para sua solubilização. Utilizando-se a quarta e última metodologia (D), sugere-se que seja realizada em uma terceira aula. A reação foi realizada em etanol como solvente e com adição de gotas da solução de NaOH (10%), assim como na metodologia A, essa também faz uso de solvente e de uma fonte de energia, nesse caso, a irradiação por micro-ondas em reator científico. O tempo de reação foi de 15 min, o menor tempo dentre as metodologias estudadas e os rendimentos foram na faixa de 73-80% (Tabela 1). Apesar de apresentar o menor tempo, essa metodologia fez utilização de solvente, consistindo em ponto desfavorável frente as metodologias B e C, mas tem a vantagem frente a metodologia tradicional pois o tempo de reação foi bem menor. Uma das formas possíveis de caracterização da formação do produto de interesse é a determinação do ponto de fusão (PF), como se trata de substâncias já conhecidas, comentado anteriormente, essa foi uma forma mais prática de realizar a identificação, além de ser um método acessível dentro dos laboratórios de aulas experimentais. Sugere-se que os alunos pesquisem previamente na literatura o valor do PF de cada uma das substâncias para comparação com os obtidos na prática. A Tabela 2 mostra os pontos de fusão e a aparência das chalconas sintetizadas.
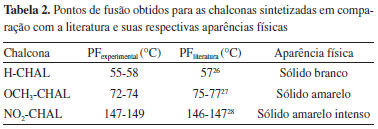
Existem outras formas de identificação de substâncias orgânicas, mas levando em consideração que esse trabalho é uma proposta para alunos de início ou meio de curso de graduação ou técnico, metodologias mais robustas e sofisticadas como ressonância magnética nuclear ou infravermelho não seriam aplicadas neste caso, pois seria necessário um conhecimento mais aprofundado, provavelmente, ainda não adquirido. A obtenção das chalconas através das 3 diferentes metodologias em comparação com a metodologia tradicional, embora apresentando melhores rendimentos, mostrou-se adequada com diferentes eficiências. A natureza dos substituintes não afetou de maneira similar as diferentes metodologias, sendo que na metodologia tradicional podemos observar o menor rendimento quando presente o grupo nitro que, como retirador de elétrons favorece o ataque do íon hidróxido na primeira etapa, mas desfavorece a etapa de eliminação da água na segunda etapa. No entanto, é importante destacar que as 3 metodologias se encontram no contexto da Química Verde pois, são utilizados suportes que poderiam ser recuperados e ausência de solvente orgânico (metodologias B e C); o uso de energia alternativa como a irradiação de micro-ondas (metodologia D) que diminui o tempo de reação quando comparado com a metodologia tradicional. A importância de se ter um método eco amigável se dá devido a necessidade de uma atenção especial dos futuros profissionais da química com relação as consequências que os procedimentos na indústria química podem ter sobre a saúde humana e animal e, sobre o meio ambiente. Controlar e remediar os poluentes não é mais suficiente: deve-se direcionar os esforços no sentido de reduzir e, principalmente, prevenir o descarte de substâncias nocivas ao ambiente. No âmbito do ensino da química orgânica essa preocupação se torna ainda mais necessária, uma vez que na formação de novos profissionais já deve-se enraizar o comportamento e os princípios da Química Verde.
CONCLUSÃO Com esse trabalho pode-se concluir a importância da prática no ensino de química orgânica, seja em qualquer âmbito, mas principalmente no ensino de graduação ou médio-técnico, o qual formará profissionais da área. Para que haja melhor relação entre o ensino e o aprendizado do aluno, a prática faz com que a teoria seja melhor entendida e possa ser relacionada com os processos da indústria e da natureza. Com isso os experimentos realizados seguiram os princípios da Química Verde, especialmente os princípios; 5º (solventes e auxiliares mais seguros) e 6º (busca pela eficiência da energia), onde a ausência do uso de solventes, uso de energia alternativa como micro-ondas e o menor tempo de reação foram fatores que se destacaram nos resultados. Em comparação com a metodologia tradicional o estudo dessas metodologias alternativas se mostrou satisfatório, sendo a metodologia da maceração utilizando a alumina como suporte (metodologia C), a que apresentou uma maior eficiência (86-92%) para a síntese das chalconas. Além da não utilização de solvente para realizar a síntese, o tempo de reação foi reduzido, se comparado a metodologia tradicional, realizando-se, assim, uma reação com menor impacto ambiental. Por fim, a necessidade de se estudar métodos ambientalmente corretos mostra a importância desse trabalho.
AGRADECIMENTOS As autoras agradecem ao Programa de Bolsas de Iniciação Científica do Conselho Nacional de Desenvolvimento Científico e Tecnológico (PIBIC-CNPq) e a Universidade Federal Rural do Rio de Janeiro (UFRRJ) pelas bolsas concedidas e apoio financeiro.
REFERÊNCIAS 1. Naik, V. S.; Patil, P. S.; Wong, Q. A.; Quah, C. K.; Gummagol, N. B.; Jayanna, H. S.; J. Mol. Struct. 2020, 1222, 128901. [Crossref] 2. Iwashina T.; J. Plant Res. 2000, 113, 287. [Crossref] 3. Nowakowska, Z.; Eur. J. Med. Chem. 2007, 42, 125. [Crossref] 4. Narender, T.; Venkateswarlu, K.; Nayak, B. V.; Sarkar, S.; Tetrahedron Lett. 2011, 52, 5794. [Crossref] 5. Siqueira, G. M.; Neuenfeldt, P. D.; Duarte, A.; Bretanha, L. C.; Freitag, R. A.; Cunico, W.; Quim. Nova 2010, 33, 707. [Crossref] 6. Ferreira, M. K. A.; Fontenelle, R. O. S.; Magalhães, F. E. A.; Bandeira, P. N. S.; Menezes, J. E. S. A.; dos Santos, H.; Rev. Virtual Quim. 2018, 10, 1455. [Crossref] 7. Hassam, S. Y.; J. Braz. Chem. Soc. 2011, 22, 1286. [Crossref] 8. Mora-Pérez, A.; Hernández-Medel, M. R.; Neurología 2016, 31, 161. [Crossref] 9. Prabhakar, V.; Iqbal, H.; Balasubramanian, R.; Pak. J. Pharm. Sci. 2016, 29, 165. [Link] acessado em Dezembro 2023 10. Vellosa, A. B. S.; Lima Filho, V. B.; Soares, B. A.; Nascimento-Júnior, N. M.; Quim. Nova 2022, 45, 435. [Crossref] 11. Chaouiki, A.; Lgaz, H.; Salghi, R.; Chafiq, M.; Oudda, H.; Shubhalaxmi; Bhat, K. S.; Cretescu, I.; Ali, H.; Marzouki, R.; Chung, I. M.; Colloids Surf., A 2020, 588, 124366. [Crossref] 12. Borchardt, D. M.; Mascarello, A.; Chiaradia, L. D.; Nunes, R. J.; Oliva, G.; Yunes, R. A.; Andricopulo, A. D.; J. Braz. Chem. Soc. 2010, 21, 142. [Crossref] 13. Lenardão, E. J.; Freitag, R. A.; Dabdoub, M. J.; Batista, A. C. F.; Silveira, C. C.; Quim. Nova 2003, 26, 123. [Crossref] 14. Prado, A. G. S.; Quim. Nova 2003, 26, 738. [Crossref] 15. Merat, L. M. O. C.; San Gil, R. A. S.; Quim. Nova 2003, 26, 779. [Crossref] 16. Silva, E. C. C.; Aguiar, D. S.; Nascimento, T. F.; Brazilian Journal of Development 2021, 7, 77953. [Crossref] 17. Nyhof-Young, J.; J. Sci. Ed. Technol. 1996, 5, 69. [Crossref] 18. Lôbo, S. F.; Quim. Nova 2012, 35, 430. [Crossref] 19. Barboza, D. A. P.; Merlo, A. A.; Pazinatoa, M. S.; Rev. Virtual Quim. 2021, 13, 650. [Crossref] 20. Galiazzi, M. D. C.; Rocha, J. M. D. B.; Schmitz, L. C.; Souza, M. L. D.; Giesta, S.; Gonçalves, F. P.; Ciência & Educação 2001, 7, 249. [Crossref] 21. Schnetzler, R. P.; Quim. Nova 2002, 25, 14. [Crossref] 22. de Oliveira, J. R. S.; Revista de Ensino de Ciências e Matemática 2010, 12, 139. [Link] acessado Dezembro 2023 23. Ferreira, M. L.; Marques, A. J.; Research, Society and Development 2020, 9, e179953333. [Crossref] 24. Li, J. T.; Yang, W. Z.; Wang, S. X.; Li, S. H.; Li, T. S.; Ultrason. Sonochem. 2002, 9, 237. [Crossref] 25. Voltolini, B. G.: Síntese de Análogos a Chalconas via Condensação Aldólica, Caracterização e Avaliação o seu Potencial como Inibidores da Enzima Yoph de Yersinia sp.; Dissertação de Mestrado, Universidade Federal de Santa Catarina, Florianópolis, Brasil, 2014. [Link] acessado em Dezembro 2023 26. Zhao, J.; Qiu, J.; Gou, X.; Hua, C.; Chen, B.; Chin. J. Catal. 2016, 37, 571. [Crossref] 27. Tanemura, K.; Rohand, T.; Tetrahedron Lett. 2021, 71, 152918. [Crossref] 28. Kumar, D.; Suresh; Sandhu, J. S.; Green Chem. Lett. Rev. 2010, 3, 283. [Crossref] |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access





