Educação
|
|
| Síntese sustentável do ácido L-piroglutâmico: experimento integrado de síntese orgânica e estereoquímica Sustainable synthesis of L-pyroglutamic acid: an integrated organic synthesis and stereochemistry experiment |
|
Fernando Alves BarrettoI I. Instituto de Química, Universidade Federal da Bahia, 40170-115 Salvador - BA, Brasil Recebido: 31/03/2024 *e-mail: silviodc@ufba.br (S)-Pyroglutamic acid is a heterocyclic amino acid derivative which was easily synthesized in undergraduate laboratory through a solvent-free environmentally friendly method involving controlled heating and agitation. This preparation allowed teaching stereochemistry in undergraduate levels, which entails the synthesis of (S)-pyroglutamic acid and the assessment of its optical purity using the simple and rapid technique of melting point measurement, corroborated by polarimetry. The reasons why the solid-state properties of enantiomeric mixtures can differ from those of enantiopure compounds are also discussed, with optical rotation not being the sole distinguishing property. INTRODUÇÃO O ensino para a sustentabilidade é uma das principais ações da área Educação do Movimento Química Pós 2022 - Sustentabilidade e Soberania da Sociedade Brasileira de Química, que dialoga diretamente com os 17 Objetivos de Desenvolvimento Sustentável (ODS) e suas 169 metas, da Agenda 2030 da Organização das Nações Unidas.1 Portanto, educar as novas gerações de profissionais da química inseridos no tema sustentabilidade é tarefa de todas as áreas da química e da síntese orgânica em particular, face à inerente atuação de químicos orgânicos na indústria farmacêutica, que foi identificada como uma das que produz a maior quantidade de resíduo em relação ao produto desejado (fator E = kgsubproduto/kgproduto) de acordo com o fator E da Química Verde (compare o fator E < 0,1 de refinarias de petróleo com o fator E 25-100 da indústria farmacêutica para se ter noção dos extremos de alguns segmentos industriais).2 O ensino de biomoléculas é tema necessário na formação dos profissionais da Química. Dentre elas, os aminoácidos têm um significativo destaque face à importância bioquímica deles, e em síntese orgânica são blocos quirais de construção de outras moléculas de complexidade superior. Os aminoácidos, somados aos terpenos e carboidratos, são denominados como chiral pool, isto é, uma coleção de substâncias naturais abundantes e enantiomericamente puras que ocorrem na natureza como uma única forma geométrica das duas possíveis imagens especulares. Apesar desses aspectos, ainda é raro o emprego de aminoácidos em aulas experimentais, em franco contraste com o que ocorre na pesquisa em síntese orgânica e na indústria farmacêutica. Nos textos destinados ao ensino teórico de química orgânica fundamental, os aminoácidos são apresentados pela primeira vez ao estudante no capítulo sobre estereoquímica, mas a única reação química ensinada neste assunto é a empregada na resolução de racematos e, quando se avança no curso de química orgânica para o ensino de biomoléculas, a ênfase é na formação da ligação peptídica e na degradação de Edman.3 Em função do potencial dos aminoácidos em síntese orgânica, esse é um cenário indesejável na formação de químicos e profissionais afins. Além disso, o ensino de estereoquímica é centrado na classificação das substâncias quirais, na identificação e designação dos centros estereogênicos e nas propriedades dos estereoisômeros, com ênfase na polarimetria como técnica que permite distinguir os enantiômeros. Contudo, os cursos experimentais de química orgânica ainda não contemplam um experimento sustentável com um aminoácido que envolva reação química e avaliação da pureza óptica (ou do excesso enantiomérico) do produto obtido. Em continuação ao desenvolvimento de experimentos didáticos em Química Verde,4 apresentamos aqui a transposição didática de uma síntese sustentável por nós recentemente desenvolvida,5 na forma de um experimento integrado de síntese orgânica sustentável e estereoquímica, de transformação termicamente induzida do ácido (S)-glutâmico ao ácido (S)-piroglutâmico (ou L-piroglutâmico), com avaliação da pureza óptica do produto por polarimetria, e que ensina a diferença entre os pontos de fusão do racemato e do enantiômero como propriedade adicional na distinção entre eles.
ESTRATÉGIA E ORGANIZAÇÃO DO EXPERIMENTO Dentre as sínteses descritas para o ácido (S)-piroglutâmico a partir do ácido (S)-glutâmico,6-11 foram selecionados dois protocolos (reação em água como solvente e a síntese no estado sólido) para serem submetidos à transposição didática necessária à realidade da infraestrutura do laboratório de ensino. Diversas adaptações foram investigadas para que o tempo de execução do experimento se tornasse adequado a uma aula entre 2-4 h e o procedimento compatível com equipamentos e vidrarias convencionais desse tipo de laboratório, bem como o emprego de reagentes e solventes acessíveis e não tóxicos, para que seja exequível às diversas realidades de condições do laboratório de ensino. Após a síntese e caracterização estrutural do produto obtido, são determinados a pureza óptica por polarimetria e o ponto de fusão para que os estudantes façam a correlação entre estas duas propriedades do ácido piroglutâmico racêmico e quiral. Para melhor compreensão dos estudantes neste assunto, se faz necessário discorrer sobre aspectos do comportamento de racematos e enantiômeros puros no estado sólido, um tema não adequadamente trabalhado nos livros introdutórios.4
PROPRIEDADES DE SUBSTÂNCIAS QUIRAIS NO ESTADO SÓLIDO E DO ÁCIDO PIROGLUTÂMICO EM PARTICULAR: O PONTO DE FUSÃO COMO DISCRIMINANTE DA PUREZA ÓPTICA Nos textos básicos de química orgânica consultados, é comum a afirmação que todas as propriedades de um dado par de enantiômeros são idênticas, exceto pelo sentido do desvio da luz plano-polarizada (um enantiômero é levogiro e o outro dextrogiro), e que o racemato não tem atividade óptica.4 Na maioria dos livros textos descritos na referência 4, não são apresentadas comparações entre outras propriedades físicas do racemato e dos enantiômeros, ficando quase que tácito e implícito que estas outras propriedades são idênticas entre os enantiômeros e o racemato. Embora estas informações sejam apropriadas para grande parte dos sistemas químicos em solução, no estado sólido essas afirmações não são essencialmente verdadeiras, pois algumas das propriedades de misturas de enantiômeros são dependentes da composição no estado sólido, a exemplo da densidade e a solubilidade.12 Quando os livros comentam as diferenças entre propriedade de enatiômeros puros e racematos, o exemplo recorrente é o ácido tartárico, por razões históricas inerentes à contribuição de Pasteur. Destacamos os livros dos autores Bruice3 e Solomons3 que, no capítulo “Esteroquímica”, indicam a diferença de ponto de fusão e/ou solubilidade para os ácidos tartáricos, e no Solomons3 há uma breve discussão sobre as diferenças de pontos de fusão entre enatiômeros e racematos e sua relação com a magnitude das forças intermoleculares que atuam entre moléculas dos enantiômeros puros e entre moléculas da mistura racêmica. Enantiômeros puros possuem arranjos microscópicos que se caracterizam como cristais enantiomorfos (imagens especulares um do outro), e diferem dos cristais do racemato. Contudo, macroscopicamente, pode não se observar distinção alguma entre as morfologias dos sólidos dos enantiômeros e do racemato.12 A origem das diferenças das propriedades de misturas de enantiômeros no estado sólido, de composições molares diferentes, é consequência de coexistirem distintos tipos de estruturas cristalinas, podendo haver cristais do tipo homoquiral, em que um único enantiômero participa da célula unitária com interações entre suas moléculas do tipo L-L (levogira-levogira) ou D-D (dextrogira-dextrogira), guardando analogia com a situação de um aperto de mão entre duas pessoas (duas mão direitas ou duas mãos esquerdas, Figura 1), e cristais do tipo heteroquiral em que os dois enantiômeros compõem a célula unitária na proporção 1:1 com interações do tipo L-D (levogira-dextrogira), analogamente às mãos direitas e esquerda entrelaçadas, Figura 1. Estas analogias podem ainda ser estendidas para mostrar que, similarmente ao fato de que a força de um aperto de mão do tipo mão direita/mão esquerda causa estranheza entre dois humanos, cristais homoquirais e heteroquirais apresentam forças intermoleculares distintas por terem interações distintas entre as moléculas do retículo cristalino. Assim, embora as forças das interações intermoleculares entre os pares de moléculas L-L ou D-D sejam idênticas, quando comparadas ao par L-D são diferentes. Estes fatos se refletem em temperaturas de fusão distintas entre o racemato e os enantiômeros puros. Dessa forma, como o ponto de fusão (PF) dos cristais é uma propriedade muito simples de se medir em todo laboratório de ensino, o PF pode fornecer informação acerca da pureza óptica de uma substância quiral.
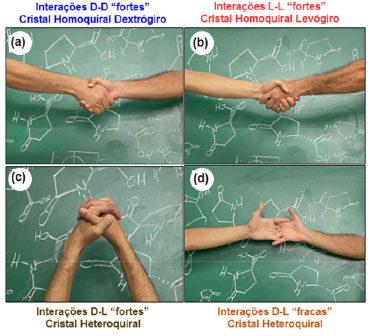 Figura 1. Simulação das interações intermoleculares entre enantiômeros empregando mãos humanas como representação dessas moléculas quirais e suas associações no estado sólido. Aperto de mãos idênticas em analogia às interações intermoleculares fortes entre os enantiômeros no cristal, sendo (a) dextrogiros, e (b) levogiros; entrelaçamento entre mãos direita e esquerda em analogia às interações intermoleculares de misturas dos enantiômeros dextrogiro e levogiro no cristal, sendo (c) interações fortes, e (d) interações fracas
Para o caso específico do ácido piroglutâmico, as diferentes proporções enantioméricas levam à coexistência de diferentes proporções entre sólidos heteroquirais e homoquirais levogiro e dextrogiro, resultando numa relação de fases que se assemelha a de um sistema eutético binário. Neste sistema, o racemato se comporta como uma entidade química única distinta dos enantiômeros puros,12 inclusive fundindo a uma temperatura cerca de 30 ºC acima destes, Figura 2.
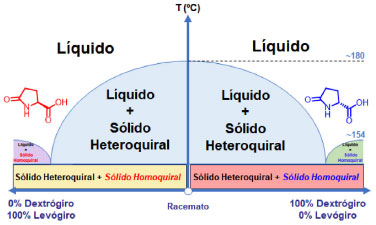 Figura 2. Representação do diagrama de fases de temperatura de fusão versus composição molar para a mistura de enantiômeros do ácido piroglutâmico
A temperatura de fusão é significativamente maior para o racemato do que para os enantiômeros puros do ácido piroglutâmico. Em função desse comportamento, é possível associar a medida da temperatura de fusão com a rotação óptica específica do enantiômero sintetizado no experimento aqui desenvolvido, como propriedade adicional na avaliação da pureza óptica do produto obtido, sendo possível até que, em laboratórios de ensino que não têm acesso a um polarímetro, a avaliação da pureza óptica possa ser inferida de forma muito simples medido apenas o PF, devido à significativa diferença dos valores de temperatura de fusão entre o racemato e os enantiômeros do ácido piroglutâmico.
SÍNTESE TÉRMICA SEM SOLVENTE DO ÁCIDO L-PIROGLUTÂMICO Dos métodos descritos para a preparações do ácido (S)-piroglutâmico,5-11 a desidratação intramolecular termicamente induzida do ácido (S)-glutâmico é o mais simples para este propósito, Esquema 1. Entretanto, os procedimentos descritos no século passado são inadequados para uma aula experimental pois são demorados. Métodos atuais de síntese foram inicialmente investigados como estratégia de diminuir o tempo de reação. Assim, várias tentativas de se promover a desidratação intramolecular do ácido (S)-glutâmico em água como solvente, num forno de micro-ondas doméstico (por ser acessível aos laboratórios de ensino), não levaram à formação do produto, sendo o reagente recuperado. O uso do micro-ondas doméstico foi descontinuado pois, em muitos casos, houve também decomposição do reagente com liberação de vapores com forte cheiro de amônia. A reação no estado sólido foi investigada empregado a moagem manual do ácido (S)-glutâmico com gral e pistilo, mas novamente o reagente foi recuperado.
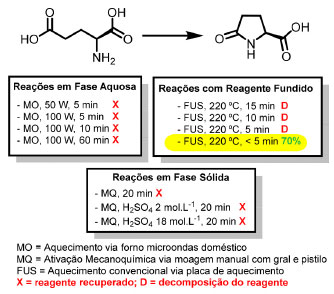 Esquema 1. Transposição didática da síntese sustentável do ácido (S)-piroglutâmico
Conhecendo as sínteses térmicas sem solvente do ácido (S)-piroglutâmico a partir do ácido (S)-glutâmico,5,9-11 foram investigadas algumas condições para que a síntese se tornasse exequível nas condições do laboratório de ensino, com o tempo de aula limitado ao máximo de quatro horas semanais. Das condições avaliadas, a que resultou na mais adequada se encontra destacada no Esquema 1. Para o sucesso da síntese, é crucial que se faça o pré-aquecimento da placa como detalhado na seção “Parte Experimental”, e que se faça movimentos circulares constantes no béquer com o ácido no estado sólido, e principalmente após a sua fusão, que é quando começa a ocorrer a reação. A atenção ao término do borbulhamento também é muito importante para que o rendimento seja adequado. Para ilustrar, a Figura 3 apresenta um conjunto de fotos das etapas do procedimento, onde fica evidente a simplicidade da execução da síntese sem solvente. É importante destacar que a agitação proporcionada pelo movimento manual circular não pode ser substituída por uma barra magnética para agitação mecânica pois, quanto se testou essa forma de agitação, parte do sólido foi projetado para as paredes do recipiente e ocorreu a degradação do reagente. Adicionalmente, se o meio reacional for aquecido por 5 min ou mais começa a ocorrer a decomposição da amostra com formação de fumos e escurecimento, e o produto desejado não é obtido.
 Figura 3. Fotos das etapas da síntese sem solvente do ácido piroglutâmico: o sólido reagente; fusão, resfriamento do óleo, e solidificação induzida do produto. Notar que a manipulação do béquer ocorre após o resfriamento. Não manipular o béquer quente com as mãos
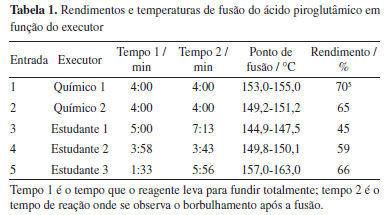
Como o tempo de uso da placa pré-aquecida é pequeno, não é necessário o uso de uma placa por estudante, o que minimiza a exposição da turma a várias placas superaquecidas. A etapa de recristalização é também rápida, o que também facilita a logística de uso e distribuição das placas de aquecimento no laboratório de ensino. A recristalização com acetona aquecida é também um diferencial da síntese aqui apresentada pois, ao contrário da maioria dos experimentos que normalmente o estudante realiza nos cursos experimentais de química orgânica, o produto da reação é praticamente insolúvel em acetona a quente, enquanto as impurezas (subprodutos e reagente) são solúveis, o que torna a purificação muito rápida, se assemelhando a uma lavagem com solvente aquecido. Portanto, o experimento é complementar ao treinamento geralmente propiciado nos laboratórios de ensino onde, nas recristalizações efetuadas, o produto é solúvel a quente e as impurezas são insolúveis. Os rendimentos e as temperaturas de fusão do ácido piroglutâmico, obtidos da desidratação intramolecular do ácido glutâmico, estão indicadas na Tabela 1. Os dados descritos indicam o sucesso da síntese, tanto executada por químicos experientes quanto por estudantes de graduação em treinamento experimental.
A análise da atividade óptica de uma solução aquosa do produto resultou no valor de [α]20D –10,69, comparável ao valor descrito na literatura6 para uma amostra de concentração similar ([α]20D = –11,35, concentração 0,02 g mL-1), o que indica uma pureza óptica satisfatória face à simplicidade do procedimento aqui desenvolvido para uma aula experimental, revelando o sucesso na síntese do ácido (S)-piroglutâmico. Este resultado também demostra que a condição reacional empregada na desidratação intramolecular evita a racemização do centro estereogênico do aminoácido de partida durante a reação de ciclização. Em adição à determinação da pureza óptica via polarimetria, a determinação da temperatura de fusão é um indicativo do sucesso da síntese, uma vez que existe uma diferença significativa no valor do PF do racemato (180-183 ºC)9 e do enatiômero levogiro (154-156 ºC).7 O ponto de fusão indica a pureza da amostra pela faixa estreita e, neste caso, é também uma indicação da pureza óptica. Portanto, o experimento proporciona a consolidação do treinamento na medida do ponto de fusão e insere esta propriedade numa nova dimensão de análise de composição microscópica de substâncias quirais, ampliando a compreensão do estudante nas propriedades no estado sólido da matéria. Os espectros no infravermelho (IV) e de ressonância magnética nuclear (RMN) são fornecidos no Material Suplementar nas Figuras 2S a 7S, e podem ser explorados para correlacionar os dados com a estrutura do produto, e para reforçar que as propriedades físicas são idênticas para isômeros puros e mistura racêmica. Por exemplo, a análise das bandas de maior intensidade dos espectros no infravermelho não distingue o ácido glutâmico racêmico do quiral. Identificado o produto e aferida sua atividade óptica, que comprova a preservação do centro estereogênico, o mecanismo do Esquema 2 indica a formação da lactama pelo ataque nucleofílico do grupo amino ao grupo ácido da extremidade da cadeia, formando o intermediário tetraédrico que avança para o produto com a eliminação de uma molécula de água. Na temperatura em que a reação é realizada, a última etapa é irreversível pela volatilização da água formada, responsável pela formação das bolhas observadas durante o experimento.
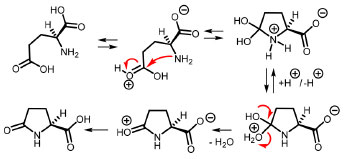 Esquema 2. Proposta de caminho reacional para a ciclização intramolecular do ácido (S)-glutâmico para o ácido (S)-piroglutâmico
Tão importante quanto os aspectos sintéticos e estereoquímicos até aqui discutidos, o experimento desenvolvido tem aderência à formação para com a sustentabilidade uma vez que, dentre as sínteses conhecidas para o produto da aula experimental, o procedimento desenvolvido é o que emprega a menor quantidade de solvente orgânico na etapa de purificação e que, num contexto de uma aula de maior duração, o solvente acetona pode ser parcialmente recuperado via destilação simples e reempregado. Não menos importante, a reação realizada no estado sólido evita até mesmo o emprego de água como solvente, um bem ecologicamente muito valioso e cuja captação e tratamento é mais nobre para fins de consumo humano que para realização de reações química (apesar de que, em comparação com solventes orgânicos, o emprego da água é muito mais sustentável). Ou seja, quando possível, o melhor solvente é o não solvente! Adicionalmente, o reagente é proveniente de fonte renovável, não petroquímica, o que é um diferencial cada vez mais desejado. Do exposto, é possível associar o experimento com os seguintes princípios da Química Verde:2 prevenção de resíduos (o rendimento é satisfatório e a quantidade de solvente usado na etapa de purificação é a menor dentre as síntese conhecidas), economia atômica (a maioria dos átomos do reagente está no produto, exceto uma molécula de água), solventes e auxiliares mais seguros, eficiência energética (o tempo de reação sob aquecimento é o menor entre as sínteses conhecidas), matérias-primas renováveis, redução de derivados (a alta pureza ótica indica isso). Assim, holisticamente, a execução do experimento, aliada à integrada intervenção do Professor, pode contribuir para uma formação que promova o pensamento sustentável.
CONCLUSÕES O experimento desenvolvido emprega condições simples, exequíveis em todo laboratório de ensino experimental de química orgânica, e contempla o aspecto da sustentabilidade pois a reação sem solvente no estado sólido13 demanda uma quantidade pequena de solvente orgânico na etapa de purificação (10-14 mL por g de reagente), minimizando o uso de solvente orgânico e a formação de resíduos no laboratório didático, e é uma transposição didática da síntese mais sustentável que se conhece para o ácido (S)-piroglutâmico a partir do ácido (S)-glutâmico. Tão importante como esses aspectos, o experimento amplia o emprego da polarimetria na formação dos futuros profissionais e a percepção dos critérios de pureza de uma substância quiral pela determinação do excesso enantiomérico do produto obtido, bem como aprofunda o estudo das propriedades dessas substâncias no estado sólido pela correlação entre o valor da temperatura de fusão e identificação de substância quiral enantiomericamente enriquecida ou racemizada.
PARTE EXPERIMENTAL Os pontos de fusão foram determinados em um aparelho de placa aquecida, Microquímica MQAPF 301, e não foram corrigidos. Os espectros na região do infravermelho foram obtidos na forma de disco de KBr em um aparelho Shimadzu IR Affinity-1, e os espectros de RMN foram obtidos em 500 MHz para 1H e 125 MHz para 13C, empregando um espectrômetro Bruker Avance III 500. A rotação óptica foi medida em um polarímetro digital Polartronic H532. Todos os reagentes empregados foram da marca Aldrich e os solventes foram da marca Quimidrol. Síntese do ácido (S)-piroglutâmico Atenção: usar luva térmica ou pinça tenaz na manipulação do béquer aquecido. Em uma capela com exaustão, colocar uma placa de aquecimento e ajustar a potência de aquecimento de forma que a temperatura atinja 220 ºC (para medir a temperatura pode-se empregar um béquer pequeno com óleo e introduzir um termômetro preso a uma garra) e aguardar 10 min para estabilização da temperatura. Em um béquer de 100 mL adicionar 1,48 g (10,0 mmol) do ácido (S)-glutâmico e colocar na placa com movimentos circulares mantendo o béquer totalmente apoiado sobre a superfície da placa de aquecimento, para evitar o aquecimento não homogêneo do seu conteúdo. Com o progresso do aquecimento, observa-se a fusão gradativa do ácido glutâmico formando um líquido amarelado e o borbulhamento suave do mesmo (esta etapa leva cerca de 5 min). O aquecimento é interrompido retirando o béquer da placa de aquecimento no instante em que o borbulhamento cessa (leva cerca de 5 min). Resfriar o béquer na seguinte ordem: por 30 s à temperatura ambiente, em seguida em banho de água por 2 min, e por mais 2 min em banho de gelo. Após esta sequência, o béquer é mantido em repouso por 1 h à temperatura ambiente, e ocorre a cristalização gradativa do óleo amarelo. Após a cristalização completa, adicionar 10 mL de acetona ao béquer e levar a uma placa de aquecimento a 50-60 ºC. Os cristais ao fundo do béquer são revolvidos com o auxílio de uma espátula metálica para promover a solubilização das impurezas amareladas durante o aquecimento (o produto é insolúvel). Com o progresso da trituração, gradativamente se observa a mudança de aparência do material sólido, que inicialmente é composto por cristais brancos-amarelados e passa por um material de coloração amarelada com textura de goma e por fim torna-se um pó branco, sendo as impurezas amareladas extraídas pelo solvente. A trituração é interrompida neste ponto e em seguida o sólido é filtrado a vácuo, lavado com 10 mL de acetona e seco ao ar, resultando em 0,8418 g (6,52 mmol, 65% de rendimento) de ácido (S)-piroglutâmico, como um sólido branco. Determinar o ponto de fusão e a rotação óptica. Infravermelho (KBr): 3402; 1721; 1647; 1420; 1234; 1207; 713; 621 cm-1. Medida da atividade óptica do ácido (S)-piroglutâmico Preparar uma solução aquosa de concentração 0,02 g mL-1 empregando 40 mg do produto. A medição da rotação ótica padrão foi realizada na temperatura de 20 ºC e usando a lâmpada de sódio de comprimento de onda de 589 nm com caminho óptico de 10 cm.
MATERIAL SUPLEMENTAR A Figura 1S, da placa de aquecimento com aferição da temperatura e reações simultâneas, e Figuras 2S-7S dos espectros do reagente e produto estão disponíveis em http://quimicanova.sbq.org.br, na forma de arquivo PDF, com acesso livre.
AGRADECIMENTOS Os autores agradecem o suporte financeiro do Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), da Fundação de Amparo à Pesquisa do Estado da Bahia (FAPESB) e da Coordenação de Aperfeiçoamento de Pessoal de Nível Superior - Brasil (CAPES), código de financiamento 001. Agradecemos as bolsas de pós-graduação do CNPq para F. A. B. e L. A., e a bolsa de produtividade em pesquisa de S. C. Agradecemos ao Professor K. T. de Oliveira (UFSCar) pelas medidas de rotação óptica.
REFERÊNCIAS 1. Silva, I. F.; Nascimento, P. H. P.; Lago, R. M.; Ramos, M. N.; Galembeck, F.; Rocha Filho, R. C.; Teixeira A. P. C.; Quim. Nova 2022, 45, 497. [Crossref] 2. Corrêa, A. G.; Zuin, V. G.; Química Verde: Fundamentos e Aplicações, 1ª ed.; EdUFSCar: São Carlos, 2009; Lenardão, E. J.; Freitag, R. A.; Dabdoub, M. J.; Batista, A. C. F.; Silveira, C. C.; Quim. Nova 2003, 26, 123. [Crossref] 3. Barbosa, L. C. A.; Introdução à Química Orgânica, vol. 1 e 2, 2ª ed.; Pearson: São Paulo, 2011; Bruice, P. Y.; Química Orgânica, 4a ed.; Prentice Hall: São Paulo, 2006; Carey, F. A.; Química Orgânica, vol. 1, 7a ed.; McGraw-Hill-Bookmann: São Paulo, 2011; Clayden, J.; Greeves, N.; Warren, S.; Organic Chemistry, 2nd ed.; Oxford University Press: Oxford, 2012; Constantino, M. G.; Química Orgânica: Curso Básico Universitário, vol. 1; LTC: Rio de Janeiro, 2008; Klein, D.; Química Orgânica, vol. 1, 2a ed.; LTC: Rio de Janeiro, 2016; McMurry, J.; Química Orgânica, 3a ed.; Cengage Learning: São Paulo, 2016; Solomons, T. W. G.; Fryhle, C. B.; Snyder, S. A.; Química Orgânica, vol. 1, 10a ed.; LTC: Rio de Janeiro, 2018; Vollhardt, K. P. C.; Schore, N. E.; Química Orgânica: Estrutura e Função, 6a ed.; Bookman: Porto Alegre, 2013. 4. Cunha, S.; Rodrigues, M. C.; Mattos, R. R.; Teixeira, L. S. G.; Santos, A. O.; Santos, E. V.; Souza, R. S.; Andrade, G. S.; de Paula, R.; Jesus, D. S.; Quim. Nova 2018, 41, 691 [Crossref]; Cunha, S.; Fontes, T.; Araújo, D.; Riatto, V.; Quim. Nova 2017, 41, 116 [Crossref]; Cunha, S.; Santana, L. L. B.; J. Braz. Chem. Soc. 2017, 28, 1137 [Crossref]; Cunha, S.; Costa, O. B. S.; Santana, L. L. B.; Lopes, W. A.; Quim. Nova 2015, 38, 874 [Crossref]; Riatto, V.; Victor, M. M.; Cunha, S.; Quim. Nova 2015, 38, 727 [Crossref]; Cunha, S.; Lustosa, D. M.; Conceição, N. D.; Fascio, M.; Magalhães, V.; Quim. Nova 2012, 35, 638. [Crossref] 5. Barretto, F. A.; Cunha, S.; J. Heterocycl. Chem. 2024, 61, 955. [Crossref] 6. Foreman, F. W.; Biochem. J. 1914, 8, 481. [Crossref] 7. Hardy, P. M.; Synthesis 1978, 4, 290. [Crossref] 8. Bladé-Font, A.; Tetrahedron Lett. 1980, 21, 2443. [Crossref] 9. King, J. A.; Mcmillan, F. H.; J. Am. Chem. Soc. 1952, 74, 2859. [Crossref] 10. Beecham, A. F.; J. Am. Chem. Soc. 1954, 76, 4613. [Crossref] 11. Mjjin, D.; Petrovic, S.; Stojanovic, O.; J. Serb. Chem. Soc. 1989, 54, 11. [Link] acessado em Agosto 2024 12. Eliel, E. L.; Wilen, S. H.; Mander, L. N.; Stereochemistry of Organic Compounds, illustrated ed.; Wiley-Interscience; New York, 1994. 13. Tanaka, K.; Toda, F.; Chem. Rev. 2000, 100, 1025. [Crossref]
Editor Associado responsável pelo artigo: Giovanni W. Amarante |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access






