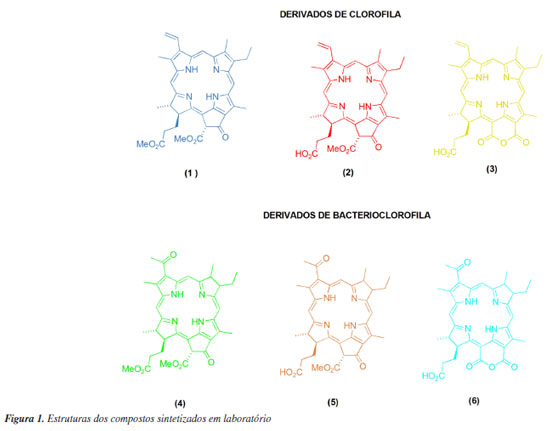
Artigo
|
|
| Estudo teórico e experimental de derivados de clorinas e bacterioclorinas visando a sustentabilidade Theoretical and experimental study of chlorins and bacteriochlorins derivatives aiming for sustainability |
|
Andrés C. A. AcevedoI; Juliana K. BilhaI; Priscila R. M. PereiraI; Paula A. J. AraujoII; Marciana P. UlianaI,II,* I. Instituto Latino-Americano de Tecnologia, Infraestrutura e Território, Universidade Federal da Integração Latino-Americana (UNILA), 85870-650 Foz do Iguaçu - PR, Brasil Recebido: 25/03/2024 *e-mail: marciana.machado@unila.edu.br Porphyrinoid compounds such as chlorins and bacteriochlorin have currently been widely studied to remedy health problems, develop new technologies, apply in solar cells, and decontaminate food, aiming for sustainability. Its wide applicability demonstrates the potential of these derivatives to solve society's problems. Thus, this work seeks to understand more about the reactivity and properties of these derivatives. In this way, structural changes were made to chlorophyll, giving rise to three chlorin compounds (1-3), and also to bacteriochlorophyll, giving rise to three bacteriochlorins (4-6). The experimentally obtained results were analyzed by infrared and UV-Vis spectroscopy and the experimental spectroscopic data were compared with data obtained theoretically with Gaussian 09 software, using density functional theory (DFT), such as B3LYP and CAM-B3LYP. After the analyses, it was observed that the data obtained experimentally are quite similar to those obtained theoretically. Thus, it is possible to demonstrate that theoretical calculations are useful tools and can help predict molecules, often avoiding the synthesis of a given molecules in the laboratory, minimizing the use of reagents and solvents and thus contributing to sustainability. INTRODUÇÃO Os compostos porfirinóides são compostos aromáticos e são classificados em porfirinas, clorinas, isobacterioclorinas e bacterioclorinas. Esta classificação é determinada de acordo com seu grau de insaturação dos anéis pirrólicos bem como a posição das insaturações, conferindo espectros de absorção característicos para cada classe de compostos.1-3 Estes compostos porfirinóides são de extrema importância para a vida e, dentre eles, podemos destacar a clorofila, um dos pigmentos mais abundantes da terra, que pertence a classe das clorinas e tem papel fundamental à vida, responsável pela fotossíntese das plantas e cianobactérias.4 Modificações químicas na estrutura da clorofila podem torná-la eficiente para diversas aplicações.5,6 A bacterioclorofila, que pertence a classe das bacterioclorinas, é encontrada em bactérias púrpuras de ambientes aquáticos anaeróbios, como lodo, água parada e águas de redes subterrâneas. Estes pigmentos também podem ser modificados estruturalmente e aplicados na área de saúde.2,7 Os derivados de clorofila e bacterioclorofila são utilizados na inativação de microrganismos e células tumorais.3,8 Atualmente as infecções causadas por microrganismos na área hospitalar são bastante comuns,9 muitas vezes estes microrganismos são resistentes a antibióticos utilizados para sua inativação o que torna um problema de saúde pública, pois diminui a qualidade de vida da população.10,11 Neste sentido a pesquisa nesta área de modificação estrutural de compostos químicos vem crescendo a fim de obter novos fármacos, eficientes na inativação de microrganismos, que não apresentem custo muito elevado, com baixos efeitos colaterais e que não causem resistência nos microrganismos.12 O desenvolvimento de novos fármacos e novas técnicas aplicadas a saúde contribuem para os objetivos do desenvolvimento sustentável que trata da boa saúde e bem estar.13 Estes derivados de clorofila e bacterioclorofila são utilizados como fotossensibilizadores (FS), os quais são ativados com uma luz com comprimento de onda específico na presença de oxigênio. Esta técnica é chamada de terapia fotodinâmica (TFD) e gera espécies reativas de oxigênio e radicais que, por sua vez, causam danos às células de microrganismos ou de células tumorais levando à inativação das mesmas.14,15 Para uma eficiente inativação de microrganismos e de células cancerígenas utilizando a TFD, neste caso também denominada de inativação fotodinâmica, é necessário que o FS apresente uma absorção na região entre 610 até 800 nm, que não seja tóxico no escuro, apresente baixo custo e estabilidade.15 Os derivados de clorofila e bacterioclorofila também são aplicados na inativação de células tumorais.15 Isso é de extrema importância, pois o câncer, por ser uma das doenças que mais mata atualmente, apresenta efeitos colaterais muito pronunciados durante os tratamentos padrão, como: quimioterapia, radioterapia e imunoterapia. Esses tratamentos diminuem a imunidade, causam perda de cabelo, abalam a autoestima da pessoa, causam náuseas, vômitos, diarréias, entre outros. Quando se utiliza a TFD, não ocorrem tantos efeitos colaterais no indivíduo, pois trata-se de uma resposta dirigida ao local de aplicação da luz. Os derivados de pigmentos naturais como, por exemplo, o photoditazine, que é um derivado de clorofila, é comercial e apresenta atividade frente a células tumorais.16 Já o Tookad® é um derivado de bacterioclorofila e atualmente usado no tratamento de câncer de próstata.17,18 Sendo assim, estes pigmentos naturais do tipo porfirinóides são amplamente utilizados na medicina a fim de tratar doenças causadas tanto por microrganismos quanto para câncer, contribuindo para o bem estar da população. Os derivados porfirinóides também estão sendo utilizados na construção de células solares sensibilizadas por corante (DSSC).19 As porfirinas são usadas nas camadas emissoras, devido a sua estrutura eletrônica e eletroluminescência, indicando emissão no espectro vermelho e absorvendo maior quantidade de luz, promovendo a conversão da luz solar em eletricidade, elas funcionam por meio do transporte de elétrons gerando um potencial de corrente elétrica considerável para alimentar sistemas de pequeno e médio porte.20,21 Esta aplicação de compostos porfirinóides é de extrema importância, pois apresenta aplicação no campo de energias renováveis, as quais visam utilizar materiais mais verdes, sustentáveis e que possam substituir fontes de energias convencionais, provenientes de combustíveis fósseis, contribuindo para a geração de energia limpa e sustentável.22 Considerando as mudanças climáticas e escassez energética, é necessária a implementação de políticas públicas voltadas à geração de energia limpa e amigável ao meio ambiente e que contribuem para os objetivos de desenvolvimento sustentáveis, prezando em fornecer energia acessível e sustentável.13,22 Estes pigmentos do tipo clorinas e bacterioclorinas também são utilizados como marcadores tumorais, uma vez que se irradia estes fotossensibilizadores com luz específica, eles passam por um estado excitado e quando retornam ao estado fundamental, emitem fluorescência, identificando por imagem de fluorescência a localização do tecido tumoral, contribuindo para a saúde e bem estar da população.23,24 Os derivados de clorofila também estão sendo utilizados para a descontaminação de alimentos, podemos destacar o uso do chlorophyllin na inativação de microrganismos presentes em sementes, as quais são utilizadas para produção de brotos que são consumidos de forma fresca. Estes brotos quando contaminados com microrganismos podem levar à intoxicação alimentar da população. Desta forma, os derivados porfirinóides já possuem um papel de extrema importância para a segurança alimentar.25 Para que o fotossensibilizador possa ser utilizado na TFD in vivo, é desejável que o mesmo seja iluminado em uma região de 650 até 900 nm, pois neste comprimento de onda a luz tem uma boa penetração no tecido e não apresenta grande interação com as moléculas presentes no mesmo, portanto, esta região de 650 a 900 nm é considerada janela terapêutica.26 Para o fotossensibilizador ser ativado por uma luz neste comprimento de onda, é necessário que apresente um espectro de absorção com banda de absorção nesta região, como é o caso de clorinas e bacterioclorinas. A absorção de radiação na região do visível de espectro eletromagnético é devido as ligações duplas conjugadas presentes nos derivados porfirinóides, a qual caracteriza uma cor específica para cada classe de composto.2 No espectro de absorção apresenta uma banda denominada Soret em aproximadamente 400 nm enquanto outras bandas de menor intensidade são denominadas de bandas Q, que variam para cada classe de composto.27-29 As clorinas apresentam um espectro de absorção com uma banda bem característica na região de 450-660 nm, enquanto as bacterioclorinas absorvem luz na região de 690-780 nm.7,9 Os grupos funcionais ligados aos compostos porfirinóides bem como o metal a qual forma complexo influenciam no deslocamento destas bandas no espectro de absorção.3,7 Sendo assim, essa adição de grupos funcionais bem como a adição de metais, causam uma mudança nas bandas Q dos compostos porfirinóides.3 Esse deslocamento de banda pode ser previsto através de cálculos teóricos,30 minimizando assim, etapas de síntese, reduzindo o uso de reagentes e solventes em laboratório e contribuindo para a sustentabilidade. Para isso é preciso que o cálculo teórico seja avaliado e inicialmente comparado com espectros experimentais a fim de avaliar se o método utilizado é eficiente. A fim de buscar soluções sustentáveis e práticas para sanar problemas de saúde, segurança alimentar e problemas energéticos, tem se intensificado a busca por bons fotossensibilizadores, com propriedades específicas. A química computacional é um recurso para prever e investigar estados conformacionais, propriedades eletrônicas e físico-químicas das moléculas destes compostos porfirinóides por meio da teoria das funcionais da densidade (DFT).31 Atualmente, se faz uso de produtos porfirinóides como as porfirinas, clorinas, bacterioclorinas e isobacterioclorinas, como modelo químico usado como fotossensibilizadores no campo da saúde.32 Desta forma, é possível prever, por cálculos teóricos, a alteração nos espectros de absorção com a adição de novos metais e grupos funcionais ligados ao anel central.30 É possível prever também alterações químicas, o que reduz os erros de predição de propriedades, bem como simular eventos químicos podendo comparar estes dados provenientes dos cálculos teóricos com dados experimentais. A obtenção desses dados experimentais demandaria bastante tempo no laboratório e faria uso de solventes potencialmente poluidores. Contudo, o uso de cálculos teóricos é uma alternativa limpa, sustentável e minimiza os problemas anteriormente citados.33-35 Com o objetivo de prever os espectros de absorção bem como os espectros de infravermelho, espectro de UV-visível e as energias HOMO (highest occupied molecular orbital) e LUMO (lowest unoccupied molecular orbital), dureza química (η), reatividade química (μ), eletrofilicidade (ω) e momento de dipolo, foram realizados neste trabalho cálculos teóricos utilizando software Gaussian 09.36 O uso de software para cálculos teóricos baseados na mecânica quântica é de grande utilidade, pois com sua versatilidade é possível realizar cálculos avançados aplicados a pesquisa e desenvolvimento de vários campos da bioquímica, química bem como medicina e farmácia.37 O uso de software prevê espectros de absorção sem a necessidade de sintetizar os compostos após a validação do método. Desta forma, a fim de comparar os dados teóricos e experimentais objetivando validar o método utilizado, foram realizados a síntese de seis derivados de produtos porfirinóides, 3 deles derivados de clorofila (moléculas 1-3) e 3 derivados de bacterioclorofila (moléculas 4-6) e estes compostos avaliados frente aos espectros de infravermelho e UV-Vis.
PARTE EXPERIMENTAL Metodologia de síntese dos compostos Neste estudo foi realizada a síntese de derivados de clorofila (moléculas 1-3) e de derivados de bacterioclorofilas (moléculas 4-6). Inicialmente a clorofila foi obtida da cianobactéria (Spirulina máxima), disponível comercialmente. O derivado da clorofila denominado metil-feoforbídeo (1) foi obtido através da reação de transesterificação, onde a clorofila presente na cianobactéria foi tratada com metanol e ácido sulfúrico (10%), durante 48 h a temperatura ambiente, protegida da luz. Após a extração, a molécula foi neutralizada com bicarbonato de sódio, lavada com água, secada com sulfato de sódio anidro, e purificada por coluna cromatográfica, conforme a literatura.29 O fotossensibilizador feoforbídeo-a (2) foi obtido pela hidrólise do metil-feoforbideo (1) com uma solução de HCl (10%), durante 48 h a temperatura ambiente, e, após a extração com metanol e acetato de etila e solvente reduzido no rota-evaporador, a solução resultante foi neutralizada com bicarbonato de sódio, lavada com água e secada com sulfato de sódio anidro. Este procedimento foi realizado segundo a referência bibliográfica.38 O derivado de clorofila denominado purpurina p-18 (3) foi obtida pela reação de oxidação do metil feoforbídeo (1) dissolvido em éter etílico. A esta solução foi adicionada uma solução de KOH (4.8 g dissolvida em 16 mL de acetona). Foi borbulhado oxigênio nesta solução, durante 1 h. A mistura foi extraída com água e a fase aquosa acidificada com ácido sulfúrico até pH em torno de 2-4, então foi extraída com diclorometano, lavada com água, e secada com sulfato de sódio anidro, após foi filtrada e o solvente evaporado, segundo a literatura.6,39 Os derivados de bacterioclorina (4-6) foram todos obtidos da bactéria Rhodopseumonas faecalis. O derivado denominado metil-bacterioclorina (4) foi obtido da bacterioclorofila pela reação de transesterificação segundo a literatura.7 A bactéria Rhodopseudomonas faecalis liofilizada, foi tratada com metanol e H2SO4 (10%) durante 24 h. Após a extração com diclorometano, o resíduo foi neutralizado com bicarbonato de sódio, lavado com água e secado com sulfato de sódio anidro.27 O fotossensibilizador H-bacterioclorina (5) foi obtido da metil-bacterioclorina (4) através de uma reação de hidrólise, na qual o metil-bacterioclorina (4) foi tratado com HCl 10% durante 6 h.40 O outro derivado de bacterioclorofila, denominado purpurina da bacterioclorofila (6), foi obtido pela oxidação do metil-bacterioclorina (4), o qual foi tratada com KOH em acetona, com oxigênio sendo borbulhado na reação, conforme descrito na literatura.40 Os compostos obtidos foram caracterizados por espectroscopia de ressonância magnética nuclear (1H RMN), conforme espectros apresentados no Material Suplementar. O equipamento utilizado foi o espectrofotômetro Bruker Avance 400, com 400 MHz para os espectros de 1H RMN, utilizando o tetrametilsilano como referência interna. Todos os fotossensibilizadores porfirinóides obtidos foram submetidos a análise de UV-Vis em solução de diclorometano no espectrofotômetro UV-Vis modelo Evolution 201, Thermo Scientific. A espectroscopia de infravermelho foi realizada com os compostos na forma de pó, em pastilha de KBr anidro utilizando o espectrômetro FRONTIER MIR+SP10 STD, Perkin Elmer. Os espectros experimentais de UV-Vis e infravermelho foram utilizados para comparar com os dados obtidos por cálculos teóricos. Metodologia computacional Para os cálculos teóricos foi utilizado o software Gaussian 09,36 instalado no laboratório de computação de alto desempenho (HPC) da Universidade Federal da Integração Latino-Americana (UNILA). Todos os cálculos foram feitos usando a funcional B3LYP41 (funcional híbrido que possui funcionais GGA, aproximação de gradiente generalizado de troca e correlação, inclui uma contribução do método Hartree Fock e foi desenvolvida por Becke (letra B) e um termo de correlação desenvolvido por Lee, Yang e Parr (sigla LYP), contém três parâmetros empíricos para otimizar o cálculo) e CAM-B3LYP42 (combina uma porção da funcional B3LYP mas um parâmetro de longo alcance) com as funcões de base 6-31+g(d,p) (base 6-31G funções gaussianas e com função difusa (+) e de polarização nor orbitais d e p) no vácuo e para o cálculo dos espectros de UV-Vis foi usada a teoria das funcionais de densidade dependente do tempo (TDDFT) também implementada no Gaussian 09. A partir dos resultados obtidos pode inferir-se sobre as propriedades químicas e físicas das moléculas. Proporcionando a predição de espectros de absorção (UV-Vis) bem como a vibração molecular predizendo o espectro de infravermelho (IV), além de calcular a energia molecular dos orbitais de fronteria, HOMO e LUMO, e usando o teorema de Koopman43 foi possível calcular alguns índices de reatividade química como dureza química (η), reatividade química (μ) e eletrofilicidade (ω). Dos cálculos também podem ser extraídos os momentos de dipolo de cada um dos sistemas químicos estudados.44 As estruturas químicas foram otimizadas inicialmente com um cálculo semi-empírico PM637 na sequência, as moléculas foram otimizadas com o uso da DFT e usando a funcional B3LYP, funcional amplamente usada neste tipo de moléculas45 e a função base 6-31+g (d,p). Para as estruturas de mínima energia foram calculadas as frequências vibracionais para garantir um mínimo de energia, após foram calculados de estados excitados para obter o espectro UV-Vis usando TDDFT.46 Para simular a presença do solvente no cálculo de estados excitados foi usado o método PCM (do inglês polarizable continuum model).47
RESULTADOS E DISCUSSÃO Obtenção dos derivados porfirinóides Neste trabalho foi realizada a síntese de derivados porfirinóides como derivados de clorofila (1-3) e derivados de bacterioclorofilas (4-6). Para isso a Spirulina máxima, adquirida comercialmente, foi utilizada como fonte de clorofila.29 Já para a obtenção de derivados de bacterioclorinas, foi necessário cultivar em laboratório a bactéria Rhodopseudomonas faecalis.7 A obtenção dos respectivos compostos já foram citados na literatura conforme descrito na Parte Experimental. Na Figura 1, podemos observar as estruturas dos compostos porfirinóides sintetizados. As moléculas 1-3 são derivados de clorofila, e, portanto, pertencem a classe das clorinas, pois apresentam em sua estrutura 20 elétrons π. Já as moléculas 4-6 são derivados de bacterioclorofila, pois apresentam em sua estrutura 18 elétrons π.
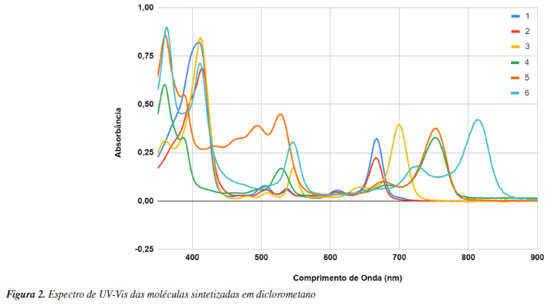
Comparação dos dados obtidos experimentalmente com os dados obtidos teoricamente Dados de espectroscopia de UV-Vis Os compostos porfirinóides sintetizados 1-3 (derivados de clorofila) e 4-6 (derivados de bacterioclorofila) foram caracterizados por espectroscopia UV-Vis (Figura 2). A espectroscopia de UV-Vis evidencia a radiação absorvida pelas moléculas, provocando transições eletrônicas, as quais podem ser quantificadas.48 Os compostos porfirinóides apresentam uma banda maior em torno de 400 nm denominada banda Soret e bandas menores que variam conforme a classe destes compostos. Podemos observar que os derivados de clorofila 1 e 2 apresentam uma banda Q na região de 660 nm e o derivado 3 que também é um derivado de clorofila, mas com um grupo anidrido na sua estrutura apresenta uma banda Q bem específica em 697 nm. Os derivados de bacterioclorinas 4 e 5 apresentam uma banda Q na região de 750 nm e o derivado 6 com o grupo anidrido ligado a bacterioclorina apresenta uma banda Q bem característica de bacterioclorofila em 813 nm.
Os derivados de clorina apresentam uma absorção de banda Q bem característica na região de 660 nm e as bacterioclorinas na região de 750 nm. No entanto, estas bandas podem variar para mais ou para menos, dependendo do tipo de substituinte ligados a estes derivados porfirinóides.3 Sendo assim, é necessário validar o método teórico comparando os espectros experimentais com os teóricos. Após a validação, é possível prever teoricamente o efeito de novos substituintes e metais na banda de absorção e com isso é possível prever qual a melhor modificação química que deve ser feita para que se obtenha um espectro de absorção na região desejada. Esta previsão das bandas Q é bastante importante, uma vez que estes compostos são utilizados na terapia fotodinâmica, por exemplo, é desejável que apresentem espectros de absorção na região entre 750 e 800 nm. Neste comprimento de onda, é onde ocorre a maior penetração da luz no tecido, tornando-o mais efetivo para tratamento de infeções mais profundas, e nesta faixa de comprimento de onda a luz não causa danos ao tecido saudável.3 Neste trabalho, além de obter os espectros experimentais, foram calculados os espectros de UV-Vis para as seis moléculas semi-sintetizadas. Foi usado o método computacional TDDFT e com auxílio do software Gaussian 09,36 foram obtidos dados teóricos a serem comparados com os espectros experimentais, onde foi possível obter as frequências de oscilador (f), comprimentos de onda λ (nm) e orbitais envolvidos nas transições eletrônicas basicamente entre HOMO - LUMO, HOMO-1 e LUMO+1 (Tabela 1). Na Tabela 2, temos a comparação entre os dados experimentais e teóricos.
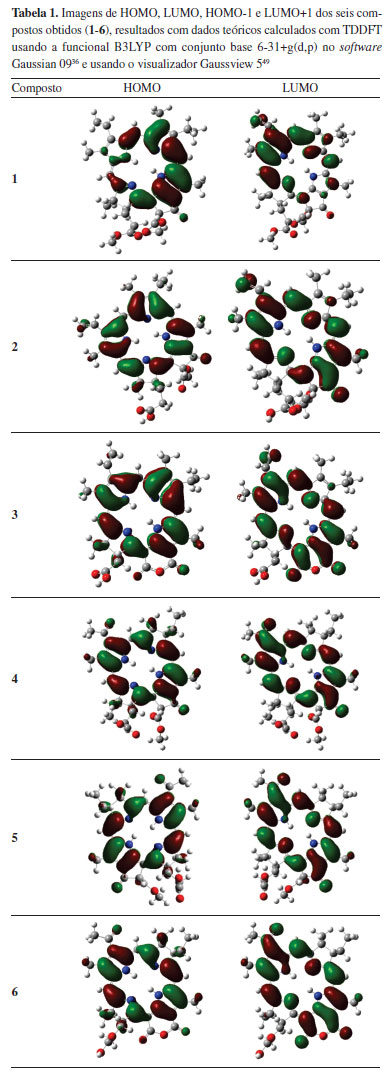
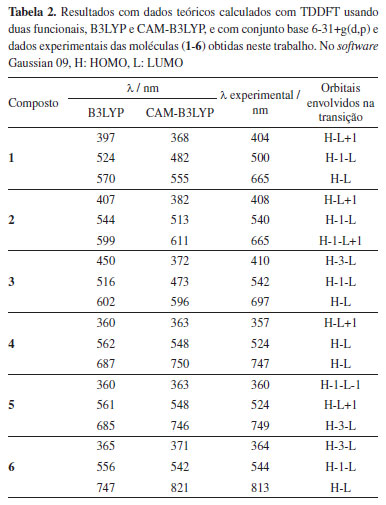
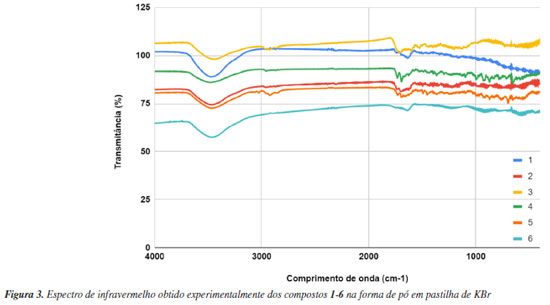
A teoria de funcionais da densidade (DFT) é um método aproximado que usa o cálculo da densidade eletrônica do sistema estudado, assim o cálculo é mais simplificado quando se refere ao tempo computacional. Isso é muito vantajoso na hora de fazer cálculos em moléculas com muitos átomos como é o caso das clorofilas e bacterioclorinas usadas neste estudo. Por isso esse método, DFT, se tornou importante nos últimos anos, por possuir ótima precisão e baixo custo computacional.50,51 A resolução da equação de Schrodinger utilizando a DFT é feita por um caminho diferente no qual, em vez de obter diretamente a função de onda do sistema, busca obter a densidade eletrônica do sistema.52 Com a DFT é possível prever e calcular várias propriedades de sistemas contendo muitos átomos, como no caso as estruturas de clorinas e bacterioclorinas, como por exemplo a estabilidade estrutural, geometria de mínima energia, propriedades elétricas, magnéticas, estados excitados e mecanismos de reação,30,53,54 também é possível fazer o uso de software de visualização que auxiliem na análise conformacional, otimização de geometria, e modelação molecular.31,45 Nos dados experimentais da espectroscopia foram observados os maiores picos na faixa de absorção de 360-410 nm referente aos derivados porfirinóides. Quando comparamos com os dados obtidos através dos cálculos teóricos B3LYP e CAM-B3LYP, observamos que estes dados também váriam de 360-450 nm, ficando muito similar aos dados encontrados experimentalmente. Podemos observar que tanto para os derivados de clorina como para os derivados de bacterioclorina, quando ocorre a oxidação e formação de compostos com o anel com anidrido, ocorre um deslocamento da banda Q. A clorina 1 apresenta banda de absorção em aproximadamente 665 nm muito caracteristica da classe das clorinas, no entanto, quando esta clorina é oxidada e obtida a clorina 3, que contém o anel anidrido em sua estrutura, sua banda de absorção muda para aproximadamente 700 nm.6 Já para o derivado de bacterioclorina 1, apresenta banda de absorção em 747 nm e quando a mesma é oxidada formando o derivado 6, também com um anel anidrido na sua estrutura molecular, esta banda passa para 813 nm. Esse deslocamento das bandas pela adição do anidridro adjacente ao anel porfirinoide muda a polaridade da molécula, alterando consequentemente a conjugação da molécula. Estas mudanças nos deslocamentos destas bandas já são descritas na literatura.40,55,56 Além disso, podemos observar que os cálculos teóricos obtidos pelo método B3LYP não se aproximaram muito dos dados obtidos experimentalmente, sendo assim, foi utilizado outro método CAM-B3LYP conforme apresentado na Tabela 2, onde podemos observar que os dados obtidos teoricamente neste método foram bastante similares aos valores experimentais, cujo dado experimental para o derivado 6 foi de 813 nm enquanto que o valor calculado para esta molécula foi de 821 nm, demostrando ser um método mais eficiente. Para a bacterioclorina 4, apresentou uma banda em 747 nm enquanto que o calculado pelo método B3LYP foi de 687 nm e com o método CAM-B3LYP foi de 750 nm, demostrando mais uma vez que o método CAM-B3LYP é eficiente para predizer o espectro de UV-Vis para estes compostos. Podemos observar que a modificação estrutural destes compostos não apresenta grande alteração da banda na região de 300 nm, mas influencia a banda em aproximadamente 650 nm das clorinas e 750 nm das bacterioclorinas, o que é desejável para as diversas aplicações destes compostos. Desta forma, é importante ter um método eficaz de cálculo teórico, o qual consiga prever estas alterações no espectro, podendo assim fornecer informações úteis nos informando se determinada modificação estrutural é benéfica para determinada aplicação, evitando muitas vezes uma síntese em laboratório, minimizar o uso de reagentes e solventes de uma síntese contribuindo para a sustentabilidade. Estes sistemas estudados já foram temas de estudo por métodos de estrutura eletrônica usando a DFT, os resultados obtidos são muito semelhantes aos nossos sistemas como por exemplo em porfirinas e ftalocianinas.57,58 Outra ferramenta teórica que foi usada no trabalho que mostra a origem das transições eletrônicas dos espectros UV-Vis (Tabela 2) são as densidades dos orbitais moleculares, tanto HOMO, LUMO, HOMO-1 e LUMO+1 (Tabela 1), concentrados na parte da molécula de maior conjugação, mesmo tendo grupos funcionais adjacentes a densidade eletrônica de onde acontecem as transições eletrônicas na região do UV-Vis acontece nestes orbitais. Pode-se observar que uma pequena parte do LUMO está concentrada nestes grupos adjacentes ao anel aromático. Dados de espectroscopia de infravermelho (IV) Os compostos sintetizados foram avaliados com espectroscopia de infravermelho (Figura 3) a fim de comparar os espectros obtidos experimentalmente com os espectros calculados. A espectroscopia de infravermelho proporciona padrão de absorção e tipo de ligação absorvida, fornecendo um fingerprint ou impressão digital da frequência de cada ligação.48 Com isso é possível identificar os respectivos grupos funcionais nas respectivas faixas de absorção do infravermelho vibracional.
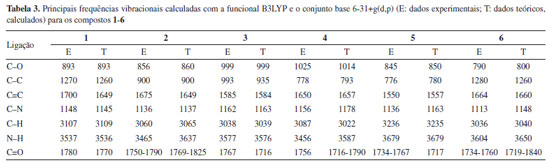
Os compostos que possuem ligações covalentes absorvem frequência de radiação eletromagnética na região do infravermelho, esta absorção de energia é quantizada, a qual corresponde as frequências de deformação axial e angular das ligações covalentes das moléculas. Cada tipo de ligação apresenta uma própria frequência de vibração, com isso o espectro de infravermelho é característico para cada molécula.48 O processo de absorção ocorre quando as moléculas absorvem radiação no infravermelho, com isso são excitadas atingindo um estado com maior energia.59 As frequências de radiação do infravermelho absorvidas equivalem as frequências vibracionais naturais da molécula, com isso, a energia que é absorvida aumenta a amplitude dos movimentos vibracionais das ligações na molécula.59 Também foram calculados através da funcional B3LYP, os dados de infravermelho para todos os compostos sintetizados. Os valores tanto calculados quanto experimentais estão representados na Tabela 3, a fim de obtermos uma comparação entre os dois resultados. É possível observar também grande similaridade entre os valores obtidos de forma experimental e os dados obtidos teoricamente (B3LYP). Na região específica de carbonila (C=O), temos sinais que variam entre a faixa de 1716 até 1800 cm-1, o qual comprova a presença de C=O nos compostos 1, 2, 3, 4, 5 e 6. Nesta região temos sinais de C=O de cetona, esteres e ácidos carboxílicos e anidridos.48,51,60 Já para os compostos 3 e 6 que apresentam um grupo anidrido, podemos observar que temos bandas em aproximadamente 1770 cm-1, e que os dados experimentais e teóricos apresentam similaridade. A literatura relata uma banda na região entre 1760 e 1810 cm-1 para anidridos, o que condiz com os dados apresentados. Na região de 1585-1700 cm-1 temos as bandas correspondentes às ligações C=C de compostos aromáticos, uma vez que estes compostos tipo clorinas e bacterioclorinas são considerados aromáticos. Podemos observar que os valores obtidos experimentalmente são muito similares aos valores calculados, conforme Tabela 3.48
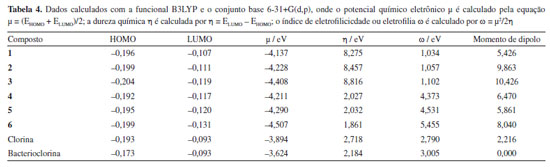
Na região de 3600-3450 cm-1 temos uma banda que corresponde a vibrações N-H, a qual comprova que estes compostos porfirinóides não se encontram complexados com nenhum metal, comprovando que na extração quando se utiliza meio ácido ocorre a completa remoção do metal, tanto da clorofila quanto da bacterioclorofila. No trabalho de Berezin et al.,61 foram discutidos os resultados sobre os espectros de infravermelho das clorofilas no intervalo de frequência de 1900 a 650 cm-1, observando similaridade entre as frequências tanto como os espectros teóricos e experimentais, em especial entre as ligações C-H, C-C. O autor destaca alguns deslocamentos das bandas, mas, segundo o autor, os dados experimentais e teóricos apresentam boa concordância. Através da análise realizada entre os dados teóricos e experimentais, podemos observar que os métodos utilizados para este fim foram eficientes, uma vez que apresentam uma certa similaridade. Mostrando assim, que pelos cálculos podemos predizer com eficiência os espectros de infravermelho de uma nova molécula ou de uma molécula que desejamos modificar experimentalmente. Vale a pena destacar que teoricamente conseguimos identificar a presença de grupos funcionais adjacentes ao anel porfirínico. Dados de reatividade através de calculos teóricos Pelos cálculos teóricos foi possível obter índices de reatividade como μ (potencial químico), η (dureza química), ω (electrofilia) conforme demostrado na Tabela 4.44,62 A fim de comparar melhor a influência dos grupos funcionais nestas propriedades químicas, utilizou-se aqui a clorina e bacterioclorina livres de grupos funcionais (Figura 4) além dos compostos já sintetizados (1-6).

O potencial químico eletrônico μ é associado com a probabilidade de um sistema em trocar a densidade de elétrons com o ambiente no estado fundamental.44 Podemos observar na Tabela 4 que os sistemas avaliados através dos cálculos teóricos que apresentam potenciais químicos baixo são os sistemas que apresentam menor probabilidade de atuar como aceitadores de elétrons, quando comparados com os sistemas que apresentam maior número de substituintes orgânicos ligados ao anel pirrólico central. A dureza química η pode ser definida como a tendência de uma molécula de trocar densidade eletrônica com o meio, sendo assim, a dureza química pode ser relacionada com a mudança de potencial químico eletrônico. Quanto menor a dureza química de um sistema, representa maior facilidade deste sistema reagir com outra espécie doadora de elétrons. O cálculo da dureza química mostra que moléculas com mais grupos funcionais em sua estrutura como o metil feoforbídeo, feoforbídeo e purpurina da clorofila possuem uma maior dureza comparada com os outros sistemas. Pela teoria de ácidos e bases duros e moles, os sistemas estudados provavelmente poderiam reagir com espécies de caráter duro. O índice de eletrofilicidade ou eletrofilia ω44,52 é a tendência de um eletrófilo adquirir uma quantidade de densidade eletrônica, dada por μ, e a resistência de uma molécula para trocar a densidade eletrônica com o ambiente, dada por η. Assim, um bom eletrófilo é uma espécie que possui um alto valor de μ e um baixo valor de η. O índice de eletrofilicidade é de grande utilidade para o estudo da reatividade de compostos orgânicos como é o caso das porfirinas e compostos análogos usados neste estudo. Estas estruturas possuem caráter polar devido a presença de átomos de nitrogênio e demais grupos funcionais adjacentes, encontrados dentro do anel pirrólico da porfirina.44 Como mostra a Tabela 4, as moléculas com maior caráter eletrofílico são as bacterioclorinas, as moléculas com presença de grupo COOH (2 e 3) e a aquelas com anel anidrido (3 e 6), as outras moléculas poderiam ser classificadas como pouco reativas frente a espécies doadoras de elétrons. Outro dado obtido pelos cálculos teóricos foi o momento de dipolo, para os sistemas de clorina e bacterioclorina livres de metais e sem adição de funcionalização, apresentam um momento de dipolo menor quando comparado com os respectivos compostos funcionalizados, pois os grupos funcionais presentes nestes casos são grupos polares, como grupos ésteres, ácidos carboxílicos e anidridos, causando nestas moléculas um aumento no momento de dipolo (Tabela 4). Isso pode ser observado quando comparamos os compostos livres (clorina) com a clorina funcionalizada 3, quando comparamos a bacterioclorina livre com a bacterioclorina funcionalizada 6, uma vez que a adição dos grupos funcionais como ácido carboxílico e anidrido aumentam a polaridade da molécula, resultando em uma distribuição assimétrica das cargas elétricas.
CONCLUSÕES Neste trabalho foi possível realizar a obtenção dos derivados porfirinóides do tipo clorinas que são obtidos da clorofila, bem como as bacterioclorinas derivados das bacterioclorofilas. Foram realizados os espectros de infravermelho e UV-Vis, podendo assim compará-los com os dados obtidos teoricamente. Os cálculos teóricos foram realizados utilizando as funcionais B3LYP e CAM-B3LYP amplamente usadas em cálculos teóricos de sistemas similares e o conjunto base 6-31+(d,p), sendo possível obter dados de espectros bem como dados de reatividade química. Os espectros de infravermelho e de UV-Vis obtidos através de cálculos foram comparados com os dados experimentais e foi possível observar que os dados são muito similares. Portanto, os cálculos teóricos representam uma ferramenta eficaz para estudar e avaliar propriedades destas moléculas estudadas, podendo prever comportamentos nas reações destas moléculas e sendo possível prever os efeitos causados pela adição de um grupo funcional em uma determinada molécula, sem que ela seja sintetizada em laboratório, minimizando a utilização de reagentes e solventes, contribuindo para a sustentabilidade. Os cálculos teóricos, nestes casos, são ferramentas úteis e que podem auxiliar na predição de moléculas as quais podem ser aplicadas como fotossensibilizador na área da medicina, biotecnologia, energias e promovendo um bom fotossensibilizador para placas solares e outras aplicações tecnológicas.
MATERIAL SUPLEMENTAR O material suplementar desse trabalho está disponível em http://quimicanova.sbq.org.br/, na forma de arquivo PDF, com acesso livre.
AGRADECIMENTOS Os autores agradecem a UNILA-PRPPG (editais: 214/2021; 122/2020; 104/2020; 105/2020; 90/2022, 77/2022 e 121/2023), Fundação Araucária (FA), CAPES e CNPQ (processo: 140159/2024-0) pelo suporte financeiro; ao Laboratório de Cromatografia e Métodos Ópticos e ao Programa de Pós-Graduação em Energia e Sustentabilidade da UNILA.
REFERÊNCIAS 1. Tulaeva, L. A.; Pushkareva, E. I.; Tolstikova, O. V.; Belykh, D. V.; Russ. Chem. Bull. 2021, 70, 359. [Crossref] 2. Zhu, W.; Gao, Y.-H.; Liao, P.-Y.; Chen, D.-Y.; Sun, N.-N.; Thi, P. A. N.; Yan, Y.-J.; Wu, X.-F.; Chen, Z.-L.; Eur. J. Med. Chem. 2018, 160, 146. [Crossref] 3. Pucelik, B.; Sułek, A.; Dąbrowski, J. M.; Coord. Chem. Rev. 2020, 416, 213340. [Crossref] 4. Strixino, J. F.: Estudo e Correlação de Diferentes Derivados de Hematoporfirina e Clorinas no Processo de Terapia Fotodinâmica; Tese de Doutorado, Universidade de São Paulo, Ribeirão Preto, Brasil, 2021. [Link] acessado em setembro 2024. 5. Cai, J.-Q.; Liu, X.-M.; Gao, Z.-J.; Li, L.-L.; Wang, H.; Mater. Today 2021, 45, 77. [Crossref] 6. Uliana, M. P.; Rodrigues, A. C.; Ono, B. A.; Pratavieira, S.; de Oliveira, K. T.; Kurachi, C.; Molecules 2022, 27, 5769. [Crossref] 7. Pratavieira, S.; Uliana, M. P.; Lopes, N. S. S.; Donatoni, M. C.; Linares, D. R.; Anibal, F. F.; de Oliveira, K. T.; Kurachi, C.; de Souza, C. W. O.; Photodiagn. Photodyn. Ther. 2021, 34, 102251. [Crossref] 8. Wen, X.; Li, Y.; Hamblin, M. R.; Photodiagn. Photodyn. Ther. 2017, 19, 140. [Crossref] 9. Pignata-Viana, M. C.; Santos, J. S.; Viana, P. T.; Clinical and Biomedical Research 2019, 39, 161. [Crossref] 10. Costa, K. A. D.; Ferenz, M.; da Silveira, S. M.; Millezi, A. F.; Rev. Inst. Laticinios Candido Tostes 2016, 71, 75. [Crossref] 11. Rodrigues, A. C.; Bilha, J. K.; Pereira, P. R. M.; de Souza, C. W. O.; Passarini, M. R. Z.; Uliana, M. P.; Braz. J. Microbiol. 2024, 55, 1139. [Crossref] 12. Amos-Tautua, B. M.; Songca, S. P.; Oluwafemi, O. S.; Molecules 2019, 24, 2456. [Crossref] 13. Nações Unidas Brasil, Sobre o Nosso Trabalho para Alcançar osObjetivos do Desenvolvimento Sustentável no Brasil, https://brasil.un.org/pt-br/sdgs, acessado em setembro 2024. 14. Yang, F.; Xu, M.; Chen, X.; Luo, Y.; Biomed. Pharmacother. 2023, 164, 114933. [Crossref] 15. Agostinis, P.; Berg, K.; Cengel, K. A.; Foster, T. H.; Girotti, A. W.; Gollnick, S. O.; Hahn, S. M.; Hamblin, M. R.; Juzeniene, A.; Kessel, D.; Korbelik, M.; Moan, J.; Mroz, P.; Nowis, D.; Piette, J.; Wilson, B. C.; Golab, J.; Ca-Cancer J. Clin. 2011, 61, 250. [Crossref] 16. Krupka, M.; Bartusik-Aebisher, D.; Strzelczyk, N.; Latos, M.; Sieroń, A.; Cieślar, G.; Aebisher, D.; Czarnecka, M.; Kawczyk-Krupka, A.; Latos, W.; Photodiagn. Photodyn. Ther. 2020, 32, 101981. [Crossref] 17. Osuchowski, M.; Bartusik-Aebisher, D.; Osuchowski, F.; Aebisher, D.; Photodiagn. Photodyn. Ther. 2021, 33, 102158. [Crossref] 18. Azzouzi, A. R.; Barret, E.; Bennet, J.; Moore, C.; Taneja, S.; Muir, G.; Villers, A.; Coleman, J.; Allen, C.; Scherz, A.; Emberton, M.; World J. Urol. 2015, 33, 945. [Crossref] 19. Sampaio, S. G.: Corantes a partir da Meso-Porfirina do LCC para Aplicação em Células Solares Sensibilizadas; Tese de Doutorado, Universidade Federal do Ceará, Fortaleza, Brasil, 2018. [Link] acessado em setembro 2024. 20. Lima, N. M. A.: Porfirinas/Metaloporfirinas Derivadas do Cardanol para Aplicação em Oleds e Terapia Fotodinâmica; Tese de Doutorado, Universidade Federal do Ceará, Fortaleza, Brasil, 2020. [Link] acessado em setembro 2024. 21. Lu, J.; Li, H.; Liu, S.; Chang, Y.-C.; Wu, H.-P.; Cheng, Y.; Diau, E. W.-G.; Wang, M.; Phys. Chem. Chem. Phys. 2016, 18, 6885. [Crossref] 22. Camarena, D. A.; Méndez, N. O.; Madai, E. F. R.; Vázquez-Núñez, E.; Jóvenes en la Ciencia 2022, 16, 1. [Link] acessado em setembro 2024 23. Laranjo, M.; Aguiar, M. C.; Pereira, N. A. M.; Brites, G.; Nascimento, B. F. O.; Brito, A. F.; Casalta-Lopes, J.; Gonçalves, A. C.; Sarmento-Ribeiro, A. B.; Pineiro, M.; Botelho, M. F.; Pinho e Melo, T. M. V. D.; Eur. J. Med. Chem. 2020, 200, 112468. [Crossref] 24. Efendiev, K.; Alekseeva, P.; Linkov, K.; Shiryaev, A.; Pisareva, T.; Gilyadova, A.; Reshetov, I.; Voitova, A.; Loschenov, V.; Photodiagn. Photodyn. Ther. 2024, 45, 103969. [Crossref] 25. Josewin, S. W.; Kim, M.-J.; Yuk, H.-G.; Food Microbiol. 2018, 76, 219. [Crossref] 26. Lessa, J. B.: Terapia Fotodinâmica Antimicrobiana com Utilização da Clorina-e6 em Biofilmes Monoespécie de Fusobacterium nucleatum e Porphyromonas gingivalis; Trabalho de Conclusão de Curso, Universidade Estadual Paulista (Unesp), Araraquara, Brasil, 2023. [Link] acessado em setembro 2024. 27. Sasaki, S. I.; Tamiaki, H.; J. Org. Chem. 2006, 71, 2648. [Crossref] 28. Landolt, H.; Börnstein, R.; Landolt-Börnstein: Numerical Data and Functional Relationships in Science and Technology; Springer: Nova York, 2002. 29. Uliana, M. P.; Pires, L.; Pratavieira, S.; Brocksom, T. J.; de Oliveira, K. T.; Bagnato, V. S.; Kurachi, C.; Photochem. Photobiol. Sci. 2014, 13, 1137. [Crossref] 30. Machado, N.; Carvalho, B. G.; Soto, C. A. T.; Martin, A. A.; Favero, P. P.; Spectrochim. Acta, Part A 2018, 195, 68. [Crossref] 31. Buck, S. T. G.; Bettanin, F.; Orestes, E.; Homem-De-Mello, P.; Imasato, H.; Viana, R. B.; Perussi, J. R.; da Silva, J.; J. Chem. 2017, 2017, 7365263. [Crossref] 32. Castro, K. A. D. F.; Rodrigues, J. M. M.; Faustino, M. A. F.; Tomé, J. P. C.; Cavaleiro, J. A. S.; Neves, M. G. P. M. S.; Simões, M. M. Q.; J. Organomet. Chem. 2021, 938, 121751. [Crossref] 33. Cuesta, H. S.; Meneses, O. L.; infoANALÍTICA 2020, 70, 69. [Crossref] 34. Dulski, M.; Kempa, M.; Kozub, P.; Wójcik, J.; Rojkiewicz, M.; Kuś, P.; Szurko, A.; Ratuszna, A.; Wrzalik, R.; Spectrochim. Acta, Part A 2013, 104, 315. [Crossref] 35. Zhang, W.-Y.; Li, G.-C.; Wang, B.; Fan, Y.; Sun, X.-Q.; Yang, Y.-X.; Zhang, C.-Y.; Feng, X.-X.; Xu, W.-B.; Liu, J.-C.; J. Mol. Struct. 2024, 1302, 137497. [Crossref] 36. Frisch, M. J.; Trucks, G. W.; Schlegel, H. B.; Scuseria, G. E.; Robb, M. A.; Cheeseman, J. R.; Scalmani, G.; Barone, V.; Petersson, G. A.; Nakatsuji, H.; Li, X.; Caricato, M.; Marenich, A.; Bloino, J.; Janesko, B. G.; Gomperts, R.; Mennucci, B.; Hratchian, H. P.; Ortiz, J. V.; Izmaylov, A. F.; Sonnenberg, J. L.; Williams-Young, D.; Ding, F.; Lipparini, F.; Egidi, F.; Goings, J.; Peng, B.; Petrone, A.; Henderson, T.; Ranasinghe, D.; Zakrzewski, V. G.; Gao, J.; Rega, N.; Zheng, G.; Liang, W.; Hada, M.; Ehara, M.; Toyota, K.; Fukuda, R.; Hasegawa, J.; Ishida, M.; Nakajima, T.; Honda, Y.; Kitao, O.; Nakai, H.; Vreven, T.; Throssell, K.; Montgomery Jr., J. A.; Peralta, J. E.; Ogliaro, F.; Bearpark, M.; Heyd, J. J.; Brothers, E.; Kudin, K. N.; Staroverov, V. N.; Keith, T.; Kobayashi, R.; Normand, J.; Raghavachari, K.; Rendell, A.; Burant, J. C.; Iyengar, S. S.; Tomasi, J.; Cossi, M.; Millam, J. M.; Klene, M.; Adamo, C.; Cammi, R.; Ochterski, J. W.; Martin, R. L.; Morokuma, K.; Farkas, O.; Foresman, J. B.; Fox, D. J.; Gaussian 09, Revision A.02; Gaussian Inc., Wallingford, CT, 2016. 37. Stewart, J. J. P.; J. Mol. Model. 2013, 19, 1. [Crossref] 38. Belykh, D. V.; Kopylov, E. A.; Gruzdev, I. V.; Kuchin, A. V.; Russ. J. Org. Chem. 2010, 46, 577. [Crossref] 39. Zheng, M.; Wang, X.; Doan, B.; Lewis, K. A.; Schneider, T. D.; Storz, G.; J. Bacteriol. 2001, 183, 4571. [Crossref] 40. Kozyrev, A. N.; Chen, Y.; Goswami, L. N.; Tabaczynski, W. A.; Pandey, R. K.; J. Org. Chem. 2006, 71, 1949. [Crossref] 41. Becke, A. D.; J. Chem. Phys. 1993, 98, 5648. [Crossref] 42. Yanai, T.; Tew, D. P.; Handy, N. C.; Chem. Phys. Lett. 2004, 393, 51. [Crossref] 43. Koopmans, T.; Physica 1934, 1, 104. [Crossref] 44. Domingo, L. R.; Ríos-Gutiérrez, M.; Pérez, P.; Molecules 2016, 21, 748. [Crossref] 45. Jaramillo, P.; Coutinho, K.; Cabral, B. J. C.; Canuto, S.; Chem. Phys. Lett. 2011, 516, 250. [Crossref] 46. Dreuw, A.; Head-Gordon, M.; Chem. Rev. 2005, 105, 4009. [Crossref] 47. Tomasi, J.; Mennucci, B.; Cammi, R.; Chem. Rev. 2005, 105, 2999. [Crossref] 48. Pavia; Lampman; Kriz; Vyvyan; Introduction to Spectroscopy, 4th ed.; Cengage Learning: Belmont, USA, 20093. 49. Dennington, R.; Keith, T. A.; Millam, J. M.; GaussView, version 5; Semichem Inc., Shawnee Mission, KS, 2016. 50. Lewars, E. G.; Computational Chemistry: Introduction to the Theory and Applications of Molecular and Quantum Mechanics, 2nd ed.; Springer: Netherlands, 2011. 51. Şener, S.; Bayraç, A. T.; Şener, B. B.; Tozlu, C.; Acar, N.; Salih, B.; Yüksel, M.; Bekarğlu, Ö.; Eur. J. Pharm. Sci. 2019, 129, 124. [Crossref] 52. Parr, R. G.; Szentpály, L. V.; Liu, S.; J. Am. Chem. Soc. 1999, 121, 1922. [Crossref] 53. Koch, W.; Holthausen, M. C.; A Chemist's Guide to Density Functional Theory, 2nd ed.; Wiley-VCH Verlag GmbH: Weinheim, Germany, 2001. [Crossref] 54. Laurent, A. D.; Jacquemin, D.; Int. J. Quantum Chem. 2013, 113, 2019. [Crossref] 55. Drogat, N.; Gady, C.; Granet, R.; Sol, V.; Dyes Pigm. 2013, 98, 609. [Crossref] 56. Shen, H.; Zhang, C.; Zhou, H.; Li, C.; Yuan, H.; Jiang, J.; Wang, C.; Arabian J. Chem. 2024, 17, 105549. [Crossref] 57. Mazzone, G.; Alberto, M. E.; de Simone, B. C.; Marino, T.; Russo, N.; Molecules 2016, 21, 288. [Crossref] 58. Mack, J.; Stone, J.; Nyokong, T.; J. Porphyrins Phthalocyanines 2014, 18, 630. [Crossref] 59. Silverstein, R. M.; Webster, F. X.; Kiemle, D. J.; Bryce, D. L.; Spectrometric Identification of Organic Compounds, 8th ed.; John Wiley & Sons: New Jersey, 2014. 60. Rychikhina, E.; Ivanova, S. S.; Romanenko, Y. V.; Koifman, O. I.; Stuzhin, P. A.; Polyhedron 2022, 217, 115743. [Crossref] 61. Berezin, D. B.; Makarov, V. V.; Znoyko, S. A.; Mayzlish, V. E.; Kustov, A. V.; Mendeleev Commun. 2020, 30, 621. [Crossref] 62. Atwan, A. T.; Jabbar, M. L.; Eurasian Journal of Physics, Chemistry and Mathematics 2022, 11, 29. [Link] acessado em setembro 2024 |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access